Method Article
تحليل الوقت الحقيقي للاتصال العصبي بين الأمعاء والدماغ: ديناميكيات الكالسيوم على نطاق واسع في القشرة استجابة لتحفيز الجلوكوز المعوي
In This Article
Summary
يعد التواصل بين الأمعاء والدماغ ، الذي يسهله العصب المبهم ، أمرا بالغ الأهمية للتواصل بين جهاز الغدد الصماء المعدية المعوية والدماغ. ومع ذلك ، لا يزال من غير المفهوم ما إذا كان حقن الجلوكوز داخل المعدة يمكن أن يغير النشاط القشري. هنا ، نقدم بروتوكولا شاملا لمراقبة التغيرات في النشاط القشري بعد حقن الجلوكوز في الاثني عشر.
Abstract
يلعب التواصل بين الجهاز الهضمي والدماغ بعد امتصاص العناصر الغذائية دورا أساسيا في تفضيل الطعام والتمثيل الغذائي وسلوكيات التغذية. فيما يتعلق بالعناصر الغذائية المحددة على وجه الخصوص ، أوضحت العديد من الدراسات أن امتصاص الجلوكوز داخل الخلايا الظهارية في الأمعاء يحرض على تنشيط العديد من جزيئات الإشارات. تشتهر الهرمونات مثل الببتيد الشبيه بالجلوكاجون -1 بأنها وسطاء إشارات مثاليين. نظرا لأن الهرمونات تؤثر في الغالب على الدماغ من خلال مسارات الدورة الدموية ، فإنها تعدل نشاط الدماغ ببطء.
ومع ذلك ، فقد أظهرت الدراسات الحديثة مسارين سريعين للأمعاء والدماغ يسهلهم الجهاز العصبي اللاإرادي. يعمل أحدهما عبر المسار العصبي الوارد الشوكي ، بينما يتوسط العصب المبهم الآخر. وبالتالي ، فإن استجابات الدماغ بعد امتصاص الجلوكوز في الجهاز الهضمي معقدة. علاوة على ذلك ، نظرا لأن التحفيز المعوي يحفز أخيرا أنشطة قشرية متنوعة ، بما في ذلك الاستجابات الحسية وحساسية الألم والمكافأة والحركية ، فمن الضروري استخدام المنهجيات التي تسهل تصور دوائر الدماغ الموضعية والأنشطة القشرية لفهم الانتقال العصبي للأمعاء والدماغ بشكل كامل. أشارت بعض الدراسات إلى تغيرات حادة في تركيزات أيون الكالسيوم (Ca2+) داخل منطقة ما تحت المهاد والمنطقة السقيفية البطنية بشكل مستقل من خلال مسارات مختلفة بعد التحفيز المعوي. ومع ذلك ، لم يعرف ما إذا كانت هناك تغييرات في نشاط القشرة الدماغية.
لمراقبة نشاط القشرة الدماغية بعد حقن الجلوكوز داخل المعدة ، قمنا بتطوير تقنية تصوير للتصور في الوقت الفعلي لديناميكيات Ca2+ على نطاق واسع من خلال جمجمة سليمة تماما ، باستخدام الفئران المعدلة وراثيا التي تعبر عن مؤشرات Ca2+ المشفرة وراثيا. تقدم هذه الدراسة بروتوكولا شاملا لتقنية مصممة لمراقبة تصوير Ca2+ عبر الجمجمة الناجم عن التحفيز المعوي بعد حقن الجلوكوز داخل المعدة عبر قسطرة مزروعة. تشير البيانات الأولية إلى أن إعطاء محلول الجلوكوز في الأمعاء ينشط القشرة الأمامية ، والتي تظل غير مستجيبة لإدارة المياه.
Introduction
في المقام الأول ، يحدث استشعار الأمعاء للجلوكوز عبر مستقبلات الطعم الحلو (Tas1r2 ، Tas1r3) والناقل المشترك للصوديوم والجلوكوز 1 (SGLT-1) الموجود في خلايا الغدد الصماء المعوية داخل تجويف الأمعاء1،2،3،4،5،6. الإحساس بالجلوكوز في الدماغ هو عملية تمتد عادة من دقائق إلى ساعات بعد امتصاصه من القناة الهضمية ، وهو يحدث يعتمد بشكل أساسي على زيادة مستويات السكر في الدم في البلازما وإفراز الهرمونات7،8،9،10،11 (على سبيل المثال ، الببتيد الشبيه بالجلوكاجون -1 [GLP-1] ، الببتيد YY (PYY) ، وعديد الببتيد الأنسوليني المعتمد على الجلوكوز [GIP]). يصلون إلى النواة المقوسة لمنطقة ما تحت المهاد (ARC) ، حيث يربطون الخلايا العصبية المؤيدة للميلانوكورتين (POMC) والخلايا العصبية المرتبطة بالبروتين (AgRP) عن طريق تدفق الدم والعصب المبهم (العصب السمبتاوي) 12،13،14. يؤدي التغيير في نشاط هذه الخلايا العصبية إلى التحكم في عملية التمثيل الغذائي وسلوك التغذية15،16.
تسلط الأدبيات الحديثة الضوء بشكل متزايد على أهمية الإشارات العصبية للأمعاء والدماغ بعد امتصاص الجلوكوز. يمكن تصنيف هذا المسار المعقد على نطاق واسع إلى آليتين أساسيتين. الأول ينطوي على تنشيط الوافدين في العمود الفقري ، مما يؤثر في النهاية على نشاط الخلايا العصبية AgRP في ARC. تستلزم الآلية الثانية تحفيز العصب المبهم من خلال الوصلات مع الخلايا الظهارية. بالنظر إلى الطرق متعددة الأوجه التي يمكن للخلايا الظهارية المعوية من خلالها تنشيط العصب المبهم13 ، يعتبر دوره متعدد الاستخدامات.
ترتبط نسبة كبيرة من أنشطة الأمعاء المبهم والأعصاب الواردة في العمود الفقري بسلوكيات التغذية17،18،19. ومع ذلك ، تشير الأدلة الناشئة إلى أن بعض الألياف العصبية المبهمة ، التي تنتظر "خلايا الأعصاب" ، متورطة في تفضيل الجلوكوز. تعبر خلايا Neuropod ، وهي مجموعة فرعية من خلايا الغدد الصم المعوية ، عن SGLT-1 على جانبها اللمعي وتنقل المحفزات الحسية إلى العصب المبهم عبر نقاط الاشتباك العصبي الجلوتاماتيرجيك2،20،21،22. يؤدي تنشيط العصب المبهم إلى تحفيز الخلايا العصبية الدوبامينية في المنطقة السقيفية البطنية (VTA) في غضون ثوان19. والجدير بالذكر أن تثبيط تنشيط المبهم ، خاصة في الاثني عشر ، باستخدام مضاد الغلوتامات يقلل من تفضيل السكروز في الفئران1. هذا يؤكد الدور الحاسم لتنشيط خلايا الأرجل العصبية في تعديل سلوك اختيار الطعام بعد تناول الجلوكوز2.
على الرغم من هذه التطورات ، فإن الفهم الشامل لآليات الاستشعار السريع للجلوكوز المعوي وتأثيرها على الأنشطة القشرية لا يزال لغزا معقدا. على الرغم من أن تنشيط الدماغ الذي تتحكم فيه الخلايا العصبية AgRP لا يشمل القشرة الدماغية23 ، فمن المعروف أن الخلايا العصبية الدوبامينية في مشروع VTA إلى القشرة الدماغية. ومع ذلك ، فمن غير المعروف ما إذا كان التنشيط العصبي الدوبامين السريع VTA بعد استشعار الجلوكوز ينشط القشرة الدماغية حقا. لتوضيح هذه الآلية ، قمنا بالتحقيق في إمكانية إعطاء الجلوكوز داخل المعدة للتأثير بسرعة على ديناميكيات Ca2+ القشرية في الفئران المعدلة وراثيا التي تعبر عن مؤشر كالسيوم مشفر وراثيا.
تقدم هذه الورقة طريقة منخفضة التكلفة وأقل توغلا لفهم التغيرات في النشاط القشري بعد إعطاء الجلوكوز داخل المعدة بشكل شامل باستخدام تصوير Ca2+ على نطاق واسع في الفئران في الآونة الأخيرة ، اكتسبت تقنية التصوير Ca2+ واسعة عبر الجمجمة من خلال جمجمة سليمة ، باستخدام الفئران المعدلة وراثيا التي تعبر عن مؤشرات الكالسيوم المشفرة وراثيا ، شعبية24. والجدير بالذكر أن خط الفأر المعدل وراثيا BAC GLT-1-G-CaMP7 # 817 (المعروف أيضا باسم G7NG817 الفأر) المستخدم في هذه الدراسة يعبر عن مستشعر Ca2+ ، G-CaMP7 ، في الخلايا العصبية والخلايا النجمية25. نظرا لكثافة التعبير العالية في القشرة الدماغية ، فإن خط الفأر المعدل وراثيا هذا مناسب بشكل خاص لتصوير Ca2+ عبر الجمجمة باستخدام مجهر التألق القياسي.
Protocol
تمت الموافقة على جميع البروتوكولات التجريبية من قبل اللجنة المؤسسية لرعاية واستخدام بجامعة أوتشانوميزو باليابان (بروتوكولات دراسة 22017). تم إجراء جميع التجارب على وفقا للمبادئ التوجيهية للتجارب على لجامعة أوتشانوميزو التي تتوافق مع المبادئ التوجيهية الأساسية للإجراء السليم للتجارب على والأنشطة ذات الصلة في مؤسسات البحث الأكاديمية (وزارة التعليم والثقافة والرياضة والعلوم والتكنولوجيا ، اليابان). تم بذل جهود لتقليل عدد المستخدمة. أجريت هذه الدراسة وفقا للدلائل الإرشادية ARRIVE.
1. تحضير الفئران المعدلة وراثيا
- لمتابعة هذه التجربة ، استخدم خط الفأر المعدل وراثيا BAC GLT-1-G-CaMP7 # 817 البالغ ، أي G7NG817 الفئران24،25 (أكبر من 8 أسابيع). سلالة الخلفية للفئرانG7NG817 25 هي C57BL / 6J.
- ضع الفئران تحت دورة ضوئية / مظلمة مدتها 12 ساعة / 12 ساعة وقم بتربيبها في مجموعات تصل إلى خمسة فئران.
2. إنشاء القسطرة
- استخدم المقص لضبط أنبوب السيليكون (القطر الداخلي 0.5 مم ، القطر الخارجي 1.0 مم) بطول دقيق يبلغ 7 سم (الشكل 1A-a).
ملاحظة: قبل الإجراءات ، تم تعقيم المقص وأنبوب السيليكون. - قم بلصق الخرز البلاستيكي الصغير (القطر الداخلي 3 مم ، القطر الخارجي 5 مم) بالأنبوب المخصص ، مع التأكد من وضعه على بعد 3 مم من نهايته (الشكل 1 أ-ب). قم بلصق الخرزات بإحكام باستخدام غراء cyanoacrylate (المتغيرات الطبية أو القياسية مقبولة).
- استئصال قمة إبرة 23 جم ثم قطع 1.5 سم من طرف الإبرة (الشكل 1A-c).
- أدخل الإبرة المقطعة 23 G من الخطوة 2.3 في طرف أنبوب السيليكون ، مقابل المكان الذي تم فيه لصق الخرزات (الشكل 1A-d).
3. إنشاء الحاقن
- استخدم كماشة معقمة لاستئصال 1 سم من طرف الإبرة (الشكل 1 ب أ).
ملاحظة: تأكد من أن الفتحة الموجودة في الطرف المقطوع تحتفظ بسلامتها ولا تتشوه ، لأن أي تشويه يمكن أن يعيق تدفق محلول الحقن. - قم بإقران إبرة الحقن المعدلة 23 جم من الخطوة 3.1.1 إلى حقنة 2.5 مل (الشكل 1 ب-ب).
- قم بتقطيع أنبوب السيليكون إلى الطول المطلوب (أنبوب سيليكون 15 سم في هذه التجربة) وقم بغمده فوق إبرة الحقن 23 جم (الشكل 1B-c).
ملاحظة: سوف يتقلب حجم المحلول الذي يتم صرفه بناء على طول الأنبوب. على سبيل المثال ، مع أنبوب 15 سم ، سيبقى ما يقرب من 50 ميكرولتر من المحلول بعد التجربة. - افصل إبرة الحقن 23 جم على بعد 1.5 سم من طرف الإبرة.
- انضم إلى الجزء المقسم من الخطوة 3.4 باستخدام قسطرة السيليكون المصممة في الخطوة 3.3 (الشكل 1B-d).
ملاحظة: تأكد من بقاء الفتحات التي تم إنشاؤها في الخطوتين 3.1 و 3.4 غير مشوهة بعد الشق. إذا كانت هناك حاجة إلى التصحيح ، فاستخدم كماشة لاستعادة تكوينها الدائري.
4. توطين المعدة
- قم بإعطاء التخدير للفأر عن طريق استنشاق الأيزوفلوران بنسبة 3.0٪ في غرفة محددة. ضع مرهم للعيون لمنع جفاف العين.
- انقل الفأر المخدر بدقة من غرفة الاستنشاق إلى طاولة الجراحة عند التحقق من حالة تخدير الفأر. توفير الدعم الحراري طوال العملية.
- ضع الفأر ضعيفا ، وقم بمحاذاة فمه القريب من جهاز الاستنشاق ، وقم بتعديل تركيز الأيزوفلوران من 3.0٪ إلى 2.0٪.
ملاحظة: افصل الجزء السفلي من قناع الأيزوفلوران عن نظيره العلوي وقم بتثبيت القناع المنفصل (الجزء العلوي) على طاولة الجراحة باستخدام شريط لاصق. - استكمل تجويف الفم والأطراف الأمامية والخلفية للفأر بالطاولة الجراحية باستخدام شريط لاصق.
ملاحظة: عن طريق تثبيت الماوس على الطاولة ، يمكن منع الأخطاء الجراحية الناتجة عن الحركة حتى لو تم تخدير الفأر. - قم بإزالة شعر الفأر من الجزء العلوي الأيسر من البطن (150٪ من المنطقة المحيطة بموقع الجراحة) باستخدام كريم إزالة الشعر. ضع مسكنا موضعيا موضعيا على موقع الجراحة وانتظر لمدة 5 دقائق قبل المتابعة.
- ضع جل مخدر موضعي على جلد البطن وانتظر لمدة 5 إلى 10 دقائق. ثم قم بتطهير المنطقة الجراحية 3 مرات بجولات متناوبة من اليودوفور و 70٪ من الإيثانول. تأكد من عمق التخدير عن طريق قرصة إصبع القدم وقم بتغطية بستائر جراحية معقمة. قم بعمل شق جلدي بطول 1.5 سم تقريبا (الشكل 1C-b) ، يقع على بعد 1 سم على يمين متوسط البطن و 5 مم أسفل عملية الخنجري (الشكل 1C-c). بعد ذلك ، قم بعمل شق 1.5 سم في جدار البطن في نفس موقع شق الجلد الأولي.
ملاحظة: توخي الحذر لتجنب إلحاق الضرر بالكبد الأساسي. - أعد وضع الفص الكبدي الأيسر بدقة بشكل جانبي باستخدام ملقط غير حاد ، مما يكشف عن المعدة تحتها.
5. إدخال القسطرة
- ارفع المعدة وأخرجها بحذر من خلال الشق.
ملاحظة: توخي أقصى درجات الحذر للحفاظ على سلامة الأعضاء المجاورة ، وخاصة الكبد ، والامتناع عن ممارسة قوة لا داعي لها على المعدة. - استخدم المقص لإنشاء ثقب صغير (قطره حوالي 1.5 مم) في البواب.
- أدخل نهاية القسطرة في الثقب ، مع التأكد من أن الخرزة على اتصال مباشر مع البوابي.
ملاحظة: يتم تطهير القسطرة بمحلول غلوكونات الكلورهيكسيدين من 0.1 إلى 0.5٪ قبل الإدخال. - قم بلصق حبة القسطرة على المعدة باستخدام غراء سيانواكريليت طبي.
ملاحظة: تأكد من بقاء المعدة غير متصلة بالأعضاء المحيطة. - تحقق من الارتباط القوي للقسطرة بالمعدة، ثم أعد وضع المعدة بدقة إلى موضعها الفطري أسفل الفص الكبدي الأيسر.
- قم بخياطة جدار البطن ، مما يسمح للقسطرة بالتمدد خارجيا ، باستخدام خياطة بولي ديوكسانون (PDS). بعد ذلك ، أغلق شق الجلد بطريقة مماثلة لإغلاق البطن.
- أعد وضع الماوس برفق في قفص معقم.
ملاحظة: يجب أن تكون الفئران بعد الجراحة في مكان فردي. ضع مسكنا موضعيا على إغلاق الجرح واتبع خطط المسكنات كما هو موصى به في الإرشادات المؤسسية المحلية. - اسمح بفترة استرداد لا تقل عن 48 ساعة في بيئة قياسية.
ملاحظة: يتم إغلاق أحد طرفي القسطرة التي يتم إدخالها في معدة الماوس بإبرة 23G بطرف محكم الغلق لمنع دخول المواد الغريبة وتجنب العض. نظرا لأن القسطرة البارزة من البطن قصيرة ، فإنها تمنع الفأر من سحبها عبر الفراش ، مما قد يتسبب في فتحها أو تشابكها.
6. التحضير للتصوير عبر الجمجمة في الجسم الحي Ca2+
- يتم إعطاء التخدير للفأر باستخدام الأيزوفلوران (الحث بنسبة 2٪ ؛ الصيانة بين 0.8٪ و 1.0٪).
- قم بتثبيت الماوس على منصة تجسيمية باستخدام قضبان الأذن المساعدة للتخفيف من آثار النبض والتنفس. بعد ذلك ، ضع الماوس تحت مجهر ستيريو فلوري.
- استخدم مجموعة مرشحات مضان أزرق عريضة النطاق (مع إثارة عند 460-490 نانومتر وانبعاث عند 520 نانومتر) جنبا إلى جنب مع مصدر ضوء الزئبق.
- التقط الصور باستخدام الكاميرا وقم بمعالجتها باستخدام برنامج التصوير المخصص.
- قم بإزالة الشعر بعناية من فروة الرأس باستخدام ماكينة حلاقة كهربائية أو كريم لإزالة الشعر.
ملاحظة: في حالة استخدام ماكينة حلاقة ، تأكد من تطهيرها تماما واحرص على عدم قطع الجلد. - تطهير سطح فروة الرأس باستخدام قطعة قطن أو أداة مماثلة بمحلول غلوكونات الكلورهيكسيدين المخفف إلى 0.1-0.5٪. بعد ذلك ، قم بالتطهير بالكحول وكرر هذه الجولات المتناوبة 3x.
- ضع جل مخدر موضعي وانتظر لمدة 5-10 دقائق.
- استعد لتطبيق الأسمنت الأكريليك للأسنان.
- استخدم شفرة مشرط معقمة لقطع فروة الرأس. إما إزالة فروة الرأس تماما أو عمل قطع مستقيم من مؤخرة الرأس إلى الجبهة.
- استخدم المشابك لكشف الجمجمة عن طريق تمديد أي جلد زائد.
- استخدم قطعة قطن لإزالة النسيج الضام للسمحاق.
- ضع الأسمنت الأكريليكي على الفور بعد إزالة السمحاق. تصرف بسرعة لمنع سطح الجمجمة من أن يصبح معتما بسبب التبخر من العظم المكشوف.
- انتظر حوالي 5 دقائق حتى يجف الأسمنت.
7. تصوير Ca2+ عبر الجمجمة مع إعطاء الجلوكوز داخل الاثني عشر
- موازنة كل من المحلول التجريبي والمحلول الملحي مع درجة الحرارة المحيطة. إخضاع الفئران لقيود غذائية لمدة محددة (على سبيل المثال ، 2 ساعة).
- قم بتطهير أي محتوى متبقي داخل القسطرة الجانبية للماوس باستخدام ~0.03 مل من المحلول الملحي قبل بدء الحقن.
- قم بشفط المحلول التجريبي (على سبيل المثال ، محلول جلوكوز بنسبة 10٪ محضر في 300 ميكرولتر من الماء ، مكملا ب 300 ميكرولتر إضافي من الماء) في المحقنة ، ثم قم بتوصيله بالقسطرة. تأكد من الجرعة المثلى للمحلول المصمم خصيصا للهدف التجريبي المحدد.
ملاحظة: خلال هذه المرحلة ، توخي الحذر لمنع الضغط غير المبرر على القسطرة ، مما قد يعرض التشريح الداخلي للفأر للخطر. احاول معالجة الأنبوب الجانبي بجانب الماوس بأقصى درجات اللطف. بالإضافة إلى ذلك ، تأكد من بقاء المحقنة خالية من شفط محلول الهواء ، حيث يمكن أن يؤدي الهواء والفقاعات المحبوسة إلى انتفاخ الجهاز الهضمي. - قم بتقييم الحالة الفسيولوجية للماوس وقم بتنشيط وظيفة التسجيل في برنامج التصوير بالنقر فوق زر عملية التسجيل في تطبيق البرنامج.
- التقط الصور بدقة 512 × 512 بكسل وعمق 16 بت ومعدل إطارات 10 هرتز.
ملاحظة: يمكن ضبط معلمات التسجيل لتتماشى مع المتطلبات التجريبية المحددة. - الحصول على بيانات تلقائية (على سبيل المثال ، تمتد على 50 ثانية) ، متبوعا بالتسريب التدريجي للمحلول التجريبي بمعدل مخصص للتجربة (هنا ، 0.035 مل / ثانية).
ملاحظة: في نهاية التجربة ، سيتم القتل الرحيم للفأر على الفور عن طريق خلع عنق الرحم تحت تخدير الأيزوفلوران.
8. معالجة بيانات الصور وتحليلها
- بيانات صورة المهملات إلى 64 × 64 بكسل.
- تحديد مناطق الاهتمام المرسومة يدويا (ROIs) باستخدام ImageJ. ارجع إلى أطلس دماغ الفأر لتعيين عائد الاستثمار على أنه المنطقة الأمامية (M2) ، والمنطقة الحسية الجسدية بما في ذلك البرميل (Somato) ، والمنطقة القذالية (المرئية) ، والمنطقة خلف الطحال (RSC).
- استخدم الدالة MATLAB ReadImageJROI لاستخراج الإحداثيات المقابلة لعائد الاستثمار. الوصول إلى وظيفة MATLAB من خلال الرابط المقدم: https://jp.mathworks.com/matlabcentral/fileexchange/32479-readimagejroi
- احسب متوسط معدل تغير شدة التألق داخل عائد الاستثمار باستخدام MATLAB.
- حدد معدل تغير شدة التألق (ΔF / F) بالمعادلة (1):
 (1)
(1)
حيث يمثل Ft قيمة شدة التألق في وقت محدد ويشار إلى متوسط قيمة الشدة من بداية التسجيل حتى 50 ثانية في الحقن على أنه F0.
- حدد معدل تغير شدة التألق (ΔF / F) بالمعادلة (1):
- حساب التأخير في محلول الحقن في الوصول إلى العضو. استخدم متوسط قيمة الشدة التي تمتد على ثلاث ثوان بعد الحقن كخط أساس. أشكال الموجة المستهدفة تتجاوز قيمة شدة خط الأساس + 1 SD للتحليل إذا حدثت بعد 3 ثوان أو بعد الحقن.
النتائج
تصوير Ca2+ واسع عبر الجمجمة باستخدام فأر G7NG817 مخدر بالإيزوفلوران
أنشأنا القسطرة باتباع الإجراء الموضح في الشكل 1. بعد تحديد موضع المعدة بعناية ، قمنا بتوصيل القسطرة بهذا الموقع (الشكل 1). بعد السماح بوقت كاف للتعافي بعد إدخال القسطرة (حوالي 48 ساعة) ، قمنا بقياس النشاط العصبي التلقائي تحت تخدير الأيزوفلوران الخفيف (0.8-1.0٪) لتحديد تغيرات شدة التألق الأساسي لملاحظات التحفيز المعوي اللاحقة. نتيجة لذلك ، أكدنا أنماط التذبذب العشوائية Ca2+ التي امتدت عبر القشرة بأكملها (الشكل 2 أ). يقدم الشكل 2 أمثلة تمثيلية لنشاط الدماغ التلقائي ، مع إدخال القسطرة مسبقا. حددنا وقت أول ذروة عابرة يمكن ملاحظتها من Ca2+ في منطقة M2 بعد الحقن على أنه 0.0 ثانية. عرض تمثيل اللون الزائف ذروة هذا Ca2+ عابر كقيمة قصوى ، مع متوسط القيمة بالإضافة إلى انحراف معياري واحد (1 SD) كحد أدنى للقيمة. كان من الواضح أن نصفي الكرة الأيسر والأيمن يظهران نشاطا متزامنا في جميع المناطق.
بعد ذلك ، أنشأنا عائد استثمار لتوصيف الموجات داخل كل منطقة وظيفية. كما هو موضح في الشكل 2 ب ، قدمنا التغيرات الزمنية في معدل شدة التألق لكل عائد استثمار (الشكل 2 ب). اتبعت هذه التذبذبات السطحية الملحوظة Ca2+ نمطا قمع للانفجار ، بالتناوب بين فترات النشاط المنخفض والتغيرات الفلورية ذات السعة العالية. يتماشى نمط النشاط هذا مع النتائج السابقة التي قامت في وقت واحد بقياس مخطط كهربية الدماغ للسطح القشري وديناميكيات Ca2+ 26.
على الرغم من تقلبات السطح العالمي أو الإقليمي Ca2+ بين حالات القمع والانفجار ، يمكن أن تختلف المنطقة القشرية المحددة التي تبدأ زيادة الكالسيوم. كما ذكرنا سابقا ، عندما تحفز الإشارة منطقة قشرية محلية ، من المتوقع أن تنشط المنطقة ، مما يؤدي لاحقا إلى تحول عالمي في الحالة القشرية27،28.
التغيرات في ديناميكيات قشرة Ca2+ بعد حقن الجلوكوز داخل المعدة
بعد ذلك ، لتوضيح كيفية تأثير الجلوكوز أو الماء على النشاط القشري ، قمنا بمراقبة ديناميكيات Ca2+ على نطاق واسع في القشرة أثناء الحقن وبعده. نتيجة لذلك ، وجدنا تغييرات في ديناميكيات Ca2+ القشرية بعد حقن الجلوكوز داخل المعدة. على عكس النشاط التلقائي الموضح في مناطق متنوعة من التنشيط القشري ، لاحظنا التنشيط الفوري في منطقة الفص الجبهي أو القشرة الحركية الثانوية (M2) عند الحقن المباشر للجلوكوز عبر القسطرة ، وهو تأثير لا يسببه حقن الماء داخل المعدة (الشكل 3A-C). علاوة على ذلك ، لاحظنا أن أحداث Ca2+ العابرة والبارزة تميل إلى الحدوث بشكل مستمر على مدار 10 ثوان تقريبا بعد حقن الجلوكوز داخل المعدة. لم تكن هذه الظواهر المستمرة واضحة عند إعطاء المياه (الشكل 3D-F).
تميزت أحداث Ca2+ في كل عائد استثمار بحساب نسبة تغير شدة التألق ، باستخدام القشرة السمعية (المرجع) كمرجع ، في الذروة الأولى التي تحدث في غضون 4-8 ثوان بعد الانتهاء من إعطاء الجلوكوز. نتيجة لذلك ، لوحظ تغيير كبير عند حقن الجلوكوز بعد مقارنة الاستجابة في منطقة M2 باستخدام القشرة السمعية كمرجع قبل الحقن وبعده.
في المقابل ، لم يلاحظ مثل هذا التغيير عند حقن الماء (الشكل 3G ، الماء N = 7: قبل الحقن ، 2.38 ± 2.53 مقابل 2.05 ± 1.84 ، ص > 0.05 ؛ الجلوكوز N = 7: قبل الحقن ، 2.48 ± 0.97 مقابل 3.76 ± 2.76 ، ص < 0.01 ، اختبار رتبة Wilcoxon الموقعة). بعد ذلك ، عند تحديد مستويات التنشيط في كل منطقة قشرية من خلال نسبة قيمة ما بعد الحقن إلى قبل الحقن ، لوحظ اختلاف كبير فقط في منطقة M2 (الشكل 3H ، M2: 0.92 ± 0.89 مقابل 1.30 ± 0.32 ، ص = 0.006 ؛ سوماتو: 0.95 ± 0.076 مقابل 1.04 ± 0.13 ، ص = 0.27 ؛ مرئي: 0.92 ± 0.3 مقابل 1.00 ± 0.06 ، ص = 0.89 ؛ RSC: 0.97 ± 0.27 مقابل 1.10 ± 0.27 ، ص = 0.60 ، t-test).
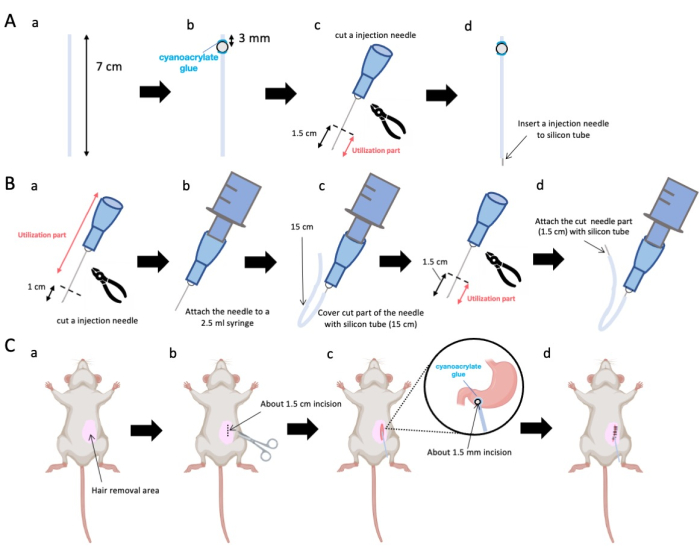
الشكل 1: نظرة عامة على الطريقة. (أ) إنشاء القسطرة: (أ) قطع أنبوب السيليكون. (ب) قم بلصق حبة بلاستيكية على أنبوب السيليكون باستخدام غراء سيانواكريليت الطبي. (ج) اقطع الإبرة 23 جم 1.5 سم من الحافة. (د) اربط الطرف المقطوع للإبرة بأنبوب السيليكون. (ب) مجموعة الحاقن: (أ) قم بقص إبرة حقن 23 جم بمقدار 1 سم. (ب) قم بتوصيل إبرة الحقن المشذبة بحقنة سعة 2.5 مل. (ج) غمد الجزء المقطوع من إبرة الحقن بأنبوب سيليكون. (د) اقطع الإبرة 23 جم 1.5 سم من الحافة. (ه) قم بتوصيل الطرف المقطوع للإبرة بأنبوب السيليكون. (ج) الإجراء الجراحي: (أ) إزالة المنطقة الجراحية. (ب) شق الجلد وجدار البطن بطول 1.5 سم تقريبا. (ج) قم بعمل ثقب صغير (قطره حوالي 1.5 مم) في الفرع البوابي باستخدام المقص وأدخل القسطرة (أنبوب السيليكون). قم بتأمين القسطرة في antrum pyloric باستخدام غراء cyanoacrylate الطبي. (د) خياطة جدار البطن والجلد باستخدام مادة خياطة حريرية وإبرة 5/0. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
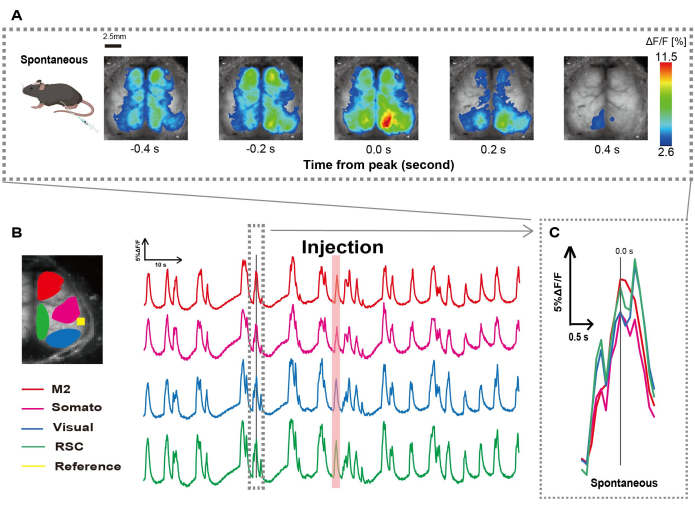
الشكل 2: تذبذبات Ca2+ العفوية في G7NG817 الفئران ذات القسطرة المرفقة. (أ) مثال تمثيلي على تذبذبات Ca2+ على نطاق واسع في القشرة معروضة على فترات 0.2 ثانية. يتم تمثيل التغييرات في شدة التألق بتراكب لون زائف. تظهر النافذة الزمنية المحاطة بالخط المتقطع في B أول ظهور Ca2+ عابر ، مع تعيين ذروته على أنها الوقت 0. يستخدم تمثيل اللون الزائف ذروة Ca2+ العابر كقيمة قصوى ومتوسط +1 SD كقيمة أدنى. (ب) تغيرات السلاسل الزمنية في شدة التألق لكل عائد استثمار في المثال. تتوافق ألوان الخط مع مناطق قشرية مختلفة: الأحمر يمثل M2 ؛ الأرجواني يمثل المنطقة الحسية الجسدية (Somato); يمثل اللون الأزرق المنطقة المرئية (مرئي) ؛ ويمثل اللون الأخضر منطقة الطحال الرجعية. يظهر شريط السلمون الملون وقت الحقن. (ج) يتم عزل ذروة واحدة داخل المخطط المتقطع وعرضها في عرض مكبر. الاختصارات: SD = الانحراف المعياري؛ عائد الاستثمار = منطقة الاهتمام ؛ RSC = منطقة الطحال الرجعية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
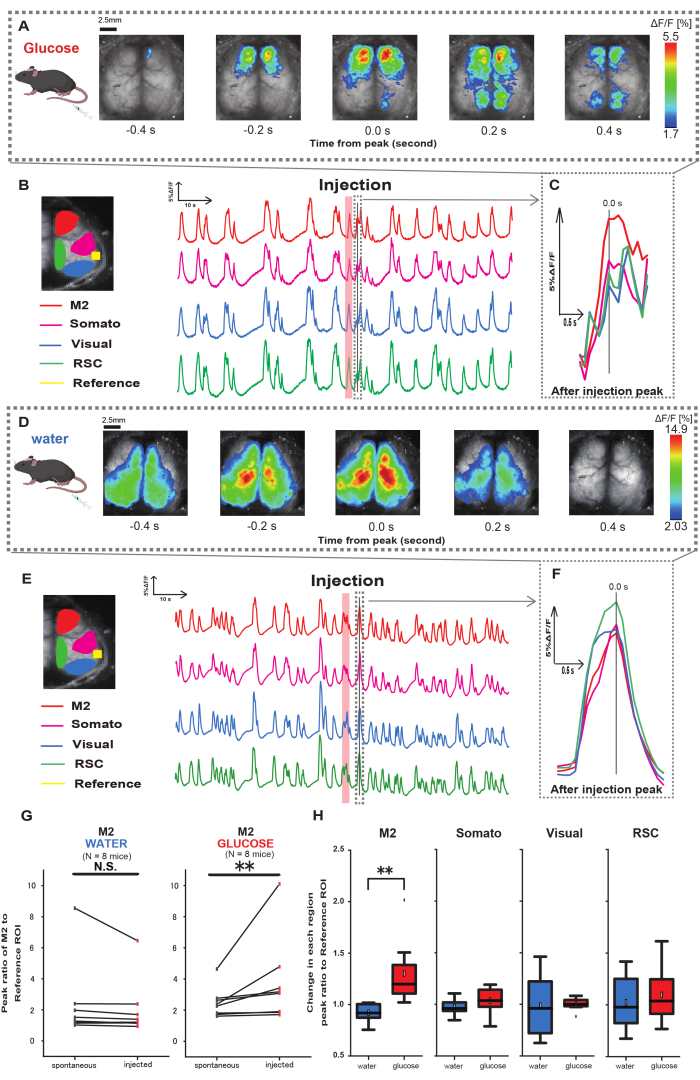
الشكل 3: استجابة القشرة العريضةCa 2+ أثناء / بعد حقن الجلوكوز أو الماء. (أ) مثال تمثيلي لإعطاء الغلوكوز معروض على فترات 0.2 ثانية. يتم تمثيل التغييرات في شدة التألق بتراكب لون زائف. تظهر النافذة الزمنية المحاطة بالخط المتقطع في B أول ظهور Ca2+ عابر بعد الحقن ، مع ضبط ذروته على أنها الوقت 0. يعتمد تمثيل اللون الزائف على ذروة أول عابر Ca2+ بعد الحقن كقيمة قصوى ومتوسط +1 SD كقيمة أدنى. (ب) تغيرات السلاسل الزمنية لشدة التألق لكل عائد استثمار في المثال. تتوافق ألوان الخط مع مناطق قشرية مختلفة: يمثل اللون الأحمر M2 ، ويمثل اللون الأرجواني المنطقة الحسية الجسدية (Somato) ، والأزرق يمثل المنطقة المرئية (مرئي) ، والأخضر يمثل منطقة الطحال الرجعية. (ج) يتم عزل ذروة واحدة داخل المخطط المتقطع وعرضها في عرض مكبر. تحليل موجة الكالسيوم المستهدفة هي أول موجة ظهرت في غضون 4-8 ثوان بعد الحقن. (د) مثال تمثيلي لحقن الماء كبيانات للتحكم في الجلوكوز. (ه) تغيرات السلاسل الزمنية في شدة التألق لكل عائد استثمار في المثال. ألوان الخط كما في B. (و) يتم عزل ذروة واحدة داخل المخطط المتقطع وعرضها في عرض مكبر. تحليل موجة الكالسيوم المستهدفة هي أول موجة ظهرت في غضون 4-8 ثوان بعد الحقن. (ز) مقارنة بين النشاط التلقائي M2 (قبل) والاستجابة بعد الحقن (المحقون). يتغير متوسط شدة التألق على مدى 50 ثانية قبل الحقن ، وتم حساب ذروة الاستجابة في منطقة M2 بين 4 ثوان و 8 ثوان بعد الحقن ، باستخدام القشرة السمعية كمرجع. (ح) مقارنة مستويات التنشيط في كل منطقة قشرية عند إعطاء الماء أو الجلوكوز. تم حساب نسبة قيمة ما بعد الحقن إلى ما قبل الحقن ، كما هو محدد في G ، لكل منطقة. N.S. يمثل غير ذي شأن (ص > 0.05). ** <0.01. يتم تعريف أشرطة الخطأ على أنها الخطأ القياسي للمتوسط. الاختصارات: SD = الانحراف المعياري؛ عائد الاستثمار = منطقة الاهتمام ؛ RSC = منطقة الطحال الرجعية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تقدم هذه المقالة كيفية ربط قسطرة بالأمعاء ومراقبة إشارات Ca2+ واسعة عبر الجمجمة مع الفئران المعدلة وراثيا التي تعبر عن مؤشر Ca2+ مشفر وراثيا. في هذه التجربة ، لم نحصل على بيانات التصوير التي تستخدم الطول الموجي الثانوي لمصدر الضوء. وذلك لأن الفئران المعدلة وراثيا التي استخدمناها في هذه الدراسة تظهر معدل تغيير شدة مضان مرتفع جدا (~ عدة عشرات بالمائة) استجابة للمنبهات الحسية بسبب خصائص بروتين مؤشر Ca2+ (G-CaMP7) المستخدم. ومن ثم ، اعتقدنا أن التلوث من ديناميكا الدم كان ضئيلا. علاوة على ذلك ، حدثت الاستجابات العصبية التي ركزنا عليها بسرعة في غضون ثوان قليلة ، لذلك اعتبرنا أنه من غير الضروري حساب احتقان الدم الوظيفي المحلي المتولد لاحقا. طريقة زرع القسطرة هذه قادرة على الاندماج مع الفئران المعدلة وراثيا الأخرى لمراقبة النشاط العصبي في مناطق الدماغ الأخرى وعلى نطاقات زمنية مختلفة. ومع ذلك ، إذا تم استخدام فئران أخرى معدلة وراثيا ، فيجب إجراء تجربة التحكم الموضحة أعلاه.
هذه الطريقة لربط القسطرة بالأمعاء مناسبة للحقن بجرعة واحدة بتكلفة منخفضة وهي سهلة وأقل توغلا من الطريقة المقترحةسابقا 29. تقليديا ، يتم تطبيق القطن الماص على الجهاز الهضمي وخياطته. ومع ذلك ، يمكن أن تضعف الخياطة التعافي بعد الجراحة في الفئران. لذلك ، اعتمدنا طريقة الإرفاق. السبب في اختيارنا للخرز البلاستيكي هو أنها تلتصق بشكل أفضل بالسيليكون باستخدام غراء سيانواكريلات الذي نستخدمه.
لقد تم الافتراض تقليديا أن الدماغ يدرك الجلوكوز بناء على تصاعد مستويات الجلوكوز في الدم في البلازما وإفراز الهرمونات المصاحب. وبالتالي ، يحتاج الدماغ من عدة دقائق إلى ساعات للكشف عن الجلوكوز بعد امتصاصه من القناة الهضمية4. اقترحت بعض الأبحاث أن استشعار الأمعاء يتحكم في تفضيل طعم الفئران بالإضافة إلى استقبال الطعم الحلو عن طريقالفم 1،3،17،22. كمثال توضيحي ، قدم الباحثون دليلا على أن المحلول غير المغذي المقترن بالجلوكوز داخل المعدة (IG) والمحلول غير المغذي المقترن بنكهة α-methyl-d-glucopyranoside (MDG) غير القابل للتمثيل الغذائي يمكن أن يثير تفضيلا لكل محلول غير مغذي منكه مقارنة بمجموعة IG المقترنة بالماء. نظرا لأن حقن الجلوكوز داخل الصفاق لم يحفز تناول المحلول غير المغذي30 ، فقد كان من المتوقع أن يلعب استشعار المغذيات في الأمعاء دورا مهما في الخيارات الغذائية للفئران1،19،22.
كشفت دراسة حديثة عن وجود خلية قابلة للإثارة كهربائيا في الأمعاء ، يشار إليها باسم "خلية Neuropod" ، والتي تستخدم المستقبلات الجزيئية لاكتشاف ونقل المحفزات الحسية إلى العصب المبهم عبر مشبك جلوتاماتيرجيك. بينما ركزت الدراسات السابقة بشكل أساسي على دور GLP-1 في التحكم في تغذية الفئران الغذائية ، فقد أظهرت التحقيقات الحديثة أن تنشيط العصب المبهم بواسطة خلايا الأرجل العصبية يعدل شهية الفئران. ينشط العصب المبهم لاحقا Nucleus Tractus Solitarius ، مما يؤدي إلى التنشيط اللاحق للخلايا العصبية الدوبامينية19. ومع ذلك ، من غير المعروف ما إذا كان تنشيط الخلايا العصبية الدوبامين ينشط القشرة أيضا. لتصنيف الاستجابات الدماغية بعد تسريب الجلوكوز داخل المعدة ، قمنا بتحسين تقنية ربط القسطرة لأغراض التصوير. عند استخدام هذه التقنية ، من الضروري توخي الحذر لمنع تلف الأعضاء ، مع إيلاء اهتمام خاص للكبد ، المعرض للإصابة أثناء التلاعب المطلوب للتأكد من موقع المعدة.
تشير النتائج التي توصلنا إليها إلى أن حقن الجلوكوز داخل المعدة ينشط قشرة الفص الجبهي في غضون ثوان. ومع ذلك ، فإن إعطاء الجلوكوز داخل المعدة يبدأ مسارات إشارات متعددة في وقت واحد ، مثل الطرق الهرمونية والعصب المبهم والعصب الوارد الشوكي. تتم معالجة هذه الإشارات في جذع الدماغ على نطاقات زمنية مختلفة. لذلك ، يجب أن تستكشف الدراسات المستقبلية كيفية معالجة هذه الإشارات المعقدة ودمجها داخل الدماغ.
علاوة على ذلك ، فإن خط الفأر المعدل وراثيا BAC GLT-1-G-CaMP7 الذي استخدمناه في الدراسة الحالية يعبر عن مستشعر Ca2+ ، G-CaMP7 ، في كل من الخلايا العصبية والخلايا النجمية. من حيث المبدأ ، فإن ارتفاع الكالسيوم2 + الفص الجبهي الذي تم الحصول عليه عن طريق تصوير Ca2+ على نطاق واسع عبر الجمجمة مشتق من الخلايا العصبية و / أو الخلايا النجمية. ومع ذلك ، نظرا لأن الخلايا النجمية تعبر عن مستقبلات الدوبامين في حالة وجود إشارات الدوبامين ، فإنها تشير إلى التنشيط المحتمل لإشارات IP3 / Ca2+ الفلكية. نظرا لأن إشارات IP3 / Ca2+ النجمية تنظم اللدونة المشبكية ، فقد تلعب أيضا دورا مهما في التغييرات في تفضيل السكروز والتغيرات في سلوك التغذية بعد استقبال الجلوكوز. وبالتالي ، ستكون هناك حاجة إلى التصوير بدقة خلوية باستخدام الفحص المجهري ثنائي الفوتون لتحديد ما إذا كانت الاستجابة التي لوحظت في قشرة الفص الجبهي بعد إعطاء الجلوكوز نشأت من الخلايا العصبية أو الخلايا النجمية في الدراسات المستقبلية. تتضمن طريقة أخرى فعالة مراقبة تعبير مؤشر Ca2+ الخاص بالخلية في الفئران التي تستخدم الفيروس المرتبط بالغدة (AAV) من خلال القياس الضوئي للألياف. علاوة على ذلك ، من الضروري التحقق ، باستخدام تقنيات الفيزيولوجيا الكهربية ، مما إذا كان محفز الجلوكوز للأمعاء قد حفز العصب المبهم حقا. إذا كانت خلايا الأرجل العصبية تنقل إشارات إلى العصب المبهم عن طريق تلقي الجلوكوز ، فإننا نتوقع عدم وجود استجابة من العصب المبهم عند إعطاء مثبط SGLT-1. أخيرا ، سيكون التحقق من الصحة باستخدام مضادات مستقبلات الدوبامين المختلفة ضروريا لتأكيد ما إذا كانت إسقاطات العصب المبهم إلى Nucleus Tractus Solitarii (NTS) قد نشطت الخلايا العصبية الدوبامينية ، مما يزيد من إشارات قشرة الفص الجبهي Ca2+ . عموما, يتيح هذا النظام تحقيقا شاملا لآثار النقل العصبي السريع من القناة الهضمية إلى الدماغ. إنه يقدم منهجية واعدة للغاية يمكن أن توضح الآليات ، مثل كيف يغير الإجهاد تفضيل السكروز فيما يتعلق بالتفاعلات بين الأمعاء والدماغ.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذا العمل من قبل جامعة Ochanomizu ، ومنح KAKENHI (18K14859 ، 20K15895) ، وبرنامج JST FOREST ، ورقم المنحة JPMJFR204G ، ومؤسسة أبحاث علوم البصريات والتكنولوجيا ، ومجلس أبحاث Kao لدراسة علوم الرعاية الصحية ، والرابطة اليابانية للابتكار الكيميائي ، ومؤسسة TERUMO لعلوم الحياة. يشكر المؤلف الدكتور تاكاشي تسوبوي وكازوكي هارادا وأكيو ناتسوبوري على إشرافهم على التجارب. كما يشكر المؤلف أعضاء المختبر على دعمهم.
Materials
| Name | Company | Catalog Number | Comments |
| 2.5 mL TERUMO syringe | TERUMO | ss-02Sz | |
| 23 G injection needle | TERUMO | 4987350390691 | |
| Anesthetic (ISOFLURANE Inhalation Solution) | viatris | 871119 | |
| cotton swab | local company | ||
| Cyanoacrylate glue (AronArufa A) | TOAGOSEI | 7990700Q1022 | |
| dental acrylic cement C&B | Sun Medical | 221AABZX00115000 | |
| Depilatory cream | Kracie | local company | |
| Digital CMOS camera | Hamamatsu Photonics | ORCA-Spark | |
| Ear bar | NARISHIGE | EB-5N | |
| Filter set (U-MWB2) | Evident | U-MWB2 | |
| Fine Scissors | Fine Dcience Tools | 14040-10 | |
| G7NG817 mice | RIKEN BRC | RBRC09650 | |
| Image software | Hamamatsu Photonics | HC Image software | |
| Isoflurane vapolizer | shinanoseisakusyo | SN-487-0T | |
| Light source (U-HGLGPS) | Evident | U-HGLGPS | |
| microscopy (MVX10) | Evident | ||
| Plastic beads (inner diameter 3 mm, outer diameter 5 mm) | local company | ||
| Pliers | local company | ||
| Polydioxanone suture, monodiox | Alfresa Pharma | HR1305MV45-KF2R | This absorbable, monofilament PDS suture is employed for closing the surgical incision |
| Round ended forceps | F.S.T. | 11617-12 | |
| saline | Otsuka Pharmaceutical Factory | 35061311 | |
| Silicon tube (inner diameter 0.5 mm, outer diameter 1.0 mm) | AS ONE CORPORATIO | 33151413 | local company |
| small surgery needle | Natsume Seisakusho Co., Ltd. | AC03DNT | |
| Stereotaxic stage | NARISHIGE | MA-6N | |
| Xylocaine Jelly 2% | Sandoz K.K. | 614429303 | This jelly is used as a local analgesic to alleviate surgical pain |
References
- Buchanan, K. L., et al. The preference for sugar over sweetener depends on a gut sensor cell. Nature Neuroscience. 25 (2), 191-200 (2022).
- Reimann, F. Molecular mechanisms underlying nutrient detection by incretin-secreting cells. International Dairy Journal. 20 (4), 236-242 (2010).
- Kreuch, D., et al. Gut mechanisms linking intestinal sweet sensing to glycemic control. Frontiers in Endocrinology. 9, 741 (2018).
- Gorboulev, V., et al. Na(+)-D-glucose cotransporter SGLT1 is pivotal for intestinal glucose absorption and glucose-dependent incretin secretion. Diabetes. 61 (1), 187-196 (2012).
- Harada, N., Inagaki, N. Role of sodium-glucose transporters in glucose uptake of the intestine and kidney. Journal of Diabetes Investigation. 3 (4), 352-353 (2012).
- Kaelberer, M. M., Rupprecht, L. E., Liu, W. W., Weng, P., Bohórquez, D. V. Neuropod cells: The emerging biology of gut-brain sensory transduction. Annual Review of Neuroscience. 43, 337-353 (2020).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Larsen, P. J., Tang-Christensen, M., Jessop, D. S. Central administration of glucagon-like peptide-1 activates hypothalamic neuroendocrine neurons in the rat. Endocrinology. 138 (10), 4445-4455 (1997).
- Alhadeff, A. L., Rupprecht, L. E., Hayes, M. R. GLP-1 neurons in the nucleus of the solitary tract project directly to the ventral tegmental area and nucleus accumbens to control for food intake. Endocrinology. 153 (2), 647-658 (2012).
- Raybould, H. E. Gut chemosensing: interactions between gut endocrine cells and visceral afferents. Autonomic Neuroscience: Basic & Clinical. 153 (1-2), 41-46 (2010).
- Routh, V. H. Glucose-sensing neurons: are they physiologically relevant. Physiology & Behavior. 76 (3), 403-413 (2002).
- Secher, A., et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. The Journal of Clinical Investigation. 124 (10), 4473-4488 (2014).
- Williams, E. K., et al. Sensory neurons that detect stretch and nutrients in the digestive system. Cell. 166 (1), 209-221 (2016).
- Borgmann, D., et al. Gut-brain communication by distinct sensory neurons differently controls feeding and glucose metabolism. Cell Metabolism. 33 (7), 1466-1482.e7 (2021).
- Krashes, M. J., et al. Rapid, reversible activation of AgRP neurons drives feeding behavior in mice. The Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- Aponte, Y., Atasoy, D., Sternson, S. M. AGRP neurons are sufficient to orchestrate feeding behavior rapidly and without training. Nature Neuroscience. 14 (3), 351-355 (2011).
- Zhang, L., Han, W., Lin, C., Li, F., de Araujo, I. E. Sugar metabolism regulates flavor preferences and portal glucose sensing. Frontiers in Integrative Neuroscience. 12, 57 (2018).
- Goldstein, ., et al. Hypothalamic detection of macronutrients via multiple gut-brain pathways. Cell Metabolism. 33 (3), 676-687.e5 (2021).
- Fernandes, A. B., et al. Postingestive modulation of food seeking depends on vagus-mediated dopamine neuron activity. Neuron. 106 (5), 778-788.e6 (2020).
- Kaelberer, M. M., et al. . A gut-brain neural circuit for nutrient sensory transduction. 361 (6408), eaat5236 (2018).
- Bohórquez, D. V., et al. Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. The Journal of Clinical Investigation. 125 (2), 782-786 (2015).
- Tan, H. -. E., et al. The gut-brain axis mediates sugar preference. Nature. 580 (7804), 511-516 (2020).
- Wang, D., et al. Whole-brain mapping of the direct inputs and axonal projections of POMC and AgRP neurons. Frontiers in Neuroanatomy. 9, 40 (2015).
- Yamada, S., Wang, Y., Monai, H. Transcranial cortex-wide Ca2+ imaging for the functional mapping of cortical dynamics. Frontiers in Neuroscience. 17, 1119793 (2023).
- Monai, H., et al. Calcium imaging reveals glial involvement in transcranial direct current stimulation-induced plasticity in mouse brain. Nature Communications. 7 (1), 11100 (2016).
- Ferron, J. -. F., Kroeger, D., Chever, O., Amzica, F. Cortical Inhibition during Burst Suppression Induced with Isoflurane Anesthesia. The Journal of Neuroscience. 29 (31), 9850-9860 (2009).
- Ming, Q., et al. Isoflurane-induced burst suppression is a thalamus-modulated, focal-Onset rhythm with persistent local asynchrony and variable propagation patterns in rats. Frontiers in Systems Neuroscience. 14, 599781 (2021).
- Schwalm, M., et al. Functional states shape the spatiotemporal representation of local and cortex-wide neural activity in mouse sensory cortex. Journal of Neurophysiology. 128 (4), 763-777 (2022).
- Ueno, A., et al. Mouse intragastric infusion (iG) model. Nature Protocols. 7 (4), 771-781 (2012).
- Zukerman, S., Ackroff, K., Sclafani, A. Post-oral glucose stimulation of intake and conditioned flavor preference in C57BL/6J mice: A concentration-response study. Physiology & Behavior. 109, 33-41 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved