Method Article
Análise em tempo real da comunicação neural intestino-cérebro: dinâmica do cálcio em todo o córtex em resposta à estimulação intestinal da glicose
Neste Artigo
Resumo
A comunicação intestino-cérebro, facilitada pelo nervo vago, é crucial para a comunicação entre o sistema endócrino gastrointestinal e o cérebro. No entanto, ainda não se sabe se a injeção intragástrica de glicose pode alterar a atividade cortical. Aqui, oferecemos um protocolo abrangente para observar mudanças na atividade cortical após a injeção de glicose no duodeno.
Resumo
A comunicação entre o trato gastrointestinal e o cérebro após a absorção de nutrientes desempenha um papel essencial na preferência alimentar, metabolismo e comportamentos alimentares. Particularmente no que diz respeito a nutrientes específicos, muitos estudos elucidaram que a assimilação da glicose nas células epiteliais intestinais instiga a ativação de muitas moléculas sinalizadoras. Hormônios como o peptídeo-1 semelhante ao glucagon são conhecidos como mediadores de sinalização por excelência. Como os hormônios influenciam predominantemente o cérebro por meio de vias circulatórias, eles modulam lentamente a atividade cerebral.
No entanto, estudos recentes mostraram duas vias rápidas intestino-cérebro facilitadas pelo sistema nervoso autônomo. Um opera através da via neural aferente espinhal, enquanto o nervo vago medeia o outro. Consequentemente, as respostas cerebrais após a assimilação da glicose no trato gastrointestinal são complicadas. Além disso, como a estimulação intestinal finalmente induz diversas atividades corticais, incluindo respostas sensoriais, nociceptivas, de recompensa e motoras, é necessário empregar metodologias que facilitem a visualização de circuitos cerebrais localizados e atividades pan-corticais para compreender totalmente a transmissão neural intestino-cérebro. Alguns estudos indicaram alterações precipitadas nas concentrações de íons cálcio (Ca2+) no hipotálamo e na área tegmental ventral de forma independente por diferentes vias após a estimulação intestinal. No entanto, não se sabe se há alterações na atividade do córtex cerebral.
Para observar a atividade do córtex cerebral após a injeção intragástrica de glicose, desenvolvemos uma técnica de imagem para visualização em tempo real da dinâmica do Ca2+ em todo o córtex através de um crânio totalmente intacto, usando camundongos transgênicos expressando indicadores de Ca2+ geneticamente codificados. Este estudo apresenta um protocolo abrangente para uma técnica projetada para monitorar a imagem de Ca2+ do córtex transcraniano induzida por estimulação intestinal após injeção intragástrica de glicose por meio de um cateter implantado. Os dados preliminares sugerem que a administração de solução de glicose no intestino ativa o córtex frontal, que permanece sem resposta à administração de água.
Introdução
Principalmente, a detecção intestinal de glicose ocorre através dos receptores de sabor doce (Tas1r2, Tas1r3) e do cotransportador de sódio-glicose 1 (SGLT-1) localizado nas células enteroendócrinas dentro do lúmen intestinal 1,2,3,4,5,6. A sensação de glicose no cérebro é um processo que normalmente se estende de minutos a horas após sua absorção pelo intestino, uma ocorrência baseada principalmente no aumento dos níveis de açúcar no sangue plasmático e na liberação de hormônios 7,8,9,10,11 (por exemplo, peptídeo-1 semelhante ao glucagon [GLP-1], Peptídeo YY (PYY) e polipeptídeo insulinotrópico dependente de glicose [GIP]). Eles atingem o núcleo arqueado do hipotálamo (ARC), onde se ligam aos neurônios pró-opiomelanocortina (POMC) e aos neurônios da proteína relacionada à agouti (AgRP) pelo fluxo sanguíneo e nervo vago (nervo parassimpático)12,13,14. A mudança na atividade desses neurônios leva ao controle do metabolismo e do comportamento alimentar15,16.
A literatura recente destaca cada vez mais a importância da sinalização neural intestino-cérebro após a absorção de glicose. Esse caminho complexo pode ser amplamente categorizado em dois mecanismos principais. O primeiro envolve a ativação de aferências espinhais, influenciando a atividade neuronal do AgRP no ARC. O segundo mecanismo envolve a estimulação do nervo vago por meio de conexões com células epiteliais. Dadas as maneiras multifacetadas pelas quais as células epiteliais intestinais podem ativar o nervo vago13, seu papel é considerado versátil.
Uma proporção significativa das atividades do intestino vago e do nervo aferente espinhal está associada a comportamentos alimentares 17,18,19. No entanto, evidências emergentes sugerem que certas fibras nervosas vagas, projetando-se para "células de neurópodes", estão implicadas na preferência pela glicose. As células dos neurópodes, um subconjunto de células enteroendócrinas, expressam SGLT-1 em seu lado luminal e transmitem estímulos sensoriais a um nervo vago por meio de sinapses glutamatérgicas 2,20,21,22. A ativação do nervo vago desencadeia neurônios dopaminérgicos na área tegmental ventral (VTA) em segundos19. Notavelmente, a inibição da ativação vagal, particularmente no duodeno, usando um antagonista do glutamato reduz a preferência pela sacarose em camundongos1. Isso ressalta o papel crítico da ativação das células dos neurópodes na modulação do comportamento de escolha alimentar após a ingestão de glicose2.
Apesar desses avanços, uma compreensão completa dos mecanismos de detecção rápida de glicose intestinal e seus efeitos nas atividades corticais permanece um enigma complexo. Embora a ativação cerebral controlada pelos neurônios AgRP não inclua o córtex cerebral23, sabe-se que os neurônios dopaminérgicos no VTA se projetam para o córtex cerebral. No entanto, não se sabe se a ativação neuronal dopaminérgica rápida do VTA após a detecção de glicose realmente ativa o córtex cerebral. Para elucidar esse mecanismo, investigamos o potencial da administração intragástrica de glicose para influenciar rapidamente a dinâmica cortical de Ca2+ em camundongos transgênicos que expressam um indicador de cálcio geneticamente codificado.
Este artigo apresenta um método de baixo custo e menos invasivo para entender de forma abrangente as mudanças na atividade cortical após a administração intragástrica de glicose usando imagens de Ca2+ em todo o córtex em camundongos Recentemente, a técnica de imagem de Ca2+ do córtex transcraniano através de um crânio intacto, usando camundongos transgênicos expressando indicadores de cálcio geneticamente codificados, ganhou popularidade24. Notavelmente, a linha de camundongos transgênicos BAC GLT-1-G-CaMP7 # 817 (também conhecida como camundongo G7NG817) empregada neste estudo expressa o sensor Ca2+ , G-CaMP7, em neurônios e astrócitos25. Devido à sua alta densidade de expressão no córtex cerebral, esta linha de camundongos transgênicos é especialmente adequada para imagens de Ca2+ em todo o córtex transcraniano usando um microscópio de epifluorescência padrão.
Protocolo
Todos os protocolos experimentais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Ochanomizu, Japão (protocolos de estudo em animais 22017). Todos os experimentos com animais foram realizados de acordo com as diretrizes para experimentação animal da Universidade de Ochanomizu que estão em conformidade com as Diretrizes Fundamentais para a Conduta Adequada de Experimentos com Animais e Atividades Relacionadas em Instituições de Pesquisa Acadêmica (Ministério da Educação, Cultura, Esportes, Ciência e Tecnologia, Japão). Esforços foram feitos para minimizar o número de animais utilizados. Este estudo foi realizado em conformidade com as diretrizes ARRIVE.
1. Preparação de camundongos transgênicos
- Para seguir este experimento, use camundongos transgênicos BAC GLT-1-G-CaMP7 # 817 machos e fêmeas adultos, ou seja, camundongos G7NG81724,25 (com mais de 8 semanas). A linhagem de fundo de G7NG817 camundongos25 é C57BL / 6J.
- Aloje os ratos em um ciclo claro/escuro de 12 h / 12 h e crie-os em grupos de até cinco camundongos.
2. Criação de cateter
- Use uma tesoura para ajustar o tubo de silicone (diâmetro interno de 0,5 mm, diâmetro externo de 1,0 mm) para um comprimento preciso de 7 cm (Figura 1A-a).
NOTA: Antes dos procedimentos, tesoura e tubo de silicone foram esterilizados. - Cole contas de plástico diminutas (diâmetro interno de 3 mm, diâmetro externo de 5 mm) ao tubo adaptado, certificando-se de que estejam situadas a 3 mm de seu terminal (Figura 1A-b). Fixe as contas com segurança usando cola de cianoacrilato (variantes médicas ou padrão são aceitáveis).
- Extirpar o ápice de uma agulha de 23 G e, em seguida, cortar 1,5 cm da ponta da agulha (figura 1A-c).
- Introduza a agulha seccionada de 23 G do passo 2.3 na extremidade do tubo de silicone, oposta ao local onde as esferas foram afixadas (Figura 1A-d).
3. Criação do injetor
- Use um alicate estéril para extirpar 1 cm da ponta da agulha (Figura 1B-a).
NOTA: Certifique-se de que o orifício na extremidade cortada mantenha sua integridade e não fique deformado, pois qualquer distorção pode obstruir o fluxo da solução de injeção. - Acople a agulha de injeção de 23 G adaptada da etapa 3.1.1 a uma seringa de 2,5 mL (Figura 1B-b).
- Segmentar um tubo de silício com o comprimento necessário (um tubo de silício de 15 cm nesta experiência) e colocá-lo sobre a agulha de injecção de 23 G (figura 1B-c).
NOTA: O volume de solução dispensado irá flutuar com base no comprimento da tubulação. Por exemplo, com um tubo de 15 cm, aproximadamente 50 μL de solução permanecerão após o experimento. - Corte a agulha de injeção de 23 G a 1,5 cm da ponta da agulha.
- Junte a porção seccionada da etapa 3.4 com o cateter de silicone formado na etapa 3.3 (Figura 1B-d).
NOTA: Certifique-se de que os orifícios criados nas etapas 3.1 e 3.4 permaneçam sem distorção após a incisão. Se a retificação for necessária, use um alicate para restaurar sua configuração circular.
4. Localização gástrica
- Administre anestesia ao camundongo por meio de inalação de isoflurano a 3,0% em uma câmara especificada. Aplique pomada oftálmica para evitar o ressecamento dos olhos.
- Transfira delicadamente o camundongo anestesiado da câmara de inalação para a mesa cirúrgica ao verificar o estado anestesiado do camundongo. Forneça suporte térmico durante todo o procedimento.
- Coloque o camundongo em decúbito dorsal, alinhando sua boca próxima ao aparelho de inalação, e module a concentração de isoflurano de 3,0% a 2,0%.
NOTA: Desengate o segmento inferior da máscara de isoflurano de sua contraparte superior e ancore a máscara separada (segmento superior) à mesa cirúrgica usando fita adesiva. - Complemente a cavidade oral, os membros anteriores e os membros posteriores do camundongo à mesa cirúrgica usando fita adesiva.
NOTA: Ao fixar o mouse na mesa, erros cirúrgicos devido ao movimento podem ser evitados mesmo se o mouse estiver anestesiado. - Remova o cabelo do camundongo da parte superior esquerda do abdômen (150% da área ao redor do local da cirurgia) usando creme depilatório. Aplique um analgésico local topicamente no local da cirurgia e aguarde 5 min antes de prosseguir.
- Aplique um gel anestésico local na pele abdominal e aguarde de 5 a 10 min. Em seguida, desinfete a área cirúrgica 3 vezes com rodadas alternadas de iodóforo e etanol a 70%. Confirme a profundidade da anestesia por meio de uma pinça no dedo do pé e cubra o animal com campos cirúrgicos estéreis. Faça uma incisão na pele com aproximadamente 1,5 cm de comprimento (Figura 1C-b), situada 1 cm à direita da mediana abdominal e 5 mm abaixo do apêndice xifóide (Figura 1C-c). Em seguida, crie uma incisão de 1,5 cm na parede abdominal no mesmo local da incisão inicial na pele.
NOTA: Tenha cuidado para evitar causar danos ao fígado subjacente. - Reposicione delicadamente o lobo hepático esquerdo lateralmente usando uma pinça de ponta romba, revelando o estômago abaixo.
5. Inserção do cateter
- Eleve o estômago e retire-o com cuidado através da incisão.
NOTA: Tenha o máximo cuidado para preservar a integridade dos órgãos adjacentes, principalmente o fígado, e evite exercer força indevida no estômago. - Use uma tesoura para criar uma perfuração diminuta (aproximadamente 1,5 mm de diâmetro) no antro pilórico.
- Introduza o terminal do cateter na perfuração, garantindo que o cordão esteja em contato direto com o antro pilórico.
NOTA: O cateter é desinfetado com uma solução de gluconato de clorexidina a 0,1 a 0,5% antes da inserção. - Cole o cordão do cateter no estômago empregando cola de cianoacrilato de grau médico.
NOTA: Certifique-se de que o estômago permaneça solto dos órgãos circundantes. - Verifique a fixação firme do cateter ao estômago e, em seguida, reposicione delicadamente o estômago em sua localização inata abaixo do lobo hepático esquerdo.
- Costure a parede abdominal, permitindo que o cateter se estenda externamente, usando uma sutura de polidioxanona (PDS). Em seguida, feche a incisão na pele de maneira análoga ao fechamento abdominal.
- Reposicione suavemente o mouse em uma gaiola higienizada.
NOTA: Os camundongos pós-operatórios devem ser alojados individualmente. Aplique um analgésico local topicamente no fechamento da ferida e siga os planos analgésicos recomendados pelas diretrizes institucionais locais. - Permitir um período mínimo de recuperação de 48 h em um ambiente padrão.
NOTA: Uma extremidade do cateter inserida no estômago do camundongo é fechada com uma agulha 23G com uma ponta selada para evitar a entrada de substâncias estranhas e evitar mordidas. Como o cateter que se projeta do abdômen é curto, ele evita que o mouse o arraste pela cama, o que pode fazer com que ele se abra ou fique emaranhado.
6. Preparação para imagens transcranianas in vivo de Ca2+
- Administrar anestesia ao camundongo com isoflurano (indução a 2%; manutenção entre 0,8% e 1,0%).
- Prenda o mouse em uma plataforma estereotáxica usando barras de ouvido auxiliares para mitigar os efeitos da pulsação e da respiração. Em seguida, posicione o mouse sob um microscópio estéreo de fluorescência.
- Utilize um conjunto de filtros de fluorescência azul de banda larga (com excitação a 460-490 nm e emissão a 520 nm) em conjunto com uma fonte de luz de mercúrio.
- Capture as imagens usando uma câmera e processe-as usando o software de imagem designado.
- Remova cuidadosamente o cabelo do couro cabeludo usando um barbeador elétrico ou creme depilatório.
NOTA: Se estiver usando uma navalha, certifique-se de que ela esteja completamente desinfetada e tome cuidado para não cortar a pele. - Desinfete a superfície do couro cabeludo usando um cotonete ou ferramenta semelhante com uma solução de gluconato de clorexidina diluída a 0,1-0,5%. Em seguida, desinfete com álcool e repita essas rodadas alternadas 3x.
- Aplique um gel anestésico local e aguarde 5-10 min.
- Prepare-se para aplicar cimento acrílico dental.
- Use uma lâmina de bisturi estéril para cortar o couro cabeludo. Remova completamente o couro cabeludo ou faça um corte reto da parte de trás da cabeça até a testa.
- Use clipes para expor o crânio, estendendo o excesso de pele.
- Use um cotonete para remover o tecido conjuntivo do periósteo.
- Aplique imediatamente o cimento acrílico após a remoção do periósteo. Aja rapidamente para evitar que a superfície do crânio se torne opaca devido à evaporação do osso exposto.
- Aguarde cerca de 5 min para que o cimento seque.
7. Imagem transcraniana de Ca2+ com administração intraduodenal de glicose
- Equilibre a solução experimental e a solução salina à temperatura ambiente. Sujeitar os camundongos a uma restrição alimentar por um período especificado (por exemplo, 2 h).
- Purgue qualquer conteúdo residual dentro do cateter do lado do mouse usando ~ 0,03 mL de solução salina antes de iniciar a injeção.
- Aspire a solução experimental (por exemplo, uma solução de glicose a 10% preparada em 300 μL de água, complementada com 300 μL adicionais de água) para a seringa e, em seguida, conecte-a ao cateter. Determinar a dose óptima da solução adaptada ao objectivo experimental específico.
NOTA: Durante esta fase, tenha cuidado para evitar tensão indevida no cateter, o que pode comprometer a anatomia interna do camundongo. Esforce-se para manipular o tubo do lado do mouse com a máxima gentileza. Além disso, certifique-se de que a seringa permaneça desprovida de aspiração de ar após a solução, pois o ar aprisionado e as bolhas podem induzir distensão gastrointestinal. - Avalie o estado fisiológico do mouse e ative a função de gravação do software de imagem clicando no botão do processo de gravação do aplicativo de software.
- Capture imagens com resolução de 512 x 512 pixels, profundidade de 16 bits e taxa de quadros de 10 Hz.
NOTA: Os parâmetros de gravação podem ser ajustados para se alinharem com requisitos experimentais específicos. - Adquira dados espontâneos (por exemplo, abrangendo 50 s), seguidos pela infusão gradual da solução experimental a uma taxa adaptada ao experimento (aqui, 0,035 mL / s).
NOTA: Ao final do experimento, o camundongo será sacrificado prontamente por luxação cervical sob anestesia com isoflurano.
8. Processamento e análise de dados de imagem
- Compartimentar dados de imagem em 64 x 64 pixels.
- Determine regiões de interesse (ROIs) desenhadas à mão usando ImageJ. Consulte o atlas do cérebro de camundongos para designar ROIs como a área frontal (M2), a área somatossensorial, incluindo o Barril (Somato), a área occipital (Visual) e a região retroesplenial (RSC).
- Use a função MATLAB ReadImageJROI para extrair as coordenadas correspondentes aos ROIs. Acesse a função MATLAB através do link fornecido: https://jp.mathworks.com/matlabcentral/fileexchange/32479-readimagejroi
- Calcule a taxa média de mudança de intensidade de fluorescência dentro do ROI usando o MATLAB.
- Defina a taxa de variação da intensidade de fluorescência (ΔF/F) com a equação (1):
 Características (1)
Características (1)
Em que Ft representa o valor da intensidade de fluorescência num momento específico e o valor médio da intensidade desde o início do registo até aos 50 s da injecção é indicado como F0.
- Defina a taxa de variação da intensidade de fluorescência (ΔF/F) com a equação (1):
- Considere o atraso na solução injetável que chega ao órgão. Use o valor médio de intensidade abrangendo os três segundos após a injeção como linha de base. Formas de onda alvo que ultrapassam o valor de intensidade basal + 1 DP para análise se ocorrerem 3 s ou mais tarde após a injeção.
Resultados
Imagem de Ca2+ largo do córtex transcraniano com um camundongo G7NG817 anestesiado com isoflurano
O cateter foi criado seguindo o procedimento ilustrado na Figura 1. Após identificar cuidadosamente a posição do estômago, fixamos o cateter nesse local (Figura 1). Depois de permitir tempo de recuperação suficiente após a inserção do cateter (aproximadamente 48 h), medimos a atividade neural espontânea sob anestesia leve com isoflurano (0,8-1,0%) para estabelecer as alterações na intensidade da fluorescência basal para observações subsequentes de estimulação intestinal. Como resultado, confirmamos os padrões aleatórios de oscilação de Ca2+ que abrangeram todo o córtex (Figura 2A). A Figura 2 fornece exemplos representativos de atividade cerebral espontânea, com os cateteres inseridos previamente. Definimos o tempo do primeiro pico transitório observável de Ca2+ na região M2 após a injeção como 0,0 s. A representação de pseudo cor exibiu o pico desse transiente de Ca2+ como o valor máximo, com o valor médio mais um desvio padrão (1 DP) como o valor mínimo. Ficou claro que os hemisférios esquerdo e direito exibiram atividade síncrona em todas as regiões.
Em seguida, estabelecemos ROIs para caracterizar as ondas dentro de cada área funcional. Conforme mostrado na Figura 2B, apresentamos as mudanças temporais na taxa de intensidade de fluorescência para cada ROI (Figura 2B). Essas oscilações de superfície observadas de Ca2+ seguiram um padrão de supressão de explosão, alternando entre períodos de baixa atividade e mudanças de fluorescência de alta amplitude. Esse padrão de atividade se alinha com descobertas anteriores que mediram simultaneamente o EEG da superfície cortical e a dinâmica do Ca2+ 26.
Apesar das flutuações globais ou regionais de Ca2+ na superfície entre os estados de supressão e explosão, a região cortical específica que inicia o aumento de cálcio pode ser diferente. Como relatado anteriormente, quando um sinal estimula uma região cortical local, espera-se que a área seja ativada, subsequentemente levando a uma mudança global no estado cortical27,28.
Alterações na dinâmica do córtex Ca2+ após injeção intragástrica de glicose
Em seguida, para elucidar como a administração de glicose ou água influencia a atividade cortical, monitoramos a dinâmica do Ca2+ em todo o córtex durante e após a injeção. Como resultado, encontramos alterações na dinâmica cortical de Ca2+ após a injeção intragástrica de glicose. Em contraste com a atividade espontânea ilustrada em diversas regiões de ativação cortical, observamos ativação imediata na área pré-frontal ou no córtex motor secundário (M2) após injeção direta de glicose no intestino através do cateter, um efeito não induzido pela injeção intragástrica de água (Figura 3A-C). Além disso, observamos que esses eventos transitórios e proeminentes de Ca2+ tenderam a ocorrer continuamente por aproximadamente 10 s após a injeção intragástrica de glicose. Tais fenômenos persistentes não foram aparentes quando a água foi administrada (Figura 3D-F).
Os eventos de Ca2+ em cada ROI foram caracterizados pelo cálculo da razão de mudança da intensidade de fluorescência, usando o córtex auditivo (Referência) como referência, no primeiro pico ocorrido dentro de 4-8 s após o término da administração de glicose. Como resultado, foi observada uma mudança significativa quando a glicose foi injetada após a comparação da resposta na região M2 usando o córtex auditivo como referência antes e após a injeção.
Em contraste, essa mudança não foi observada quando a água foi injetada (Figura 3G, água N = 7: antes vs. injeção, 2,38 ± 2,53 vs. 2,05 ± 1,84, p > 0,05; glicose N = 7: antes vs. injeção, 2,48 ± 0,97 vs. 3,76 ± 2,76, p < 0,01, teste dos postos sinalizados de Wilcoxon). Em seguida, definindo os níveis de ativação em cada região cortical pela razão entre o valor de após a injeção e antes da injeção, foi observada uma diferença significativa apenas na região M2 (Figura 3H, M2: 0,92 ± 0,89 vs. 1,30 ± 0,32, p = 0,006; Somato: 0,95 ± 0,076 vs. 1,04 ± 0,13, p = 0,27; Visual: 0,92 ± 0,3 vs. 1,00 ± 0,06, p = 0,89; RSC: 0,97 ± 0,27 vs. 1,10 ± 0,27, p = 0,60, teste t).
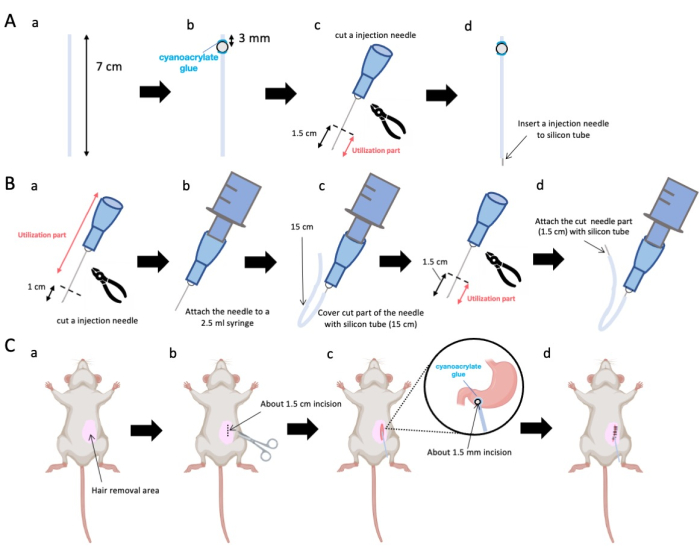
Figura 1: Visão geral do método. (A) Criação do cateter: (a) Corte o tubo de silicone. (b) Fixe um cordão de plástico no tubo de silício usando cola médica de cianoacrilato. (c) Corte a agulha de 23 G a 1,5 cm da ponta. (d) Prenda a extremidade cortada da agulha ao tubo de silicone. (B) Conjunto do injetor: (a) Apare uma agulha de injeção de 23 G em 1 cm. (b) Conecte a agulha de injeção aparada a uma seringa de 2,5 mL. c) Bainhar a secção cortada da agulha de injecção com um tubo de silicone. d) Corte a agulha de 23 G a 1,5 cm da ponta. (e) Prenda a extremidade cortada da agulha ao tubo de silicone. (C) Procedimento cirúrgico: (a) Depilar a área cirúrgica. (b) Incisar a pele e a parede abdominal com um comprimento de aproximadamente 1,5 cm. (c) Criar uma pequena perfuração (cerca de 1,5 mm de diâmetro) no antro pilórico usando uma tesoura e inserir o cateter (tubo de silicone). Prenda o cateter ao antro pilórico usando cola médica de cianoacrilato. (d) Costure a parede abdominal e a pele usando material de sutura de seda 5/0 e agulha. Clique aqui para ver uma versão maior desta figura.
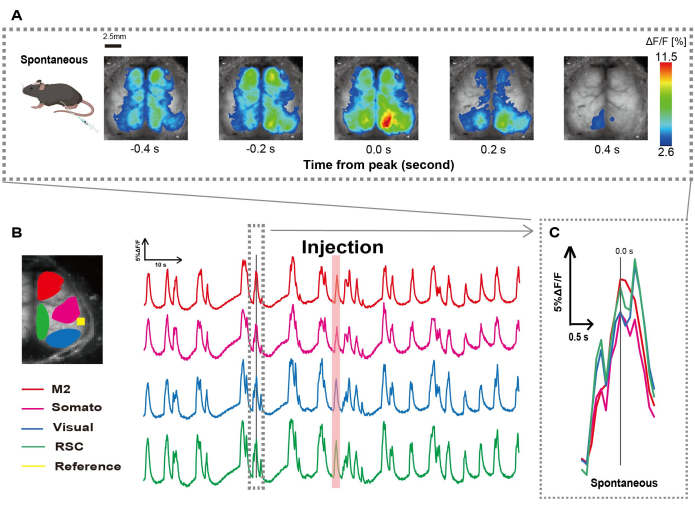
Figura 2: Oscilações espontâneas de Ca2+ em camundongos G7NG817 com um cateter acoplado. (A) Um exemplo representativo de oscilações de Ca2+ em todo o córtex exibidas em intervalos de 0,2 s. As mudanças na intensidade da fluorescência são representadas com uma sobreposição de pseudo-cor. A janela de tempo circundada pela linha tracejada em B mostra o primeiro transiente Ca2+ que aparece, com seu pico definido como tempo 0. A representação de pseudo cor usa o pico desse transiente de Ca2+ como o valor máximo e a média +1 DP como o valor mínimo. (B) Mudanças de séries temporais na intensidade de fluorescência para cada ROI no exemplo. As cores das linhas correspondem a diferentes áreas corticais: o vermelho representa M2; magenta representa a área somatossensorial (Somato); azul representa a área visual (Visual); e verde representa a região retro esplênica. A tira colorida salmão mostra o tempo de injeção. (C) Um único pico dentro do contorno tracejado é isolado e exibido em uma visão ampliada. Abreviaturas: DP = desvio padrão; ROI = região de interesse; RSC = região retro esplênica. Clique aqui para ver uma versão maior desta figura.
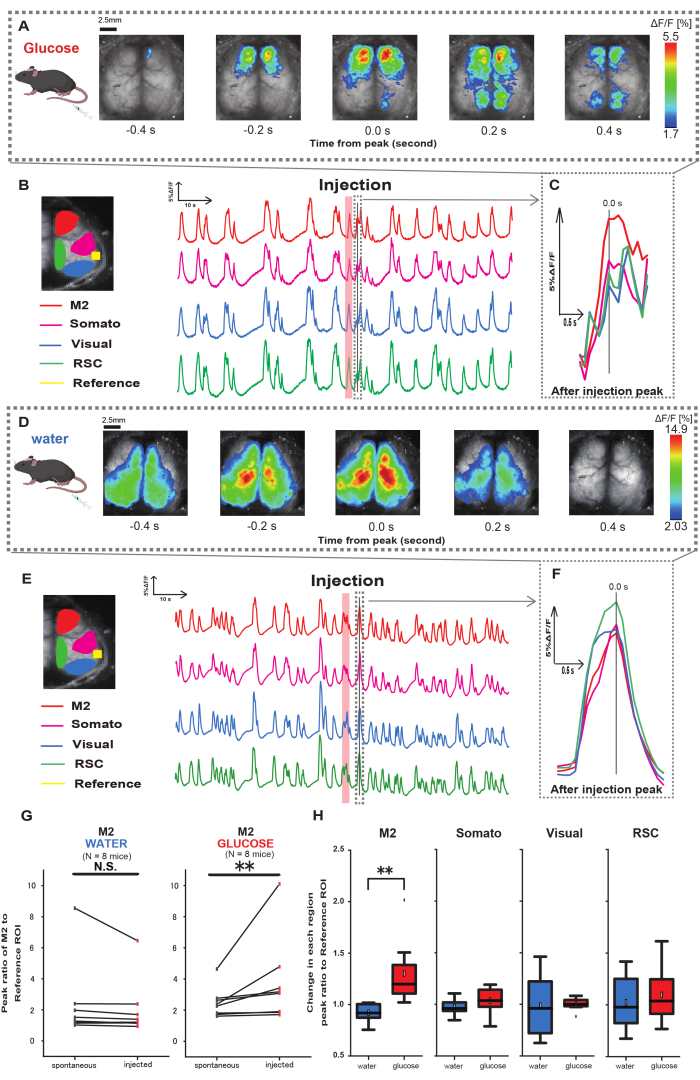
Figura 3: Resposta de Ca2+ ampla do córtex durante/após a injeção de glicose ou água. (A) Um exemplo representativo de administração de glicose exibido em intervalos de 0,2 s. As mudanças na intensidade da fluorescência são representadas com uma sobreposição de pseudo-cor. A janela de tempo circundada pela linha tracejada em B mostra o primeiro transiente de Ca2+ que aparece após a injeção, com seu pico definido como tempo 0. A representação de pseudo-cor é baseada no pico do primeiro transiente de Ca2+ após a injeção como o valor máximo e a média +1 DP como o valor mínimo. (B) Mudanças de séries temporais de intensidade de fluorescência para cada ROI no exemplo. As cores das linhas correspondem a diferentes áreas corticais: vermelho representa M2, magenta representa a área somatossensorial (Somato), azul representa a área visual (Visual) e verde representa a região retroesplenial. (C) Um único pico dentro do contorno tracejado é isolado e exibido em uma visão ampliada. Analisar onda de cálcio alvo é a primeira onda que apareceu dentro de 4-8 s após a injeção. (D) Um exemplo representativo de injeção de água como dados de controle de glicose. (E) Mudanças de séries temporais na intensidade de fluorescência para cada ROI no exemplo. As cores das linhas são como em B. (F) Um único pico dentro do contorno tracejado é isolado e exibido em uma visão ampliada. Analisar onda de cálcio alvo é a primeira onda que apareceu dentro de 4-8 s após a injeção. (G) Comparação da atividade espontânea de M2 (antes) e resposta após a injeção (injetada). A intensidade média de fluorescência muda ao longo de 50 s antes da injeção, e a resposta de pico na região M2 entre 4 s e 8 s após a injeção foi calculada, usando o córtex auditivo como referência. (H) Comparação dos níveis de ativação em cada região cortical quando água ou glicose foram administradas. A razão entre o valor pós-injeção e antes da injeção, conforme determinado em G, foi calculada para cada região. N.S. representa não significativo (p > 0,05). ** <0,01. As barras de erro são definidas como o erro padrão da média. Abreviaturas: DP = desvio padrão; ROI = região de interesse; RSC = região retro esplênica. Clique aqui para ver uma versão maior desta figura.
Discussão
Este artigo apresenta como conectar um cateter ao intestino e observar sinais de Ca2+ em todo o córtex transcraniano com camundongos transgênicos que expressam um indicador de Ca2+ geneticamente codificado. Neste experimento, não obtivemos os dados de imagem que usam um comprimento de onda secundário da fonte de luz. Isso ocorre porque os camundongos transgênicos que empregamos neste estudo exibem uma taxa de mudança de intensidade de fluorescência muito alta (~ várias dezenas de por cento) em resposta a estímulos sensoriais devido às propriedades da proteína indicadora Ca2+ (G-CaMP7) empregada. Portanto, pensamos que a contaminação por hemodinâmica era insignificante. Além disso, as respostas neurais nas quais nos concentramos ocorreram rapidamente em poucos segundos, por isso consideramos desnecessário levar em conta a hiperemia funcional local gerada posteriormente. Este método de implantação de cateter é capaz de se combinar com outros camundongos geneticamente modificados para observar a atividade neuronal em outras regiões do cérebro e em diferentes escalas de tempo. No entanto, se forem utilizados outros ratinhos geneticamente modificados, deve ser realizada a experiência de controlo acima descrita.
Este método de fixação do cateter ao intestino é adequado para injeção de dose única a baixo custo e é fácil e menos invasivo do que o método proposto anteriormente29. Tradicionalmente, o algodão absorvente é aplicado no órgão digestivo e suturado. No entanto, a sutura pode prejudicar a recuperação pós-operatória em camundongos. Portanto, adotamos o método de anexação. A razão pela qual escolhemos contas de plástico é que elas aderiram melhor ao silicone com a cola de cianoacrilato que usamos.
Tradicionalmente, tem sido postulado que o cérebro percebe a glicose com base no aumento dos níveis plasmáticos de glicose no sangue e na liberação concomitante de hormônios. Consequentemente, o cérebro requer vários minutos a horas para detectar a glicose após sua absorção pelo intestino4. Algumas pesquisas sugeriram que a detecção intestinal controla a preferência de sabor dos camundongos, além da recepção oral do sabor doce 1,3,17,22. Como exemplo ilustrativo, os pesquisadores forneceram evidências de que a solução não nutritiva com sabor emparelhada com glicose intragástrica (IG) e a solução não nutritiva com sabor emparelhada com α-metil-d-glicopiranosídeo (MDG) não metabolizável IG podem provocar preferência por cada solução não nutritiva com sabor em comparação com o grupo emparelhado com água IG. Como a injeção intraperitoneal de glicose não estimulou a ingestão de soluções não nutritivas30, previa-se que a detecção intestinal de nutrientes desempenharia um papel crucial nas escolhas alimentares dos camundongos 1,19,22.
Um estudo recente revelou a presença de uma célula eletricamente excitável no intestino, conhecida como "célula neuropod", que emprega receptores moleculares para detectar e transduzir estímulos sensoriais em um nervo vago por meio de uma sinapse glutamatérgica. Embora estudos anteriores tenham se concentrado principalmente no papel do GLP-1 no controle da alimentação de camundongos, investigações recentes demonstraram que a ativação do nervo vago pelas células dos neurópodes modula o apetite do camundongo. O nervo vago subsequentemente ativa o Núcleo do Trato Solitário, levando à subsequente ativação de neurônios dopaminérgicos19. No entanto, não se sabe se a ativação do neurônio dopaminérgico também ativa o córtex. Para categorizar as respostas cerebrais após a infusão intragástrica de glicose, refinamos a técnica de fixação do cateter para fins de imagem. Ao empregar essa tecnologia, é imperativo ter cautela para evitar danos aos órgãos, com particular atenção ao fígado, que é suscetível a lesões durante a manipulação necessária para determinar a localização do estômago.
Nossos achados indicam que a injeção intragástrica de glicose ativa o córtex pré-frontal em segundos. No entanto, a administração intragástrica de glicose inicia várias vias de sinalização simultaneamente, como rotas hormonais, nervo vago e nervo aferente espinhal. Esses sinais são processados no tronco cerebral em diferentes escalas de tempo. Portanto, estudos futuros devem explorar como esses sinais intrincados são processados e integrados ao cérebro.
Além disso, a linhagem de camundongos transgênicos BAC GLT-1-G-CaMP7 que empregamos no presente estudo expressa o sensor de Ca2+ , G-CaMP7, tanto em neurônios quanto em astrócitos. Em princípio, a elevação pré-frontal de Ca2+ obtida pela imagem de Ca2+ largo do córtex transcraniano é derivada de neurônios e/ou astrócitos. No entanto, uma vez que os astrócitos expressam receptores de dopamina se a sinalização de dopamina estiver envolvida, isso sugere a ativação potencial da sinalização astrocítica IP3 / Ca2+ . Uma vez que a sinalização astrocítica IP3 / Ca2+ regula a plasticidade sináptica, ela também pode desempenhar um papel importante nas mudanças na preferência pela sacarose e alterações no comportamento alimentar após a recepção da glicose. Consequentemente, a imagem em resolução celular usando microscopia de dois fótons seria necessária para identificar se a resposta observada no córtex pré-frontal após a administração de glicose se originou de neurônios ou astrócitos em estudos futuros. Outro método eficaz envolve a observação da expressão do indicador Ca2+ específico da célula em camundongos usando o vírus adeno-associado (AAV) por meio de fotometria de fibra. Além disso, é necessário verificar, por meio de técnicas eletrofisiológicas, se o estímulo de glicose no intestino estimulou genuinamente o nervo vago. Se as células dos neurópodes estão transmitindo sinais para o nervo vago recebendo glicose, não prevemos nenhuma resposta do nervo vago quando um inibidor de SGLT-1 é administrado. Finalmente, a validação usando vários antagonistas do receptor de dopamina seria necessária para confirmar se as projeções do nervo vago para o Nucleus Tractus Solitarii (NTS) ativaram os neurônios dopaminérgicos, aumentando os sinais de Ca2+ do córtex pré-frontal. No geral, este sistema permite uma investigação abrangente dos efeitos rápidos da transmissão neural do intestino para o cérebro. Ele apresenta uma metodologia altamente promissora que poderia elucidar mecanismos, como a forma como o estresse altera a preferência pela sacarose em relação às interações intestino-cérebro.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi apoiado pela Universidade de Ochanomizu, bolsas KAKENHI (18K14859, 20K15895), Programa JST FOREST, Concessão Número JPMJFR204G, Fundação de Pesquisa para Optociência e Tecnologia, Conselho de Pesquisa Kao para o Estudo da Ciência da Saúde, Associação Japonesa para Inovação Química e Fundação de Ciências da Vida TERUMO. O autor agradece ao Dr. Takashi Tsuboi, Kazuki Harada e Akiyo Natsubori por sua supervisão dos experimentos. O autor também agradece aos membros do laboratório por seu apoio.
Materiais
| Name | Company | Catalog Number | Comments |
| 2.5 mL TERUMO syringe | TERUMO | ss-02Sz | |
| 23 G injection needle | TERUMO | 4987350390691 | |
| Anesthetic (ISOFLURANE Inhalation Solution) | viatris | 871119 | |
| cotton swab | local company | ||
| Cyanoacrylate glue (AronArufa A) | TOAGOSEI | 7990700Q1022 | |
| dental acrylic cement C&B | Sun Medical | 221AABZX00115000 | |
| Depilatory cream | Kracie | local company | |
| Digital CMOS camera | Hamamatsu Photonics | ORCA-Spark | |
| Ear bar | NARISHIGE | EB-5N | |
| Filter set (U-MWB2) | Evident | U-MWB2 | |
| Fine Scissors | Fine Dcience Tools | 14040-10 | |
| G7NG817 mice | RIKEN BRC | RBRC09650 | |
| Image software | Hamamatsu Photonics | HC Image software | |
| Isoflurane vapolizer | shinanoseisakusyo | SN-487-0T | |
| Light source (U-HGLGPS) | Evident | U-HGLGPS | |
| microscopy (MVX10) | Evident | ||
| Plastic beads (inner diameter 3 mm, outer diameter 5 mm) | local company | ||
| Pliers | local company | ||
| Polydioxanone suture, monodiox | Alfresa Pharma | HR1305MV45-KF2R | This absorbable, monofilament PDS suture is employed for closing the surgical incision |
| Round ended forceps | F.S.T. | 11617-12 | |
| saline | Otsuka Pharmaceutical Factory | 35061311 | |
| Silicon tube (inner diameter 0.5 mm, outer diameter 1.0 mm) | AS ONE CORPORATIO | 33151413 | local company |
| small surgery needle | Natsume Seisakusho Co., Ltd. | AC03DNT | |
| Stereotaxic stage | NARISHIGE | MA-6N | |
| Xylocaine Jelly 2% | Sandoz K.K. | 614429303 | This jelly is used as a local analgesic to alleviate surgical pain |
Referências
- Buchanan, K. L., et al. The preference for sugar over sweetener depends on a gut sensor cell. Nature Neuroscience. 25 (2), 191-200 (2022).
- Reimann, F. Molecular mechanisms underlying nutrient detection by incretin-secreting cells. International Dairy Journal. 20 (4), 236-242 (2010).
- Kreuch, D., et al. Gut mechanisms linking intestinal sweet sensing to glycemic control. Frontiers in Endocrinology. 9, 741 (2018).
- Gorboulev, V., et al. Na(+)-D-glucose cotransporter SGLT1 is pivotal for intestinal glucose absorption and glucose-dependent incretin secretion. Diabetes. 61 (1), 187-196 (2012).
- Harada, N., Inagaki, N. Role of sodium-glucose transporters in glucose uptake of the intestine and kidney. Journal of Diabetes Investigation. 3 (4), 352-353 (2012).
- Kaelberer, M. M., Rupprecht, L. E., Liu, W. W., Weng, P., Bohórquez, D. V. Neuropod cells: The emerging biology of gut-brain sensory transduction. Annual Review of Neuroscience. 43, 337-353 (2020).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Larsen, P. J., Tang-Christensen, M., Jessop, D. S. Central administration of glucagon-like peptide-1 activates hypothalamic neuroendocrine neurons in the rat. Endocrinology. 138 (10), 4445-4455 (1997).
- Alhadeff, A. L., Rupprecht, L. E., Hayes, M. R. GLP-1 neurons in the nucleus of the solitary tract project directly to the ventral tegmental area and nucleus accumbens to control for food intake. Endocrinology. 153 (2), 647-658 (2012).
- Raybould, H. E. Gut chemosensing: interactions between gut endocrine cells and visceral afferents. Autonomic Neuroscience: Basic & Clinical. 153 (1-2), 41-46 (2010).
- Routh, V. H. Glucose-sensing neurons: are they physiologically relevant. Physiology & Behavior. 76 (3), 403-413 (2002).
- Secher, A., et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. The Journal of Clinical Investigation. 124 (10), 4473-4488 (2014).
- Williams, E. K., et al. Sensory neurons that detect stretch and nutrients in the digestive system. Cell. 166 (1), 209-221 (2016).
- Borgmann, D., et al. Gut-brain communication by distinct sensory neurons differently controls feeding and glucose metabolism. Cell Metabolism. 33 (7), 1466-1482.e7 (2021).
- Krashes, M. J., et al. Rapid, reversible activation of AgRP neurons drives feeding behavior in mice. The Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- Aponte, Y., Atasoy, D., Sternson, S. M. AGRP neurons are sufficient to orchestrate feeding behavior rapidly and without training. Nature Neuroscience. 14 (3), 351-355 (2011).
- Zhang, L., Han, W., Lin, C., Li, F., de Araujo, I. E. Sugar metabolism regulates flavor preferences and portal glucose sensing. Frontiers in Integrative Neuroscience. 12, 57 (2018).
- Goldstein, ., et al. Hypothalamic detection of macronutrients via multiple gut-brain pathways. Cell Metabolism. 33 (3), 676-687.e5 (2021).
- Fernandes, A. B., et al. Postingestive modulation of food seeking depends on vagus-mediated dopamine neuron activity. Neuron. 106 (5), 778-788.e6 (2020).
- Kaelberer, M. M., et al. . A gut-brain neural circuit for nutrient sensory transduction. 361 (6408), eaat5236 (2018).
- Bohórquez, D. V., et al. Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. The Journal of Clinical Investigation. 125 (2), 782-786 (2015).
- Tan, H. -. E., et al. The gut-brain axis mediates sugar preference. Nature. 580 (7804), 511-516 (2020).
- Wang, D., et al. Whole-brain mapping of the direct inputs and axonal projections of POMC and AgRP neurons. Frontiers in Neuroanatomy. 9, 40 (2015).
- Yamada, S., Wang, Y., Monai, H. Transcranial cortex-wide Ca2+ imaging for the functional mapping of cortical dynamics. Frontiers in Neuroscience. 17, 1119793 (2023).
- Monai, H., et al. Calcium imaging reveals glial involvement in transcranial direct current stimulation-induced plasticity in mouse brain. Nature Communications. 7 (1), 11100 (2016).
- Ferron, J. -. F., Kroeger, D., Chever, O., Amzica, F. Cortical Inhibition during Burst Suppression Induced with Isoflurane Anesthesia. The Journal of Neuroscience. 29 (31), 9850-9860 (2009).
- Ming, Q., et al. Isoflurane-induced burst suppression is a thalamus-modulated, focal-Onset rhythm with persistent local asynchrony and variable propagation patterns in rats. Frontiers in Systems Neuroscience. 14, 599781 (2021).
- Schwalm, M., et al. Functional states shape the spatiotemporal representation of local and cortex-wide neural activity in mouse sensory cortex. Journal of Neurophysiology. 128 (4), 763-777 (2022).
- Ueno, A., et al. Mouse intragastric infusion (iG) model. Nature Protocols. 7 (4), 771-781 (2012).
- Zukerman, S., Ackroff, K., Sclafani, A. Post-oral glucose stimulation of intake and conditioned flavor preference in C57BL/6J mice: A concentration-response study. Physiology & Behavior. 109, 33-41 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados