Method Article
肠脑神经通讯实时分析:响应肠道葡萄糖刺激的皮层宽钙动力学
摘要
由迷走神经促进的肠脑通讯对于胃肠道内分泌系统和大脑之间的通讯至关重要。然而,胃内葡萄糖注射是否可以改变皮质活性仍不清楚。在这里,我们提供了一个全面的方案来观察葡萄糖注射到十二指肠后皮质活动的变化。
摘要
营养吸收后胃肠道和大脑之间的交通在食物偏好、新陈代谢和摄食行为中起着至关重要的作用。特别是关于特定营养素,许多研究已经阐明,肠道上皮细胞内葡萄糖的同化会刺激许多信号分子的激活。胰高血糖素样肽-1 等激素是众所周知的典型信号传导介质。由于激素主要通过循环途径影响大脑,因此它们会缓慢调节大脑活动。
然而,最近的研究表明,自主神经系统促进了两种快速的肠脑通路。一个通过脊髓传入神经通路运作,而迷走神经介导另一个。因此,胃肠道葡萄糖同化后的大脑反应很复杂。此外,由于肠道刺激最终会诱导不同的皮层活动,包括感觉、伤害感受、奖励和运动反应,因此有必要采用有助于局部大脑回路和泛皮层活动可视化的方法,以充分理解肠脑神经传递。一些研究表明,在肠道刺激后,下丘脑和腹侧被盖区内的钙离子 (Ca2+) 浓度会通过不同的途径独立地急剧变化。然而,大脑皮层活动是否有变化尚不清楚。
为了观察胃内葡萄糖注射后的大脑皮层活动,我们开发了一种成像技术,使用表达基因编码的 Ca2+ 指标的转基因小鼠,通过完全完整的颅骨实时可视化皮层宽的 Ca2+ 动力学。本研究提出了一种全面的方案,该技术旨在通过植入导管进行胃内葡萄糖注射后监测肠道刺激诱导的经颅皮层宽 Ca2+ 成像。初步数据表明,将葡萄糖溶液注入肠道会激活额叶皮层,而额叶皮层对饮水仍然没有反应。
引言
首先,肠道对葡萄糖的感应是通过位于肠腔内分泌细胞中的甜味受体(Tas1r2、Tas1r3)和钠-葡萄糖协同转运蛋白 1 (SGLT-1) 发生的 1,2,3,4,5,6。葡萄糖在大脑中的感觉是一个过程,通常在从肠道吸收后持续数分钟到数小时,这一现象主要基于血浆血糖水平升高和激素7、8、9、10、11(例如胰高血糖素样肽-1 [GLP-1]、肽 YY (PYY) 和葡萄糖依赖性促胰岛素多肽 [GIP])的释放。它们到达下丘脑 (ARC) 的弓状核,在那里它们通过血流和迷走神经(副交感神经)结合阿片黑皮质素前体 (POMC) 神经元和刺豚鼠相关蛋白 (AgRP) 神经元12,13,14。这些神经元活动的变化导致新陈代谢和摄食行为的控制15,16。
最近的文献越来越强调葡萄糖吸收后肠脑神经信号传导的重要性。这种复杂的途径大致可分为两种主要机制。第一个涉及脊髓传入神经的激活,最终影响 ARC 中的 AgRP 神经元活动。第二种机制需要通过与上皮细胞的连接刺激迷走神经。鉴于肠道上皮细胞可以激活迷走神经13 的多种方式,它的作用被认为是多方面的。
很大一部分肠道迷走神经和脊髓传入神经活动与摄食行为有关 17,18,19。然而,新出现的证据表明,某些投射到"神经足细胞"的迷走神经纤维与葡萄糖偏好有关。神经足细胞是肠内分泌细胞的一个亚群,在其管腔侧表达 SGLT-1,并通过谷氨酸能突触将感觉刺激传递到迷走神经 2,20,21,22。迷走神经的激活会在几秒钟内触发腹侧被盖区 (VTA) 的多巴胺能神经元19。值得注意的是,使用谷氨酸拮抗剂抑制迷走神经活化,特别是在十二指肠中,可降低小鼠的蔗糖偏好1。这强调了神经足细胞活化在调节葡萄糖摄入后食物选择行为中的关键作用2。
尽管取得了这些进步,但对快速肠道葡萄糖感应机制及其对皮质活动的影响的透彻理解仍然是一个复杂的谜。虽然 AgRP 神经元控制的大脑激活不包括大脑皮层23,但众所周知,VTA 中的多巴胺能神经元投射到大脑皮层。然而,葡萄糖感应后的快速 VTA 多巴胺能神经元激活是否真正激活大脑皮层尚不清楚。为了阐明这种机制,我们研究了胃内葡萄糖给药快速影响表达基因编码钙指示剂的转基因小鼠皮质 Ca2+ 动力学的潜力。
本文提出了一种低成本且侵入性较小的方法,以全面了解小鼠胃内葡萄糖给药后皮质活动的变化 最近,使用表达基因编码钙指标的转基因小鼠,通过完整颅骨的经颅皮层宽 Ca2+ 成像技术越来越受欢迎24.值得注意的是,本研究中使用的 BAC GLT-1-G-CaMP7 #817 转基因小鼠系(也称为 G7NG817 小鼠)在神经元和星形胶质细胞中表达 Ca2+ 传感器 G-CaMP725。由于其在大脑皮层中的高表达密度,该转基因小鼠系特别适用于使用标准落射荧光显微镜进行经颅皮层宽 Ca2+ 成像。
研究方案
所有实验方案均已获得日本御茶水女子大学机构动物护理和使用委员会的批准(动物研究方案 22017)。所有动物实验均根据御茶水女子大学的动物实验指南进行,该指南符合学术研究机构正确进行动物实验和相关活动的基本指南(日本教育、文化、体育、科学和技术部)。已努力尽量减少使用的动物数量。这项研究是按照 ARRIVE 指南进行的。
1. 转基因小鼠的制备
- 为了遵循此实验,使用成年雄性和雌性 BAC GLT-1-G-CaMP7 #817 转基因小鼠系,即 G7NG817小鼠24,25(大于 8 周)。G7NG817小鼠25 的背景菌株为 C57BL/6J。
- 将小鼠置于 12 小时/12 小时的光照/黑暗循环下,并将它们分组饲养,最多五只小鼠。
2. 导管创建
- 用剪刀将硅管(内径 0.5 mm,外径 1.0 mm)调整到 7 cm 的精确长度(图 1A-a)。
注意:在手术之前,剪刀和硅胶管已消毒。 - 将小塑料珠(内径 3 mm,外径 5 mm)粘附到定制的管上,确保它们位于距离其末端 3 mm 的位置(图 1A-b)。使用氰基丙烯酸酯胶牢固地固定珠子(可接受医用或标准变体)。
- 切除 23 G 针的尖端,然后从针尖切下 1.5 厘米(图 1A-c)。
- 将步骤 2.3 中切片的 23 G 针头引入硅管的末端,与珠子的固定位置相反(图 1A-d)。
3. 喷油器创建
- 使用无菌钳子从针尖切开 1 厘米(图 1B-a)。
注意:确保切断端的孔口保持其完整性并且不会变形,因为任何变形都可能阻碍注射液的流动。 - 将步骤 3.1.1 中合适的 23 G 注射针耦合到 2.5 mL 注射器中(图 1B-b)。
- 将硅管分割成所需长度(本实验中为 15 cm 硅管)并将其护套在 23 G 注射针上(图 1B-c)。
注:分配的溶液体积将根据管路的长度而波动。例如,对于 15 cm 试管,实验后大约 50 μL 溶液会残留。 - 在距离针尖 1.5 cm 处切断 23 G 注射针。
- 将步骤 3.4 中的切片部分与步骤 3.3 中成型的硅导管连接起来(图 1B-d)。
注意:确保在步骤 3.1 和 3.4 中创建的孔口在切口后保持不变形。如果需要整改,请使用钳子恢复其圆形配置。
4. 胃定位
- 通过在指定腔室中吸入 3.0% 异氟醚对小鼠进行麻醉。涂抹眼药膏以防止眼睛干涩。
- 在验证小鼠的麻醉状态后,将麻醉的小鼠从吸入室小心地转移到手术台上。在整个手术过程中提供热支持。
- 将小鼠仰卧,使其嘴靠近吸入装置,并将异氟醚浓度从 3.0% 调节至 2.0%。
注意: 将异氟醚面罩的下段与其上段分离,并使用胶带将分离的面罩(上段)固定在手术台上。 - 使用胶带将小鼠的口腔、前肢和后肢补充到手术台上。
注意:通过将鼠标固定在桌子上,即使鼠标被麻醉,也可以防止因移动而导致的手术错误。 - 使用脱毛霜从左上腹部(手术部位周围区域的 150%)去除小鼠的毛发。在手术部位局部涂抹局部镇痛药,等待 5 分钟后再进行。
- 将局部麻醉凝胶涂抹在腹部皮肤上,等待 5 到 10 分钟。然后,用交替轮换的碘伏和 70% 乙醇对手术区域消毒 3 次。通过脚趾捏确认麻醉深度,并用无菌手术布覆盖动物。做一个大约 1.5 厘米长的皮肤切口(图 1C-b),位于腹部正中右侧 1 厘米处,剑突下方 5 毫米处(图 1C-c)。然后,在腹壁上与初始皮肤切口相同的位置创建一个 1.5 厘米的切口。
注意: 请谨慎行事,以免对底层肝脏造成伤害。 - 使用钝头镊子小心翼翼地横向重新定位左肝叶,露出下面的胃。
5. 导管插入
- 抬高腹部并小心地通过切口将其拔出。
注意:请格外小心地保持邻近器官的完整性,尤其是肝脏,并避免对胃施加过度的力。 - 用剪刀在幽门窦上创建一个小的穿孔(直径约 1.5 毫米)。
- 将导管的末端引入穿孔,确保珠子与幽门窦直接接触。
注意:插入前用 0.1 至 0.5% 葡萄糖酸洗必泰溶液对导管进行消毒。 - 使用医用级氰基丙烯酸酯胶将导管的珠子粘附在胃上。
注意:确保胃不附着在周围器官上。 - 验证导管是否牢固地连接到胃上,然后小心地将胃重新定位到左肝叶下方的先天位置。
- 使用聚二恶烷酮 (PDS) 缝合腹壁,使导管向外延伸。之后,以类似于腹部闭合的方式闭合皮肤切口。
- 轻轻地将鼠标放在经过消毒的笼子中。
注意:术后小鼠应单独饲养。在伤口闭合处局部涂抹局部镇痛药,并遵循当地机构指南推荐的镇痛计划。 - 在标准环境中允许至少 48 小时的恢复期。
注意:插入小鼠胃中的导管的一端用带有密封尖端的 23G 针头闭合,以防止异物进入并避免咬合。由于从腹部伸出的导管很短,它可以防止老鼠将其拖过床上用品,这可能会导致它打开或缠结。
6 . 体内经 颅 Ca2+ 成像的准备
- 使用异氟醚对小鼠进行麻醉(诱导为 2%;维持在 0.8% 和 1.0% 之间)。
- 使用辅助耳杆将鼠标固定在立体定位平台上,以减轻脉动和呼吸的影响。随后,将鼠标置于荧光立体显微镜下。
- 将宽带蓝色荧光滤光片组(激发波长为 460-490 nm,发射波长为 520 nm)与汞光源结合使用。
- 使用相机捕获图像,并使用指定的成像软件对其进行处理。
- 使用电动剃须刀或脱毛霜小心去除头皮上的毛发。
注意: 如果使用剃须刀,请确保对其进行彻底消毒,并注意不要割伤皮肤。 - 使用棉签或类似工具蘸稀释至 0.1-0.5% 的葡萄糖酸氯己定溶液对头皮表面进行消毒。接下来,用酒精消毒并交替重复 3 次。
- 涂抹局部麻醉凝胶并等待 5-10 分钟。
- 准备涂抹牙科丙烯酸水泥。
- 使用无菌手术刀刀片切割头皮。要么完全去除头皮,要么从后脑勺到前额做一个笔直的切口。
- 使用夹子通过延长任何多余的皮肤来露出头骨。
- 使用棉签去除骨膜的结缔组织。
- 去除骨膜后立即涂抹丙烯酸水泥。迅速采取行动,防止颅骨表面因暴露骨骼蒸发而变得不透明。
- 等待约 5 分钟,让水泥干燥。
7. 经颅 Ca2+ 成像与十二指肠内葡萄糖给药
- 将实验溶液和盐水平衡至环境温度。对小鼠进行指定持续时间(例如,2 小时)的饮食限制。
- 在开始注射之前,使用 ~0.03 mL 生理盐水清除小鼠侧导管内的任何残留内容物。
- 将实验溶液(例如,在 300 μL 水中制备的 10% 葡萄糖溶液,再加入 300 μL 水)吸入注射器中,然后将其连接到导管。确定针对特定实验目标量身定制的溶液的最佳剂量。
注意:在此阶段,请小心防止导管过度劳损,这可能会危及小鼠的内部解剖结构。尽量轻柔地作鼠标侧的管道。此外,确保注射器在溶液吸入后没有空气,因为滞留的空气和气泡可能会引起胃肠道膨胀。 - 通过单击软件应用程序的 录制过程 按钮,评估鼠标的生理状态并激活成像软件的录制功能。
- 以 512 x 512 像素的分辨率、16 位深度和 10 Hz 的帧速率捕获图像。
注:可以调整记录参数以符合特定的实验要求。 - 获取自发数据(例如,跨越 50 秒),然后以适合实验的速率(此处为 0.035 mL/s)逐渐注入实验溶液。
注意:在实验结束时,将在异氟醚麻醉下通过宫颈脱位立即对小鼠实施安乐死。
8. 图像数据处理和分析
- 将图像数据分箱为 64 x 64 像素。
- 使用 ImageJ 确定手绘感兴趣区域 (ROI)。参考小鼠脑图谱,将 ROI 指定为额叶区域 (M2)、体感区域,包括桶 (Somato)、枕部区域 (Visual) 和脾后区域 (RSC)。
- 使用 MATLAB 函数 ReadImageJROI 提取与 ROI 对应的坐标。通过提供的链接访问 MATLAB 函数:https://jp.mathworks.com/matlabcentral/fileexchange/32479-readimagejroi
- 使用 MATLAB 计算 ROI 内荧光强度变化的平均速率。
- 用公式 (1) 定义荧光强度变化率 (ΔF/F):
 (1)
(1)
其中 Ft 表示特定时间的荧光强度值,从记录开始到注射 50 秒的平均强度值表示为 F0。
- 用公式 (1) 定义荧光强度变化率 (ΔF/F):
- 考虑注射液到达器官的延迟。使用注射后 3 秒的平均强度值作为基线。如果目标波形在注射后 3 秒或更晚出现,则超过基线强度值 + 1 SD 进行分析。
结果
使用异氟醚麻醉的 G7NG817 小鼠进行经颅皮层宽 Ca2+ 成像
我们按照 图 1 所示的程序创建了导管。在仔细确定胃的位置后,我们将导管连接到该位置(图 1)。在导管插入后留出足够的恢复时间(约 48 小时)后,我们在轻度异氟醚麻醉 (0.8-1.0%) 下测量自发性神经活动,以确定后续肠道刺激观察的基线荧光强度变化。结果,我们确认了跨越整个皮层的随机 Ca2+ 振荡模式(图 2A)。 图 2 提供了预先插入导管的自发性大脑活动的代表性示例。我们将注射后 M2 区域中第一个可观察到的 Ca2 + 瞬时峰的时间定义为 0.0 s。伪彩色表示将此 Ca2+ 瞬变的峰值显示为最大值,平均值加一个标准差 (1 SD) 作为最小值。很明显,左半球和右半球在所有区域都显示出同步活动。
接下来,我们建立了 ROI 来描述每个功能领域的波动。如图 2B 所示,我们展示了 每个 ROI 的荧光强度率的时间变化 (图 2B)。这些观察到的表面 Ca2+ 振荡遵循突发抑制模式,在低活性和高振幅荧光变化之间交替。这种活动模式与之前同时测量皮质表面 EEG 和 Ca2+ 动力学26 的发现一致。
尽管抑制和爆发状态之间存在整体或区域表面 Ca2+ 波动,但引发钙激增的特定皮质区域可能不同。如前所述,当信号刺激局部皮层区域时,预计该区域会激活,随后驱动皮层状态的整体转变27,28。
胃内葡萄糖注射后皮层 Ca2+ 动力学的变化
接下来,为了阐明葡萄糖或水给药如何影响皮质活动,我们在注射期间和之后监测了皮层宽的 Ca2+ 动力学。结果,我们发现胃内葡萄糖注射后皮质 Ca2+ 动力学发生了变化。与皮质激活的不同区域所示的自发活动相反,我们观察到通过导管直接肠道注射葡萄糖后前额叶区或次级运动皮层 (M2) 的立即激活,这种效果不是由胃内注射引起的(图 3A-C)。此外,我们观察到这些短暂的、突出的 Ca2+ 事件往往在胃内葡萄糖注射后约 10 s 内连续发生。当加水时,这种持续的现象并不明显(图 3D-F)。
以听觉皮层 (参考) 为参考,通过计算荧光强度变化比的比率来表征每个 ROI 中的 Ca2+ 事件,在葡萄糖给药完成后 4-8 秒内出现第一个峰值。结果,使用听觉皮层作为注射前后的参考比较 M2 区的反应后,在注射葡萄糖时观察到显着变化。
相比之下,注射水时没有观察到这种变化(图 3G,水 N = 7:注射前与注射,2.38 ± 2.53 vs. 2.05 ± 1.84,p > 0.05;葡萄糖 N = 7:注射前,2.48 ± 0.97 vs. 3.76 ± 2.76,p < 0.01,Wilcoxon 符号秩检验)。接下来,通过注射后与注射前的值之比来定义每个皮质区域的激活水平,仅在 M2 区域观察到显着差异(图 3H,M2:0.92 ± 0.89 vs. 1.30 ± 0.32,p = 0.006;Somato:0.95 ± 0.076 vs. 1.04 ± 0.13,p = 0.27;视觉:0.92 ± 0.3 对比 1.00 ± 0.06,p = 0.89;RSC:0.97 ± 0.27 vs. 1.10 ± 0.27,p = 0.60,t 检验)。
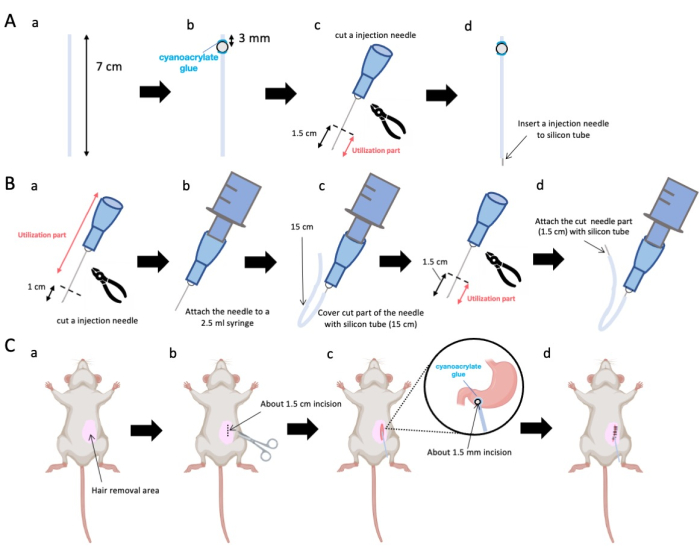
图 1:方法概述。 (A) 导管创建:(a) 切割硅管。(b) 使用医用氰基丙烯酸酯胶将塑料珠粘在硅管上。(c) 将 23 G 针头从尖端剪下 1.5 厘米。(d) 将针头的切割端连接到硅胶管上。(B) 进样器组件:(a) 将 23 G 注射针修剪 1 cm。(b) 将修剪后的注射针连接到 2.5 mL 注射器。(c) 用硅胶管包裹注射针的切割部分。(d) 将 23 G 针头从尖端剪下 1.5 cm。(e) 将针头的切割端连接到硅胶管上。(C) 外科手术: (a) 对手术区域进行脱毛。(b) 将皮肤和腹壁切开约 1.5 厘米长。(c) 用剪刀在幽门窦上打一个小孔(直径约 1.5 毫米),然后插入导管(硅管)。使用医用氰基丙烯酸酯胶将导管固定到幽门胃窦。(d) 使用 5/0 丝缝合材料和针缝合腹壁和皮肤。 请单击此处查看此图的较大版本。
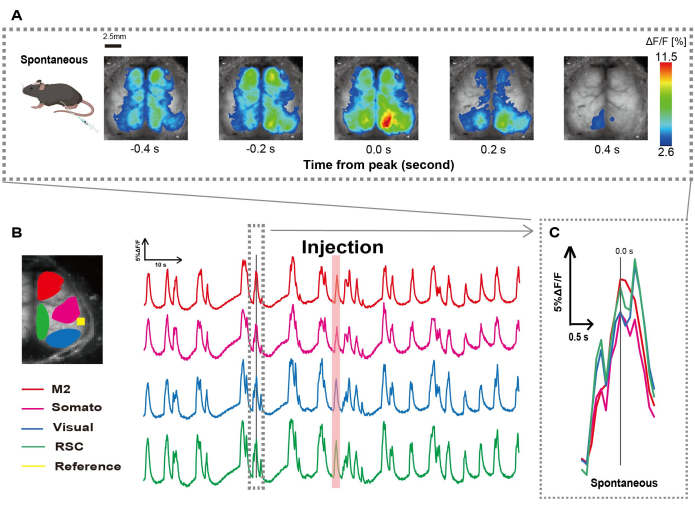
图 2:连接导管的 G7NG817 小鼠的自发皮层宽 Ca2+ 振荡。 (A) 以 0.2 s 间隔显示的皮层宽 Ca2+ 振荡的代表性示例。荧光强度的变化用伪色叠加表示。 B 中虚线包围的时间窗口显示了第一个出现的 Ca2+ 瞬变,其峰值设置为时间 0。伪彩色表示使用 Ca2+ 瞬变的峰值作为最大值,使用平均值 +1 SD 作为最小值。(B) 示例中每个 ROI 的荧光强度的时间序列变化。线条颜色对应于不同的皮质区域:红色代表 M2;洋红色代表体感区 (Somato);蓝色表示可视区域 (Visual);绿色代表复古脾区域。鲑鱼色条带显示注射时间。(C) 虚线轮廓内的单个峰被分离出来并以放大视图显示。缩写: SD = 标准差;ROI = 感兴趣区域;RSC = 脾后区。 请单击此处查看此图的较大版本。
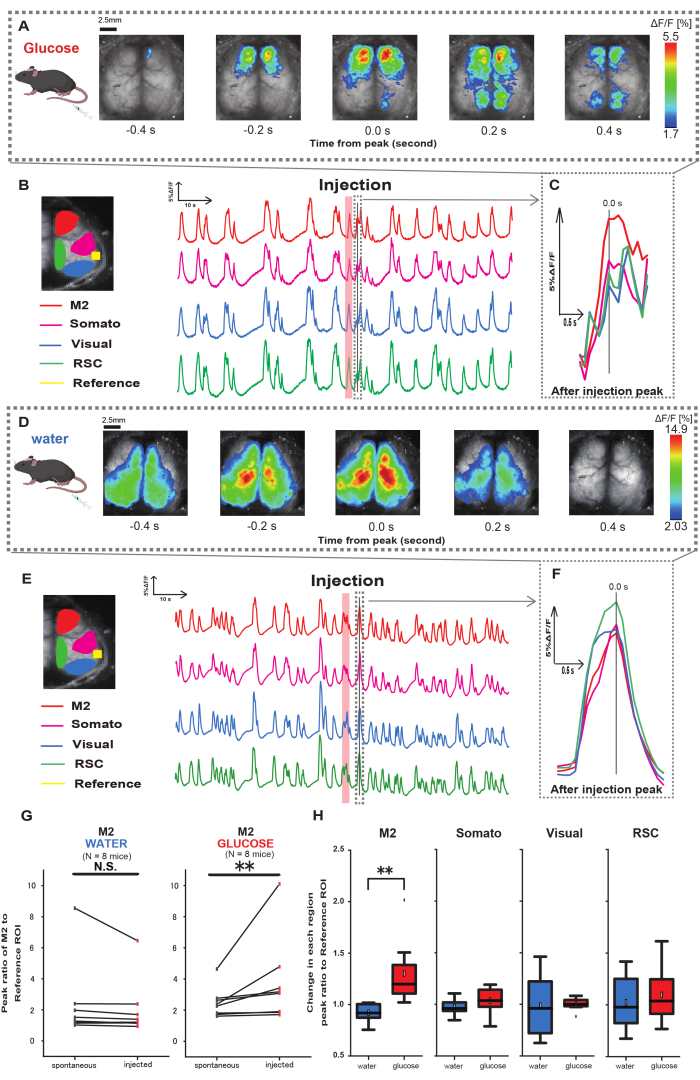
图 3:葡萄糖或水注射期间/之后的皮层宽 Ca2+ 反应。 (A) 以 0.2 秒的间隔显示葡萄糖给药的代表性示例。荧光强度的变化用伪色叠加表示。 B 中虚线环绕的时间窗口显示了进样后第一个出现的 Ca2+ 瞬变,其峰值设置为时间 0。伪彩色表示基于进样后第一个 Ca2+ 瞬变的峰值作为最大值,平均值 +1 SD 作为最小值。(B) 示例中每个 ROI 的荧光强度的时间序列变化。线条颜色对应于不同的皮质区域:红色代表 M2,洋红色代表体感区 (Somato),蓝色代表视觉区域 (Visual),绿色代表脾后区。(C) 虚线轮廓内的单个峰被分离出来并以放大视图显示。分析目标钙波是注射后 4-8 s 内出现的最早波。(D) 水注射作为葡萄糖控制数据的代表性示例。(E) 示例中每个 ROI 的荧光强度的时间序列变化。线条颜色与 B 相同。(F) 虚线轮廓内的单个峰被分离出来,并以放大视图显示。分析目标钙波是注射后 4-8 s 内出现的最早波。(G) M2 自发活动(注射前)和注射后反应(注射)的比较。注射前 50 s 的平均荧光强度变化,并使用听觉皮层作为参考计算注射后 4 s 至 8 s 之间 M2 区域的峰值响应。(H) 水或葡萄糖给药时每个皮质区域的激活水平比较。计算每个区域的注射后与注射前值的比率,以 G 为单位。N.S. 表示不显著 (p > 0.05)。** <0.01.误差线定义为平均值的标准误差。缩写: SD = 标准差;ROI = 感兴趣区域;RSC = 脾后区。 请单击此处查看此图的较大版本。
讨论
本文介绍了如何将导管连接到肠道,并使用表达基因编码的 Ca2+ 指标的转基因小鼠观察经颅皮层宽 Ca2+ 信号。在这个实验中,我们没有得到使用光源的次波长的成像数据。这是因为由于所采用的 Ca2+ 指示蛋白 (G-CaMP7) 的特性,我们在本研究中使用的转基因小鼠在响应感觉刺激时表现出非常高的荧光强度变化率(~几十%)。因此,我们认为血流动力学的污染可以忽略不计。此外,我们关注的神经反应在几秒钟内迅速发生,因此我们认为没有必要考虑随后产生的局部功能性充血。这种导管植入方法能够与其他转基因小鼠相结合,以观察其他大脑区域和不同时间尺度上的神经元活动。但是,如果使用其他转基因小鼠,则应进行上述对照实验。
这种将导管连接到肠道的方法适用于低成本的单剂量注射,并且比早先提出的方法简单且侵入性更小29。传统上,将吸收棉涂抹在消化器官上并缝合。然而,缝合会损害小鼠的术后恢复。因此,我们采用了 atta 的方法。我们选择塑料珠的原因是,我们使用的氰基丙烯酸酯胶水可以更好地粘附在硅胶上。
传统上假设大脑根据血浆血糖水平的升高和伴随的激素释放来感知葡萄糖。因此,大脑在葡萄糖从肠道吸收后需要几分钟到几小时才能检测到葡萄糖4。一些研究表明,除了口腔甜味接收外,肠道感应还控制小鼠的味觉偏好 1,3,17,22。作为一个说明性的例子,研究人员提供了证据表明,胃内 (IG) 葡萄糖配对的调味非营养性溶液和 IG 不可代谢的 α-甲基-d-吡喃葡萄糖苷 (MDG) 配对的调味非营养性溶液可以引起对每种调味非营养溶液的偏好与 IG 水配对组相比。由于腹膜内葡萄糖注射不会刺激非营养性溶液的摄入30,因此预计肠道营养感应将在小鼠的食物选择中发挥至关重要的作用 1,19,22。
最近的一项研究揭示了肠道中存在一种电兴奋细胞,称为"神经足细胞",它利用分子受体通过谷氨酸能突触检测并将感觉刺激转导到迷走神经上。虽然以前的研究主要集中在 GLP-1 在控制小鼠食物进食中的作用,但最近的研究表明,神经足细胞的迷走神经激活会调节小鼠的食欲。迷走神经随后激活 Solitarius 核,导致随后激活多巴胺能神经元19。然而,目前尚不清楚多巴胺能神经元激活是否也会激活皮层。为了对胃内葡萄糖输注后的脑反应进行分类,我们改进了导管连接技术以进行成像。使用这项技术时,必须谨慎行事以防止器官损伤,尤其是肝脏,在确定胃位置所需的作过程中,肝脏容易受到损伤。
我们的研究结果表明,胃内葡萄糖注射可在几秒钟内激活前额叶皮层。然而,胃内葡萄糖给药同时启动多个信号通路,例如激素途径、迷走神经和脊髓传入神经。这些信号在不同的时间尺度上在脑干中进行处理。因此,未来的研究应该探索这些复杂的信号如何在大脑中被处理和整合。
此外,我们在本研究中使用的 BAC GLT-1-G-CaMP7 转基因小鼠系在神经元和星形胶质细胞中表达 Ca2+ 传感器 G-CaMP7。原则上,经颅皮层宽 Ca2+ 成像获得的前额叶 Ca2+ 升高来自神经元和/或星形胶质细胞。然而,由于如果涉及多巴胺信号传导,星形胶质细胞会表达多巴胺受体,因此表明星形胶质细胞 IP3/Ca2+ 信号传导可能激活。由于星形胶质细胞 IP3/Ca2 + 信号传导调节突触可塑性,因此它也可能在葡萄糖接收后蔗糖偏好的变化和摄食行为的改变中发挥重要作用。因此,在未来的研究中,需要使用双光子显微镜以细胞分辨率成像,以确定在葡萄糖给药后在前额叶皮层观察到的反应是否来自神经元或星形胶质细胞。另一种有效的方法包括通过纤维光度法使用腺相关病毒 (AAV) 观察小鼠细胞特异性 Ca2+ 指示剂的表达。此外,有必要使用电生理技术验证葡萄糖对肠道的刺激是否真正刺激了迷走神经。如果神经足细胞通过接收葡萄糖将信号传递到迷走神经,我们预计当施用 SGLT-1 抑制剂时迷走神经不会有任何反应。最后,有必要使用各种多巴胺受体拮抗剂进行验证,以确认迷走神经投射到单束核 (NTS) 是否激活了多巴胺能神经元,增加了前额叶皮层 Ca2+ 信号。总体而言,该系统能够全面研究从肠道到大脑的快速神经传递效应。它提出了一种非常有前途的方法,可能会阐明机制,例如压力如何改变蔗糖对肠脑相互作用的偏好。
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作得到了御茶水女子大学、KAKENHI 赠款 (18K14859、20K15895)、JST FOREST 计划、赠款号 JPMJFR204G、光科学与技术研究基金会、花王医疗保健科学研究委员会、日本化学创新协会和 TERUMO 生命科学基金会的支持。作者感谢 Takashi Tsuboi 博士、Kazuki Harada 和 Akiyo Natsubori 对实验的监督。作者还感谢实验室成员的支持。
材料
| Name | Company | Catalog Number | Comments |
| 2.5 mL TERUMO syringe | TERUMO | ss-02Sz | |
| 23 G injection needle | TERUMO | 4987350390691 | |
| Anesthetic (ISOFLURANE Inhalation Solution) | viatris | 871119 | |
| cotton swab | local company | ||
| Cyanoacrylate glue (AronArufa A) | TOAGOSEI | 7990700Q1022 | |
| dental acrylic cement C&B | Sun Medical | 221AABZX00115000 | |
| Depilatory cream | Kracie | local company | |
| Digital CMOS camera | Hamamatsu Photonics | ORCA-Spark | |
| Ear bar | NARISHIGE | EB-5N | |
| Filter set (U-MWB2) | Evident | U-MWB2 | |
| Fine Scissors | Fine Dcience Tools | 14040-10 | |
| G7NG817 mice | RIKEN BRC | RBRC09650 | |
| Image software | Hamamatsu Photonics | HC Image software | |
| Isoflurane vapolizer | shinanoseisakusyo | SN-487-0T | |
| Light source (U-HGLGPS) | Evident | U-HGLGPS | |
| microscopy (MVX10) | Evident | ||
| Plastic beads (inner diameter 3 mm, outer diameter 5 mm) | local company | ||
| Pliers | local company | ||
| Polydioxanone suture, monodiox | Alfresa Pharma | HR1305MV45-KF2R | This absorbable, monofilament PDS suture is employed for closing the surgical incision |
| Round ended forceps | F.S.T. | 11617-12 | |
| saline | Otsuka Pharmaceutical Factory | 35061311 | |
| Silicon tube (inner diameter 0.5 mm, outer diameter 1.0 mm) | AS ONE CORPORATIO | 33151413 | local company |
| small surgery needle | Natsume Seisakusho Co., Ltd. | AC03DNT | |
| Stereotaxic stage | NARISHIGE | MA-6N | |
| Xylocaine Jelly 2% | Sandoz K.K. | 614429303 | This jelly is used as a local analgesic to alleviate surgical pain |
参考文献
- Buchanan, K. L., et al. The preference for sugar over sweetener depends on a gut sensor cell. Nature Neuroscience. 25 (2), 191-200 (2022).
- Reimann, F. Molecular mechanisms underlying nutrient detection by incretin-secreting cells. International Dairy Journal. 20 (4), 236-242 (2010).
- Kreuch, D., et al. Gut mechanisms linking intestinal sweet sensing to glycemic control. Frontiers in Endocrinology. 9, 741 (2018).
- Gorboulev, V., et al. Na(+)-D-glucose cotransporter SGLT1 is pivotal for intestinal glucose absorption and glucose-dependent incretin secretion. Diabetes. 61 (1), 187-196 (2012).
- Harada, N., Inagaki, N. Role of sodium-glucose transporters in glucose uptake of the intestine and kidney. Journal of Diabetes Investigation. 3 (4), 352-353 (2012).
- Kaelberer, M. M., Rupprecht, L. E., Liu, W. W., Weng, P., Bohórquez, D. V. Neuropod cells: The emerging biology of gut-brain sensory transduction. Annual Review of Neuroscience. 43, 337-353 (2020).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Larsen, P. J., Tang-Christensen, M., Jessop, D. S. Central administration of glucagon-like peptide-1 activates hypothalamic neuroendocrine neurons in the rat. Endocrinology. 138 (10), 4445-4455 (1997).
- Alhadeff, A. L., Rupprecht, L. E., Hayes, M. R. GLP-1 neurons in the nucleus of the solitary tract project directly to the ventral tegmental area and nucleus accumbens to control for food intake. Endocrinology. 153 (2), 647-658 (2012).
- Raybould, H. E. Gut chemosensing: interactions between gut endocrine cells and visceral afferents. Autonomic Neuroscience: Basic & Clinical. 153 (1-2), 41-46 (2010).
- Routh, V. H. Glucose-sensing neurons: are they physiologically relevant. Physiology & Behavior. 76 (3), 403-413 (2002).
- Secher, A., et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. The Journal of Clinical Investigation. 124 (10), 4473-4488 (2014).
- Williams, E. K., et al. Sensory neurons that detect stretch and nutrients in the digestive system. Cell. 166 (1), 209-221 (2016).
- Borgmann, D., et al. Gut-brain communication by distinct sensory neurons differently controls feeding and glucose metabolism. Cell Metabolism. 33 (7), 1466-1482.e7 (2021).
- Krashes, M. J., et al. Rapid, reversible activation of AgRP neurons drives feeding behavior in mice. The Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- Aponte, Y., Atasoy, D., Sternson, S. M. AGRP neurons are sufficient to orchestrate feeding behavior rapidly and without training. Nature Neuroscience. 14 (3), 351-355 (2011).
- Zhang, L., Han, W., Lin, C., Li, F., de Araujo, I. E. Sugar metabolism regulates flavor preferences and portal glucose sensing. Frontiers in Integrative Neuroscience. 12, 57 (2018).
- Goldstein, ., et al. Hypothalamic detection of macronutrients via multiple gut-brain pathways. Cell Metabolism. 33 (3), 676-687.e5 (2021).
- Fernandes, A. B., et al. Postingestive modulation of food seeking depends on vagus-mediated dopamine neuron activity. Neuron. 106 (5), 778-788.e6 (2020).
- Kaelberer, M. M., et al. . A gut-brain neural circuit for nutrient sensory transduction. 361 (6408), eaat5236 (2018).
- Bohórquez, D. V., et al. Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. The Journal of Clinical Investigation. 125 (2), 782-786 (2015).
- Tan, H. -. E., et al. The gut-brain axis mediates sugar preference. Nature. 580 (7804), 511-516 (2020).
- Wang, D., et al. Whole-brain mapping of the direct inputs and axonal projections of POMC and AgRP neurons. Frontiers in Neuroanatomy. 9, 40 (2015).
- Yamada, S., Wang, Y., Monai, H. Transcranial cortex-wide Ca2+ imaging for the functional mapping of cortical dynamics. Frontiers in Neuroscience. 17, 1119793 (2023).
- Monai, H., et al. Calcium imaging reveals glial involvement in transcranial direct current stimulation-induced plasticity in mouse brain. Nature Communications. 7 (1), 11100 (2016).
- Ferron, J. -. F., Kroeger, D., Chever, O., Amzica, F. Cortical Inhibition during Burst Suppression Induced with Isoflurane Anesthesia. The Journal of Neuroscience. 29 (31), 9850-9860 (2009).
- Ming, Q., et al. Isoflurane-induced burst suppression is a thalamus-modulated, focal-Onset rhythm with persistent local asynchrony and variable propagation patterns in rats. Frontiers in Systems Neuroscience. 14, 599781 (2021).
- Schwalm, M., et al. Functional states shape the spatiotemporal representation of local and cortex-wide neural activity in mouse sensory cortex. Journal of Neurophysiology. 128 (4), 763-777 (2022).
- Ueno, A., et al. Mouse intragastric infusion (iG) model. Nature Protocols. 7 (4), 771-781 (2012).
- Zukerman, S., Ackroff, K., Sclafani, A. Post-oral glucose stimulation of intake and conditioned flavor preference in C57BL/6J mice: A concentration-response study. Physiology & Behavior. 109, 33-41 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。