Method Article
腸-脳神経コミュニケーションのリアルタイム解析:腸管グルコース刺激に応答した皮質ワイドカルシウムダイナミクス
要約
迷走神経によって促進される腸と脳のコミュニケーションは、胃腸内分泌系と脳との間のコミュニケーションに不可欠です。しかし、胃内グルコース注射が皮質活動を変えることができるかどうかはまだわかっていません。ここでは、十二指腸へのグルコース注射後の皮質活動の変化を観察するための包括的なプロトコルを提供します。
要約
栄養吸収後の胃腸管と脳との間のコミュニケーションは、食物の好み、代謝、摂食行動に重要な役割を果たします。特に特定の栄養素に関しては、腸上皮細胞内でのグルコースの同化が多くのシグナル伝達分子の活性化を促すことが多くの研究で解明されています。グルカゴン様ペプチド-1などのホルモンは、典型的なシグナル伝達メディエーターとして有名です。ホルモンは主に循環経路を通じて脳に影響を与えるため、脳の活動をゆっくりと調節します。
しかし、最近の研究では、自律神経系によって促進される2つの迅速な腸-脳経路が示されています。一方は脊髄求心性神経経路を介して動作し、迷走神経は他方を媒介します。その結果、胃腸管でのグルコース同化後の脳の反応は複雑です。また、腸内刺激によって、感覚反応、侵害受容反応、報酬反応、運動反応など、さまざまな皮質活動が最終的に誘導されるため、脳内神経伝達を完全に理解するためには、脳の局所回路や汎皮質活動の可視化を促進する方法論を採用する必要があります。いくつかの研究では、視床下部および腹側被蓋領域内のカルシウムイオン(Ca2+)濃度の急激な変化が、腸刺激後のさまざまな経路を通じて独立して変化することが示されています。しかし、大脳皮質の活動に変化があるかどうかはわかっていません。
胃内グルコース注入後の大脳皮質活動を観察するために、遺伝的にコードされたCa2+指標を発現するトランスジェニックマウスを用いて、完全に無傷の頭蓋骨を通して皮質全体のCa2+ダイナミクスをリアルタイムに可視化するイメージング技術を開発しました。この研究は、腸刺激誘発性経頭蓋皮質ワイド Ca2+ イメージングを監視するために設計された技術の包括的なプロトコルを提示します 移植されたカテーテルを介した胃内グルコース注射後。予備データは、グルコース溶液を腸に投与すると、前頭皮質が活性化され、前頭皮質は水の投与に反応しないままであることを示唆しています。
概要
主に、グルコースの腸内感知は、腸管腔1,2,3,4,5,6内の腸内分泌細胞にある甘味受容体(Tas1r2、Tas1r3)およびナトリウム-グルコース共輸送体1(SGLT-1)を介して行われます。脳内のグルコースの感覚は、典型的には腸からの吸収後数分から数時間に及ぶプロセスであり、主に血漿血糖値の上昇とホルモン7,8,9,10,11(例えば、グルカゴン様ペプチド-1[GLP-1]、ペプチドYY(PYY)、およびグルコース依存性インスリン分泌促進ポリペプチド[GIP])の放出に基づく。視床下部の弓状核(ARC)に到達し、そこで血流と迷走神経(副交感神経)によってプロオピオメラノコルチン(POMC)ニューロンとアグーチ関連タンパク質(AgRP)ニューロンに結合する12,13,14。これらのニューロンの活動の変化は、代謝と摂食行動の制御につながる15,16。
最近の文献では、グルコース吸収後の腸脳神経シグナル伝達の重要性がますます強調されています。この複雑な経路は、大きく分けて2つの主要なメカニズムに分類できます。1つ目は、脊髄求心性神経の活性化であり、最終的にはARCのAgRPニューロン活動に影響を与えます。2番目のメカニズムは、上皮細胞との接続による迷走神経の刺激を伴います。腸上皮細胞が迷走神経を活性化できる多面的な方法13を考えると、その役割は用途が広いと考えられています。
腸迷走神経と脊髄求心性神経活動のかなりの割合が摂食行動に関連しています17,18,19。しかし、新たな証拠は、「神経ポッド細胞」に突き出た特定の迷走神経線維がグルコース選好に関与していることを示唆しています。腸内分泌細胞のサブセットである神経ポッド細胞は、その管腔側でSGLT-1を発現し、グルタミン酸作動性シナプス2,20,21,22を介して迷走神経に感覚刺激を伝達します。迷走神経の活性化は、数秒以内に腹側被蓋野(VTA)のドーパミン作動性ニューロンをトリガーします19。特に、グルタミン酸拮抗薬を使用して迷走神経の活性化を阻害すると、特に十二指腸では、マウスのスクロース選好が低下する1。このことは、グルコース摂取後の食物選択行動を調節する神経ポッド細胞の活性化が重要な役割を果たしていることを強調しています2。
これらの進歩にもかかわらず、腸の急速なグルコースセンシングメカニズムとそれらが皮質活動に及ぼす影響についての徹底的な理解は、複雑な謎のままです。AgRPニューロンによって制御される脳の活性化には大脳皮質23は含まれていないが、VTAのドーパミン作動性ニューロンが大脳皮質に投射していることが知られている。しかし、グルコース感知後のVTAドーパミン作動性ニューロンの急速な活性化が本当に大脳皮質を活性化するかどうかは不明です。このメカニズムを解明するために、遺伝的にコードされたカルシウム指標を発現するトランスジェニックマウスにおいて、胃内グルコース投与が皮質Ca2+ ダイナミクスに急速に影響を与える可能性を調査しました。
この論文は、マウスの皮質ワイドCa2+ イメージングを使用して、胃内グルコース投与後の皮質活動の変化を包括的に理解するための低コストで低侵襲の方法を提示します。最近、遺伝的にコードされたカルシウム指標を発現するトランスジェニックマウスを使用して、無傷の頭蓋骨を介した経頭蓋皮質ワイドCa2+ イメージング技術が人気を博しています24.特に、本研究で用いたBAC GLT-1-G-CaMP7 #817トランスジェニックマウス系統(別名G7NG817マウス)は、Ca2+ センサーであるG-CaMP7をニューロンおよびアストロサイトに発現しています25。大脳皮質での発現密度が高いため、このトランスジェニックマウス系統は、標準的な落射蛍光顕微鏡を使用した経頭蓋皮質ワイドCa2+ イメージングに特に適しています。
プロトコル
すべての実験プロトコルは、日本のお茶の水大学の施設動物管理および使用委員会によって承認されました(動物研究プロトコル22017)。すべての動物実験は、「学術研究機関における動物実験等適正な実施に関する基本ガイドライン」(文部科学省)に準拠したお茶の水女子大学の動物実験ガイドラインに従って実施されました。使用する動物の数を最小限に抑えるための努力が払われました。この研究は、ARRIVEガイドラインに準拠して実施されました。
1. トランスジェニックマウスの作製
- この実験を行うには、成体の雄と雌のBAC GLT-1-G-CaMP7 #817トランスジェニックマウス系統、すなわち24.25匹(8週齢)のマウスG7NG817使用します。G7NG817マウス25の背景系統はC57BL/6Jである。
- マウスを12時間/12時間の明暗サイクルで飼育し、最大5匹のマウスのグループで育てます。
2. カテーテルの作成
- はさみを使用して、シリコンチューブ(内径0.5 mm、外径1.0 mm)を正確な長さ7 cmに調整します(図1A-a)。
注:手順の前に、はさみとシリコンチューブを滅菌しました。 - 小さなプラスチックビーズ(内径3 mm、外径5 mm)をテーラードチューブに接着し、それらが末端から3 mmの位置にあることを確認します(図1A-b)。シアノアクリレート接着剤を使用してビーズをしっかりと貼り付けます(医療用または標準的なバリエーションでも可)。
- 23 Gの針の頂点を切除し、続いて針先から1.5 cm切り取ります(図1A-c)。
- ステップ2.3で切片化された23Gの針を、ビーズが固定されている場所とは反対側のシリコンチューブの端部に導入します(図1A-d)。
3. インジェクターの作成
- 滅菌ペンチを使用して、針先から1cmを切り取ります(図1B-a)。
注意: 切断された端のオリフィスが完全性を保持し、歪みが注入溶液の流れを妨げる可能性があるため、変形しないことを確認してください。 - ステップ 3.1.1 の適合した 23 G 注射針を 2.5 mL シリンジに結合します (図 1B-b)。
- シリコンチューブを必要な長さ(この実験では15cmのシリコンチューブ)にセグメント化し、23Gの注射針(図1B-c)にかぶせます。
注:分注される溶液の量は、チューブの長さに基づいて変動します。例えば、15 cmのチューブでは、約50 μLの溶液が実験後も残ります。 - 23Gの注射針を針先から1.5cm切断します。
- ステップ3.4で切片化した部分を、ステップ3.3で作製したシリコンカテーテルと接合します(図1B-d)。
注意: 手順3.1および3.4で作成したオリフィスが、切開後に歪まないことを確認してください。修正が必要な場合は、ペンチを使用して円形の構成を復元します。
4. 胃の局在化
- 指定されたチャンバーで3.0%イソフルラン吸入を介してマウスに麻酔を投与します。眼の乾燥を防ぐために眼科用軟膏を塗布します。
- 麻酔をかけたマウスを吸入室から手術台に繊細に移し、マウスの麻酔状態を確認します。手順全体を通して熱サポートを提供します。
- マウス仰臥位を寝かせ、その口を吸入装置に近づけ、イソフルラン濃度を3.0%から2.0%に調節します。
注:イソフルランマスクの下セグメントをその優れた対応物から外し、分離したマスク(上部セグメント)を粘着テープを使用して手術台に固定します。. - マウスの口腔、前肢、後肢を粘着テープを使用して手術台に補います。
注意:マウスをテーブルに固定することにより、マウスが麻酔をかけられていても、動きによる手術ミスを防ぐことができます。 - 脱毛クリームを使用して、マウスの左上腹部(手術部位の周囲の150%)からマウスの毛を取り除きます。手術部位に局所鎮痛剤を局所的に塗布し、5分間待ってから進行します。
- 腹部の皮膚に局所麻酔ジェルを塗布し、5〜10分待ちます。次に、ヨードフォアと70%エタノールを交互に繰り返して手術部位を3回消毒します。つま先をつまんで麻酔の深さを確認し、動物を滅菌外科用ドレープで覆います。腹部中央値の右側1 cm、剣状突起の5 mm下に、長さ約1.5 cmの皮膚切開を行います(図1C-b)。次に、最初の皮膚切開と同じ位置の腹壁に1.5cmの切開を作成します。
注意: 基礎となる肝臓に害を及ぼさないように注意してください。 - 鈍い鉗子を使用して左肝葉を横方向に繊細に再配置し、その下の胃を明らかにします。
5. カテーテル挿入
- 胃を持ち上げ、切開部から慎重に胃を抜く。
注意: 隣接する臓器、特に肝臓の完全性を維持するために細心の注意を払い、胃に過度の力を加えることを控えてください。 - はさみを使用して、幽門前庭に小さな穿孔(直径約1.5mm)を作成します。
- カテーテルの末端を穿孔に挿入し、ビードが幽門前庭に直接接触していることを確認します。
注:カテーテルは、挿入前に0.1〜0.5%グルコン酸クロルヘキシジン溶液で消毒されます。 - カテーテルのビードを、医療グレードのシアノアクリレート接着剤を使用して胃に接着します。
注:胃が周囲の臓器に付着していないことを確認してください。 - カテーテルが胃にしっかりと取り付けられていることを確認してから、胃を左肝葉の下の本来の位置に繊細に再配置します。
- 腹壁を縫合し、ポリジオキサノン(PDS)縫合糸を使用してカテーテルを外部に伸ばします。その後、腹部閉鎖に類似した方法で皮膚切開を閉じます。
- マウスを消毒されたケージにそっと再配置します。
注:術後マウスは単独で飼育する必要があります。創傷閉鎖に局所鎮痛剤を局所的に適用し、地域の施設ガイドラインで推奨されている鎮痛計画に従ってください。 - 標準環境で 48 時間の最小復旧期間を許可します。
注:マウスの胃に挿入されたカテーテルの一端は、異物の侵入を防ぎ、噛むのを防ぐために、先端が密閉された23G針で閉じられています。腹部から突き出ているカテーテルが短いため、マウスが寝具に引きずり込まれて開いたり絡まったりするのを防ぎます。
6. in vivo 経頭蓋Ca2+ イメージングの調製
- イソフルランを使用してマウスに麻酔を投与します(2%の誘導;0.8%から1.0%の間の維持)。
- 補助イヤーバーを使用してマウスを定位固定装置プラットフォームに固定し、脈動と呼吸の影響を軽減します。続いて、マウスを蛍光実体顕微鏡下に置きます。
- 広帯域青色蛍光フィルターセット(460-490nmで励起、520nmで発光)と水銀光源を組み合わせて使用します。
- カメラで撮影し、指定の撮像ソフトで現像します。
- 電気シェーバーまたは脱毛クリームを使用して、頭皮から髪を慎重に取り除きます。
注意: かみそりを使用する場合は、完全に消毒されていることを確認し、皮膚を切らないように注意してください。 - 綿棒または同様のツールを使用して、0.1〜0.5%に希釈したグルコン酸クロルヘキシジンの溶液で頭皮の表面を消毒します。次に、アルコールで消毒し、この交互のラウンドを3回繰り返します。
- 局所麻酔ジェルを塗布し、5〜10分待ちます。
- 歯科用アクリルセメントを塗布する準備をします。
- 滅菌メスの刃を使用して頭皮を切断します。頭皮を完全に取り除くか、後頭部から額までまっすぐに切り込みを入れます。
- クリップを使用して、余分な皮膚を伸ばすことで頭蓋骨を露出させます。
- 綿棒を使用して、骨膜の結合組織を取り除きます。
- 骨膜を取り除いた後、すぐにアクリルセメントを塗布します。露出した骨からの蒸発により頭蓋骨の表面が不透明になるのを防ぐために迅速に行動します。
- セメントが乾くまで約5分待ちます。
7. 十二指腸内グルコース投与による経頭蓋Ca2+ イメージング
- 実験溶液と生理食塩水の両方を周囲温度まで平衡化します。マウスに指定された期間(例:2時間)の食事制限を課します。
- 注射を開始する前に、~0.03 mLの生理食塩水を使用してマウス側カテーテル内の残留物をすべてパージします。
- 実験溶液(例えば、300 μL の水で調製した 10% グルコース溶液にさらに 300 μL の水を加えた溶液)をシリンジに吸引し、カテーテルにインターフェースします。特定の実験目的に合わせた溶液の最適な投与量を確認します。
注:この段階では、マウスの内部解剖学的構造を危険にさらす可能性のあるカテーテルへの過度の負担を防ぐために注意を払ってください。マウス側のチューブを最大限の優しさで操作するよう努めてください。さらに、閉じ込められた空気や気泡が胃腸の膨満を誘発する可能性があるため、シリンジに溶液後の吸引後に空気が入らないようにしてください。 - マウスの生理状態を評価し、ソフトウェアアプリケーションの 記録処理 ボタンをクリックして、イメージングソフトウェアの記録機能をアクティブにします。
- 512 x 512 ピクセルの解像度、16 ビット深度、10 Hz のフレーム レートで画像をキャプチャします。
注:記録パラメータは、特定の実験要件に合わせて調整できます。 - 自発的なデータ(例:50 s)を取得し、その後、実験に合わせた速度(ここでは0.035 mL/s)で実験溶液を徐々に注入します。
注: 実験の最後に、マウスはイソフルラン麻酔下で頸部脱臼によって速やかに安楽死されます。
8. 画像データの処理と分析
- 画像データを 64 x 64 ピクセルにビンします。
- ImageJ を使用して手描きの関心領域 (ROI) を決定します。マウス脳アトラスを参照して、ROIを前頭野(M2)、バレルを含む体性感覚野(Somato)、後頭野(Visual)、および後脾臓領域(RSC)として指定します。
- MATLAB 関数 ReadImageJROI を使用して、ROI に対応する座標を抽出します。提供されているリンクからMATLAB関数にアクセスします:https://jp.mathworks.com/matlabcentral/fileexchange/32479-readimagejroi
- MATLAB を使用して、ROI 内の蛍光強度の平均変化率を計算します。
- 蛍光強度変化率 (ΔF/F) を式 (1) で定義します。
 (1)
(1)
ここで、Ftは特定の時間における蛍光強度値を表し、記録開始から注入開始までの50秒までの平均強度値はF0として表されます。
- 蛍光強度変化率 (ΔF/F) を式 (1) で定義します。
- 注射液が臓器に到達するまでの遅延を考慮します。注入後 3 秒間の平均強度値をベースラインとして使用します。ベースライン強度値 + 1 SD を超えるターゲット波形は、注入後 3 秒以降に発生した場合に解析します。
結果
イソフルラン麻酔G7NG817マウスによる経頭蓋皮質ワイドCa2+ イメージング
カテーテルは、図1に示す手順に従って作成しました。胃の位置を慎重に特定した後、その位置にカテーテルを取り付けました(図1)。カテーテル挿入後の十分な回復時間(約48時間)を考慮した後、軽度のイソフルラン麻酔下(0.8-1.0%)で自発神経活動を測定し、その後の腸刺激観察のためのベースライン蛍光強度変化を確立しました。その結果、皮質全体に広がるランダムなCa2+振動パターンを確認しました(図2A)。図2は、事前にカテーテルを挿入した状態での自発的な脳活動の代表的な例を示しています。注入後の M2 領域で最初に観測可能な Ca2+ 過渡ピークの時間を 0.0 秒と定義しました。疑似カラー表現では、この Ca2+ トランジェントのピークを最大値として表示し、平均値に 1 標準偏差 (1 SD) を加えた値を最小値として表示しました。左半球と右半球がすべての領域で同期した活動を示していることは明らかでした。
次に、各機能領域内の波を特徴付けるためのROIを確立しました。 図2Bに示すように、 各ROIの蛍光強度率の時間的変化 を示しました(図2B)。これらの観測された表面Ca2+ 振動は、バースト抑制パターンに従い、低活性の期間と高振幅の蛍光変化を交互に繰り返しました。この活動パターンは、皮質表面EEGとCa2+ ダイナミクス26を同時に測定した以前の知見と一致しています。
抑制状態とバースト状態の間の全球的または局所的な表面Ca2+の変動にもかかわらず、カルシウムの急増を開始する特定の皮質領域は異なる場合があります。以前に報告されたように、信号が局所的な皮質領域を刺激すると、その領域は活性化すると予想され、その後、皮質状態27,28の全体的なシフトを駆動する。
胃内グルコース注射後の皮質Ca2+ ダイナミクスの変化
次に、グルコースや水の投与が皮質活動にどのような影響を与えるのかを解明するために、注射中および注射後の皮質全体のCa2+ダイナミクスをモニタリングしました。その結果、胃内グルコース注射後の皮質Ca2+ダイナミクスの変化が見出されました。皮質活性化の多様な領域で示される自発的な活動とは対照的に、カテーテルを介してグルコースを直接腸に注入すると、前頭前野または二次運動皮質(M2)での即時活性化が観察されましたが、これは胃水注入では誘発されない効果です(図3A-C)。さらに、これらの一過性の顕著なCa2+イベントは、胃内グルコース注射後約10秒にわたって連続して発生する傾向があることが観察されました。このような持続的な現象は、水を投与したときには明らかになりませんでした(図3D-F)。
各ROIにおけるCa2+ イベントは、グルコース投与の完了後4〜8秒以内に発生する最初のピークで、聴覚皮質(参照)を参照として使用して、蛍光強度変化率の比率を計算することによって特徴付けられました。その結果、注入前後の聴覚皮質を基準にM2領域での反応を比較した上で、グルコースを注入した際に有意な変化が観察されました。
対照的に、水を注入した場合、そのような変化は観察されませんでした(図3G、水N=7:注射前、2.38±2.53対2.05±1.84、p > 0.05;グルコースN = 7:注射前、2.48 ± 0.97 vs. 3.76 ± 2.76、p < 0.01、Wilcoxon符号順位検定)。次に、各皮質領域における活性化レベルを注射後と注射前の値の比で定義すると、M2領域のみで有意差が認められた(図3H、M2:0.92 ± 0.89対1.30 ± 0.32、p = 0.006;ソマト: 0.95 ± 0.076 対 1.04 ± 0.13, p = 0.27;ビジュアル: 0.92 ± 0.3 対 1.00 ± 0.06、p = 0.89;RSC: 0.97 ± 0.27 対 1.10 ± 0.27、p = 0.60、 t検定)。
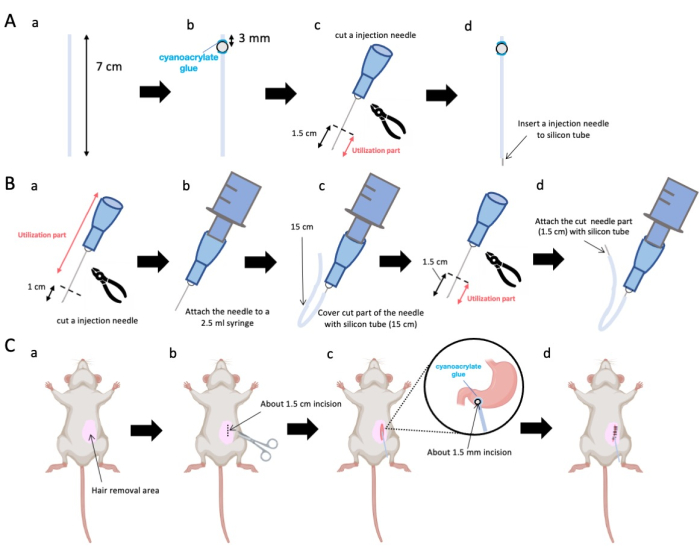
図1:方法の概要 (A)カテーテルの作成:(a)シリコンチューブを切断します。(b)医療用シアノアクリレート接着剤を使用して、シリコンチューブにプラスチックビーズを貼り付けます。(c)23Gの針を先端から1.5cm切り取ります。(d)針の切断端をシリコンチューブに取り付けます。(b)インジェクターアセンブリ:(a)23Gの注射針を1cmトリミングします(b)トリミングした注射針を2.5mLの注射器に接続します。.(c)注射針の切断部分をシリコンチューブで覆います。(d)23Gの針を先端から1.5cmカットします。(e)針の切断端をシリコンチューブに取り付けます。(C)外科的処置:(a)手術部位を脱毛します。(b)皮膚と腹壁を約1.5cmの長さに切開します。(c)ハサミで幽門前道に小さな穿孔(直径約1.5mm)をあけ、カテーテル(シリコンチューブ)を挿入します。医療用シアノアクリレート接着剤を使用してカテーテルを幽門前庭に固定します。(d)5/0シルク縫合材と針を使用して腹壁と皮膚を縫います。 この図の拡大版を表示するには、ここをクリックしてください。
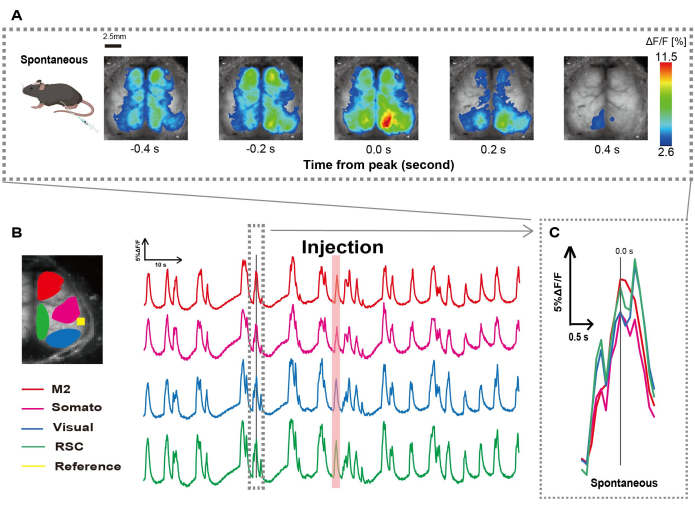
図2:カテーテルを装着したマウスにおける皮質幅の自発的なCa2+振動G7NG817(A)0.2秒間隔で表示された皮質幅のCa2+振動の代表的な例。蛍光強度の変化は、疑似カラーオーバーレイで表されます。B の破線で囲まれたタイム ウィンドウは、最初に出現する Ca2+ トランジェントを示しており、そのピークは時間 0 に設定されています。擬似カラー表現では、その Ca2+ トランジェントのピークを最大値として使用し、平均 +1 SD を最小値として使用します。(B)例の各ROIの蛍光強度の時系列変化。線の色はさまざまな皮質領域に対応しています:赤はM2を表します。マゼンタは体性感覚野(ソマト)を表します。青は視覚領域(ビジュアル)を表します。緑はレトロな脾臓の領域を表しています。サーモン色の帯は注入時間を示しています。(C)破線のアウトライン内の単一のピークが分離され、拡大図で表示されます。略語:SD =標準偏差;ROI = 関心領域RSC = レトロ脾臓領域。この図の拡大版を表示するには、ここをクリックしてください。
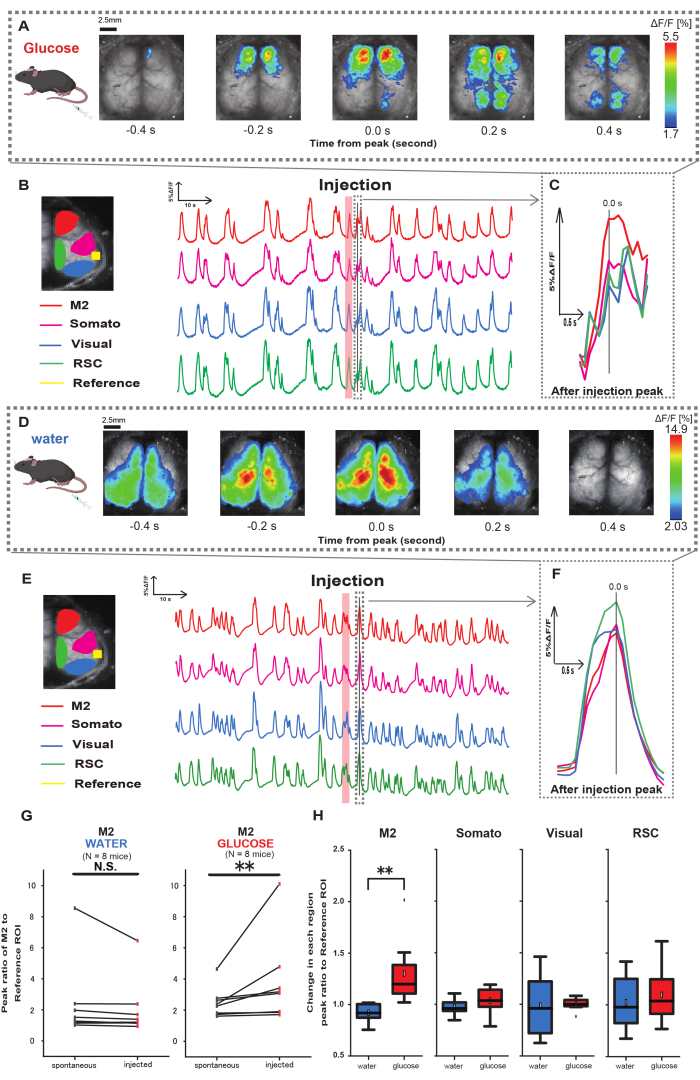
図3:グルコースまたは水の注入中/注入後のCortexワイドCa2+ 応答。 (A)0.2秒間隔で示したグルコース投与の代表例。蛍光強度の変化は、疑似カラーオーバーレイで表されます。 B の破線で囲まれた時間ウィンドウは、注入後に最初に現れる Ca2+ トランジェントを示しており、そのピークは時間 0 に設定されています。疑似カラー表現は、注入後の最初の Ca2+ トランジェントのピークを最大値とし、平均 +1 SD を最小値として基づいています。(B)例の各ROIの蛍光強度の時系列変化。線の色はさまざまな皮質領域に対応しており、赤はM2、マゼンタは体性感覚領域(Somato)、青は視覚領域(Visual)、緑はレトロな脾臓領域を表しています。(C)破線のアウトライン内の単一のピークが分離され、拡大図で表示されます。ターゲットカルシウム波の分析は、注入後4〜8秒以内に現れた最も早い波です。(D)血糖コントロールデータとしての水注入の代表例。(E)例の各ROIの蛍光強度の時系列変化。線の色は Bと同じです。(F)破線のアウトライン内の単一のピークが分離され、拡大図で表示されます。ターゲットカルシウム波の分析は、注入後4〜8秒以内に現れた最も早い波です。(G)M2の自発活動(注入前)と注入後の反応(注入)の比較。平均蛍光強度は注入前の50秒にわたって変化し、聴皮質を基準として、注射後4秒から8秒後のM2領域のピーク応答を計算しました。(H)水またはグルコースが投与されたときの各皮質領域の活性化レベルの比較。注入後と注入前の値の比率は、 Gで決定され、各領域について計算されました。N.S. は非有意 (p > 0.05) を表します。** <0.01.エラーバーは、平均の標準誤差として定義されます。略語:SD =標準偏差;ROI = 関心領域RSC = レトロ脾臓領域。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この記事では、カテーテルを腸に取り付け、遺伝的にコードされたCa2+インジケーターを発現するトランスジェニックマウスを使用して、経頭蓋皮質全体のCa2+シグナルを観察する方法を紹介します。この実験では、光源の二次波長を用いた撮像データは得られませんでした。これは、本研究で用いたトランスジェニックマウスが、Ca2+指標タンパク質(G-CaMP7)の特性により、感覚刺激に応答して非常に高い蛍光強度変化率(~数十%)を示すためです。したがって、血行動態による汚染は無視できると考えました。さらに、私たちが着目した神経応答は数秒以内に急速に起こるため、その後に生じる局所的な機能性充血を考慮する必要はないと考えました。このカテーテル留置法は、他の遺伝子改変マウスと組み合わせて、他の脳領域の神経活動を異なる時間スケールで観察することができます。ただし、他の遺伝子改変マウスを使用する場合は、上記の対照実験を行う必要があります。
カテーテルを腸に取り付けるこの方法は、低コストでの単回投与注射に適しており、以前に提案された方法よりも簡単で侵襲性が低い29。伝統的に、吸収性のある綿を消化器官に塗布して縫合します。しかし、マウスでは縫合が術後の回復を阻害することがあります。そこで、取り付ける方法を採用しました。プラスチックビーズを選んだ理由は、私たちが使用しているシアノアクリレート接着剤でシリコーンによりよく接着するためです。
伝統的に、脳は血漿血糖値のエスカレーションとそれに伴うホルモン放出に基づいてグルコースを知覚すると仮定されてきました。その結果、脳は、腸からグルコースが吸収された後、グルコースを検出するのに数分から数時間かかります4。いくつかの研究は、腸の感知がマウスの味の好みを制御するだけでなく、経口の甘い味の受容1,3,17,22を示唆しています。実例として、研究者は、胃内(IG)グルコース対のフレーバー非栄養溶液およびIG非代謝性α-メチル-d-グルコピラノシド(MDG)対のフレーバー非栄養溶液が、IG水対群と比較して各フレーバー非栄養溶液の選好を引き出すことができるという証拠を提供しました。腹腔内グルコース注射は非栄養溶液の摂取を刺激しなかったため30、腸の栄養感知がマウスの食物選択に重要な役割を果たすことが予想された1,19,22。
最近の研究では、腸内に「ニューロポッド細胞」と呼ばれる電気的に興奮する細胞が存在することが明らかになっています。これは、分子受容体を使用して、グルタミン酸作動性シナプスを介して感覚刺激を検出し、迷走神経に伝達します。これまでの研究は、主にマウスの摂食制御におけるGLP-1の役割に焦点を当ててきましたが、最近の研究では、神経ポッド細胞による迷走神経活性化がマウスの食欲を調節することが示されています。迷走神経はその後、孤独核核を活性化し、その後のドーパミン作動性ニューロンの活性化につながる19。しかし、ドーパミン作動性ニューロンの活性化が皮質も活性化するかどうかは不明です。胃内グルコース注入後の脳反応を分類するために、イメージング目的でカテーテル取り付け技術を改良しました。この技術を採用する際には、特に胃の位置を確認するために必要な操作中に損傷を受けやすい肝臓に関して、臓器の損傷を防ぐための注意を払うことが不可欠です。
私たちの調査結果は、胃内グルコース注射が数秒以内に前頭前野を活性化することを示しています。しかし、胃内グルコース投与は、ホルモン経路、迷走神経、脊髄求心神経など、複数のシグナル伝達経路を同時に開始します。これらの信号は、脳幹でさまざまな時間スケールで処理されます。したがって、将来の研究では、これらの複雑な信号がどのように処理され、脳内で統合されるかを探る必要があります。
また、本研究で用いたBAC GLT-1-G-CaMP7トランスジェニックマウス系統は、Ca2+センサーであるG-CaMP7をニューロンとアストロサイトの両方に発現しています。原則として、経頭蓋皮質ワイド Ca2+ イメージングによって得られる前頭前野 Ca2+ 上昇は、ニューロンおよび/または星状細胞に由来します。しかし、ドーパミンシグナル伝達が関与している場合、アストロサイトはドーパミン受容体を発現するため、アストロサイトIP3/Ca2+シグナル伝達の活性化の可能性を示唆しています。アストロサイトIP3/Ca2+シグナル伝達はシナプスの可塑性を調節するため、グルコース受容後のショ糖選好の変化や摂食行動の変化にも重要な役割を果たす可能性があります。したがって、グルコース投与後に前頭前野で観察された応答がニューロンまたはアストロサイトに由来するかどうかを特定するために、2光子顕微鏡を使用した細胞分解能でのイメージングが必要になります。また、アデノ随伴ウイルス(AAV)を用いたマウスにおいて、細胞特異的なCa2+インジケーターの発現をファイバーフォトメトリーで観察する方法も有効です。さらに、腸へのグルコース刺激が本当に迷走神経を刺激したかどうかを、電気生理学的手法を用いて検証する必要があります。神経ポッド細胞がグルコースを受けて迷走神経に信号を伝達しているとすれば、SGLT-1阻害剤を投与しても迷走神経からの反応は見られません。最後に、迷走神経突出部 Solitarii (NTS) への迷走神経突起がドーパミン作動性ニューロンを活性化し、前頭前野の Ca2+ シグナルを増加させるかどうかを確認するには、さまざまなドーパミン受容体拮抗薬を使用した検証が必要になります。全体として、このシステムは、腸から脳への急速な神経伝達効果を包括的に調査することを可能にします。これは、ストレスが腸と脳の相互作用に関するショ糖の好みをどのように変化させるかなどのメカニズムを解明する可能性のある非常に有望な方法論を提示します。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
本研究は、お茶の水女子大学、科研費(18K14859、20K15895)、JST FORESTプログラム、JPMJFR204G、公益財団法人光科学技術研究振興財団、花王健康科学研究推進協議会、公益社団法人化学技術振興協会、公益財団法人テルモ生命科学振興財団の支援を受けて行われました。筆者は、実験の監督をしてくれた坪井隆博士、原田和樹博士、夏堀明代氏に感謝します。また、研究室のメンバーのご支援にも感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 2.5 mL TERUMO syringe | TERUMO | ss-02Sz | |
| 23 G injection needle | TERUMO | 4987350390691 | |
| Anesthetic (ISOFLURANE Inhalation Solution) | viatris | 871119 | |
| cotton swab | local company | ||
| Cyanoacrylate glue (AronArufa A) | TOAGOSEI | 7990700Q1022 | |
| dental acrylic cement C&B | Sun Medical | 221AABZX00115000 | |
| Depilatory cream | Kracie | local company | |
| Digital CMOS camera | Hamamatsu Photonics | ORCA-Spark | |
| Ear bar | NARISHIGE | EB-5N | |
| Filter set (U-MWB2) | Evident | U-MWB2 | |
| Fine Scissors | Fine Dcience Tools | 14040-10 | |
| G7NG817 mice | RIKEN BRC | RBRC09650 | |
| Image software | Hamamatsu Photonics | HC Image software | |
| Isoflurane vapolizer | shinanoseisakusyo | SN-487-0T | |
| Light source (U-HGLGPS) | Evident | U-HGLGPS | |
| microscopy (MVX10) | Evident | ||
| Plastic beads (inner diameter 3 mm, outer diameter 5 mm) | local company | ||
| Pliers | local company | ||
| Polydioxanone suture, monodiox | Alfresa Pharma | HR1305MV45-KF2R | This absorbable, monofilament PDS suture is employed for closing the surgical incision |
| Round ended forceps | F.S.T. | 11617-12 | |
| saline | Otsuka Pharmaceutical Factory | 35061311 | |
| Silicon tube (inner diameter 0.5 mm, outer diameter 1.0 mm) | AS ONE CORPORATIO | 33151413 | local company |
| small surgery needle | Natsume Seisakusho Co., Ltd. | AC03DNT | |
| Stereotaxic stage | NARISHIGE | MA-6N | |
| Xylocaine Jelly 2% | Sandoz K.K. | 614429303 | This jelly is used as a local analgesic to alleviate surgical pain |
参考文献
- Buchanan, K. L., et al. The preference for sugar over sweetener depends on a gut sensor cell. Nature Neuroscience. 25 (2), 191-200 (2022).
- Reimann, F. Molecular mechanisms underlying nutrient detection by incretin-secreting cells. International Dairy Journal. 20 (4), 236-242 (2010).
- Kreuch, D., et al. Gut mechanisms linking intestinal sweet sensing to glycemic control. Frontiers in Endocrinology. 9, 741 (2018).
- Gorboulev, V., et al. Na(+)-D-glucose cotransporter SGLT1 is pivotal for intestinal glucose absorption and glucose-dependent incretin secretion. Diabetes. 61 (1), 187-196 (2012).
- Harada, N., Inagaki, N. Role of sodium-glucose transporters in glucose uptake of the intestine and kidney. Journal of Diabetes Investigation. 3 (4), 352-353 (2012).
- Kaelberer, M. M., Rupprecht, L. E., Liu, W. W., Weng, P., Bohórquez, D. V. Neuropod cells: The emerging biology of gut-brain sensory transduction. Annual Review of Neuroscience. 43, 337-353 (2020).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Larsen, P. J., Tang-Christensen, M., Jessop, D. S. Central administration of glucagon-like peptide-1 activates hypothalamic neuroendocrine neurons in the rat. Endocrinology. 138 (10), 4445-4455 (1997).
- Alhadeff, A. L., Rupprecht, L. E., Hayes, M. R. GLP-1 neurons in the nucleus of the solitary tract project directly to the ventral tegmental area and nucleus accumbens to control for food intake. Endocrinology. 153 (2), 647-658 (2012).
- Raybould, H. E. Gut chemosensing: interactions between gut endocrine cells and visceral afferents. Autonomic Neuroscience: Basic & Clinical. 153 (1-2), 41-46 (2010).
- Routh, V. H. Glucose-sensing neurons: are they physiologically relevant. Physiology & Behavior. 76 (3), 403-413 (2002).
- Secher, A., et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. The Journal of Clinical Investigation. 124 (10), 4473-4488 (2014).
- Williams, E. K., et al. Sensory neurons that detect stretch and nutrients in the digestive system. Cell. 166 (1), 209-221 (2016).
- Borgmann, D., et al. Gut-brain communication by distinct sensory neurons differently controls feeding and glucose metabolism. Cell Metabolism. 33 (7), 1466-1482.e7 (2021).
- Krashes, M. J., et al. Rapid, reversible activation of AgRP neurons drives feeding behavior in mice. The Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- Aponte, Y., Atasoy, D., Sternson, S. M. AGRP neurons are sufficient to orchestrate feeding behavior rapidly and without training. Nature Neuroscience. 14 (3), 351-355 (2011).
- Zhang, L., Han, W., Lin, C., Li, F., de Araujo, I. E. Sugar metabolism regulates flavor preferences and portal glucose sensing. Frontiers in Integrative Neuroscience. 12, 57 (2018).
- Goldstein, ., et al. Hypothalamic detection of macronutrients via multiple gut-brain pathways. Cell Metabolism. 33 (3), 676-687.e5 (2021).
- Fernandes, A. B., et al. Postingestive modulation of food seeking depends on vagus-mediated dopamine neuron activity. Neuron. 106 (5), 778-788.e6 (2020).
- Kaelberer, M. M., et al. . A gut-brain neural circuit for nutrient sensory transduction. 361 (6408), eaat5236 (2018).
- Bohórquez, D. V., et al. Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. The Journal of Clinical Investigation. 125 (2), 782-786 (2015).
- Tan, H. -. E., et al. The gut-brain axis mediates sugar preference. Nature. 580 (7804), 511-516 (2020).
- Wang, D., et al. Whole-brain mapping of the direct inputs and axonal projections of POMC and AgRP neurons. Frontiers in Neuroanatomy. 9, 40 (2015).
- Yamada, S., Wang, Y., Monai, H. Transcranial cortex-wide Ca2+ imaging for the functional mapping of cortical dynamics. Frontiers in Neuroscience. 17, 1119793 (2023).
- Monai, H., et al. Calcium imaging reveals glial involvement in transcranial direct current stimulation-induced plasticity in mouse brain. Nature Communications. 7 (1), 11100 (2016).
- Ferron, J. -. F., Kroeger, D., Chever, O., Amzica, F. Cortical Inhibition during Burst Suppression Induced with Isoflurane Anesthesia. The Journal of Neuroscience. 29 (31), 9850-9860 (2009).
- Ming, Q., et al. Isoflurane-induced burst suppression is a thalamus-modulated, focal-Onset rhythm with persistent local asynchrony and variable propagation patterns in rats. Frontiers in Systems Neuroscience. 14, 599781 (2021).
- Schwalm, M., et al. Functional states shape the spatiotemporal representation of local and cortex-wide neural activity in mouse sensory cortex. Journal of Neurophysiology. 128 (4), 763-777 (2022).
- Ueno, A., et al. Mouse intragastric infusion (iG) model. Nature Protocols. 7 (4), 771-781 (2012).
- Zukerman, S., Ackroff, K., Sclafani, A. Post-oral glucose stimulation of intake and conditioned flavor preference in C57BL/6J mice: A concentration-response study. Physiology & Behavior. 109, 33-41 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved