Method Article
장-뇌 신경 통신의 실시간 분석: 장 포도당 자극에 대한 반응의 피질 전체 칼슘 역학
요약
미주 신경에 의해 촉진되는 장과 뇌의 소통은 위장 내분비계와 뇌 사이의 소통에 매우 중요합니다. 그러나 위내 포도당 주입이 대뇌 피질 활동을 변화시킬 수 있는지는 아직 이해되지 않았습니다. 여기에서는 십이지장에 포도당을 주입한 후 대뇌 피질 활동의 변화를 관찰하기 위한 포괄적인 프로토콜을 제공합니다.
초록
영양소 흡수 후 위장관과 뇌 사이의 통신은 음식 선호도, 신진대사 및 섭식 행동에 필수적인 역할을 합니다. 특히 특정 영양소와 관련하여, 많은 연구에서 장 상피 세포 내 포도당의 동화작용이 많은 신호 분자의 활성화를 촉진한다는 것을 밝혔습니다. 글루카곤 유사 펩타이드-1과 같은 호르몬은 전형적인 신호 전달 매개체로 알려져 있습니다. 호르몬은 주로 순환 경로를 통해 뇌에 영향을 미치기 때문에 뇌 활동을 천천히 조절합니다.
그러나 최근 연구는 자율 신경계에 의해 촉진되는 두 가지 신속한 장-뇌 경로를 보여주었습니다. 하나는 척추 구심성 신경 경로를 통해 작동하고 미주 신경은 다른 하나를 중재합니다. 결과적으로, 위장관에서 포도당 동화 작용에 따른 뇌 반응은 복잡합니다. 더욱이, 장 자극이 최종적으로 감각, 통각 수용, 보상 및 운동 반응을 포함한 다양한 대뇌 피질 활동을 유도함에 따라, 장-뇌 신경 전달을 완전히 이해하기 위해 국소적인 뇌 회로와 범-피질 활동의 시각화를 용이하게 하는 방법론을 채택할 필요가 있습니다. 일부 연구에서는 장 자극 후 서로 다른 경로를 통해 독립적으로 시상하부와 복피개 영역 내의 칼슘 이온(Ca2+) 농도의 급격한 변화를 나타냈습니다. 그러나 대뇌 피질 활동에 변화가 있는지는 알려져 있지 않습니다.
위 내 포도당 주입 후 대뇌 피질 활동을 관찰하기 위해 유전적으로 인코딩된 Ca2+ 지표를 발현하는 형질전환 마우스를 사용하여 완전히 손상되지 않은 두개골을 통해 피질 전체 Ca2+ 역학을 실시간으로 시각화하는 이미징 기술을 개발했습니다. 이 연구는 이식된 카테터를 통한 위장 내 포도당 주입 후 장 자극 유도 경두개 피질 wide Ca2+ 이미징을 모니터링하도록 설계된 기술에 대한 포괄적인 프로토콜을 제시합니다. 예비 데이터에 따르면 포도당 용액을 장에 투여하면 전두엽 피질이 활성화되어 수분 투여에 반응하지 않습니다.
서문
주로 장 내강 1,2,3,4,5,6 내의 장내분비 세포에 위치한 단맛 수용체(Tas1r2, Tas1r3)와 나트륨-포도당 공동수송체 1(SGLT-1)을 통해 포도당을 장에서 감지합니다. 포도당이 장에서 흡수된 후 일반적으로 몇 분에서 몇 시간에 걸쳐 발생하는 과정으로, 주로 혈장 혈당 수치 증가와 호르몬 7,8,9,10,11(예: 글루카곤 유사 펩타이드-1[GLP-1], 펩타이드 YY(PYY) 및 포도당 의존성 인슐린트로픽 폴리펩타이드[GIP])의 방출에 기초하여 발생합니다. 그들은 시상 하부 (ARC)의 아치형 핵에 도달하여 혈류 및 미주 신경 (부교감 신경)에 의해 pro-opiomelanocortin (POMC) 뉴런과 agouti 관련 단백질 (AgRP) 뉴런을 결합합니다 12,13,14. 이러한 뉴런의 활동 변화는 신진대사와 섭식 행동의 조절로 이어진다15,16.
최근 문헌은 포도당 흡수 후 장-뇌 신경 신호 전달의 중요성을 점점 더 강조하고 있습니다. 이 복잡한 경로는 크게 두 가지 주요 메커니즘으로 분류할 수 있습니다. 첫 번째는 척추 구심성의 활성화와 관련이 있으며, 궁극적으로 ARC의 AgRP 신경 세포 활동에 영향을 미칩니다. 두 번째 메커니즘은 상피 세포와의 연결을 통해 미주 신경을 자극하는 것입니다. 장 상피 세포가 미주 신경을 활성화할 수 있는 다면적인 방법을 감안할 때(13), 그 역할은 다재다능한 것으로 간주됩니다.
장내 미주신경 및 척추 구심성 신경 활동의 상당 부분은 섭식 행동과 관련이 있다 17,18,19. 그러나 새로운 증거는 "신경족 세포"로 돌출된 특정 미주 신경 섬유가 포도당 선호와 관련이 있음을 시사합니다. 장내분비 세포의 하위 집합인 신경족 세포는 발광 쪽에서 SGLT-1을 발현하고 글루타민성 시냅스 2,20,21,22를 통해 미주 신경에 감각 자극을 전달합니다. 미주 신경의 활성화는 몇 초 내에 복부 피개 영역(VTA)에서 도파민 뉴런을 유발합니다19. 특히, 특히 십이지장에서 미주신경 활성화를 억제하는 글루타메이트 길항제를 사용하면 마우스에서 자당 선호도가 감소합니다1. 이는 포도당 섭취 후 음식 선택 행동을 조절하는 데 있어 신경족류 세포 활성화의 중요한 역할을 강조합니다2.
이러한 발전에도 불구하고 빠른 장 포도당 감지 메커니즘과 대뇌 피질 활동에 미치는 영향에 대한 철저한 이해는 복잡한 수수께끼로 남아 있습니다. AgRP 뉴런에 의해 조절되는 뇌 활성화에는 대뇌 피질(cerebral cortex)23이 포함되지 않지만, VTA의 도파민 뉴런(dopaminergic neuron)이 대뇌 피질(cerebral cortex)로 돌출되는 것으로 알려져 있다. 그러나 포도당 감지 후 빠른 VTA 도파민 신경 세포 활성화가 실제로 대뇌 피질을 활성화하는지 여부는 알려져 있지 않습니다. 이 메커니즘을 설명하기 위해, 우리는 유전적으로 인코딩된 칼슘 지시자를 발현하는 형질전환 마우스에서 위내 포도당 투여가 대뇌 피질 Ca2+ 역학에 빠르게 영향을 미칠 수 있는 가능성을 조사했습니다.
본 논문은 마우스에서 피질 wide Ca2+ 이미징을 사용하여 위내 포도당 투여 후 피질 활성의 변화를 종합적으로 이해하기 위한 저비용, 덜 침습적인 방법을 제시합니다 최근에는 유전적으로 인코딩된 칼슘 지표를 발현하는 형질전환 마우스를 사용하여 온전한 두개골을 통한 경두개 피질 넓은 Ca2+ 이미징 기술이 인기를 얻고 있습니다24. 특히, 본 연구에서 사용된 BAC GLT-1-G-CaMP7 #817 형질전환 마우스 라인(G7NG817 마우스라고도 함)은 뉴런 및 성상교세포에서 Ca2+ 센서인 G-CaMP7을 발현합니다25. 대뇌 피질의 높은 발현 밀도로 인해 이 형질전환 마우스 라인은 표준 형광 현미경을 사용하는 경두개 피질 wide Ca2+ 이미징에 특히 적합합니다.
프로토콜
모든 실험 프로토콜은 일본 오차노미즈 대학의 기관 동물 관리 및 사용 위원회(동물 연구 프로토콜 22017)의 승인을 받았습니다. 모든 동물 실험은 학술 연구 기관(일본 문부과학성)에서 동물 실험 및 관련 활동의 올바른 실시를 위한 기본 지침에 준거한 오차노미즈 대학의 동물 실험 지침에 따라 수행되었습니다. 사용되는 동물의 수를 최소화하기 위해 노력했습니다. 이 연구는 ARRIVE 지침에 따라 수행되었습니다.
1. 형질전환 마우스의 제조
- 이 실험을 따르기 위해 성인 남성 및 여성 BAC GLT-1-G-CaMP7 #817 형질전환 마우스 라인, 즉 G7NG817 마우스24,25(8주 이상)를 사용하십시오. G7NG817 마우스(25)의 배경 변형은 C57BL/6J이다.
- 12시간/12시간 밝음/어둡기 주기 아래에 쥐를 수용하고 최대 5마리의 쥐 그룹으로 키웁니다.
2. 카테터 생성
- 가위를 사용하여 실리콘 튜브(내경 0.5mm, 외경 1.0mm)를 7cm의 정확한 길이로 조정합니다(그림 1A-a).
알림: 절차에 앞서 가위와 실리콘 튜브를 살균했습니다. - 작은 플라스틱 비드(내경 3mm, 외경 5mm)를 맞춤형 튜브에 부착하여 종단에서 3mm 떨어진 곳에 위치하도록 합니다(그림 1A-b). 시아노아크릴레이트 접착제를 사용하여 비드를 단단히 고정합니다(의료용 또는 표준 변형 가능).
- 23G 바늘의 정점을 절제한 다음 바늘 끝에서 1.5cm를 자릅니다(그림 1A-c).
- 2.3단계에서 절단된 23G 바늘을 비드가 부착된 곳과 반대쪽인 실리콘 튜브의 말단에 삽입합니다(그림 1A-d).
3. 인젝터 생성
- 멸균 플라이어를 사용하여 바늘 끝에서 1cm를 절제합니다(그림 1B-a).
알림: 절단된 끝의 오리피스가 무결성을 유지하고 변형되지 않도록 하십시오., 변형이 주입 용액의 흐름을 방해할 수 있으므로 말입니다. - 3.1.1단계에서 조정된 23G 주입 바늘을 2.5mL 주사기에 연결합니다(그림 1B-b).
- 실리콘 튜브를 필요한 길이(이 실험에서는 15cm 실리콘 튜브)로 분할하고 23G 주입 바늘 위에 넣습니다(그림 1B-c).
알림: 분배되는 용액의 양은 튜브의 길이에 따라 변동됩니다. 예를 들어, 15cm 튜브의 경우 약 50μL의 용액이 실험 후에도 남아 있습니다. - 주사 바늘 끝에서 1.5cm 떨어진 23G 주사 바늘을 절단합니다.
- 3.4단계에서 절편된 부분을 3.3단계에서 만든 실리콘 카테터와 결합합니다(그림 1B-d).
참고: 3.1 및 3.4단계에서 생성된 오리피스가 절개 후 왜곡되지 않은 상태로 유지되는지 확인하십시오. 정류가 필요한 경우 플라이어를 사용하여 원형 구성을 복원하십시오.
4. 위 국소화
- 지정된 챔버에서 3.0% 이소플루란 흡입을 통해 마우스에 마취를 투여합니다. 안구 건조증을 예방하기 위해 안과 연고를 바르십시오.
- 마우스의 마취 상태를 확인한 후 흡입 챔버에서 마취된 마우스를 수술 테이블로 섬세하게 옮깁니다. 절차 전반에 걸쳐 열 지원을 제공합니다.
- 마우스를 supine으로 눕히고 입을 흡입 장치에 가깝게 정렬하고 이소플루란 농도를 3.0%에서 2.0%로 조절합니다.
알림: 이소플루란 마스크의 아래쪽 부분을 위쪽 마스크에서 분리하고 접착 테이프를 사용하여 분리된 마스크(위쪽 부분)를 수술 테이블에 고정합니다. - 접착 테이프를 사용하여 쥐의 구강, 앞다리 및 뒷다리를 수술 테이블에 보충합니다.
참고: 마우스를 테이블에 고정하면 마우스를 마취한 상태에서도 움직임으로 인한 수술 오류를 예방할 수 있습니다. - 제모 크림을 사용하여 왼쪽 상복부(수술 부위 주변 부위의 150%)에서 쥐의 털을 제거합니다. 수술 부위에 국소 진통제를 국소적으로 바르고 5분 동안 기다렸다가 진행합니다.
- 국소 마취 젤을 복부 피부에 바르고 5-10분 동안 기다립니다. 그런 다음 요오드와 70% 에탄올을 번갈아 가며 수술 부위를 3회 소독합니다. 발가락 꼬집을 통해 마취 깊이를 확인하고 멸균 수술 드레이프로 동물을 덮습니다. 대략 1.5cm 길이의 피부를 절개합니다(그림 1C-b), 복부 중앙분리대 오른쪽 1cm, 시푸이드 돌기 아래 5mm(그림 1C-c). 그런 다음 초기 피부 절개와 동일한 위치에서 복벽에 1.5cm의 절개를 만듭니다.
알림: 기저 간에 해를 입히지 않도록 주의하십시오. - 끝이 뭉툭한 집게를 사용하여 왼쪽 간엽을 측면으로 섬세하게 재배치하여 그 아래의 위를 드러냅니다.
5. 카테터 삽입
- 위를 들어 올리고 절개 부위를 통해 조심스럽게 빼냅니다.
알림: 인접 장기, 특히 간의 무결성을 보존하기 위해 최대한의 주의를 기울이고 위에 과도한 힘을 가하지 마십시오. - 가위를 사용하여 유문 antrum에 작은 천공(직경 약 1.5mm)을 만듭니다.
- 카테터의 말단을 천공에 삽입하여 비드가 유문 안반과 직접 접촉하도록 합니다.
참고: 카테터는 삽입하기 전에 0.1-0.5% 클로르헥시딘 글루코네이트 용액으로 소독합니다. - 의료용 시아노아크릴레이트 접착제를 사용하여 카테터의 비드를 위에 부착합니다.
알림: 위가 주변 장기에 붙어 있지 않은지 확인하십시오. - 카테터가 위에 단단히 부착되었는지 확인한 다음 위를 왼쪽 간엽 아래의 타고난 위치로 섬세하게 재배치합니다.
- 폴리디옥사논(PDS) 봉합사를 사용하여 카테터가 외부로 확장될 수 있도록 복벽을 꿰맬다. 그런 다음 복부 폐쇄와 유사한 방식으로 피부 절개 부위를 봉합합니다.
- 소독된 케이지에 마우스를 조심스럽게 재배치합니다.
참고: 수술 후 마우스는 단독으로 수용해야 합니다. 상처 봉합 부위에 국소 진통제를 국소적으로 바르고 현지 기관 지침에 따라 진통제 계획을 따르십시오. - 표준 환경에서 최소 48시간의 복구 기간을 허용합니다.
참고: 쥐의 위에 삽입된 카테터의 한쪽 끝은 이물질의 침입을 방지하고 물지 않도록 끝이 밀봉된 23G 바늘로 닫혀 있습니다. 복부에서 튀어나온 카테터는 짧기 때문에 마우스가 침구 사이로 카테터를 끌고 들어가는 것을 방지하여 카테터가 열리거나 얽힐 수 있습니다.
6. in vivo 경두개 Ca2+ 이미징을 위한 준비
- 이소플루란을 사용하여 마우스에 마취를 투여합니다(2%에서 유도, 0.8%에서 1.0% 사이의 유지).
- 맥동과 호흡의 영향을 완화하기 위해 보조 이어 바를 사용하여 마우스를 입체 플랫폼에 고정합니다. 그런 다음 마우스를 형광 실체 현미경 아래에 놓습니다.
- 광대역 청색 형광 필터 세트(460-490nm에서 여기, 520nm에서 방출)를 수은 광원과 함께 사용합니다.
- 카메라를 사용하여 이미지를 캡처하고 지정된 이미징 소프트웨어를 사용하여 처리합니다.
- 전기 면도기나 제모 크림을 사용하여 두피의 털을 조심스럽게 제거합니다.
알림: 면도기를 사용하는 경우 철저히 소독하고 피부가 찢어지지 않도록 주의하십시오. - 면봉 또는 이와 유사한 도구를 사용하여 0.1-0.5%로 희석한 클로르헥시딘 글루코네이트 용액을 사용하여 두피 표면을 소독합니다. 그런 다음 알코올로 소독하고 이 라운드를 번갈아 3회 반복합니다.
- 국소 마취 젤을 바르고 5-10분 동안 기다립니다.
- 치과용 아크릴 시멘트를 바를 준비를 합니다.
- 멸균 메스 칼날을 사용하여 두피를 자릅니다. 두피를 완전히 제거하거나 머리 뒤에서 이마까지 직선으로 자릅니다.
- 클립을 사용하여 여분의 피부를 확장하여 두개골을 노출시킵니다.
- 면봉을 사용하여 골막의 결합 조직을 제거합니다.
- 골막을 제거한 후 즉시 아크릴 시멘트를 도포하십시오. 노출된 뼈의 증발로 인해 두개골 표면이 불투명해지는 것을 방지하기 위해 신속하게 행동하십시오.
- 시멘트가 마를 때까지 약 5분 동안 기다립니다.
7. 십이지장 내 포도당 투여를 통한 경두개 Ca2+ 이미징
- 실험 용액과 식염수를 모두 주변 온도와 평형화합니다. 마우스에게 지정된 기간(예: 2시간) 동안 식이 제한을 가합니다.
- 주입을 시작하기 전에 ~0.03mL의 식염수를 사용하여 마우스 측 카테터 내의 잔류 내용물을 퍼지합니다.
- 실험 용액(예: 300μL의 물에 300μL의 물로 준비된 10% 포도당 용액에 추가로 300μL의 물로 보충)을 주사기에 흡입한 다음 카테터에 연결합니다. 특정 실험 목표에 맞는 용액의 최적 투여량을 확인합니다.
알림: 이 단계에서는 마우스의 내부 해부학적 구조를 위태롭게 할 수 있는 카테터에 과도한 부담을 주지 않도록 주의하십시오. 마우스 측 튜브를 최대한 부드럽게 조작하도록 노력하십시오. 또한 갇힌 공기와 기포가 위장 팽창을 유발할 수 있으므로 주사기에 용액 흡인 후 공기 제거가 없는지 확인하십시오. - 마우스의 생리적 상태를 평가하고 소프트웨어 응용 프로그램의 기록 프로세스 버튼을 클릭하여 이미징 소프트웨어의 기록 기능을 활성화합니다.
- 512 x 512 픽셀의 해상도, 16비트 심도 및 10Hz의 프레임 속도로 이미지를 캡처합니다.
참고: 기록 매개변수는 특정 실험 요구 사항에 맞게 조정할 수 있습니다. - 자발적인 데이터(예: 50초에 걸쳐)를 획득한 후 실험에 맞는 속도(여기서는 0.035mL/s)로 실험 용액을 점진적으로 주입합니다.
참고: 실험이 끝나면 마우스는 이소플루란 마취 하에 자궁경부 탈구에 의해 즉시 안락사됩니다.
8. 이미지 데이터 처리 및 분석
- 이미지 데이터를 64 x 64 픽셀로 비닝합니다.
- ImageJ를 사용하여 손으로 그린 관심 영역(ROI)을 확인할 수 있습니다. 마우스 뇌 아틀라스를 참조하여 ROI를 전두엽 영역(M2), 배럴을 포함한 체성 감각 영역(Somato), 후두부 영역(시각) 및 후비장 영역(RSC)으로 지정합니다.
- MATLAB 함수 ReadImageJROI 를 사용하여 ROI에 대응하는 좌표를 추출합니다. 제공된 링크를 통해 MATLAB 함수에 액세스합니다 https://jp.mathworks.com/matlabcentral/fileexchange/32479-readimagejroi
- MATLAB을 사용하여 ROI 내에서 형광 강도 변화의 평균 속도를 계산할 수 있습니다.
- 방정식 (1)으로 형광 강도 변화율(ΔF/F)을 정의합니다.
 (1)
(1)
여기서, Ft는 특정 시간에서의 형광 강도 값을 나타내고, 기록 시작부터 주입 후 50초까지의 평균 강도 값은F0로 표시된다.
- 방정식 (1)으로 형광 강도 변화율(ΔF/F)을 정의합니다.
- 주입 용액이 장기에 도달하는 데 걸리는 지연을 고려하십시오. 주입 후 3초에 걸친 평균 강도 값을 기준선으로 사용합니다. 주입 후 3초 이후에 발생하는 경우 분석을 위해 기준선 강도 값 + 1 SD를 초과하는 대상 파형.
결과
이소플루란 마취 G7NG817 마우스를 사용한 경두개 피질 wide Ca2+ 이미징
그림 1에 설명된 절차에 따라 카테터를 만들었습니다. 위의 위치를 주의 깊게 파악한 후 해당 위치에 카테터를 부착했습니다(그림 1). 카테터 삽입 후 충분한 회복 시간(약 48시간)을 허용한 후 가벼운 이소플루란 마취(0.8-1.0%) 하에 자발적인 신경 활동을 측정하여 후속 장 자극 관찰을 위한 기준선 형광 강도 변화를 확립했습니다. 그 결과, 우리는 전체 피질에 걸쳐 있는 무작위 Ca2+ 진동 패턴을 확인했습니다(그림 2A). 그림 2는 카테터를 미리 삽입한 자발적인 뇌 활동의 대표적인 예를 보여줍니다. 주입 후 M2 영역에서 첫 번째 관찰 가능한 Ca2+ 과도 피크의 시간을 0.0초로 정의했습니다. 의사 색상 표현은 이 Ca2+ 과도 현상의 피크를 최대값으로 표시하고 평균값에 1 표준 편차(1 SD)를 최소값으로 표시했습니다. 좌반구와 우반구가 모든 지역에서 동시다발적인 활동을 보인다는 것이 분명했다.
다음으로, 각 기능 영역 내의 파동을 특성화하기 위해 ROI를 설정했습니다. 그림 2B에서 볼 수 있듯이 각 ROI에 대한 형광 강도 속도의 시간적 변화를 제시했습니다(그림 2B). 이러한 관찰된 표면 Ca2+ 진동은 낮은 활성 기간과 높은 진폭의 형광 변화 기간 사이를 번갈아 가며 버스트 억제 패턴을 따랐습니다. 이 활동 패턴은 대뇌 피질 표면 EEG와 Ca2+ 역학을 동시에 측정한 이전 연구 결과와 일치한다26.
억제 상태와 파열 상태 사이의 글로벌 또는 지역 표면 Ca2+ 변동에도 불구하고, 칼슘 급증을 시작하는 특정 피질 영역은 다를 수 있습니다. 이전에 보고된 바와 같이, 신호가 국소 대뇌 피질 영역을 자극할 때, 그 영역은 활성화될 것으로 예상되며, 이어서 대뇌 피질 상태(27,28)의 전지구적 변화를 주도할 것으로 예상된다.
위내 포도당 주입 후 피질 Ca2+ 역학의 변화
다음으로, 포도당 또는 수분 투여가 대뇌 피질 활동에 어떻게 영향을 미치는지 설명하기 위해 주사 중 및 주입 후에 피질 전체 Ca2+ 역학을 모니터링했습니다. 그 결과, 위내 포도당 주입 후 대뇌 피질 Ca2+ 역학의 변화를 발견했습니다. 다양한 대뇌 피질 활성화 영역에서 나타나는 자발적인 활동과는 대조적으로, 카테터를 통해 포도당을 직접 장에 주입하면 전전두엽 영역 또는 2차 운동 피질(M2)의 즉각적인 활성화를 관찰했는데, 이는 위장 내 수분 주입에 의해 유도되지 않는 효과입니다(그림 3A-C). 또한, 이러한 일시적이고 두드러진 Ca2+ 이벤트는 위장 내 포도당 주입 후 약 10초 동안 지속적으로 발생하는 경향이 있음을 관찰했습니다. 이러한 지속적인 현상은 물을 투여했을 때 뚜렷하지 않았습니다(그림 3D-F).
각 ROI의 Ca2+ 이벤트는 포도당 투여 완료 후 4-8초 이내에 발생하는 첫 번째 피크에서 청각 피질(참조)을 기준으로 사용하여 형광 강도 변화 비율의 비율을 계산하는 것으로 특성화되었습니다. 그 결과, 포도당을 주입했을 때 청각 피질을 주사 전후의 기준으로 M2 영역의 반응을 비교한 후 유의미한 변화가 관찰되었습니다.
대조적으로, 물을 주입했을 때는 이러한 변화가 관찰되지 않았습니다(그림 3G, 물 N = 7: 주입 전 대비 2.38 ± 2.53 대 2.05 ± 1.84, p > 0.05; 포도당 N = 7: 주입 전 대비 2.48 ± 0.97 대 3.76 ± 2.76, p < 0.01, Wilcoxon 부호 순위 검정). 다음으로, 주입 후와 주입 전의 값의 비율로 각 피질 영역의 활성화 수준을 정의하면 M2 영역에서만 유의한 차이가 관찰되었습니다(그림 3H, M2: 0.92 ± 0.89 대 1.30 ± 0.32, p=0.006; 소마토: 0.95 ± 0.076 대 1.04 ± 0.13, p = 0.27; 시각: 0.92 ± 0.3 대 1.00 ± 0.06, p = 0.89; RSC: 0.97 ± 0.27 vs. 1.10 ± 0.27, p = 0.60, t-검정).
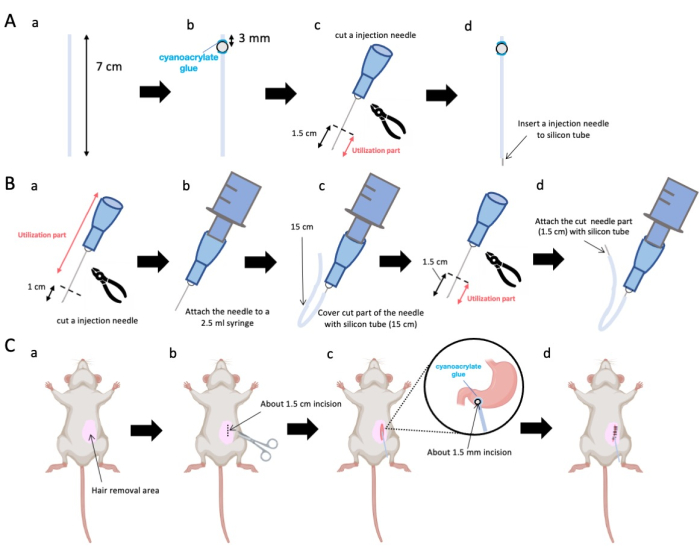
그림 1: 방법의 개요. (A) 카테터 생성: (a) 실리콘 튜브를 자릅니다. (b) 의료용 시아노아크릴레이트 접착제를 사용하여 플라스틱 구슬을 실리콘 튜브에 부착합니다. (c) 23G 바늘을 끝에서 1.5cm 자릅니다. (d) 바늘의 절단된 끝을 실리콘 튜브에 부착합니다. (B) 인젝터 어셈블리: (a) 23G 주사 바늘을 1cm 자릅니다. (b) 트리밍된 주사 바늘을 2.5mL 주사기에 연결합니다. (c) 주사 바늘의 절단 부분을 실리콘 튜브로 피넣습니다. (d) 23G 바늘을 끝에서 1.5cm 자릅니다. (e) 바늘의 절단된 끝을 실리콘 튜브에 부착합니다. (C) 수술 절차: (a) 수술 부위를 제모합니다. (b) 피부와 복벽을 약 1.5cm 길이로 절개합니다. (c) 가위를 사용하여 유문 안틀에 작은 천공 (직경 약 1.5mm)을 만들고 카테터 (실리콘 튜브)를 삽입합니다. 의료용 시아노아크릴레이트 접착제를 사용하여 카테터를 유문 안틀에 고정합니다. (d) 5/0 실크 봉합사 재료와 바늘을 사용하여 복벽과 피부를 꿰매십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
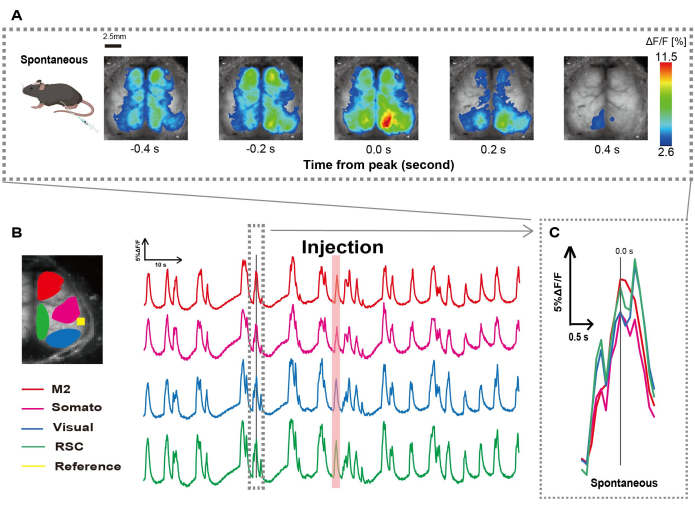
그림 2: 카테터가 부착된 G7NG817 마우스의 자발적 피질 넓은 Ca2+ 진동. (A) 0.2초 간격으로 표시된 피질 넓은 Ca2+ 진동의 대표적인 예. 형광 강도의 변화는 pseudo color overlay로 표현됩니다. B 에서 점선으로 둘러싸인 시간 창은 피크가 시간 0으로 설정된 첫 번째 Ca2+ 과도 현상을 보여줍니다. 의사 색상 표현은 해당 Ca2+ 과도의 피크를 최대값으로 사용하고 평균 +1 SD를 최소값으로 사용합니다. (B) 예제의 각 ROI에 대한 형광 강도의 시계열 변화. 선 색상은 다른 피질 영역에 해당합니다 : 빨간색은 M2를 나타냅니다. 자홍색은 체성 감각 영역(Somato)을 나타냅니다. 파란색은 시각적 영역(Visual)을 나타냅니다. 그리고 녹색은 복고풍 비장 지역을 나타냅니다. 연어 색상의 스트립은 주입 시간을 보여줍니다. (C) 점선 윤곽선 내의 단일 피크가 분리되어 확대 보기에 표시됩니다. 약어: SD = 표준 편차; ROI = 관심 영역; RSC = retro splenial region(레트로 비장 영역). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
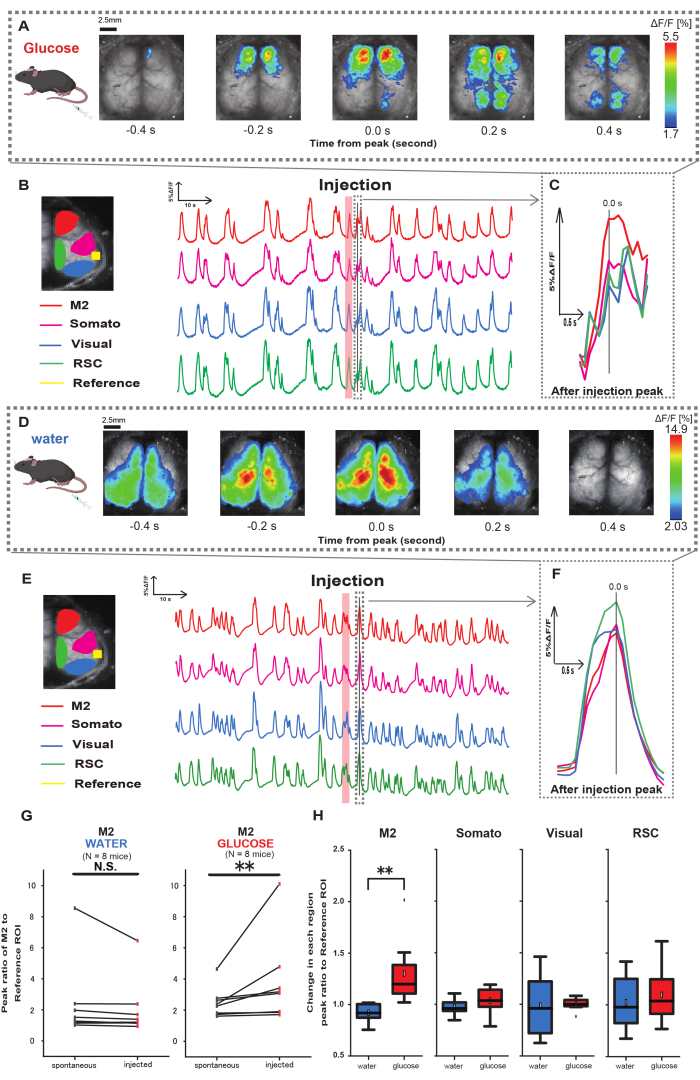
그림 3: 포도당 또는 물 주입 중/후의 Cortex wide Ca2+ 반응. (A) 0.2초 간격으로 표시된 포도당 투여의 대표적인 예. 형광 강도의 변화는 pseudo color overlay로 표현됩니다. B 의 점선으로 둘러싸인 시간 창은 주입 후 처음으로 나타나는 Ca2+ 과도 상태를 보여주며 피크는 시간 0으로 설정됩니다. 의사 색상 표현은 주입 후 첫 번째 Ca2+ 과도 현상의 피크를 최대값으로, 평균 +1 SD를 최소값으로 기반으로 합니다. (B) 예제의 각 ROI에 대한 형광 강도의 시계열 변화. 선의 색상은 다양한 피질 영역에 해당합니다: 빨간색은 M2, 자홍색은 체성 감각 영역(Somato), 파란색은 시각 영역(Visual), 녹색은 복고풍 비장 영역을 나타냅니다. (C) 점선 윤곽선 내의 단일 피크가 분리되어 확대 보기에 표시됩니다. 분석 대상 칼슘 파동은 주입 후 4-8초 이내에 나타난 가장 빠른 파동입니다. (D) 포도당 조절 데이터로서의 물 주입의 대표적인 예. (E) 예제의 각 ROI에 대한 형광 강도의 시계열 변화. 선 색상은 B와 같습니다. (F) 점선 윤곽선 내의 단일 피크가 분리되어 확대 보기에 표시됩니다. 분석 대상 칼슘 파동은 주입 후 4-8초 이내에 나타난 가장 빠른 파동입니다. (G) M2 자발적 활동(전)과 주입(주입) 후 반응의 비교. 평균 형광 강도는 주입 전 50초 동안 변하고, 주입 후 4초와 8초 사이의 M2 영역의 피크 반응을 청각 피질을 기준으로 계산했습니다. (H) 물 또는 포도당이 투여되었을 때 각 피질 영역의 활성화 수준 비교. G에서 결정된 바와 같이, 주입 후 값과 주입 전의 값의 비율은 각 영역에 대해 계산되었습니다. N.S.는 유의하지 않음을 나타냅니다(p > 0.05). ** <0.01. 오차 막대는 평균의 표준 오차로 정의됩니다. 약어: SD = 표준 편차; ROI = 관심 영역; RSC = retro splenial region(레트로 비장 영역). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 기사에서는 장에 카테터를 부착하고 유전적으로 인코딩된 Ca2+ 지시자를 발현하는 형질전환 마우스로 경두개 피질 넓은 Ca2+ 신호를 관찰하는 방법을 제시합니다. 이 실험에서는 광원의 2차 파장을 사용하는 이미징 데이터를 얻지 못했습니다. 이는 본 연구에서 사용한 형질전환 마우스가 사용된 Ca2+ 지시자 단백질(G-CaMP7)의 특성으로 인해 감각 자극에 대한 반응으로 매우 높은 형광 강도 변화율(~수십 %)을 나타내기 때문입니다. 따라서 우리는 혈류역학으로 인한 오염은 무시할 수 있다고 생각했습니다. 더욱이, 우리가 집중한 신경 반응은 몇 초 내에 빠르게 발생했기 때문에 이후에 발생하는 국소 기능성 충혈을 설명할 필요가 없다고 생각했습니다. 이 카테터 이식 방법은 다른 유전자 변형 마우스와 결합하여 다른 뇌 영역과 다른 시간 척도에서 신경 세포 활동을 관찰할 수 있습니다. 그러나, 다른 유전자 변형 마우스를 사용하는 경우에는 상술한 대조 실험을 수행하여야 한다.
카테터를 장에 부착하는 이 방법은 저렴한 비용으로 1회 투여에 적합하며, 앞서 제안된 방법보다 쉽고 덜 침습적이다. 전통적으로 흡수성 면은 소화 기관에 적용되고 봉합됩니다. 그러나 봉합은 마우스의 수술 후 회복을 방해할 수 있습니다. 따라서 우리는 부착 방법을 채택했습니다. 우리가 플라스틱 구슬을 선택한 이유는 우리가 사용하는 시아노아크릴레이트 접착제로 실리콘에 더 잘 접착되기 때문입니다.
전통적으로 뇌는 혈장 혈당 수치의 증가와 그에 수반되는 호르몬 방출에 따라 포도당을 감지한다고 가정해 왔습니다. 결과적으로, 뇌는 장에서 포도당을 흡수한 후 포도당을 감지하는 데 몇 분에서 몇 시간이 걸린다4. 일부 연구에 따르면 장 감지는 구강 단맛 수용 외에도 쥐의 미각 선호도를 제어합니다 1,3,17,22. 예를 들어, 연구자들은 위내(IG) 포도당 쌍 향미 비영양 용액 및 IG 비대사성 α-메틸-d-글루코피라노사이드(MDG) 쌍 향미 비영양 용액이 IG 물 쌍 그룹에 비해 각 향이 첨가된 비영양 용액에 대한 선호도를 유발할 수 있다는 증거를 제공했습니다. 복강내 포도당 주입이 비영양 용액 섭취를 자극하지 않았기 때문에(30), 장내 영양소 감지가 마우스의 음식 선택에 결정적인 역할을 할 것으로 예상되었다 1,19,22.
최근 연구에 따르면 장에 "뉴로포드 세포(Neuropod cell)"라고 하는 전기적으로 흥분할 수 있는 세포가 존재하며, 이 세포는 분자 수용체를 사용하여 감각 자극을 감지하고 글루타민성 시냅스를 통해 미주 신경에 전달합니다. 이전 연구는 주로 GLP-1이 쥐의 먹이 섭취를 조절하는 역할에 초점을 맞췄지만, 최근 연구에서는 신경족 세포에 의한 미주 신경 활성화가 쥐의 식욕을 조절한다는 것을 입증했습니다. 미주 신경은 이어서 Nucleus Tractus solitarius를 활성화하여 도파민 뉴런의 활성화를 유도한다19. 그러나 도파민 뉴런 활성화가 피질도 활성화하는지는 알려져 있지 않습니다. 위내 포도당 주입 후 대뇌 반응을 분류하기 위해 이미징 목적으로 카테터 부착 기술을 개선했습니다. 이 기술을 사용할 때는 장기 손상을 방지하기 위해 주의를 기울여야 하며, 특히 위의 위치를 확인하는 데 필요한 조작 중에 부상을 입기 쉬운 간과 관련하여 주의를 기울여야 합니다.
우리의 연구 결과는 위장 내 포도당 주사가 몇 초 안에 전전두엽 피질을 활성화한다는 것을 나타냅니다. 그러나 위장 내 포도당 투여는 호르몬 경로, 미주 신경 및 척추 구심성 신경과 같은 여러 신호 전달 경로를 동시에 시작합니다. 이러한 신호는 서로 다른 시간 척도로 뇌간에서 처리됩니다. 따라서 향후 연구에서는 이러한 복잡한 신호가 뇌 내에서 어떻게 처리되고 통합되는지를 조사해야 합니다.
또한, 본 연구에서 사용한 BAC GLT-1-G-CaMP7 형질전환 마우스 라인은 뉴런과 성상세포 모두에서 Ca2+ 센서인 G-CaMP7을 발현합니다. 원칙적으로, 경두개 피질 wide Ca2+ 이미징에 의해 얻어진 전전두엽 Ca2+ 상승은 뉴런 및/또는 성상교세포에서 파생됩니다. 그러나 도파민 신호전달이 관여하면 성상세포가 도파민 수용체를 발현하기 때문에 성상세포성 IP3/Ca2+ 신호전달의 잠재적인 활성화를 시사합니다. 성상세포(astrocytic) IP3/Ca2+ 신호전달은 시냅스 가소성(synaptic plasticity)을 조절하기 때문에, 포도당 수용 후 자당 선호도의 변화와 섭식 행동의 변화에도 중요한 역할을 할 수 있습니다. 결과적으로, 포도당 투여 후 전전두엽 피질에서 관찰된 반응이 뉴런 또는 성상교세포에서 비롯된 것인지 여부를 확인하기 위해 이광자 현미경을 사용하여 세포 해상도로 이미징해야 합니다. 또 다른 효과적인 방법은 섬유 광도계를 통해 아데노 관련 바이러스(AAV)를 사용하여 마우스에서 세포 특이적 Ca2+ 지시자 발현을 관찰하는 것입니다. 또한, 전기생리학적 기법을 이용하여 장에 대한 포도당 자극이 실제로 미주신경을 자극하였는지 여부를 확인할 필요가 있다. 신경족 세포가 포도당을 받아 미주신경으로 신호를 전달하는 경우, SGLT-1 억제제를 투여할 때 미주신경에서 반응이 없을 것으로 예상됩니다. 마지막으로, NTS(Nucleus Tractus Solitarii)에 대한 미주 신경 돌기가 도파민 뉴런을 활성화하여 전전두엽 피질 Ca2+ 신호를 증가시키는지 여부를 확인하기 위해 다양한 도파민 수용체 길항제를 사용한 검증이 필요합니다. 전반적으로, 이 시스템은 장에서 뇌로의 빠른 신경 전달 효과에 대한 포괄적인 조사를 가능하게 합니다. 이는 스트레스가 장-뇌 상호 작용에 대한 자당 선호도를 어떻게 변화시키는지와 같은 메커니즘을 잠재적으로 설명할 수 있는 매우 유망한 방법론을 제시합니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 오차노미즈 대학, KAKENHI 보조금(18K14859, 20K15895), JST FOREST 프로그램, 보조금 번호 JPMJFR204G, Opto-Science and Technology 연구 재단, Kao 의료 과학 연구 위원회, 일본 화학 혁신 협회 및 테루모 생명 과학 재단의 지원을 받았습니다. 저자는 실험을 감독해 준 타카시 츠보이 박사, 하라다 카즈키, 아키요 나츠보리 박사에게 감사를 표한다. 저자는 또한 연구실 구성원들의 지원에 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| 2.5 mL TERUMO syringe | TERUMO | ss-02Sz | |
| 23 G injection needle | TERUMO | 4987350390691 | |
| Anesthetic (ISOFLURANE Inhalation Solution) | viatris | 871119 | |
| cotton swab | local company | ||
| Cyanoacrylate glue (AronArufa A) | TOAGOSEI | 7990700Q1022 | |
| dental acrylic cement C&B | Sun Medical | 221AABZX00115000 | |
| Depilatory cream | Kracie | local company | |
| Digital CMOS camera | Hamamatsu Photonics | ORCA-Spark | |
| Ear bar | NARISHIGE | EB-5N | |
| Filter set (U-MWB2) | Evident | U-MWB2 | |
| Fine Scissors | Fine Dcience Tools | 14040-10 | |
| G7NG817 mice | RIKEN BRC | RBRC09650 | |
| Image software | Hamamatsu Photonics | HC Image software | |
| Isoflurane vapolizer | shinanoseisakusyo | SN-487-0T | |
| Light source (U-HGLGPS) | Evident | U-HGLGPS | |
| microscopy (MVX10) | Evident | ||
| Plastic beads (inner diameter 3 mm, outer diameter 5 mm) | local company | ||
| Pliers | local company | ||
| Polydioxanone suture, monodiox | Alfresa Pharma | HR1305MV45-KF2R | This absorbable, monofilament PDS suture is employed for closing the surgical incision |
| Round ended forceps | F.S.T. | 11617-12 | |
| saline | Otsuka Pharmaceutical Factory | 35061311 | |
| Silicon tube (inner diameter 0.5 mm, outer diameter 1.0 mm) | AS ONE CORPORATIO | 33151413 | local company |
| small surgery needle | Natsume Seisakusho Co., Ltd. | AC03DNT | |
| Stereotaxic stage | NARISHIGE | MA-6N | |
| Xylocaine Jelly 2% | Sandoz K.K. | 614429303 | This jelly is used as a local analgesic to alleviate surgical pain |
참고문헌
- Buchanan, K. L., et al. The preference for sugar over sweetener depends on a gut sensor cell. Nature Neuroscience. 25 (2), 191-200 (2022).
- Reimann, F. Molecular mechanisms underlying nutrient detection by incretin-secreting cells. International Dairy Journal. 20 (4), 236-242 (2010).
- Kreuch, D., et al. Gut mechanisms linking intestinal sweet sensing to glycemic control. Frontiers in Endocrinology. 9, 741 (2018).
- Gorboulev, V., et al. Na(+)-D-glucose cotransporter SGLT1 is pivotal for intestinal glucose absorption and glucose-dependent incretin secretion. Diabetes. 61 (1), 187-196 (2012).
- Harada, N., Inagaki, N. Role of sodium-glucose transporters in glucose uptake of the intestine and kidney. Journal of Diabetes Investigation. 3 (4), 352-353 (2012).
- Kaelberer, M. M., Rupprecht, L. E., Liu, W. W., Weng, P., Bohórquez, D. V. Neuropod cells: The emerging biology of gut-brain sensory transduction. Annual Review of Neuroscience. 43, 337-353 (2020).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Larsen, P. J., Tang-Christensen, M., Jessop, D. S. Central administration of glucagon-like peptide-1 activates hypothalamic neuroendocrine neurons in the rat. Endocrinology. 138 (10), 4445-4455 (1997).
- Alhadeff, A. L., Rupprecht, L. E., Hayes, M. R. GLP-1 neurons in the nucleus of the solitary tract project directly to the ventral tegmental area and nucleus accumbens to control for food intake. Endocrinology. 153 (2), 647-658 (2012).
- Raybould, H. E. Gut chemosensing: interactions between gut endocrine cells and visceral afferents. Autonomic Neuroscience: Basic & Clinical. 153 (1-2), 41-46 (2010).
- Routh, V. H. Glucose-sensing neurons: are they physiologically relevant. Physiology & Behavior. 76 (3), 403-413 (2002).
- Secher, A., et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. The Journal of Clinical Investigation. 124 (10), 4473-4488 (2014).
- Williams, E. K., et al. Sensory neurons that detect stretch and nutrients in the digestive system. Cell. 166 (1), 209-221 (2016).
- Borgmann, D., et al. Gut-brain communication by distinct sensory neurons differently controls feeding and glucose metabolism. Cell Metabolism. 33 (7), 1466-1482.e7 (2021).
- Krashes, M. J., et al. Rapid, reversible activation of AgRP neurons drives feeding behavior in mice. The Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- Aponte, Y., Atasoy, D., Sternson, S. M. AGRP neurons are sufficient to orchestrate feeding behavior rapidly and without training. Nature Neuroscience. 14 (3), 351-355 (2011).
- Zhang, L., Han, W., Lin, C., Li, F., de Araujo, I. E. Sugar metabolism regulates flavor preferences and portal glucose sensing. Frontiers in Integrative Neuroscience. 12, 57 (2018).
- Goldstein, ., et al. Hypothalamic detection of macronutrients via multiple gut-brain pathways. Cell Metabolism. 33 (3), 676-687.e5 (2021).
- Fernandes, A. B., et al. Postingestive modulation of food seeking depends on vagus-mediated dopamine neuron activity. Neuron. 106 (5), 778-788.e6 (2020).
- Kaelberer, M. M., et al. . A gut-brain neural circuit for nutrient sensory transduction. 361 (6408), eaat5236 (2018).
- Bohórquez, D. V., et al. Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. The Journal of Clinical Investigation. 125 (2), 782-786 (2015).
- Tan, H. -. E., et al. The gut-brain axis mediates sugar preference. Nature. 580 (7804), 511-516 (2020).
- Wang, D., et al. Whole-brain mapping of the direct inputs and axonal projections of POMC and AgRP neurons. Frontiers in Neuroanatomy. 9, 40 (2015).
- Yamada, S., Wang, Y., Monai, H. Transcranial cortex-wide Ca2+ imaging for the functional mapping of cortical dynamics. Frontiers in Neuroscience. 17, 1119793 (2023).
- Monai, H., et al. Calcium imaging reveals glial involvement in transcranial direct current stimulation-induced plasticity in mouse brain. Nature Communications. 7 (1), 11100 (2016).
- Ferron, J. -. F., Kroeger, D., Chever, O., Amzica, F. Cortical Inhibition during Burst Suppression Induced with Isoflurane Anesthesia. The Journal of Neuroscience. 29 (31), 9850-9860 (2009).
- Ming, Q., et al. Isoflurane-induced burst suppression is a thalamus-modulated, focal-Onset rhythm with persistent local asynchrony and variable propagation patterns in rats. Frontiers in Systems Neuroscience. 14, 599781 (2021).
- Schwalm, M., et al. Functional states shape the spatiotemporal representation of local and cortex-wide neural activity in mouse sensory cortex. Journal of Neurophysiology. 128 (4), 763-777 (2022).
- Ueno, A., et al. Mouse intragastric infusion (iG) model. Nature Protocols. 7 (4), 771-781 (2012).
- Zukerman, S., Ackroff, K., Sclafani, A. Post-oral glucose stimulation of intake and conditioned flavor preference in C57BL/6J mice: A concentration-response study. Physiology & Behavior. 109, 33-41 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유