Method Article
Analisi in tempo reale della comunicazione neurale intestino-cervello: dinamica del calcio a livello di corteccia in risposta alla stimolazione intestinale del glucosio
In questo articolo
Riepilogo
La comunicazione intestino-cervello, facilitata dal nervo vago, è fondamentale per la comunicazione tra il sistema endocrino gastrointestinale e il cervello. Tuttavia, non è ancora chiaro se l'iniezione intragastrica di glucosio possa modificare l'attività corticale. Qui, offriamo un protocollo completo per osservare i cambiamenti nell'attività corticale dopo l'iniezione di glucosio nel duodeno.
Abstract
La comunicazione tra il tratto gastrointestinale e il cervello dopo l'assorbimento dei nutrienti svolge un ruolo essenziale nelle preferenze alimentari, nel metabolismo e nei comportamenti alimentari. In particolare per quanto riguarda specifici nutrienti, molti studi hanno chiarito che l'assimilazione del glucosio all'interno delle cellule epiteliali intestinali stimola l'attivazione di molte molecole di segnalazione. Ormoni come il peptide-1 simile al glucagone sono rinomati come mediatori di segnalazione per eccellenza. Poiché gli ormoni influenzano prevalentemente il cervello attraverso le vie circolatorie, modulano lentamente l'attività cerebrale.
Tuttavia, studi recenti hanno dimostrato due percorsi intestino-cervello rapidi facilitati dal sistema nervoso autonomo. Uno opera attraverso la via neurale afferente spinale, mentre il nervo vago media l'altro. Di conseguenza, le risposte cerebrali in seguito all'assimilazione del glucosio nel tratto gastrointestinale sono complicate. Inoltre, poiché la stimolazione intestinale induce infine diverse attività corticali, tra cui risposte sensoriali, nocicettive, di ricompensa e motorie, è necessario impiegare metodologie che facilitino la visualizzazione dei circuiti cerebrali localizzati e delle attività pancorticali per comprendere appieno la trasmissione neurale intestino-cervello. Alcuni studi hanno indicato alterazioni precipitose delle concentrazioni di ioni calcio (Ca2+) all'interno dell'ipotalamo e dell'area tegmentale ventrale in modo indipendente attraverso diverse vie dopo la stimolazione intestinale. Tuttavia, non è noto se ci siano cambiamenti nell'attività della corteccia cerebrale.
Per osservare l'attività della corteccia cerebrale dopo l'iniezione intragastrica di glucosio, abbiamo sviluppato una tecnica di imaging per la visualizzazione in tempo reale delle dinamiche del Ca2+ nell'intera corteccia attraverso un cranio completamente intatto, utilizzando topi transgenici che esprimono indicatori di Ca2+ geneticamente codificati. Questo studio presenta un protocollo completo per una tecnica progettata per monitorare l'imaging del Ca2+ dell'ampia corteccia transcranica indotta dalla stimolazione intestinale dopo l'iniezione intragastrica di glucosio tramite un catetere impiantato. I dati preliminari suggeriscono che la somministrazione di soluzione di glucosio nell'intestino attiva la corteccia frontale, che rimane insensibile alla somministrazione di acqua.
Introduzione
In primo luogo, il rilevamento intestinale del glucosio avviene attraverso i recettori del gusto dolce (Tas1r2, Tas1r3) e il cotrasportatore sodio-glucosio 1 (SGLT-1) situati nelle cellule enteroendocrine all'interno del lume intestinale 1,2,3,4,5,6. La sensazione di glucosio nel cervello è un processo che in genere va da minuti a ore dopo il suo assorbimento dall'intestino, un evento basato principalmente sull'aumento dei livelli plasmatici di zucchero nel sangue e sul rilascio di ormoni 7,8,9,10,11 (ad esempio, peptide-1 simile al glucagone [GLP-1], peptide YY (PYY) e polipeptide insulinotropico glucosio-dipendente [GIP]). Raggiungono il nucleo arcuato dell'ipotalamo (ARC), dove legano i neuroni pro-opiomelanocortina (POMC) e i neuroni della proteina correlata all'aguti (AgRP) attraverso il flusso sanguigno e il nervo vago (nervo parasimpatico)12,13,14. Il cambiamento nell'attività di questi neuroni porta al controllo del metabolismo e del comportamento alimentare 15,16.
La letteratura recente evidenzia sempre più l'importanza della segnalazione neurale intestino-cervello in seguito all'assorbimento del glucosio. Questo complesso percorso può essere ampiamente classificato in due meccanismi principali. Il primo coinvolge l'attivazione delle afferenze spinali, influenzando in ultima analisi l'attività neuronale dell'AgRP nell'ARC. Il secondo meccanismo comporta la stimolazione del nervo vago attraverso connessioni con le cellule epiteliali. Dati i molteplici modi in cui le cellule epiteliali intestinali possono attivare il nervo vago13, il suo ruolo è considerato versatile.
Una percentuale significativa delle attività del nervo vago intestinale e del nervo afferente spinale è associata ai comportamenti alimentari 17,18,19. Tuttavia, prove emergenti suggeriscono che alcune fibre del nervo vago, che proiettano verso le "cellule neuropodi", sono implicate nella preferenza per il glucosio. Le cellule neuropodi, un sottoinsieme di cellule enteroendocrine, esprimono SGLT-1 sul loro lato luminale e trasmettono stimoli sensoriali a un nervo vago attraverso sinapsi glutammatergiche 2,20,21,22. L'attivazione del nervo vago innesca i neuroni dopaminergici nell'area tegmentale ventrale (VTA) entro pochi secondi19. In particolare, l'inibizione dell'attivazione vagale, in particolare nel duodeno, con l'uso di un antagonista del glutammato riduce la preferenza per il saccarosio nei topi1. Ciò sottolinea il ruolo critico dell'attivazione delle cellule neuropodi nella modulazione del comportamento di scelta alimentare dopo l'assunzione di glucosio2.
Nonostante questi progressi, una comprensione approfondita dei meccanismi di rilevamento rapido del glucosio intestinale e del loro effetto sulle attività corticali rimane un enigma complesso. Sebbene l'attivazione cerebrale controllata dai neuroni AgRP non includa la corteccia cerebrale23, è noto che i neuroni dopaminergici nel VTA proiettano alla corteccia cerebrale. Tuttavia, non è noto se la rapida attivazione neuronale dopaminergica VTA dopo il rilevamento del glucosio attivi veramente la corteccia cerebrale. Per chiarire questo meccanismo, abbiamo studiato il potenziale della somministrazione intragastrica di glucosio di influenzare rapidamente la dinamica corticale del Ca2+ in topi transgenici che esprimono un indicatore di calcio geneticamente codificato.
Questo articolo presenta un metodo a basso costo e meno invasivo per comprendere in modo completo i cambiamenti nell'attività corticale a seguito della somministrazione intragastrica di glucosio utilizzando l'imaging Ca2+ a livello di corteccia nei topi Recentemente, la tecnica di imaging Ca2+ a livello di corteccia transcranica attraverso un cranio intatto, utilizzando topi transgenici che esprimono indicatori di calcio geneticamente codificati, ha guadagnato popolarità24. In particolare, la linea di topo transgenico BAC GLT-1-G-CaMP7 #817 (nota anche come topo G7NG817) impiegata in questo studio esprime il sensore Ca2+ , G-CaMP7, nei neuroni e negli astrociti25. Grazie alla sua elevata densità di espressione nella corteccia cerebrale, questa linea di topi transgenici è particolarmente adatta per l'imaging del Ca2+ dell'ampia corteccia transcranica utilizzando un microscopio a epifluorescenza standard.
Protocollo
Tutti i protocolli sperimentali sono stati approvati dal Comitato Istituzionale per la Cura e l'Uso degli Animali dell'Università di Ochanomizu, Giappone (protocolli di studio sugli animali 22017). Tutti gli esperimenti sugli animali sono stati eseguiti secondo le linee guida per la sperimentazione animale dell'Università di Ochanomizu che sono conformi alle linee guida fondamentali per la corretta conduzione degli esperimenti sugli animali e delle attività correlate negli istituti di ricerca accademica (Ministero dell'Istruzione, della Cultura, dello Sport, della Scienza e della Tecnologia, Giappone). Sono stati compiuti sforzi per ridurre al minimo il numero di animali utilizzati. Questo studio è stato condotto in conformità con le linee guida ARRIVE.
1. Preparazione di topi transgenici
- Per seguire questo esperimento, utilizzare maschi e femmine adulti della linea di topi transgenici BAC GLT-1-G-CaMP7 #817, vale a dire G7NG817 topi24,25 (di età superiore alle 8 settimane). Il ceppo di fondo dei topi G7NG81725 è C57BL/6J.
- Ospita i topi sotto un ciclo luce/buio di 12 ore/12 ore e allevali in gruppi di massimo cinque topi.
2. Creazione del catetere
- Utilizzare le forbici per regolare il tubo di silicone (diametro interno 0,5 mm, diametro esterno 1,0 mm) a una lunghezza precisa di 7 cm (Figura 1A-a).
NOTA: Prima delle procedure, le forbici e il tubo di silicone venivano sterilizzati. - Far aderire le minuscole perle di plastica (diametro interno 3 mm, diametro esterno 5 mm) al tubo su misura, assicurandosi che siano situate a 3 mm dal suo capolinea (Figura 1A-b). Fissare le perline in modo sicuro utilizzando la colla cianoacrilica (sono accettabili varianti mediche o standard).
- Asciugare l'apice di un ago da 23 g e successivamente tagliare a 1,5 cm dalla punta dell'ago (Figura 1A-c).
- Introdurre l'ago sezionato da 23 G dal passaggio 2.3 nell'estremità del tubo di silicone, opposta a dove sono state fissate le perline (Figura 1A-d).
3. Creazione dell'iniettore
- Utilizzare una pinza sterile per asportare 1 cm dalla punta dell'ago (Figura 1B-a).
NOTA: Assicurarsi che l'orifizio all'estremità recisa mantenga la sua integrità e non si deformi, poiché qualsiasi distorsione potrebbe ostruire il flusso della soluzione di iniezione. - Associare l'ago per iniezione adattato da 23 G del passaggio 3.1.1 a una siringa da 2,5 mL (Figura 1B-b).
- Segmentare un tubo di silicone alla lunghezza richiesta (un tubo di silicone da 15 cm in questo esperimento) e avvolgerlo sopra l'ago per iniezione da 23 G (Figura 1B-c).
NOTA: Il volume della soluzione erogata fluttuerà in base alla lunghezza del tubo. Ad esempio, con un tubo da 15 cm, circa 50 μL di soluzione rimarranno dopo l'esperimento. - Recidere l'ago per iniezione da 23 G a 1,5 cm dalla punta dell'ago.
- Unire la parte sezionata del passaggio 3.4 con il catetere in silicone modellato nel passaggio 3.3 (Figura 1B-d).
NOTA: Assicurarsi che gli orifizi creati nei passaggi 3.1 e 3.4 rimangano non distorti dopo l'incisione. Se è necessaria una rettifica, utilizzare una pinza per ripristinarne la configurazione circolare.
4. Localizzazione gastrica
- Somministrare l'anestesia al topo tramite inalazione di isoflurano al 3,0% in una camera specifica. Applicare un unguento oftalmico per prevenire la secchezza oculare.
- Trasferire delicatamente il topo anestetizzato dalla camera di inalazione al tavolo operatorio dopo aver verificato lo stato anestetizzato del topo. Fornire supporto termico durante tutta la procedura.
- Stendere il topo supino, allineando la bocca in prossimità dell'apparato inspiratorio, e modulare la concentrazione di isoflurano dal 3,0% al 2,0%.
NOTA: Sganciare il segmento inferiore della maschera di isoflurano dalla sua controparte superiore e ancorare la maschera separata (segmento superiore) al tavolo chirurgico utilizzando del nastro adesivo. - Integrare la cavità orale, gli arti anteriori e posteriori del topo al tavolo operatorio utilizzando del nastro adesivo.
NOTA: Fissando il mouse al tavolo, è possibile prevenire errori chirurgici dovuti al movimento anche se il mouse è anestetizzato. - Rimuovere i peli del topo dall'addome superiore sinistro (150% dell'area intorno al sito chirurgico) utilizzando una crema depilatoria. Applicare un analgesico locale per via topica sul sito dell'intervento e attendere 5 minuti prima di procedere.
- Applicare un gel anestetico locale sulla pelle addominale e attendere da 5 a 10 minuti. Quindi, disinfettare l'area chirurgica 3 volte con cicli alternati di iodoforo ed etanolo al 70%. Confermare la profondità dell'anestesia con un pizzico per le dita dei piedi e coprire l'animale con teli chirurgici sterili. Praticare un'incisione cutanea di circa 1,5 cm di lunghezza (Figura 1C-b), situata 1 cm a destra della mediana addominale e 5 mm sotto il processo xifoideo (Figura 1C-c). Quindi, creare un'incisione di 1,5 cm nella parete addominale nella stessa posizione dell'incisione cutanea iniziale.
NOTA: Prestare attenzione per evitare di infliggere danni al fegato sottostante. - Riposizionare delicatamente il lobo epatico sinistro lateralmente utilizzando una pinza smussata, rivelando lo stomaco sottostante.
5. Inserimento del catetere
- Sollevare lo stomaco ed estrarlo con cautela attraverso l'incisione.
NOTA: Prestare la massima attenzione per preservare l'integrità degli organi adiacenti, in particolare il fegato, ed astenersi dall'esercitare una forza eccessiva sullo stomaco. - Usa le forbici per creare una minuscola perforazione (circa 1,5 mm di diametro) nell'antro pilorico.
- Introdurre l'estremità del catetere nella perforazione, assicurandosi che la perlina sia a diretto contatto con l'antro pilorico.
NOTA: Il catetere viene disinfettato con una soluzione di clorexidina gluconato allo 0,1-0,5% prima dell'inserimento. - Far aderire la perlina del catetere allo stomaco utilizzando colla cianoacrilica di grado medico.
NOTA: Assicurarsi che lo stomaco rimanga non attaccato agli organi circostanti. - Verificare che il catetere sia saldamente attaccato allo stomaco, quindi riposizionare delicatamente lo stomaco nella sua sede innata sotto il lobo epatico sinistro.
- Cucire la parete addominale, consentendo al catetere di estendersi esternamente, utilizzando una sutura in polidiossanone (PDS). Dopodiché, chiudere l'incisione cutanea in modo analogo alla chiusura addominale.
- Riposizionare delicatamente il mouse in una gabbia igienizzata.
NOTA: I topi postoperatori devono essere alloggiati singolarmente. Applicare un analgesico locale per via topica sulla chiusura della ferita e seguire i piani analgesici come raccomandato dalle linee guida istituzionali locali. - Consentire un periodo di recupero minimo di 48 ore in un ambiente standard.
NOTA: Un'estremità del catetere inserito nello stomaco del topo viene chiusa con un ago da 23G con una punta sigillata per impedire l'ingresso di sostanze estranee ed evitare di mordere. Poiché il catetere che sporge dall'addome è corto, impedisce al topo di trascinarlo attraverso la lettiera, il che potrebbe causarne l'apertura o l'impigliamento.
6. Preparazione per l'imaging transcranico in vivo del Ca2+
- Somministrare l'anestesia al topo utilizzando isoflurano (induzione al 2%; mantenimento tra lo 0,8% e l'1,0%).
- Fissa il mouse su una piattaforma stereotassica utilizzando barre auricolari ausiliarie per mitigare gli effetti della pulsazione e della respirazione. Successivamente, posizionare il mouse sotto uno stereomicroscopio a fluorescenza.
- Utilizzare un set di filtri a fluorescenza blu a banda larga (con eccitazione a 460-490 nm ed emissione a 520 nm) in combinazione con una sorgente luminosa al mercurio.
- Acquisire le immagini utilizzando una fotocamera ed elaborarle utilizzando il software di imaging designato.
- Rimuovere con cura i peli dal cuoio capelluto utilizzando un rasoio elettrico o una crema depilatoria.
NOTA: Se si utilizza un rasoio, assicurarsi che sia accuratamente disinfettato e fare attenzione a non tagliare la pelle. - Disinfettare la superficie del cuoio capelluto utilizzando un batuffolo di cotone o uno strumento simile con una soluzione di clorexidina gluconato diluita allo 0,1-0,5%. Quindi, disinfettare con alcool e ripetere i giri alternati 3 volte.
- Applicare un gel anestetico locale e attendere 5-10 minuti.
- Prepararsi ad applicare il cemento acrilico dentale.
- Usa una lama di bisturi sterile per tagliare il cuoio capelluto. Rimuovere completamente il cuoio capelluto o fare un taglio dritto dalla parte posteriore della testa alla fronte.
- Usa le clip per esporre il teschio estendendo la pelle in eccesso.
- Utilizzare un batuffolo di cotone per rimuovere il tessuto connettivo del periostio.
- Applicare immediatamente il cemento acrilico dopo aver rimosso il periostio. Agire rapidamente per evitare che la superficie del cranio diventi opaca a causa dell'evaporazione dall'osso esposto.
- Attendere circa 5 minuti affinché il cemento si asciughi.
7. Imaging transcranico del Ca2+ con somministrazione intraduodenale di glucosio
- Equilibrare sia la soluzione sperimentale che la soluzione salina a temperatura ambiente. Sottoporre i topi a una restrizione dietetica per una durata specificata (ad esempio, 2 ore).
- Eliminare l'eventuale contenuto residuo all'interno del catetere lato topo utilizzando ~0,03 ml di soluzione fisiologica prima di iniziare l'iniezione.
- Aspirare la soluzione sperimentale (ad esempio, una soluzione di glucosio al 10% preparata in 300 μL di acqua, completata con altri 300 μL di acqua) nella siringa, quindi interfacciarla con il catetere. Accertare il dosaggio ottimale della soluzione in base allo specifico obiettivo sperimentale.
NOTA: Durante questa fase, prestare attenzione per evitare sforzi eccessivi sul catetere, che potrebbero compromettere l'anatomia interna del topo. Sforzarsi di manipolare il tubo lato mouse con la massima delicatezza. Inoltre, assicurarsi che la siringa rimanga priva di aspirazione della soluzione post aria, poiché l'aria intrappolata e le bolle potrebbero indurre distensione gastrointestinale. - Valuta lo stato fisiologico del mouse e attiva la funzione di registrazione del software di imaging facendo clic sul pulsante del processo di registrazione dell'applicazione software.
- Acquisisci immagini con una risoluzione di 512 x 512 pixel, una profondità di 16 bit e una frequenza fotogrammi di 10 Hz.
NOTA: I parametri di registrazione possono essere regolati per allinearsi a specifici requisiti sperimentali. - Acquisire dati spontanei (ad esempio, che coprono 50 s), seguiti dall'infusione graduale della soluzione sperimentale a una velocità adattata all'esperimento (qui, 0,035 mL/s).
NOTA: Al termine dell'esperimento, il topo sarà prontamente soppresso mediante lussazione cervicale in anestesia con isoflurano.
8. Elaborazione e analisi dei dati delle immagini
- Raccogli i dati dell'immagine in 64 x 64 pixel.
- Determina le regioni di interesse (ROI) disegnate a mano utilizzando ImageJ. Fare riferimento all'atlante del cervello del topo per designare le ROI come l'area frontale (M2), l'area somatosensoriale compreso il barile (Somato), l'area occipitale (visiva) e la regione retrospleniale (RSC).
- Utilizza la funzione MATLAB ReadImageJROI per estrarre le coordinate corrispondenti alle ROI. Accedi alla funzione MATLAB tramite il link fornito: https://jp.mathworks.com/matlabcentral/fileexchange/32479-readimagejroi
- Calcola il tasso medio di variazione dell'intensità della fluorescenza all'interno del ROI utilizzando MATLAB.
- Definisci il tasso di variazione dell'intensità della fluorescenza (ΔF/F) con l'equazione (1):
 (1)
(1)
Dove Ft rappresenta il valore dell'intensità della fluorescenza in un momento specifico e il valore medio dell'intensità dall'inizio della registrazione fino a 50 s dall'inizio dell'iniezione è indicato come F0.
- Definisci il tasso di variazione dell'intensità della fluorescenza (ΔF/F) con l'equazione (1):
- Tenere conto del ritardo con cui la soluzione iniettabile raggiunge l'organo. Utilizzare il valore medio dell'intensità che copre i tre secondi dopo l'iniezione come valore di riferimento. Forme d'onda target che superano il valore di intensità basale + 1 SD per l'analisi se si verificano 3 s o più tardi dopo l'iniezione.
Risultati
Imaging del Ca2+ a livello di corteccia transcranica con un topo G7NG817 anestetizzato con isoflurano
Abbiamo creato il catetere seguendo la procedura illustrata in Figura 1. Dopo aver identificato attentamente la posizione dello stomaco, abbiamo attaccato il catetere a quella posizione (Figura 1). Dopo aver concesso un tempo di recupero sufficiente dopo l'inserimento del catetere (circa 48 ore), abbiamo misurato l'attività neurale spontanea in anestesia lieve con isoflurano (0,8-1,0%) per stabilire le variazioni di intensità della fluorescenza al basale per le successive osservazioni di stimolazione intestinale. Di conseguenza, abbiamo confermato i modelli di oscillazione casuali del Ca2+ che attraversavano l'intera corteccia (Figura 2A). La Figura 2 fornisce esempi rappresentativi di attività cerebrale spontanea, con i cateteri inseriti in anticipo. Abbiamo definito il tempo del primo picco transitorio osservabile di Ca2+ nella regione M2 dopo l'iniezione come 0,0 s. La rappresentazione pseudo a colori mostrava il picco di questo transitorio Ca2+ come valore massimo, con il valore medio più una deviazione standard (1 SD) come valore minimo. Era chiaro che gli emisferi sinistro e destro mostravano un'attività sincrona in tutte le regioni.
Successivamente, abbiamo stabilito i ROI per caratterizzare le onde all'interno di ciascuna area funzionale. Come mostrato nella Figura 2B, abbiamo presentato le variazioni temporali del tasso di intensità della fluorescenza per ciascun ROI (Figura 2B). Queste oscillazioni di superficie del Ca2+ osservate hanno seguito un modello di soppressione del burst, alternando periodi di bassa attività e cambiamenti di fluorescenza ad alta ampiezza. Questo modello di attività si allinea con i risultati precedenti che hanno misurato simultaneamente l'EEG della superficie corticale e la dinamica del Ca2+ 26.
Nonostante le fluttuazioni globali o regionali del Ca2+ di superficie tra gli stati di soppressione e di burst, la regione corticale specifica che avvia il picco di calcio può differire. Come riportato in precedenza, quando un segnale stimola una regione corticale locale, ci si aspetta che l'area si attivi, determinando successivamente un cambiamento globale nello stato corticale27,28.
Cambiamenti nella dinamica del Ca2+ della corteccia dopo l'iniezione intragastrica di glucosio
Successivamente, per chiarire come la somministrazione di glucosio o acqua influenzi l'attività corticale, abbiamo monitorato la dinamica del Ca2+ a livello di corteccia durante e dopo l'iniezione. Di conseguenza, abbiamo riscontrato alterazioni nella dinamica corticale del Ca2+ dopo l'iniezione intragastrica di glucosio. In contrasto con l'attività spontanea illustrata in diverse regioni di attivazione corticale, abbiamo osservato un'attivazione immediata nell'area prefrontale o nella corteccia motoria secondaria (M2) dopo l'iniezione diretta di glucosio nell'intestino attraverso il catetere, un effetto non indotto dall'iniezione intragastrica di acqua (Figura 3A-C). Inoltre, abbiamo osservato che questi eventi transitori e prominenti di Ca2+ tendevano a verificarsi continuamente per circa 10 secondi dopo l'iniezione intragastrica di glucosio. Tali fenomeni persistenti non erano evidenti quando veniva somministrata l'acqua (Figura 3D-F).
Gli eventi di Ca2+ in ciascuna ROI sono stati caratterizzati calcolando il rapporto di variazione dell'intensità della fluorescenza, utilizzando la corteccia uditiva (Riferimento) come riferimento, al primo picco che si verifica entro 4-8 s dopo il completamento della somministrazione di glucosio. Di conseguenza, è stato osservato un cambiamento significativo quando il glucosio è stato iniettato dopo aver confrontato la risposta nella regione M2 utilizzando la corteccia uditiva come riferimento prima e dopo l'iniezione.
Al contrario, tale cambiamento non è stato osservato quando l'acqua è stata iniettata (Figura 3G, acqua N = 7: prima dell'iniezione, 2,38 ± 2,53 contro 2,05 ± 1,84, p > 0,05; glucosio N = 7: prima dell'iniezione, 2,48 ± 0,97 contro 3,76 ± 2,76, p < 0,01, test del grado firmato di Wilcoxon). Successivamente, definendo i livelli di attivazione in ciascuna regione corticale dal rapporto tra il valore di dopo l'iniezione e prima dell'iniezione, è stata osservata una differenza significativa solo nella regione M2 (Figura 3H, M2: 0,92 ± 0,89 vs. 1,30 ± 0,32, p = 0,006; Somato: 0,95 ± 0,076 contro 1,04 ± 0,13, p = 0,27; Visivo: 0,92 ± 0,3 contro 1,00 ± 0,06, p = 0,89; RSC: 0,97 ± 0,27 vs. 1,10 ± 0,27, p = 0,60, t-test).
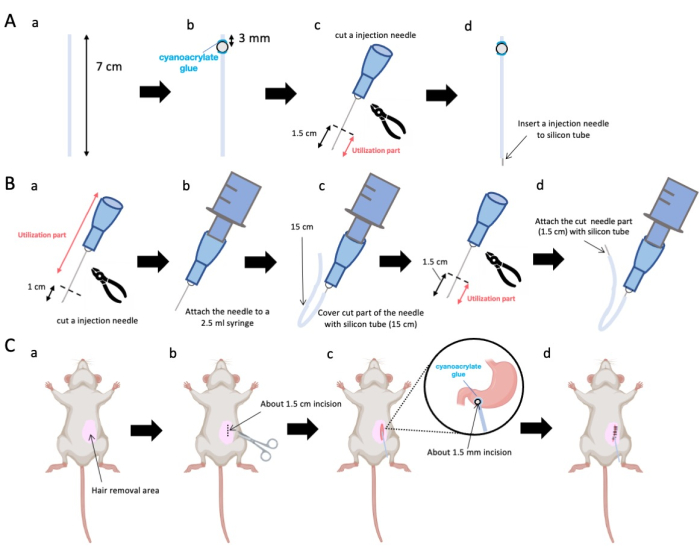
Figura 1: Panoramica del metodo. (A) Creazione del catetere: (a) Tagliare il tubo di silicone. (b) Fissare una perlina di plastica al tubo di silicone utilizzando colla cianoacrilica medica. (c) Tagliare l'ago da 23 G a 1,5 cm dalla punta. (d) Collegare l'estremità tagliata dell'ago al tubo di silicone. (B) Gruppo iniettore: (a) Tagliare un ago per iniezione da 23 G di 1 cm. (b) Collegare l'ago per iniezione tagliato a una siringa da 2,5 mL. (c) Rinfoderare la sezione tagliata dell'ago per iniezione con un tubo di silicone. (d) Tagliare l'ago da 23 G a 1,5 cm dalla punta. (e) Collegare l'estremità tagliata dell'ago al tubo di silicone. (C) Procedura chirurgica: (a) Depilare l'area chirurgica. (b) Incidere la pelle e la parete addominale per una lunghezza di circa 1,5 cm. (c) Creare una piccola perforazione (circa 1,5 mm di diametro) nell'antro pilorico usando le forbici e inserire il catetere (tubo di silicone). Fissare il catetere all'antro pilorico utilizzando colla cianoacrilica medica. (d) Cucire la parete addominale e la pelle utilizzando materiale di sutura in seta 5/0 e ago. Clicca qui per visualizzare una versione più grande di questa figura.
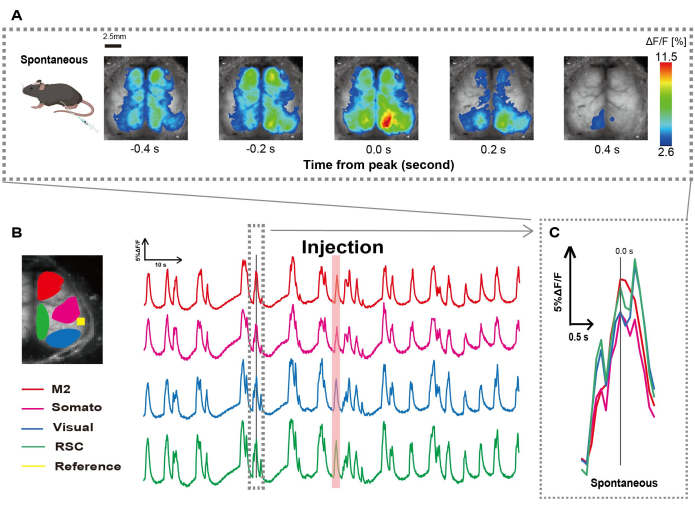
Figura 2: Oscillazioni spontanee del Ca2+ a livello della corteccia in G7NG817 topi con un catetere collegato. (A) Un esempio rappresentativo di oscillazioni del Ca2+ a livello di corteccia visualizzate a intervalli di 0,2 s. Le variazioni dell'intensità della fluorescenza sono rappresentate con una pseudo sovrapposizione di colori. La finestra temporale circondata dalla linea tratteggiata in B mostra il primo transitorio Ca2+ che appare, con il suo picco impostato come tempo 0. La rappresentazione pseudo del colore utilizza il picco di quel transitorio Ca2+ come valore massimo e la media +1 SD come valore minimo. (B) Variazioni delle serie temporali nell'intensità della fluorescenza per ciascun ROI nell'esempio. I colori delle linee corrispondono a diverse aree corticali: il rosso rappresenta M2; il magenta rappresenta l'area somatosensoriale (Somato); il blu rappresenta l'area visiva (Visual); e il verde rappresenta la regione retrospleniale. La striscia color salmone mostra il tempo di iniezione. (C) Un singolo picco all'interno del contorno tratteggiato viene isolato e visualizzato in una vista ingrandita. Abbreviazioni: SD = deviazione standard; ROI = regione di interesse; RSC = regione retrospleniale. Clicca qui per visualizzare una versione più grande di questa figura.
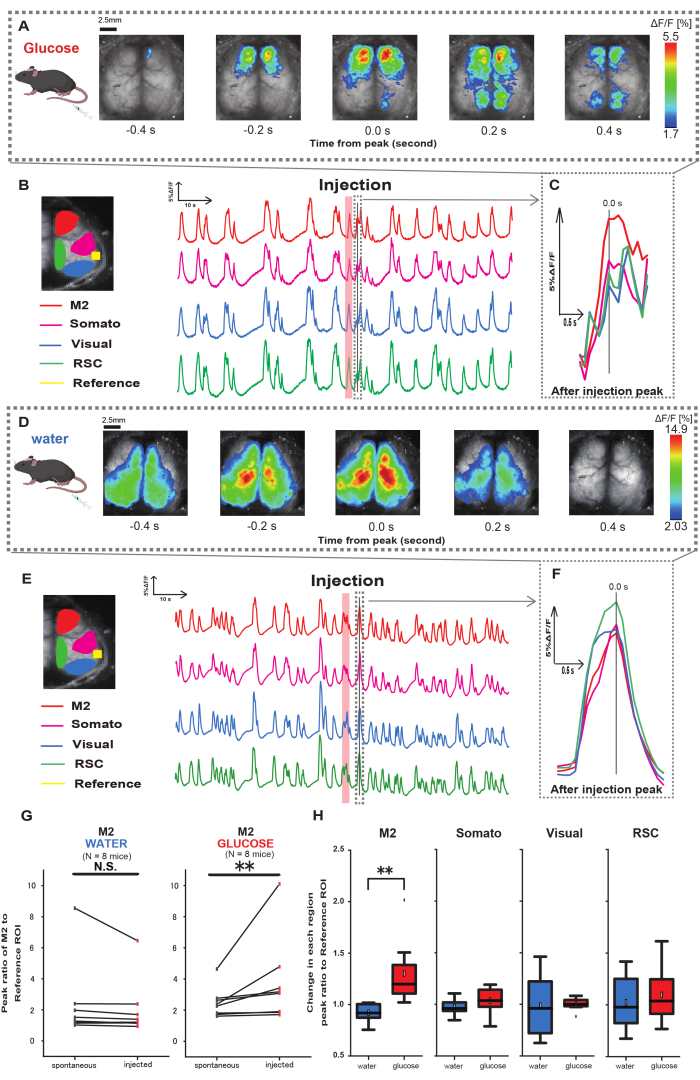
Figura 3: Risposta Ca2+ a livello di corteccia durante/dopo l'iniezione di glucosio o acqua. (A) Un esempio rappresentativo di somministrazione di glucosio visualizzato a intervalli di 0,2 s. Le variazioni dell'intensità della fluorescenza sono rappresentate con una pseudo sovrapposizione di colori. La finestra temporale circondata dalla linea tratteggiata in B mostra il primo transitorio Ca2+ che appare dopo l'iniezione, con il suo picco impostato come tempo 0. La rappresentazione pseudo del colore si basa sul picco del primo transitorio Ca2+ dopo l'iniezione come valore massimo e sulla media +1 SD come valore minimo. (B) Variazioni delle serie temporali dell'intensità di fluorescenza per ogni ROI nell'esempio. I colori delle linee corrispondono a diverse aree corticali: il rosso rappresenta M2, il magenta rappresenta l'area somatosensoriale (Somato), il blu rappresenta l'area visiva (Visual) e il verde rappresenta la regione retrospleniale. (C) Un singolo picco all'interno del contorno tratteggiato viene isolato e visualizzato in una vista ingrandita. L'analisi dell'onda di calcio target è la prima onda che è apparsa entro 4-8 s dopo l'iniezione. (D) Un esempio rappresentativo di iniezione d'acqua come dati di controllo del glucosio. (E) Variazioni delle serie temporali nell'intensità della fluorescenza per ogni ROI nell'esempio. I colori delle linee sono come in B. (F) Un singolo picco all'interno del contorno tratteggiato viene isolato e visualizzato in una vista ingrandita. L'analisi dell'onda di calcio target è la prima onda che è apparsa entro 4-8 s dopo l'iniezione. (G) Confronto tra l'attività spontanea di M2 (prima) e la risposta dopo l'iniezione (iniettata). L'intensità media della fluorescenza cambia nell'arco di 50 s prima dell'iniezione ed è stata calcolata la risposta di picco nella regione M2 tra 4 s e 8 s dopo l'iniezione, utilizzando la corteccia uditiva come riferimento. (H) Confronto dei livelli di attivazione in ciascuna regione corticale quando è stata somministrata acqua o glucosio. Per ciascuna regione è stato calcolato il rapporto tra il valore di dopo l'iniezione e quello di prima dell'iniezione, determinato in G. N.S. rappresenta non significativo (p > 0,05). ** <0,01. Le barre di errore sono definite come l'errore standard della media. Abbreviazioni: SD = deviazione standard; ROI = regione di interesse; RSC = regione retrospleniale. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo articolo illustra come collegare un catetere all'intestino e osservare i segnali di Ca2+ a livello di corteccia transcranica con topi transgenici che esprimono un indicatore di Ca2+ geneticamente codificato. In questo esperimento, non abbiamo ottenuto i dati di imaging che utilizzano una lunghezza d'onda secondaria della sorgente luminosa. Questo perché i topi transgenici che abbiamo impiegato in questo studio mostrano un tasso di variazione dell'intensità della fluorescenza molto elevato (~ diverse decine di punti percentuali) in risposta a stimoli sensoriali a causa delle proprietà della proteina indicatore Ca2+ (G-CaMP7) impiegata. Quindi, abbiamo pensato che la contaminazione da emodinamica fosse trascurabile. Inoltre, le risposte neurali su cui ci siamo concentrati si sono verificate rapidamente in pochi secondi, quindi abbiamo ritenuto non necessario tenere conto dell'iperemia funzionale locale generata successivamente. Questo metodo di impianto del catetere è in grado di combinarsi con altri topi geneticamente modificati per osservare l'attività neuronale in altre regioni del cervello e su scale temporali diverse. Tuttavia, se vengono utilizzati altri topi geneticamente modificati, dovrebbe essere eseguito l'esperimento di controllo sopra descritto.
Questo metodo di collegamento del catetere all'intestino è adatto per l'iniezione di una singola dose a basso costo ed è facile e meno invasivo rispetto al metodo proposto in precedenza29. Tradizionalmente, il cotone assorbente viene applicato all'organo digestivo e suturato. Tuttavia, la sutura può compromettere il recupero post-operatorio nei topi. Pertanto, abbiamo adottato il metodo di fissaggio. Il motivo per cui abbiamo scelto le perline di plastica è che aderiscono meglio al silicone con la colla cianoacrilica che usiamo.
È stato tradizionalmente postulato che il cervello percepisca il glucosio in base all'aumento dei livelli plasmatici di glucosio nel sangue e al concomitante rilascio di ormoni. Di conseguenza, il cervello impiega da diversi minuti a ore per rilevare il glucosio dopo il suo assorbimento dall'intestino4. Alcune ricerche hanno suggerito che il rilevamento intestinale controlla la preferenza gustativa dei topi oltre alla ricezione orale del gusto dolce 1,3,17,22. Come esempio illustrativo, i ricercatori hanno fornito prove che la soluzione non nutritiva aromatizzata accoppiata con glucosio intragastrico (IG) e la soluzione non nutritiva aromatizzata accoppiata con α-metil-d-glucopiranoside (MDG) non metabolizzabile possono suscitare la preferenza per ciascuna soluzione non nutritiva aromatizzata rispetto al gruppo IG accoppiato con acqua. Poiché l'iniezione intraperitoneale di glucosio non stimolava l'assunzione di soluzione non nutritiva30, si prevedeva che il rilevamento dei nutrienti intestinali avrebbe svolto un ruolo cruciale nelle scelte alimentari dei topi 1,19,22.
Un recente studio ha rivelato la presenza di una cellula elettricamente eccitabile nell'intestino, denominata "cellula neuropode", che impiega recettori molecolari per rilevare e trasdurre stimoli sensoriali su un nervo vago tramite una sinapsi glutammatergica. Mentre studi precedenti si sono concentrati principalmente sul ruolo del GLP-1 nel controllo dell'alimentazione alimentare dei topi, recenti indagini hanno dimostrato che l'attivazione del nervo vago da parte delle cellule neuropodi modula l'appetito del topo. Il nervo vago attiva successivamente il Nucleo Tractus Solitarius, portando alla successiva attivazione dei neuroni dopaminergici19. Tuttavia, non è noto se l'attivazione dei neuroni dopaminergici attivi anche la corteccia. Per classificare le risposte cerebrali dopo l'infusione intragastrica di glucosio, abbiamo perfezionato la tecnica di attacco del catetere per scopi di imaging. Quando si impiega questa tecnologia, è imperativo prestare attenzione per prevenire danni agli organi, con particolare riguardo al fegato, che è suscettibile di lesioni durante la manipolazione necessaria per accertare la posizione dello stomaco.
I nostri risultati indicano che l'iniezione intragastrica di glucosio attiva la corteccia prefrontale in pochi secondi. Tuttavia, la somministrazione intragastrica di glucosio avvia contemporaneamente più vie di segnalazione, come le vie ormonali, il nervo vago e il nervo afferente spinale. Questi segnali vengono elaborati nel tronco encefalico su scale temporali diverse. Pertanto, gli studi futuri dovrebbero esplorare il modo in cui questi intricati segnali vengono elaborati e integrati all'interno del cervello.
Inoltre, la linea di topi transgenici BAC GLT-1-G-CaMP7 che abbiamo impiegato nel presente studio esprime il sensore di Ca2+ , G-CaMP7, sia nei neuroni che negli astrociti. In linea di principio, l'aumento prefrontale del Ca2+ ottenuto dall'imaging del Ca2+ nell'ampia corteccia transcranica deriva da neuroni e/o astrociti. Tuttavia, poiché gli astrociti esprimono recettori della dopamina se è coinvolta la segnalazione della dopamina, suggerisce la potenziale attivazione della segnalazione astrocitaria IP3/Ca2+ . Poiché la segnalazione astrocitica IP3/Ca2+ regola la plasticità sinaptica, può anche svolgere un ruolo importante nei cambiamenti nella preferenza per il saccarosio e nelle alterazioni del comportamento alimentare dopo la ricezione del glucosio. Di conseguenza, l'imaging a risoluzione cellulare utilizzando la microscopia a due fotoni sarebbe necessario per identificare se la risposta osservata nella corteccia prefrontale dopo la somministrazione di glucosio ha avuto origine da neuroni o astrociti in studi futuri. Un altro metodo efficace consiste nell'osservare l'espressione dell'indicatore Ca2+ cellulo-specifico nei topi utilizzando virus adeno-associati (AAV) attraverso la fotometria delle fibre. Inoltre, è necessario verificare, utilizzando tecniche elettrofisiologiche, se lo stimolo glicemico all'intestino abbia realmente stimolato il nervo vago. Se le cellule neuropodi trasmettono segnali al nervo vago ricevendo glucosio, non prevediamo alcuna risposta dal nervo vago quando viene somministrato un inibitore SGLT-1. Infine, sarebbe necessaria una validazione utilizzando vari antagonisti del recettore della dopamina per confermare se le proiezioni del nervo vago al nucleo tractus solitarii (NTS) attivassero i neuroni dopaminergici, aumentando i segnali Ca2+ della corteccia prefrontale. Nel complesso, questo sistema consente un'indagine completa degli effetti della rapida trasmissione neurale dall'intestino al cervello. Presenta una metodologia molto promettente che potrebbe potenzialmente chiarire i meccanismi, come il modo in cui lo stress altera la preferenza per il saccarosio per quanto riguarda le interazioni intestino-cervello.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dall'Università di Ochanomizu, dalle sovvenzioni KAKENHI (18K14859, 20K15895), dal programma JST FOREST, dal numero di sovvenzione JPMJFR204G, dalla Fondazione di ricerca per l'optoscienza e la tecnologia, dal Consiglio di ricerca Kao per lo studio delle scienze sanitarie, dall'Associazione giapponese per l'innovazione chimica e dalla fondazione per le scienze della vita TEROMO. L'autore ringrazia il Dr. Takashi Tsuboi, Kazuki Harada e Akiyo Natsubori per la loro supervisione degli esperimenti. L'autore ringrazia anche i membri del laboratorio per il loro supporto.
Materiali
| Name | Company | Catalog Number | Comments |
| 2.5 mL TERUMO syringe | TERUMO | ss-02Sz | |
| 23 G injection needle | TERUMO | 4987350390691 | |
| Anesthetic (ISOFLURANE Inhalation Solution) | viatris | 871119 | |
| cotton swab | local company | ||
| Cyanoacrylate glue (AronArufa A) | TOAGOSEI | 7990700Q1022 | |
| dental acrylic cement C&B | Sun Medical | 221AABZX00115000 | |
| Depilatory cream | Kracie | local company | |
| Digital CMOS camera | Hamamatsu Photonics | ORCA-Spark | |
| Ear bar | NARISHIGE | EB-5N | |
| Filter set (U-MWB2) | Evident | U-MWB2 | |
| Fine Scissors | Fine Dcience Tools | 14040-10 | |
| G7NG817 mice | RIKEN BRC | RBRC09650 | |
| Image software | Hamamatsu Photonics | HC Image software | |
| Isoflurane vapolizer | shinanoseisakusyo | SN-487-0T | |
| Light source (U-HGLGPS) | Evident | U-HGLGPS | |
| microscopy (MVX10) | Evident | ||
| Plastic beads (inner diameter 3 mm, outer diameter 5 mm) | local company | ||
| Pliers | local company | ||
| Polydioxanone suture, monodiox | Alfresa Pharma | HR1305MV45-KF2R | This absorbable, monofilament PDS suture is employed for closing the surgical incision |
| Round ended forceps | F.S.T. | 11617-12 | |
| saline | Otsuka Pharmaceutical Factory | 35061311 | |
| Silicon tube (inner diameter 0.5 mm, outer diameter 1.0 mm) | AS ONE CORPORATIO | 33151413 | local company |
| small surgery needle | Natsume Seisakusho Co., Ltd. | AC03DNT | |
| Stereotaxic stage | NARISHIGE | MA-6N | |
| Xylocaine Jelly 2% | Sandoz K.K. | 614429303 | This jelly is used as a local analgesic to alleviate surgical pain |
Riferimenti
- Buchanan, K. L., et al. The preference for sugar over sweetener depends on a gut sensor cell. Nature Neuroscience. 25 (2), 191-200 (2022).
- Reimann, F. Molecular mechanisms underlying nutrient detection by incretin-secreting cells. International Dairy Journal. 20 (4), 236-242 (2010).
- Kreuch, D., et al. Gut mechanisms linking intestinal sweet sensing to glycemic control. Frontiers in Endocrinology. 9, 741 (2018).
- Gorboulev, V., et al. Na(+)-D-glucose cotransporter SGLT1 is pivotal for intestinal glucose absorption and glucose-dependent incretin secretion. Diabetes. 61 (1), 187-196 (2012).
- Harada, N., Inagaki, N. Role of sodium-glucose transporters in glucose uptake of the intestine and kidney. Journal of Diabetes Investigation. 3 (4), 352-353 (2012).
- Kaelberer, M. M., Rupprecht, L. E., Liu, W. W., Weng, P., Bohórquez, D. V. Neuropod cells: The emerging biology of gut-brain sensory transduction. Annual Review of Neuroscience. 43, 337-353 (2020).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Larsen, P. J., Tang-Christensen, M., Jessop, D. S. Central administration of glucagon-like peptide-1 activates hypothalamic neuroendocrine neurons in the rat. Endocrinology. 138 (10), 4445-4455 (1997).
- Alhadeff, A. L., Rupprecht, L. E., Hayes, M. R. GLP-1 neurons in the nucleus of the solitary tract project directly to the ventral tegmental area and nucleus accumbens to control for food intake. Endocrinology. 153 (2), 647-658 (2012).
- Raybould, H. E. Gut chemosensing: interactions between gut endocrine cells and visceral afferents. Autonomic Neuroscience: Basic & Clinical. 153 (1-2), 41-46 (2010).
- Routh, V. H. Glucose-sensing neurons: are they physiologically relevant. Physiology & Behavior. 76 (3), 403-413 (2002).
- Secher, A., et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. The Journal of Clinical Investigation. 124 (10), 4473-4488 (2014).
- Williams, E. K., et al. Sensory neurons that detect stretch and nutrients in the digestive system. Cell. 166 (1), 209-221 (2016).
- Borgmann, D., et al. Gut-brain communication by distinct sensory neurons differently controls feeding and glucose metabolism. Cell Metabolism. 33 (7), 1466-1482.e7 (2021).
- Krashes, M. J., et al. Rapid, reversible activation of AgRP neurons drives feeding behavior in mice. The Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- Aponte, Y., Atasoy, D., Sternson, S. M. AGRP neurons are sufficient to orchestrate feeding behavior rapidly and without training. Nature Neuroscience. 14 (3), 351-355 (2011).
- Zhang, L., Han, W., Lin, C., Li, F., de Araujo, I. E. Sugar metabolism regulates flavor preferences and portal glucose sensing. Frontiers in Integrative Neuroscience. 12, 57 (2018).
- Goldstein, ., et al. Hypothalamic detection of macronutrients via multiple gut-brain pathways. Cell Metabolism. 33 (3), 676-687.e5 (2021).
- Fernandes, A. B., et al. Postingestive modulation of food seeking depends on vagus-mediated dopamine neuron activity. Neuron. 106 (5), 778-788.e6 (2020).
- Kaelberer, M. M., et al. . A gut-brain neural circuit for nutrient sensory transduction. 361 (6408), eaat5236 (2018).
- Bohórquez, D. V., et al. Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. The Journal of Clinical Investigation. 125 (2), 782-786 (2015).
- Tan, H. -. E., et al. The gut-brain axis mediates sugar preference. Nature. 580 (7804), 511-516 (2020).
- Wang, D., et al. Whole-brain mapping of the direct inputs and axonal projections of POMC and AgRP neurons. Frontiers in Neuroanatomy. 9, 40 (2015).
- Yamada, S., Wang, Y., Monai, H. Transcranial cortex-wide Ca2+ imaging for the functional mapping of cortical dynamics. Frontiers in Neuroscience. 17, 1119793 (2023).
- Monai, H., et al. Calcium imaging reveals glial involvement in transcranial direct current stimulation-induced plasticity in mouse brain. Nature Communications. 7 (1), 11100 (2016).
- Ferron, J. -. F., Kroeger, D., Chever, O., Amzica, F. Cortical Inhibition during Burst Suppression Induced with Isoflurane Anesthesia. The Journal of Neuroscience. 29 (31), 9850-9860 (2009).
- Ming, Q., et al. Isoflurane-induced burst suppression is a thalamus-modulated, focal-Onset rhythm with persistent local asynchrony and variable propagation patterns in rats. Frontiers in Systems Neuroscience. 14, 599781 (2021).
- Schwalm, M., et al. Functional states shape the spatiotemporal representation of local and cortex-wide neural activity in mouse sensory cortex. Journal of Neurophysiology. 128 (4), 763-777 (2022).
- Ueno, A., et al. Mouse intragastric infusion (iG) model. Nature Protocols. 7 (4), 771-781 (2012).
- Zukerman, S., Ackroff, K., Sclafani, A. Post-oral glucose stimulation of intake and conditioned flavor preference in C57BL/6J mice: A concentration-response study. Physiology & Behavior. 109, 33-41 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon