Method Article
Analyse en temps réel de la communication neuronale intestin-cerveau : dynamique du calcium à l’échelle du cortex en réponse à la stimulation intestinale du glucose
Dans cet article
Résumé
La communication intestin-cerveau, facilitée par le nerf vague, est cruciale pour la communication entre le système endocrinien gastro-intestinal et le cerveau. Cependant, on ne sait toujours pas si l’injection intragastrique de glucose peut modifier l’activité corticale. Ici, nous proposons un protocole complet pour observer les changements de l’activité corticale après l’injection de glucose dans le duodénum.
Résumé
La communication entre le tractus gastro-intestinal et le cerveau après l’absorption des nutriments joue un rôle essentiel dans les préférences alimentaires, le métabolisme et les comportements alimentaires. En ce qui concerne plus particulièrement des nutriments spécifiques, de nombreuses études ont permis d’élucider que l’assimilation du glucose dans les cellules épithéliales intestinales déclenche l’activation de nombreuses molécules de signalisation. Les hormones telles que le glucagon-like peptide-1 sont réputées être des médiateurs de signalisation par excellence. Étant donné que les hormones influencent principalement le cerveau par les voies circulatoires, elles modulent lentement l’activité cérébrale.
Cependant, des études récentes ont montré deux voies intestin-cerveau rapides facilitées par le système nerveux autonome. L’un fonctionne via la voie neuronale afférente de la colonne vertébrale, tandis que le nerf vague médie l’autre. Par conséquent, les réponses cérébrales suite à l’assimilation du glucose dans le tractus gastro-intestinal sont compliquées. De plus, comme la stimulation intestinale induit finalement diverses activités corticales, y compris des réponses sensorielles, nociceptives, de récompense et motrices, il est nécessaire d’utiliser des méthodologies qui facilitent la visualisation des circuits cérébraux localisés et des activités pan-corticales pour comprendre pleinement la transmission neuronale intestin-cerveau. Certaines études ont indiqué des altérations précipitées des concentrations d’ions calcium (Ca2+) dans l’hypothalamus et l’aire tegmentale ventrale indépendamment par différentes voies après la stimulation intestinale. Cependant, on ne sait pas s’il y a des changements dans l’activité du cortex cérébral.
Pour observer l’activité du cortex cérébral après une injection intragastrique de glucose, nous avons développé une technique d’imagerie pour la visualisation en temps réel de la dynamique du Ca2+ à l’échelle du cortex à travers un crâne entièrement intact, en utilisant des souris transgéniques exprimant des indicateurs de Ca2+ génétiquement codés. Cette étude présente un protocole complet pour une technique conçue pour surveillerl’imagerie transcrânienne du cortex transcrânien induite par la stimulation intestinale après une injection intragastrique de glucose via un cathéter implanté. Les données préliminaires suggèrent que l’administration d’une solution de glucose dans l’intestin active le cortex frontal, qui ne répond pas à l’administration d’eau.
Introduction
Principalement, la détection intestinale du glucose se produit via les récepteurs du goût sucré (Tas1r2, Tas1r3) et le cotransporteur sodium-glucose 1 (SGLT-1) situés dans les cellules entéroendocrines de la lumière intestinale 1,2,3,4,5,6. La sensation de glucose dans le cerveau est un processus qui s’étend généralement de quelques minutes à quelques heures après son absorption par l’intestin, un phénomène principalement basé sur une augmentation des taux de sucre plasmatique dans le sang et la libération d’hormones 7,8,9,10,11 (par exemple, le glucagon-like peptide-1 [GLP-1], le peptide YY (PYY) et le polypeptide insulinotrope dépendant du glucose [GIP]). Ils atteignent le noyau arqué de l’hypothalamus (ARC), où ils lient les neurones pro-opiomélanocortine (POMC) et les neurones de la protéine liée à l’agouti (AgRP) par le flux sanguin et le nerf vague (nerf parasympathique)12,13,14. Le changement dans l’activité de ces neurones conduit au contrôle du métabolisme et du comportement alimentaire15,16.
La littérature récente souligne de plus en plus l’importance de la signalisation neuronale intestin-cerveau après l’absorption du glucose. Cette voie complexe peut être largement classée en deux mécanismes principaux. La première implique l’activation des afférences vertébrales, influençant finalement l’activité neuronale de l’AgRP dans l’ARC. Le deuxième mécanisme implique la stimulation du nerf vague par des connexions avec les cellules épithéliales. Étant donné les multiples facettes dont les cellules épithéliales intestinales peuvent activer le nerf vague13, son rôle est considéré comme polyvalent.
Une proportion importante des activités du nerf vague intestinal et du nerf afférent rachidien est associée aux comportements alimentaires 17,18,19. Cependant, de nouvelles preuves suggèrent que certaines fibres nerveuses vagues, projetées vers les « cellules de neuropodes », sont impliquées dans la préférence pour le glucose. Les cellules neuropodes, un sous-ensemble des cellules entéroendocrines, expriment SGLT-1 sur leur face luminale et transmettent des stimuli sensoriels à un nerf vague via les synapses glutamatergiques 2,20,21,22. L’activation du nerf vague déclenche les neurones dopaminergiques dans l’aire tegmentale ventrale (ATV) en quelques secondes19. Notamment, l’inhibition de l’activation vagale, en particulier dans le duodénum, à l’aide d’un antagoniste du glutamate réduit la préférence pour le saccharose chez la souris1. Cela souligne le rôle essentiel de l’activation des cellules des neuropodes dans la modulation du comportement de choix alimentaire après l’apport en glucose2.
Malgré ces progrès, une compréhension approfondie des mécanismes de détection rapide du glucose intestinal et de leur effet sur les activités corticales reste une énigme complexe. Bien que l’activation cérébrale contrôlée par les neurones AgRP n’inclue pas le cortex cérébral23, on sait que les neurones dopaminergiques de l’ATV projettent vers le cortex cérébral. Cependant, on ne sait pas si l’activation neuronale dopaminergique rapide de l’ATV après la détection du glucose active réellement le cortex cérébral. Pour élucider ce mécanisme, nous avons étudié le potentiel de l’administration intragastrique de glucose pour influencer rapidement la dynamique corticale du Ca2+ chez des souris transgéniques exprimant un indicateur calcique génétiquement codé.
Cet article présente une méthode peu coûteuse et moins invasive pour comprendre de manière exhaustive les changements de l’activité corticale après l’administration intragastrique de glucose à l’aide de l’imagerie Ca2+ à l’échelle du cortex chez la souris Récemment, la technique d’imagerie Ca2+ à l’échelle du cortex transcrânien à travers un crâne intact, en utilisant des souris transgéniques exprimant des indicateurs de calcium génétiquement codés, a gagné en popularité24. Notamment, la lignée de souris transgénique BAC GLT-1-G-CaMP7 #817 (également connue sous le nom de souris G7NG817) utilisée dans cette étude exprime le capteur Ca2+ , G-CaMP7, dans les neurones et les astrocytes25. En raison de sa forte densité d’expression dans le cortex cérébral, cette lignée de souris transgéniques est particulièrement adaptée à l’imagerie Ca2+ à l’échelle du cortex transcrânien à l’aide d’un microscope à épifluorescence standard.
Protocole
Tous les protocoles expérimentaux ont été approuvés par le Comité institutionnel de soin et d’utilisation des animaux de l’Université d’Ochanomizu, au Japon (protocoles d’étude sur les animaux 22017). Toutes les expériences sur les animaux ont été effectuées conformément aux directives pour l’expérimentation animale de l’Université d’Ochanomizu qui sont conformes aux Directives fondamentales pour la bonne conduite de l’expérimentation animale et des activités connexes dans les institutions de recherche universitaires (Ministère de l’éducation, de la culture, des sports, de la science et de la technologie, Japon). Des efforts ont été déployés pour minimiser le nombre d’animaux utilisés. Cette étude a été réalisée dans le respect des directives ARRIVE.
1. Préparation de souris transgéniques
- Pour suivre cette expérience, utilisez la lignée de souris transgéniques BAC GLT-1-G-CaMP7 #817 mâles et femelles adultes, à savoir G7NG817 souris 24,25 (âgées de plus de 8 semaines). La souche de fond de G7NG817 souris25 est C57BL/6J.
- Placez les souris sous un cycle lumière/obscurité de 12 h / 12 h et élevez-les en groupes de jusqu’à cinq souris.
2. Création d’un cathéter
- À l’aide de ciseaux, ajustez le tube en silicone (diamètre intérieur 0,5 mm, diamètre extérieur 1,0 mm) à une longueur précise de 7 cm (Figure 1A-a).
REMARQUE : Avant les procédures, les ciseaux et le tube de silicone ont été stérilisés. - Collez de minuscules billes de plastique (diamètre intérieur 3 mm, diamètre extérieur 5 mm) sur le tube adapté, en veillant à ce qu’elles soient situées à 3 mm de son extrémité (figure 1A-b). Fixez solidement les billes à l’aide de colle cyanoacrylate (les variantes médicales ou standard sont acceptables).
- Exciser l’apex d’une aiguille de 23 G et couper ensuite à 1,5 cm de l’extrémité de l’aiguille (figure 1A-c).
- Introduisez l’aiguille 23 G sectionnée de l’étape 2.3 dans l’extrémité du tube en silicone, à l’opposé de l’endroit où les billes ont été fixées (Figure 1A-d).
3. Création d’injecteurs
- À l’aide d’une pince stérile, exciser à 1 cm de la pointe de l’aiguille (figure 1B-a).
REMARQUE : Assurez-vous que l’orifice à l’extrémité sectionnée conserve son intégrité et ne se déforme pas, car toute distorsion pourrait obstruer l’écoulement de la solution d’injection. - Couplage de l’aiguille d’injection de 23 G adaptée de l’étape 3.1.1 à une seringue de 2,5 mL (figure 1B-b).
- Segmentez un tube de silicium à la longueur requise (un tube de silicium de 15 cm dans cette expérience) et gainez-le sur l’aiguille d’injection de 23 G (Figure 1B-c).
REMARQUE : Le volume de solution distribué fluctuera en fonction de la longueur du tube. Par exemple, avec un tube de 15 cm, environ 50 μL de solution persisteront après l’expérience. - Coupez l’aiguille d’injection de 23 G à 1,5 cm de la pointe de l’aiguille.
- Joignez la partie sectionnée de l’étape 3.4 avec le cathéter en silicium façonné à l’étape 3.3 (Figure 1B-d).
REMARQUE : Assurez-vous que les orifices créés aux étapes 3.1 et 3.4 ne sont pas déformés après l’incision. Si une rectification est nécessaire, utilisez des pinces pour restaurer sa configuration circulaire.
4. Localisation gastrique
- Administrer l’anesthésie à la souris par inhalation d’isoflurane à 3,0 % dans une chambre spécifiée. Appliquez une pommade ophtalmique pour prévenir la sécheresse oculaire.
- Transférez délicatement la souris anesthésiée de la chambre d’inhalation à la table d’opération après avoir vérifié l’état anesthésié de la souris. Fournir un soutien thermique tout au long de la procédure.
- Posez la souris en décubitus dorsal, en alignant sa bouche à proximité de l’appareil d’inhalation, et modulez la concentration d’isoflurane de 3,0 % à 2,0 %.
REMARQUE : Dégagez le segment inférieur du masque d’isoflurane de son homologue supérieur et ancrez le masque séparé (segment supérieur) à la table chirurgicale à l’aide de ruban adhésif. - Complétez la cavité buccale, les membres antérieurs et les membres postérieurs de la souris sur la table d’opération à l’aide de ruban adhésif.
REMARQUE : En fixant la souris à la table, les erreurs chirurgicales dues au mouvement peuvent être évitées même si la souris est anesthésiée. - Retirez les poils de la souris de la partie supérieure gauche de l’abdomen (150 % de la zone autour du site chirurgical) à l’aide d’une crème dépilatoire. Appliquez un analgésique local par voie topique sur le site de la chirurgie et attendez 5 minutes avant de procéder.
- Appliquez un gel anesthésique local sur la peau abdominale et attendez 5 à 10 min. Ensuite, désinfectez la zone chirurgicale 3 fois avec une alternance d’iodophores et d’éthanol à 70%. Confirmez la profondeur de l’anesthésie à l’aide d’un pincement des orteils et couvrez l’animal avec des champs chirurgicaux stériles. Faites une incision cutanée d’environ 1,5 cm de longueur (figure 1C-b), située à 1 cm à droite de la médiane abdominale et à 5 mm sous l’apophyse xiphoïde (figure 1C-c). Ensuite, créez une incision de 1,5 cm dans la paroi abdominale au même endroit que l’incision cutanée initiale.
REMARQUE : Faites preuve de prudence pour éviter d’infliger des dommages au foie sous-jacent. - Repositionnez délicatement le lobe hépatique gauche latéralement à l’aide d’une pince à bout émoussé, en révélant l’estomac en dessous.
5. Insertion du cathéter
- Surélevez l’estomac et extirpez-le prudemment par l’incision.
REMARQUE : Faites preuve du plus grand soin pour préserver l’intégrité des organes adjacents, notamment le foie, et évitez d’exercer une force excessive sur l’estomac. - À l’aide de ciseaux, vous créez une petite perforation (environ 1,5 mm de diamètre) dans l’antre du pylore.
- Introduisez l’extrémité du cathéter dans la perforation, en vous assurant que la bille est en contact direct avec l’antre pylorique.
REMARQUE : Le cathéter est désinfecté avec une solution de gluconate de chlorhexidine à 0,1 à 0,5 % avant l’insertion. - Collez la perle du cathéter sur l’estomac à l’aide d’une colle cyanoacrylate de qualité médicale.
REMARQUE : Assurez-vous que l’estomac reste non attaché aux organes environnants. - Vérifiez l’attachement ferme du cathéter à l’estomac, puis repositionnez délicatement l’estomac à sa position innée sous le lobe hépatique gauche.
- Coudre la paroi abdominale, permettant au cathéter de s’étendre vers l’extérieur, à l’aide d’une suture en polydioxanone (PDS). Après cela, fermez l’incision cutanée d’une manière analogue à la fermeture abdominale.
- Repositionnez doucement la souris dans une cage aseptisée.
REMARQUE : Les souris postopératoires doivent être logées individuellement. Appliquez un analgésique local localement sur la fermeture de la plaie et suivez les plans analgésiques recommandés par les directives de l’établissement local. - Prévoyez une période de récupération minimale de 48 h dans un environnement standard.
REMARQUE : Une extrémité du cathéter inséré dans l’estomac de la souris est fermée avec une aiguille 23G avec une pointe scellée pour empêcher l’entrée de substances étrangères et pour éviter de mordre. Comme le cathéter qui dépasse de l’abdomen est court, il empêche la souris de le traîner à travers la litière, ce qui pourrait le faire s’ouvrir ou s’emmêler.
6. Préparation à l’imagerie transcrânienne in vivo Ca2+
- Administrer une anesthésie à la souris à l’aide d’isoflurane (induction à 2 % ; entretien entre 0,8 % et 1,0 %).
- Fixez la souris sur une plate-forme stéréotaxique à l’aide de barres d’oreille auxiliaires pour atténuer les effets de la pulsation et de la respiration. Par la suite, placez la souris sous un stéréomicroscope à fluorescence.
- Utiliser un ensemble de filtres de fluorescence bleue à large bande (avec excitation à 460-490 nm et émission à 520 nm) en conjonction avec une source lumineuse au mercure.
- Capturez les images à l’aide d’un appareil photo et traitez-les à l’aide du logiciel d’imagerie désigné.
- Retirez soigneusement les poils du cuir chevelu à l’aide d’un rasoir électrique ou d’une crème dépilatoire.
REMARQUE : Si vous utilisez un rasoir, assurez-vous qu’il est soigneusement désinfecté et veillez à ne pas couper la peau. - Désinfectez la surface du cuir chevelu à l’aide d’un coton-tige ou d’un outil similaire avec une solution de gluconate de chlorhexidine diluée à 0,1-0,5%. Ensuite, désinfectez avec de l’alcool et répétez cette alternance 3 fois.
- Appliquez un gel anesthésique local et attendez 5 à 10 minutes.
- Préparez-vous à appliquer du ciment acrylique dentaire.
- Utilisez une lame de scalpel stérile pour couper le cuir chevelu. Soit vous enlevez complètement le cuir chevelu, soit vous faites une coupe franche de l’arrière de la tête vers le front.
- Utilisez des clips pour exposer le crâne en étendant tout excès de peau.
- Utilisez un coton-tige pour retirer le tissu conjonctif du périoste.
- Appliquez immédiatement le ciment acrylique après avoir retiré le périoste. Agissez rapidement pour éviter que la surface du crâne ne devienne opaque en raison de l’évaporation de l’os exposé.
- Attendez environ 5 minutes que le ciment sèche.
7. Imagerie transcrânienne Ca2+ avec administration intraduodénale de glucose
- Équilibrer à la fois la solution expérimentale et la solution saline à la température ambiante. Soumettez les souris à une restriction alimentaire pendant une durée déterminée (par exemple, 2 h).
- Purger tout contenu résiduel à l’intérieur du cathéter côté souris à l’aide de ~0,03 mL de solution saline avant de commencer l’injection.
- Aspirez la solution expérimentale (par exemple, une solution de glucose à 10 % préparée dans 300 μL d’eau, complétée par 300 μL d’eau supplémentaires) dans la seringue, puis interfacez-la avec le cathéter. Déterminez le dosage optimal de la solution adapté à l’objectif expérimental spécifique.
REMARQUE : Pendant cette phase, faites preuve de prudence pour éviter une tension excessive sur le cathéter, ce qui pourrait compromettre l’anatomie interne de la souris. Essayez de manipuler le tube côté souris avec la plus grande douceur. De plus, assurez-vous que la seringue reste dépourvue d’air après l’aspiration de la solution, car l’air et les bulles emprisonnés pourraient induire une distension gastro-intestinale. - Évaluez l’état physiologique de la souris et activez la fonction d’enregistrement du logiciel d’imagerie en cliquant sur le bouton de processus d’enregistrement de l’application logicielle.
- Capturez des images à une résolution de 512 x 512 pixels, une profondeur de 16 bits et une fréquence d’images de 10 Hz.
REMARQUE : Les paramètres d’enregistrement peuvent être ajustés pour s’aligner sur les exigences expérimentales spécifiques. - Obtenir des données spontanées (p. ex., sur une période de 50 s), suivies de l’infusion progressive de la solution expérimentale à un rythme adapté à l’expérience (ici, 0,035 mL/s).
REMARQUE : À la fin de l’expérience, la souris sera euthanasiée rapidement par luxation cervicale sous anesthésie isoflurane.
8. Traitement et analyse des données d’image
- Regrouper les données d’image en 64 x 64 pixels.
- Déterminez les régions d’intérêt (ROI) dessinées à la main à l’aide d’ImageJ. Reportez-vous à l’atlas du cerveau de la souris pour désigner les zones d’intérêt comme la zone frontale (M2), l’aire somatosensorielle comprenant le tonneau (Somato), la zone occipitale (visuelle) et la région rétrosplénienne (RSC).
- Utilisez la fonction MATLAB ReadImageJROI pour extraire les coordonnées correspondant aux ROI. Accédez à la fonction MATLAB via le lien fourni : https://jp.mathworks.com/matlabcentral/fileexchange/32479-readimagejroi
- Calculez le taux moyen de changement d’intensité de fluorescence dans le ROI à l’aide de MATLAB.
- Définir le taux de variation de l’intensité de fluorescence (ΔF/F) à l’aide de l’équation (1) :
 (1)
(1)
Où Ft représente la valeur de l’intensité de fluorescence à un moment donné et la valeur moyenne de l’intensité depuis le début de l’enregistrement jusqu’à 50 s après le début de l’injection est notée F0.
- Définir le taux de variation de l’intensité de fluorescence (ΔF/F) à l’aide de l’équation (1) :
- Tenez compte du retard dans l’arrivée de la solution d’injection dans l’organe. Utilisez la valeur d’intensité moyenne couvrant les trois secondes suivant l’injection comme référence. Formes d’onde cibles dépassant la valeur d’intensité de base + 1 écart-type pour l’analyse si elles se produisent 3 secondes ou plus après l’injection.
Résultats
Imagerie Ca2+ à l’échelle du cortex transcrânien avec une souris G7NG817 anesthésiée à l’isoflurane
Nous avons créé le cathéter en suivant la procédure illustrée à la figure 1. Après avoir soigneusement identifié la position de l’estomac, nous avons fixé le cathéter à cet endroit (Figure 1). Après avoir laissé un temps de récupération suffisant après l’insertion du cathéter (environ 48 h), nous avons mesuré l’activité neuronale spontanée sous anesthésie légère à l’isoflurane (0,8-1,0%) pour établir les changements d’intensité de fluorescence de base pour les observations ultérieures de stimulation intestinale. En conséquence, nous avons confirmé les modèles d’oscillation aléatoires Ca2+ qui couvraient l’ensemble du cortex (Figure 2A). La figure 2 fournit des exemples représentatifs d’activité cérébrale spontanée, avec les cathéters insérés au préalable. Nous avons défini le temps du premier pic transitoire Ca2+ observable dans la région M2 après l’injection à 0,0 s. La représentation pseudo-couleur affichait le pic de ce transitoire Ca2+ comme valeur maximale, avec la valeur moyenne plus un écart-type (1 ET) comme valeur minimale. Il était clair que les hémisphères gauche et droit présentaient une activité synchrone dans toutes les régions.
Ensuite, nous avons établi des retours sur investissement pour caractériser les ondes au sein de chaque zone fonctionnelle. Comme le montre la figure 2B, nous avons présenté les changements temporels du taux d’intensité de fluorescence pour chaque retour sur investissement (figure 2B). Ces oscillations de surface Ca2+ observées ont suivi un schéma de suppression en rafale, alternant entre des périodes de faible activité et des changements de fluorescence de grande amplitude. Ce modèle d’activité s’aligne sur les résultats précédents qui ont mesuré simultanément l’EEG de surface corticale et la dynamique Ca2+ 26.
Malgré les fluctuations globales ou régionales de Ca2+ de surface entre les états de suppression et d’explosion, la région corticale spécifique à l’origine de la poussée calcique peut différer. Comme indiqué précédemment, lorsqu’un signal stimule une région corticale locale, on s’attend à ce que la zone s’active, entraînant par la suite un changement global de l’état cortical27,28.
Modifications de la dynamique du cortex Ca2+ après injection intragastrique de glucose
Ensuite, pour élucider comment l’administration de glucose ou d’eau influence l’activité corticale, nous avons surveillé la dynamique du Ca2+ à l’échelle du cortex pendant et après l’injection. En conséquence, nous avons constaté des altérations de la dynamique corticale du Ca2+ après une injection intragastrique de glucose. Contrairement à l’activité spontanée illustrée dans diverses régions d’activation corticale, nous avons observé une activation immédiate dans la zone préfrontale ou le cortex moteur secondaire (M2) lors de l’injection directe de glucose dans l’intestin via le cathéter, un effet non induit par l’injection d’eau intragastrique (Figure 3A-C). De plus, nous avons observé que ces événements transitoires et proéminents de Ca2+ avaient tendance à se produire en continu pendant environ 10 secondes après l’injection intragastrique de glucose. De tels phénomènes persistants n’étaient pas apparents lors de l’administration de l’eau (Figure 3D-F).
Les événements Ca2+ dans chaque ROI ont été caractérisés en calculant le rapport du rapport de changement d’intensité de fluorescence, en utilisant le cortex auditif (référence) comme référence, au premier pic survenant dans les 4 à 8 s suivant la fin de l’administration de glucose. En conséquence, un changement significatif a été observé lors de l’injection de glucose après comparaison de la réponse dans la région M2 en utilisant le cortex auditif comme référence avant et après l’injection.
En revanche, aucun changement de ce type n’a été observé lorsque l’eau a été injectée (Figure 3G, eau N = 7 : avant l’injection, 2,38 ± 2,53 ± 1,84, p > 0,05 ; glucose N = 7 : avant l’injection, 2,48 ± 0,97 ± 2,76, p < 0,01, test de Wilcoxon). Ensuite, en définissant les niveaux d’activation dans chaque région corticale par le rapport entre la valeur après injection et la valeur avant injection, une différence significative n’a été observée que dans la région M2 (Figure 3H, M2 : 0,92 ± 0,89 vs. 1,30 ± 0,32, p = 0,006 ; Somato : 0,95 ± 0,076 vs 1,04 ± 0,13, p = 0,27 ; Visuel : 0,92 ± 0,3 vs 1,00 ± 0,06, p = 0,89 ; RSC : 0,97 ± 0,27 vs 1,10 ± 0,27, p = 0,60, test t).
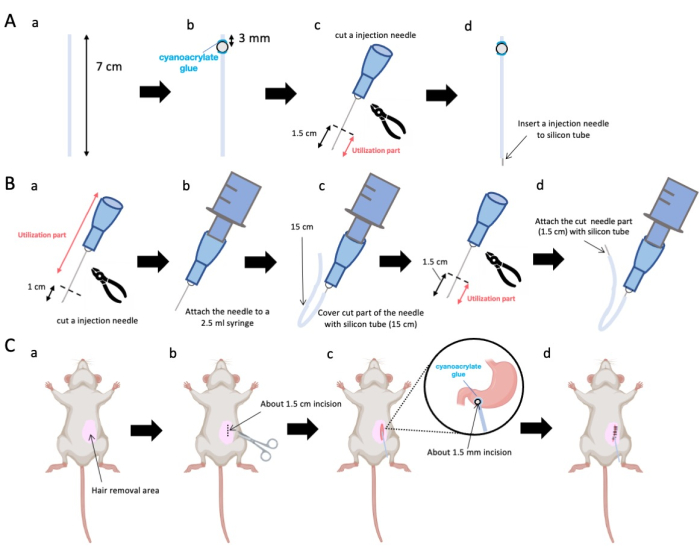
Figure 1 : Vue d’ensemble de la méthode. (A) Création du cathéter : (a) Coupez le tube de silicium. b) Fixer une bille de plastique sur le tube de silicone à l’aide d’une colle médicale cyanoacrylate. (c) Coupez l’aiguille de 23 G à 1,5 cm de la pointe. (d) Fixez l’extrémité coupée de l’aiguille au tube de silicone. (B) Ensemble injecteur : (a) Coupez une aiguille d’injection de 23 G de 1 cm. (b) Connectez l’aiguille d’injection coupée à une seringue de 2,5 mL. c) Engainer la section coupée de l’aiguille d’injection à l’aide d’un tube en silicone. (d) Coupez l’aiguille de 23 G à 1,5 cm de la pointe. (e) Fixez l’extrémité coupée de l’aiguille au tube de silicone. (C) Intervention chirurgicale : (a) Épiler la zone chirurgicale. (b) Inciser la peau et la paroi abdominale sur une longueur d’environ 1,5 cm. (c) Créer une petite perforation (environ 1,5 mm de diamètre) dans l’antre pylorique à l’aide de ciseaux et insérer le cathéter (tube de silicone). Fixez le cathéter à l’antre pylorique à l’aide d’une colle médicale cyanoacrylate. (d) Coudre la paroi abdominale et la peau à l’aide d’un matériau de suture en soie 5/0 et d’une aiguille. Veuillez cliquer ici pour voir une version agrandie de cette figure.
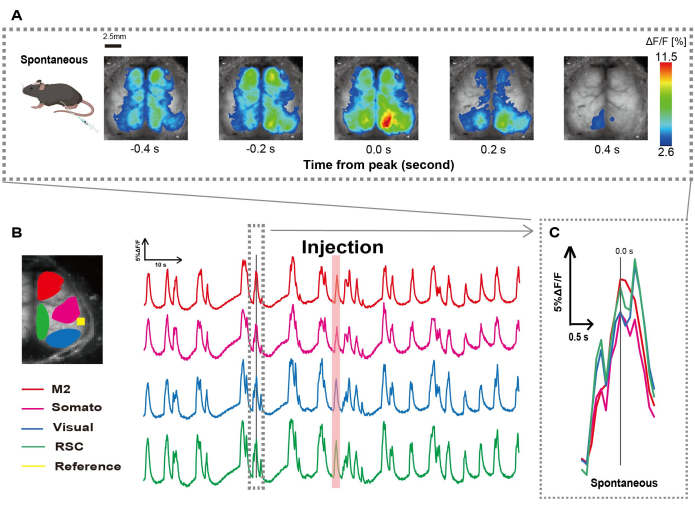
Figure 2 : Oscillations spontanées de Ca2+ à l’échelle du cortex chez G7NG817 souris avec un cathéter attaché. (A) Un exemple représentatif d’oscillations Ca2+ à l’échelle du cortex affichées à des intervalles de 0,2 s. Les changements d’intensité de fluorescence sont représentés par une superposition de pseudo-couleurs. La fenêtre de temps entourée par la ligne pointillée dans B montre le premier transitoire Ca2+ apparaissant, avec son pic défini sur le temps 0. La représentation pseudo-couleur utilise le pic de ce transitoire Ca2+ comme valeur maximale et la moyenne +1 SD comme valeur minimale. (B) Changements de série chronologique de l’intensité de fluorescence pour chaque retour d’intérêt dans l’exemple. Les couleurs des lignes correspondent à différentes zones corticales : le rouge représente M2 ; le magenta représente l’aire somatosensorielle (Somato) ; le bleu représente la zone visuelle (Visuel) ; et le vert représente la région rétro spléniale. La bande de couleur saumon indique le temps d’injection. (C) Un seul pic à l’intérieur du contour pointillé est isolé et affiché dans une vue agrandie. Abréviations : ET = écart-type ; ROI = région d’intérêt ; RSC = région rétro spléniale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
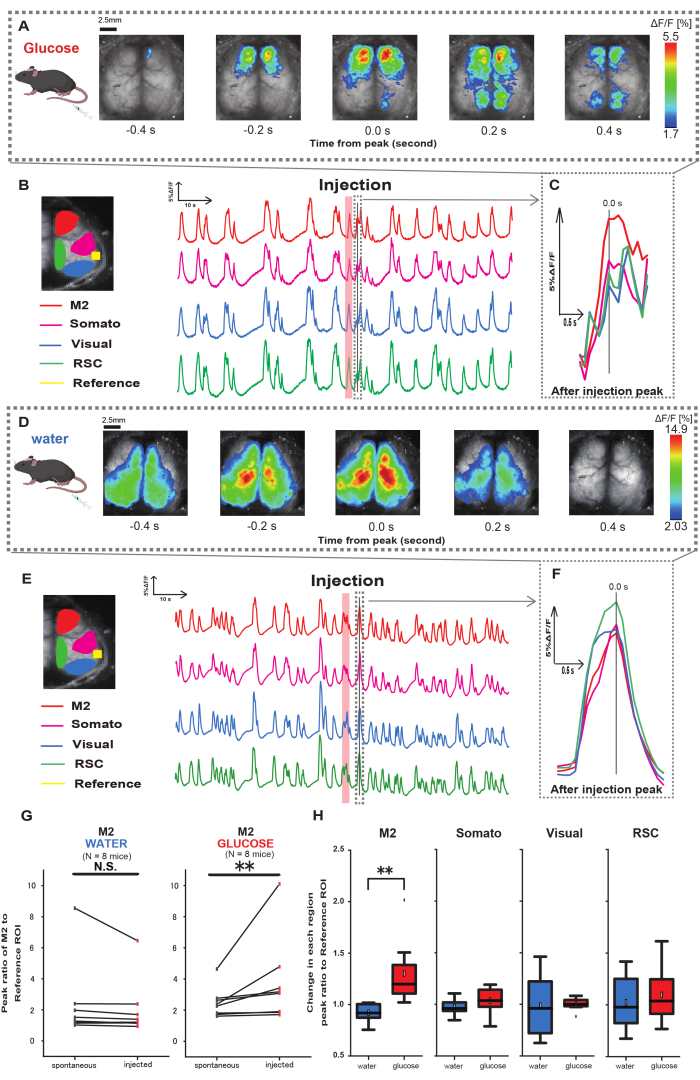
Figure 3 : Réponse Ca2+ à l’échelle du cortex pendant/après l’injection de glucose ou d’eau. (A) Un exemple représentatif d’administration de glucose affiché à des intervalles de 0,2 s. Les changements d’intensité de fluorescence sont représentés par une superposition de pseudo-couleurs. La fenêtre de temps entourée par la ligne pointillée dans B montre le premier transitoire Ca2+ apparaissant après l’injection, avec son pic fixé au temps 0. La représentation pseudo-couleur est basée sur le pic du premier transitoire Ca2+ après l’injection comme valeur maximale et la moyenne +1 SD comme valeur minimale. (B) Changements de série chronologique de l’intensité de fluorescence pour chaque ROI dans l’exemple. Les couleurs des lignes correspondent à différentes zones corticales : le rouge représente M2, le magenta représente l’aire somatosensorielle (Somato), le bleu représente l’aire visuelle (Visual) et le vert représente la région rétro spléniale. (C) Un seul pic à l’intérieur du contour pointillé est isolé et affiché dans une vue agrandie. L’onde calcique cible est la vague la plus précoce qui est apparue dans les 4 à 8 secondes suivant l’injection. (D) Un exemple représentatif d’injection d’eau en tant que données de contrôle du glucose. (E) Changements de série chronologique de l’intensité de fluorescence pour chaque retour d’intérêt dans l’exemple. Les couleurs des lignes sont comme dans B. (F) Un seul pic à l’intérieur du contour pointillé est isolé et affiché dans une vue agrandie. L’onde calcique cible est la vague la plus précoce qui est apparue dans les 4 à 8 secondes suivant l’injection. (G) Comparaison de l’activité spontanée de M2 (avant) et de la réponse après injection (injectée). L’intensité moyenne de la fluorescence change en 50 s avant l’injection, et la réponse maximale dans la région M2 entre 4 s et 8 s après l’injection a été calculée, en utilisant le cortex auditif comme référence. (H) Comparaison des niveaux d’activation dans chaque région corticale lors de l’administration d’eau ou de glucose. Le rapport entre la valeur après injection et la valeur avant injection, déterminé en G, a été calculé pour chaque région. N.S. représente non significatif (p > 0,05). ** <0,01. Les barres d’erreur sont définies comme l’erreur type de la moyenne. Abréviations : ET = écart-type ; ROI = région d’intérêt ; RSC = région rétro spléniale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cet article présente comment attacher un cathéter à l’intestin et observer les signaux Ca2+ à l’échelle du cortex transcrânien avec des souris transgéniques qui expriment un indicateur Ca2+ génétiquement codé. Dans cette expérience, nous n’avons pas obtenu les données d’imagerie qui utilisent une longueur d’onde secondaire de la source lumineuse. En effet, les souris transgéniques que nous avons employées dans cette étude présentent un taux de changement d’intensité de fluorescence très élevé (~plusieurs dizaines de pour cent) en réponse à des stimuli sensoriels en raison des propriétés de la protéine indicatrice Ca2+ (G-CaMP7) utilisée. Par conséquent, nous avons pensé que la contamination par l’hémodynamique était négligeable. De plus, les réponses neuronales sur lesquelles nous nous sommes concentrés se sont produites rapidement en quelques secondes, de sorte que nous avons considéré qu’il n’était pas nécessaire de tenir compte de l’hyperémie fonctionnelle locale générée par la suite. Cette méthode d’implantation de cathéter est capable de se combiner avec d’autres souris génétiquement modifiées pour observer l’activité neuronale dans d’autres régions du cerveau et à différentes échelles de temps. Cependant, si d’autres souris génétiquement modifiées sont utilisées, l’expérience de contrôle décrite ci-dessus doit être effectuée.
Cette méthode de fixation du cathéter à l’intestin convient à l’injection unique à faible coût et est facile et moins invasive que la méthode proposée précédemment29. Traditionnellement, le coton absorbant est appliqué sur l’organe digestif et suturé. Cependant, les points de suture peuvent nuire à la récupération postopératoire chez la souris. Par conséquent, nous avons adopté la méthode de fixation. La raison pour laquelle nous avons choisi des billes de plastique est qu’elles adhèrent mieux au silicone avec la colle cyanoacrylate que nous utilisons.
Il a traditionnellement été postulé que le cerveau perçoit le glucose en fonction de l’augmentation de la glycémie plasmatique et de la libération concomitante d’hormones. Par conséquent, le cerveau a besoin de plusieurs minutes à quelques heures pour détecter le glucose suite à son absorption par l’intestin4. Certaines recherches ont suggéré que la détection intestinale contrôle la préférence gustative des souris en plus de la réception orale du goût sucré 1,3,17,22. À titre d’exemple, les chercheurs ont fourni des preuves que la solution non nutritive aromatisée intragastrique (IG) appariée au glucose et la solution non nutritive associée au α-méthyl-d-glucopyranoside (MDG) non métabolisable à l’IG peuvent susciter une préférence pour chaque solution non nutritive aromatisée par rapport au groupe IG apparié à l’eau. Comme l’injection intrapéritonéale de glucose n’a pas stimulé l’apport en solution non nutritive30, on s’attendait à ce que la détection des nutriments intestinaux joue un rôle crucial dans les choix alimentaires des souris 1,19,22.
Une étude récente a révélé la présence d’une cellule électriquement excitable dans l’intestin, appelée « cellule neuropode », qui utilise des récepteurs moléculaires pour détecter et transduire des stimuli sensoriels sur un nerf vague via une synapse glutamatergique. Alors que des études antérieures se sont principalement concentrées sur le rôle du GLP-1 dans le contrôle de l’alimentation des souris, des recherches récentes ont démontré que l’activation du nerf vague par les cellules des neuropodes module l’appétit de la souris. Le nerf vague active ensuite le Nucleus Tractus Solitarius, conduisant à l’activation ultérieure des neurones dopaminergiques19. Cependant, on ne sait pas si l’activation des neurones dopaminergiques active également le cortex. Pour catégoriser les réponses cérébrales après une perfusion intragastrique de glucose, nous avons affiné la technique de fixation du cathéter à des fins d’imagerie. Lors de l’utilisation de cette technologie, il est impératif de faire preuve de prudence pour éviter d’endommager les organes, en particulier le foie, qui est susceptible d’être blessé lors de la manipulation nécessaire pour déterminer l’emplacement de l’estomac.
Nos résultats indiquent que l’injection intragastrique de glucose active le cortex préfrontal en quelques secondes. Cependant, l’administration intragastrique de glucose initie simultanément plusieurs voies de signalisation, telles que les voies hormonales, le nerf vague et le nerf afférent rachidien. Ces signaux sont traités dans le tronc cérébral à différentes échelles de temps. Par conséquent, des études futures devraient explorer comment ces signaux complexes sont traités et intégrés dans le cerveau.
De plus, la lignée de souris transgénique BAC GLT-1-G-CaMP7 que nous avons utilisée dans la présente étude exprime le capteur Ca2+ , G-CaMP7, à la fois dans les neurones et les astrocytes. En principe, l’élévation préfrontale de Ca2+ obtenue par imagerie Ca2+ à l’échelle du cortex transcrânien est dérivée des neurones et/ou des astrocytes. Cependant, comme les astrocytes expriment des récepteurs de dopamine si la signalisation dopaminergique est impliquée, cela suggère l’activation potentielle de la signalisation astrocytaire IP3/Ca2+ . Étant donné que la signalisation astrocytaire IP3/Ca2+ régule la plasticité synaptique, elle peut également jouer un rôle important dans les changements de préférence pour le saccharose et les altérations du comportement alimentaire après la réception du glucose. Par conséquent, l’imagerie à résolution cellulaire à l’aide de la microscopie à deux photons serait nécessaire pour déterminer si la réponse observée dans le cortex préfrontal après l’administration de glucose provenait des neurones ou des astrocytes dans les études futures. Une autre méthode efficace consiste à observer l’expression de l’indicateur Ca2+ spécifique à la cellule chez la souris à l’aide d’un virus adéno-associé (AAV) par photométrie par fibre. De plus, il est nécessaire de vérifier, à l’aide de techniques électrophysiologiques, si le stimulus glycémique vers l’intestin a réellement stimulé le nerf vague. Si les cellules neuropodes transmettent des signaux au nerf vague en recevant du glucose, nous prévoyons qu’il n’y aura pas de réponse du nerf vague lorsqu’un inhibiteur du SGLT-1 est administré. Enfin, une validation à l’aide de divers antagonistes des récepteurs de la dopamine serait nécessaire pour confirmer si les projections du nerf vague vers le Nucleus Tractus Solitarii (NTS) ont activé les neurones dopaminergiques, augmentant ainsi les signaux Ca2+ du cortex préfrontal. Dans l’ensemble, ce système permet une étude complète des effets de la transmission neuronale rapide de l’intestin au cerveau. Il présente une méthodologie très prometteuse qui pourrait potentiellement élucider des mécanismes, tels que la façon dont le stress modifie la préférence du saccharose concernant les interactions intestin-cerveau.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par l’Université d’Ochanomizu, les subventions KAKENHI (18K14859, 20K15895), le programme JST FOREST, numéro de subvention JPMJFR204G, la Fondation de recherche pour l’opto-science et la technologie, le Conseil de recherche de Kao pour l’étude des sciences de la santé, l’Association japonaise pour l’innovation chimique et la fondation TERUMO pour les sciences de la vie. L’auteur remercie le Dr Takashi Tsuboi, Kazuki Harada et Akiyo Natsubori pour leur supervision des expériences. L’auteur remercie également les membres du laboratoire pour leur soutien.
matériels
| Name | Company | Catalog Number | Comments |
| 2.5 mL TERUMO syringe | TERUMO | ss-02Sz | |
| 23 G injection needle | TERUMO | 4987350390691 | |
| Anesthetic (ISOFLURANE Inhalation Solution) | viatris | 871119 | |
| cotton swab | local company | ||
| Cyanoacrylate glue (AronArufa A) | TOAGOSEI | 7990700Q1022 | |
| dental acrylic cement C&B | Sun Medical | 221AABZX00115000 | |
| Depilatory cream | Kracie | local company | |
| Digital CMOS camera | Hamamatsu Photonics | ORCA-Spark | |
| Ear bar | NARISHIGE | EB-5N | |
| Filter set (U-MWB2) | Evident | U-MWB2 | |
| Fine Scissors | Fine Dcience Tools | 14040-10 | |
| G7NG817 mice | RIKEN BRC | RBRC09650 | |
| Image software | Hamamatsu Photonics | HC Image software | |
| Isoflurane vapolizer | shinanoseisakusyo | SN-487-0T | |
| Light source (U-HGLGPS) | Evident | U-HGLGPS | |
| microscopy (MVX10) | Evident | ||
| Plastic beads (inner diameter 3 mm, outer diameter 5 mm) | local company | ||
| Pliers | local company | ||
| Polydioxanone suture, monodiox | Alfresa Pharma | HR1305MV45-KF2R | This absorbable, monofilament PDS suture is employed for closing the surgical incision |
| Round ended forceps | F.S.T. | 11617-12 | |
| saline | Otsuka Pharmaceutical Factory | 35061311 | |
| Silicon tube (inner diameter 0.5 mm, outer diameter 1.0 mm) | AS ONE CORPORATIO | 33151413 | local company |
| small surgery needle | Natsume Seisakusho Co., Ltd. | AC03DNT | |
| Stereotaxic stage | NARISHIGE | MA-6N | |
| Xylocaine Jelly 2% | Sandoz K.K. | 614429303 | This jelly is used as a local analgesic to alleviate surgical pain |
Références
- Buchanan, K. L., et al. The preference for sugar over sweetener depends on a gut sensor cell. Nature Neuroscience. 25 (2), 191-200 (2022).
- Reimann, F. Molecular mechanisms underlying nutrient detection by incretin-secreting cells. International Dairy Journal. 20 (4), 236-242 (2010).
- Kreuch, D., et al. Gut mechanisms linking intestinal sweet sensing to glycemic control. Frontiers in Endocrinology. 9, 741 (2018).
- Gorboulev, V., et al. Na(+)-D-glucose cotransporter SGLT1 is pivotal for intestinal glucose absorption and glucose-dependent incretin secretion. Diabetes. 61 (1), 187-196 (2012).
- Harada, N., Inagaki, N. Role of sodium-glucose transporters in glucose uptake of the intestine and kidney. Journal of Diabetes Investigation. 3 (4), 352-353 (2012).
- Kaelberer, M. M., Rupprecht, L. E., Liu, W. W., Weng, P., Bohórquez, D. V. Neuropod cells: The emerging biology of gut-brain sensory transduction. Annual Review of Neuroscience. 43, 337-353 (2020).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Larsen, P. J., Tang-Christensen, M., Jessop, D. S. Central administration of glucagon-like peptide-1 activates hypothalamic neuroendocrine neurons in the rat. Endocrinology. 138 (10), 4445-4455 (1997).
- Alhadeff, A. L., Rupprecht, L. E., Hayes, M. R. GLP-1 neurons in the nucleus of the solitary tract project directly to the ventral tegmental area and nucleus accumbens to control for food intake. Endocrinology. 153 (2), 647-658 (2012).
- Raybould, H. E. Gut chemosensing: interactions between gut endocrine cells and visceral afferents. Autonomic Neuroscience: Basic & Clinical. 153 (1-2), 41-46 (2010).
- Routh, V. H. Glucose-sensing neurons: are they physiologically relevant. Physiology & Behavior. 76 (3), 403-413 (2002).
- Secher, A., et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. The Journal of Clinical Investigation. 124 (10), 4473-4488 (2014).
- Williams, E. K., et al. Sensory neurons that detect stretch and nutrients in the digestive system. Cell. 166 (1), 209-221 (2016).
- Borgmann, D., et al. Gut-brain communication by distinct sensory neurons differently controls feeding and glucose metabolism. Cell Metabolism. 33 (7), 1466-1482.e7 (2021).
- Krashes, M. J., et al. Rapid, reversible activation of AgRP neurons drives feeding behavior in mice. The Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- Aponte, Y., Atasoy, D., Sternson, S. M. AGRP neurons are sufficient to orchestrate feeding behavior rapidly and without training. Nature Neuroscience. 14 (3), 351-355 (2011).
- Zhang, L., Han, W., Lin, C., Li, F., de Araujo, I. E. Sugar metabolism regulates flavor preferences and portal glucose sensing. Frontiers in Integrative Neuroscience. 12, 57 (2018).
- Goldstein, ., et al. Hypothalamic detection of macronutrients via multiple gut-brain pathways. Cell Metabolism. 33 (3), 676-687.e5 (2021).
- Fernandes, A. B., et al. Postingestive modulation of food seeking depends on vagus-mediated dopamine neuron activity. Neuron. 106 (5), 778-788.e6 (2020).
- Kaelberer, M. M., et al. . A gut-brain neural circuit for nutrient sensory transduction. 361 (6408), eaat5236 (2018).
- Bohórquez, D. V., et al. Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. The Journal of Clinical Investigation. 125 (2), 782-786 (2015).
- Tan, H. -. E., et al. The gut-brain axis mediates sugar preference. Nature. 580 (7804), 511-516 (2020).
- Wang, D., et al. Whole-brain mapping of the direct inputs and axonal projections of POMC and AgRP neurons. Frontiers in Neuroanatomy. 9, 40 (2015).
- Yamada, S., Wang, Y., Monai, H. Transcranial cortex-wide Ca2+ imaging for the functional mapping of cortical dynamics. Frontiers in Neuroscience. 17, 1119793 (2023).
- Monai, H., et al. Calcium imaging reveals glial involvement in transcranial direct current stimulation-induced plasticity in mouse brain. Nature Communications. 7 (1), 11100 (2016).
- Ferron, J. -. F., Kroeger, D., Chever, O., Amzica, F. Cortical Inhibition during Burst Suppression Induced with Isoflurane Anesthesia. The Journal of Neuroscience. 29 (31), 9850-9860 (2009).
- Ming, Q., et al. Isoflurane-induced burst suppression is a thalamus-modulated, focal-Onset rhythm with persistent local asynchrony and variable propagation patterns in rats. Frontiers in Systems Neuroscience. 14, 599781 (2021).
- Schwalm, M., et al. Functional states shape the spatiotemporal representation of local and cortex-wide neural activity in mouse sensory cortex. Journal of Neurophysiology. 128 (4), 763-777 (2022).
- Ueno, A., et al. Mouse intragastric infusion (iG) model. Nature Protocols. 7 (4), 771-781 (2012).
- Zukerman, S., Ackroff, K., Sclafani, A. Post-oral glucose stimulation of intake and conditioned flavor preference in C57BL/6J mice: A concentration-response study. Physiology & Behavior. 109, 33-41 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon