A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
جراحة المجازة الاثني عشر الصائمية في الفئران المصابة بداء السكري التي يسببها النظام الغذائي
* These authors contributed equally
In This Article
Summary
يمكن لجراحة المجازة الاثني عشر الصائمية (DJB) تحسين استقلاب الجلوكوز وتقليل مقاومة الأنسولين. هنا ، نقدم بروتوكولا لإنشاء نموذج ماوس مستقر وموثوق به من DJB.
Abstract
انتشار السمنة ومرض السكري من النوع 2 هو مصدر قلق صحي عالمي خطير. السمنة هي عامل ممرض رئيسي في مرض السكري من النوع 2 وأمراض القلب والأوعية الدموية وبعض أنواع السرطان. تقدم جراحة السمنة خيارا علاجيا طويل الأمد وفعالا لكل من السمنة ومرض السكري. من المعروف على نطاق واسع أن تكميم المعدة (SG) وتحويل مسار المعدة Roux-en-Y (RYGB) هما أكثر جراحات السمنة شيوعا. بالإضافة إلى ذلك ، أظهرت العديد من جراحات السمنة الاستكشافية آثارا علاجية واعدة. أظهرت المجازة الاثني عشر والصائم (DJB) ، المصممة خصيصا لمرضى السكر الذين يعانون من انخفاض مؤشر كتلة الجسم ، نتائج أيضية مفيدة. ومع ذلك ، فإن فوائده الأيضية المستقلة عن الوزن ليست مفهومة تماما بسبب النماذج الحيوانية المحدودة. في هذه المقالة ، نصف بروتوكولات الرعاية المحسنة والتقنيات الجراحية لإجراء جراحة DJB في الفئران المصابة بداء السكري التي يسببها النظام الغذائي (DIO). يساهم استخدام نموذج الماوس في فهم أفضل لطبيعة التغييرات التي تسببها جراحة DJB مع تسهيل الممارسة السريرية ذات الصلة.
Introduction
السمنة ومرض السكري من النوع 2 هي الأمراض المزمنة الأكثر شيوعا في العالم ، وانتشارها آخذ في الازدياد بين الأفراد الشباب1. جراحة السمنة هي العلاج الأكثر فعالية للسمنة ومرض السكري ، مما يسهل استقرار نسبة الجلوكوز في الدم على المدى الطويلمع تحسين المضاعفات المرتبطة بالسمنة 2,3. هناك عدة أنواع من جراحة السمنة ، مصنفة حسب ما إذا كانت تقلل من حجم المعدة أو امتصاص الأمعاء. وتشمل هذه التقييدية ، malabsorptive ، والجمع4،5.
تم تطوير المجازة الاثني عشر الصائمية (DJB) لأول مرة من قبل Rubino و Marescaux ، الذين أظهروا أنه يمكن التخفيف من مرض السكري من النوع 2 عن طريق توصيل الاثني عشر والصائم بدلا من تقليل حجم المعدة 6,7. يحافظ DJB على المعدة بأكملها ويتجاوز الاثني عشر بأكمله والصائم القريب. تنقسم الأمعاء إلى أطراف القناة الصفراوية والجهاز الهضمي والأطراف الشائعة 6,8. يشترك DJB في بعض أوجه التشابه مع جراحات السمنة ، بما في ذلك تحويل مسار المعدة Roux-en-Y (RYGB) ، والمجازة المعدية المصغرة ، والمجازة الصفراوية البنكرياسية ، وتحويل الاثني عشر ، و DJB بالإضافة إلى تكميم المعدة9. بالمقارنة مع RYGB ، لا يتطلب DJB مفاغرة الجهاز الهضمي ، مما يقلل من وقت التشغيل ويحسن معدل نجاح الإجراء. يشبه DJB RYGB في تحسين استقلاب الجلوكوز ولكنه لا يؤثر على وزن الجسم10. بعد جراحة DJB ، يحفز توصيل الطعام السريع إلى الأمعاء الدقيقة البعيدة إفراز الببتيد الشبيه بالجلوكاجون -1 (GLP-1) ، مما يؤدي إلى تحسين استقلاب الجلوكوز11,12.
يعد استخدام النماذج الحيوانية أمرا ضروريا لفهم المسارات الأيضية والخلوية والجزيئية. ساهمت النماذج الحيوانية لجراحة السمنة في فهمنا للآليات المحتملة الكامنة وراء السمنة ومرض السكري13،14. ومع ذلك ، بسبب الاختلافات الفسيولوجية بين الأنواع ، من المستحيل تكرار الأمراض البشرية بشكل مثالي في النماذج الحيوانية15. من بين النماذج الحيوانية المختلفة المتاحة لأغراض البحث ، يشبه نموذج الفأر الناجم عن السمنة (DIO) إلى حد كبير السمنة البشرية ومتلازمة التمثيل الغذائي16. تم اختيار الفئران لجراحة DJB لتحديد جدوى الجراحة وتوفير تقنيات لمزيد من البحث. تقدم هذه المخطوطة ملخصا شاملا لكل من الجوانب الفنية والتفاصيل التجريبية لجراحة DJB.
Protocol
تتبع جميع خطوات البروتوكول الموضحة أدناه إرشادات لجنة رعاية واستخدام بالمستشفى العام لقيادة المسرح الجنوبي بموجب رقم الموافقة 2020112501.
1. التحضير العام قبل الجراحة
ملاحظة: تم شراء ثلاثين ذكرا من الفئران C57BL / 6 البالغة من العمر 6 أسابيع. تم إيواء الفئران في مختبر محدد خال من مسببات الأمراض (SPF) تحت دورة ضوء / ظلام مدتها 12 ساعة. درجة الحرارة ، 22 ± 2 درجة مئوية ؛ والرطوبة ، 55-65 ٪. تم منح الفئران حرية الوصول إلى الماء وتغذت على نظام غذائي يحتوي على 60٪ من الدهون لمدة 6 أسابيع للحث على السمنة. تم إعطاء حقنة داخل الصفاق بقيمة 40 ملغ/كغ من الستربتوزوتوسين لمدة 5 أيام للحث على الإصابةبمرض السكري 17. من بين الفئران الثلاثين ، تم فحص اثنين وعشرين فأرا بحثا عن جلوكوز الدم العشوائي > 300 مجم / ديسيلتر وتم تعيينهم عشوائيا إلى مجموعات DJB (ن = 15) والجراحة الوهمية (ن = 7). تم استبعاد ثمانية فئران من التجربة بسبب انخفاض مستوى الجلوكوز في الدم.
- صوم الفئران لمدة 8 ساعات قبل الجراحة. سحب الماء قبل 2 ساعة من الجراحة.
- يتم تطبيق محلول بنتوباربيتال الصوديوم 1٪ (6 مل/ كغ) والبوبرينورفين (1 ملغ/ كغ) داخل الصفاق. المس أصابع أو ذيول الفئران بالملقط وتأكد من أن الفئران لا تظهر أي ارتعاش أو اهتزاز واضح. تحت التخدير الكافي ، يمكن للفئران التنفس بحرية دون أكسجين إضافي.
- ضع الفئران في وضع ضعيف على لوح معقموتحت مجهر مجسم. تطبيق مرهم العين على العينين. استخدم بطانية كهربائية للحفاظ على دفء الفئران طوال العملية. استخدم إجراءات معقمة ، بما في ذلك العباءات الجراحية والقفازات المعقمة والأدوات المعقمة.
- في الفئران الوهمية الضابطة ، قم بعمل شقين على التوالي في الاثني عشر 1 سم تحت البواب وفي الصائم 5 سم أسفل Treitz ثم خيط الشقوق.
2. الالتفافية الصائمية الاثني عشر: الإجراء الجراحي
- ضع معجون مزيل الشعر من الخنجري على البطن لإزالة الشعر من هذه المنطقة. امسح الكريم وتأكد من نظافة البشرة. فرك المنطقة ثلاث مرات مع فرك بالتناوب من حلول اليود والكحول.
- قم بتغطية الماوس بستارة معقمة ، وترك منطقة العمليات مكشوفة ، وقم بعمل شق 2 سم من الخنجري إلى البطن.
- استخدم مبعدة البطن لكشف تجويف البطن. ادفع دهون البطن بعيدا باستخدام قطعة قطن مبللة ، وانقل الكبد إلى الجانب الرأسي لكشف المعدة والأمعاء بالكامل.
- تقع المعدة والبواب أسفل الكبد ، ويقع رباط تريتز في الاثني عشر البعيد. ربط الصائم المزدوج ، 5 سم بعيد عن رباط Treitz مع خياطة حريرية 6-0 (الشكل 1 أ). قطع الصائم عند نقطة منتصف المربوطين وخياطة الجذع الصائمي بخياطة حرير 10-0 (الشكل 1 ب).
ملاحظة: تجنب التواء الأوعية الدموية المساريقي. - اسحب الشق الصائمي القريب 5 سم على طول الأمعاء إلى الصائم لإنشاء مفاغرة صائمية. قم بمحاذاة الحشاء أفقيا ، ثم استخدم خياطة حريرية 10-0 لإنشاء مفاغرة جانبية (الشكل 1C).
ملاحظة: أثناء الجراحة ، حافظ على رطوبة الأمعاء بالمحلول الملحي لتقليل فقد الماء. هذا سيمنع الأمعاء من الشباك وسيجعل الخياطة أسهل. - تأمين طرفي الأمعاء وقطع شق إلى طول متساو (الشكل 1D). خياطة الطبقة الثانية من جدار الأمعاء الخلفي مع خياطة مستمرة كاملة السماكة.
ملاحظة: طول الشق حوالي 0.5-0.6 سم ، ومسافة الإبرة ~ 0.5 مم. - تأمين طرفي الأمعاء وخياطة الجدار الأمامي للأمعاء. خياطة الطبقة الأولى من الجدار الأمامي بخياطة مستمرة بسيطة والطبقة الثانية بخياطة أفقية (الشكل 1E-F).
ملاحظة: مسح محتويات الأمعاء بمسحات القطن لمنع عدوى تجويف البطن. - اسحب الشق الصائمي البعيد إلى الاثني عشر 1 سم أسفل البواب لإنشاء مفاغرة الاثني عشر الصائم (الشكل 1G). قم بخياطتها باستخدام نفس الطريقة كما في الخطوات 2.6-2.7 (الشكل 1H-K).
ملاحظة: تحقق من الخيط في زاوية المفاغرة لتقليل تسرب المفاغرة. - اربط الأمعاء بالملقط الدقيق واقطع الأمعاء بالمقص الدقيق. ربط مزدوج الاثني عشر بخياطة حريرية 6-0 ، 2 مم من النهاية البعيدة لمفاغرة الاثني عشر الصائم. قطع عند نقطة المنتصف بمقص صغير وخياطة الجذع بخياطة حريرية 10-0 (الشكل 1L).
ملاحظة: تتفرع الأوعية المعدية المعوية بشكل عمودي على رأس البنكرياس وهي مجاورة للباب ، مما يتطلب استكشافا دقيقا للأوعية في القسم العرضي. تم تحديد التقاء القناة الصفراوية المشتركة والاثني عشر ، مع الحرص على عدم إتلاف البنكرياس أو القناة الصفراوية المشتركة. - شطف تجويف البطن بمحلول ملحي 30 درجة مئوية. إعادة الأمعاء إلى تجويف البطن. خياطة العضلات والجلد بشكل منفصل مع الحرير 6-0. ثم ، تطهير الجلد مع اليودوفور.
- بعد الجراحة، يتم حقن محلول ملحي بدرجة حرارة 30 درجة مئوية (30 مل/كغ) تحت الجلد في الظهر لمنع الجفاف. حقن البنسلين (10 ملغ/كغ) في العضل للوقاية من العدوى.
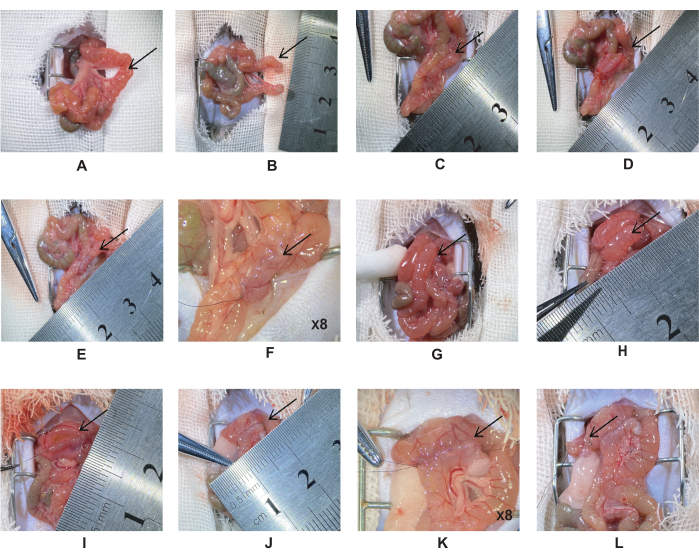
الشكل 1: إجراء المجازة الاثني عشر الصائم. (أ) موقع الصائم 5 سم البعيد عن رباط تريتز. (ب) ربط الصائم مرتين بالحرير 6-0 ، مقطوعة من منتصف الرباط. (ج) مفاغرة الصائم الصائمية. د: شق مسافة 0.5-0.6 سم، وخيط الجدار الخلفي. (إ-و) مفاغرة الصائم الصائمية الكاملة. (ز) اسحب الصائم البعيد إلى الاثني عشر 1 سم أسفل البواب. (ح) مفاغرة الاثني عشر - الصائم. (ط) قطع مفاغرة الاثني عشر والصائم بشق 0.5-0.6 سم وخياطة الجدار الخلفي بخياطة بسيطة مستمرة. (ي-ك) مفاغرة الاثني عشر الصائم الكاملة. (L) عند 2 مم من المفاغرة البعيدة إلى مفاغرة الاثني عشر - الصائم ، قم بربط الاثني عشر مرتين بالحرير 6-0 وقطع منتصف الرباط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. الرعاية العامة بعد العملية الجراحية
- بعد الجراحة ، ضع الفئران على بطانية كهربائية لمنع انخفاض حرارة الجسم. اسمح للفئران بالزحف بحرية حتى تستيقظ تماما قبل العودة إلى أقفاصها.
- في يوم ما بعد الجراحة ، قم بتقييد الطعام والماء وحقن 2 مل من المياه المالحة تحت الجلد في الجزء الخلفي من الفئران. في اليوم الأول بعد العملية الجراحية ، أعط 10 مل من الجلوكوز بنسبة 10 ٪ ومشروب وظيفي (نسبة 1: 1) بدون طعام ، وحقن 1 مل من المياه المالحة تحت الجلد.
- في اليومين الثاني والثالث بعد العملية الجراحية ، قم بإطعام الفئران بمزيج من 20 مل من الجلوكوز بنسبة 10 ٪ ومشروب وظيفي. بعد اليوم الرابع ، أعط الفئران الماء النقي واتباع نظام غذائي غني بالدهون. يجب إجراء التغذية الانتقالية وفقا لحالة الشفاء بعد العملية الجراحية بالترتيب التالي: محلول أو شبه سائل أو طعام صلب.
- تسكين ما بعد الجراحة: حقن البوبرينورفين (0.1 ملغ / كغ) كل 12 ساعة من الأيام 1 إلى 3 ، ثم مرة واحدة يوميا حتى اليوم 5.
- بعد الجراحة ، راقب ظروف التغذية والنشاط والبراز والتئام الجروح للفئران.
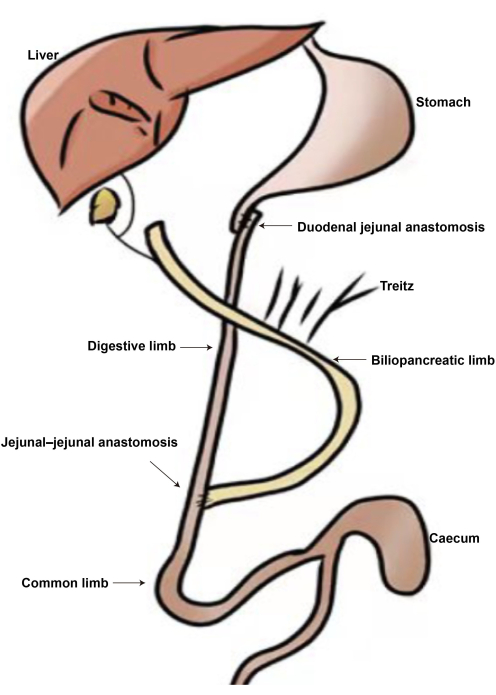
الشكل 2: رسم تخطيطي لجراحة DJB. أ: مفاغرة الاثني عشر الصائم. ب: مفاغرة الصائم الصائمية. ج: الطرف الصفراوي البنكرياسي. د: الطرف الهضمي. ه: الطرف المشترك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
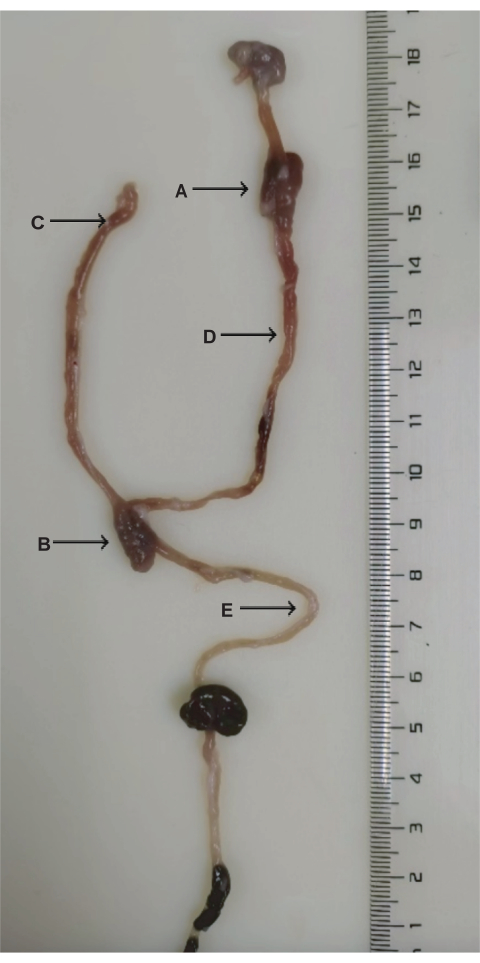
الشكل 3: تشريح جراحة DJB. أ: مفاغرة الاثني عشر الصائم. ب: مفاغرة الصائم الصائمية. ج: الطرف الصفراوي البنكرياسي. د: الطرف الهضمي. ه: الطرف المشترك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تقييم ما بعد الجراحة من المعلمات الأيضية
- قياس وزن الجسم
- صوم الفئران لمدة 8 ساعات قبل القياس. وزن الفئران أسبوعيا يوم الاثنين قبل وبعد الجراحة لمدة 8 أسابيع.
- قياس تناول الطعام
- منزل فأر واحد في كل قفص. قم بقياس كمية الطعام الصلب في كل قفص قبل وبعد 24 ساعة. يمثل الفرق بين القيمتين كمية الطعام اليومية.
- قياس عشوائي لنسبة الجلوكوز في الدم
- في الساعة 8:00 صباحا يوم الاثنين الأسبوعي للقياس ، اجمع قطرة دم من طرف ذيل الفأر وضعها على شريط الجلوكوز الذي يتم إدخاله في جهاز قياس السكر.
- اختبار تحمل الجلوكوز عن طريق الفم
- بعد ثمانية أسابيع من جراحة DJB ، قم بصيام الفئران لمدة 8 ساعات قبل اختبار تحمل الجلوكوز عن طريق الفم. اجمع قطرة دم من طرف ذيل الفأر وضعها على شريط جلوكوز يتم إدخاله في جهاز قياس السكر. يتم تطبيق جرعة فموية من 20٪ د-غلوكوز (2 غ/كغ). قم بقياس مستويات الجلوكوز في الدم عند 0 و 15 و 30 و 60 و 90 و 120 و 150 و 180 دقيقة بعد التزجيج.
النتائج
الشروط العامة
كان متوسط وقت التشغيل لإجراء DJB 84.5 ± 2.6 دقيقة. خضع خمسة عشر فأرا لعملية جراحية DJB ، ونجا تسعة فئران. كما هو موضح في الجدول 1 ، حدثت غالبية الوفيات أثناء الجراحة أو في الأيام ال 7 التالية. كانت أسباب الوفاة بعد العملية الجراحية هي النزيف (ن = 2) ?...
Discussion
في عام 1953 ، أجرى Varco et al.18 أول مجازة jejuno-ileal كبداية لجراحة علاج البدانة. منذ ذلك الحين ، تم إجراء العديد من جراحات السمنة من قبل الجراحين. أدت هذه العمليات الجراحية إلى فقدان الوزن وتحسين مضاعفات التمثيل الغذائي4،19،
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
ودعمت هذه الدراسة بمنحة من مشروع تخطيط العلوم والتكنولوجيا في مقاطعة غوانغدونغ الصينية (رقم 202002020069).
Materials
| Name | Company | Catalog Number | Comments |
| Abdominal retractor | F.S.T | 17000-03 | Colibri Retractor -3cm,retractor range 1.5cm/3cm long |
| 1% sodium pentobarbital solution | Guangzhou Chemical Reagent Factory | / | Dissolved 500mg of pentobarbital sodium powder in 50ml of normal saline to obtain 1% pentobarbital sodium solution. |
| Benzylpenicillin sodium for Injection | North China Pharmaceutical Company Ltd. | F2062121 | Penicillin |
| Buprenorphine | Guangzhou Chemical Reagent Factory | / | Analgesia |
| Buprenorphine | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Analgesic |
| Citric acid-sodium citrate buffer | LEAGENE | R00522 | Buffer solution |
| Cotton buds | HaoZheng Medical | 60220610 | Cotton swabs |
| Depilatory paste | Veet | AAPR-S222 | Hair removal cream |
| Ear tag | ZEYA | SUS304 | Ear-mark |
| Electric blanket | ZOSEN | ZS-CWDRT | Heat pad |
| Electronic scale | WETTLER TOLEDO | 20060902-6 | Measure the weight |
| Enteral nutritional powder | Abbott Laboratories | / | Nutrition powder |
| Eye ointment | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Protect the eyes |
| Glucometer | Roche | 6993788001 | Assess blood glucose |
| Graphpad Prism version 9.4.1 | GraphPad Software | version 9.4.1 | Software for statistical analysis |
| High-fat diet (High Fat [60FDC] Purified Rodent Diet) | Dyets | 112252 | 60kcal% High Fat Diet |
| Micro Forceps | Jinzhong Medical | 18-1140 | Micro forceps |
| Micro needle holder | Jinzhong Medical | EMT-160-Z | Needle holder |
| Micro Scissors | Jinzhong Medical | YBC010 | Micro scissors |
| Microscope camera | LAPSUN | E 2000 | Video |
| Ophthalmic scissors | Jinzhong Medical | Y00030 | Surgical scissors |
| Pentobarbital | Guangzhou Chemical Reagent Factory | / | Narcosis |
| Sodium chloride Injection | Guangzhou Otsuka Pharmaceutical Co., Ltd | B21L0301 | NaCl 0.9% |
| Stereo microscope | ZEISS | Stemi 305 | Binocular stereomicroscope |
| Streptozotocin | Sigma | S110910-1g | STZ |
| Suture line | LINGQIAO SUTURE | ZS-LQPMRZ5/0 | Prolene 6/0,Prolene 10/0 |
| Tissue forceps | Jinzhong Medical | H1701 | Surgical forceps |
References
- Lascar, N., Brown, J., Pattison, H., Barnett, A. H., Bailey, C. J., Bellary, S. Type 2 diabetes in adolescents and young adults. Lancet Diabetes Endocrinol. 6 (1), 69-80 (2018).
- Song, Y., Zhao, F. Bibliometric analysis of metabolic surgery for type 2 diabetes: current status and future prospects. Updates Surg. 74 (2), 697-707 (2022).
- Cummings, D. E., Rubino, F. Metabolic surgery for the treatment of type 2 diabetes in obese individuals. Diabetologia. 61 (2), 257-264 (2018).
- Buchwald, H. The evolution of metabolic/bariatric surgery. Obes Surg. 24 (8), 1126-1135 (2014).
- Akalestou, E., Miras, A. D., Rutter, G. A., le Roux, C. W. Mechanisms of weight loss after obesity surgery. Endocr Rev. 43 (1), 19-34 (2022).
- Rubino, F., et al. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes. Ann Surg. 244 (5), 741-749 (2006).
- Rubino, F., Marescaux, J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg. 239 (1), 1-11 (2004).
- Akalestou, E., et al. Establishing a successful rat model of duodenal- jejunal bypass: A detailed guide. Lab Anim. 53 (4), 362-371 (2019).
- Yu, H. H., Hsieh, M. C., Wu, S. Y., Sy, E. D., Shan, Y. S. Effects of duodenal-jejunal bypass surgery in ameliorating nonalcoholic steatohepatitis in diet-induced obese rats. Diabetes Metab Syndr Obes. 12, 149-159 (2019).
- Garciacaballero, M., Navarrete, S., Favretti, F., Celik, A., Del Castillo, D. Diabetes surgery in type 2 BMI 24-29 vs IMC 30-34 diabetic patients: is there differences among restrictive, malabsorptive and gastric bypass procedures. Nutr Hosp. 28 (2), 23-30 (2013).
- Vidal, J., Jiménez, A. Diabetes remission following metabolic surgery: is GLP-1 the culprit. Curr Atheroscler Rep. 15 (10), 357 (2013).
- Speck, M., Cho, Y. M., Asadi, A., Rubino, F., Kieffer, T. J. Duodenal-jejunal bypass protects GK rats from {beta}-cell loss and aggravation of hyperglycemia and increases enteroendocrine cells coexpressing GIP and GLP-1. Am J Physiol Endocrinol Metab. 300 (5), E923-E932 (2011).
- Ashrafian, H., et al. Metabolic surgery: an evolution through bariatric animal models. Obes Rev. 11 (12), 907-920 (2010).
- Rao, R. S., Rao, V., Kini, S. Animal models in bariatric surgery--a review of the surgical techniques and postsurgical physiology. Obes Surg. 20 (9), 1293-1305 (2010).
- Im, Y. R., et al. A systematic review of animal models of NAFLD finds high-fat, high-fructose diets most closely resemble human NAFLD. Hepatology. 74 (4), 1884-1901 (2021).
- Kleinert, M., et al. Animal models of obesity and diabetes mellitus. Nat Rev Endocrinol. 14 (3), 140-162 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Curr Protoc. 1 (4), e78 (2021).
- Buchwald, H., Varco, R. L., Moore, R. B., Schwartz, M. Z. Intestinal bypass procedures. Partial ileal bypass for hyperlipidemia and jejunoileal bypass for obesity. Curr Probl Surg. , 1-51 (1975).
- DeMaria, E. J. Bariatric surgery for morbid obesity. N Engl J Med. 356 (21), 2176-2183 (2007).
- Bolling, C. F., Armstrong, S. C., Reichard, K. W., Michalsky, M. P. Metabolic and bariatric surgery for pediatric patients with severe obesity. Pediatrics. 144 (6), e20193224 (2019).
- Mason, E. E. Gastric bypass for morbid obesity. Surg Annu. 11, 99-126 (1979).
- Cheng, Y., et al. Sleeve gastrectomy with bypass of proximal small intestine provides better diabetes control than sleeve gastrectomy alone under postoperative high-fat diet. Obes Surg. 29 (1), 84-92 (2019).
- Rubino, F., et al. The role of the small bowel in the regulation of circulating ghrelin levels and food intake in the obese Zucker rat. Endocrinology. 146 (4), 1745-1751 (2005).
- Zachariah, P. J., et al. Compared to sleeve gastrectomy, duodenal-jejunal bypass with sleeve gastrectomy gives better glycemic control in T2DM patients, with a lower β-cell response and similar appetite sensations: mixed-meal study. Obes Surg. 26 (12), 2862-2872 (2016).
- Jiang, B., et al. Role of proximal intestinal glucose sensing and metabolism in the blood glucose control in type 2 diabetic rats after duodenal jejunal bypass surgery. Obes Surg. 32 (4), 1119-1129 (2022).
- Han, H. F., et al. Duodenal-jejunal bypass increases intraduodenal bile acids and upregulates duodenal SIRT1 expression in high-fat diet and streptozotocin-induced diabetic rats. World J Gastroenterol. 28 (31), 4338-4350 (2022).
- Yan, S., et al. Reduction of intestinal electrogenic glucose absorption after duodenojejunal bypass in a mouse model. Obes Surg. 23 (9), 1361-1369 (2013).
- Arble, D. M., et al. Metabolic comparison of one-anastomosis gastric bypass, single-anastomosis duodenal-switch, Roux-en-Y gastric bypass, and vertical sleeve gastrectomy in rat. Surg Obes Relat Dis. 14 (12), 1857-1867 (2018).
- Liang, Y., et al. Duodenal-jejunal bypass surgery reverses diabetic phenotype and reduces obesity in db/db Mice. Curr Chem Genom Transl Med. 11, 41-49 (2017).
- Barataud, A., et al. Absence of role of dietary protein sensing in the metabolic benefits of duodenal-jejunal bypass in the mouse. Sci Rep. 7, 44856 (2017).
- . Close-up on lab animal microsurgery. Lab Anim (NY). 35 (1), 43 (2006).
- Couceiro, J., Castro, R., Tien, H., Ozyurekoglu, T. Step by step: microsurgical training method combining two nonliving animal models. J Vis Exp. (99), e52625 (2015).
- Nasser, K. M., Wahba, H. A., Kamal, E., El-Makhzangy, A. M., Bahaa, N. Animal model for training and improvement of the surgical skills in endolaryngeal microsurgery. J Voice. 26 (3), 351-357 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved