Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Duodenal-Jejunal-Bypass-Operation bei ernährungsinduzierten adipösen diabetischen Mäusen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Eine Duodenal-Jejunal-Bypass-Operation (DJB) kann den Glukosestoffwechsel verbessern und die Insulinresistenz reduzieren. Hier stellen wir ein Protokoll vor, um ein stabiles und zuverlässiges Mausmodell von DJB zu etablieren.
Zusammenfassung
Die Prävalenz von Fettleibigkeit und Typ-2-Diabetes ist ein ernstes globales Gesundheitsproblem. Fettleibigkeit ist ein wichtiger pathogener Faktor bei Typ-2-Diabetes, Herz-Kreislauf-Erkrankungen und einigen Krebsarten. Die Adipositaschirurgie bietet eine langfristige und effektive Behandlungsmöglichkeit sowohl für Fettleibigkeit als auch für Diabetes. Die Schlauchmagen-Operation (SG) und der Roux-en-Y-Magenbypass (RYGB) gelten weithin als die beliebtesten bariatrischen Operationen. Darüber hinaus haben mehrere explorative bariatrische Operationen vielversprechende therapeutische Wirkungen gezeigt. Der Duodenal-Jejunal-Bypass (DJB), der speziell auf Diabetiker mit niedrigem Body-Mass-Index zugeschnitten ist, hat positive metabolische Ergebnisse gezeigt. Die gewichtsunabhängigen metabolischen Vorteile sind jedoch aufgrund begrenzter Tiermodelle nicht vollständig verstanden. In diesem Artikel beschreiben wir die optimierten Behandlungsprotokolle und Operationstechniken für die Durchführung von DJB-Operationen bei ernährungsinduzierten adipösen (DIO) diabetischen Mäusen. Die Verwendung eines Mausmodells trägt zu einem besseren Verständnis der Art der durch die DJB-Operation induzierten Veränderungen bei und erleichtert gleichzeitig die damit verbundene klinische Praxis.
Einleitung
Fettleibigkeit und Typ-2-Diabetes sind die häufigsten chronischen Krankheiten der Welt, und ihre Prävalenz nimmt bei jungen Menschen zu1. Die bariatrische Chirurgie ist die wirksamste Behandlung von Fettleibigkeit und Diabetes, da sie eine langfristige Blutzuckerstabilität ermöglicht und gleichzeitig die mit Fettleibigkeit verbundenen Komplikationen verbessert 2,3. Es gibt verschiedene Arten der bariatrischen Chirurgie, die danach klassifiziert werden, ob sie das Magenvolumen oder die Darmabsorption reduzieren. Dazu gehören restriktiv, malabsorptiv und Kombination 4,5.
Der Duodenal-Jejunal-Bypass (DJB) wurde erstmals von Rubino und Marescaux entwickelt, die zeigten, dass Typ-2-Diabetes durch die Verbindung von Duodenum und Jejunum und nicht durch eine Verringerung des Magenvolumens gelindert werden kann 6,7. DJB erhält den gesamten Magen und umgeht den gesamten Zwölffingerdarm und das proximale Jejunum. Der Darm ist in biliopankreatische, Verdauungs- und gewöhnliche Gliedmaßen unterteilt 6,8. DJB weist einige Ähnlichkeiten mit bariatrischen Operationen auf, darunter der Roux-en-Y-Magenbypass (RYGB), der Mini-Magenbypass, der biliopankreatische Bypass, die Duodenaldiversion und die DJB plus Schlauchmagen-9. Im Vergleich zu RYGB ist bei DJB keine gastrointestinale Anastomose erforderlich, was die Operationszeit verkürzt und die Erfolgsrate des Eingriffs verbessert. DJB ist ähnlich wie RYGB bei der Verbesserung des Glukosestoffwechsels, beeinflusst aber nicht das Körpergewicht10. Nach der DJB-Operation stimuliert die schnelle Nahrungsabgabe an den distalen Dünndarm die Sekretion von Glucagon-like Peptide-1 (GLP-1), was zu einem verbesserten Glukosestoffwechsel führt11,12.
Die Verwendung von Tiermodellen ist für das Verständnis der metabolischen, zellulären und molekularen Signalwege unerlässlich. Tiermodelle der bariatrischen Chirurgie haben zu unserem Verständnis möglicher Mechanismen beigetragen, die Fettleibigkeit und Diabetes zugrunde liegen13,14. Aufgrund der physiologischen Unterschiede zwischen den Spezies ist es jedoch unmöglich, menschliche Krankheiten in Tiermodellen perfekt nachzubilden15. Unter den verschiedenen Tiermodellen, die für Forschungszwecke zur Verfügung stehen, ähnelt das Mausmodell der ernährungsinduzierten Adipositas (DIO) am ehesten der menschlichen Adipositas und dem metabolischen Syndrom16. Mäuse wurden für die DJB-Operation ausgewählt, um die Durchführbarkeit der Operation zu ermitteln und Techniken für die weitere Forschung bereitzustellen. Dieses Manuskript bietet eine umfassende Zusammenfassung sowohl der technischen Aspekte als auch der experimentellen Details der DJB-Chirurgie.
Protokoll
Alle im Folgenden beschriebenen Protokollschritte folgen den Richtlinien des Animal Care and Use Committee des General Hospital des Southern Theater Command unter der Zulassungsnummer 2020112501.
1. Allgemeine präoperative Vorbereitung
HINWEIS: Es wurden dreißig 6 Wochen alte männliche C57BL/6-Mäuse gekauft. Die Mäuse wurden in einem spezifisch pathogenfreien (SPF) Labor unter einem 12-stündigen Hell-Dunkel-Zyklus untergebracht; Temperatur, 22 ± 2 °C; und Luftfeuchtigkeit, 55-65%. Die Mäuse erhielten freien Zugang zu Wasser und erhielten 6 Wochen lang eine Diät mit 60 % kcal Fett, um Fettleibigkeit zu induzieren. Eine intraperitoneale Injektion von 40 mg/kg Streptozotocin wurde 5 Tage lang verabreicht, um Diabetes17 zu induzieren. Unter den dreißig Mäusen wurden zweiundzwanzig Mäuse auf zufällige Blutzuckerwerte > 300 mg/dl gescreent und nach dem Zufallsprinzip der DJB- (n = 15) und der Scheinchirurgie (n = 7) zugeteilt. Acht Mäuse wurden aufgrund von minderwertigem Blutzuckerspiegel vom Experiment ausgeschlossen.
- Fasten Sie die Mäuse 8 Stunden vor der Operation. Entnehmen Sie das Wasser 2 h vor der Operation.
- Verabreichen Sie 1% Natrium-Pentobarbital-Lösung (6 ml/kg) und Buprenorphin (1 mg/kg) intraperitoneal. Berühren Sie die Zehen oder Schwänze der Mäuse mit einer Pinzette und stellen Sie sicher, dass die Mäuse kein offensichtliches Zucken oder Zittern zeigen. Unter adäquater Narkose können die Mäuse ohne zusätzlichen Sauerstoff frei atmen.
- Legen Sie die Mäuse in Rückenlage auf eine sterile Platte und unter ein Stereomikroskop. Tragen Sie Augensalbe auf die Augen auf. Verwenden Sie eine Heizdecke, um die Mäuse während des gesamten Eingriffs warm zu halten. Verwenden Sie sterile Verfahren, einschließlich OP-Kittel, sterile Handschuhe und autoklavierte Instrumente.
- Bei Scheinkontrollmäusen werden die beiden Schnitte im Zwölffingerdarm jeweils 1 cm unterhalb des Pylorus und im Jejunum 5 cm unterhalb der Treitz vorgenommen und dann die Schnitte vernäht.
2. Zwölffingerdarm-Jejunalbypass: Chirurgischer Eingriff
- Tragen Sie die Enthaarungspaste aus dem Xiphoid auf den Bauch auf, um Haare aus diesem Bereich zu entfernen. Wischen Sie die Creme ab und stellen Sie sicher, dass die Haut sauber ist. Schrubben Sie den Bereich dreimal abwechselnd mit Jod- und Alkohollösungen.
- Decken Sie die Maus mit einem sterilen Tuch ab, lassen Sie den Operationsbereich frei, und machen Sie einen 2 cm langen Schnitt vom Xiphoid bis zum Bauch.
- Verwenden Sie einen Bauchretraktor, um die Bauchhöhle freizulegen. Schieben Sie das Bauchfett mit einem feuchten Wattestäbchen weg und bewegen Sie die Leber zur Kopfseite, um Magen und Darm vollständig freizulegen.
- Der Magen und der Pylorus befinden sich unterhalb der Leber, und das Band von Treitz befindet sich am distalen Zwölffingerdarm. Doppelte Ligatur des Jejunums, 5 cm distal des Treitz-Bandes mit einer 6-0-Seidennaht (Abbildung 1A). Schneiden Sie das Jejunum in der Mitte der beiden Ligaturen und vernähen Sie den Jejunalstumpf mit einer 10-0-Seidennaht (Abbildung 1B).
HINWEIS: Vermeiden Sie es, die mesenterialen Blutgefäße zu verdrehen. - Ziehen Sie den proximalen Jejunalschnitt 5 cm entlang des Darms bis zum Jejunum, um eine Jejunal-Jejunal-Anastomose zu erzeugen. Richten Sie die beiden Därme horizontal aus und verwenden Sie dann eine 10-0-Seidennaht, um die laterale Anastomose zu erzeugen (Abbildung 1C).
HINWEIS: Halten Sie den Darm während der Operation mit Kochsalzlösung feucht, um den Wasserverlust zu reduzieren. Dies verhindert, dass sich der Darm zusammenrollt, und erleichtert das Nähen. - Sichern Sie beide Enden des Darms und schneiden Sie den Schnitt auf die gleiche Länge (Abbildung 1D). Vernähen Sie die zweite Schicht der hinteren Darmwand mit einer durchgehenden Naht in voller Dicke.
HINWEIS: Die Schnittlänge beträgt ca. 0,5-0,6 cm und der Nadelabstand ~0,5 mm. - Befestigen Sie beide Enden des Darms und nähen Sie die vordere Darmwand. Die erste Schicht der Vorderwand mit einer einfachen durchgehenden Naht und die zweite Schicht mit einer horizontalen Varusnaht vernähen (Abbildung 1E-F).
HINWEIS: Tupfen Sie den Darminhalt mit Wattestäbchen ab, um eine Infektion der Bauchhöhle zu verhindern. - Ziehen Sie den distalen Jejunalschnitt 1 cm unterhalb des Pylorus in den Zwölffingerdarm, um eine Zwölffingerdarm-Jejunal-Anastomose zu erzeugen (Abbildung 1G). Vernähen Sie es mit der gleichen Methode wie in den Schritten 2.6-2.7 (Abbildung 1H-K).
HINWEIS: Überprüfen Sie die Naht an der Anastomosenecke, um Anastomosenleckagen zu reduzieren. - Ligustieren Sie den Darm mit der Mikrozange und schneiden Sie den Darm mit der Mikroschere. Ligatur des Zwölffingerdarms mit einer 6-0-Seidennaht, 2 mm vom distalen Ende der Zwölffingerdarm-Jejunalanastomose entfernt. Schneiden Sie mit einer Mikroschere in der Mitte und nähen Sie den Stumpf mit einer 10-0 Seidennaht (Abbildung 1L).
HINWEIS: Die gastroduodenalen Gefäße verzweigen sich senkrecht zum Kopf der Bauchspeicheldrüse und grenzen an den Pylorus, was eine sorgfältige Untersuchung der Gefäße im Querschnitt erfordert. Der Zusammenfluss von Gallengang communis und Duodenum wurde lokalisiert, wobei darauf geachtet wurde, dass weder die Bauchspeicheldrüse noch der gemeinsame Gallengang beschädigt wurden. - Spülen Sie die Bauchhöhle mit 30 °C Kochsalzlösung aus. Führe den Darm wieder in die Bauchhöhle zurück. Nähen Sie den Muskel und die Haut separat mit einer 6-0 Seide. Desinfizieren Sie dann die Haut mit einem Jodophor.
- Nach der Operation 30 °C Kochsalzlösung (30 ml/kg) subkutan in den Rücken injizieren, um eine Austrocknung zu verhindern. Injizieren Sie Penicillin (10 mg/kg) intramuskulär, um eine Infektion zu verhindern.
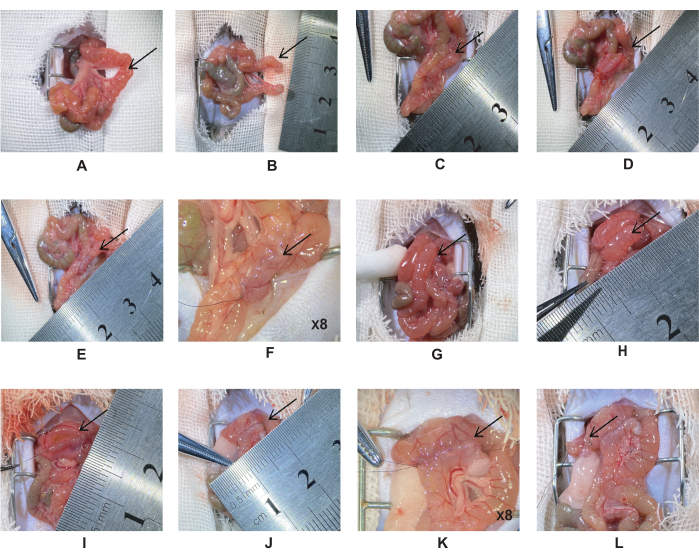
Abbildung 1: Duodenal-Jejunal-Bypass-Verfahren. (A) Lage des Jejunums 5 cm distal des Bandes von Treitz. (B) Ligatur des Jejunums mit 6-0 Seide verdoppeln und durch die Mitte der Ligatur schneiden. (C) Jejunal-Jejunal-Anastomose. (D) Machen Sie einen 0,5-0,6 cm langen Schnitt und nähen Sie die hintere Wand. (E-F) Vollständige Jejunal-Jejunal-Anastomose. (G) Ziehen Sie das distale Jejunal 1 cm unterhalb des Pylorus zum Zwölffingerdarm. (H) Duodenal-Jejunal-Anastomose. (I) Schneiden Sie die Zwölffingerdarm-Jejunal-Anastomose mit einem 0,5-0,6 cm langen Schnitt und vernähen Sie die hintere Wand mit einer einfachen durchgehenden Naht. (J-K) Vollständige Duodenal-Jejunal-Anastomose. (L) Bei 2 mm Abstand von der distalen zur Zwölffingerdarm-Jejunalanastomose den Zwölffingerdarm mit 6-0 Seide doppelt ligatisieren und die Mitte der Ligatur durchschneiden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Allgemeine postoperative Betreuung
- Legen Sie die Mäuse nach der Operation auf eine Heizdecke, um eine Unterkühlung zu vermeiden. Lassen Sie die Mäuse frei kriechen, bis sie vollständig wach sind, bevor Sie in ihre Käfige zurückkehren.
- Beschränken Sie am postoperativen Tag die Nahrungs- und Wassermenge und injizieren Sie 2 ml Kochsalzlösung subkutan in den Rücken der Mäuse. Geben Sie am ersten postoperativen Tag 10 ml 10% Glukose und ein funktionelles Getränk (Verhältnis 1:1) ohne Nahrung und injizieren Sie 1 ml Kochsalzlösung subkutan.
- Füttern Sie die Mäuse am zweiten und dritten postoperativen Tag mit einer Mischung aus 20 ml 10% Glukose und einem funktionellen Getränk. Geben Sie den Mäusen nach dem vierten Tag reines Wasser und eine fettreiche Ernährung. Die Übergangsfütterung sollte entsprechend dem postoperativen Erholungsstatus in der folgenden Reihenfolge erfolgen: Lösung, halbflüssige oder feste Nahrung.
- Postoperative Analgesie: Injizieren Sie Buprenorphin (0,1 mg/kg) alle 12 Stunden von Tag 1 bis 3 und dann einmal täglich bis zum Tag 5.
- Beobachten Sie nach der Operation die Fütterungsbedingungen, die Aktivität, den Kot und die Wundheilung der Mäuse.
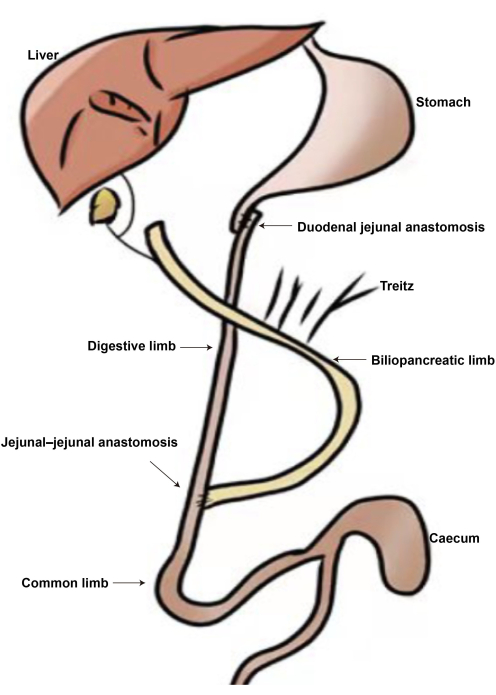
Abbildung 2: Das Diagramm der DJB-Operation. (A) Duodenal-Jejunal-Anastomose. (B) Jejunal-Jejunal-Anastomose. (C) Biliopankreatische Gliedmaße. (D) Verdauungsglied. (E) Gemeinsame Gliedmaße. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
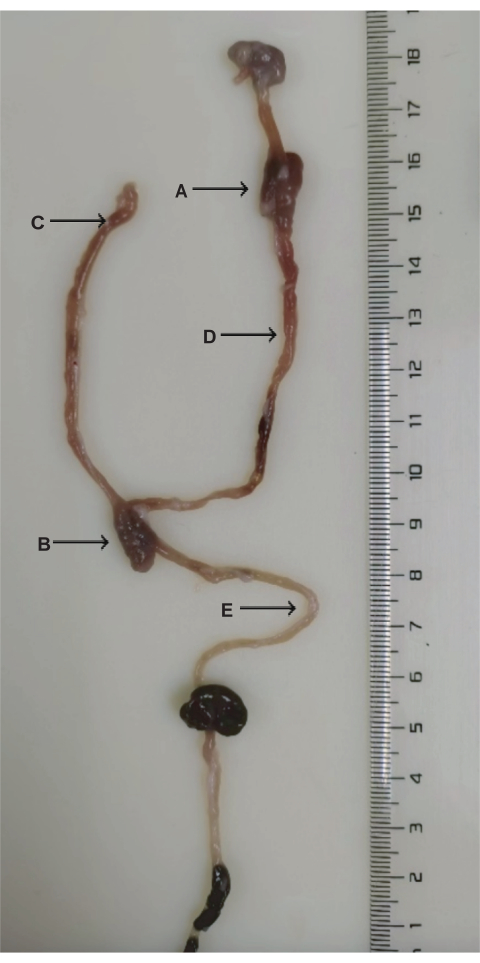
Abbildung 3: Anatomie der DJB-Chirurgie. (A) Duodenal-Jejunal-Anastomose. (B) Jejunal-Jejunal-Anastomose. (C) Biliopankreatische Gliedmaße. (D) Verdauungsglied. (E) Gemeinsame Gliedmaße. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Postoperative Bewertung der metabolischen Parameter
- Messung des Körpergewichts
- Fasten Sie die Mäuse 8 h vor der Messung. Wiegen Sie die Mäuse 8 Wochen lang wöchentlich am Montag vor und nach der Operation.
- Messung der Nahrungsaufnahme
- Halten Sie eine Maus in jedem Käfig. Messen Sie die Menge an fester Nahrung in jedem Käfig vor und nach 24 Stunden. Die Differenz zwischen den beiden Werten stellt die tägliche Nahrungsaufnahme dar.
- Stichprobenartige Blutzuckermessung
- Entnehmen Sie am wöchentlichen Montag der Messung um 8:00 Uhr einen Tropfen Blut von der Spitze des Mausschwanzes und geben Sie ihn auf einen Glukosestreifen, der in das Blutzuckermessgerät eingeführt wird.
- Oraler Glukosetoleranztest
- Acht Wochen nach der DJB-Operation fasten Sie die Mäuse 8 Stunden lang, bevor Sie den oralen Glukosetoleranztest durchführen. Sammeln Sie einen Tropfen Blut von der Spitze des Mausschwanzes und legen Sie ihn auf einen Glukosestreifen, der in das Blutzuckermessgerät eingeführt wird. Verabreichen Sie eine orale Dosis von 20 % D-Glukose (2 g/kg). Messen Sie den Blutzuckerspiegel nach 0, 15, 30, 60, 90, 120, 150 und 180 Minuten nach der Sonde.
Ergebnisse
Rahmenbedingungen
Die mittlere Operationszeit für das DJB-Verfahren betrug 84,5 ± 2,6 Minuten. Fünfzehn Mäuse wurden einer DJB-Operation unterzogen, neun Mäuse überlebten. Wie in Tabelle 1 gezeigt, ereigneten sich die meisten Todesfälle während der Operation oder in den folgenden 7 Tagen. Die Ursachen für den postoperativen Tod waren Blutungen (n=2) am postoperativen Tag 1, Anastomosenleckagen (n=1) am postoperativen Tag 4, Anastomosenobstruk...
Diskussion
Im Jahr 1953 führten Varco et al.18 den ersten jejuno-ilealen Bypass als Beginn der bariatrischen Chirurgie durch. Seitdem wurden zahlreiche bariatrische Operationen von Chirurgen durchgeführt. Diese Operationen haben zu Gewichtsverlust und verbesserten metabolischen Komplikationen geführt 4,19,20. Darüber hinaus führten Mason und Ito21 1967 d...
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Diese Studie wurde durch einen Zuschuss des Science and Technology Planning Project der Provinz Guangdong in China (Nr. 202002020069) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Abdominal retractor | F.S.T | 17000-03 | Colibri Retractor -3cm,retractor range 1.5cm/3cm long |
| 1% sodium pentobarbital solution | Guangzhou Chemical Reagent Factory | / | Dissolved 500mg of pentobarbital sodium powder in 50ml of normal saline to obtain 1% pentobarbital sodium solution. |
| Benzylpenicillin sodium for Injection | North China Pharmaceutical Company Ltd. | F2062121 | Penicillin |
| Buprenorphine | Guangzhou Chemical Reagent Factory | / | Analgesia |
| Buprenorphine | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Analgesic |
| Citric acid-sodium citrate buffer | LEAGENE | R00522 | Buffer solution |
| Cotton buds | HaoZheng Medical | 60220610 | Cotton swabs |
| Depilatory paste | Veet | AAPR-S222 | Hair removal cream |
| Ear tag | ZEYA | SUS304 | Ear-mark |
| Electric blanket | ZOSEN | ZS-CWDRT | Heat pad |
| Electronic scale | WETTLER TOLEDO | 20060902-6 | Measure the weight |
| Enteral nutritional powder | Abbott Laboratories | / | Nutrition powder |
| Eye ointment | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Protect the eyes |
| Glucometer | Roche | 6993788001 | Assess blood glucose |
| Graphpad Prism version 9.4.1 | GraphPad Software | version 9.4.1 | Software for statistical analysis |
| High-fat diet (High Fat [60FDC] Purified Rodent Diet) | Dyets | 112252 | 60kcal% High Fat Diet |
| Micro Forceps | Jinzhong Medical | 18-1140 | Micro forceps |
| Micro needle holder | Jinzhong Medical | EMT-160-Z | Needle holder |
| Micro Scissors | Jinzhong Medical | YBC010 | Micro scissors |
| Microscope camera | LAPSUN | E 2000 | Video |
| Ophthalmic scissors | Jinzhong Medical | Y00030 | Surgical scissors |
| Pentobarbital | Guangzhou Chemical Reagent Factory | / | Narcosis |
| Sodium chloride Injection | Guangzhou Otsuka Pharmaceutical Co., Ltd | B21L0301 | NaCl 0.9% |
| Stereo microscope | ZEISS | Stemi 305 | Binocular stereomicroscope |
| Streptozotocin | Sigma | S110910-1g | STZ |
| Suture line | LINGQIAO SUTURE | ZS-LQPMRZ5/0 | Prolene 6/0,Prolene 10/0 |
| Tissue forceps | Jinzhong Medical | H1701 | Surgical forceps |
Referenzen
- Lascar, N., Brown, J., Pattison, H., Barnett, A. H., Bailey, C. J., Bellary, S. Type 2 diabetes in adolescents and young adults. Lancet Diabetes Endocrinol. 6 (1), 69-80 (2018).
- Song, Y., Zhao, F. Bibliometric analysis of metabolic surgery for type 2 diabetes: current status and future prospects. Updates Surg. 74 (2), 697-707 (2022).
- Cummings, D. E., Rubino, F. Metabolic surgery for the treatment of type 2 diabetes in obese individuals. Diabetologia. 61 (2), 257-264 (2018).
- Buchwald, H. The evolution of metabolic/bariatric surgery. Obes Surg. 24 (8), 1126-1135 (2014).
- Akalestou, E., Miras, A. D., Rutter, G. A., le Roux, C. W. Mechanisms of weight loss after obesity surgery. Endocr Rev. 43 (1), 19-34 (2022).
- Rubino, F., et al. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes. Ann Surg. 244 (5), 741-749 (2006).
- Rubino, F., Marescaux, J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg. 239 (1), 1-11 (2004).
- Akalestou, E., et al. Establishing a successful rat model of duodenal- jejunal bypass: A detailed guide. Lab Anim. 53 (4), 362-371 (2019).
- Yu, H. H., Hsieh, M. C., Wu, S. Y., Sy, E. D., Shan, Y. S. Effects of duodenal-jejunal bypass surgery in ameliorating nonalcoholic steatohepatitis in diet-induced obese rats. Diabetes Metab Syndr Obes. 12, 149-159 (2019).
- Garciacaballero, M., Navarrete, S., Favretti, F., Celik, A., Del Castillo, D. Diabetes surgery in type 2 BMI 24-29 vs IMC 30-34 diabetic patients: is there differences among restrictive, malabsorptive and gastric bypass procedures. Nutr Hosp. 28 (2), 23-30 (2013).
- Vidal, J., Jiménez, A. Diabetes remission following metabolic surgery: is GLP-1 the culprit. Curr Atheroscler Rep. 15 (10), 357 (2013).
- Speck, M., Cho, Y. M., Asadi, A., Rubino, F., Kieffer, T. J. Duodenal-jejunal bypass protects GK rats from {beta}-cell loss and aggravation of hyperglycemia and increases enteroendocrine cells coexpressing GIP and GLP-1. Am J Physiol Endocrinol Metab. 300 (5), E923-E932 (2011).
- Ashrafian, H., et al. Metabolic surgery: an evolution through bariatric animal models. Obes Rev. 11 (12), 907-920 (2010).
- Rao, R. S., Rao, V., Kini, S. Animal models in bariatric surgery--a review of the surgical techniques and postsurgical physiology. Obes Surg. 20 (9), 1293-1305 (2010).
- Im, Y. R., et al. A systematic review of animal models of NAFLD finds high-fat, high-fructose diets most closely resemble human NAFLD. Hepatology. 74 (4), 1884-1901 (2021).
- Kleinert, M., et al. Animal models of obesity and diabetes mellitus. Nat Rev Endocrinol. 14 (3), 140-162 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Curr Protoc. 1 (4), e78 (2021).
- Buchwald, H., Varco, R. L., Moore, R. B., Schwartz, M. Z. Intestinal bypass procedures. Partial ileal bypass for hyperlipidemia and jejunoileal bypass for obesity. Curr Probl Surg. , 1-51 (1975).
- DeMaria, E. J. Bariatric surgery for morbid obesity. N Engl J Med. 356 (21), 2176-2183 (2007).
- Bolling, C. F., Armstrong, S. C., Reichard, K. W., Michalsky, M. P. Metabolic and bariatric surgery for pediatric patients with severe obesity. Pediatrics. 144 (6), e20193224 (2019).
- Mason, E. E. Gastric bypass for morbid obesity. Surg Annu. 11, 99-126 (1979).
- Cheng, Y., et al. Sleeve gastrectomy with bypass of proximal small intestine provides better diabetes control than sleeve gastrectomy alone under postoperative high-fat diet. Obes Surg. 29 (1), 84-92 (2019).
- Rubino, F., et al. The role of the small bowel in the regulation of circulating ghrelin levels and food intake in the obese Zucker rat. Endocrinology. 146 (4), 1745-1751 (2005).
- Zachariah, P. J., et al. Compared to sleeve gastrectomy, duodenal-jejunal bypass with sleeve gastrectomy gives better glycemic control in T2DM patients, with a lower β-cell response and similar appetite sensations: mixed-meal study. Obes Surg. 26 (12), 2862-2872 (2016).
- Jiang, B., et al. Role of proximal intestinal glucose sensing and metabolism in the blood glucose control in type 2 diabetic rats after duodenal jejunal bypass surgery. Obes Surg. 32 (4), 1119-1129 (2022).
- Han, H. F., et al. Duodenal-jejunal bypass increases intraduodenal bile acids and upregulates duodenal SIRT1 expression in high-fat diet and streptozotocin-induced diabetic rats. World J Gastroenterol. 28 (31), 4338-4350 (2022).
- Yan, S., et al. Reduction of intestinal electrogenic glucose absorption after duodenojejunal bypass in a mouse model. Obes Surg. 23 (9), 1361-1369 (2013).
- Arble, D. M., et al. Metabolic comparison of one-anastomosis gastric bypass, single-anastomosis duodenal-switch, Roux-en-Y gastric bypass, and vertical sleeve gastrectomy in rat. Surg Obes Relat Dis. 14 (12), 1857-1867 (2018).
- Liang, Y., et al. Duodenal-jejunal bypass surgery reverses diabetic phenotype and reduces obesity in db/db Mice. Curr Chem Genom Transl Med. 11, 41-49 (2017).
- Barataud, A., et al. Absence of role of dietary protein sensing in the metabolic benefits of duodenal-jejunal bypass in the mouse. Sci Rep. 7, 44856 (2017).
- . Close-up on lab animal microsurgery. Lab Anim (NY). 35 (1), 43 (2006).
- Couceiro, J., Castro, R., Tien, H., Ozyurekoglu, T. Step by step: microsurgical training method combining two nonliving animal models. J Vis Exp. (99), e52625 (2015).
- Nasser, K. M., Wahba, H. A., Kamal, E., El-Makhzangy, A. M., Bahaa, N. Animal model for training and improvement of the surgical skills in endolaryngeal microsurgery. J Voice. 26 (3), 351-357 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten