A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח מעקפים תריסריון-ג'ג'ונל בעכברים סוכרתיים שמנים הנגרמים על ידי דיאטה
* These authors contributed equally
In This Article
Summary
ניתוח מעקף תריסריון-ג'ג'ונל (DJB) יכול לשפר את חילוף החומרים של גלוקוז ולהפחית את התנגודת לאינסולין. כאן, אנו מציגים פרוטוקול להקמת מודל עכבר יציב ואמין של DJB.
Abstract
השכיחות של השמנת יתר וסוכרת מסוג 2 היא דאגה בריאותית עולמית רצינית. השמנת יתר היא גורם פתוגני מרכזי בסוכרת מסוג 2, מחלות לב וכלי דם וסוגי סרטן מסוימים. ניתוח בריאטרי מציע אפשרות טיפול ארוכת טווח ויעילה הן בהשמנת יתר והן בסוכרת. כריתת קיבה בשרוול (SG) ומעקף קיבה Roux-en-Y (RYGB) מוכרים באופן נרחב כניתוחים בריאטריים הפופולריים ביותר. בנוסף, מספר ניתוחים בריאטריים גישוש הדגימו השפעות טיפוליות מבטיחות. מעקף התריסריון-ג'ג'ונל (DJB), המותאם במיוחד לחולי סוכרת עם מדד מסת גוף נמוך, הראה תוצאות מטבוליות מועילות. עם זאת, היתרונות המטבוליים הבלתי תלויים במשקל שלו אינם מובנים במלואם בשל מודלים מוגבלים של בעלי חיים. במאמר זה, אנו מתארים את פרוטוקולי הטיפול הממוטבים ואת הטכניקות הכירורגיות לביצוע ניתוח DJB בעכברים סוכרתיים הסובלים מהשמנת יתר הנגרמת על ידי דיאטה (DIO). שימוש במודל עכבר תורם להבנה טובה יותר של אופי השינויים הנגרמים על ידי ניתוח DJB תוך הקלה על פרקטיקה קלינית קשורה.
Introduction
השמנת יתר וסוכרת מסוג 2 הן המחלות הכרוניות הנפוצות ביותר בעולם, ושכיחותן עולה בקרב צעירים1. ניתוח בריאטרי הוא הטיפול היעיל ביותר בהשמנת יתר וסוכרת, המאפשר יציבות גלוקוז בדם לטווח ארוך תוך שיפור הסיבוכים הקשורים להשמנת יתר 2,3. ישנם מספר סוגים של ניתוחים בריאטריים, מסווגים לפי האם הם מפחיתים נפח קיבה או ספיגת מעיים; אלה כוללים הגבלה, malabsorptive, ושילוב 4,5.
מעקף התריסריון-ג'ג'ונל (DJB) פותח לראשונה על ידי רובינו ומרסקו, שהראו כי ניתן להקל על סוכרת מסוג 2 על ידי חיבור התריסריון והג'ג'ונום במקום על ידי הפחתת נפח הקיבה 6,7. DJB משמר את כל הקיבה ועוקף את התריסריון כולו ואת הג'ג'ונום הפרוקסימלי. המעי מחולק biliopancreatic, העיכול, ואת הגפיים הנפוצות 6,8. DJB חולק כמה קווי דמיון עם ניתוחים בריאטריים, כולל מעקף קיבה Roux-en-Y (RYGB), מיני מעקף קיבה, מעקף biliopancreatic, הסחת התריסריון, ו DJB בתוספת שרוול gastrectomy9. בהשוואה ל- RYGB, DJB אינו דורש אנסטומוזה במערכת העיכול, המפחיתה את זמן הניתוח ומשפרת את שיעור ההצלחה של ההליך. DJB דומה ל- RYGB בשיפור חילוף החומרים של גלוקוז אך אינו משפיע על משקל הגוף10. לאחר ניתוח DJB, אספקת מזון מהירה למעי הדק הדיסטלי מעוררת את הפרשת פפטיד דמוי גלוקגון-1 (GLP-1), וכתוצאה מכך מטבוליזם גלוקוז משופר11,12.
השימוש במודלים של בעלי חיים חיוני להבנת המסלולים המטבוליים, התאיים והמולקולריים. מודלים של ניתוחים בריאטריים בבעלי חיים תרמו להבנתנו את המנגנונים הפוטנציאליים העומדים בבסיס השמנת יתר וסוכרת13,14. עם זאת, בשל ההבדלים הפיזיולוגיים בין המינים, אי אפשר לשכפל באופן מושלם מחלות אנושיות במודלים של בעלי חיים15. בין מודלים שונים של בעלי חיים הזמינים למטרות מחקר, מודל העכבר להשמנת יתר הנגרמת על ידי דיאטה (DIO) דומה ביותר להשמנת יתר אנושית ולתסמונת מטבולית16. עכברים נבחרו לניתוח DJB כדי לקבוע את היתכנות הניתוח ולספק טכניקות למחקר נוסף. כתב יד זה מספק סיכום מקיף הן של היבטים טכניים והן של פרטים ניסיוניים של ניתוח DJB.
Protocol
כל צעדי הפרוטוקול המתוארים להלן פועלים בהתאם להנחיות הוועדה לטיפול ושימוש בבעלי חיים של בית החולים הכללי של פיקוד הזירה הדרומית תחת מספר האישור 2020112501.
1. הכנה כללית לפני הניתוח
הערה: נרכשו 30 עכברי C57BL/6 זכרים בני 6 שבועות. עכברים שוכנו במעבדה ספציפית נטולת פתוגן (SPF) תחת מחזור אור/חושך של 12 שעות; טמפרטורה, 22 ± 2 °C (75 °F); ולחות, 55-65%. עכברים קיבלו גישה חופשית למים והוזנו בתזונה של 60% שומן קק"ל במשך 6 שבועות כדי לגרום להשמנת יתר. זריקה תוך צפקית של סטרפטוזוטוצין 40 מ"ג/ק"ג ניתנה במשך 5 ימים לגרימת סוכרת17. בין שלושים העכברים, עשרים ושניים עכברים נבדקו לגלוקוז אקראי בדם > 300 מ"ג / ד"ל וחולקו באופן אקראי לקבוצות DJB (n = 15) וניתוחי דמה (n = 7). שמונה עכברים לא נכללו בניסוי בשל רמת גלוקוז נמוכה בדם.
- צום את העכברים במשך 8 שעות לפני הניתוח. יש להוציא מים שעתיים לפני הניתוח.
- מתן 1% נתרן pentobarbital פתרון (6 מ"ל / ק"ג) ו buprenorphine (1 מ"ג / ק"ג) intraperitonely. גע בבהונות או בזנבות של העכברים עם מלקחיים וודא שהעכברים אינם מראים עוויתות או רעידות ברורות. תחת הרדמה מספקת, העכברים יכולים לנשום בחופשיות ללא תוספת חמצן.
- הניחו את העכברים במצב שכיבה על לוח סטרילבורד ומתחת לסטריאומיקרוסקופ. יש למרוח משחת עיניים על העיניים. השתמשו בשמיכה חשמלית כדי לשמור על חום העכברים לאורך כל ההליך. השתמש בהליכים סטריליים, כולל חלוקים כירורגיים, כפפות סטריליות ומכשירים אוטוקלאביים.
- בעכברי בקרת דמה, יש לבצע את שני החתכים בהתאמה בתריסריון 1 ס"מ מתחת לפילורוס ובג'ג'ונום 5 ס"מ מתחת לטרייץ ולאחר מכן לתפור את החתכים.
2. מעקף התריסריון: הליך כירורגי
- החל את הדבק depilatory מן xiphoid על הבטן כדי להסיר שיער מאזור זה. נגבו את הקרם וודאו שהעור נקי. יש לקרצף את האזור שלוש פעמים עם קרצוף לסירוגין של תמיסות יוד ואלכוהול.
- מכסים את העכבר בשריטה סטרילית, משאירים את אזור הניתוח חשוף, ומבצעים חתך של 2 ס"מ מהקסיפואיד לבטן.
- השתמש retractor הבטן לחשוף את חלל הבטן. הרחיקו את שומן הבטן באמצעות צמר גפן רטוב, והזיזו את הכבד לצד הצפלי כדי לחשוף באופן מלא את הקיבה והמעיים.
- הקיבה והפילורוס נמצאים מתחת לכבד, והרצועה של טרייץ נמצאת בתריסריון הדיסטלי. לקשור פעמיים את הג'ג'ונום, 5 ס"מ דיסטלי לרצועה של טרייץ עם תפר משי 6-0 (איור 1A). חתכו את הג'ג'ונום בנקודת האמצע של שתי הקשירות ותפרו את גדם הג'ג'ונל בתפר משי 10-0 (איור 1B).
הערה: הימנעו מפיתול כלי הדם המזנטריים. - משוך את החתך הג'ג'ונלי הפרוקסימלי 5 ס"מ לאורך המעי אל הג'ג'ונום כדי ליצור אנסטומוזה ג'ג'ונלית-ג'ג'ונלית. יישרו את שני המעיים בצורה אופקית, ולאחר מכן השתמשו בתפר משי 10-0 כדי ליצור את האנסטומוזה הצידית (איור 1C).
הערה: במהלך הניתוח, יש לשמור על לחות המעי עם מי מלח כדי להפחית את איבוד המים. זה ימנע מהמעי להתכרבל ויקל על התפרים. - אבטחו את שני קצוות המעי וחתכו את החתך לאורך שווה (איור 1D). תפרו את השכבה השנייה של דופן המעי האחורית בתפר רציף בעובי מלא.
הערה: אורך החתך הוא כ 0.5-0.6 ס"מ, ומרחק המחט הוא ~ 0.5 מ"מ. - אבטחו את שני קצוות המעי ותפרו את הדופן הקדמית של המעי. תפרו את השכבה הראשונה של הדופן הקדמית בתפר רציף פשוט ואת השכבה השנייה בתפר וארוס אופקי (איור 1E-F).
הערה: יש לספוג את תוכן המעי עם צמר גפן כדי למנוע זיהום של חלל הבטן. - משכו את החתך הג'ג'ונלי הדיסטלי לתוך התריסריון 1 ס"מ מתחת לפילורוס כדי ליצור אנסטומוזה תריסריון-ג'ג'ונלי (איור 1G). תפרו אותו באותה שיטה כמו בשלבים 2.6-2.7 (איור 1H-K).
הערה: בדוק את התפר בפינה האנסטומוטית כדי להפחית דליפה אנסטומטית. - קשרו את המעי עם מלקחיים מיקרו וחתכו את המעי עם מספריים מיקרו. תריסריון כפול בתפר משי 6-0, 2 מ"מ מהקצה הדיסטלי של האנסטומוזה התריסריון-ג'ג'ונל. חתכו בנקודת האמצע עם מספריים זעירים ותפרו את הגדם בתפר משי 10-0 (איור 1L).
הערה: כלי הדם במערכת העיכול מסתעפים בניצב לראש הלבלב וצמודים לפילורוס, מה שמחייב חקירה זהירה של כלי הדם בחתך הרוחבי. המפגש של צינור המרה המשותף והתריסריון היה ממוקם, תוך הקפדה שלא לפגוע בלבלב או בצינור המרה המשותף. - יש לשטוף את חלל הבטן במי מלח בטמפרטורה של 30°C. להחזיר את המעי לחלל הבטן. תפרו את השריר והעור בנפרד עם משי 6-0. לאחר מכן, לחטא את העור עם יודופור.
- לאחר הניתוח, יש להזריק 30°C מלוחים (30 מ"ל/ק"ג) תת עורית בגב כדי למנוע התייבשות. יש להזריק פניצילין (10 מ"ג/ק"ג) תוך שרירית למניעת זיהום.
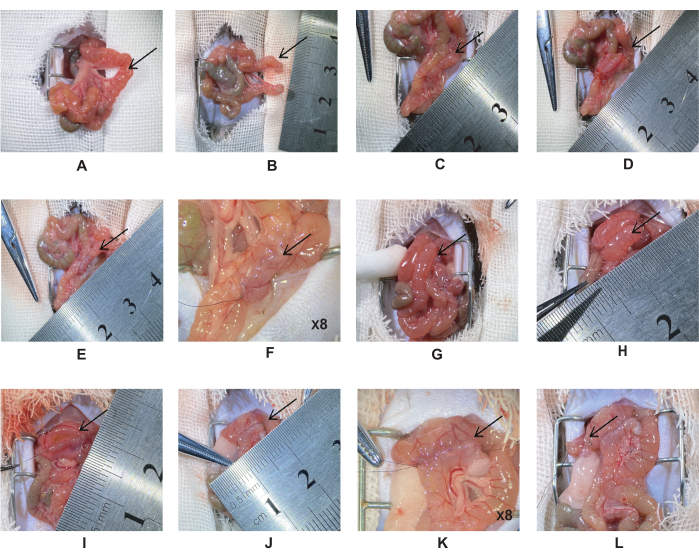
איור 1: הליך מעקף תריסריון-ג'ג'ונל. (A) מיקום הג'ג'ונום 5 ס"מ דיסטלי לרצועה של טרייץ. (B) לקשור פעמיים את הג'ג'ונום עם משי 6-0, לחתוך דרך אמצע הליגטורה. (C) אנסטומוזה ג'ג'ונלית-ג'ג'ונלית. (D) לבצע חתך של 0.5-0.6 ס"מ, ולתפור את הדופן האחורית. (ה-ו) אנסטומוזה ג'ג'ונלית-ג'ג'ונלית מלאה. (G) משכו את הג'ג'ונל הדיסטלי לתריסריון 1 ס"מ מתחת לפילורוס. (H) אנסטומוזה תריסריון-ג'ג'ונלית. (I) לחתוך את האנסטומוזה התריסריון-ג'ג'ונל בחתך של 0.5-0.6 ס"מ ולתפור את הדופן האחורית בתפר רציף פשוט. (י-ק) אנסטומוזה מלאה של התריסריון. (L) במרחק של 2 מ"מ מהדיסטלי לאנסטומוזה התריסריון-ג'ג'ונלי, יש לקשור את התריסריון במשי 6-0 ולחתוך דרך אמצע הליגטורה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. טיפול כללי לאחר הניתוח
- לאחר הניתוח, הניחו את העכברים על שמיכה חשמלית למניעת היפותרמיה. אפשרו לעכברים לזחול בחופשיות עד שהם ערים לחלוטין לפני שהם חוזרים לכלובים שלהם.
- ביום שלאחר הניתוח, להגביל את המזון והמים ולהזריק 2 מ"ל של מלוחים תת עורית לתוך החלק האחורי של העכברים. ביום הראשון שלאחר הניתוח, לתת 10 מ"ל של 10% גלוקוז משקה פונקציונלי (יחס 1: 1) ללא מזון, ולהזריק 1 מ"ל של מלוחים תת עורית.
- בימים השני והשלישי שלאחר הניתוח, להאכיל את העכברים עם תערובת של 20 מ"ל של 10% גלוקוז ומשקה פונקציונלי. לאחר היום הרביעי, תנו לעכברים מים טהורים ותזונה עתירת שומן. האכלת מעבר צריכה להתבצע על פי מצב ההתאוששות לאחר הניתוח בסדר הבא: תמיסה, מזון נוזלי למחצה או מוצק.
- שיכוך כאבים לאחר הניתוח: להזריק buprenorphine (0.1 מ"ג / ק"ג) כל 12 שעות מ ימים 1 עד 3, ולאחר מכן פעם ביום עד יום 5.
- לאחר הניתוח, שימו לב לתנאי ההאכלה, הפעילות, הצואה וריפוי הפצעים של העכברים.
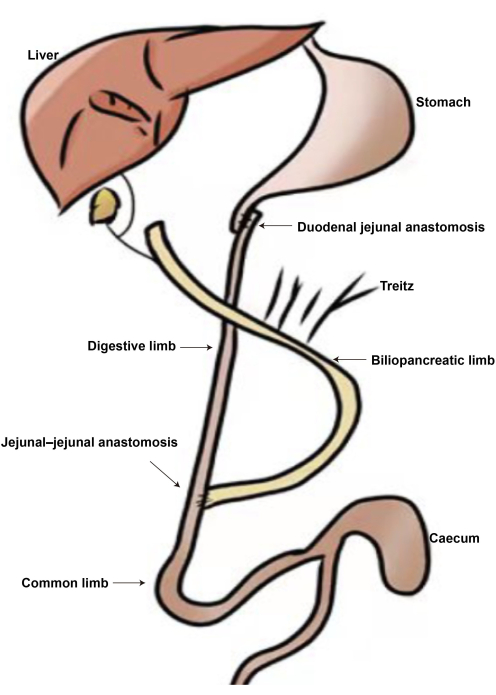
איור 2: התרשים של ניתוח DJB. (A) אנסטומוזה תריסריון-ג'ג'ונל. (B) אנסטומוזה ג'ג'ונלית-ג'ג'ונלית. (C) איבר ביליו-לבלבלב. (D) איבר העיכול. (ה) איבר משותף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
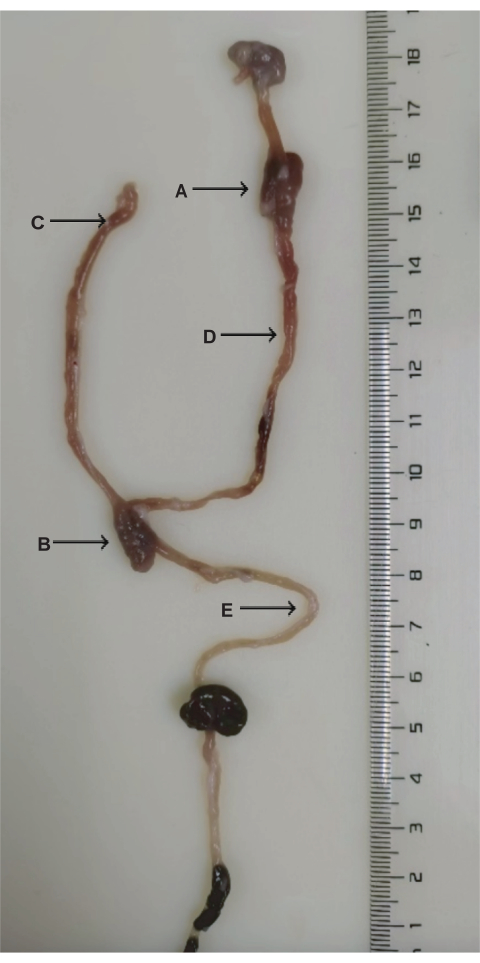
איור 3: אנטומיה של ניתוחי DJB. (A) אנסטומוזה תריסריון-ג'ג'ונלית. (B) אנסטומוזה ג'ג'ונלית-ג'ג'ונלית. (C) איבר ביליו-לבלבלב. (D) איבר העיכול. (ה) איבר משותף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. הערכה לאחר הניתוח של פרמטרים מטבוליים
- מדידת משקל גוף
- צמו את העכברים במשך 8 שעות לפני המדידה. יש לשקול את העכברים מדי שבוע ביום שני לפני ואחרי הניתוח במשך 8 שבועות.
- מדידת צריכת מזון
- אחסנו עכבר אחד בכל כלוב. מדדו את כמות המזון המוצק בכל כלוב לפני ואחרי 24 שעות. ההבדל בין שני הערכים מייצג את צריכת המזון היומית.
- מדידת גלוקוז אקראית בדם
- בשעה 8:00 בבוקר ביום שני השבועי של המדידה, אספו טיפת דם מקצה זנב העכבר ומרחו אותה על רצועת גלוקוז המוחדרת לגלוקומטר.
- בדיקת סבילות לגלוקוז דרך הפה
- שמונה שבועות לאחר ניתוח DJB, מהר את העכברים במשך 8 שעות לפני בדיקת סובלנות גלוקוז דרך הפה. אספו טיפת דם מקצה זנב העכבר והניחו אותה על רצועת גלוקוז המוחדרת לגלוקומטר. מתן מינון פומי של 20% D-גלוקוז (2 גרם / ק"ג). למדוד את רמות הגלוקוז בדם ב 0, 15, 30, 60, 90, 120, 150, ו 180 דקות לאחר gavage.
תוצאות
תנאים כלליים
זמן הניתוח הממוצע של הליך DJB היה 84.5 ± 2.6 דקות. 15 עכברים עברו ניתוח DJB, תשעה עכברים שרדו. כפי שניתן לראות בטבלה 1, רוב מקרי המוות התרחשו במהלך הניתוח או ב-7 הימים שלאחריו. הגורמים למוות לאחר הניתוח היו דימום (n=2) ביום 1 לאחר הניתוח, דליפה אנסטומוט?...
Discussion
בשנת 1953 ביצעו Varco et al.18 את המעקף הג'ג'ונו-איליאלי הראשון כתחילת הניתוח הבריאטרי. מאז, ניתוחים בריאטריים רבים בוצעו על ידי מנתחים. ניתוחים אלה הביאו לירידה במשקל ושיפרו את הסיבוכים המטבוליים 4,19,20. יתר על כן, בש?...
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
מחקר זה נתמך על ידי מענק מפרויקט תכנון המדע והטכנולוגיה של מחוז גואנגדונג בסין (מס '202002020069).
Materials
| Name | Company | Catalog Number | Comments |
| Abdominal retractor | F.S.T | 17000-03 | Colibri Retractor -3cm,retractor range 1.5cm/3cm long |
| 1% sodium pentobarbital solution | Guangzhou Chemical Reagent Factory | / | Dissolved 500mg of pentobarbital sodium powder in 50ml of normal saline to obtain 1% pentobarbital sodium solution. |
| Benzylpenicillin sodium for Injection | North China Pharmaceutical Company Ltd. | F2062121 | Penicillin |
| Buprenorphine | Guangzhou Chemical Reagent Factory | / | Analgesia |
| Buprenorphine | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Analgesic |
| Citric acid-sodium citrate buffer | LEAGENE | R00522 | Buffer solution |
| Cotton buds | HaoZheng Medical | 60220610 | Cotton swabs |
| Depilatory paste | Veet | AAPR-S222 | Hair removal cream |
| Ear tag | ZEYA | SUS304 | Ear-mark |
| Electric blanket | ZOSEN | ZS-CWDRT | Heat pad |
| Electronic scale | WETTLER TOLEDO | 20060902-6 | Measure the weight |
| Enteral nutritional powder | Abbott Laboratories | / | Nutrition powder |
| Eye ointment | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Protect the eyes |
| Glucometer | Roche | 6993788001 | Assess blood glucose |
| Graphpad Prism version 9.4.1 | GraphPad Software | version 9.4.1 | Software for statistical analysis |
| High-fat diet (High Fat [60FDC] Purified Rodent Diet) | Dyets | 112252 | 60kcal% High Fat Diet |
| Micro Forceps | Jinzhong Medical | 18-1140 | Micro forceps |
| Micro needle holder | Jinzhong Medical | EMT-160-Z | Needle holder |
| Micro Scissors | Jinzhong Medical | YBC010 | Micro scissors |
| Microscope camera | LAPSUN | E 2000 | Video |
| Ophthalmic scissors | Jinzhong Medical | Y00030 | Surgical scissors |
| Pentobarbital | Guangzhou Chemical Reagent Factory | / | Narcosis |
| Sodium chloride Injection | Guangzhou Otsuka Pharmaceutical Co., Ltd | B21L0301 | NaCl 0.9% |
| Stereo microscope | ZEISS | Stemi 305 | Binocular stereomicroscope |
| Streptozotocin | Sigma | S110910-1g | STZ |
| Suture line | LINGQIAO SUTURE | ZS-LQPMRZ5/0 | Prolene 6/0,Prolene 10/0 |
| Tissue forceps | Jinzhong Medical | H1701 | Surgical forceps |
References
- Lascar, N., Brown, J., Pattison, H., Barnett, A. H., Bailey, C. J., Bellary, S. Type 2 diabetes in adolescents and young adults. Lancet Diabetes Endocrinol. 6 (1), 69-80 (2018).
- Song, Y., Zhao, F. Bibliometric analysis of metabolic surgery for type 2 diabetes: current status and future prospects. Updates Surg. 74 (2), 697-707 (2022).
- Cummings, D. E., Rubino, F. Metabolic surgery for the treatment of type 2 diabetes in obese individuals. Diabetologia. 61 (2), 257-264 (2018).
- Buchwald, H. The evolution of metabolic/bariatric surgery. Obes Surg. 24 (8), 1126-1135 (2014).
- Akalestou, E., Miras, A. D., Rutter, G. A., le Roux, C. W. Mechanisms of weight loss after obesity surgery. Endocr Rev. 43 (1), 19-34 (2022).
- Rubino, F., et al. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes. Ann Surg. 244 (5), 741-749 (2006).
- Rubino, F., Marescaux, J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg. 239 (1), 1-11 (2004).
- Akalestou, E., et al. Establishing a successful rat model of duodenal- jejunal bypass: A detailed guide. Lab Anim. 53 (4), 362-371 (2019).
- Yu, H. H., Hsieh, M. C., Wu, S. Y., Sy, E. D., Shan, Y. S. Effects of duodenal-jejunal bypass surgery in ameliorating nonalcoholic steatohepatitis in diet-induced obese rats. Diabetes Metab Syndr Obes. 12, 149-159 (2019).
- Garciacaballero, M., Navarrete, S., Favretti, F., Celik, A., Del Castillo, D. Diabetes surgery in type 2 BMI 24-29 vs IMC 30-34 diabetic patients: is there differences among restrictive, malabsorptive and gastric bypass procedures. Nutr Hosp. 28 (2), 23-30 (2013).
- Vidal, J., Jiménez, A. Diabetes remission following metabolic surgery: is GLP-1 the culprit. Curr Atheroscler Rep. 15 (10), 357 (2013).
- Speck, M., Cho, Y. M., Asadi, A., Rubino, F., Kieffer, T. J. Duodenal-jejunal bypass protects GK rats from {beta}-cell loss and aggravation of hyperglycemia and increases enteroendocrine cells coexpressing GIP and GLP-1. Am J Physiol Endocrinol Metab. 300 (5), E923-E932 (2011).
- Ashrafian, H., et al. Metabolic surgery: an evolution through bariatric animal models. Obes Rev. 11 (12), 907-920 (2010).
- Rao, R. S., Rao, V., Kini, S. Animal models in bariatric surgery--a review of the surgical techniques and postsurgical physiology. Obes Surg. 20 (9), 1293-1305 (2010).
- Im, Y. R., et al. A systematic review of animal models of NAFLD finds high-fat, high-fructose diets most closely resemble human NAFLD. Hepatology. 74 (4), 1884-1901 (2021).
- Kleinert, M., et al. Animal models of obesity and diabetes mellitus. Nat Rev Endocrinol. 14 (3), 140-162 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Curr Protoc. 1 (4), e78 (2021).
- Buchwald, H., Varco, R. L., Moore, R. B., Schwartz, M. Z. Intestinal bypass procedures. Partial ileal bypass for hyperlipidemia and jejunoileal bypass for obesity. Curr Probl Surg. , 1-51 (1975).
- DeMaria, E. J. Bariatric surgery for morbid obesity. N Engl J Med. 356 (21), 2176-2183 (2007).
- Bolling, C. F., Armstrong, S. C., Reichard, K. W., Michalsky, M. P. Metabolic and bariatric surgery for pediatric patients with severe obesity. Pediatrics. 144 (6), e20193224 (2019).
- Mason, E. E. Gastric bypass for morbid obesity. Surg Annu. 11, 99-126 (1979).
- Cheng, Y., et al. Sleeve gastrectomy with bypass of proximal small intestine provides better diabetes control than sleeve gastrectomy alone under postoperative high-fat diet. Obes Surg. 29 (1), 84-92 (2019).
- Rubino, F., et al. The role of the small bowel in the regulation of circulating ghrelin levels and food intake in the obese Zucker rat. Endocrinology. 146 (4), 1745-1751 (2005).
- Zachariah, P. J., et al. Compared to sleeve gastrectomy, duodenal-jejunal bypass with sleeve gastrectomy gives better glycemic control in T2DM patients, with a lower β-cell response and similar appetite sensations: mixed-meal study. Obes Surg. 26 (12), 2862-2872 (2016).
- Jiang, B., et al. Role of proximal intestinal glucose sensing and metabolism in the blood glucose control in type 2 diabetic rats after duodenal jejunal bypass surgery. Obes Surg. 32 (4), 1119-1129 (2022).
- Han, H. F., et al. Duodenal-jejunal bypass increases intraduodenal bile acids and upregulates duodenal SIRT1 expression in high-fat diet and streptozotocin-induced diabetic rats. World J Gastroenterol. 28 (31), 4338-4350 (2022).
- Yan, S., et al. Reduction of intestinal electrogenic glucose absorption after duodenojejunal bypass in a mouse model. Obes Surg. 23 (9), 1361-1369 (2013).
- Arble, D. M., et al. Metabolic comparison of one-anastomosis gastric bypass, single-anastomosis duodenal-switch, Roux-en-Y gastric bypass, and vertical sleeve gastrectomy in rat. Surg Obes Relat Dis. 14 (12), 1857-1867 (2018).
- Liang, Y., et al. Duodenal-jejunal bypass surgery reverses diabetic phenotype and reduces obesity in db/db Mice. Curr Chem Genom Transl Med. 11, 41-49 (2017).
- Barataud, A., et al. Absence of role of dietary protein sensing in the metabolic benefits of duodenal-jejunal bypass in the mouse. Sci Rep. 7, 44856 (2017).
- . Close-up on lab animal microsurgery. Lab Anim (NY). 35 (1), 43 (2006).
- Couceiro, J., Castro, R., Tien, H., Ozyurekoglu, T. Step by step: microsurgical training method combining two nonliving animal models. J Vis Exp. (99), e52625 (2015).
- Nasser, K. M., Wahba, H. A., Kamal, E., El-Makhzangy, A. M., Bahaa, N. Animal model for training and improvement of the surgical skills in endolaryngeal microsurgery. J Voice. 26 (3), 351-357 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved