Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Дуоденально-тоеюнальное шунтирование у мышей с ожирением, вызванным диетой и диабетом
* Эти авторы внесли равный вклад
В этой статье
Резюме
Операция дуоденально-тоеугольного шунтирования (DJB) может улучшить метаболизм глюкозы и снизить резистентность к инсулину. Здесь мы представляем протокол для создания стабильной и надежной мышиной модели DJB.
Аннотация
Распространенность ожирения и диабета 2 типа является серьезной проблемой глобального здравоохранения. Ожирение является основным патогенным фактором при диабете 2 типа, сердечно-сосудистых заболеваниях и некоторых видах рака. Бариатрическая хирургия предлагает долгосрочный и эффективный вариант лечения как ожирения, так и диабета. Рукавная гастрэктомия (SG) и шунтирование желудка Roux-en-Y (RYGB) широко признаны самыми популярными бариатрическими операциями. Кроме того, несколько исследовательских бариатрических операций продемонстрировали многообещающие терапевтические эффекты. Дуоденально-тощеечное шунтирование (DJB), специально разработанное для диабетиков с низким индексом массы тела, показало положительные метаболические результаты. Тем не менее, его метаболические преимущества, зависящие от веса, не до конца понятны из-за ограниченных животных моделей. В этой статье мы описываем оптимизированные протоколы ухода и хирургические методы для проведения операции DJB у мышей с диабетом, страдающих диетическим ожирением (DIO). Использование мышиной модели способствует лучшему пониманию природы изменений, вызванных хирургией DJB, одновременно облегчая соответствующую клиническую практику.
Введение
Ожирение и сахарный диабет 2 типа являются наиболее распространенными хроническими заболеваниями в мире, и их распространенность растет среди молодых людей1. Бариатрическая хирургия является наиболее эффективным методом лечения ожирения и диабета, способствуя долгосрочной стабильности уровня глюкозы в крови, а также улучшая осложнения, связанные с ожирением 2,3. Существует несколько видов бариатрической хирургии, классифицируемых по тому, уменьшают ли они объем желудка или всасывание в кишечнике; К ним относятся рестриктивный, мальабсорбционный и комбинированный 4,5.
Дуоденально-тощеечное шунтирование (DJB) было впервые разработано Рубино и Мареско, которые продемонстрировали, что диабет 2 типа может быть облегчен путем соединения двенадцатиперстной кишки и тощей кишки, а не путем уменьшения объема желудка 6,7. DJB сохраняет весь желудок и обходит всю двенадцатиперстную кишку и проксимальный отдел тощей кишки. Кишечник делится на билиопанкреатический, пищеварительный и общий конечности 6,8. DJB имеет некоторое сходство с бариатрическими операциями, включая шунтирование желудка Roux-en-Y (RYGB), мини-шунтирование желудка, билиопанкреатическое шунтирование, дуоденальное шунтирование и DJB плюс рукавная гастрэктомия9. По сравнению с RYGB, DJB не требует желудочно-кишечного анастомоза, что сокращает время операции и повышает вероятность успешности процедуры. DJB схож с RYGB в улучшении метаболизма глюкозы, но не влияет на массу тела10. После операции DJB быстрая доставка пищи в дистальный отдел тонкой кишки стимулирует секрецию глюкагоноподобного пептида-1 (GLP-1), что приводит к улучшению метаболизма глюкозы 11,12.
Использование животных моделей имеет важное значение для понимания метаболических, клеточных и молекулярных путей. Животные модели бариатрической хирургии внесли свой вклад в наше понимание потенциальных механизмов, лежащих в основе ожирения и диабета13,14. Однако из-за физиологических различий между видами невозможно идеально воспроизвести болезни человека на животных моделях15. Среди различных животных моделей, доступных для исследовательских целей, мышиная модель ожирения, вызванного питанием (DIO), наиболее близко напоминает ожирение человека и метаболический синдром. Мыши были отобраны для операции DJB, чтобы определить целесообразность операции и предоставить методы для дальнейших исследований. В этой рукописи представлено всестороннее резюме как технических аспектов, так и экспериментальных деталей хирургии DJB.
протокол
Все описанные ниже протокольные шаги соответствуют рекомендациям Комитета по уходу за животными и их использованию Главного госпиталя Южного командования ТВД под номером утверждения 2020112501.
1. Общая предоперационная подготовка
ПРИМЕЧАНИЕ: Было куплено тридцать 6-недельных самцов мышей C57BL/6. Мышей помещали в лабораторию без специфических патогенов (SPF) в течение 12-часового цикла свет/темнота; температура, 22 ± 2 °C; и влажность, 55-65%. Мышам предоставляли свободный доступ к воде и кормили диетой с содержанием жиров 60% ккал в течение 6 недель, чтобы вызвать ожирение. Внутрибрюшинная инъекция стрептозотоцина в дозе 40 мг/кг вводилась в течение 5 дней для индуцирования диабета17. Среди тридцати мышей 22 мыши были обследованы на случайный уровень глюкозы в крови > 300 мг/дл и случайным образом распределены в группы DJB (n=15) и симуляции хирургии (n=7). Восемь мышей были исключены из эксперимента из-за низкого уровня глюкозы в крови.
- Голодайте на мышах в течение 8 часов до операции. Отведите воду за 2 ч до операции.
- Вводите 1% раствор пентобарбитала натрия (6 мл/кг) и бупренорфин (1 мг/кг) внутрибрюшинно. Коснитесь щипцами пальцев ног или хвостов мышей и убедитесь, что мыши не проявляют явных подергиваний или дрожания. При адекватной анестезии мыши могут свободно дышать без дополнительного кислорода.
- Поместите мышей в лежачем положении на стерильную доску и под стереомикроскоп. Нанесите глазную мазь на глаза. Используйте электрическое одеяло, чтобы согреть мышей на протяжении всей процедуры. Используйте стерильные процедуры, включая хирургические халаты, стерильные перчатки и автоклавные инструменты.
- У мышей с фиктивной контрольной кишкой сделайте два разреза соответственно в двенадцатиперстной кишке на 1 см ниже привратника и в тощей кишке на 5 см ниже Трейца, а затем зашите разрезы.
2. Дуоденальное шунтирование тощей кишки: хирургическая процедура
- Нанесите пасту для депиляции из мечевидной кости на живот, чтобы удалить волосы из этой области. Сотрите крем и убедитесь, что кожа чистая. Трижды протрите участок, чередуя скраб из йодных и спиртовых растворов.
- Накройте мышь стерильной простыней, оставив операционную область открытой, и сделайте разрез шириной 2 см от мечевидной кости до брюшной полости.
- Используйте брюшной ретрактор, чтобы обнажить брюшную полость. Оттолкните абдоминальный жир с помощью влажного ватного тампона, и переместите печень на головную сторону, чтобы полностью обнажить желудок и кишечник.
- Желудок и привратник находятся ниже печени, а связка Трейца — в дистальном отделе двенадцатиперстной кишки. Дважды перевязать тощую кишку на расстоянии 5 см от связки Трейца шелковым швом 6-0 (рис. 1А). Разрежьте тощую кишку в середине двух лигий и зашите культю тощей кишки шелковым швом 10-0 (Рисунок 1B).
ПРИМЕЧАНИЕ: Избегайте перекручивания брыжеечных кровеносных сосудов. - Протяните проксимальный разрез тощей кишки на 5 см вдоль кишки к тощей кишке, чтобы создать тощево-тощий анастомоз. Выровняйте две кишки горизонтально, а затем используйте шелковый шов 10-0 для создания латерального анастомоза (Рисунок 1C).
ПРИМЕЧАНИЕ: Во время операции поддерживайте кишечник влажным с помощью физиологического раствора, чтобы уменьшить потерю воды. Это предотвратит скручивание кишечника и облегчит наложение швов. - Закрепите оба конца кишечника и разрежьте разрез одинаковой длины (рисунок 1D). Второй слой задней стенки кишечника зашить сплошным швом на всю толщину.
ПРИМЕЧАНИЕ: Длина разреза составляет примерно 0,5-0,6 см, а расстояние между иглами ~0,5 мм. - Закрепите оба конца кишечника и зашите переднюю стенку кишечника. Сшить первый слой передней стенки простым непрерывным швом, а второй слой – горизонтальным варусным швом (рисунок 1E-F).
ПРИМЕЧАНИЕ: Промокните содержимое кишечника ватными палочками, чтобы предотвратить инфицирование брюшной полости. - Протяните дистальный разрез тощей кишки в двенадцатиперстной кишке на 1 см ниже привратника, чтобы создать дуоденально-тоедный анастомоз (рис. 1G). Зашить его тем же методом, что и на шагах 2.6-2.7 (рисунок 1H-K).
ПРИМЕЧАНИЕ: Проверьте шов в углу анастомоза, чтобы уменьшить утечку анастомоза. - Перевяжите кишечник с помощью микрощипцов и разрежьте кишечник микроножницами. Дважды перевязать двенадцатиперстную кишку шелковым швом 6-0, на расстоянии 2 мм от дистального конца дуоденально-тоечного анастомоза. Разрежьте в средней точке микроножницами и зашите культю шелковым швом 10-0 (Рисунок 1L).
Примечание: Гастродуоденальные сосуды разветвляются перпендикулярно головке поджелудочной железы и примыкают к привратнику, что требует тщательного обследования сосудов в поперечном сечении. Место слияния общего желчного протока и двенадцатиперстной кишки было расположено, чтобы не повредить поджелудочную железу или общий желчный проток. - Промойте брюшную полость физиологическим раствором 30 °C. Вернуть кишечник в брюшную полость. Сшить мышцу и кожу отдельно шелком 6-0. Затем продезинфицируйте кожу йодофором.
- После операции введите подкожно в спину физиологический раствор 30 °C (30 мл/кг) для предотвращения обезвоживания. Введите пенициллин (10 мг/кг) внутримышечно для предотвращения инфекции.
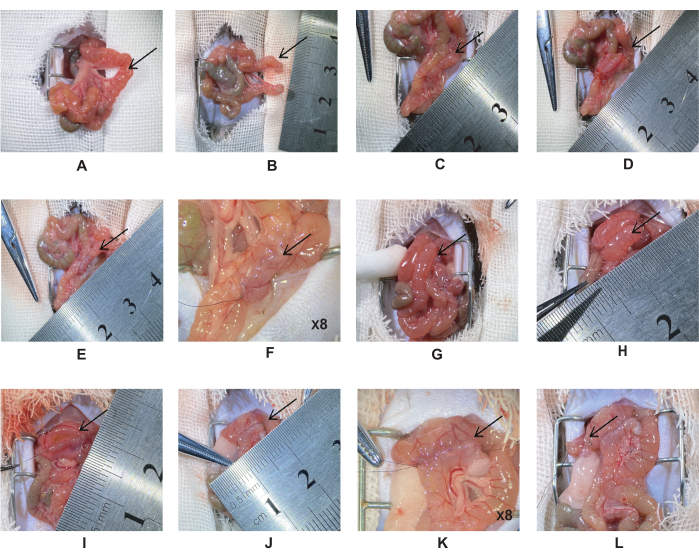
Рисунок 1: Процедура дуоденально-тошечного шунтирования. (A) Расположение тощей кишки на расстоянии 5 см дистальнее связки Трейца. (Б) Дважды перевязать тощую кишку шелком 6-0, разрезать середину лигатуры. (В) Тощево-тоеюнальный анастомоз. (D) Сделайте разрез 0,5-0,6 см и зашите заднюю стенку. (Э-Ж) Полный тощево-тоеюнальный анастомоз. (G) Подтяните дистальный отдел тощей кишки к двенадцатиперстной кишке на 1 см ниже привратника. (H) Дуоденально-тоеюнальный анастомоз. (I) Разрежьте дуоденально-тощидный анастомоз с разрезом 0,5-0,6 см и зашите заднюю стенку простым непрерывным швом. (Дж-К) Полный дуоденально-тощий анастомоз. (L) На расстоянии 2 мм от дистального к дуоденально-тоечному анастомозу дважды перевязать двенадцатиперстную кишку шелком 6-0 и разрезать середину лигатуры. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Общий послеоперационный уход
- После операции поместите мышей на электрическое одеяло, чтобы предотвратить переохлаждение. Позвольте мышам свободно ползать, пока они полностью не проснутся, прежде чем вернуться в свои клетки.
- В послеоперационный день ограничьте прием пищи и воды и введите 2 мл физиологического раствора подкожно в спину мышей. В первые послеоперационные сутки дайте 10 мл 10% глюкозы и функциональный напиток (соотношение 1:1) без еды, а также подкожно введите 1 мл физиологического раствора.
- На второй и третий послеоперационные сутки кормите мышей смесью из 20 мл 10% глюкозы и функционального питья. После четвертого дня давайте мышам чистую воду и диету с высоким содержанием жиров. Переходное кормление следует проводить в соответствии со статусом послеоперационного восстановления в следующем порядке: раствор, полужидкая или твердая пища.
- Послеоперационная анальгезия: вводить бупренорфин (0,1 мг/кг) каждые 12 ч с 1 по 3 день, а затем один раз в сутки до 5 дня.
- После операции наблюдайте за условиями кормления, активностью, калом и заживлением ран мышей.
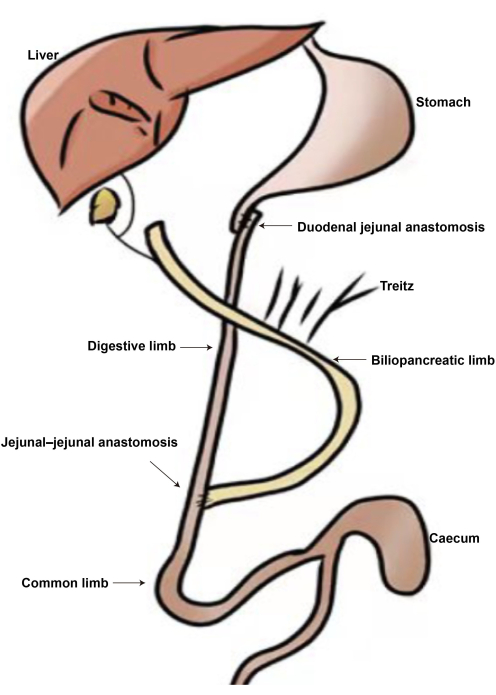
Рисунок 2: Схема операции DJB. (А) Дуоденально-тощий анастомоз. (Б) Тощево-тоеногий анастомоз. (В) Билиопанкреатическая конечность. (D) Пищеварительная конечность. (E) Общая конечность. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
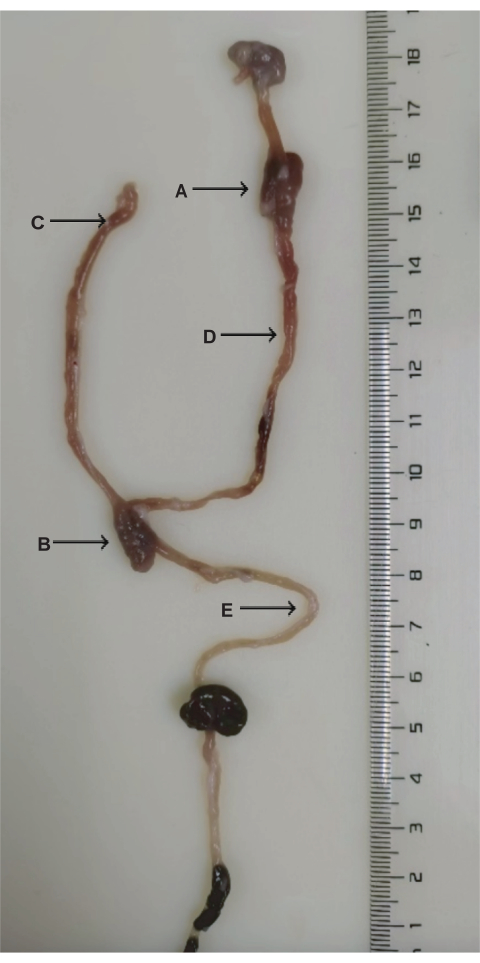
Рисунок 3: Анатомия хирургии DJB. (А) Дуоденально-тоечный анастомоз. (Б) Тощево-тоеногий анастомоз. (В) Билиопанкреатическая конечность. (D) Пищеварительная конечность. (E) Общая конечность. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Послеоперационная оценка метаболических показателей
- Измерение массы тела
- Голодайте на мышах в течение 8 ч до начала измерения. Взвешивайте мышей еженедельно в понедельник до и после операции в течение 8 недель.
- Измерение потребления пищи
- Держите по одной мыши в каждой клетке. Измерьте количество твердой пищи в каждой клетке до и после 24 ч. Разница между этими двумя значениями представляет собой ежедневное потребление пищи.
- Случайное измерение уровня глюкозы в крови
- В 8:00 утра в еженедельный понедельник измерения соберите каплю крови с кончика мышиного хвоста и нанесите ее на полоску глюкозы, вставленную в глюкометр.
- Пероральный тест на толерантность к глюкозе
- Через восемь недель после операции DJB голодайте мышей в течение 8 часов перед пероральным тестом на толерантность к глюкозе. Соберите каплю крови с кончика мышиного хвоста и поместите ее на полоску глюкозы, вставленную в глюкометр. Введите пероральную дозу 20% D-глюкозы (2 г/кг). Измеряйте уровень глюкозы в крови через 0, 15, 30, 60, 90, 120, 150 и 180 минут после зондирования.
Результаты
Общие условия
Среднее время операции по установке DJB составило 84,5 ± 2,6 минуты. Пятнадцать мышей перенесли операцию DJB, девять мышей выжили. Как показано в таблице 1, большинство смертей произошло во время хирургического вмешательства или в течение п?...
Обсуждение
В 1953 году Varco et al.18 выполнили первое тое-подвздошное шунтирование, положив начало бариатрической хирургии. С тех пор хирургами были проведены многочисленные бариатрические операции. Эти операции привели к снижению веса и уменьшению метаболических осложн...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование было поддержано грантом Проекта планирования науки и технологий провинции Гуандун в Китае (No 202002020069).
Материалы
| Name | Company | Catalog Number | Comments |
| Abdominal retractor | F.S.T | 17000-03 | Colibri Retractor -3cm,retractor range 1.5cm/3cm long |
| 1% sodium pentobarbital solution | Guangzhou Chemical Reagent Factory | / | Dissolved 500mg of pentobarbital sodium powder in 50ml of normal saline to obtain 1% pentobarbital sodium solution. |
| Benzylpenicillin sodium for Injection | North China Pharmaceutical Company Ltd. | F2062121 | Penicillin |
| Buprenorphine | Guangzhou Chemical Reagent Factory | / | Analgesia |
| Buprenorphine | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Analgesic |
| Citric acid-sodium citrate buffer | LEAGENE | R00522 | Buffer solution |
| Cotton buds | HaoZheng Medical | 60220610 | Cotton swabs |
| Depilatory paste | Veet | AAPR-S222 | Hair removal cream |
| Ear tag | ZEYA | SUS304 | Ear-mark |
| Electric blanket | ZOSEN | ZS-CWDRT | Heat pad |
| Electronic scale | WETTLER TOLEDO | 20060902-6 | Measure the weight |
| Enteral nutritional powder | Abbott Laboratories | / | Nutrition powder |
| Eye ointment | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Protect the eyes |
| Glucometer | Roche | 6993788001 | Assess blood glucose |
| Graphpad Prism version 9.4.1 | GraphPad Software | version 9.4.1 | Software for statistical analysis |
| High-fat diet (High Fat [60FDC] Purified Rodent Diet) | Dyets | 112252 | 60kcal% High Fat Diet |
| Micro Forceps | Jinzhong Medical | 18-1140 | Micro forceps |
| Micro needle holder | Jinzhong Medical | EMT-160-Z | Needle holder |
| Micro Scissors | Jinzhong Medical | YBC010 | Micro scissors |
| Microscope camera | LAPSUN | E 2000 | Video |
| Ophthalmic scissors | Jinzhong Medical | Y00030 | Surgical scissors |
| Pentobarbital | Guangzhou Chemical Reagent Factory | / | Narcosis |
| Sodium chloride Injection | Guangzhou Otsuka Pharmaceutical Co., Ltd | B21L0301 | NaCl 0.9% |
| Stereo microscope | ZEISS | Stemi 305 | Binocular stereomicroscope |
| Streptozotocin | Sigma | S110910-1g | STZ |
| Suture line | LINGQIAO SUTURE | ZS-LQPMRZ5/0 | Prolene 6/0,Prolene 10/0 |
| Tissue forceps | Jinzhong Medical | H1701 | Surgical forceps |
Ссылки
- Lascar, N., Brown, J., Pattison, H., Barnett, A. H., Bailey, C. J., Bellary, S. Type 2 diabetes in adolescents and young adults. Lancet Diabetes Endocrinol. 6 (1), 69-80 (2018).
- Song, Y., Zhao, F. Bibliometric analysis of metabolic surgery for type 2 diabetes: current status and future prospects. Updates Surg. 74 (2), 697-707 (2022).
- Cummings, D. E., Rubino, F. Metabolic surgery for the treatment of type 2 diabetes in obese individuals. Diabetologia. 61 (2), 257-264 (2018).
- Buchwald, H. The evolution of metabolic/bariatric surgery. Obes Surg. 24 (8), 1126-1135 (2014).
- Akalestou, E., Miras, A. D., Rutter, G. A., le Roux, C. W. Mechanisms of weight loss after obesity surgery. Endocr Rev. 43 (1), 19-34 (2022).
- Rubino, F., et al. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes. Ann Surg. 244 (5), 741-749 (2006).
- Rubino, F., Marescaux, J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg. 239 (1), 1-11 (2004).
- Akalestou, E., et al. Establishing a successful rat model of duodenal- jejunal bypass: A detailed guide. Lab Anim. 53 (4), 362-371 (2019).
- Yu, H. H., Hsieh, M. C., Wu, S. Y., Sy, E. D., Shan, Y. S. Effects of duodenal-jejunal bypass surgery in ameliorating nonalcoholic steatohepatitis in diet-induced obese rats. Diabetes Metab Syndr Obes. 12, 149-159 (2019).
- Garciacaballero, M., Navarrete, S., Favretti, F., Celik, A., Del Castillo, D. Diabetes surgery in type 2 BMI 24-29 vs IMC 30-34 diabetic patients: is there differences among restrictive, malabsorptive and gastric bypass procedures. Nutr Hosp. 28 (2), 23-30 (2013).
- Vidal, J., Jiménez, A. Diabetes remission following metabolic surgery: is GLP-1 the culprit. Curr Atheroscler Rep. 15 (10), 357 (2013).
- Speck, M., Cho, Y. M., Asadi, A., Rubino, F., Kieffer, T. J. Duodenal-jejunal bypass protects GK rats from {beta}-cell loss and aggravation of hyperglycemia and increases enteroendocrine cells coexpressing GIP and GLP-1. Am J Physiol Endocrinol Metab. 300 (5), E923-E932 (2011).
- Ashrafian, H., et al. Metabolic surgery: an evolution through bariatric animal models. Obes Rev. 11 (12), 907-920 (2010).
- Rao, R. S., Rao, V., Kini, S. Animal models in bariatric surgery--a review of the surgical techniques and postsurgical physiology. Obes Surg. 20 (9), 1293-1305 (2010).
- Im, Y. R., et al. A systematic review of animal models of NAFLD finds high-fat, high-fructose diets most closely resemble human NAFLD. Hepatology. 74 (4), 1884-1901 (2021).
- Kleinert, M., et al. Animal models of obesity and diabetes mellitus. Nat Rev Endocrinol. 14 (3), 140-162 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Curr Protoc. 1 (4), e78 (2021).
- Buchwald, H., Varco, R. L., Moore, R. B., Schwartz, M. Z. Intestinal bypass procedures. Partial ileal bypass for hyperlipidemia and jejunoileal bypass for obesity. Curr Probl Surg. , 1-51 (1975).
- DeMaria, E. J. Bariatric surgery for morbid obesity. N Engl J Med. 356 (21), 2176-2183 (2007).
- Bolling, C. F., Armstrong, S. C., Reichard, K. W., Michalsky, M. P. Metabolic and bariatric surgery for pediatric patients with severe obesity. Pediatrics. 144 (6), e20193224 (2019).
- Mason, E. E. Gastric bypass for morbid obesity. Surg Annu. 11, 99-126 (1979).
- Cheng, Y., et al. Sleeve gastrectomy with bypass of proximal small intestine provides better diabetes control than sleeve gastrectomy alone under postoperative high-fat diet. Obes Surg. 29 (1), 84-92 (2019).
- Rubino, F., et al. The role of the small bowel in the regulation of circulating ghrelin levels and food intake in the obese Zucker rat. Endocrinology. 146 (4), 1745-1751 (2005).
- Zachariah, P. J., et al. Compared to sleeve gastrectomy, duodenal-jejunal bypass with sleeve gastrectomy gives better glycemic control in T2DM patients, with a lower β-cell response and similar appetite sensations: mixed-meal study. Obes Surg. 26 (12), 2862-2872 (2016).
- Jiang, B., et al. Role of proximal intestinal glucose sensing and metabolism in the blood glucose control in type 2 diabetic rats after duodenal jejunal bypass surgery. Obes Surg. 32 (4), 1119-1129 (2022).
- Han, H. F., et al. Duodenal-jejunal bypass increases intraduodenal bile acids and upregulates duodenal SIRT1 expression in high-fat diet and streptozotocin-induced diabetic rats. World J Gastroenterol. 28 (31), 4338-4350 (2022).
- Yan, S., et al. Reduction of intestinal electrogenic glucose absorption after duodenojejunal bypass in a mouse model. Obes Surg. 23 (9), 1361-1369 (2013).
- Arble, D. M., et al. Metabolic comparison of one-anastomosis gastric bypass, single-anastomosis duodenal-switch, Roux-en-Y gastric bypass, and vertical sleeve gastrectomy in rat. Surg Obes Relat Dis. 14 (12), 1857-1867 (2018).
- Liang, Y., et al. Duodenal-jejunal bypass surgery reverses diabetic phenotype and reduces obesity in db/db Mice. Curr Chem Genom Transl Med. 11, 41-49 (2017).
- Barataud, A., et al. Absence of role of dietary protein sensing in the metabolic benefits of duodenal-jejunal bypass in the mouse. Sci Rep. 7, 44856 (2017).
- . Close-up on lab animal microsurgery. Lab Anim (NY). 35 (1), 43 (2006).
- Couceiro, J., Castro, R., Tien, H., Ozyurekoglu, T. Step by step: microsurgical training method combining two nonliving animal models. J Vis Exp. (99), e52625 (2015).
- Nasser, K. M., Wahba, H. A., Kamal, E., El-Makhzangy, A. M., Bahaa, N. Animal model for training and improvement of the surgical skills in endolaryngeal microsurgery. J Voice. 26 (3), 351-357 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены