È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Chirurgia di bypass duodenale-digiunale in topi diabetici obesi indotti dalla dieta
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
La chirurgia di bypass duodenale-digiunale (DJB) può migliorare il metabolismo del glucosio e ridurre la resistenza all'insulina. Qui, presentiamo un protocollo per stabilire un modello murino stabile e affidabile di DJB.
Abstract
La prevalenza dell'obesità e del diabete di tipo 2 è un serio problema di salute globale. L'obesità è un importante fattore patogeno nel diabete di tipo 2, nelle malattie cardiovascolari e in alcuni tipi di cancro. La chirurgia bariatrica offre un'opzione di trattamento efficace e a lungo termine sia per l'obesità che per il diabete. La gastrectomia a manica (SG) e il bypass gastrico Roux-en-Y (RYGB) sono ampiamente riconosciuti come gli interventi di chirurgia bariatrica più popolari. Inoltre, diversi interventi di chirurgia bariatrica esplorativa hanno dimostrato promettenti effetti terapeutici. Il bypass duodenale-digiunale (DJB), specificamente studiato per i diabetici con basso indice di massa corporea, ha mostrato esiti metabolici benefici. Tuttavia, i suoi benefici metabolici indipendenti dal peso non sono completamente compresi a causa dei modelli animali limitati. In questo articolo, descriviamo i protocolli di cura ottimizzati e le tecniche chirurgiche per l'esecuzione della chirurgia DJB nei topi diabetici obesi indotti dalla dieta (DIO). L'utilizzo di un modello murino contribuisce a una migliore comprensione della natura dei cambiamenti indotti dalla chirurgia DJB, facilitando al contempo la pratica clinica correlata.
Introduzione
L'obesità e il diabete di tipo 2 sono le malattie croniche più comuni al mondo e la loro prevalenza è in aumento tra igiovani 1. La chirurgia bariatrica è il trattamento più efficace per l'obesità e il diabete, facilitando la stabilità della glicemia a lungo termine e migliorando anche le complicanze associate all'obesità 2,3. Esistono diversi tipi di chirurgia bariatrica, classificati in base al fatto che riducano il volume gastrico o l'assorbimento intestinale; Questi includono restrittivi, malassorbivi e combinazioni 4,5.
Il bypass duodenale-digiunale (DJB) è stato sviluppato per la prima volta da Rubino e Marescaux, che hanno dimostrato che il diabete di tipo 2 può essere alleviato collegando il duodeno e il digiuno piuttosto che riducendo il volume gastrico 6,7. La DJB preserva l'intero stomaco e bypassa l'intero duodeno e il digiuno prossimale. L'intestino è diviso in arti biliopancreatici, digestivi e comuni 6,8. Il DJB condivide alcune somiglianze con gli interventi di chirurgia bariatrica, tra cui il bypass gastrico Roux-en-Y (RYGB), il bypass mini-gastrico, il bypass biliopancreatico, la diversione duodenale e la DJB più la gastrectomia a manica9. Rispetto al RYGB, il DJB non richiede un'anastomosi gastrointestinale, il che riduce il tempo operatorio e migliora il tasso di successo della procedura. Il DJB è simile al RYGB nel migliorare il metabolismo del glucosio ma non influisce sul peso corporeo10. Dopo l'intervento chirurgico di DJB, la rapida somministrazione di cibo nell'intestino tenue distale stimola la secrezione del peptide-1 simile al glucagone (GLP-1), con conseguente miglioramento del metabolismo del glucosio11,12.
L'uso di modelli animali è essenziale per comprendere le vie metaboliche, cellulari e molecolari. I modelli animali di chirurgia bariatrica hanno contribuito alla nostra comprensione dei potenziali meccanismi alla base dell'obesità e del diabete13,14. Tuttavia, a causa delle differenze fisiologiche tra le specie, è impossibile replicare perfettamente le malattie umane nei modelli animali15. Tra i vari modelli animali disponibili per scopi di ricerca, il modello murino di obesità indotta dalla dieta (DIO) assomiglia più da vicino all'obesità umana e alla sindrome metabolica16. I topi sono stati selezionati per la chirurgia DJB per determinare la fattibilità dell'intervento chirurgico e per fornire tecniche per ulteriori ricerche. Questo manoscritto fornisce un riassunto completo sia degli aspetti tecnici che dei dettagli sperimentali della chirurgia DJB.
Protocollo
Tutte le fasi del protocollo descritte di seguito seguono le linee guida del Comitato per la cura e l'uso degli animali dell'Ospedale Generale del Comando del Teatro Meridionale con il numero di approvazione 2020112501.
1. Preparazione preoperatoria generale
NOTA: Sono stati acquistati trenta topi maschi C57BL/6 di 6 settimane. I topi sono stati alloggiati in un laboratorio privo di patogeni specifici (SPF) con un ciclo luce/buio di 12 ore; temperatura, 22 ± 2 °C; e umidità, 55-65%. Ai topi è stato dato libero accesso all'acqua e sono stati alimentati con una dieta a base di grassi al 60% di kcal per 6 settimane per indurre l'obesità. Un'iniezione intraperitoneale di 40 mg/kg di streptozotocina è stata somministrata per 5 giorni per indurre il diabete17. Tra i trenta topi, ventidue topi sono stati sottoposti a screening per la glicemia casuale > 300 mg/dL e assegnati in modo casuale ai gruppi DJB (n=15) e chirurgia fittizia (n=7). Otto topi sono stati esclusi dall'esperimento a causa della glicemia scadente.
- Digiunare i topi per 8 ore prima dell'intervento. Prelevare l'acqua 2 ore prima dell'intervento.
- Somministrare una soluzione di pentobarbital sodico all'1% (6 mL/kg) e buprenorfina (1 mg/kg) per via intraperitoneale. Tocca le dita dei piedi o la coda dei topi con una pinza e assicurati che i topi non mostrino contrazioni o tremori evidenti. In anestesia adeguata, i topi possono respirare liberamente senza ossigeno supplementare.
- Posizionare i topi in posizione supina su una tavola sterile e sotto uno stereomicroscopio. Applicare un unguento per gli occhi sugli occhi. Usa una coperta elettrica per mantenere i topi caldi durante la procedura. Utilizzare procedure sterili, inclusi camici chirurgici, guanti sterili e strumenti autoclavati.
- Nei topi di controllo fittizi, praticare le due incisioni rispettivamente nel duodeno 1 cm sotto il piloro e nel digiuno 5 cm sotto il Treitz e quindi suturare le incisioni.
2. Bypass digiunale duodenale: procedura chirurgica
- Applicare la pasta depilatoria dallo xifoide all'addome per rimuovere i peli da questa regione. Pulisci la crema e assicurati che la pelle sia pulita. Strofinare l'area tre volte con uno scrub alternato di soluzioni di iodio e alcol.
- Coprire il topo con un telo sterile, lasciando scoperta l'area operativa, e praticare un'incisione di 2 cm dallo xifoide all'addome.
- Utilizzare un divaricatore addominale per esporre la cavità addominale. Spingere via il grasso addominale usando un batuffolo di cotone umido e spostare il fegato sul lato cefalico per esporre completamente lo stomaco e l'intestino.
- Lo stomaco e il piloro si trovano al di sotto del fegato e il legamento di Treitz si trova al duodeno distale. Doppia legatura del digiuno, 5 cm distalmente al legamento di Treitz con una sutura di seta 6-0 (Figura 1A). Tagliare il digiuno nel punto medio delle due legature e suturare il moncone digiunale con una sutura di seta 10-0 (Figura 1B).
NOTA: Evitare di torcere i vasi sanguigni mesenterici. - Tirare l'incisione digiunale prossimale di 5 cm lungo l'intestino fino al digiuno per creare un'anastomosi digiunale-digiunale. Allineare i due intestini orizzontalmente, quindi utilizzare una sutura di seta 10-0 per creare l'anastomosi laterale (Figura 1C).
NOTA: Durante l'intervento chirurgico, mantenere l'intestino umido con soluzione fisiologica per ridurre la perdita di acqua. Ciò impedirà all'intestino di arricciarsi e renderà più facile la sutura. - Fissare entrambe le estremità dell'intestino e tagliare l'incisione alla stessa lunghezza (Figura 1D). Sutura il secondo strato della parete intestinale posteriore con una sutura continua a tutto spessore.
NOTA: La lunghezza dell'incisione è di circa 0,5-0,6 cm e la distanza dell'ago è di ~0,5 mm. - Fissare entrambe le estremità dell'intestino e suturare la parete anteriore dell'intestino. Sutura il primo strato della parete anteriore con una semplice sutura continua e il secondo strato con una sutura varo orizzontale (Figura 1E-F).
NOTA: Tamponare il contenuto intestinale con tamponi di cotone per prevenire l'infezione della cavità addominale. - Tirare l'incisione digiunale distale nel duodeno 1 cm sotto il piloro per creare un'anastomosi duodenale-digiunale (Figura 1G). Suturarlo utilizzando lo stesso metodo dei passaggi 2.6-2.7 (Figura 1H-K).
NOTA: Controllare la sutura nell'angolo anastomotico per ridurre le perdite anastomotiche. - Legare l'intestino con la micro pinza e tagliare l'intestino con le micro forbici. Legare due volte il duodeno con una sutura di seta 6-0, a 2 mm dall'estremità distale dell'anastomosi duodenale-digiunale. Tagliare nel punto medio con micro forbici e suturare il moncone con una sutura di seta 10-0 (Figura 1L).
NOTA: I vasi gastroduodenali si ramificano perpendicolarmente alla testa del pancreas e sono adiacenti al piloro, richiedendo un'attenta esplorazione dei vasi nella sezione trasversale. La confluenza del dotto biliare comune e del duodeno è stata localizzata, facendo attenzione a non danneggiare il pancreas o il dotto biliare comune. - Sciacquare la cavità addominale con soluzione fisiologica a 30 °C. Riporta l'intestino nella cavità addominale. Sutura il muscolo e la pelle separatamente con una seta 6-0. Quindi, disinfettare la pelle con iodoforo.
- Dopo l'intervento chirurgico, iniettare soluzione fisiologica a 30 °C (30 ml/kg) per via sottocutanea nella parte posteriore per prevenire la disidratazione. Iniettare la penicillina (10 mg/kg) per via intramuscolare per prevenire l'infezione.
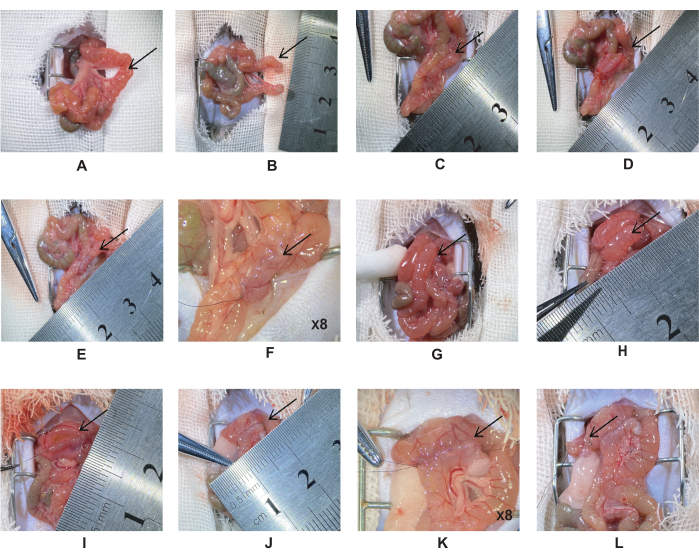
Figura 1: Procedura di bypass duodenale-digiunale. (A) Posizione del digiuno 5 cm distalmente al legamento di Treitz. (B) Legare due volte il digiuno con seta 6-0, tagliato al centro della legatura. (C) Anastomosi digiunale-digiunale. (D) Praticare un'incisione di 0,5-0,6 cm e suturare la parete posteriore. (E-F) Anastomosi digiunale-digiunale completa. (G) Tirare il digiunale distale fino al duodeno 1 cm sotto il piloro. (H) Anastomosi duodenale-digiunale. (I) Tagliare l'anastomosi duodenale-digiunale con un'incisione di 0,5-0,6 cm e suturare la parete posteriore con una semplice sutura continua. (J-K) Anastomosi duodenale-digiunale completa. (L) A 2 mm dall'anastomosi distale a quella duodenale-digiunale, legare due volte il duodeno con seta 6-0 e tagliare al centro della legatura. Clicca qui per visualizzare una versione più grande di questa figura.
3. Assistenza postoperatoria generale
- Dopo l'intervento chirurgico, posiziona i topi su una coperta elettrica per prevenire l'ipotermia. Lascia che i topi striscino liberamente fino a quando non si svegliano completamente prima di tornare nelle loro gabbie.
- Il giorno postoperatorio, limitare il cibo e l'acqua e iniettare 2 ml di soluzione salina per via sottocutanea nella parte posteriore dei topi. Il primo giorno postoperatorio, somministrare 10 ml di glucosio al 10% e una bevanda funzionale (rapporto 1:1) senza cibo e iniettare 1 ml di soluzione fisiologica per via sottocutanea.
- Il secondo e il terzo giorno postoperatorio, nutrire i topi con una miscela di 20 ml di glucosio al 10% e una bevanda funzionale. Dopo il quarto giorno, dai ai topi acqua pura e una dieta ricca di grassi. L'alimentazione di transizione deve essere eseguita in base allo stato di recupero postoperatorio nel seguente ordine: cibo in soluzione, semiliquido o solido.
- Analgesia postoperatoria: iniettare buprenorfina (0,1 mg/kg) ogni 12 ore dal giorno 1 al giorno 3, e poi una volta al giorno fino al giorno 5.
- Dopo l'intervento chirurgico, osservare le condizioni di alimentazione, l'attività, le feci e la guarigione delle ferite dei topi.
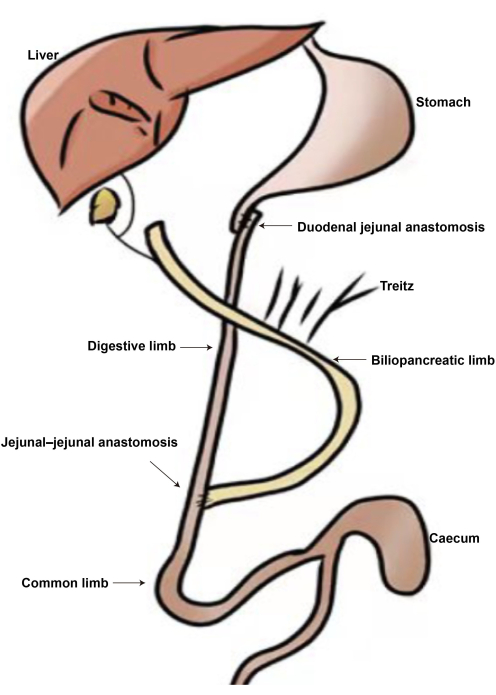
Figura 2: Lo schema della chirurgia DJB. (A) Anastomosi duodenale-digiunale. (B) Anastomosi digiunale-digiunale. (C) Arto biliopancreatico. (D) Arto digestivo. (E) Arto comune. Clicca qui per visualizzare una versione più grande di questa figura.
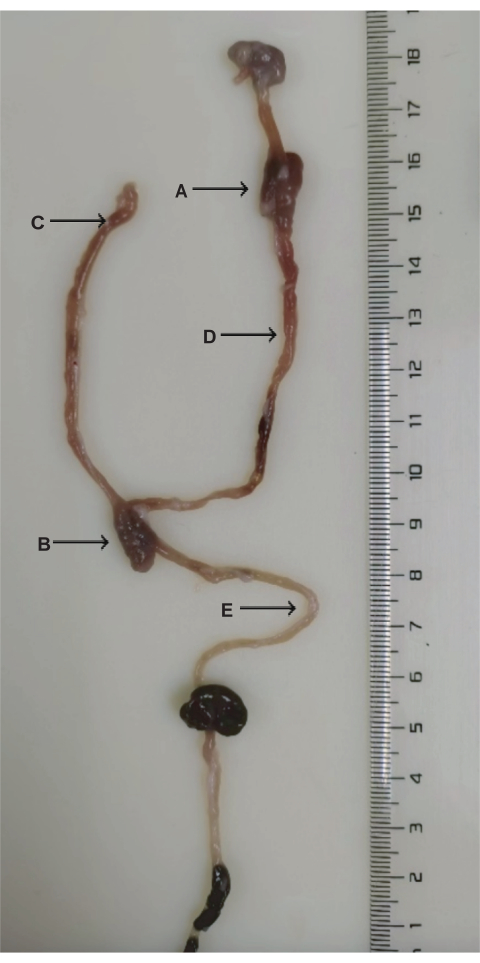
Figura 3: Anatomia della chirurgia DJB. (A) Anastomosi duodenale-digiunale. (B) Anastomosi digiunale-digiunale. (C) Arto biliopancreatico. (D) Arto digestivo. (E) Arto comune. Clicca qui per visualizzare una versione più grande di questa figura.
4. Valutazione postoperatoria dei parametri metabolici
- Misurazione del peso corporeo
- Digiunare i topi per 8 ore prima della misurazione. Pesare i topi settimanalmente il lunedì prima e dopo l'intervento chirurgico per 8 settimane.
- Misurazione dell'assunzione di cibo
- Ospita un topo in ogni gabbia. Misurare la quantità di cibo solido in ogni gabbia prima e dopo 24 ore. La differenza tra i due valori rappresenta l'assunzione giornaliera di cibo.
- Misurazione casuale della glicemia
- Alle 8:00 del lunedì settimanale di misurazione, raccogliere una goccia di sangue dalla punta della coda del topo e applicarla su una striscia di glucosio inserita nel glucometro.
- Test di tolleranza al glucosio orale
- Otto settimane dopo l'intervento chirurgico DJB, digiunare i topi per 8 ore prima del test di tolleranza al glucosio orale. Raccogli una goccia di sangue dalla punta della coda del topo e posizionala su una striscia di glucosio inserita nel glucometro. Somministrare una dose orale di D-glucosio al 20% (2 g/kg). Misurare i livelli di glucosio nel sangue a 0, 15, 30, 60, 90, 120, 150 e 180 minuti dopo il gavage.
Risultati
Condizioni generali
Il tempo operatorio medio per la procedura DJB è stato di 84,5 ± 2,6 minuti. Quindici topi sono stati sottoposti a chirurgia DJB, nove topi sono sopravvissuti. Come mostrato nella Tabella 1, la maggior parte dei decessi si è verificata durante l'intervento chirurgico o nei 7 giorni successivi. Le cause della morte postoperatoria sono state sanguinamento (n=2) il giorno 1 postoperatorio, perdita anastomotica (n=1) il giorno 4 pos...
Discussione
Nel 1953, Varco et al.18 eseguirono il primo bypass digiuno-ileale come inizio della chirurgia bariatrica. Da allora, numerosi interventi di chirurgia bariatrica sono stati eseguiti da chirurghi. Questi interventi chirurgici hanno portato alla perdita di peso e al miglioramento delle complicanze metaboliche 4,19,20. Inoltre, nel 1967, Mason e Ito21...
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questo studio è stato sostenuto da una sovvenzione del Progetto di pianificazione scientifica e tecnologica della provincia cinese del Guangdong (n. 202002020069).
Materiali
| Name | Company | Catalog Number | Comments |
| Abdominal retractor | F.S.T | 17000-03 | Colibri Retractor -3cm,retractor range 1.5cm/3cm long |
| 1% sodium pentobarbital solution | Guangzhou Chemical Reagent Factory | / | Dissolved 500mg of pentobarbital sodium powder in 50ml of normal saline to obtain 1% pentobarbital sodium solution. |
| Benzylpenicillin sodium for Injection | North China Pharmaceutical Company Ltd. | F2062121 | Penicillin |
| Buprenorphine | Guangzhou Chemical Reagent Factory | / | Analgesia |
| Buprenorphine | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Analgesic |
| Citric acid-sodium citrate buffer | LEAGENE | R00522 | Buffer solution |
| Cotton buds | HaoZheng Medical | 60220610 | Cotton swabs |
| Depilatory paste | Veet | AAPR-S222 | Hair removal cream |
| Ear tag | ZEYA | SUS304 | Ear-mark |
| Electric blanket | ZOSEN | ZS-CWDRT | Heat pad |
| Electronic scale | WETTLER TOLEDO | 20060902-6 | Measure the weight |
| Enteral nutritional powder | Abbott Laboratories | / | Nutrition powder |
| Eye ointment | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Protect the eyes |
| Glucometer | Roche | 6993788001 | Assess blood glucose |
| Graphpad Prism version 9.4.1 | GraphPad Software | version 9.4.1 | Software for statistical analysis |
| High-fat diet (High Fat [60FDC] Purified Rodent Diet) | Dyets | 112252 | 60kcal% High Fat Diet |
| Micro Forceps | Jinzhong Medical | 18-1140 | Micro forceps |
| Micro needle holder | Jinzhong Medical | EMT-160-Z | Needle holder |
| Micro Scissors | Jinzhong Medical | YBC010 | Micro scissors |
| Microscope camera | LAPSUN | E 2000 | Video |
| Ophthalmic scissors | Jinzhong Medical | Y00030 | Surgical scissors |
| Pentobarbital | Guangzhou Chemical Reagent Factory | / | Narcosis |
| Sodium chloride Injection | Guangzhou Otsuka Pharmaceutical Co., Ltd | B21L0301 | NaCl 0.9% |
| Stereo microscope | ZEISS | Stemi 305 | Binocular stereomicroscope |
| Streptozotocin | Sigma | S110910-1g | STZ |
| Suture line | LINGQIAO SUTURE | ZS-LQPMRZ5/0 | Prolene 6/0,Prolene 10/0 |
| Tissue forceps | Jinzhong Medical | H1701 | Surgical forceps |
Riferimenti
- Lascar, N., Brown, J., Pattison, H., Barnett, A. H., Bailey, C. J., Bellary, S. Type 2 diabetes in adolescents and young adults. Lancet Diabetes Endocrinol. 6 (1), 69-80 (2018).
- Song, Y., Zhao, F. Bibliometric analysis of metabolic surgery for type 2 diabetes: current status and future prospects. Updates Surg. 74 (2), 697-707 (2022).
- Cummings, D. E., Rubino, F. Metabolic surgery for the treatment of type 2 diabetes in obese individuals. Diabetologia. 61 (2), 257-264 (2018).
- Buchwald, H. The evolution of metabolic/bariatric surgery. Obes Surg. 24 (8), 1126-1135 (2014).
- Akalestou, E., Miras, A. D., Rutter, G. A., le Roux, C. W. Mechanisms of weight loss after obesity surgery. Endocr Rev. 43 (1), 19-34 (2022).
- Rubino, F., et al. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes. Ann Surg. 244 (5), 741-749 (2006).
- Rubino, F., Marescaux, J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg. 239 (1), 1-11 (2004).
- Akalestou, E., et al. Establishing a successful rat model of duodenal- jejunal bypass: A detailed guide. Lab Anim. 53 (4), 362-371 (2019).
- Yu, H. H., Hsieh, M. C., Wu, S. Y., Sy, E. D., Shan, Y. S. Effects of duodenal-jejunal bypass surgery in ameliorating nonalcoholic steatohepatitis in diet-induced obese rats. Diabetes Metab Syndr Obes. 12, 149-159 (2019).
- Garciacaballero, M., Navarrete, S., Favretti, F., Celik, A., Del Castillo, D. Diabetes surgery in type 2 BMI 24-29 vs IMC 30-34 diabetic patients: is there differences among restrictive, malabsorptive and gastric bypass procedures. Nutr Hosp. 28 (2), 23-30 (2013).
- Vidal, J., Jiménez, A. Diabetes remission following metabolic surgery: is GLP-1 the culprit. Curr Atheroscler Rep. 15 (10), 357 (2013).
- Speck, M., Cho, Y. M., Asadi, A., Rubino, F., Kieffer, T. J. Duodenal-jejunal bypass protects GK rats from {beta}-cell loss and aggravation of hyperglycemia and increases enteroendocrine cells coexpressing GIP and GLP-1. Am J Physiol Endocrinol Metab. 300 (5), E923-E932 (2011).
- Ashrafian, H., et al. Metabolic surgery: an evolution through bariatric animal models. Obes Rev. 11 (12), 907-920 (2010).
- Rao, R. S., Rao, V., Kini, S. Animal models in bariatric surgery--a review of the surgical techniques and postsurgical physiology. Obes Surg. 20 (9), 1293-1305 (2010).
- Im, Y. R., et al. A systematic review of animal models of NAFLD finds high-fat, high-fructose diets most closely resemble human NAFLD. Hepatology. 74 (4), 1884-1901 (2021).
- Kleinert, M., et al. Animal models of obesity and diabetes mellitus. Nat Rev Endocrinol. 14 (3), 140-162 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Curr Protoc. 1 (4), e78 (2021).
- Buchwald, H., Varco, R. L., Moore, R. B., Schwartz, M. Z. Intestinal bypass procedures. Partial ileal bypass for hyperlipidemia and jejunoileal bypass for obesity. Curr Probl Surg. , 1-51 (1975).
- DeMaria, E. J. Bariatric surgery for morbid obesity. N Engl J Med. 356 (21), 2176-2183 (2007).
- Bolling, C. F., Armstrong, S. C., Reichard, K. W., Michalsky, M. P. Metabolic and bariatric surgery for pediatric patients with severe obesity. Pediatrics. 144 (6), e20193224 (2019).
- Mason, E. E. Gastric bypass for morbid obesity. Surg Annu. 11, 99-126 (1979).
- Cheng, Y., et al. Sleeve gastrectomy with bypass of proximal small intestine provides better diabetes control than sleeve gastrectomy alone under postoperative high-fat diet. Obes Surg. 29 (1), 84-92 (2019).
- Rubino, F., et al. The role of the small bowel in the regulation of circulating ghrelin levels and food intake in the obese Zucker rat. Endocrinology. 146 (4), 1745-1751 (2005).
- Zachariah, P. J., et al. Compared to sleeve gastrectomy, duodenal-jejunal bypass with sleeve gastrectomy gives better glycemic control in T2DM patients, with a lower β-cell response and similar appetite sensations: mixed-meal study. Obes Surg. 26 (12), 2862-2872 (2016).
- Jiang, B., et al. Role of proximal intestinal glucose sensing and metabolism in the blood glucose control in type 2 diabetic rats after duodenal jejunal bypass surgery. Obes Surg. 32 (4), 1119-1129 (2022).
- Han, H. F., et al. Duodenal-jejunal bypass increases intraduodenal bile acids and upregulates duodenal SIRT1 expression in high-fat diet and streptozotocin-induced diabetic rats. World J Gastroenterol. 28 (31), 4338-4350 (2022).
- Yan, S., et al. Reduction of intestinal electrogenic glucose absorption after duodenojejunal bypass in a mouse model. Obes Surg. 23 (9), 1361-1369 (2013).
- Arble, D. M., et al. Metabolic comparison of one-anastomosis gastric bypass, single-anastomosis duodenal-switch, Roux-en-Y gastric bypass, and vertical sleeve gastrectomy in rat. Surg Obes Relat Dis. 14 (12), 1857-1867 (2018).
- Liang, Y., et al. Duodenal-jejunal bypass surgery reverses diabetic phenotype and reduces obesity in db/db Mice. Curr Chem Genom Transl Med. 11, 41-49 (2017).
- Barataud, A., et al. Absence of role of dietary protein sensing in the metabolic benefits of duodenal-jejunal bypass in the mouse. Sci Rep. 7, 44856 (2017).
- . Close-up on lab animal microsurgery. Lab Anim (NY). 35 (1), 43 (2006).
- Couceiro, J., Castro, R., Tien, H., Ozyurekoglu, T. Step by step: microsurgical training method combining two nonliving animal models. J Vis Exp. (99), e52625 (2015).
- Nasser, K. M., Wahba, H. A., Kamal, E., El-Makhzangy, A. M., Bahaa, N. Animal model for training and improvement of the surgical skills in endolaryngeal microsurgery. J Voice. 26 (3), 351-357 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon