Method Article
تسهيل تكرار الحقن داخل الشريان السباتي في نماذج الفئران من خلال تقنية جديدة لإصلاح موقع الحقن
In This Article
Summary
إصلاح الشريان السباتي في نموذج الفأر بعد الحقن يعيد تدفق الدم إلى الشريان دون التأثير سلبا على توزيع المادة المحقونة. يسهل إصلاح موقع الحقن الحقن اللاحقة من خلال نفس الشريان ويمنع نقص التروية الدماغية في سلالات الفئران التي تفتقر إلى دائرة ويليس الكاملة.
Abstract
بالنظر إلى التطورات الحديثة في تقديم علاجات جديدة مضادة للأورام باستخدام طرق التوصيل الانتقائية داخل الشرايين داخل الأوعية الدموية في علم الأورام العصبية ، هناك حاجة ملحة لتطوير طرق للحقن داخل الشريان السباتي في نماذج الفئران ، بما في ذلك طرق لإصلاح الشريان السباتي في الفئران بعد الحقن للسماح بالحقن اللاحقة. لقد طورنا طريقة للحقن داخل الشريان السباتي في نموذج فأر لتوصيل العلاجات إلى الشريان السباتي الداخلي (ICA) بإجراءين بديلين.
أثناء الحقن ، يتم إدخال الإبرة في الشريان السباتي المشترك (CCA) بعد ربط خياطة حول الشريان السباتي الخارجي (ECA) ويتم توصيل العلاجات المحقونة إلى ICA. بعد الحقن ، يمكن ربط الشريان السباتي المشترك (CCA) ، مما يحد من عدد الحقن داخل الشريان السباتي إلى واحد. يتضمن الإجراء البديل الموصوف في هذه المقالة تعديلا حيث يتبع حقن الشريان السباتي إصلاح موقع الحقن في CCA ، والذي يعيد تدفق الدم داخل CCA ويتجنب مضاعفات نقص التروية الدماغية التي تظهر في بعض نماذج الفئران.
قارنا أيضا توصيل الخلايا الجذعية الوسيطة البشرية المشتقة من نخاع العظم (BM-hMSCs) بالأورام داخل الجمجمة عند تسليمها عن طريق الحقن داخل الشريان السباتي مع وبدون إصلاح موقع الحقن بعد الحقن. لا يختلف تسليم BM-hMSCs بشكل كبير بين الطرق. تظهر نتائجنا أن إصلاح موقع الحقن في CCA يسمح بتكرار الحقن من خلال نفس الشريان ولا يضعف توصيل وتوزيع المواد المحقونة ، مما يوفر نموذجا يتمتع بمرونة أكبر يحاكي الحقن داخل الشريان السباتي بشكل أوثق في البشر.
Introduction
يعد توصيل العلاجات لأورام المخ أمرا صعبا بسبب عدم نفاذية الحاجز الدموي الدماغي (BBB) وحاجز ورم الدم (BTB). يمكن تحقيق الحقن المباشر داخل الورم للعلاجات للتحايل على BBB من خلال استخدام قسطرة خزان Ommaya ، أو التسريب الدقيق منخفض التدفق للتسليم المعزز بالحمل الحراري ، أو الحقن الموضعي في تجويف الاستئصال أو الأنسجة المجاورة1. ومع ذلك ، فإن الحجم الإجمالي لأنسجة الورم التي يتم الوصول إليها بهذه الطرق محدود2،3،4. تم استخدام الحقن داخل الشرايين سابقا لتوصيل العوامل العلاجية لأورام المخ بهدف الوصول إلى المزيد من الورم5،6،7،8 وفي الآونة الأخيرة ، أظهرت التطورات في كل من تقنيات التوصيل داخل الشرايين والعوامل العلاجية الجديدة فائدة استخدام هذا النهج في علاج أورام المخ7 ، 9. وتشمل هذه التطورات تطوير القسطرة الدقيقة ، والتسليم الانتقائي داخل الشرايين داخل الأوعية الدموية (ESIA) مع التصوير المتقدم ، واستخدام العوامل التناضحية لتعطيل BBB و BTB ، وتطوير العلاجات البيولوجية المستهدفة. لذلك ، لإجراء الاختبارات قبل السريرية للعوامل العلاجية الجديدة التي تدار عن طريق الحقن داخل الشرايين ، من الضروري وجود نماذج بحثية متعدية مناسبة 9,10.
في نماذج الفئران من أورام المخ ، تمر العوامل العلاجية التي يتم توصيلها داخل الصفاق أو الوريد (من خلال الوريد الذيل) عبر الكبد أو القلب والرئتين ، على التوالي ، قبل توزيعها على الجسم بأكمله ، بما في ذلك الدماغ. قد تؤدي تأثيرات المرور الأول هذه إلى حبس العامل وإزالته ، أو تخفيف العامل قبل الوصول إلى الدماغ ، وقد تقدم سمية تحد من الجرعة قبل تحقيق جرعة علاجية في الدماغ. في المقابل ، يتيح حقن الشريان السباتي التوصيل المركز إلى الدماغ قبل الدورة الدموية عن طريق تجاوز عملية التمثيل الغذائي للمرور الأول والحد من الولادة خارج الهدف. في حين أن الحقن داخل الشريان السباتي في الفئران أكثر كثافة في العمل ، فإن خصوصية وقابلية استنساخ هذه التقنية تؤدي إلى انخفاض أعداد لإكمال التحقيقات11،12.
بشكل عام ، في الطرق الموصوفة سابقا لحقن الشريان السباتي في الفئران ، يتم ربط الشريان السباتي المشترك بعد الحقن ويتم توفير الدورة الدموية إلى الدماغ عن طريق الشريان السباتي المقابل والدورة الدموية الدماغية الخلفية عبر دائرة ويليس11،12. هذه الطريقة لها قيود متأصلة تتمثل في السماح فقط بحقنة واحدة كحد أقصى في الشريان السباتي الداخلي أو الخارجي. من الأهمية بمكان أيضا أن سلالات الفئران المستخدمة في التجارب التي يتم فيها ربط الشريان السباتي لها دائرة كاملة من ويليس لمنع نقص التروية الدماغية بسبب الشريان المربوط13. كما ثبت أن انسداد الشريان السباتي يقلل من تدفق الدم الدماغي ويحد من توزيع الجسيمات المحقونة14. بالإضافة إلى ذلك ، فإن انسداد الشريان السباتي في الفئران بعد الحقن لا يحاكي حقن الشريان السباتي في المرضى من البشر.
استخدمت مجموعتنا سابقا حقن الشريان السباتي لتوصيل الخلايا الجذعية الوسيطة بنجاح إلى الدماغ10،15،16،17،18،19. في هذه المقالة ، نصف طريقة حقن الشريان السباتي هذه بالتفصيل ونشمل تعديلا للطريقة التي طورناها ، حيث يتم إصلاح موقع الحقن دون انسداد الشريان ، وتجنب القيود التي يفرضها ربط الشريان السباتي بعد الحقن. في هذه الطريقة ، يتم تحضير الشريان السباتي المشترك (CCA) للحقن عن طريق وضع خيطين ، أحدهما في أي من طرفي موقع الحقن المقصود ، ويتم شد الخيط السفلي (أسفل موقع الحقن). يتم إغلاق الشريان السباتي الخارجي (ECA) باستخدام خياطة أخرى. يتم إدخال الإبرة في CCA ، ويتم توصيل العلاجات إلى الشريان السباتي الداخلي (ICA). بعد ذلك ، يتم تشديد الخيط العلوي على CCA لمنع التدفق العكسي من ICA. في هذه الخطوة ، يمكن ربط CCA المحقون أو إصلاحه. إذا كان سيتم ربط CCA ، يتم شد الغرز وتركها في مكانها. إذا تم إصلاح موقع الحقن ، تتم إزالة الغرز بعد الإصلاح ، ويتم استعادة تدفق الدم. وترد أدناه تفاصيل هذه الإجراءات البديلة.
Protocol
تتوافق جميع الخطوات الموضحة أدناه مع بروتوكولنا ، والذي يتبع الإرشادات التي وضعتها ووافقت عليها اللجنة المؤسسية لرعاية واستخدام في مركز إم دي أندرسون للسرطان بجامعة تكساس.
1. إعداد الطاولة الجراحية والفأر للإجراء الجراحي
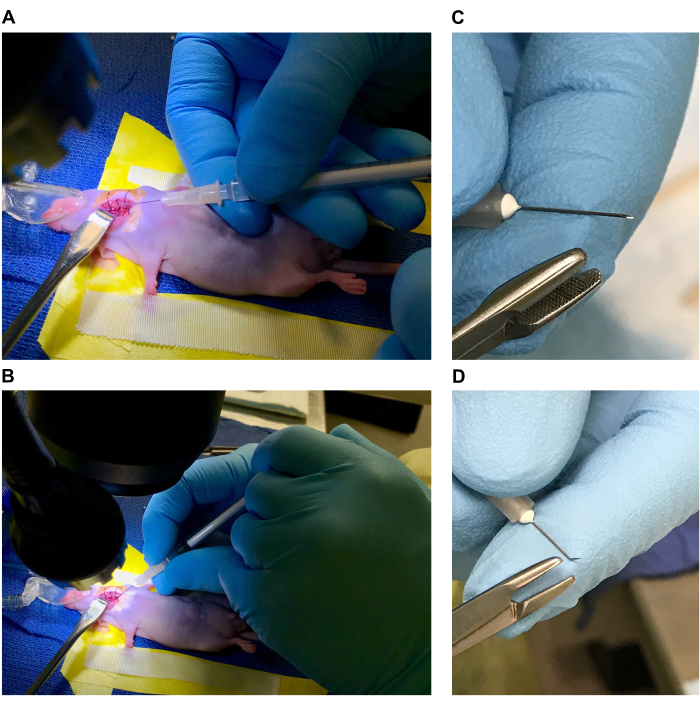
- تحضير الطاولة الجراحية والفأر للإجراء الجراحي (راجع الشكل 1 أ ، ب)
- رتب مجهر التشريح ومصدر الضوء أمام مبخر الأيزوفلوران مع نظام كسح نشط أو ضعه على طاولة سحب سفلي. ضع وسادة التدفئة الكهربائية على قاعدة مجهر التشريح (أو يفضل أن تكون تحت المجهر إذا كانت القاعدة صلبة ويمكن أن تنقل الحرارة) وقم بتغطيتها بستارة جراحية معقمة.
ملاحظة: يجب تعقيم جميع الأدوات الجراحية والستائر عن طريق التعقيم قبل الاستخدام ويجب أن تكون جميع المستهلكات معقمة ومعبأة بشكل فردي. يجب استخدام القفازات المعقمة طوال فترة الإعداد والإجراءات وتغييرها عند الضرورة للحفاظ على العقم. - قم بإعداد السرير (4-5 بوصة طول × 2 بوصة عرض) على الستارة الجراحية باستخدام شريط مختبر الفينيل. قص شاش مربع بحجم 1.5 بوصة × 1.5 بوصة ، ولفه بإحكام ، وضع الشاش الملفوف تحت قطعة من شريط الفينيل مقاس 3 بوصات عند "رأس" السرير لتشكيل وسادة (إمالة الرأس باستخدام وسادة تسمح بتمديد أكبر لمنطقة الرقبة البطنية).
- ضع 4 بوصات من الشريط الجراحي على جانبي السرير (أعلى شريط الفينيل). [في حالة استخدام الأيزوفلوران ، ضع مخروط أنف التخدير مع وزن (أو شريط) متصل بالقرب من رأس السرير. اضبطه لوضع محدد بمجرد تخدير الماوس وتقييده.] انظر الشكل 1 أ ، ب.
- باستخدام مفك إبرة أو ملقط ثقيل ، قم بتمزيق قطع صغيرة من القطن من قطعة قطن ولفها إلى كرات بأحجام مختلفة يتراوح قطرها من 0.5 إلى 1 مم (8-10 قطع قطنية لكل ماوس). الحفاظ على القطن على الستارة الجراحية بالقرب من رأس السرير.
- باستخدام أدوات معقمة ، قم بقطع خيط خياطة 6-0 إلى قطع 1 سم (3-4 قطع لكل ماوس). ضع أطوال الخياطة المعدة على ستارة معقمة. تحضير حقنة 1 مل لإدارة البوبرينورفين أو مسكن آخر مناسب (على النحو المعتمد من قبل بروتوكول اللجنة المؤسسية لرعاية واستخدام [IACUC]). تعقيم جميع الأدوات الجراحية وفقا لمعايير IACUC قبل وضع الأدوات في الحقل المعقم.
- رتب مجهر التشريح ومصدر الضوء أمام مبخر الأيزوفلوران مع نظام كسح نشط أو ضعه على طاولة سحب سفلي. ضع وسادة التدفئة الكهربائية على قاعدة مجهر التشريح (أو يفضل أن تكون تحت المجهر إذا كانت القاعدة صلبة ويمكن أن تنقل الحرارة) وقم بتغطيتها بستارة جراحية معقمة.
- تحضير الماوس للإجراء الجراحي (راجع الشكل 1C-F)
- تخدير فأر واحد باتباع الطرق المعتمدة من IACUC لجراحات البقاء على قيد الحياة الكبرى (استخدم إما إيزوفلوران 1٪ -4٪ ، بناء على حساسية الفئران الفردية ، أو كوكتيل من 10 مجم / مل من الكيتامين ، 1 مجم / مل زيلازين عند 100-200 مجم / كجم (الكيتامين) من وزن الجسم). قص الفراء أو إزالة الشعر إذا لزم الأمر. تطبيق 0.5-1.0 ملغ/ كغ من البوبرينورفين ER (ممتد الإطلاق) عن طريق الحقن تحت الجلد قبل 30 دقيقة من بدء العملية الجراحية.
- ضع الماوس المخدر بحيث تستقر الوسادة تحت الرقبة (الشكل 1C). تساعد الوسادة على تمديد الرقبة ودعمها عند استخدامها مع مخروط الأنف المخدر. في حالة استخدام كوكتيل الكيتامين / الزيلازين ، ضع قضيب أسنان مرجح أو أداة مماثلة في الفم ، خلف القواطع لإمالة الرأس وتمديد الرقبة.
- قم بتقييد الأطراف الأمامية باستخدام الشريط الجراحي الذي تم وضعه مسبقا على طول جانبي السرير الجراحي (الشكل 1 د). اضبط موضع الماوس تحت المجهر بحيث يكون السطح البطني للرقبة في العرض واضبط التكبير لمراقبة موقع الجراحة بشكل مريح (الشكل 1E).
ملاحظة: يجب ضبط تكبير مجهر التشريح من قبل الجراح على مستوى راحته لكل خطوة. - ضع الدموع الاصطناعية باستخدام قطعة قطن معقمة. تطهير موقع الجراحة عن طريق تبديل مسحات دائرية من البيتادين أو الكلورهيكسيدين والكحول ثلاث مرات لكل مطهر (الشكل 1F).
- تأكد من عمق التخدير من خلال التأكد من أن الفأر لا يتراجع عن ساقه استجابة لقرصة إصبع القدم. راقب معدل التنفس وتأكد من أن الماوس لا يلهث ، لأن هذا مؤشر على التخدير المفرط عند استخدام الأيزوفلوران. إذا لزم الأمر ، اضبط معدلات تدفق الأكسجين والأيزوفلوران للوصول إلى عمق التخدير المناسب وحتى التنفس.
2. الإجراء الجراحي (الشكل 2 والشكل 3 والشكل 4 والشكل 5 والشكل 6 والشكل 7)
- الشق الأولي والتشريح
- ابدأ بعمل شق طولي بطول 1 سم ، يبدأ فقط من الجمجمة إلى manubrium (كتلة بارزة في نهاية الجمجمة من القص) ويستمر فوق القصبة الهوائية باستخدام شفرة مشرط معقمة أو أداة مماثلة باتباع إرشادات IACUC المعتمدة من المستخدم (الشكل 2 أ).
- أدخل طرف المقص المغلق في الشق وافتحه برفق لإجراء تشريح حاد للنسيج الضام تحت الجلد ، ويفصل بين الغدتين اللعابيتين. باستخدام الملقط الناعم ، اسحب الغدة اللعابية اليمنى برفق من خلال الشق للراحة على سطح الجلد المجهز بشكل معقم أو اسحب الغدة اللعابية بشكل جانبي باستخدام مبعدة الخطاف الحاد (الشكل 2 ب ، ج). إذا بدت الغدة الخارجية جافة أو لزجة ، رطبها بمحلول ملحي معقم.
- استمر في تشريح النسيج الضام بشكل حاد حتى تظهر العضلات القصية الترقوية الخشائية وثنائية المعدة (الشكل 2 د).
ملاحظة: سيتم استخدام المثلث العضلي الذي يتكون من القصبة الهوائية / العضلة القصية اللامية (sh) والعضلة القصية الترقوية الخشائية (sm) والعضلة ثنائية المعدة (dg) (البطن الذيلية) لتحديد موقع CCA الأيمن وتشعب الشريان السباتي في البروتوكول. بشكل عام ، يمكن أيضا رؤية عضلة الأومو اللامي الأصغر (oh) مستلقية بشكل عرضي عبر CCA (الشكل 2D) ؛ ومع ذلك ، تختلف هذه العضلات في الحجم وليس من غير المألوف أن تكون العضلة اللامية غائبة تماما في الفئران الصغيرة أو الصغيرة.
- عزل CCA
- باستخدام ملقط الطرف المائل ، استمر في تشريح النسيج الضام بعناية (عن طريق فتح أطراف الملقط) بالقرب من النهاية الذيلية للمثلث العضلي لكشف الشريان السباتي المشترك والوريد الوداجي والعصب المبهم.
ملاحظة: الشريان السباتي المشترك هو أكبر وعاء دموي مجاور للقصبة الهوائية ويمكن التعرف عليه بسهولة بشكل عام عند قاعدة المثلث العضلي (الشكل 2E ، السهم). كن حذرا للغاية مع الملقط الدقيق حول الأوعية الدموية لأن الأطراف يمكن أن تخترق الأوعية بسهولة مما يؤدي إلى نزيف مفرط وربما مميت. - استمر في تشريح النسيج الضام بعناية حول جزء الشريان السباتي المشترك من قاعدة المثلث العضلي حتى العضلة اللامية اللامية. استخدم كرات القطن الصغيرة المعقمة للسيطرة على أي نزيف بسيط وامتصاص السوائل المفرزة من الغدد اللعابية حسب الحاجة.
- قم بتشريح النسيج الضام بعناية لفصل CCA عن العصب المبهم. توخ الحذر بشكل خاص لتقليل التعامل مع العصب المبهم وتلفه ، والذي يمكن تحديده بسهولة على أنه الحزمة العصبية السميكة البيضاء المجاورة ل CCA (الشكل 2F).
- باستخدام ملقط الطرف المائل ، استمر في تشريح النسيج الضام بعناية (عن طريق فتح أطراف الملقط) بالقرب من النهاية الذيلية للمثلث العضلي لكشف الشريان السباتي المشترك والوريد الوداجي والعصب المبهم.
- إعداد التقييم القطري المشترك
- بمجرد تعبئة CCA بالكامل من العضلة القصية الترقوية الخشائية ، وحيثما يكون مرئيا ، حتى العضلة اللامية ، ضع قطعة 1 سم من خياطة 6-0 على الجلد المجهز بشكل معقم لعظم الفأر (لسهولة الاسترجاع) ومرر ملقط الطرف المائل تحت CCA (مع الحرص على عزل CCA عن العصب المبهم والوريد الوداجي) (الشكل 3 أ). إذا لم تكن العضلة اللامية موجودة ، فقم بمسح المنطقة المحيطة ب CCA بما يكفي لتتمكن من وضع الغرز على CCA والجمجمة والذيلية إلى موقع الحقن المقترح ، وإدخال الإبرة.
- مع وجود الملقط الناعم في اليد اليسرى ، مرر الخيط إلى ملقط الطرف المائل ، مع الإمساك بالقرب من نهاية الخيط. اسحب برفق نصف طول الخيط أسفل CCA باستخدام ملقط الطرف المائل (الشكل 3B).
- كرر هذه العملية مع خياطة ثانية ، موازية للخياطة الأولى (الشكل 3C).
- اربط كل خياطة بشكل غير محكم حول CCA ، لكن لا تشد العقد أو تقيد تدفق الدم (الشكل 3 د).
- عزل الشريان السباتي الخارجي وتحضيره
- باستخدام ملقط الطرف المائل ، قم بإزالة النسيج الضام بعناية في نهاية الجمجمة للمثلث العضلي ، من الجمجمة إلى العضلة اللامية ، لتحديد موقع CCA والتشعب إلى ECA و ICA (الشكل 4A).
ملاحظة: يميل ECA نحو خط الوسط ويكون أكثر سطحية قليلا ، بينما ينحني ICA بشكل جانبي ويتحرك أعمق في الرقبة. توخ الحذر بشكل خاص لمنع تلف العصب تحت اللسان (HN) الذي يعبر فوق ICA فوق التشعب مباشرة. - قم بإزالة النسيج الضام بعناية من جميع جوانب ECA بالقرب من التشعب. بمجرد إزالة ما يكفي من النسيج الضام بعيدا عن ECA ، ضع قطعة من الخيط على الجلد المحضر بشكل معقم على عظم الفأر وقم بتمرير ملقط الطرف المائل أسفل ECA. باستخدام الملقط الدقيق في اليد اليسرى ، مرر الخيط إلى ملقط الطرف المائل في الفراغ بين ICA و ECA واسحب نصف طول الخيط برفق (الشكل 4 ب). اربط الخيط بشكل فضفاض حول ECA ، لكن لا تشد العقدة.
ملاحظة: من المهم إزالة ما يكفي من النسيج الضام من ECA بحيث يمكنك الإمساك بالخيط باستخدام ملقط الطرف المائل دون الاستيلاء عن غير قصد على النسيج الضام المحيط بالشرايين ، مما يتسبب في تلف الشرايين عند استرداد الخرزة.
- باستخدام ملقط الطرف المائل ، قم بإزالة النسيج الضام بعناية في نهاية الجمجمة للمثلث العضلي ، من الجمجمة إلى العضلة اللامية ، لتحديد موقع CCA والتشعب إلى ECA و ICA (الشكل 4A).
- إعداد إبرة وحقنة
ملاحظة: في هذه الخطوة ، يمكن إجراء الحقن بإبرة مستقيمة ، مما يسمح للمحقنة بالراحة وتثبيتها بواسطة جسم الماوس (الشكل 5 أ). بدلا من ذلك ، يمكن إجراء الحقن باستخدام إبرة مثنية بالقرب من الطرف ، مما يسمح بحمل المحقنة مثل قلم رصاص مع وضع اليد على طاولة الجراحة (الشكل 5 ب). تعمل كلتا التقنيتين بشكل جيد ، واختيار التقنية هو تفضيل شخصي.- لتحضير الإبرة المثنية ، أمسك إبرة 33 جم ، 1/2 بوصة مع توجيه الشطبة لأعلى وأمسك الطرف بمحرك إبرة معقم (الشكل 5 ج). ثني الإبرة حوالي 30-40 درجة مباشرة نحو شطبة (الشكل 5D).
- املأ المحقنة بالحجم المناسب للمحلول المراد حقنه (تأكد من حساب مساحة تجويف الإبرة إذا لم يتم سحب محلول الحقن من خلال الإبرة لتحميل المحقنة). قم بتوصيل الإبرة وإزالة أي فقاعات هواء. تأكد من أن الغضروف المفصلي للمحلول مرئي عند شطبة الإبرة.
- الحقن داخل الشريان السباتي
- شد عقدة الخيط حول جهاز حماية البيئة. بعد ذلك ، حرك الخيط السفلي على CCA لأسفل نحو العضلة القصية الترقوية الخشائية قدر الإمكان وشد العقدة. تأكد من أن الخيط العلوي على CCA يبقى فضفاضا حتى بعد الحقن. ضع كرة قطنية معقمة في حافة التجويف لامتصاص السوائل المفرزة والدم أثناء الحقن.
- أمسك المحقنة في اليد اليمنى والملقط الدقيق في اليد اليسرى ، أحضر الإبرة إلى الشريان مباشرة فوق الخيط السفلي على CCA. باستخدام الملقط الناعم ، اسحب الطرف السائب للخيط السفلي برفق في اتجاه ذيلي لوضع مستوى منخفض من التوتر على CCA (الشكل 6 أ).
- أدخل الإبرة في CCA بعد الشطبة مباشرة وحرر التوتر ببطء من الخيط (الشكل 6 ب).
ملاحظة: الشريان لديه تدفق دم كبير ومن المحتمل أن ينزف في التجويف الجراحي عند إدخال الإبرة. ومع ذلك ، بمجرد إدخال الإبرة بعد الشطبة ، سيشكل الشريان ختما حول الإبرة وسيتوقف النزيف. يشير النزيف المستمر مع وجود الإبرة في مكانها إلى أن الإبرة ليست بعيدة بما يكفي في الشريان (الفجوة من الشطبة تسمح بتدفق الدم) أو أن الإبرة قد تم دفعها عبر الجزء الخلفي من الشريان. من المهم الآن أن تمسك الإبرة بثبات شديد لمنع تمزق الشريان أو السماح للإبرة بالانزلاق. راقب باستمرار المصابة بأحداث النزف ، وإذا كان النزيف كبيرا (مثل عندما يفقد لونه ، أو يبدو مزرقا ، أو يصبح باردا عند اللمس ، أو أي نقطة نهاية إنسانية أخرى موصوفة في بروتوكول استخدام) ، فمن الضروري تطبيق نقاط نهاية إنسانية. - استخدم اليد اليسرى لدفع مكبس المحقنة لحقن المحلول ببطء شديد (الشكل 5 ب ، ما لا يقل عن 15 ثانية لحقن 100 ميكرولتر من المحلول). لا تقم بإزالة الإبرة عند الانتهاء من حقن المحلول. لمنع التدفق العكسي ، باستخدام الملقط الدقيق في اليد اليسرى ، أمسك الخيط العلوي على CCA (لا يزال مربوطا بشكل فضفاض) بواسطة العقدة وارفعه لثني الشريان (الشكل 6C).
- قم بإزالة الإبرة ، وضع المحقنة جانبا ، والتقط ملقط بزاوية باليد اليمنى. الحفاظ على شبك في الشريان ، تشديد العقدة في خياطة العلوي على CCA (الشكل 6D).
ملاحظة: في هذه المرحلة ، يجب ألا يكون هناك نزيف إضافي في التجويف الجراحي. بعد هذه الخطوة ، هناك إجراءان بديلان كما هو موضح في الخطوتين 2.7 و 2.8 أدناه. إذا كان سيتم ربط CCA ، فاتبع الخطوة 2.7. إذا كان سيتم إصلاح CCA في موقع الحقن ، فاتبع التعديل المدرج في الخطوة 2.8.
- ربط CCA
- في الحالات التي لا تتطلب إعادة الدورة الدموية إلى CCA ، اترك الشريان مربوطا ، مع ترك كلا الغرز مشدودة على CCA. تقليم نهايات خياطة وتأكد من أن عقدة خياطة مشدودة بالكامل.
- انتقل إلى إجراءات الإغلاق وتسكين الألم الموضحة في الخطوة 2.9.
- بديل لربط إصلاح موقع حقن CCA واستعادة الدورة الدموية
- باستخدام كرات قطنية معقمة ، امتص أي دم متبقي داخل التجويف الجراحي. حدد موقع الحقن على CCA (الشكل 7 أ) وحدد عدد الغرز اللازمة للإغلاق. قم بري موقع الحقن وتجويف المنطقة المعزولة من CCA جيدا لإزالة الدم المتخثر.
- باستخدام ملقط الطرف المائل ، أمسك إبرة الخياطة 9-0 بواسطة جسم الإبرة بالقرب من الأرجوحة. أثناء استخدام الملقط الدقيق لدعم الشريان من الجانب الآخر ، ضع خيطا واحدا في CCA عن طريق اختراق جدار الشرايين حوالي 1-1.5 مم جانبي لموقع الحقن ، عموديا على الشريان. امسك الشريان بالملقط الناعم ، وافتح موقع الحقن ومرر الإبرة والخياطة عبر الجانبين الأيمن والأيسر بشكل فردي. بدلا من ذلك ، أمسك الشريان ، واضغط برفق على الجانبين مع الملقط الناعم ، ومرر الإبرة ، وخيط عبر جانبي الشريان بعضة واحدة.
ملاحظة: مع أي من التقنيتين ، كن حذرا من أن الإبرة والخيط لا يخترقان الجدار الخلفي داخل الشريان لأن هذا سيغلق التجويف عند شده. - أغلق موقع الحقن بعقدة الجراح التي تقوم بربط أداة بالملقط الدقيق والملقط ذي الطرف المائل ، باستخدام ما لا يقل عن أربع رميات (الشكل 7 ب). بشكل عام ، استخدم خيطا واحدا بسيطا متقطعا لإغلاق موقع الحقن لإبرة 33 جرام.
- لاستعادة الدورة الدموية باستخدام الملقط الناعم ، قم بفك وإزالة الخيط حول ECA ، متبوعا بالخيط العلوي على CCA (الشكل 7C ، D). بعد ذلك ، قم بفك الخيط السفلي ببطء على CCA ولكن لا تقم بفك ربطه على الفور. تأكد من أن موقع الحقن مغلق بما فيه الكفاية لمنع النزيف الكبير مع استعادة ضغط الدم وتدفقه (الشكل 7 د).
ملاحظة: في حالة حدوث نزيف كبير في موقع الحقن ، يمكن إعادة شد الخيط السفلي على CCA بسرعة ويمكن تعديل موقع الحقن أو إعادة خياطته إذا لزم الأمر. - قم بإزالة خيوط CCA العلوية والسفلية (الشكل 7E). انتقل إلى الخطوة 2.9.
- إغلاق وتسكين
- أعد وضع الغدة اللعابية في التجويف وأغلق الشق بثلاث خيوط بسيطة متقطعة باستخدام حزمة خياطة معقمة. قم بإزالة قيود الشريط الجراحي ، واسمح للفأر بالتعافي من التخدير على وسادة التدفئة.
ملاحظة: يجب إعطاء جرعات متابعة من المسكن وفقا للتكرار والجرعة المحددة في بروتوكول IACUC المعتمد من المستخدم. يوصى بمدة الشفاء لمدة أسبوع واحد بين الحقن. إذا كانت هناك حاجة إلى الحقن المتكرر ، يمكن استخدام إصلاح موقع الحقن بعد الحقن الأول ويمكن اتباع نفس الإجراء الجراحي للحقن اللاحقة. يمكن إعطاء الحقن اللاحق في الجمجمة CCA إلى موقع الحقن الذي تم إصلاحه حيث من المحتمل أن تؤدي الخياطة المتكررة لإصلاح نفس موقع الحقن إلى تندب وجلطات دموية.
- أعد وضع الغدة اللعابية في التجويف وأغلق الشق بثلاث خيوط بسيطة متقطعة باستخدام حزمة خياطة معقمة. قم بإزالة قيود الشريط الجراحي ، واسمح للفأر بالتعافي من التخدير على وسادة التدفئة.
النتائج
وقد أظهرت التقارير السابقة أن الخلايا الجذعية الوسيطة البشرية المشتقة من نخاع العظم (BM-hMSCs) التي يتم تسليمها عن طريق الحقن داخل الشريان السباتي نجحت في توطين الأورام الدبقية داخل الجمجمة في الفئران19. استخدمنا هذا النموذج لمقارنة آثار ربط CCA مقابل إصلاح CCA مع استعادة الدورة الدموية بعد الحقن السباتي ل BM-hMSCs في الفئران الحاملة للورم الدبقي. تم زرع الفئران العارية Athymic بخلايا الورم الدبقي U87 ، تليها حقن BM-hMSCs المسمى GFP مع ربط CCA اللاحق أو إصلاح CCA مع استعادة الدورة الدموية. بعد 3 أيام ، تم التضحية بالفئران وتم حصاد الأدمغة وتثبيتها وإجراء الكيمياء الهيستولوجية المناعية للكشف عن GFP ، وتم حساب الخلايا الإيجابية ل GFP (الشكل 8A-D).
تم تقييم التوجيه الكلي ل GFP-BM-hMSCs إلى الأورام الدبقية داخل الجمجمة من خلال العدد الإجمالي للخلايا الإيجابية GFP داخل حدود الورم على شريحتين مختلفتين (أقسام >75 ميكرومتر) من نفس العينة. أشارت مقارنة الوسائل بواسطة اختبار t غير المزاوج إلى عدم وجود فرق كبير بين متوسط التوجيه الملاحظ بين الإجراءين (P = 0.6858) (الشكل 8E). تم تقييم تشتت GFP-BM-hMSCs في جميع أنحاء الورم عن طريق حساب الخلايا الإيجابية ل GFP عبر 10 حقول عالية الطاقة داخل الورم. قد تشير زيادة أعداد الخلايا داخل الحقول عالية الطاقة إلى تغيرات في تشتت الخلايا في جميع أنحاء الورم الناتجة عن الاختلاف في الإجراء. أشارت مقارنة القيم المتوسطة باستخدام اختبار Wilcoxon Signed Rank إلى عدم وجود فرق كبير بين متوسط عدد الخلايا الإيجابية ل GFP عبر الحقول عالية الطاقة بين ربط CCA ومجموعات إصلاح CCA (الشكل 8F).

الشكل 1: تحضير الطاولة الجراحية والفأر للجراحة. (أ ، ب) سرير جراحي (ملصقات أ. شريط فينيل يشكل السرير ، ب. شريط جراحي مقيد للأطراف الأمامية ، ج. وسادة ، د. وزن ، ه. مخروط أنف التخدير ، مبعدة خطاف غير حاد ، G. خيوط 1 سم في 70٪ إيثانول ، H. ملقط ناعم ، I. ملقط بزاوية ، J. مقص ضيق ، K. كرات قطنية معقمة). (ج، د) وضع الماوس. (ه، و) موقع الجراحة وتطهير موقع الجراحة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
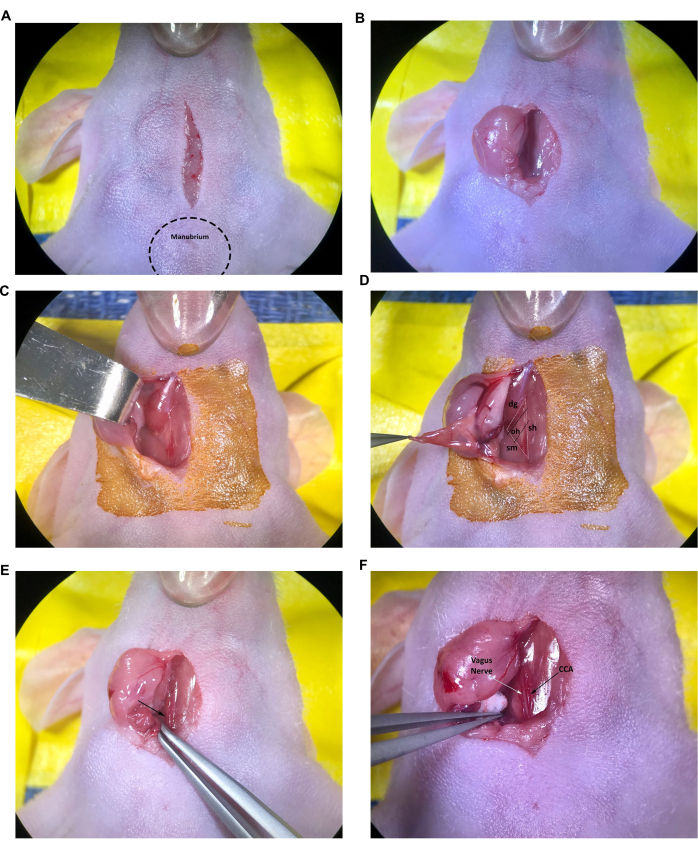
الشكل 2: شق وتعرض الهياكل في موقع الحقن. أ: شق خط الوسط. (ب، ج) تراجع الغدة اللعابية اليمنى. (د) المثلث العضلي المكون من القصبة الهوائية/العضلة القصية اللاإمية، والعضلة القصية الترقوية الخشائية، والعضلة ثنائية المعدة، العضلة اللامية اللامية مرئية أيضا. ه: الشريان السباتي المشترك، ويشار إليه بالسهم. (و) العصب المبهم والشريان السباتي المشترك، ويشار إليهما بالأسهم. الاختصارات: sh = القصبة الهوائية / العضلات القصية اللامية. sm = العضلة القصية الترقوية الخشائية. dg = عضلة ثنائية المعدة. أوه = عضلة أومو لامي. CCA = الشريان السباتي المشترك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
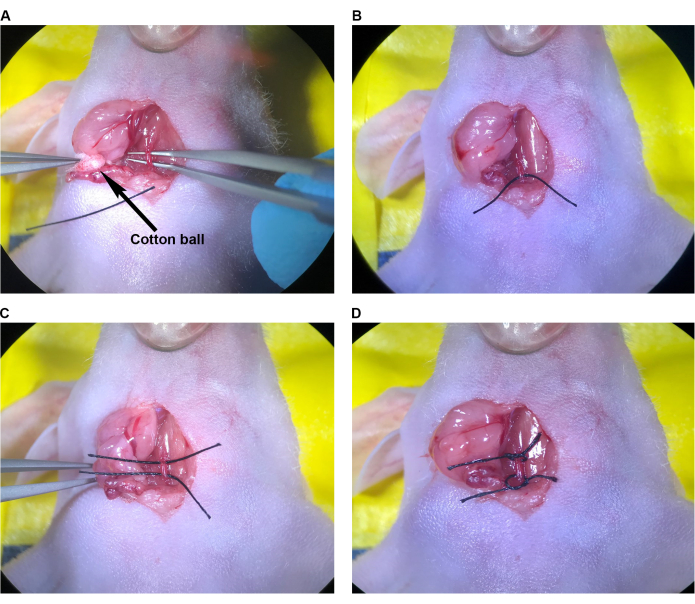
الشكل 3: تحضير التقييم القطري المشترك للحقن. (أ) ملقط ذو طرف زاوية يمر تحت التقييم القطري المشترك. (ب) سحب الخيط في منتصف الطريق تحت التقييم القطري المشترك باستخدام ملقط ذو طرف زاوي. (ج) سحب الخيط الثاني في منتصف الطريق تحت التقييم القطري المشترك. (د) خيط مربوط في معرفات فضفاضة حول CCA. اختصار: CCA = الشريان السباتي المشترك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
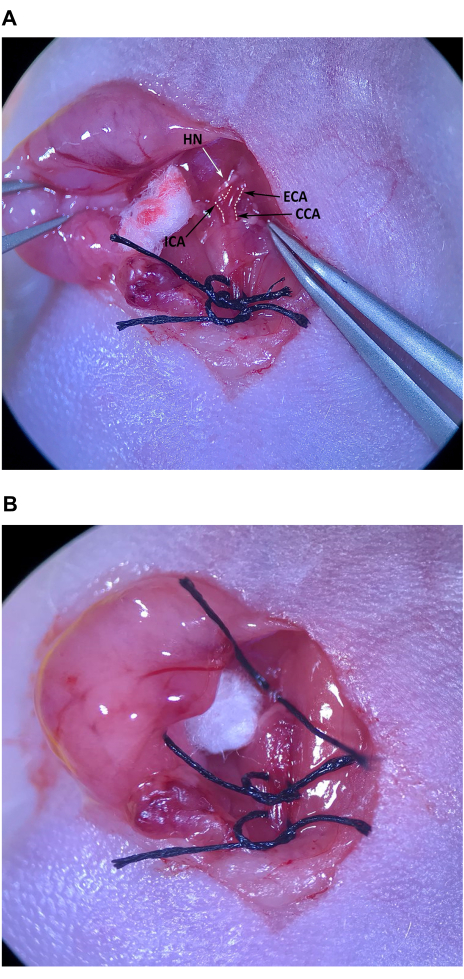
الشكل 4: عزل الشريان السباتي الخارجي وتحضيره. أ: التقييم القطري المشترك، والشريان السباتي الخارجي، والشريان السباتي الداخلي. (ب) تم سحب الخيط في منتصف الطريق تحت ECA. الاختصارات: CCA الشريان السباتي المشترك. ECA = الشريان السباتي الخارجي. ICA = الشريان السباتي الداخلي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 5: تحضير الإبرة والمحقنة. أ: الحقن بإبرة مستقيمة مع وضع حقنة على جسم الفأر. ب: الحقن بإبرة مثنية، مع وضع اليد على طاولة الجراحة. (ج، د) تحضير إبرة عازمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
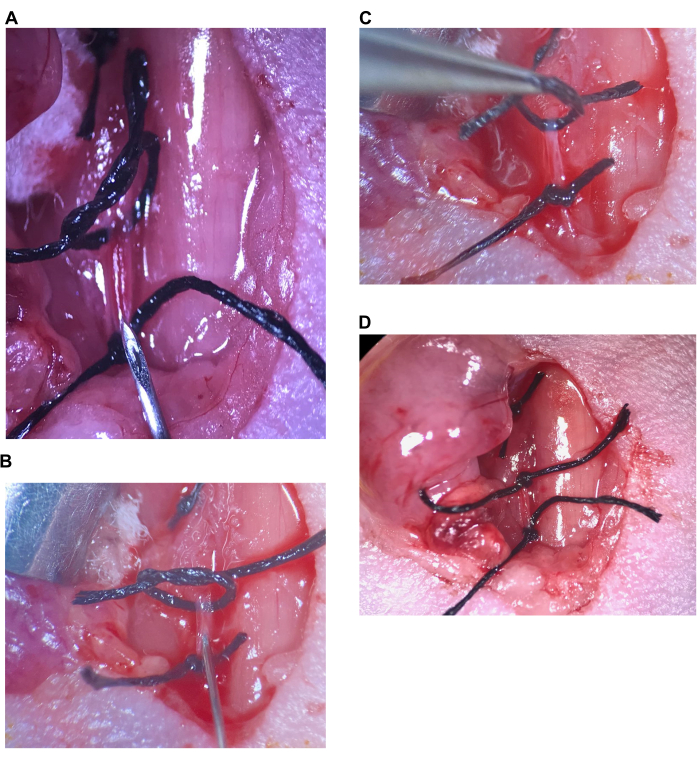
الشكل 6: الحقن داخل الشريان السباتي. (أ) يكون الخيط العلوي مفكوكا، ويشد الخيط السفلي على التقييم القطري المشترك، وتوضع الإبرة فوق الخيط السفلي. (ب) يتم إدخال الإبرة بعد الشطبة مباشرة، ويتم إغلاق الشريان حول الإبرة. (ج) يرفع الخيط العلوي لربط الشريان لأعلى ومنع التدفق العكسي. (د) يتم شد الخيط العلوي على التقييم القطري المشترك. اختصار: CCA = الشريان السباتي المشترك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
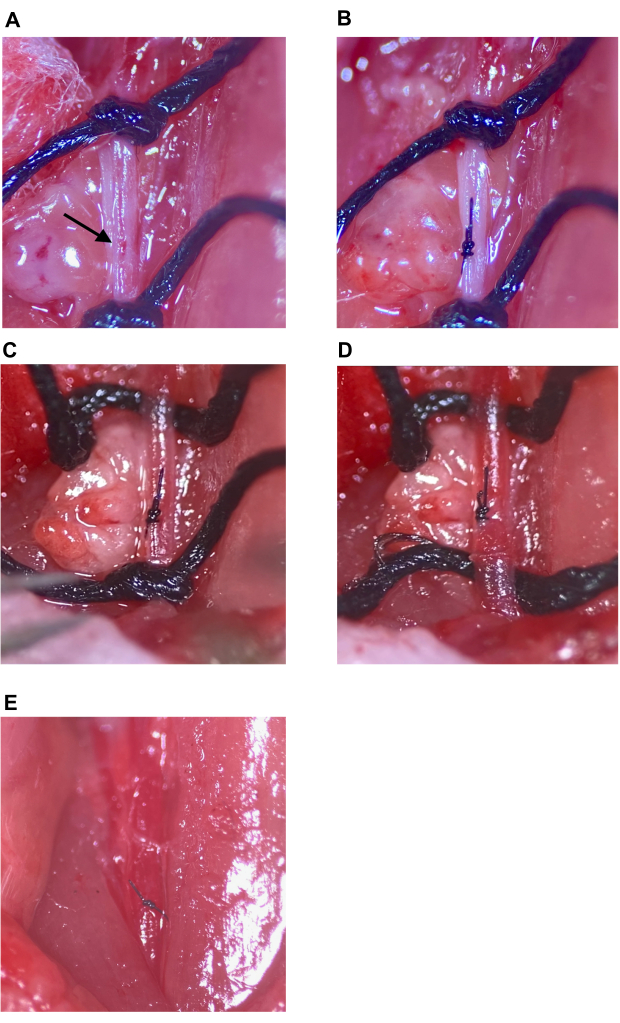
الشكل 7: إصلاح موقع الحقن واستعادة الدورة الدموية. أ: موقع الحقن المشار إليه بسهم. (ب) أغلق موقع الحقن بعقدة الجراح، أربع رميات على الأقل. (ج، د) تخفيف الغرز العلوية والسفلية على CCA بعد إصلاح موقع الحقن ؛ لا نزيف ينظر بعد تخفيف خياطة. (ه) تزال الغرز بعد تحديد موقع الحقن ليتم إصلاحه بشكل كاف. اختصار: CCA = الشريان السباتي المشترك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
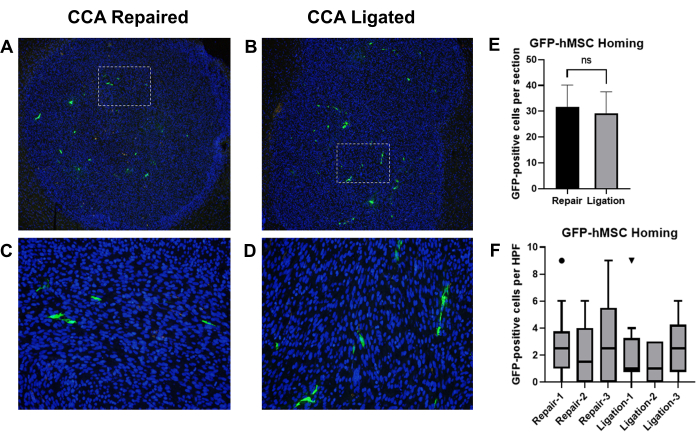
الشكل 8: الحقن داخل الشريان السباتي ل GFP-BM-hMSCs ومقارنة التوجيه بأورام الورم الدبقي داخل الجمجمة بعد ربط CCA أو إصلاح CCA مع استعادة الدورة الدموية. تم تلطيخ أقسام أنسجة المخ من الفئران الحاملة للورم بالأجسام المضادة الأولية المضادة ل GFP و Alexa Fluor 488 الثانوية لتسمية GFP-BM-hMSCs (باللون الأخضر). كانت النوى ملطخة ب Hoechst 33342 (أزرق). تمثل الحقول منخفضة الطاقة للأقسام المصنفة التي تظهر التوجيه الكلي للورم والحقول عالية الطاقة التي تظهر توزيع الخلايا الإيجابية ل GFP بعد (A ، C) إصلاح CCA أو (B ، D) ربط CCA. (ه) تم تقييم التوجيه العام ل GFP-BM-hMSCs للأورام من خلال العدد الإجمالي للخلايا الإيجابية ل GFP داخل حدود الورم على شريحتين مختلفتين وتمت مقارنة الوسائل بواسطة اختبار t. لم يلاحظ أي فرق كبير في التوجيه الكلي بين الإجراءات البديلة (P = 0.6858). (F) تم تقييم تشتت GFP-BM-hMSCs في جميع أنحاء الورم عن طريق حساب الخلايا الإيجابية ل GFP عبر 10 حقول عالية الطاقة داخل الورم. تشير مقارنة القيم المتوسطة بواسطة اختبار Wilcoxon Signed Rank إلى عدم وجود فرق كبير بين الأفراد ، بغض النظر عن الإجراء (P = 0.1914 ، 0.5000 ، 0.1641 ، 0.9512 ، 0.8828 ، 0.2207). الاختصارات: GFP = بروتين الفلورسنت الأخضر. GFP-BM-hMSCs = الخلايا الجذعية الوسيطة البشرية المشتقة من نخاع العظم GFP ؛ CCA = الشريان السباتي المشترك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تم استخدام حقن الشريان السباتي بشكل متزايد في السنوات الأخيرة لتقديم علاجات لأورام الدماغ. وبالتالي ، من المهم إنشاء نماذج للفئران تعكس حقن الشريان السباتي في البشر لأغراض البحث. في السابق ، تم إجراء حقن الشريان السباتي في الفئران مع الربط اللاحق للشريان ، مما يحد من عدد الحقن في الشريان11,12. بالإضافة إلى ذلك ، يمكن أن يؤدي انسداد الشريان السباتي في الفئران إلى نقص التروية الدماغية في بعض سلالات الفئران التي لا تحتوي على دائرة كاملة من ويليس13. لقد طورنا طريقة لإصلاح الشريان السباتي المحقون للتغلب على قيود الطرق السابقة. يؤدي إصلاح موقع الحقن إلى إعادة تدفق الدم إلى الشريان المحقون ، مما يقلل من فرصة الإصابة بنقص التروية الدماغية ، ويسهل الحقن اللاحقة في نفس الشريان السباتي الداخلي.
تتطلب العديد من الخطوات ، التي تعتبر حاسمة للنجاح ، معالجة دقيقة للأدوات الجراحية أو الأنسجة ، والتي تشمل: إدخال الإبرة بشكل صحيح في تجويف الشريان لتجنب النزيف أثناء الحقن داخل الشريان السباتي. تشريح دقيق للنسيج الضام من موقع الحقن قبل إدخال الإبرة ؛ إزالة جميع الكتل وفقاعات الهواء في المحقنة والإبرة قبل الحقن ؛ والإغلاق الصحيح لموقع الحقن لمنع إغلاق تجويف الشريان أثناء الإصلاح. لمنع النزيف بعد إدخال الإبرة، تأكد من إدخال الإبرة في الشريان بعد الشطبة لتشكيل ختم حول عمود الإبرة. لتجنب حدوث تمزق في الجدار الخلفي للشريان، أدخل الإبرة بزاوية ضحلة وهز المحقنة والإبرة بمهارة للخلف للحفاظ على طرف الإبرة خاليا من الجدار الخلفي الشرياني. إذا تسرب المحلول المحقون أثناء الحقن ، فهذا يشير إلى أن الإبرة قد تم إدخالها فقط في النسيج الضام المحيط بالشريان. التشريح الدقيق للنسيج الضام الزائد من موقع الحقن قبل الحقن سيمنع هذه المشكلة.
فيما يتعلق باختيار الخياطة وتقنية الإغلاق ، إذا استخدم الحقن الأولي إبرة 33 G وقام بإدخال نظيف في الشريان ، فإن خياطة واحدة بسيطة مع خياطة 9-0 كافية لإصلاح الشريان. إذا تم استخدام إبرة أكبر للحقن (30 جم وما إلى ذلك) أو حدث أي تمزق عند إدخال الإبرة (على سبيل المثال ، عندما تكون الإبرة خارج المركز أو يتحرك الشريان لأن الفأر يتنفس) ، ينتج عن ذلك ثقب أكبر قليلا يحتاج إلى إصلاح. عادة ما تكون غرزتان بسيطتان أو رقم ثمانية كافية لإصلاح هذا النوع من الثقوب الأكبر. يعتمد الاختيار بين هاتين التقنيتين على تفضيل الجراح في هذه الحالة. من المهم ملاحظة أن تقنية الإصلاح لم يتم تقييمها في الحالات التي يكون فيها ثقب موقع الحقن أكبر بكثير مما كان عليه في الحالة المذكورة أعلاه. إذا امتد التمزق في موقع الحقن بشكل جانبي (مما يؤدي إلى ثقب أوسع ، أكبر من ثلث محيط الشريان) ، فإن الإصلاح بهذه الطريقة قد يسبب تقلص الشريان وزيادة خطر تجلط الدم.
إذا كان هناك نزيف من موقع الحقن الذي تم إصلاحه أثناء إزالة الغرز ، فقد يكون ذلك بسبب تمدد الموقع الذي تم إصلاحه مع استئناف الدورة الدموية الطبيعية ؛ يمكن تصحيح ذلك عن طريق تغطية موقع الحقن الذي تم إصلاحه برفق بقطن معقم وتطبيق ضغط خفيف لمدة 30 ثانية. بدلا من ذلك ، إذا كان هناك نزيف من موقع الحقن الذي تم إصلاحه مع عدم وجود تدفق دم مرئي وشريان منتفخ قريب ، فهذا يشير إلى أن إبرة الخياطة مرت عبر الجدار الخلفي للشريان أثناء الإصلاح. في هذه الحالة ، افتح حواف موقع الحقن برفق أثناء الإصلاح ، وقم بتمرير إبرة الخياطة عبر الشريان بزاوية ضحلة ، وتأكد بصريا من أن الخيط لم يمر عبر الجدار الخلفي قبل ربط عقدة الخياطة.
مع تطبيق هذه التدابير ، تكون طريقة إصلاح موقع الحقن دقيقة وقابلة للتكرار عبر مجموعات بغض النظر عن الخلفية الوراثية أو العمر. في تجربتنا ، كان معدل النجاح 100٪ مع ثلاثة جراحين مختلفين يقومون بإجراء العملية. مع الخبرة الكافية واتباع البروتوكول المقدم بعناية ، لا نتوقع أي صعوبة للجراحين الآخرين في إجراء هذا الإجراء. مع الممارسة ، يمكن للجراح الماهر إكمال الإجراء في 15-20 دقيقة. إذا سمحت التجربة بذلك ، يمكن أيضا تقليل الوقت لكل عن طريق ترك خيوط CCA العلوية والسفلية سليمة ، والتخلي عن إصلاح موقع الحقن. ومع ذلك ، كما هو مذكور أعلاه ، تم توثيق الاختلافات الخاصة بالسلالة في تشريح الأوعية الدموية الدماغية ومن المهم التحقق من أن سلالة الفأر المستخدمة في الإجراء يمكن أن تتحمل ذلك قبل بدء التجربة.
نظرا لأن هذا إجراء جراحي ، يجب أن يؤخذ استرداد الفئران في الاعتبار. يعد تحمل الإجهاد واستعادة الجروح من الاعتبارات المهمة التي ستختلف باختلاف سلالات الفئران. بالإضافة إلى ذلك ، قد يؤدي الالتهاب في موقع الجراحة وتكوين أنسجة ندبة إلى زيادة وقت الشفاء بعد العمليات الجراحية المتكررة. لقد نجحنا في إجراء حقن متعددة بفارق 7 أيام ، ولكن إذا كانت الحقن المتكررة ضرورية ، فيجب تقييمها بعناية في سلالات الماوس المحددة التي سيتم استخدامها. يمكن أن يؤدي التعامل القوي والضغط على CCA (أثناء العزل وربط وإزالة الغرز والحقن) إلى إتلاف وإضعاف جدران الشرايين مما يؤدي إلى تمزقها أثناء الحقن المتكرر. من المهم تقليل تشريح النسيج الضام الداعم حول CCA والتشعب والامتناع عن تطبيق التوتر المفرط على الشريان.
تشير نتائجنا إلى أنه في هذا النموذج بالذات ، لا يختلف ربط CCA أو إصلاح CCA مع استعادة الدورة الدموية بعد الحقن في التردد الكلي للتوجيه أو توزيع BM-hMSCs المحقونة عبر الأورام داخل الجمجمة. في حين أن هذا قد يختلف في سلالات الفئران المختلفة ، فإن استخدام إصلاح موقع الحقن يوفر ميزة إعادة تدفق الدم إلى الشريان المحقون ، مما يسمح بالحقن اللاحقة في نفس الشريان ، والأهم من ذلك ، يشبه حقن الشريان السباتي في المرضى من البشر. يعتمد اختيار الربط مقابل إصلاح الشريان المحقون على نوع التجربة ونموذج الماوس المستخدم. إذا كانت هناك حاجة إلى حقنة ثانية ، أو إذا كان طراز الماوس لا يحتوي على دائرة كاملة من ويليس ، فيجب استخدام إصلاح موقع الحقن. يمكن أن تسهل القدرة على إعادة حقن CCA في نماذج الماوس معالجة تجريبية إضافية. على سبيل المثال ، لاختبار جرعات متعددة من علاج محتمل يتم إعطاؤه بمرور الوقت ، يعد إصلاح الشريان المحقون ضروريا لإجراء الحقن اللاحقة. ستكون هذه الطريقة مفيدة أيضا في التجارب التي تنطوي على حقن مجموعات من العوامل العلاجية التي تحتاج إلى حقنها في أوقات مختلفة. تعمل المرونة المتزايدة في الحقن داخل الشريان السباتي التي يوفرها إصلاح الشريان المحقون على تحسين الفائدة الانتقالية لنماذج ورم دماغ الفئران.
Disclosures
ليس لدى المؤلفين أي إفصاحات / تضارب مصالح ذات صلة.
Acknowledgements
تم دعم هذه الدراسة بمنح من المعهد الوطني للسرطان (R01CA115729 و R01CA214749 و 1P50 CA127001) والمساهمات الخيرية السخية لبرنامج Moon Shots™ التابع لمركز MD Anderson للسرطان بجامعة تكساس ، ومؤسسة Broach لأبحاث سرطان الدماغ ، وصندوق عائلة إلياس لأبحاث أورام المخ ، وصندوق بريسيلا هيلي لأبحاث السرطان ، وصندوق أبحاث سرطان الدماغ لعائلة بومان ، صندوق Chuanwei Lu ، صندوق أبحاث سرطان الدماغ Sweet Family ، مؤسسة Ira Schneider Memorial لأبحاث السرطان ، صندوق Jim and Pam Harris ، صندوق Gene Pennebaker لأبحاث سرطان الدماغ ، صندوق سورنسون لأبحاث أورام المخ ، صندوق Brian McCulloch التذكاري ، مؤسسة TLC من القلب وصندوق ماري هاريس باباس الممنوح لأبحاث الورم الأرومي الدبقي ، الكل إلى F.F.L.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringes (low dead space) | Air-tite Products Co. | A1 | |
| 26 G; 1/2" needle | Air-tite Products Co. | N2612 | |
| 33 G; 1/2" needle | JBP, Air-tite Products Co. | JBP3313B | |
| 3 cm Petri dish | Falcon, Fisher Scientific | 08-772A | |
| 3M durapore surgical tape | Fisher Scientific | 19-071-152 | |
| 6-0 suture thread | Fine Science Tools | 18020-60 | |
| 70% Ethanol | Fisher Scientific | 04-355-122 | |
| 9-0 microsurgical suture with needle | Fine Science Tools | 12052-09 | |
| Analgesic for major surgery | |||
| Artificial tears/ophthalmic ointment | Covetrus | 8897 | |
| Bead Sterilizer | Fisher Scientific | 14-955-341 | |
| Betadine/Chlorhexidine | McKesson, Fisher Scientific | NC1696484 | |
| Blunt hook retractor | Fine Science Tools | 17022-13 | |
| Dissecting microscope | Zeiss Microscopy, LLC | 491903-0010-000 | |
| Electric heating pad | Insource, Fisher Scientific | NC0667724 | |
| Extra narrow scissors | Fine Science Tools | 14088-10 | |
| Fine forceps - Dumont #5 forceps with micro-blunted tips | Fine Science Tools | 11253-20 | |
| Fine forceps - Dumont #5/45 angled tip forceps with micro-blunted tips | Fine Science Tools | 11253-25 | |
| Isoflurane vaporizer (or Ketamine/Xylazine cocktail) | Kent Scientific | VetFlo-1231 | |
| Light source | Laxco, Fisher Scientific | AMPSILED21 | |
| Mouse anesthesia nose cone | Braintree Scientific, Inc | XENO- M | |
| Needle driver | Fine Science Tools | 12002-12 | |
| Sterile cotton swabs | Texwipe, Fisher Scientific | 18-366-472 | |
| Sterile gauze pads | Covidien, Fisher Scientific | 22-037-907 | |
| Sterile saline (0.9%) | KD Medical, Fisher Scientific | 50-103-1363 | |
| Sterile surgical drapes | Fisher Scientific | 50-129-6666 | |
| Sterile surgical/downdraft table | |||
| Sterile suture pack (any suitable diameter for mouse wound closure) | Ethicon, Fisher Scientific | 50-209-2811 | |
| Surgical tools | |||
| Vinyl lab tape | Fisher Scientific | 15-901 |
References
- Loya, J., Zhang, C., Cox, E., Achrol, A. S., Kesari, S. Biological intratumoral therapy for the high-grade glioma part i: Intratumoral delivery and immunotoxins. CNS Oncol. 8 (3), (2019).
- Garfield, J., Dayan, A. D. Postoperative intracavitary chemotherapy of malignant gliomas. A preliminary study using methotrexate. J Neurosurg. 39 (3), 315-322 (1973).
- Kroin, J. S., Penn, R. D. Intracerebral chemotherapy: Chronic microinfusion of cisplatin. Neurosurgery. 10 (3), 349-354 (1982).
- Sendelbeck, S. L., Urquhart, J. Spatial distribution of dopamine, methotrexate and antipyrine during continuous intracerebral microperfusion. Brain Res. 328 (2), 251-258 (1985).
- Alter, R. A., et al. Long-term benefit of intra-arterial bevacizumab for recurrent glioblastoma. J Exp Ther Oncol. 12 (1), 67-71 (2017).
- Angelov, L., et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary cns lymphoma: A multi-institutional experience. J Clin Oncol. 27 (21), 3503-3509 (2009).
- Chen, S. R., Chen, M. M., Ene, C., Lang, F. F., Kan, P. Perfusion-guided endovascular super-selective intra-arterial infusion for treatment of malignant brain tumors. J Neurointerv Surg. 14 (6), 533-538 (2022).
- Faltings, L., et al. Rechallenging recurrent glioblastoma with intra-arterial bevacizumab with blood brain-barrier disruption results in radiographic response. World Neurosurg. 131, 234-241 (2019).
- Srinivasan, V. M., et al. Advances in endovascular neuro-oncology: Endovascular selective intra-arterial (esia) infusion of targeted biologic therapy for brain tumors. J Neurointerv Surg. 12 (2), 197-203 (2020).
- Shinojima, N., et al. Tgf-β mediates homing of bone marrow-derived human mesenchymal stem cells to glioma stem cells. Cancer Res. 73 (7), 2333-2344 (2013).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of visualized experiments : JoVE. (120), e55085 (2017).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Benbenishty, A., et al. Maintaining unperturbed cerebral blood flow is key in the study of brain metastasis and its interactions with stress and inflammatory responses. Brain, behavior, and immunity. 62, 265-276 (2017).
- Doucette, T., et al. Mesenchymal stem cells display tumor-specific tropism in an rcas/ntv-a glioma model. Neoplasia. 13 (8), 716-725 (2011).
- Hata, N., et al. Platelet-derived growth factor bb mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 66 (1), 144-156 (2010).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 65 (8), 3307-3318 (2005).
- Qiao, Y., et al. Magnetic resonance and photoacoustic imaging of brain tumor mediated by mesenchymal stem cell labeled with multifunctional nanoparticle introduced via carotid artery injection. Nanotechnology. 29 (16), 165101 (2018).
- Yong, R. L., et al. Human bone marrow-derived mesenchymal stem cells for intravascular delivery of oncolytic adenovirus delta24-rgd to human gliomas. Cancer Res. 69 (23), 8932-8940 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved