Method Article
Facilitación de la repetición de inyecciones intracarotídeas en modelos de ratón mediante una novedosa técnica de reparación en el lugar de la inyección
En este artículo
Resumen
La reparación de la arteria intracarótida en un modelo de ratón después de la inyección devuelve el flujo sanguíneo a la arteria sin afectar negativamente la distribución del material inyectado. La reparación en el lugar de la inyección facilita las inyecciones posteriores a través de la misma arteria y previene la isquemia cerebral en cepas de ratón que carecen de un Círculo de Willis completo.
Resumen
Dados los avances recientes en la administración de nuevas terapias antitumorales utilizando métodos de administración intraarterial selectivos endovasculares en neurooncología, existe una necesidad urgente de desarrollar métodos para las inyecciones intracarotídeas en modelos de ratón, incluidos métodos para reparar la arteria carótida en ratones después de la inyección para permitir inyecciones posteriores. Desarrollamos un método de inyección intracarotídea en un modelo de ratón para administrar terapias en la arteria carótida interna (ACI) con dos procedimientos alternativos.
Durante la inyección, la aguja se inserta en la arteria carótida común (ACC) después de atar una sutura alrededor de la arteria carótida externa (ECA) y los tratamientos inyectados se administran en la ACI. Después de la inyección, se puede ligar la arteria carótida común (CCA), lo que limita el número de inyecciones intracarotídeas a una. El procedimiento alternativo descrito en este artículo incluye una modificación en la que la inyección intracarótida es seguida por la reparación del CCA en el lugar de la inyección, lo que restaura el flujo sanguíneo dentro del CCA y evita la complicación de la isquemia cerebral observada en algunos modelos de ratón.
También comparamos la administración de células madre mesenquimales humanas derivadas de la médula ósea (BM-hMSC) con tumores intracraneales cuando se administraron mediante inyección intracarotídea con y sin reparación del sitio de inyección después de la inyección. La administración de BM-hMSC no difiere significativamente entre los métodos. Nuestros resultados demuestran que la reparación del CCA en el lugar de inyección permite inyecciones repetidas a través de la misma arteria y no perjudica la entrega y distribución del material inyectado, proporcionando así un modelo con mayor flexibilidad que emula más de cerca la inyección intracarotídea en humanos.
Introducción
La administración de terapias a los tumores cerebrales es un desafío debido a la impermeabilidad de la barrera hematoencefálica (BBB) y la barrera hematotumoral (BTB). La inyección intratumoral directa de terapias para eludir la BHE puede lograrse mediante el uso de un catéter de reservorio Ommaya, una microinfusión de bajo flujo para una administración mejorada por convección o una inyección local en la cavidad de resección o en el tejido adyacente1. Sin embargo, el volumen total de tejido tumoral que se alcanza con estos métodos es limitado 2,3,4. Las inyecciones intraarteriales se han utilizado anteriormente para administrar agentes terapéuticos a los tumores cerebrales con el objetivo de llegar a una mayor cantidad del tumor 5,6,7,8 y, en los últimos tiempos, los avances tanto en las técnicas de administración intraarterial como en los nuevos agentes terapéuticos han demostrado el beneficio de utilizar este enfoque en el tratamiento de los tumores cerebrales7, 9. Estos avances incluyen el desarrollo de microcatéteres, la administración intraarterial selectiva endovascular (ESIA) con imágenes avanzadas, el uso de agentes osmóticos para interrumpir la BHE y la BTB, y el desarrollo de terapias biológicas dirigidas. Por lo tanto, para realizar ensayos preclínicos de nuevos agentes terapéuticos que se administran a través de inyecciones intraarteriales, son necesarios modelos de investigación traslacional apropiados 9,10.
En modelos de ratón de tumores cerebrales, los fármacos terapéuticos administrados por vía intraperitoneal o intravenosa (a través de la vena de la cola) pasan a través del hígado o del corazón y los pulmones, respectivamente, antes de distribuirse a todo el cuerpo, incluido el cerebro. Estos efectos de primer paso pueden atrapar y eliminar el agente, o diluir el agente antes de llegar al cerebro, y pueden presentar toxicidades limitantes de la dosis antes de alcanzar una dosis terapéutica en el cerebro. Por el contrario, la inyección intracarótida en la arteria permite una administración enfocada al cerebro antes de la circulación al evitar el metabolismo de primer paso y limitar la administración fuera del objetivo. Si bien la inyección intracarotídea en ratones es más laboriosa, la especificidad y la reproducibilidad de la técnica resultan en una reducción del número de animales para completar las investigaciones11,12.
En general, en los métodos previamente descritos de inyección intracarótida en ratones, la arteria carótida común se liga después de la inyección y la circulación al cerebro es proporcionada por la arteria carótida contralateral y la circulación cerebral posterior a través del círculo de Willis11,12. Este método tiene la limitación inherente de permitir solo un máximo de una inyección en la arteria carótida interna o externa. También es fundamental que las cepas de ratón utilizadas en experimentos en los que se liga la arteria carótida tengan un círculo de Willis completo para prevenir la isquemia cerebral debida a la arteria ligada13. También se ha demostrado que la oclusión de la arteria carótida reduce el flujo sanguíneo cerebral y limita la distribución de las partículas inyectadas14. Además, la oclusión de la arteria carótida en ratones después de la inyección no emula la inyección intracarótida en pacientes humanos.
Nuestro grupo ha utilizado previamente inyecciones intracarótidas en la arteria para administrar con éxito células madre mesenquimales al cerebro 10,15,16,17,18,19. En este artículo, describimos en detalle este método de inyección de la arteria intracarótida e incluimos una modificación del método que desarrollamos, en el que se repara el sitio de la inyección sin ocluir la arteria, evitando las limitaciones que plantea la ligadura de la arteria carótida posterior a la inyección. En este método, la arteria carótida común (CCA) se prepara para la inyección colocando dos suturas, una en cada extremo del sitio de inyección previsto, y se aprieta la sutura inferior (debajo del sitio de inyección). La arteria carótida externa (ECA) se sella con otra sutura. La aguja se inserta en el CCA y los tratamientos se administran en la arteria carótida interna (ACI). Después de esto, la sutura superior del CCA se aprieta para evitar el reflujo del ICA. En este paso, el CCA inyectado se puede ligar o reparar. Si se va a ligar el CCA, las suturas se aprietan y se dejan en su lugar. Si se repara el sitio de la inyección, se retiran las suturas después de la reparación y se restablece el flujo sanguíneo. A continuación se proporcionan los detalles de estos procedimientos alternativos.
Protocolo
Todos los pasos que se describen a continuación cumplen con nuestro protocolo, que sigue las pautas establecidas y fue aprobado por el Comité Institucional de Cuidado y Uso de Animales del MD Anderson Cancer Center de la Universidad de Texas.
1. Preparación de la mesa quirúrgica y el ratón para el procedimiento quirúrgico
- Preparación de la mesa quirúrgica y el ratón para el procedimiento quirúrgico (consulte la figura 1A, B)
- Coloque el microscopio de disección y la fuente de luz frente al vaporizador de isoflurano con un sistema de barrido activo o colóquelo en una mesa de tiro descendente. Coloque la almohadilla térmica eléctrica sobre la base del microscopio de disección (o preferiblemente debajo del microscopio si la base es sólida y puede transmitir calor) y cúbrala con un paño quirúrgico estéril.
NOTA: Todas las herramientas quirúrgicas y los paños deben esterilizarse en autoclave antes de su uso y todos los desechables deben ser estériles y empaquetados individualmente. Se deben usar guantes estériles durante todo el montaje y el procedimiento, y se deben cambiar cuando sea necesario para mantener la esterilidad. - Prepare la cama (4-5" de largo x 2" de ancho) sobre el paño quirúrgico con cinta de laboratorio de vinilo. Corte un cuadrado de gasa de 1.5 pulgadas x 1.5 pulgadas, enróllelo firmemente y coloque la gasa enrollada debajo de un trozo de cinta de vinilo de 3 pulgadas en la "cabecera" de la cama para formar una almohada (la inclinación de la cabeza con el uso de una almohada permite una mayor extensión del área ventral del cuello).
- Coloque trozos de cinta quirúrgica de 4 pulgadas a lo largo de los lados de la cama (encima de la cinta de vinilo). [Si usa isoflurano, coloque un cono nasal de anestesia con peso (o cinta adhesiva) adherido cerca de la cabecera de la cama. Ajústelo para una ubicación específica una vez que el mouse esté anestesiado y restringido.] Ver Figura 1A,B.
- Con un destornillador de agujas o pinzas pesadas, corte pequeños trozos de algodón de un hisopo de algodón y enrolle en bolas de varios tamaños de 0,5 a 1 mm de diámetro (8-10 piezas de algodón por ratón). Mantenga el algodón en el paño quirúrgico cerca de la cabecera de la cama.
- Con instrumentos estériles, corte el hilo de sutura 6-0 en trozos de 1 cm (3-4 trozos por ratón). Coloque las longitudes de sutura preparadas sobre un paño estéril. Prepare una jeringa de 1 mL para la administración de buprenorfina u otro analgésico adecuado (según lo aprobado por el protocolo del Comité Institucional de Cuidado y Uso de Animales [IACUC]). Esterilice todas las herramientas quirúrgicas de acuerdo con las normas de la IACUC antes de colocar las herramientas en el campo estéril.
- Coloque el microscopio de disección y la fuente de luz frente al vaporizador de isoflurano con un sistema de barrido activo o colóquelo en una mesa de tiro descendente. Coloque la almohadilla térmica eléctrica sobre la base del microscopio de disección (o preferiblemente debajo del microscopio si la base es sólida y puede transmitir calor) y cúbrala con un paño quirúrgico estéril.
- Preparación del ratón para el procedimiento quirúrgico (consulte la figura 1C-F)
- Anestesiar a un ratón siguiendo los métodos aprobados por la IACUC para cirugías de supervivencia mayores (use isoflurano al 1%-4%, según la sensibilidad de ratones individuales, o un cóctel de 10 mg/mL de ketamina, 1 mg/mL de xilacina a 100-200 mg/kg (ketamina) de peso corporal). Corta el pelaje o depila si es necesario. Administrar 0,5-1,0 mg/kg de buprenorfina ER (liberación prolongada) por inyección subcutánea 30 min antes del inicio del procedimiento quirúrgico.
- Coloque el ratón anestesiado de modo que la almohada descanse debajo del cuello (Figura 1C). La almohada ayuda a extender y apoyar el cuello cuando se usa con el cono nasal de anestesia. Si usa el cóctel de ketamina / xilacina, coloque una barra de dientes con peso o una herramienta similar en la boca, detrás de los incisivos para inclinar la cabeza y extender el cuello.
- Sujete las extremidades anteriores con la cinta quirúrgica previamente colocada a lo largo de los lados de la cama quirúrgica (Figura 1D). Ajuste la posición del ratón bajo el microscopio para que la superficie ventral del cuello esté a la vista y ajuste el aumento para observar cómodamente el sitio quirúrgico (Figura 1E).
NOTA: El aumento del microscopio de disección debe ser ajustado por el cirujano a su nivel de comodidad para cada paso. - Aplique lágrimas artificiales con un hisopo de algodón estéril. Desinfectar el sitio quirúrgico alternando hisopos circulares de betadine o clorhexidina y alcohol tres veces por desinfectante (Figura 1F).
- Confirme la profundidad de la anestesia asegurándose de que el ratón no retraiga su pata en respuesta a un pellizco en el dedo del pie. Controle la frecuencia respiratoria y asegúrese de que el ratón no esté jadeando, ya que esto es una indicación de anestesia excesiva cuando se usa isoflurano. Si es necesario, ajuste los caudales de oxígeno e isoflurano para alcanzar la profundidad anestésica adecuada y una respiración uniforme.
2. Procedimiento quirúrgico (Figura 2, Figura 3, Figura 4, Figura 5, Figura 6 y Figura 7)
- Incisión primaria y disección
- Comience haciendo una incisión longitudinal de 1 cm en la línea media, comenzando solo cranealmente hasta el manubrio (bulto que sobresale en el extremo craneal del esternón) y continuando sobre la tráquea con una hoja de bisturí estéril o un instrumento similar siguiendo las pautas aprobadas por el usuario de la IACUC (Figura 2A).
- Inserte la punta de las tijeras cerradas en la incisión y ábrala suavemente para realizar una disección roma del tejido conectivo subcutáneo, separando las dos glándulas salivales. Con las pinzas finas, tire suavemente de la glándula salival derecha a través de la incisión para que descanse sobre la superficie de la piel preparada asépticamente o retraiga la glándula salival lateralmente con el retractor de gancho romo (Figura 2B, C). Si la glándula exteriorizada parece seca o pegajosa, humedecerla con solución salina estéril.
- Continuar la disección roma del tejido conectivo hasta que los músculos esternocleidomastoideo y digástrico sean visibles (Figura 2D).
NOTA: El triángulo muscular formado por el músculo tráquea/esternohioideo (sh), el músculo esternocleidomastoideo (sm) y el músculo digástrico (dg) (vientre caudal) se utilizará para localizar el CCA derecho y la bifurcación de la arteria carótida en el protocolo. En general, el músculo omohioideo (oh) más pequeño también se puede ver tendido transversalmente a través del CCA (Figura 2D); Sin embargo, este músculo varía en tamaño y no es raro que el músculo omohioideo esté ausente por completo en ratones jóvenes o pequeños.
- Aislamiento CCA
- Con las pinzas de punta en ángulo, continúe con una disección cuidadosa del tejido conectivo (abriendo las puntas de las pinzas) cerca del extremo caudal del triángulo muscular para exponer la arteria carótida común, la vena yugular y el nervio vago.
NOTA: La arteria carótida común es el vaso sanguíneo más grande adyacente a la tráquea y, por lo general, se puede identificar fácilmente en la base del triángulo muscular (Figura 2E, flecha). Tenga mucho cuidado con las pinzas finas alrededor de los vasos sanguíneos, ya que las puntas pueden cortar fácilmente los vasos, lo que resulta en un sangrado excesivo y potencialmente letal. - Continúe con la disección cuidadosa del tejido conectivo alrededor de la porción de la arteria carótida común desde la base del triángulo muscular hasta el músculo omohioideo. Use las pequeñas bolas de algodón estériles para controlar cualquier sangrado menor y absorber los líquidos secretados de las glándulas salivales según sea necesario.
- Diseccionar cuidadosamente el tejido conectivo para separar el CCA del nervio vago. Tenga especial cuidado para minimizar la manipulación y el daño al nervio vago, fácilmente identificable como el haz nervioso grueso y blanco adyacente al CCA (Figura 2F).
- Con las pinzas de punta en ángulo, continúe con una disección cuidadosa del tejido conectivo (abriendo las puntas de las pinzas) cerca del extremo caudal del triángulo muscular para exponer la arteria carótida común, la vena yugular y el nervio vago.
- Preparación de CCA
- Una vez que el ACC se ha movilizado completamente desde el músculo esternocleidomastoideo, y donde sea visible, hasta el músculo omohioideo, coloque una pieza de 1 cm de sutura 6-0 en la piel aséptica preparada del esternón del ratón (para facilitar la extracción) y pase las pinzas de punta en ángulo por debajo del CCA (teniendo cuidado de aislar el CCA del nervio vago y la vena yugular) (Figura 3A). Si el músculo omohioideo no está presente, despeje el área alrededor del CCA lo suficiente como para poder colocar suturas en el CCA, craneal y caudal al sitio de inyección propuesto, e insertar la aguja.
- Con las pinzas finas en la mano izquierda, pase la sutura a las pinzas de punta en ángulo, agarrando cerca del extremo de la sutura. Tire suavemente de la mitad de la longitud de la sutura debajo del CCA con las pinzas de punta en ángulo (Figura 3B).
- Repetir este proceso con una segunda sutura, paralela a la primera sutura (Figura 3C).
- Ate sin apretar cada sutura alrededor de la CCA, pero no apriete los nudos ni restrinja el flujo sanguíneo (Figura 3D).
- Aislamiento y preparación de la arteria carótida externa
- Con las pinzas de punta en ángulo, retire con cuidado el tejido conectivo en el extremo craneal del triángulo muscular, craneal al músculo omohioideo, para localizar el CCA y la bifurcación en ECA e ICA (Figura 4A).
NOTA: El ECA se inclina hacia la línea media y es ligeramente más superficial, mientras que el ICA se inclina lateralmente y se adentra más en el cuello. Tenga especial cuidado para evitar daños en el nervio hipogloso (HN) que cruza sobre el ICA justo por encima de la bifurcación. - Limpie con cuidado el tejido conectivo de todos los lados del AEC cerca de la bifurcación. Una vez que se haya eliminado suficiente tejido conectivo del AEC, coloque un trozo de sutura en la piel preparada asépticamente en el esternón del ratón y pase las pinzas de punta en ángulo por debajo del ECA. Con las pinzas finas en la mano izquierda, pase la sutura a las pinzas de punta en ángulo en el espacio entre el ACI y el ACE y tire suavemente de la mitad de la longitud de la sutura (Figura 4B). Ata la sutura sin apretar alrededor del ECA, pero no aprietes el nudo.
NOTA: Es importante que se elimine suficiente tejido conectivo de la ECA para que pueda agarrar la sutura con las pinzas de punta en ángulo sin agarrar inadvertidamente el tejido conectivo que rodea las arterias, causando daño a las arterias cuando se recupera la sutura.
- Con las pinzas de punta en ángulo, retire con cuidado el tejido conectivo en el extremo craneal del triángulo muscular, craneal al músculo omohioideo, para localizar el CCA y la bifurcación en ECA e ICA (Figura 4A).
- Preparación de agujas y jeringas
NOTA: Para este paso, la inyección se puede realizar con una aguja recta, lo que permite que la jeringa descanse y sea estabilizada por el cuerpo del ratón (Figura 5A). Alternativamente, la inyección se puede realizar con una aguja que se dobla cerca de la punta, lo que permite sostener la jeringa como un lápiz con la mano apoyada en la mesa quirúrgica (Figura 5B). Ambas técnicas funcionan bien, y la elección de la técnica es una preferencia personal.- Para preparar la aguja doblada, sostenga una aguja de 33 G y 1/2 pulgada con el bisel hacia arriba y sujete la punta con un destornillador de aguja estéril (Figura 5C). Doble la aguja aproximadamente 30-40° directamente hacia el bisel (Figura 5D).
- Llene la jeringa con el volumen adecuado de la solución que se va a inyectar (asegúrese de tener en cuenta el espacio de la cavidad de la aguja si la solución inyectable no se extrae a través de la aguja para cargar la jeringa). Coloque la aguja y elimine las burbujas de aire. Asegúrese de que el menisco de la solución sea visible en el bisel de la aguja.
- Inyección intracarotídea
- Apriete el nudo de la sutura alrededor del ECA. A continuación, deslice la sutura inferior del CCA hacia el músculo esternocleidomastoideo tanto como sea posible y apriete el nudo. Asegúrese de que la sutura superior del CCA permanezca suelta hasta después de la inyección. Coloque una bola de algodón estéril en el borde de la cavidad para absorber el líquido y la sangre secretados durante la inyección.
- Sosteniendo la jeringa en la mano derecha y las pinzas finas en la mano izquierda, lleve la aguja a la arteria inmediatamente por encima de la sutura inferior de la CCA. Con las pinzas finas, tire suavemente del extremo suelto de la sutura inferior en dirección caudal para colocar un nivel bajo de tensión en el CCA (Figura 6A).
- Inserte la aguja en el CCA justo después del bisel y libere lentamente la tensión de la sutura (Figura 6B).
NOTA: La arteria tiene un flujo sanguíneo sustancial y es probable que sangre hacia la cavidad quirúrgica a medida que se inserta la aguja. Sin embargo, una vez que la aguja se inserta más allá del bisel, la arteria formará un sello alrededor de la aguja y el sangrado se detendrá. El sangrado continuo con la aguja en su lugar indica que la aguja no está lo suficientemente adentro de la arteria (el espacio desde el bisel permite que la sangre fluya) o que la aguja ha sido empujada a través de la parte posterior de la arteria. Ahora es importante mantener la aguja extremadamente quieta para evitar desgarrar la arteria o permitir que la aguja se salga. Monitorear continuamente a los animales con eventos de hemorragia, y si el sangrado es significativo (como cuando un animal pierde coloración, parece cianótico, se enfría al tacto o cualquier otro criterio de valoración humanitario descrito en el protocolo de uso animal), es necesario aplicar puntos de valoración humanitarios. - Utilice la mano izquierda para empujar el émbolo de la jeringa para inyectar la solución muy lentamente (Figura 5B, no menos de 15 segundos para inyectar 100 μL de solución). No retire la aguja cuando termine de inyectar la solución. Para evitar el reflujo, con las pinzas finas en la mano izquierda, agarre la sutura superior del ACC (aún atada sin apretar) por el nudo y levántela para doblar la arteria (Figura 6C).
- Retire la aguja, deje la jeringa a un lado y levante las pinzas de punta en ángulo con la mano derecha. Manteniendo la torcedura en la arteria, apriete el nudo en la sutura superior de la ACC (Figura 6D).
NOTA: En este punto, no debe haber sangrado adicional en la cavidad quirúrgica. Después de este paso, hay dos procedimientos alternativos que se describen en los pasos 2.7 y 2.8 a continuación. Si se va a ligar el CCA, siga el paso 2.7. Si el CCA se va a reparar en el lugar de la inyección, siga la modificación indicada en el paso 2.8.
- Ligadura de CCA
- En los casos que no requieran que se restablezca la circulación al CCA, dejar la arteria ligada, dejando ambas suturas tensas en el CCA. Recorte los extremos de la sutura y confirme que los nudos de la sutura estén completamente apretados.
- Proceda a los procedimientos de cierre y analgesia descritos en el paso 2.9.
- Alternativa a la ligadura de CCA-Injection: reparación del sitio y restauración de la circulación
- Con bolas de algodón estériles, absorba la sangre residual dentro de la cavidad quirúrgica. Ubique el sitio de inyección en el CCA (Figura 7A) y determine el número de suturas necesarias para cerrar. Irrigar minuciosamente el lugar de inyección y la luz del área aislada del CCA para eliminar la sangre coagulada.
- Con las pinzas de punta en ángulo, sujete la aguja de sutura 9-0 por el cuerpo de la aguja cerca del estampado. Mientras usa las pinzas finas para sostener la arteria desde el lado opuesto, coloque una sola sutura en el CCA penetrando la pared arterial aproximadamente 1-1,5 mm lateral al lugar de la inyección, perpendicular a la arteria. Sujete la arteria con las pinzas finas, abriendo el lugar de la inyección y pasando la aguja y la sutura por los lados derecho e izquierdo individualmente. Alternativamente, sostenga la arteria, presionando suavemente los lados con las pinzas finas, pasando la aguja y sutura a través de ambos lados de la arteria con un solo bocado.
NOTA: Con cualquiera de las técnicas, tenga cuidado de que la aguja y la sutura no penetren en la pared posterior dentro de la arteria, ya que esto cerrará el lumen cuando se apriete. - Cierre el sitio de inyección con un nudo de cirujano realizando una atadura de instrumentos con las pinzas finas y las pinzas de punta angulada, usando un mínimo de cuatro lanzamientos (Figura 7B). En general, utilice una sola sutura interrumpida simple para cerrar el lugar de inyección de una aguja de 33 G.
- Para restablecer la circulación con las pinzas finas, desate y retire la sutura alrededor del ECA, seguida de la sutura superior en el CCA (Figura 7C, D). A continuación, afloje lentamente la sutura inferior del CCA, pero no la desate inmediatamente. Confirme que el sitio de la inyección esté lo suficientemente cerrado para evitar una hemorragia importante con el restablecimiento de la presión arterial y el flujo (Figura 7D).
NOTA: Si se produce una hemorragia importante en el lugar de la inyección, la sutura inferior del ACC se puede volver a apretar rápidamente y el lugar de la inyección se puede ajustar o volver a suturar si es necesario. - Retire las suturas superior e inferior de la CCA (Figura 7E). Vaya al paso 2.9.
- Cierre y analgesia
- Vuelva a colocar la glándula salival en la cavidad y cierre la incisión con tres suturas interrumpidas simples utilizando un paquete de sutura estéril. Retire las restricciones de la cinta quirúrgica y permita que el ratón se recupere de la anestesia con una almohadilla térmica.
NOTA: Las dosis de seguimiento de analgésico deben administrarse de acuerdo con la frecuencia y la dosis especificadas en el protocolo IACUC aprobado por el usuario. Se recomienda una duración de curación de una semana entre inyecciones. Si se necesitan inyecciones repetidas, se puede utilizar la reparación del sitio de inyección después de la primera inyección y se puede seguir el mismo procedimiento quirúrgico para las inyecciones posteriores. La inyección subsiguiente se puede administrar en el cráneo CCA hasta el sitio de inyección reparado, ya que la sutura repetida para reparar el mismo sitio de inyección probablemente provocará cicatrices y coágulos de sangre.
- Vuelva a colocar la glándula salival en la cavidad y cierre la incisión con tres suturas interrumpidas simples utilizando un paquete de sutura estéril. Retire las restricciones de la cinta quirúrgica y permita que el ratón se recupere de la anestesia con una almohadilla térmica.
Resultados
Informes anteriores han demostrado que las células madre mesenquimales humanas derivadas de la médula ósea (BM-hMSC) administradas por inyección intracarotídea se dirigieron con éxito a los gliomas intracraneales en ratones19. Empleamos este modelo para comparar los efectos de la ligadura de CCA frente a la reparación de CCA con la circulación restaurada después de la inyección intracarotídea de BM-hMSC en ratones portadores de glioma. A los ratones desnudos atímicos se les implantaron células de glioma U87, seguidas de una inyección de BM-hMSC marcadas con GFP con ligadura posterior de CCA o reparación de CCA con circulación restaurada. Después de 3 días, se sacrificaron ratones y se recolectaron los cerebros, se fijaron y se realizó inmunohistoquímica para detectar GFP y se contaron las células GFP positivas (Figura 8A-D).
La localización general de las GFP-BM-hMSC en los gliomas intracraneales se evaluó mediante el número total de células positivas para GFP dentro del límite tumoral en dos portaobjetos diferentes (secciones separadas por >75 μm) de la misma muestra. La comparación de las medias mediante la prueba t no apareada sugirió que no hubo diferencias significativas entre la media de homing observada entre los dos procedimientos (P = 0,6858) (Figura 8E). La dispersión de GFP-BM-hMSC por todo el tumor se evaluó mediante el recuento de células GFP positivas en 10 campos de alta potencia dentro del tumor. El aumento del número de células dentro de los campos de alta potencia puede indicar cambios en la dispersión de las células en todo el tumor como resultado de la variación en el procedimiento. La comparación de los valores medianos mediante la prueba de rango con signo de Wilcoxon indicó que no hubo diferencias significativas entre los recuentos medianos de células GFP positivas en campos de alta potencia entre los grupos de ligadura de CCA y reparación de CCA (Figura 8F).

Figura 1: Preparación de la mesa quirúrgica y del ratón para la cirugía. (A,B) Cama quirúrgica (etiquetas A. Cinta vinílica que forma la cama, B. Cinta quirúrgica de sujeción de las extremidades delanteras, C. Almohada, D. Peso, E. Cono nasal de anestesia, F. Retractor de gancho romo, G. Suturas de 1 cm en etanol al 70%, H. Pinzas finas, I. Pinzas de punta inclinada, J. Tijeras estrechas, K. Bolas de algodón estériles). (C,D) Colocación del ratón. (E,F) Sitio quirúrgico y desinfección del sitio quirúrgico. Haga clic aquí para ver una versión más grande de esta figura.
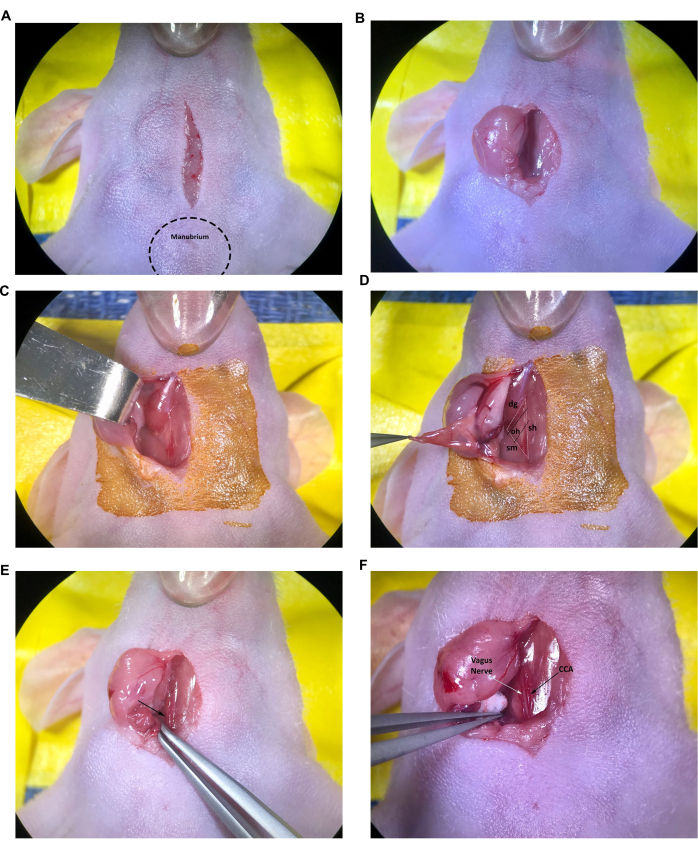
Figura 2: Incisión y exposición de estructuras en el lugar de la inyección. (A) Incisión en la línea media. (B,C) Retracción de la glándula salival derecha. (D) También es visible el triángulo muscular formado por el músculo tráquea/esternohioideo, el músculo esternocleidomastoideo y el músculo digástrico, el músculo omohioideo. (E) Arteria carótida común, indicada por la flecha. (F) Nervio vago y arteria carótida común, indicados por las flechas. Abreviaturas: sh = tráquea/músculo esternohioideo; SM = músculo esternocleidomastoideo; DG = músculo digástrico; oh = músculo omohioideo; CCA = arteria carótida común. Haga clic aquí para ver una versión más grande de esta figura.
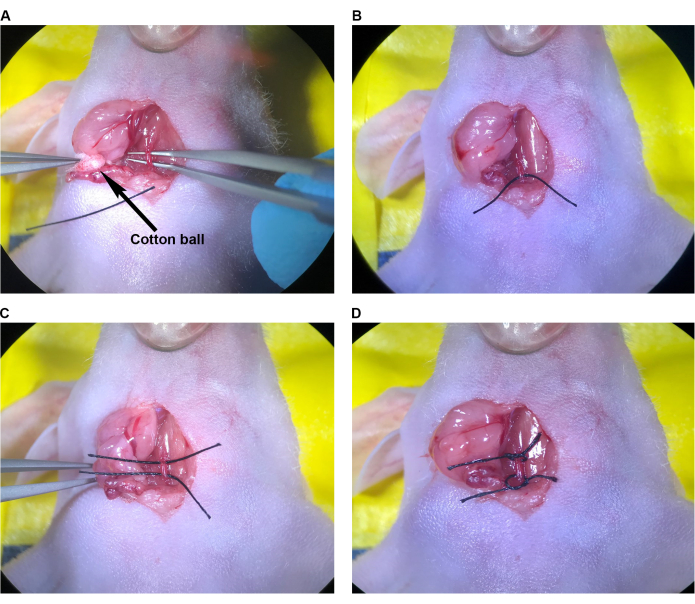
Figura 3: Preparación del ACC para la inyección. (A) Pinzas de punta en ángulo pasadas por debajo del CCA. (B) La sutura se tiró hasta la mitad por debajo del CCA usando pinzas de punta en ángulo. (C) La segunda sutura se tiró hasta la mitad debajo del CCA. (D) Suturado atado en mantas sueltas alrededor del CCA. Abreviatura: CCA = Arteria carótida común. Haga clic aquí para ver una versión más grande de esta figura.
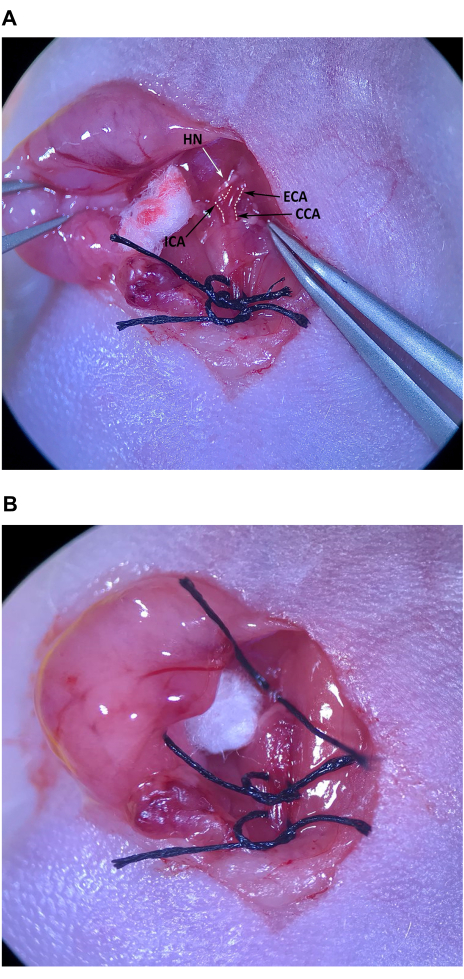
Figura 4: Aislamiento y preparación de la arteria carótida externa. (A) CCA, arteria carótida externa y arteria carótida interna. (B) Sutura tirada hasta la mitad por debajo del ECA. Abreviaturas: CCA Arteria carótida común; ECA = arteria carótida externa; ICA = arteria carótida interna. Haga clic aquí para ver una versión más grande de esta figura.
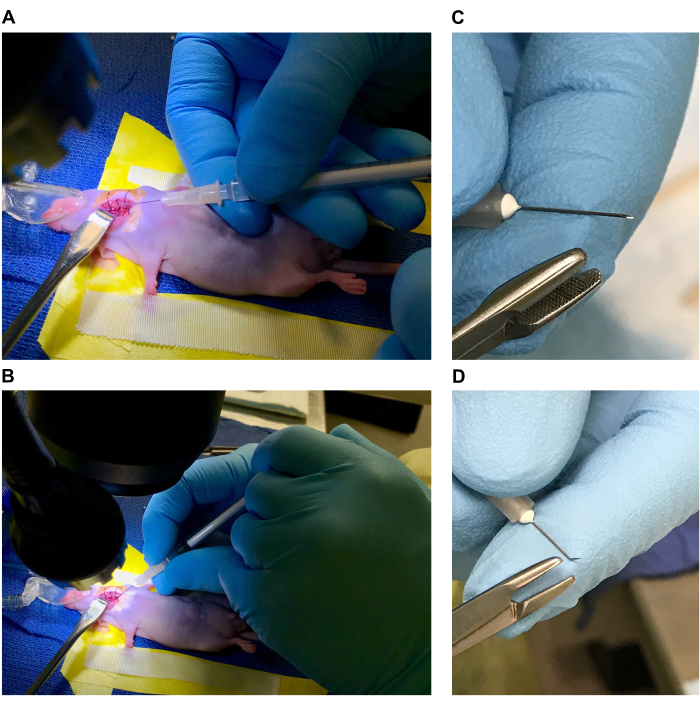
Figura 5: Preparación de la aguja y la jeringa. (A) Inyección con una aguja recta con una jeringa apoyada contra el cuerpo del ratón. (B) Inyección con una aguja doblada, con una mano apoyada en la mesa quirúrgica. (C,D) Preparación de una aguja doblada. Haga clic aquí para ver una versión más grande de esta figura.
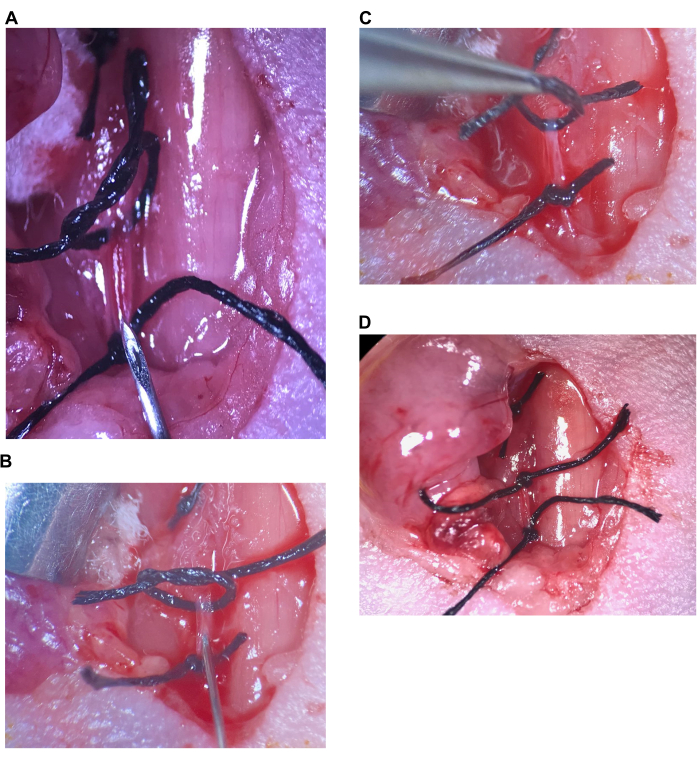
Figura 6: Inyección intracarotídea. (A) La sutura superior está floja, la sutura inferior se aprieta en el CCA, la aguja se coloca sobre la sutura inferior. (B) La aguja se inserta justo después del bisel, la arteria se sella alrededor de la aguja. (C) La sutura superior se levanta para doblar la arteria hacia arriba y evitar el reflujo. (D) Se aprieta la sutura superior del CCA. Abreviatura: CCA = Arteria carótida común. Haga clic aquí para ver una versión más grande de esta figura.
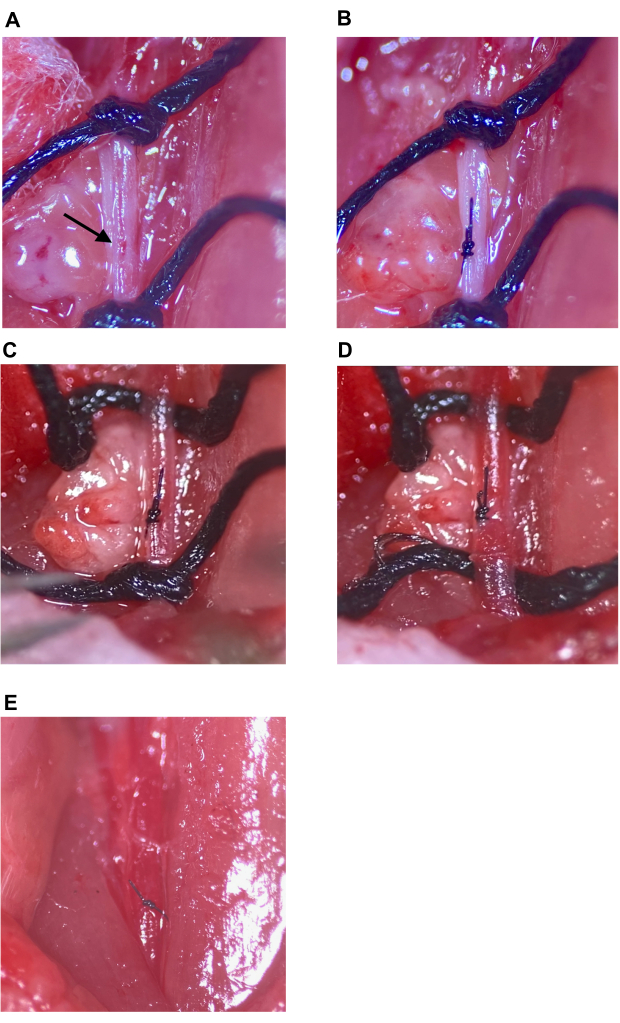
Figura 7: Reparación del lugar de inyección y restablecimiento de la circulación. (A) El sitio de inyección indicado con una flecha. (B) El sitio de inyección se cerró con un nudo de cirujano, un mínimo de cuatro lanzamientos. (C,D) Aflojamiento de las suturas superior e inferior en el CCA después de la reparación del lugar de la inyección; No se observa sangrado después del aflojamiento de la sutura. (E) Las suturas se retiran después de que se determina que el sitio de inyección está suficientemente reparado. Abreviatura: CCA = Arteria carótida común. Haga clic aquí para ver una versión más grande de esta figura.
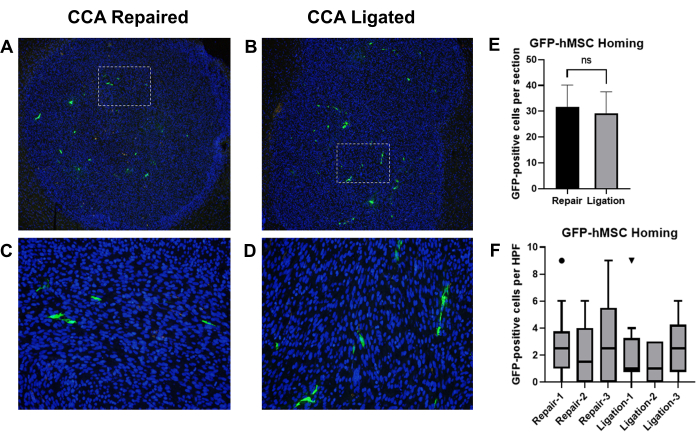
Figura 8: Inyección intracarotídea de GFP-BM-hMSC y comparación de los tumores de glioma intracraneal después de la ligadura de CCA o la reparación de CCA con circulación restaurada. Las secciones de tejido cerebral de ratones portadores de tumores se tiñeron con anticuerpos primarios anti-GFP y Alexa Fluor 488 secundarios para marcar GFP-BM-hMSC (verde). Los núcleos se tiñeron con Hoechst 33342 (azul). Campos representativos de baja potencia de secciones marcadas que muestran la localización general del tumor y campos de alta potencia que muestran la distribución de células GFP positivas después de la reparación de (A,C) CCA o la ligadura de CCA (B,D). (E) La localización general de GFP-BM-hMSC en los tumores se evaluó mediante el número total de células GFP positivas dentro del límite tumoral en dos portaobjetos diferentes y las medias se compararon mediante una prueba t. No se observaron diferencias significativas en el homing global entre los procedimientos alternativos (P = 0,6858). (F) La dispersión de GFP-BM-hMSC a través del tumor se evaluó mediante el recuento de células GFP positivas en 10 campos de alta potencia dentro del tumor. La comparación de los valores medianos mediante la prueba de rango con signo de Wilcoxon no indica diferencias significativas entre individuos, independientemente del procedimiento (P = 0,1914, 0,5000, 0,1641, 0,9512, 0,8828, 0,2207). Abreviaturas: GFP = proteína verde fluorescente; GFP-BM-hMSCs = células madre mesenquimales humanas derivadas de la médula ósea marcadas con GFP; CCA = arteria carótida común. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Las inyecciones intracarótidas en las arterias se han utilizado cada vez más en los últimos años para administrar terapias a los tumores cerebrales. En consecuencia, es importante establecer modelos de ratón que reflejen las inyecciones de arterias intracarótidas en humanos con fines de investigación. Anteriormente, las inyecciones intracarótidas en ratones se realizaban con posterior ligadura de la arteria, lo que limita el número de inyecciones en la arteria11,12. Además, la oclusión de la arteria carótida en ratones puede provocar isquemia cerebral en ciertas cepas de ratones que no tienen un Círculo de Willis13 completo. Hemos desarrollado un método para reparar la arteria carótida inyectada para superar las limitaciones de los métodos anteriores. La reparación del lugar de la inyección da como resultado el restablecimiento del flujo sanguíneo a la arteria inyectada, lo que reduce la posibilidad de isquemia cerebral y facilita las inyecciones posteriores en la misma arteria carótida interna.
Varios pasos, que son críticos para el éxito, requieren un manejo cuidadoso de los instrumentos quirúrgicos o el tejido, que incluyen: inserción de la aguja correctamente en la luz de la arteria para evitar el sangrado durante la inyección intracarotídea; disección cuidadosa del tejido conectivo del lugar de la inyección antes de la inserción de la aguja; eliminación de todos los grumos y burbujas de aire en la jeringa y la aguja antes de la inyección; y el cierre correcto del lugar de inyección para evitar el cierre de la luz de la arteria durante la reparación. Para evitar el sangrado después de insertar la aguja, asegúrese de que la aguja se inserte en la arteria más allá del bisel para formar un sello alrededor del eje de la aguja. Para evitar un desgarro en la pared posterior de la arteria, inserte la aguja en un ángulo poco profundo y balancee sutilmente la jeringa y la aguja hacia atrás para mantener la punta de la aguja alejada de la pared posterior arterial. Si la solución inyectada se filtra durante la inyección, esto sugiere que la aguja solo se insertó en el tejido conectivo que rodea la arteria; La disección cuidadosa del exceso de tejido conectivo del sitio de la inyección antes de la inyección evitará este problema.
En cuanto a la elección de la técnica de sutura y cierre, si en la inyección inicial se utilizó una aguja de 33 G y se realizó una inserción limpia en la arteria, una sutura simple con sutura 9-0 es suficiente para reparar la arteria. Si se utiliza una aguja más grande para la inyección (30 G, etc.) o se produce algún desgarro al insertar la aguja (por ejemplo, cuando la aguja está descentrada o la arteria se mueve porque el ratón está respirando), esto da como resultado un orificio ligeramente más grande que debe repararse. Dos suturas simples o una figura de ocho suelen ser suficientes para reparar este tipo de agujero más grande. La elección entre estas dos técnicas se basa en la preferencia del cirujano en esta situación. Es importante tener en cuenta que la técnica de reparación no se ha evaluado en situaciones en las que el orificio del lugar de inyección es significativamente más grande que en la situación mencionada anteriormente. Si el desgarro en el lugar de la inyección se extiende lateralmente (formando un orificio más ancho, mayor que un tercio de la circunferencia de la arteria), la reparación con este método puede causar la contracción de la arteria y un mayor riesgo de trombosis.
Si hay sangrado en el sitio de inyección reparado a medida que se retiran las suturas, puede deberse al estiramiento del sitio reparado a medida que se reanuda la circulación normal; Esto puede rectificarse cubriendo suavemente el lugar de inyección reparado con algodón estéril y aplicando una ligera presión durante 30 s. Alternativamente, si hay sangrado en el sitio de inyección reparado sin flujo sanguíneo visible y una arteria proximal distendida, indica que la aguja de sutura pasó a través de la pared posterior de la arteria durante la reparación. En este caso, abra suavemente los bordes del lugar de inyección durante la reparación, pase la aguja de sutura a través de la arteria en un ángulo poco profundo y confirme visualmente que la sutura no ha pasado a través de la pared posterior antes de atar el nudo de sutura.
Con estas medidas, el método de reparación del lugar de inyección es preciso y repetible en cohortes de animales, independientemente de su origen genético o edad. En nuestra experiencia, la tasa de éxito ha sido del 100% con tres cirujanos diferentes realizando el procedimiento. Con la experiencia adecuada y siguiendo cuidadosamente el protocolo proporcionado, no prevemos ninguna dificultad para que otros cirujanos realicen este procedimiento. Con práctica, un cirujano experto puede completar el procedimiento en 15-20 minutos. Si el experimento lo permite, también se puede reducir el tiempo por animal dejando intactas las suturas superior e inferior del CCA, renunciando a la reparación del lugar de la inyección. Sin embargo, como se señaló anteriormente, se han documentado diferencias específicas de la cepa en la anatomía vascular cerebral y es importante verificar que la cepa del ratón utilizada en el procedimiento pueda tolerar esto antes de comenzar el experimento.
Al tratarse de un procedimiento quirúrgico, hay que tener en cuenta la recuperación de los ratones. La tolerancia al estrés y la recuperación de la herida son consideraciones importantes que variarán con las diferentes cepas de ratones. Además, la inflamación en el sitio quirúrgico y la formación de tejido cicatricial pueden aumentar el tiempo de recuperación después de cirugías repetidas. Hemos realizado con éxito múltiples inyecciones con 7 días de diferencia, pero si son necesarias inyecciones más frecuentes, deben evaluarse cuidadosamente en las cepas específicas de ratón que se van a utilizar. El manejo enérgico y la tensión en el CCA (durante el aislamiento, el atado y la extracción de suturas y la inyección) pueden dañar y debilitar las paredes arteriales, lo que provoca desgarros durante las inyecciones repetidas. Es importante minimizar la disección del tejido conectivo de soporte alrededor de la CCA y la bifurcación y abstenerse de aplicar una tensión excesiva a la arteria.
Nuestros resultados sugieren que, en este modelo en particular, la ligadura o reparación de CCA con circulación restaurada después de la inyección no difiere en la frecuencia general de localización o distribución de BM-hMSC inyectadas a través de los tumores intracraneales. Si bien esto puede variar en diferentes cepas de ratones, el uso de la reparación en el lugar de la inyección ofrece la ventaja de devolver el flujo sanguíneo a la arteria inyectada, lo que permite inyecciones posteriores en la misma arteria y, lo que es más importante, se asemeja a las inyecciones intracarótidas en pacientes humanos. La elección de ligar frente a reparar la arteria inyectada se basa en el tipo de experimento y en el modelo de ratón que se utilice. Si se necesita una segunda inyección, o si el modelo de ratón no tiene un Círculo de Willis completo, se debe utilizar la reparación del sitio de inyección. La capacidad de reinyectar el CCA en modelos de ratón puede facilitar la manipulación experimental adicional. Por ejemplo, para probar múltiples dosis de un posible tratamiento administrado a lo largo del tiempo, la reparación de la arteria inyectada es esencial para realizar inyecciones posteriores. Este método también sería útil en experimentos que impliquen la inyección de combinaciones de agentes terapéuticos que deben inyectarse en diferentes momentos. El aumento de la flexibilidad en las inyecciones intracarotídeas que ofrece la reparación de la arteria inyectada mejora la utilidad traslacional de los modelos de tumores cerebrales de ratón.
Divulgaciones
Los autores no tienen divulgaciones ni conflictos de intereses relevantes.
Agradecimientos
Este estudio fue financiado por subvenciones del Instituto Nacional del Cáncer (R01CA115729, R01CA214749 y 1P50 CA127001) y por las generosas contribuciones filantrópicas al Programa™ Moon Shots del Centro Oncológico MD Anderson de la Universidad de Texas, la Fundación Broach para la Investigación del Cáncer Cerebral, el Fondo de la Familia Elias para la Investigación de Tumores Cerebrales, el Fondo de Investigación del Cáncer Priscilla Hiley, el Fondo de Investigación del Cáncer Cerebral Curefest de la Familia Bauman, Chuanwei Lu Fund, The Sweet Family Brain Cancer Research Fund, The Ira Schneider Memorial Cancer Research Foundation, The Jim & Pam Harris Fund, The Gene Pennebaker Fund for Brain Cancer Research, Sorenson Fund for Brain Tumor Research, Brian McCulloch Memorial Fund, TLC Foundation from the Heart y Mary Harris Pappas Endowed Fund for Glioblastoma Research, todos a F.F.L.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL syringes (low dead space) | Air-tite Products Co. | A1 | |
| 26 G; 1/2" needle | Air-tite Products Co. | N2612 | |
| 33 G; 1/2" needle | JBP, Air-tite Products Co. | JBP3313B | |
| 3 cm Petri dish | Falcon, Fisher Scientific | 08-772A | |
| 3M durapore surgical tape | Fisher Scientific | 19-071-152 | |
| 6-0 suture thread | Fine Science Tools | 18020-60 | |
| 70% Ethanol | Fisher Scientific | 04-355-122 | |
| 9-0 microsurgical suture with needle | Fine Science Tools | 12052-09 | |
| Analgesic for major surgery | |||
| Artificial tears/ophthalmic ointment | Covetrus | 8897 | |
| Bead Sterilizer | Fisher Scientific | 14-955-341 | |
| Betadine/Chlorhexidine | McKesson, Fisher Scientific | NC1696484 | |
| Blunt hook retractor | Fine Science Tools | 17022-13 | |
| Dissecting microscope | Zeiss Microscopy, LLC | 491903-0010-000 | |
| Electric heating pad | Insource, Fisher Scientific | NC0667724 | |
| Extra narrow scissors | Fine Science Tools | 14088-10 | |
| Fine forceps - Dumont #5 forceps with micro-blunted tips | Fine Science Tools | 11253-20 | |
| Fine forceps - Dumont #5/45 angled tip forceps with micro-blunted tips | Fine Science Tools | 11253-25 | |
| Isoflurane vaporizer (or Ketamine/Xylazine cocktail) | Kent Scientific | VetFlo-1231 | |
| Light source | Laxco, Fisher Scientific | AMPSILED21 | |
| Mouse anesthesia nose cone | Braintree Scientific, Inc | XENO- M | |
| Needle driver | Fine Science Tools | 12002-12 | |
| Sterile cotton swabs | Texwipe, Fisher Scientific | 18-366-472 | |
| Sterile gauze pads | Covidien, Fisher Scientific | 22-037-907 | |
| Sterile saline (0.9%) | KD Medical, Fisher Scientific | 50-103-1363 | |
| Sterile surgical drapes | Fisher Scientific | 50-129-6666 | |
| Sterile surgical/downdraft table | |||
| Sterile suture pack (any suitable diameter for mouse wound closure) | Ethicon, Fisher Scientific | 50-209-2811 | |
| Surgical tools | |||
| Vinyl lab tape | Fisher Scientific | 15-901 |
Referencias
- Loya, J., Zhang, C., Cox, E., Achrol, A. S., Kesari, S. Biological intratumoral therapy for the high-grade glioma part i: Intratumoral delivery and immunotoxins. CNS Oncol. 8 (3), (2019).
- Garfield, J., Dayan, A. D. Postoperative intracavitary chemotherapy of malignant gliomas. A preliminary study using methotrexate. J Neurosurg. 39 (3), 315-322 (1973).
- Kroin, J. S., Penn, R. D. Intracerebral chemotherapy: Chronic microinfusion of cisplatin. Neurosurgery. 10 (3), 349-354 (1982).
- Sendelbeck, S. L., Urquhart, J. Spatial distribution of dopamine, methotrexate and antipyrine during continuous intracerebral microperfusion. Brain Res. 328 (2), 251-258 (1985).
- Alter, R. A., et al. Long-term benefit of intra-arterial bevacizumab for recurrent glioblastoma. J Exp Ther Oncol. 12 (1), 67-71 (2017).
- Angelov, L., et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary cns lymphoma: A multi-institutional experience. J Clin Oncol. 27 (21), 3503-3509 (2009).
- Chen, S. R., Chen, M. M., Ene, C., Lang, F. F., Kan, P. Perfusion-guided endovascular super-selective intra-arterial infusion for treatment of malignant brain tumors. J Neurointerv Surg. 14 (6), 533-538 (2022).
- Faltings, L., et al. Rechallenging recurrent glioblastoma with intra-arterial bevacizumab with blood brain-barrier disruption results in radiographic response. World Neurosurg. 131, 234-241 (2019).
- Srinivasan, V. M., et al. Advances in endovascular neuro-oncology: Endovascular selective intra-arterial (esia) infusion of targeted biologic therapy for brain tumors. J Neurointerv Surg. 12 (2), 197-203 (2020).
- Shinojima, N., et al. Tgf-β mediates homing of bone marrow-derived human mesenchymal stem cells to glioma stem cells. Cancer Res. 73 (7), 2333-2344 (2013).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of visualized experiments : JoVE. (120), e55085 (2017).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Benbenishty, A., et al. Maintaining unperturbed cerebral blood flow is key in the study of brain metastasis and its interactions with stress and inflammatory responses. Brain, behavior, and immunity. 62, 265-276 (2017).
- Doucette, T., et al. Mesenchymal stem cells display tumor-specific tropism in an rcas/ntv-a glioma model. Neoplasia. 13 (8), 716-725 (2011).
- Hata, N., et al. Platelet-derived growth factor bb mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 66 (1), 144-156 (2010).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 65 (8), 3307-3318 (2005).
- Qiao, Y., et al. Magnetic resonance and photoacoustic imaging of brain tumor mediated by mesenchymal stem cell labeled with multifunctional nanoparticle introduced via carotid artery injection. Nanotechnology. 29 (16), 165101 (2018).
- Yong, R. L., et al. Human bone marrow-derived mesenchymal stem cells for intravascular delivery of oncolytic adenovirus delta24-rgd to human gliomas. Cancer Res. 69 (23), 8932-8940 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados