Method Article
Facilitation des injections intracarotidiennes répétées dans des modèles murins par une nouvelle technique de réparation du site d’injection
Dans cet article
Résumé
La réparation de l’artère intracarotide dans un modèle murin après injection ramène le flux sanguin vers l’artère sans affecter négativement la distribution du matériau injecté. La réparation du site d’injection facilite les injections ultérieures par la même artère et prévient l’ischémie cérébrale chez les souches de souris qui n’ont pas un cercle complet de Willis.
Résumé
Compte tenu des progrès récents dans l’administration de nouvelles thérapies antitumorales à l’aide de méthodes d’administration intraartérielle sélectives endovasculaires en neuro-oncologie, il est urgent de développer des méthodes d’injections intracarotidiennes dans des modèles murins, y compris des méthodes pour réparer l’artère carotide chez les souris après l’injection afin de permettre des injections ultérieures. Nous avons développé une méthode d’injection intracarotidienne dans un modèle murin pour administrer des traitements dans l’artère carotide interne (ICA) avec deux procédures alternatives.
Lors de l’injection, l’aiguille est insérée dans l’artère carotide commune (ACC) après avoir attaché une suture autour de l’artère carotide externe (ECA) et les traitements injectés sont administrés dans l’ICA. Après l’injection, l’artère carotide commune (ACC) peut être ligaturée, ce qui limite le nombre d’injections intracarotidiennes à une. La procédure alternative décrite dans cet article comprend une modification où l’injection intracarotidienne est suivie d’une réparation du site d’injection de l’ACC, ce qui rétablit le flux sanguin à l’intérieur de l’ACC et évite la complication de l’ischémie cérébrale observée dans certains modèles murins.
Nous avons également comparé l’administration de cellules souches mésenchymateuses humaines dérivées de la moelle osseuse (BM-hMSC) aux tumeurs intracrâniennes lorsqu’elles sont administrées par injection intracarotidienne avec et sans réparation du site d’injection après l’injection. L’administration des BM-hMSC ne diffère pas significativement entre les méthodes. Nos résultats démontrent que la réparation du CCA au site d’injection permet des injections répétées à travers la même artère et n’entrave pas l’administration et la distribution du matériel injecté, fournissant ainsi un modèle avec une plus grande flexibilité qui imite plus étroitement l’injection intracarotidienne chez l’homme.
Introduction
L’administration de traitements aux tumeurs cérébrales est difficile en raison de l’imperméabilité de la barrière hémato-encéphalique (BHE) et de la barrière hémato-tumorale (BTB). L’injection intratumorale directe de produits thérapeutiques pour contourner la BHE peut être réalisée par l’utilisation d’un cathéter réservoir Ommaya, d’une microperfusion à faible débit pour une administration assistée par convection ou d’une injection locale dans la cavité de résection ou les tissus adjacents1. Cependant, le volume total de tissu tumoral atteint avec ces méthodes est limité 2,3,4. Les injections intraartérielles ont déjà été utilisées pour administrer des agents thérapeutiques aux tumeurs cérébrales dans le but d’atteindre une plus grande partie de la tumeur 5,6,7,8 et ces derniers temps, les progrès des techniques d’administration intraartérielle et des nouveaux agents thérapeutiques ont démontré l’avantage de l’utilisation de cette approche dans le traitement des tumeurs cérébrales7, 9. Planche à billets Ces avancées comprennent la mise au point de microcathéters, l’administration intra-artérielle sélective endovasculaire (EIES) avec imagerie avancée, l’utilisation d’agents osmotiques pour perturber la BHE et la BTB, et la mise au point de thérapies biologiques ciblées. Par conséquent, pour mener des essais précliniques de nouveaux agents thérapeutiques administrés par injections intraartérielles, des modèles de recherche translationnelle appropriés sont nécessaires 9,10.
Dans des modèles murins de tumeurs cérébrales, les agents thérapeutiques administrés par voie intrapéritonéale ou intraveineuse (par la veine de la queue) passent par le foie ou le cœur et les poumons, respectivement, avant d’être distribués à l’ensemble du corps, y compris le cerveau. Ces effets de premier passage peuvent piéger et éliminer l’agent, ou diluer l’agent avant d’atteindre le cerveau, et peuvent présenter des toxicités limitant la dose avant d’atteindre une dose thérapeutique dans le cerveau. En revanche, l’injection dans l’artère intracarotide permet une administration ciblée vers le cerveau avant la circulation en contournant le métabolisme de premier passage et en limitant l’administration hors cible. Bien que l’injection intracarotidienne chez la souris demande plus de main-d’œuvre, la spécificité et la reproductibilité de la technique entraînent une réduction du nombre d’animaux nécessaires pour terminer les investigations11,12.
En général, dans les méthodes d’injection de l’artère intracarotide décrites précédemment chez la souris, l’artère carotide commune est ligaturée après l’injection et la circulation vers le cerveau est assurée par l’artère carotide controlatérale et la circulation cérébrale postérieure via le cercle de Willis11,12. Cette méthode a la limitation inhérente de ne permettre qu’un maximum d’une seule injection dans l’artère carotide interne ou externe. Il est également essentiel que les souches de souris utilisées dans les expériences où l’artère carotide est ligaturée aient un cercle complet de Willis pour prévenir l’ischémie cérébrale due à l’artère ligaturée13. Il a également été démontré que l’occlusion de l’artère carotide réduit le flux sanguin cérébral et limite la distribution des particules injectées14. De plus, l’occlusion de l’artère carotide chez la souris après l’injection n’imite pas l’injection de l’artère intracarotide chez les patients humains.
Notre groupe a déjà utilisé des injections intracarotides dans l’artère pour délivrer avec succès des cellules souches mésenchymateuses au cerveau 10,15,16,17,18,19. Dans cet article, nous décrivons en détail cette méthode d’injection de l’artère intracarotide et incluons une modification de la méthode que nous avons développée, dans laquelle le site d’injection est réparé sans obstruer l’artère, évitant ainsi les limitations posées par la ligature de l’artère carotide post-injection. Dans cette méthode, l’artère carotide commune (ACC) est préparée pour l’injection en plaçant deux sutures, une à chaque extrémité du site d’injection prévu, et la suture inférieure (sous le site d’injection) est resserrée. L’artère carotide externe (ECA) est scellée à l’aide d’une autre suture. L’aiguille est insérée dans l’ACC et les produits thérapeutiques sont administrés dans l’artère carotide interne (ICA). Ensuite, la suture supérieure de l’ACC est resserrée pour éviter le reflux de l’ICA. À cette étape, le CCA injecté peut être soit ligaturé, soit réparé. Si l’ACC doit être ligaturé, les sutures sont resserrées et laissées en place. Si le site d’injection est réparé, les sutures sont retirées après la réparation et la circulation sanguine est rétablie. Les détails de ces procédures alternatives sont fournis ci-dessous.
Protocole
Toutes les étapes décrites ci-dessous sont conformes à notre protocole, qui suit les directives établies et approuvées par le comité institutionnel de soin et d’utilisation des animaux du MD Anderson Cancer Center de l’Université du Texas.
1. Préparation de la table chirurgicale et de la souris pour l’intervention chirurgicale
- Préparation de la table chirurgicale et de la souris pour l’intervention chirurgicale (voir Figure 1A,B)
- Placez le microscope de dissection et la source lumineuse devant le vaporisateur d’isoflurane à l’aide d’un système de balayage actif ou placez-le sur une table à aspiration descendante. Placez le coussin chauffant électrique sur la base du microscope de dissection (ou de préférence sous le microscope si la base est solide et peut transmettre de la chaleur) et recouvrez d’un champ chirurgical stérile.
REMARQUE : Tous les outils chirurgicaux et les champs doivent être stérilisés à l’autoclave avant utilisation et tous les jetables doivent être stériles et emballés individuellement. Des gants stériles doivent être utilisés tout au long de la configuration et de la procédure et changés si nécessaire pour maintenir la stérilité. - Préparez le lit (4-5 » de long x 2 » de large) sur le champ chirurgical à l’aide de ruban de laboratoire en vinyle. Coupez un carré de gaze de 1,5 pouces x 1,5 pouce, roulez-le fermement et placez la gaze roulée sous un morceau de ruban adhésif en vinyle de 3 pouces à la « tête » du lit pour former un oreiller (l’inclinaison de la tête avec l’utilisation d’un oreiller permet une plus grande extension de la zone ventrale du cou).
- Posez des morceaux de ruban chirurgical de 4 pouces sur les côtés du lit (sur le ruban de vinyle). [Si vous utilisez de l’isoflurane, placez un cône de nez d’anesthésie avec un poids (ou du ruban adhésif) attaché près de la tête du lit. Ajustez-le pour un placement spécifique une fois que la souris est anesthésiée et retenue.] Voir Figure 1A,B.
- À l’aide d’un tourne-aiguille ou d’une pince lourde, déchirez de petits morceaux de coton d’un coton-tige et roulez-les en boules de différentes tailles de 0,5 à 1 mm de diamètre (8 à 10 morceaux de coton par souris). Gardez le coton sur le champ chirurgical près de la tête du lit.
- À l’aide d’instruments stériles, coupez le fil de suture 6-0 en morceaux de 1 cm (3-4 morceaux par souris). Placez les longueurs de suture préparées sur un champ stérile. Préparez une seringue de 1 mL pour l’administration de buprénorphine ou d’un autre analgésique approprié (tel qu’approuvé par le protocole de l’Institutional Animal Care and Use Committee [IACUC]). Stérilisez tous les outils chirurgicaux conformément aux normes IACUC avant de placer les outils dans le champ stérile.
- Placez le microscope de dissection et la source lumineuse devant le vaporisateur d’isoflurane à l’aide d’un système de balayage actif ou placez-le sur une table à aspiration descendante. Placez le coussin chauffant électrique sur la base du microscope de dissection (ou de préférence sous le microscope si la base est solide et peut transmettre de la chaleur) et recouvrez d’un champ chirurgical stérile.
- Préparation de la souris à l’intervention chirurgicale (voir figure 1C-F)
- Anesthésie une souris selon les méthodes approuvées par l’IACUC pour les chirurgies de survie majeures (utiliser soit de l’isoflurane à 1 % à 4 %, en fonction de la sensibilité de chaque souris, soit un cocktail de 10 mg/mL de kétamine, 1 mg/mL de xylazine à 100-200 mg/kg (kétamine) de poids corporel). Coupez la fourrure ou épilez-la si nécessaire. Administrer 0,5 à 1,0 mg/kg de buprénorphine ER (à libération prolongée) par injection sous-cutanée 30 minutes avant le début de l’intervention chirurgicale.
- Positionnez la souris anesthésiée de manière à ce que l’oreiller repose sous le cou (Figure 1C). L’oreiller aide à étendre et à soutenir le cou lorsqu’il est utilisé avec le cône nasal d’anesthésie. Si vous utilisez le cocktail kétamine/xylazine, placez une barre dentaire lestée ou un outil similaire dans la bouche, derrière les incisives pour incliner la tête et étendre le cou.
- Retenir les membres antérieurs à l’aide du ruban chirurgical préalablement placé sur les côtés du lit chirurgical (Figure 1D). Ajustez la position de la souris sous le microscope de manière à ce que la surface ventrale du cou soit visible et ajustez le grossissement pour observer confortablement le site chirurgical (Figure 1E).
REMARQUE : Le grossissement du microscope de dissection doit être ajusté par le chirurgien à son niveau de confort pour chaque étape. - Appliquez des larmes artificielles à l’aide d’un coton-tige stérile. Désinfectez le site chirurgical en alternant trois fois par désinfectant des écouvillons circulaires de bétadine ou de chlorhexidine et d’alcool (figure 1F).
- Confirmez la profondeur de l’anesthésie en vous assurant que la souris ne rétracte pas sa patte en réponse à un pincement de l’orteil. Surveillez la fréquence respiratoire et assurez-vous que la souris ne halète pas, car cela indique une anesthésie excessive lors de l’utilisation de l’isoflurane. Si nécessaire, ajustez les débits d’oxygène et d’isoflurane pour atteindre la profondeur d’anesthésie appropriée et une respiration uniforme.
2. Intervention chirurgicale (figure 2, figure 3, figure 4, figure 5, figure 6 et figure 7)
- Incision primaire et dissection
- Commencez par faire une incision longitudinale de 1 cm sur la ligne médiane, en commençant juste par le crâne jusqu’au manubrium (masse saillante à l’extrémité crânienne du sternum) et en continuant sur la trachée à l’aide d’une lame de scalpel stérile ou d’un instrument similaire en suivant les directives approuvées par l’utilisateur (Figure 2A).
- Insérez la pointe des ciseaux fermés dans l’incision et ouvrez-la doucement pour effectuer une dissection contondante du tissu conjonctif sous-cutané, séparant les deux glandes salivaires. À l’aide de la pince fine, tirez doucement la glande salivaire droite à travers l’incision pour qu’elle repose sur la surface de la peau préparée de manière aseptique ou rétractez la glande salivaire latéralement à l’aide de l’écarteur à crochet émoussé (figures 2B et C). Si la glande extériorisée semble sèche ou collante, humidifiez avec une solution saline stérile.
- Poursuivez la dissection brutale du tissu conjonctif jusqu’à ce que les muscles sterno-cléido-mastoïdien et digastriques soient visibles (Figure 2D).
REMARQUE : Le triangle musculaire formé par le muscle trachée/sterno-hyoïdien (sh), le muscle sterno-cléido-mastoïdien (sm) et le muscle digastrique (dg) (ventre caudal) sera utilisé pour localiser l’ACC droit et la bifurcation de l’artère carotide dans le protocole. En général, le plus petit muscle omohyoïdien (oh) peut également être vu couché transversalement sur le CCA (Figure 2D) ; Cependant, la taille de ce muscle varie et il n’est pas rare que le muscle omohyoïdien soit complètement absent chez les souris jeunes ou petites.
- Isolement de l’ACC
- À l’aide de la pince à pointe inclinée, continuez à dissectionner soigneusement le tissu conjonctif (en ouvrant les pointes de la pince) près de l’extrémité caudale du triangle musculaire pour exposer l’artère carotide commune, la veine jugulaire et le nerf vague.
REMARQUE : L’artère carotide commune est le plus gros vaisseau sanguin adjacent à la trachée et peut généralement être facilement identifiée à la base du triangle musculaire (figure 2E, flèche). Soyez extrêmement prudent avec les pinces fines autour des vaisseaux sanguins, car les pointes peuvent facilement entailler les vaisseaux, entraînant des saignements excessifs et potentiellement mortels. - Continuez à dissection soigneuse du tissu conjonctif autour de la partie de l’artère carotide commune de la base du triangle musculaire jusqu’au muscle omohyoïde. Utilisez les petites boules de coton stériles pour contrôler tout saignement mineur et absorbez les fluides sécrétés par les glandes salivaires au besoin.
- Disséquez soigneusement le tissu conjonctif pour séparer l’ACC du nerf vague. Prenez des précautions particulières pour minimiser la manipulation et les dommages au nerf vague, facilement identifiable comme étant le faisceau nerveux épais et blanc adjacent à l’ACC (figure 2F).
- À l’aide de la pince à pointe inclinée, continuez à dissectionner soigneusement le tissu conjonctif (en ouvrant les pointes de la pince) près de l’extrémité caudale du triangle musculaire pour exposer l’artère carotide commune, la veine jugulaire et le nerf vague.
- Préparation de l’ACC
- Une fois que l’ACC a été complètement mobilisé à partir du muscle sterno-cléido-mastoïdien, et là où il est visible, jusqu’au muscle omohyoïde, placez un morceau de suture 6-0 de 1 cm sur la peau préparée de manière aseptique du sternum de la souris (pour une récupération facile) et passez la pince à pointe inclinée sous l’ACC (en prenant soin d’isoler l’ACC du nerf vague et de la veine jugulaire) (Figure 3A). Si le muscle omohyoïdien n’est pas présent, dégagez suffisamment la zone autour de l’ACC pour pouvoir placer des sutures sur l’ACC, crânien et caudal jusqu’au site d’injection proposé, et pour insérer l’aiguille.
- Avec la pince fine dans la main gauche, passez la suture à la pince à pointe coudée, en saisissant près de l’extrémité de la suture. Tirez doucement sur la moitié de la longueur de la suture sous l’ACC à l’aide de la pince à pointe coudée (figure 3B).
- Répétez ce processus avec une deuxième suture, parallèle à la première suture (Figure 3C).
- Attachez sans serrer chaque suture autour de l’ACC, mais ne resserrez pas les nœuds et ne limitez pas la circulation sanguine (figure 3D).
- Isolement et préparation de l’artère carotide externe
- À l’aide de la pince à pointe inclinée, retirez soigneusement le tissu conjonctif à l’extrémité crânienne du triangle musculaire, du crâne au muscle omohyoïde, pour localiser l’ACC et la bifurcation en ECA et ICA (Figure 4A).
REMARQUE : L’ECA s’incline vers la ligne médiane et est légèrement plus superficielle, tandis que l’ICA s’incline latéralement et se déplace plus profondément dans le cou. Prenez des précautions particulières pour éviter d’endommager le nerf hypoglosse (HN) qui traverse l’ICA juste au-dessus de la bifurcation. - Enlevez soigneusement le tissu conjonctif de tous les côtés de l’ECA près de la bifurcation. Une fois qu’une quantité suffisante de tissu conjonctif a été dégagée de l’ECA, placez un morceau de suture sur la peau préparée de manière aseptique sur le sternum de la souris et passez la pince à pointe inclinée sous l’ECA. Avec la pince fine dans la main gauche, passez la suture dans la pince à pointe coudée dans l’espace entre l’ICA et l’ECA et tirez doucement la moitié de la longueur de la suture à travers (Figure 4B). Attachez sans serrer la suture autour de l’ECA, mais ne serrez pas le nœud.
REMARQUE : Il est important qu’une quantité suffisante de tissu conjonctif soit dégagée de l’ECA pour que vous puissiez saisir la suture avec la pince à pointe inclinée sans saisir par inadvertance le tissu conjonctif entourant les artères, causant des dommages aux artères lorsque la suture est récupérée.
- À l’aide de la pince à pointe inclinée, retirez soigneusement le tissu conjonctif à l’extrémité crânienne du triangle musculaire, du crâne au muscle omohyoïde, pour localiser l’ACC et la bifurcation en ECA et ICA (Figure 4A).
- Préparation à l’aiguille et à la seringue
REMARQUE : Pour cette étape, l’injection peut être effectuée à l’aide d’une aiguille droite, ce qui permet à la seringue de reposer contre le corps de la souris et d’être stabilisée par celui-ci (Figure 5A). Alternativement, l’injection peut être réalisée à l’aide d’une aiguille pliée près de l’extrémité, ce qui permet de tenir la seringue comme un crayon avec la main posée sur la table d’opération (Figure 5B). Les deux techniques fonctionnent bien et le choix de la technique est une préférence personnelle.- Pour préparer l’aiguille pliée, tenez une aiguille de 33 G de 1/2 pouce avec le biseau vers le haut et saisissez l’extrémité avec un tourne-aiguille stérile (Figure 5C). Pliez l’aiguille d’environ 30 à 40° directement vers le biseau (Figure 5D).
- Remplissez la seringue avec le volume approprié de la solution à injecter (assurez-vous de tenir compte de l’espace de la cavité de l’aiguille si la solution injectable n’est pas aspirée à travers l’aiguille pour charger la seringue). Fixez l’aiguille et retirez toutes les bulles d’air. Assurez-vous que le ménisque de la solution est visible au biseau de l’aiguille.
- Injection intracarotidienne
- Serrez le nœud de la suture autour de l’ECA. Ensuite, faites glisser la suture inférieure de l’ACC vers le muscle sterno-cléido-mastoïdien aussi loin que possible et serrez le nœud. Assurez-vous que la suture supérieure de l’ACC reste lâche jusqu’après l’injection. Placez une boule de coton stérile dans le bord de la cavité pour absorber le liquide et le sang sécrétés pendant l’injection.
- En tenant la seringue dans la main droite et la pince fine dans la main gauche, amenez l’aiguille vers l’artère immédiatement au-dessus de la suture inférieure sur l’ACC. À l’aide de la pince fine, tirez doucement l’extrémité libre de la suture inférieure dans le sens caudal pour placer un faible niveau de tension sur l’ACC (Figure 6A).
- Insérez l’aiguille dans le CCA juste après le biseau et relâchez lentement la tension de la suture (Figure 6B).
REMARQUE : L’artère a un flux sanguin important et saignera probablement dans la cavité chirurgicale lorsque l’aiguille est insérée. Cependant, une fois que l’aiguille est insérée au-delà du biseau, l’artère formera un joint autour de l’aiguille et le saignement s’arrêtera. Un saignement continu avec l’aiguille en place indique que l’aiguille n’est pas assez loin dans l’artère (l’espace du biseau permet au sang de circuler) ou que l’aiguille a été poussée à l’arrière de l’artère. Il est maintenant important de tenir l’aiguille extrêmement immobile pour éviter de déchirer l’artère ou de permettre à l’aiguille de glisser. Surveiller en permanence les animaux présentant des épisodes d’hémorragie, et si les saignements sont importants (par exemple, lorsqu’un animal perd sa coloration, semble cyanosique, devient froid au toucher ou tout autre paramètre sans cruauté décrit dans le protocole d’utilisation des animaux), il est nécessaire d’appliquer des paramètres sans cruauté. - Utilisez la main gauche pour pousser le piston de la seringue afin d’injecter la solution très lentement (Figure 5B, pas moins de 15 secondes pour injecter 100 μL de solution). Ne retirez pas l’aiguille une fois l’injection de la solution terminée. Pour éviter le reflux, à l’aide de la pince fine dans la main gauche, saisissez la suture supérieure sur l’ACC (encore lâchement attachée) par le nœud et soulevez-la pour plier l’artère (Figure 6C).
- Retirez l’aiguille, mettez la seringue de côté et prenez la pince à pointe coudée avec la main droite. En gardant le pli dans l’artère, resserrez le nœud dans la suture supérieure sur l’ACC (Figure 6D).
REMARQUE : À ce stade, il ne devrait pas y avoir de saignement supplémentaire dans la cavité chirurgicale. À la suite de cette étape, il existe deux procédures alternatives, comme décrit aux étapes 2.7 et 2.8 ci-dessous. Si l’ACC doit être ligaturé, suivez l’étape 2.7. Si l’ACC doit être réparé au point d’injection, suivez les modifications indiquées à l’étape 2.8.
- Ligature de l’ACC
- Dans les cas qui ne nécessitent pas que la circulation soit rétablie dans l’ACC, laissez l’artère ligaturée, en laissant les deux sutures serrées sur l’ACC. Coupez les extrémités de la suture et vérifiez que les nœuds de suture sont bien serrés.
- Procéder aux procédures de fermeture et d’analgésie décrites à l’étape 2.9.
- Alternative à la ligature de l’ACC-Réparation du site d’injection et rétablissement de la circulation
- À l’aide de boules de coton stériles, absorbez tout sang résiduel dans la cavité chirurgicale. Localisez le site d’injection sur l’ACC (figure 7A) et déterminez le nombre de sutures nécessaires pour le fermer. Irriguez soigneusement le site d’injection et la lumière de la zone isolée de l’ACC pour éliminer le sang coagulé.
- À l’aide de la pince à pointe coudée, saisissez l’aiguille de suture 9-0 par le corps de l’aiguille près du sertissage. Tout en utilisant la pince fine pour soutenir l’artère du côté opposé, placez une seule suture dans l’ACC en pénétrant la paroi artérielle à environ 1-1,5 mm latéralement du site d’injection, perpendiculairement à l’artère. Tenez l’artère avec la pince fine, en ouvrant le site d’injection et en passant l’aiguille et la suture à travers les côtés droit et gauche individuellement. Alternativement, tenez l’artère, en pressant doucement les côtés ensemble avec la pince fine, en passant l’aiguille et suturez les deux côtés de l’artère avec une seule bouchée.
REMARQUE : Avec l’une ou l’autre technique, veillez à ce que l’aiguille et la suture ne pénètrent pas dans la paroi arrière à l’intérieur de l’artère, car cela fermera la lumière lorsqu’elle sera resserrée. - Fermez le site d’injection à l’aide d’un nœud du chirurgien en effectuant un lien d’instrument à l’aide d’une pince fine et d’une pince à bout coudé, en utilisant un minimum de quatre lancers (figure 7B). En général, utilisez une seule suture interrompue simple pour fermer le site d’injection d’une aiguille de 33 G.
- Pour rétablir la circulation à l’aide de la pince fine, détachez et retirez la suture autour de l’ECA, puis la suture supérieure sur l’ACC (Figure 7C, D). Ensuite, desserrez lentement la suture inférieure sur le CCA, mais ne la défaites pas immédiatement. Confirmer que le site d’injection est suffisamment fermé pour prévenir une hémorragie importante avec rétablissement de la pression artérielle et du débit sanguin (figure 7D).
REMARQUE : Si un saignement important se produit au point d’injection, la suture inférieure de l’ACC peut être rapidement resserrée et le site d’injection peut être ajusté ou suturé de nouveau si nécessaire. - Retirez les sutures supérieure et inférieure de l’ACC (figure 7E). Passez à l’étape 2.9.
- Fermeture et analgésie
- Repositionnez la glande salivaire dans la cavité et fermez l’incision avec trois sutures simples interrompues à l’aide d’un suture stérile. Retirez les attaches chirurgicales et laissez la souris se remettre de l’anesthésie sur un coussin chauffant.
REMARQUE : Les doses de suivi de l’analgésique doivent être administrées en fonction de la fréquence et de la dose spécifiées dans le protocole IACUC approuvé par l’utilisateur. Il est recommandé une durée de cicatrisation d’une semaine entre les injections. Si des injections répétées sont nécessaires, la réparation du site d’injection peut être utilisée après la première injection et la même procédure chirurgicale peut être suivie pour les injections ultérieures. L’injection subséquente peut être administrée dans le crâne de l’ACC jusqu’au site d’injection réparé, car des sutures répétées pour réparer le même site d’injection entraîneront probablement des cicatrices et des caillots sanguins.
- Repositionnez la glande salivaire dans la cavité et fermez l’incision avec trois sutures simples interrompues à l’aide d’un suture stérile. Retirez les attaches chirurgicales et laissez la souris se remettre de l’anesthésie sur un coussin chauffant.
Résultats
Des rapports antérieurs ont montré que les cellules souches mésenchymateuses humaines dérivées de la moelle osseuse (BM-hMSC) délivrées par injection intracarotidienne se logeaient avec succès contre les gliomes intracrâniens chez la souris19. Nous avons utilisé ce modèle pour comparer les effets de la ligature de l’ACC par rapport à la réparation de l’ACC avec restauration de la circulation après injection intracarotidienne de BM-hMSC chez des souris porteuses d’un gliome. Des souris nues athymiques ont été implantées avec des cellules de gliome U87, suivies d’une injection de BM-hMSC marquées à la GFP avec ligature ultérieure de l’ACC ou réparation de l’ACC avec restauration de la circulation. Après 3 jours, les souris ont été sacrifiées et les cerveaux ont été récoltés, réparés, et l’immunohistochimie a été effectuée pour détecter la GFP, et les cellules positives à la GFP ont été comptées (Figure 8A-D).
La localisation globale des GFP-BM-hMSC dans les gliomes intracrâniens a été évaluée par le nombre total de cellules GFP positives à l’intérieur de la limite tumorale sur deux lames différentes (sections distantes de >75 μm) du même échantillon. La comparaison des moyennes par test t non apparié a suggéré qu’il n’y avait pas de différence significative entre le retour moyen observé entre les deux procédures (P = 0,6858) (figure 8E). La dispersion des GFP-BM-hMSCs dans toute la tumeur a été évaluée en comptant les cellules positives à la GFP dans 10 champs de haute puissance au sein de la tumeur. L’augmentation du nombre de cellules dans des champs de haute puissance peut indiquer des changements dans la dispersion des cellules dans toute la tumeur résultant de la variation de la procédure. La comparaison des valeurs médianes à l’aide du test de Wilcoxon Signed Rank a indiqué qu’il n’y avait pas de différence significative entre le nombre médian de cellules positives à la GFP dans les champs de puissance élevée entre les groupes de ligature CCA et de réparation CCA (Figure 8F).

Figure 1 : Préparation de la table d’opération et de la souris pour la chirurgie. (A,B) Lit chirurgical (étiquettes A. Ruban adhésif formant le lit, B. Ruban chirurgical, contentions des membres antérieurs, C. Oreiller, D. Poids, E. Cône de nez d’anesthésie, F. Écarteur de crochet émoussé, G. Sutures de 1 cm dans de l’éthanol à 70 %, H. Pinces fines, I. Pinces à bout coudé, J. Ciseaux étroits, K. Boules de coton stériles). (C, D) Positionnement de la souris. (E, F) Site chirurgical et désinfection du site chirurgical. Veuillez cliquer ici pour voir une version agrandie de cette figure.
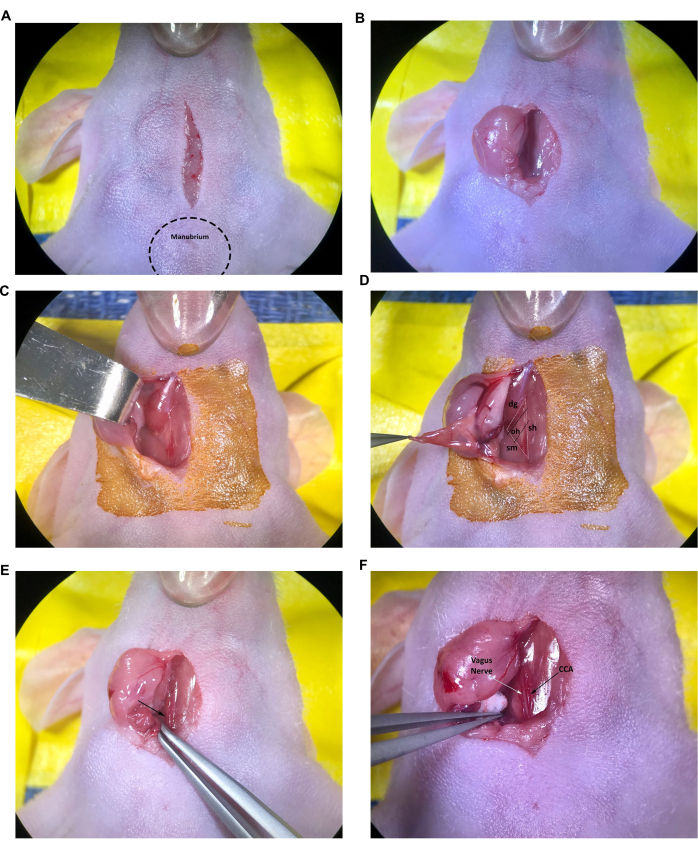
Figure 2 : Incision et exposition des structures au site d’injection. (A) Incision médiane. (B, C) Rétraction de la glande salivaire droite. (D) Le triangle musculaire formé par le muscle trachée/sterno-hyoïde, le muscle sterno-cléido-mastoïdien et le muscle digastrique, le muscle omohyoïdien est également visible. (E) Artère carotide commune, indiquée par la flèche. (F) Nerf vague et artère carotide commune, indiqués par les flèches. Abréviations : sh = trachée/muscle sterno-hyoïdien ; SM = muscle sterno-cléido-mastoïdien ; DG = muscle digastrique ; oh = muscle omohyoïdien ; CCA = Artère carotide commune. Veuillez cliquer ici pour voir une version agrandie de cette figure.
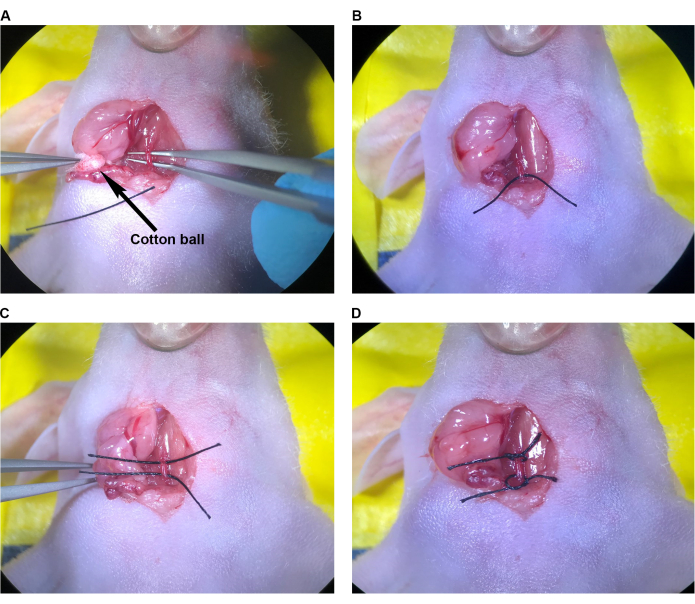
Figure 3 : Préparation de l’ACC pour l’injection. (A) Pinces à bout coudé passées sous l’ACC. (B) La suture a été tirée à mi-chemin sous l’ACC à l’aide d’une pince à bout coudé. (C) La deuxième suture a été retirée à mi-chemin en vertu de la LCC. (D) Suturé attaché en vrac autour de la CCA. Abréviation : CCA = Artère carotide commune. Veuillez cliquer ici pour voir une version agrandie de cette figure.
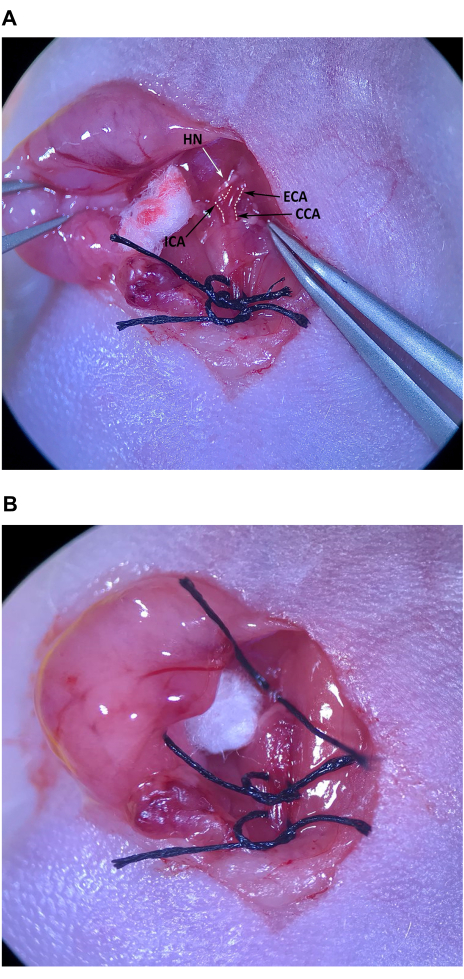
Figure 4 : Isolement et préparation de l’artère carotide externe. (A) ACC, artère carotide externe et artère carotide interne. (B) Suture retirée à mi-chemin en vertu de la LCE. Abréviations : CCA Artère carotide commune ; ECA = artère carotide externe ; ICA = artère carotide interne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
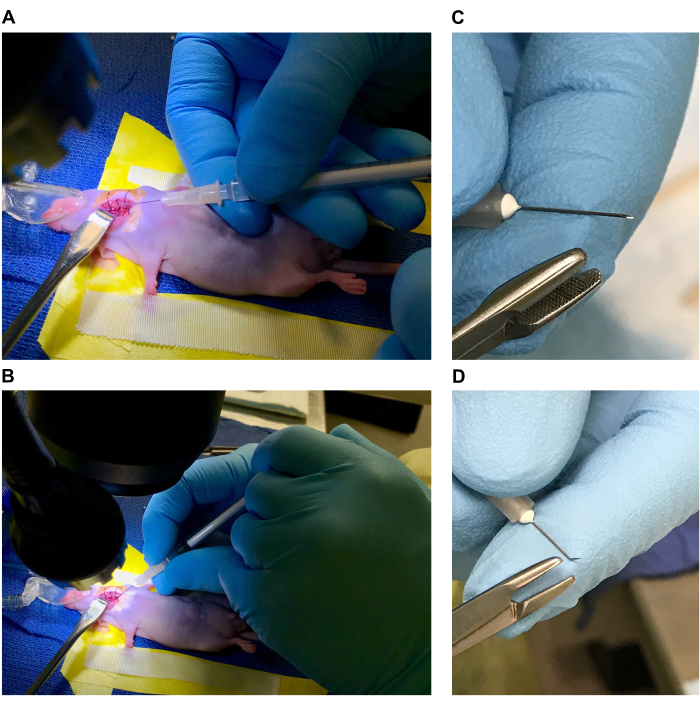
Figure 5 : Préparation de l’aiguille et de la seringue. (A) Injection avec une aiguille droite avec une seringue reposant contre le corps de la souris. (B) Injection avec une aiguille pliée, avec une main posée sur la table d’opération. (C, D) Préparation d’une aiguille pliée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
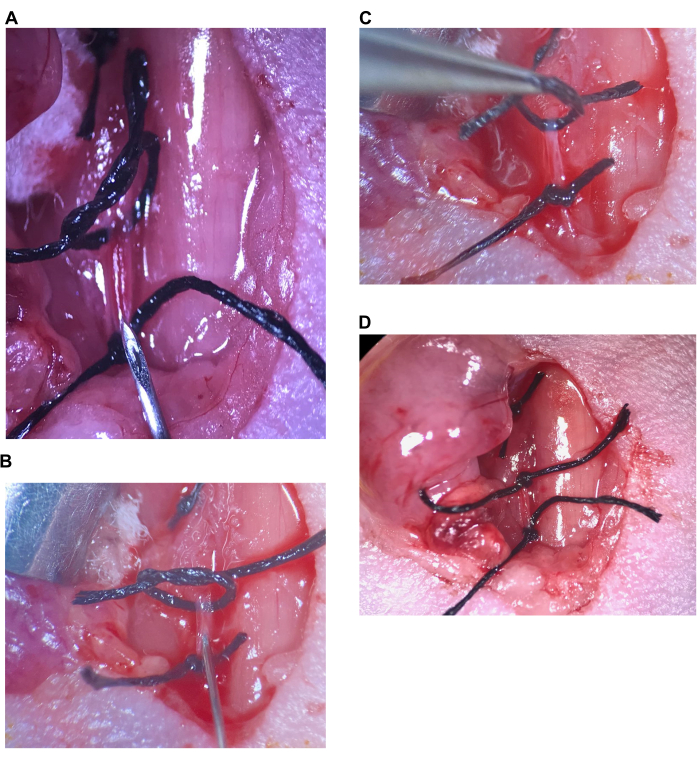
Figure 6 : Injection intracarotidienne. (A) La suture supérieure est lâche, la suture inférieure est serrée sur le CCA, l’aiguille est placée au-dessus de la suture inférieure. (B) L’aiguille est insérée juste au-delà du biseau, l’artère est scellée autour de l’aiguille. (C) La suture supérieure est soulevée pour plier l’artère vers le haut et empêcher le reflux. (D) La suture supérieure de l’ACC est resserrée. Abréviation : CCA = Artère carotide commune. Veuillez cliquer ici pour voir une version agrandie de cette figure.
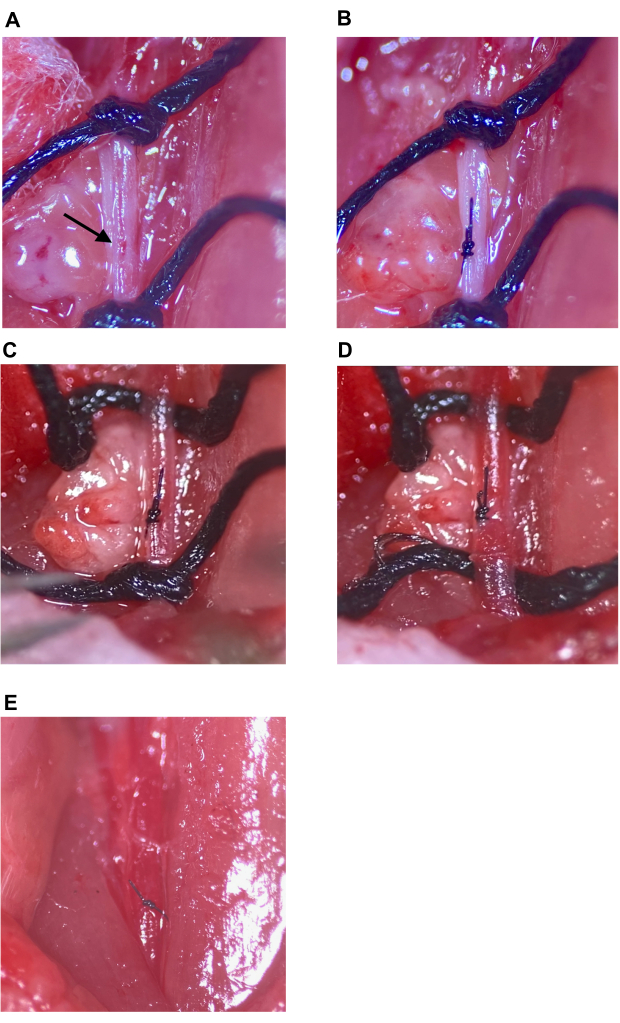
Figure 7 : Réparation du site d’injection et rétablissement de la circulation. (A) Le site d’injection indiqué par une flèche. (B) Le site d’injection s’est fermé avec un nœud du chirurgien, un minimum de quatre lancers. (C, D) Desserrage des sutures supérieures et inférieures de l’ACC après la réparation du site d’injection ; Aucun saignement n’est observé après le desserrage de la suture. (E) Les sutures sont retirées une fois que le site d’injection a été suffisamment réparé. Abréviation : CCA = Artère carotide commune. Veuillez cliquer ici pour voir une version agrandie de cette figure.
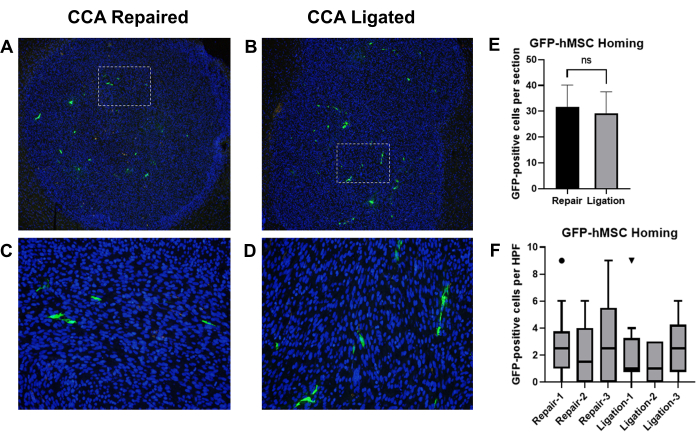
Figure 8 : Injection intracarotidienne de GFP-BM-hMSCs et comparaison du retour à domicile aux tumeurs de gliome intracrânien après ligature de l’ACC ou réparation de l’ACC avec circulation restaurée. Des coupes de tissu cérébral de souris porteuses de tumeurs ont été colorées avec des anticorps primaires anti-GFP et des anticorps secondaires Alexa Fluor 488 pour marquer GFP-BM-hMSCs (vert). Les noyaux ont été colorés avec Hoechst 33342 (bleu). Champs représentatifs de faible puissance des sections marquées montrant une localisation globale de la tumeur et champs de haute puissance montrant une distribution cellulaire GFP positive après réparation (A,C) de l’ACC ou ligature de l’ACC (B,D). (E) La localisation globale des GFP-BM-hMSCs dans les tumeurs a été évaluée par le nombre total de cellules GFP-positives à l’intérieur de la limite tumorale sur deux lames différentes et les moyennes ont été comparées par test t. Aucune différence significative n’a été observée entre les autres procédures (P = 0,6858). (F) La dispersion des GFP-BM-hMSCs dans toute la tumeur a été évaluée en comptant les cellules GFP-positives dans 10 champs de haute puissance au sein de la tumeur. La comparaison des valeurs médianes par le test de Wilcoxon Signed Rank n’indique aucune différence significative entre les individus, quelle que soit la procédure (P = 0,1914, 0,5000, 0,1641, 0,9512, 0,8828, 0,2207). Abréviations : GFP = protéine fluorescente verte ; GFP-BM-hMSCs = cellules souches mésenchymateuses humaines dérivées de la moelle osseuse marquées à la GFP ; CCA = Artère carotide commune. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les injections intracarotides dans l’artère intercarotide ont été de plus en plus utilisées ces dernières années pour administrer des traitements aux tumeurs cérébrales. Par conséquent, il est important d’établir des modèles murins qui reflètent les injections intracarotides chez l’homme à des fins de recherche. Auparavant, les injections intracarotides chez la souris étaient effectuées avec une ligature ultérieure de l’artère, ce qui limite le nombre d’injections dans l’artère11,12. De plus, l’occlusion de l’artère carotide chez la souris peut entraîner une ischémie cérébrale chez certaines souches de souris qui n’ont pas un cercle complet de Willis13. Nous avons développé une méthode pour réparer l’artère carotide injectée afin de surmonter les limites des méthodes précédentes. La réparation du site d’injection permet de rétablir le flux sanguin vers l’artère injectée, de réduire le risque d’ischémie cérébrale et de faciliter les injections ultérieures dans la même artère carotide interne.
Plusieurs étapes, qui sont essentielles au succès, nécessitent une manipulation soigneuse des instruments chirurgicaux ou des tissus, notamment : l’insertion correcte de l’aiguille dans la lumière de l’artère pour éviter les saignements lors de l’injection intracarotidienne ; dissection soigneuse du tissu conjonctif du site d’injection avant l’insertion de l’aiguille ; l’élimination de tous les amas et bulles d’air dans la seringue et l’aiguille avant l’injection ; et la fermeture correcte du site d’injection pour éviter la fermeture de la lumière de l’artère pendant la réparation. Pour éviter les saignements après l’insertion de l’aiguille, assurez-vous que l’aiguille est insérée dans l’artère au-delà du biseau pour former un joint autour de la tige de l’aiguille. Pour éviter une déchirure de la paroi arrière de l’artère, insérez l’aiguille à un angle peu profond et balancez subtilement la seringue et l’aiguille vers l’arrière pour garder l’extrémité de l’aiguille à l’écart de la paroi arrière de l’artère. Si la solution injectée s’échappe pendant l’injection, cela suggère que l’aiguille n’a été insérée que dans le tissu conjonctif entourant l’artère ; Une dissection soigneuse de l’excès de tissu conjonctif du site d’injection avant l’injection permettra d’éviter ce problème.
En ce qui concerne le choix de la suture et la technique de fermeture, si l’injection initiale a utilisé une aiguille 33 G et a fait une insertion nette dans l’artère, une simple suture avec une suture 9-0 suffit pour réparer l’artère. Si une aiguille plus grosse est utilisée pour l’injection (30 G, etc.) ou si une déchirure se produit lors de l’insertion de l’aiguille (par exemple, lorsque l’aiguille est décentrée ou que l’artère bouge parce que la souris respire), cela se traduit par un trou légèrement plus grand qui doit être réparé. Deux sutures simples ou un huit suffisent généralement pour réparer ce type de trou plus grand. Le choix entre ces deux techniques se fait en fonction de la préférence du chirurgien dans cette situation. Il est important de noter que la technique de réparation n’a pas été évaluée dans les situations où le trou du site d’injection est significativement plus grand que dans la situation mentionnée ci-dessus. Si la déchirure au site d’injection s’étend latéralement (faisant un trou plus large, supérieur à un tiers de la circonférence de l’artère), la réparation avec cette méthode peut provoquer une contraction de l’artère et un risque accru de thrombose.
S’il y a un saignement au site d’injection réparé lorsque les sutures sont retirées, cela peut être dû à l’étirement du site réparé lorsque la circulation normale reprend ; Cela peut être corrigé en couvrant doucement le site d’injection réparé avec du coton stérile et en appliquant une légère pression pendant 30 s. Alternativement, s’il y a un saignement du site d’injection réparé sans flux sanguin visible et une artère distendue proximale, cela indique que l’aiguille de suture a traversé la paroi arrière de l’artère pendant la réparation. Dans ce cas, ouvrez doucement les bords du site d’injection pendant la réparation, passez l’aiguille de suture dans l’artère à un angle peu profond et confirmez visuellement que la suture n’a pas traversé la paroi arrière avant de faire le nœud de suture.
Grâce à ces mesures en place, la méthode de réparation du site d’injection est précise et reproductible sur des cohortes d’animaux, quel que soit leur patrimoine génétique ou leur âge. D’après notre expérience, le taux de réussite a été de 100% avec trois chirurgiens différents effectuant la procédure. Avec une expérience adéquate et en suivant attentivement le protocole fourni, nous ne prévoyons aucune difficulté pour d’autres chirurgiens à effectuer cette procédure. Avec de la pratique, un chirurgien qualifié peut terminer la procédure en 15 à 20 minutes. Si l’expérience le permet, le temps par animal peut également être réduit en laissant intactes les sutures supérieures et inférieures de l’ACC, sans réparer le site d’injection. Cependant, comme indiqué ci-dessus, des différences spécifiques à la souche dans l’anatomie vasculaire cérébrale ont été documentées et il est important de vérifier que la souche de la souris utilisée dans la procédure peut tolérer cela avant de commencer l’expérience.
Comme il s’agit d’une intervention chirurgicale, la récupération des souris doit être prise en compte. La tolérance au stress et la récupération des plaies sont des considérations importantes qui varieront selon les différentes souches de souris. De plus, l’inflammation au niveau du site chirurgical et la formation de tissu cicatriciel peuvent augmenter le temps de récupération après des chirurgies répétées. Nous avons réussi à effectuer plusieurs injections à 7 jours d’intervalle, mais si des injections plus fréquentes sont nécessaires, elles doivent être soigneusement évaluées dans les souches de souris spécifiques à utiliser. La manipulation forcée et le stress sur l’ACC (pendant l’isolement, le ligage et le retrait des sutures et l’injection) peuvent endommager et affaiblir les parois artérielles, entraînant des déchirures lors d’injections répétées. Il est important de minimiser la dissection du tissu conjonctif de soutien autour de l’ACC et la bifurcation et de s’abstenir d’appliquer une tension excessive à l’artère.
Nos résultats suggèrent que dans ce modèle particulier, la ligature ou la réparation de l’ACC avec circulation restaurée après l’injection ne diffèrent pas dans la fréquence globale de guidage ou la distribution des BM-hMSC injectées dans les tumeurs intracrâniennes. Bien que cela puisse varier selon les souches de souris, l’utilisation de la réparation au site d’injection offre l’avantage de ramener le flux sanguin vers l’artère injectée, ce qui permet des injections ultérieures dans la même artère et, surtout, ressemble aux injections intracarotides chez les patients humains. Le choix de la ligature ou de la réparation de l’artère injectée est basé sur le type d’expérience et le modèle de souris utilisé. Si une deuxième injection est nécessaire, ou si le modèle de souris n’a pas un cercle de Willis complet, une réparation du site d’injection doit être utilisée. La possibilité de réinjecter l’ACC dans des modèles murins peut faciliter des manipulations expérimentales supplémentaires. Par exemple, pour tester plusieurs doses d’un thérapeutique potentiel administré au fil du temps, la réparation de l’artère injectée est essentielle pour effectuer les injections ultérieures. Cette méthode serait également utile dans les expériences impliquant l’injection de combinaisons d’agents thérapeutiques qui doivent être injectés à des moments différents. La flexibilité accrue des injections intracarotidiennes offerte par la réparation de l’artère injectée améliore l’utilité translationnelle des modèles de tumeurs cérébrales chez la souris.
Déclarations de divulgation
Les auteurs n’ont pas de divulgations/conflits d’intérêts pertinents.
Remerciements
Cette étude a été soutenue par des subventions du National Cancer Institute (R01CA115729, R01CA214749 et 1P50 CA127001) et par de généreuses contributions philanthropiques au programme Moon Shots du MD Anderson Cancer Center™ de l’Université du Texas, à la Fondation Broach pour la recherche sur le cancer du cerveau, au Fonds de la famille Elias pour la recherche sur les tumeurs cérébrales, au Fonds de recherche sur le cancer Priscilla Hiley, au Fonds de recherche sur le cancer du cerveau Curefest de la famille Bauman, Fonds Chuanwei Lu, Fonds de recherche sur le cancer du cerveau Sweet Family, Fondation commémorative Ira Schneider pour la recherche sur le cancer, Fonds Jim et Pam Harris, Fonds Gene Pennebaker pour la recherche sur le cancer du cerveau, Fonds Sorenson pour la recherche sur les tumeurs cérébrales, Fonds commémoratif Brian McCulloch, Fondation TLC du cœur et Fonds de dotation Mary Harris Pappas pour la recherche sur le glioblastome, tout à F.F.L.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringes (low dead space) | Air-tite Products Co. | A1 | |
| 26 G; 1/2" needle | Air-tite Products Co. | N2612 | |
| 33 G; 1/2" needle | JBP, Air-tite Products Co. | JBP3313B | |
| 3 cm Petri dish | Falcon, Fisher Scientific | 08-772A | |
| 3M durapore surgical tape | Fisher Scientific | 19-071-152 | |
| 6-0 suture thread | Fine Science Tools | 18020-60 | |
| 70% Ethanol | Fisher Scientific | 04-355-122 | |
| 9-0 microsurgical suture with needle | Fine Science Tools | 12052-09 | |
| Analgesic for major surgery | |||
| Artificial tears/ophthalmic ointment | Covetrus | 8897 | |
| Bead Sterilizer | Fisher Scientific | 14-955-341 | |
| Betadine/Chlorhexidine | McKesson, Fisher Scientific | NC1696484 | |
| Blunt hook retractor | Fine Science Tools | 17022-13 | |
| Dissecting microscope | Zeiss Microscopy, LLC | 491903-0010-000 | |
| Electric heating pad | Insource, Fisher Scientific | NC0667724 | |
| Extra narrow scissors | Fine Science Tools | 14088-10 | |
| Fine forceps - Dumont #5 forceps with micro-blunted tips | Fine Science Tools | 11253-20 | |
| Fine forceps - Dumont #5/45 angled tip forceps with micro-blunted tips | Fine Science Tools | 11253-25 | |
| Isoflurane vaporizer (or Ketamine/Xylazine cocktail) | Kent Scientific | VetFlo-1231 | |
| Light source | Laxco, Fisher Scientific | AMPSILED21 | |
| Mouse anesthesia nose cone | Braintree Scientific, Inc | XENO- M | |
| Needle driver | Fine Science Tools | 12002-12 | |
| Sterile cotton swabs | Texwipe, Fisher Scientific | 18-366-472 | |
| Sterile gauze pads | Covidien, Fisher Scientific | 22-037-907 | |
| Sterile saline (0.9%) | KD Medical, Fisher Scientific | 50-103-1363 | |
| Sterile surgical drapes | Fisher Scientific | 50-129-6666 | |
| Sterile surgical/downdraft table | |||
| Sterile suture pack (any suitable diameter for mouse wound closure) | Ethicon, Fisher Scientific | 50-209-2811 | |
| Surgical tools | |||
| Vinyl lab tape | Fisher Scientific | 15-901 |
Références
- Loya, J., Zhang, C., Cox, E., Achrol, A. S., Kesari, S. Biological intratumoral therapy for the high-grade glioma part i: Intratumoral delivery and immunotoxins. CNS Oncol. 8 (3), (2019).
- Garfield, J., Dayan, A. D. Postoperative intracavitary chemotherapy of malignant gliomas. A preliminary study using methotrexate. J Neurosurg. 39 (3), 315-322 (1973).
- Kroin, J. S., Penn, R. D. Intracerebral chemotherapy: Chronic microinfusion of cisplatin. Neurosurgery. 10 (3), 349-354 (1982).
- Sendelbeck, S. L., Urquhart, J. Spatial distribution of dopamine, methotrexate and antipyrine during continuous intracerebral microperfusion. Brain Res. 328 (2), 251-258 (1985).
- Alter, R. A., et al. Long-term benefit of intra-arterial bevacizumab for recurrent glioblastoma. J Exp Ther Oncol. 12 (1), 67-71 (2017).
- Angelov, L., et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary cns lymphoma: A multi-institutional experience. J Clin Oncol. 27 (21), 3503-3509 (2009).
- Chen, S. R., Chen, M. M., Ene, C., Lang, F. F., Kan, P. Perfusion-guided endovascular super-selective intra-arterial infusion for treatment of malignant brain tumors. J Neurointerv Surg. 14 (6), 533-538 (2022).
- Faltings, L., et al. Rechallenging recurrent glioblastoma with intra-arterial bevacizumab with blood brain-barrier disruption results in radiographic response. World Neurosurg. 131, 234-241 (2019).
- Srinivasan, V. M., et al. Advances in endovascular neuro-oncology: Endovascular selective intra-arterial (esia) infusion of targeted biologic therapy for brain tumors. J Neurointerv Surg. 12 (2), 197-203 (2020).
- Shinojima, N., et al. Tgf-β mediates homing of bone marrow-derived human mesenchymal stem cells to glioma stem cells. Cancer Res. 73 (7), 2333-2344 (2013).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of visualized experiments : JoVE. (120), e55085 (2017).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Benbenishty, A., et al. Maintaining unperturbed cerebral blood flow is key in the study of brain metastasis and its interactions with stress and inflammatory responses. Brain, behavior, and immunity. 62, 265-276 (2017).
- Doucette, T., et al. Mesenchymal stem cells display tumor-specific tropism in an rcas/ntv-a glioma model. Neoplasia. 13 (8), 716-725 (2011).
- Hata, N., et al. Platelet-derived growth factor bb mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 66 (1), 144-156 (2010).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 65 (8), 3307-3318 (2005).
- Qiao, Y., et al. Magnetic resonance and photoacoustic imaging of brain tumor mediated by mesenchymal stem cell labeled with multifunctional nanoparticle introduced via carotid artery injection. Nanotechnology. 29 (16), 165101 (2018).
- Yong, R. L., et al. Human bone marrow-derived mesenchymal stem cells for intravascular delivery of oncolytic adenovirus delta24-rgd to human gliomas. Cancer Res. 69 (23), 8932-8940 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon