Method Article
Erleichterung wiederholter Intrakarotis-Injektionen in Mausmodellen durch eine neuartige Reparaturtechnik an der Injektionsstelle
In diesem Artikel
Zusammenfassung
Die Reparatur der Arteria intracarotisis in einem Mausmodell nach der Injektion stellt den Blutfluss in die Arterie wieder her, ohne die Verteilung des injizierten Materials negativ zu beeinflussen. Die Reparatur der Injektionsstelle erleichtert nachfolgende Injektionen durch dieselbe Arterie und beugt zerebraler Ischämie bei Mausstämmen vor, denen ein vollständiger Willis-Circle fehlt.
Zusammenfassung
Angesichts der jüngsten Fortschritte bei der Verabreichung neuartiger Antitumortherapeutika unter Verwendung endovaskulärer selektiver intraarterieller Verabreichungsmethoden in der Neuroonkologie besteht ein dringender Bedarf, Methoden für intrakarotisfarbene Injektionen in Mausmodellen zu entwickeln, einschließlich Methoden zur Reparatur der Halsschlagader bei Mäusen nach der Injektion, um nachfolgende Injektionen zu ermöglichen. Wir haben eine Methode der Intrakarotis-Injektion in einem Mausmodell entwickelt, um Therapeutika mit zwei alternativen Verfahren in die Arteria carotis interna (ICA) zu verabreichen.
Während der Injektion wird die Nadel in die Arteria carotis communis (CCA) eingeführt, nachdem eine Naht um die Arteria carotis externa (ECA) gebunden wurde, und die injizierten Therapeutika werden in die ICA eingebracht. Nach der Injektion kann die Arteria carotis communis (CCA) ligiert werden, wodurch die Anzahl der intrakarotisfarbenen Injektionen auf eine begrenzt wird. Das in diesem Artikel beschriebene alternative Verfahren beinhaltet eine Modifikation, bei der auf die intrakarotisartige Injektion eine Reparatur des CCA an der Injektionsstelle folgt, wodurch der Blutfluss innerhalb des CCA wiederhergestellt und die Komplikation der zerebralen Ischämie vermieden wird, die bei einigen Mausmodellen beobachtet wird.
Wir verglichen auch die Verabreichung von humanen mesenchymalen Stammzellen (BM-hMSCs) aus dem Knochenmark mit intrakraniellen Tumoren, wenn sie durch intrakarotisfarbene Injektion mit und ohne Reparatur der Injektionsstelle nach der Injektion verabreicht wurden. Die Verabreichung von BM-hMSCs unterscheidet sich zwischen den Methoden nicht wesentlich. Unsere Ergebnisse zeigen, dass die Reparatur des CCA an der Injektionsstelle wiederholte Injektionen durch dieselbe Arterie ermöglicht und die Abgabe und Verteilung des injizierten Materials nicht beeinträchtigt, wodurch ein Modell mit größerer Flexibilität entsteht, das die Intrakarotis-Injektion beim Menschen besser nachahmt.
Einleitung
Die Verabreichung von Therapeutika für Hirntumoren ist aufgrund der Undurchlässigkeit der Blut-Hirn-Schranke (BHS) und der Blut-Tumor-Schranke (BTB) eine Herausforderung. Eine direkte intratumorale Injektion von Therapeutika zur Umgehung der BHS kann durch die Verwendung eines Ommaya-Reservoirkatheters, eine Mikroinfusion mit niedrigem Durchfluss für eine konvektionsverstärkte Verabreichung oder eine lokale Injektion in die Resektionshöhle oder das angrenzende Gewebe1 erreicht werden. Das Gesamtvolumen des Tumorgewebes, das mit diesen Methoden erreicht wird, ist jedoch begrenzt 2,3,4. Intraarterielle Injektionen wurden bereits früher verwendet, um Therapeutika an Hirntumoren zu verabreichen, mit dem Ziel, einen größeren Teil des Tumors zu erreichen 5,6,7,8, und in jüngster Zeit haben die Fortschritte sowohl bei intraarteriellen Verabreichungstechniken als auch bei neuartigen Therapeutika den Nutzen dieses Ansatzes bei der Behandlung von Hirntumoren gezeigt7, 9. Urheberrecht Zu diesen Fortschritten gehören die Entwicklung von Mikrokathetern, die endovaskuläre selektive intraarterielle (ESIA) Verabreichung mit fortschrittlicher Bildgebung, die Verwendung osmotischer Wirkstoffe zur Störung der BHS und BTB sowie die Entwicklung gezielter biologischer Therapien. Daher sind für die präklinische Erprobung neuartiger Therapeutika, die über intraarterielle Injektionen verabreicht werden, geeignete translationale Forschungsmodelle erforderlich 9,10.
In Mausmodellen von Hirntumoren passieren intraperitoneal oder intravenös (durch die Schwanzvene) verabreichte Therapeutika die Leber bzw. das Herz und die Lunge, bevor sie im gesamten Körper, einschließlich des Gehirns, verteilt werden. Diese First-Pass-Effekte können den Wirkstoff einfangen und entfernen oder den Wirkstoff verdünnen, bevor er das Gehirn erreicht, und können dosislimitierende Toxizitäten aufweisen, bevor eine therapeutische Dosis im Gehirn erreicht wird. Im Gegensatz dazu ermöglicht die intrakarotisartige Injektion eine fokussierte Abgabe an das Gehirn vor der Zirkulation, indem sie den First-Pass-Metabolismus umgeht und die Off-Target-Abgabe begrenzt. Während die Intrakarotis-Injektion bei Mäusen arbeitsintensiver ist, führen die Spezifität und Reproduzierbarkeit der Technik zu einer reduzierten Anzahl von Tieren, um die Untersuchungen abzuschließen11,12.
Im Allgemeinen wird bei den zuvor beschriebenen Verfahren zur Injektion der Arteria intracarotis bei Mäusen die Arteria carotis communis nach der Injektion ligiert und die Durchblutung des Gehirns durch die kontralaterale Halsschlagader und die hintere Hirnzirkulation über den Kreis von Willis11,12 gewährleistet. Diese Methode hat die inhärente Einschränkung, dass nur maximal eine einzige Injektion in die Arteria carotis interna oder externa möglich ist. Es ist auch entscheidend, dass die Mausstämme, die in Experimenten verwendet werden, bei denen die Halsschlagader ligiert ist, einen vollständigen Willis-Circle aufweisen, um eine zerebrale Ischämie aufgrund der ligierten Arteriezu verhindern 13. Es wurde auch gezeigt, dass der Verschluss der Halsschlagader den zerebralen Blutfluss reduziert und die Verteilung der injizierten Partikel begrenzt14. Darüber hinaus emuliert der Verschluss der Halsschlagader bei Mäusen nach der Injektion nicht die intrakarotisartige Injektion bei menschlichen Patienten.
Unsere Gruppe hat zuvor intrakarotisartige Injektionen verwendet, um mesenchymale Stammzellen erfolgreich in das Gehirn zu bringen 10,15,16,17,18,19. In diesem Artikel beschreiben wir diese Methode der intrakarotisartigen Arterieninjektion im Detail und fügen eine Modifikation der von uns entwickelten Methode hinzu, bei der die Injektionsstelle repariert wird, ohne die Arterie zu verschließen, wodurch die Einschränkungen der Ligatur der Halsschlagader nach der Injektion vermieden werden. Bei dieser Methode wird die Arteria carotis communis (CCA) für die Injektion vorbereitet, indem zwei Nähte gelegt werden, eine an beiden Enden der vorgesehenen Injektionsstelle, und die untere Naht (unterhalb der Injektionsstelle) festgezogen wird. Die Arteria carotis externa (ECA) wird mit einer weiteren Naht verschlossen. Die Nadel wird in die CCA eingeführt und die Therapeutika werden in die Arteria carotis interna (ICA) verabreicht. Anschließend wird die obere Naht am CCA festgezogen, um einen Rückfluss aus dem ICA zu verhindern. In diesem Schritt kann das injizierte CCA entweder ligiert oder repariert werden. Wenn das CCA ligiert werden soll, werden die Nähte festgezogen und an Ort und Stelle belassen. Wenn die Injektionsstelle repariert wird, werden die Nähte nach der Reparatur entfernt und der Blutfluss wiederhergestellt. Die Details zu diesen alternativen Verfahren finden Sie unten.
Protokoll
Alle unten beschriebenen Schritte entsprechen unserem Protokoll, das den Richtlinien folgt, die vom Institutional Animal Care and Use Committee am MD Anderson Cancer Center der University of Texas festgelegt und genehmigt wurden.
1. Vorbereitung des Operationstisches und der Maus für den chirurgischen Eingriff
- Vorbereitung des Operationstisches und der Maus für den chirurgischen Eingriff (siehe Abbildung 1A,B)
- Ordnen Sie das Präpariermikroskop und die Lichtquelle mit einem aktiven Scavenging-System vor dem Isofluran-Verdampfer an oder stellen Sie es auf einen Abwärtstisch. Legen Sie das elektrische Heizkissen auf die Basis des Präpariermikroskops (oder vorzugsweise unter das Mikroskop, wenn die Basis fest ist und Wärme übertragen kann) und bedecken Sie es mit einem sterilen OP-Tuch.
HINWEIS: Alle chirurgischen Instrumente und Abdeckungen sollten vor der Verwendung durch Autoklavieren sterilisiert werden und alle Einwegartikel sollten steril und einzeln verpackt sein. Sterile Handschuhe sollten während der gesamten Einrichtung und des Verfahrens verwendet und bei Bedarf gewechselt werden, um die Sterilität zu erhalten. - Bereiten Sie das Bett (4-5" lang x 2" breit) auf dem OP-Tuch mit Vinyl-Laborklebeband vor. Schneiden Sie ein 1,5 Zoll x 1,5 Zoll großes Quadrat Gaze ab, rollen Sie es fest und legen Sie die gerollte Gaze unter ein 3 Zoll großes Stück Vinylband am "Kopf" des Bettes, um ein Kissen zu bilden (die Kopfneigung mit Hilfe eines Kissens ermöglicht eine größere Ausdehnung des ventralen Nackenbereichs).
- Legen Sie 4 Zoll große Stücke chirurgisches Klebeband entlang der Seiten des Bettes (auf das Vinylband). [Wenn Sie Isofluran verwenden, platzieren Sie einen Anästhesie-Nasenkonus mit Gewicht (oder Klebeband) in der Nähe des Kopfende des Bettes. Passen Sie es für eine bestimmte Platzierung an, sobald die Maus betäubt und fixiert ist.] Siehe Abbildung 1A,B.
- Reißen Sie mit einem Nadeltreiber oder einer schweren Pinzette kleine Wattestäbchen von einem Wattestäbchen ab und rollen Sie sie zu Kugeln in verschiedenen Größen von 0,5 bis 1 mm Durchmesser (8-10 Wattestücke pro Maus). Bewahren Sie die Watte auf dem OP-Tuch in der Nähe des Kopfende des Bettes auf.
- Schneiden Sie mit sterilen Instrumenten 6-0 Nahtfaden in 1 cm große Stücke (3-4 Stück pro Maus). Legen Sie die vorbereiteten Nahtlängen auf ein steriles Tuch. Bereiten Sie eine 1-ml-Spritze für die Verabreichung von Buprenorphin oder einem anderen geeigneten Analgetikum vor (wie vom Protokoll des Institutional Animal Care and Use Committee [IACUC] zugelassen). Sterilisieren Sie alle chirurgischen Instrumente gemäß den IACUC-Standards, bevor Sie die Werkzeuge in den sterilen Bereich stellen.
- Ordnen Sie das Präpariermikroskop und die Lichtquelle mit einem aktiven Scavenging-System vor dem Isofluran-Verdampfer an oder stellen Sie es auf einen Abwärtstisch. Legen Sie das elektrische Heizkissen auf die Basis des Präpariermikroskops (oder vorzugsweise unter das Mikroskop, wenn die Basis fest ist und Wärme übertragen kann) und bedecken Sie es mit einem sterilen OP-Tuch.
- Vorbereitung der Maus für den chirurgischen Eingriff (siehe Abbildung 1C-F)
- Anästhesieren Sie eine Maus nach Methoden, die von der IACUC für größere Überlebensoperationen zugelassen sind (verwenden Sie entweder Isofluran 1%-4%, basierend auf der Empfindlichkeit einzelner Mäuse, oder einen Cocktail aus 10 mg/ml Ketamin, 1 mg/ml Xylazin bei 100-200 mg/kg (Ketamin) Körpergewicht). Schneiden Sie das Fell ab oder enthaaren Sie es gegebenenfalls. 0,5-1,0 mg/kg Buprenorphin ER (Retard) durch subkutane Injektion 30 Minuten vor Beginn des chirurgischen Eingriffs verabreichen.
- Positionieren Sie die betäubte Maus so, dass das Kissen unter dem Nacken liegt (Abbildung 1C). Das Kissen hilft, den Nacken zu strecken und zu stützen, wenn es mit dem Anästhesie-Nasenkonus verwendet wird. Wenn Sie den Ketamin-Xylazin-Cocktail verwenden, legen Sie eine beschwerte Zahnstange oder ein ähnliches Werkzeug hinter die Schneidezähne, um den Kopf zu neigen und den Hals zu verlängern.
- Fixieren Sie die Vordergliedmaßen mit dem chirurgischen Klebeband, das zuvor an den Seiten der Operationsliege angebracht wurde (Abbildung 1D). Passen Sie die Position der Maus unter dem Mikroskop so an, dass die ventrale Oberfläche des Halses sichtbar ist, und stellen Sie die Vergrößerung so ein, dass Sie die Operationsstelle bequem beobachten können (Abbildung 1E).
HINWEIS: Die Vergrößerung des Präpariermikroskops sollte vom Chirurgen bei jedem Schritt auf sein Komfortniveau eingestellt werden. - Tragen Sie künstliche Tränen mit einem sterilen Wattestäbchen auf. Desinfizieren Sie die Operationsstelle, indem Sie dreimal pro Desinfektionsmittel abwechselnd kreisförmige Tupfer von Betadin oder Chlorhexidin und Alkohol geben (Abbildung 1F).
- Bestätigen Sie die Tiefe der Anästhesie, indem Sie sicherstellen, dass die Maus ihr Bein nicht als Reaktion auf ein Zehenklemmen zurückzieht. Überwachen Sie die Atemfrequenz und stellen Sie sicher, dass die Maus nicht nach Luft schnappt, da dies ein Hinweis auf eine übermäßige Anästhesie bei der Verwendung von Isofluran ist. Passen Sie bei Bedarf die Sauerstoff- und Isofluran-Flussraten an, um eine angemessene Anästhesietiefe und gleichmäßige Atmung zu erreichen.
2. Chirurgischer Eingriff (Abbildung 2, Abbildung 3, Abbildung 4, Abbildung 5, Abbildung 6 und Abbildung 7)
- Primäre Inzision und Dissektion
- Beginnen Sie mit einem 1 cm langen Längsschnitt in der Mittellinie, der nur kranial bis zum Manubrium (hervorstehender Klumpen am kranialen Ende des Brustbeins) beginnt und über die Luftröhre mit einer sterilen Skalpellklinge oder einem ähnlichen Instrument gemäß den vom Benutzer genehmigten IACUC-Richtlinien fortfährt (Abbildung 2A).
- Führen Sie die Spitze der geschlossenen Schere in den Schnitt ein und öffnen Sie sie vorsichtig, um das Unterhautbindegewebe stumpf zu dissektionieren und die beiden Speicheldrüsen zu trennen. Ziehen Sie mit der feinen Pinzette die rechte Speicheldrüse vorsichtig durch den Schnitt, um auf der aseptisch vorbereiteten Hautoberfläche zu ruhen, oder ziehen Sie die Speicheldrüse mit dem stumpfen Hakenretraktor seitlich zurück (Abbildung 2B,C). Wenn die äußere Drüse trocken oder klebrig erscheint, befeuchten Sie sie mit steriler Kochsalzlösung.
- Fahren Sie mit der stumpfen Dissektion des Bindegewebes fort, bis die Muskeln sternocleidomastoideus und digastricus sichtbar sind (Abbildung 2D).
HINWEIS: Das muskuläre Dreieck, das aus dem Musculus trachea/sternohyoideus (sh), dem M. sternocleidomastoideus (sm) und dem Musculus digastricus (dg) (kaudaler Bauch) gebildet wird, wird verwendet, um die rechte CCA und die Bifurkation der Halsschlagader im Protokoll zu lokalisieren. Im Allgemeinen ist auch der kleinere Musculus omohyoid (oh) quer über den CCA zu sehen (Abbildung 2D); Dieser Muskel variiert jedoch in der Größe und es ist nicht ungewöhnlich, dass der Omohyoid-Muskel bei jungen oder kleinen Mäusen ganz fehlt.
- CCA-Isolierung
- Fahren Sie mit der abgewinkelten Pinzette mit der vorsichtigen Dissektion des Bindegewebes (durch Öffnen der Spitzen der Pinzette) in der Nähe des kaudalen Endes des Muskeldreiecks fort, um die Halsschlagader, die Halsvene und den Vagusnerv freizulegen.
HINWEIS: Die Arteria carotis communis ist das größte Blutgefäß neben der Luftröhre und kann im Allgemeinen an der Basis des muskulären Dreiecks leicht identifiziert werden (Abbildung 2E, Pfeil). Seien Sie äußerst vorsichtig mit den feinen Zangen um die Blutgefäße, da die Spitzen die Gefäße leicht einschneiden können, was zu übermäßigen und potenziell tödlichen Blutungen führt. - Fahren Sie mit der vorsichtigen Dissektion des Bindegewebes um den Teil der Arteria carotis communis von der Basis des muskulären Dreiecks bis zum Musculus omohyoidus fort. Verwenden Sie die kleinen, sterilen Wattebällchen, um kleinere Blutungen zu kontrollieren und bei Bedarf abgesonderte Flüssigkeiten aus den Speicheldrüsen aufzunehmen.
- Präparieren Sie vorsichtig das Bindegewebe, um den CCA vom Vagusnerv zu trennen. Achten Sie besonders darauf, die Handhabung und Schädigung des Vagusnervs zu minimieren, der leicht als das dicke, weiße Nervenbündel neben dem CCA identifiziert werden kann (Abbildung 2F).
- Fahren Sie mit der abgewinkelten Pinzette mit der vorsichtigen Dissektion des Bindegewebes (durch Öffnen der Spitzen der Pinzette) in der Nähe des kaudalen Endes des Muskeldreiecks fort, um die Halsschlagader, die Halsvene und den Vagusnerv freizulegen.
- CCA-Vorbereitung
- Sobald das CCA vollständig vom M. sternocleidomastoideus bis zum Musculus omohyoidus mobilisiert wurde, legen Sie ein 1 cm langes Stück 6-0-Naht auf die aseptisch vorbereitete Haut des Brustbeins der Maus (zur einfachen Entnahme) und führen Sie die Zange mit der abgewinkelten Spitze unter dem CCA durch (wobei darauf zu achten ist, dass CCA vom Vagusnerv und der Vena jugularis isoliert wird) (Abbildung 3A). Wenn der Musculus omohyoide nicht vorhanden ist, den Bereich um den CCA ausreichend reinigen, um Nähte am CCA kranial und kaudal zur vorgeschlagenen Injektionsstelle platzieren und die Nadel einführen zu können.
- Führen Sie mit der feinen Pinzette in der linken Hand die Naht an die abgewinkelte Pinzette und greifen Sie nahe dem Ende der Naht. Ziehen Sie mit der Zange mit der abgewinkelten Spitze vorsichtig die Hälfte der Länge der Naht unter die CCA (Abbildung 3B).
- Wiederholen Sie diesen Vorgang mit einer zweiten Naht, die parallel zur ersten Naht verläuft (Abbildung 3C).
- Binden Sie jede Naht locker um den CCA, aber ziehen Sie die Knoten nicht fest und schränken Sie den Blutfluss nicht ein (Abbildung 3D).
- Isolierung und Vorbereitung der Arteria carotis externa
- Entfernen Sie mit der abgewinkelten Pinzette vorsichtig das Bindegewebe am kranialen Ende des Muskeldreiecks, kranial zum Musculus omohyoideus, um das CCA und die Bifurkation in ECA und ICA zu lokalisieren (Abbildung 4A).
HINWEIS: Der ECA ist zur Mittellinie hin abgewinkelt und etwas oberflächlicher, während der ICA seitlich abgewinkelt ist und tiefer in den Hals hineinwandert. Achten Sie besonders darauf, dass der Nervus hypoglossus (HN), der den ICA direkt über der Bifurkation kreuzt, nicht beschädigt wird. - Entfernen Sie vorsichtig das Bindegewebe von allen Seiten der ECA in der Nähe der Bifurkation. Sobald genügend Bindegewebe von der ECA entfernt wurde, legen Sie ein Stück Naht auf die aseptisch vorbereitete Haut am Brustbein der Maus und führen Sie die Zange mit der abgewinkelten Spitze unter die ECA. Führen Sie mit der feinen Pinzette in der linken Hand die Naht an die abgewinkelte Pinzette im Raum zwischen ICA und ECA durch und ziehen Sie vorsichtig die Hälfte der Länge der Naht durch (Abbildung 4B). Binden Sie die Naht locker um die ECA, aber ziehen Sie den Knoten nicht fest.
HINWEIS: Es ist wichtig, dass genügend Bindegewebe aus der ECA entfernt wird, damit Sie die Naht mit der abgewinkelten Pinzette greifen können, ohne versehentlich auch das die Arterien umgebende Bindegewebe zu greifen, was zu Schäden an den Arterien führt, wenn die Naht gezogen wird.
- Entfernen Sie mit der abgewinkelten Pinzette vorsichtig das Bindegewebe am kranialen Ende des Muskeldreiecks, kranial zum Musculus omohyoideus, um das CCA und die Bifurkation in ECA und ICA zu lokalisieren (Abbildung 4A).
- Vorbereitung von Nadeln und Spritzen
HINWEIS: Für diesen Schritt kann die Injektion mit einer geraden Nadel durchgeführt werden, die es ermöglicht, dass die Spritze am Körper der Maus anliegt und von diesem stabilisiert wird (Abbildung 5A). Alternativ kann die Injektion mit einer Nadel durchgeführt werden, die in der Nähe der Spitze gebogen ist, so dass die Spritze wie ein Bleistift gehalten werden kann, während die Hand auf dem Operationstisch ruht (Abbildung 5B). Beide Techniken funktionieren gut, und die Wahl der Technik ist eine persönliche Vorliebe.- Um die gebogene Nadel vorzubereiten, halten Sie eine 33 G, 1/2 Zoll Nadel mit der Fase nach oben und fassen Sie die Spitze mit einem sterilen Nadeltreiber an (Abbildung 5C). Biegen Sie die Nadel ca. 30-40° direkt in Richtung der Fase (Abbildung 5D).
- Füllen Sie die Spritze mit dem entsprechenden Volumen der zu injizierenden Lösung (achten Sie darauf, den Hohlraum der Nadel zu berücksichtigen, wenn die Injektionslösung nicht durch die Nadel nach oben gezogen wird, um die Spritze zu laden). Befestigen Sie die Nadel und entfernen Sie alle Luftblasen. Stellen Sie sicher, dass der Meniskus der Lösung an der Abschrägung der Nadel sichtbar ist.
- Intrakarotis-Injektion
- Ziehen Sie den Knoten der Naht um die ECA fest. Schieben Sie dann die untere Naht am CCA so weit wie möglich nach unten in Richtung des Musculus sternocleidomastoideus und ziehen Sie den Knoten fest. Stellen Sie sicher, dass die obere Naht am CCA bis nach der Injektion locker bleibt. Legen Sie einen sterilen Wattebausch in den Rand der Kavität, um während der Injektion abgesonderte Flüssigkeit und Blut aufzunehmen.
- Halten Sie die Spritze in der rechten Hand und die feine Pinzette in der linken Hand und führen Sie die Nadel zur Arterie unmittelbar über der unteren Naht des CCA. Ziehen Sie mit der feinen Pinzette vorsichtig am losen Ende der unteren Naht in kaudaler Richtung, um eine geringe Spannung auf die CCA auszuüben (Abbildung 6A).
- Führen Sie die Nadel direkt hinter der Fase in den CCA ein und lösen Sie langsam die Spannung aus der Naht (Abbildung 6B).
HINWEIS: Die Arterie ist stark durchblutet und wird wahrscheinlich in die Operationshöhle bluten, wenn die Nadel eingeführt wird. Sobald die Nadel jedoch über die Fase hinaus eingeführt wird, bildet die Arterie eine Versiegelung um die Nadel und die Blutung hört auf. Anhaltende Blutungen mit platzierter Nadel deuten darauf hin, dass die Nadel nicht weit genug in die Arterie eingedrungen ist (der Spalt von der Abschrägung lässt Blut fließen) oder dass die Nadel durch den hinteren Teil der Arterie geschoben wurde. Es ist jetzt wichtig, die Nadel extrem ruhig zu halten, um zu verhindern, dass die Arterie reißt oder die Nadel herausrutscht. Kontinuierliche Überwachung von Tieren mit Blutungsereignissen, und wenn die Blutung signifikant ist (z. B. wenn ein Tier die Färbung verliert, zyanotisch erscheint, sich kühl anfühlt oder ein anderer humaner Endpunkt im Tierverwendungsprotokoll beschrieben wird), ist es notwendig, humane Endpunkte anzuwenden. - Drücken Sie mit der linken Hand auf den Spritzenkolben, um die Lösung sehr langsam zu injizieren (Abbildung 5B, mindestens 15 Sekunden, um 100 μl Lösung zu injizieren). Entfernen Sie die Nadel nicht, wenn Sie mit dem Injizieren der Lösung fertig sind. Um einen Rückfluss zu verhindern, fassen Sie mit der feinen Pinzette in der linken Hand die obere Naht am CCA (die noch locker gebunden ist) am Knoten und heben Sie sie an, um die Arterie zu knicken (Abbildung 6C).
- Entfernen Sie die Nadel, legen Sie die Spritze beiseite und nehmen Sie mit der rechten Hand eine Zange mit abgewinkelter Spitze auf. Halten Sie den Knick in der Arterie und ziehen Sie den Knoten in der oberen Naht des CCA fest (Abbildung 6D).
HINWEIS: Zu diesem Zeitpunkt sollte es keine weiteren Blutungen in die Operationshöhle geben. Nach diesem Schritt gibt es zwei alternative Vorgehensweisen, die in den Schritten 2.7 und 2.8 unten beschrieben sind. Wenn der CCA ligiert werden soll, befolgen Sie Schritt 2.7. Wenn das CCA an der Injektionsstelle repariert werden soll, befolgen Sie die in Schritt 2.8 aufgeführte Änderung.
- Ligation von CCA
- In Fällen, in denen die Durchblutung der CCA nicht wiederhergestellt werden muss, lassen Sie die Arterie ligiert und lassen Sie beide Nähte an der CCA festgezogen. Schneiden Sie die Nahtenden ab und vergewissern Sie sich, dass die Nahtknoten vollständig festgezogen sind.
- Fahren Sie mit den in Schritt 2.9 beschriebenen Verfahren zum Schließen und Analgesie fort.
- Alternative zur Ligatur der CCA-Injektionsstelle, Reparatur der Injektionsstelle und Wiederherstellung der Durchblutung
- Nehmen Sie mit sterilen Wattebällchen das restliche Blut in der Operationshöhle auf. Lokalisieren Sie die Injektionsstelle auf dem CCA (Abbildung 7A) und bestimmen Sie die Anzahl der Nähte, die zum Schließen erforderlich sind. Spülen Sie die Injektionsstelle und das Lumen des isolierten Bereichs des CCA gründlich, um geronnenes Blut zu entfernen.
- Fassen Sie die Nahtnadel 9-0 mit der abgewinkelten Pinzette am Nadelkörper in der Nähe des Swages. Während Sie die feine Pinzette verwenden, um die Arterie von der gegenüberliegenden Seite zu stützen, platzieren Sie eine einzelne Naht in der CCA, indem Sie die Arterienwand etwa 1-1,5 mm lateral der Injektionsstelle, senkrecht zur Arterie, durchdringen. Halten Sie die Arterie mit der feinen Pinzette, öffnen Sie die Injektionsstelle und führen Sie die Nadel und die Naht einzeln durch die rechte und linke Seite. Alternativ können Sie die Arterie festhalten, indem Sie die Seiten vorsichtig mit der feinen Pinzette zusammendrücken, die Nadel einführen und mit einem einzigen Biss durch beide Seiten der Arterie nähen.
HINWEIS: Achten Sie bei beiden Techniken darauf, dass die Nadel und die Naht nicht in die Rückwand im Inneren der Arterie eindringen, da dies das Lumen beim Festziehen verschließt. - Verschließen Sie die Injektionsstelle mit einem chirurgischen Knoten, indem Sie mit der feinen Pinzette und der abgewinkelten Pinzette mit mindestens vier Würfen ein Instrument binden (Abbildung 7B). Im Allgemeinen verwenden Sie eine einzige einfache unterbrochene Naht, um die Injektionsstelle einer 33-G-Nadel zu schließen.
- Um die Durchblutung mit der feinen Pinzette wiederherzustellen, lösen und entfernen Sie die Naht um die ECA, gefolgt von der oberen Naht an der CCA (Abbildung 7C,D). Lösen Sie anschließend langsam die untere Naht am CCA, aber lösen Sie sie nicht sofort. Vergewissern Sie sich, dass die Injektionsstelle ausreichend verschlossen ist, um schwere Blutungen bei wiederhergestelltem Blutdruck und Blutfluss zu verhindern (Abbildung 7D).
HINWEIS: Wenn an der Injektionsstelle größere Blutungen auftreten, kann die untere Naht am CCA schnell wieder festgezogen und die Injektionsstelle bei Bedarf angepasst oder neu vernäht werden. - Entfernen Sie die obere und untere CCA-Naht (Abbildung 7E). Fahren Sie mit Schritt 2.9 fort.
- Verschluss und Analgesie
- Positionieren Sie die Speicheldrüse in der Kavität neu und verschließen Sie den Schnitt mit drei einfachen unterbrochenen Nähten mit einer sterilen Nahtpackung. Entfernen Sie das chirurgische Klebeband und lassen Sie die Maus sich auf einem Heizkissen von der Narkose erholen.
HINWEIS: Folgedosen von Analgetika sollten entsprechend der Häufigkeit und Dosis verabreicht werden, die im genehmigten IACUC-Protokoll des Benutzers angegeben sind. Es wird eine Heilungsdauer von einer Woche zwischen den Injektionen empfohlen. Wenn wiederholte Injektionen erforderlich sind, kann nach der ersten Injektion eine Reparatur der Injektionsstelle durchgeführt werden, und bei nachfolgenden Injektionen kann das gleiche chirurgische Verfahren befolgt werden. Die anschließende Injektion kann in den CCA-Schädel an der reparierten Injektionsstelle verabreicht werden, da wiederholtes Nähen zur Reparatur derselben Injektionsstelle wahrscheinlich zu Narbenbildung und Blutgerinnseln führt.
- Positionieren Sie die Speicheldrüse in der Kavität neu und verschließen Sie den Schnitt mit drei einfachen unterbrochenen Nähten mit einer sterilen Nahtpackung. Entfernen Sie das chirurgische Klebeband und lassen Sie die Maus sich auf einem Heizkissen von der Narkose erholen.
Ergebnisse
Frühere Berichte haben gezeigt, dass aus dem Knochenmark gewonnene humane mesenchymale Stammzellen (BM-hMSCs), die durch Intrakarotis-Injektion verabreicht wurden, erfolgreich in intrakraniellen Gliomen bei Mäusen untergebracht wurden19. Wir verwendeten dieses Modell, um die Effekte der CCA-Ligation mit der CCA-Reparatur mit wiederhergestellter Durchblutung nach intrakarotiser Injektion von BM-hMSCs bei gliomtragenden Mäusen zu vergleichen. Athymen Nacktmäusen wurden U87-Gliomzellen implantiert, gefolgt von der Injektion von GFP-markierten BM-hMSCs mit anschließender CCA-Ligation oder CCA-Reparatur mit wiederhergestellter Durchblutung. Nach 3 Tagen wurden Mäuse getötet und Gehirne entnommen, fixiert und eine Immunhistochemie zum Nachweis von GFP durchgeführt, und GFP-positive Zellen wurden gezählt (Abbildung 8A-D).
Das Gesamthoming von GFP-BM-hMSCs zu intrakraniellen Gliomen wurde anhand der Gesamtzahl der GFP-positiven Zellen innerhalb der Tumorgrenze auf zwei verschiedenen Objektträgern (Schnitte >75 μm Abstand) aus derselben Probe untersucht. Der Vergleich der Mittelwerte mittels ungepaartem t-Test deutete darauf hin, dass es keinen signifikanten Unterschied zwischen dem zwischen den beiden Verfahren beobachteten mittleren Homing gab (P = 0,6858) (Abbildung 8E). Die Verteilung von GFP-BM-hMSCs im Tumor wurde durch Zählung von GFP-positiven Zellen über 10 Hochleistungsfelder innerhalb des Tumors untersucht. Erhöhte Zellzahlen in Hochleistungsfeldern können auf Veränderungen in der Dispersion der Zellen im gesamten Tumor hinweisen, die sich aus der Variation des Verfahrens ergeben. Der Vergleich der Medianwerte mit Hilfe des Wilcoxon-Vorzeichen-Rang-Tests zeigte, dass es keinen signifikanten Unterschied zwischen der medianen Anzahl von GFP-positiven Zellen in Hochleistungsfeldern zwischen CCA-Ligation und CCA-Reparaturgruppen gab (Abbildung 8F).

Abbildung 1: Vorbereitung des Operationstisches und der Maus für die Operation. (A,B) Operationsbett (Etiketten A. Vinylband, das das Bett bildet, B. Chirurgisches Klebeband für die Vordergliedmaßen, C. Kissen, D. Gewicht, E. Anästhesie-Nasenkonus, F. Stumpfer Hakenretraktor, G. 1 cm lange Nähte aus 70%igem Ethanol, H. Feine Pinzette, I. Zange mit abgewinkelter Spitze, J. Schmale Schere, K. Sterile Wattebällchen). (C,D) Positionieren der Maus. (E,F) Operationsstelle und Desinfektion der Operationsstelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
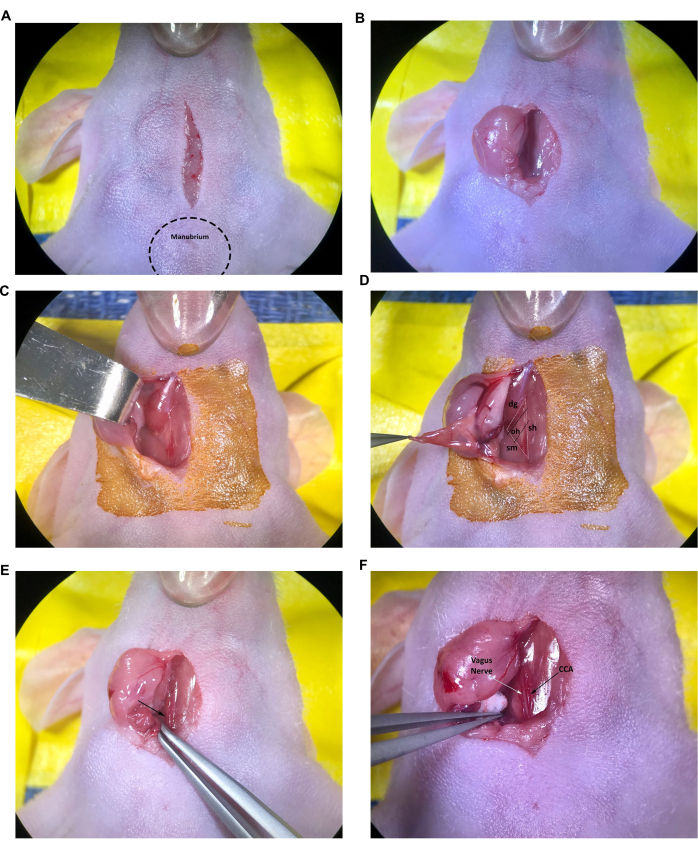
Abbildung 2: Inzision und Freilegung von Strukturen an der Injektionsstelle. (A) Inzision in der Mittellinie. (B,C) Retraktion der rechten Speicheldrüse. (D) Das muskuläre Dreieck, das aus dem Luftröhren-/Sternohyoideus-Muskel, dem Musculus sternocleidomastoideus und dem Musculus digastricus gebildet wird, ist ebenfalls sichtbar. (E) Arteria carotis communis, gekennzeichnet durch den Pfeil. (F) Nervus vagusis und Arteria carotis communis, gekennzeichnet durch die Pfeile. Abkürzungen: sh = Luftröhre/M. sternohyoideus; sm = M. sternocleidomastoideus; dg = Musculus digastricus; OH = Musculus omohyoidus; CCA = Arteria carotis communis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
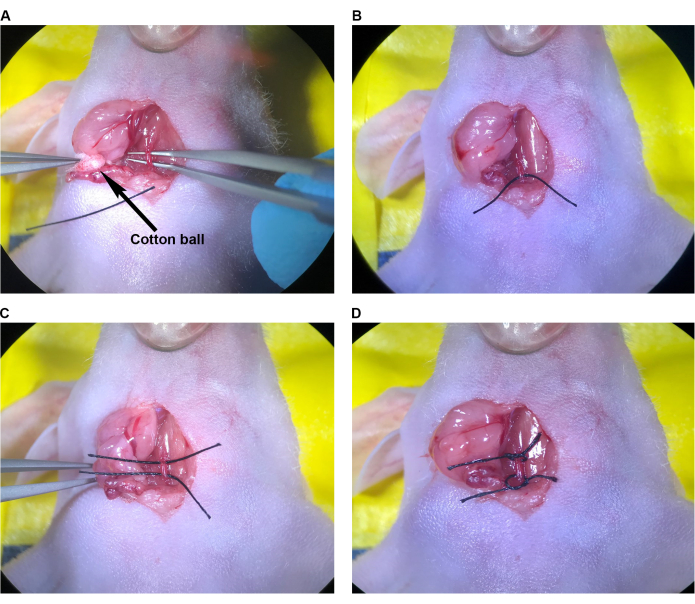
Abbildung 3: Vorbereitung der CCA für die Injektion. (A) Zange mit abgewinkelter Spitze, die unter der CCA geführt wird. (B) Die Naht wurde mit einer Zange mit abgewinkelter Spitze halb unter die CCA gezogen. (C) Die zweite Naht wurde zur Hälfte unter die CCA gezogen. (D) Vernäht, gebunden in losen Kenntnissen rund um das CCA. Abkürzung: CCA = Arteria carotis communis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
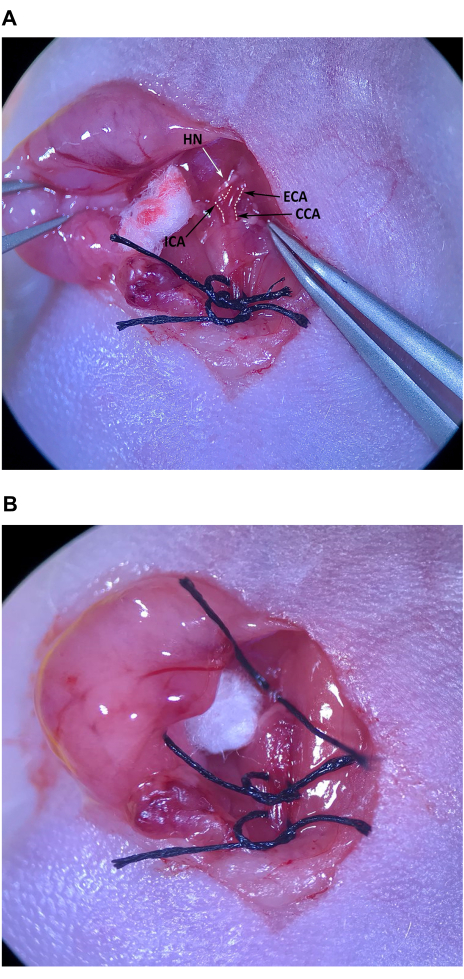
Abbildung 4: Isolierung und Vorbereitung der Arteria carotis externa. (A) CCA, Arteria carotis externa und Arteria carotis interna. (B) Die Naht wird nach der Hälfte unter dem ECA gezogen. Abkürzungen: CCA Arteria carotis communis; ECA = Arteria carotis externa; ICA = Arteria carotis interna. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
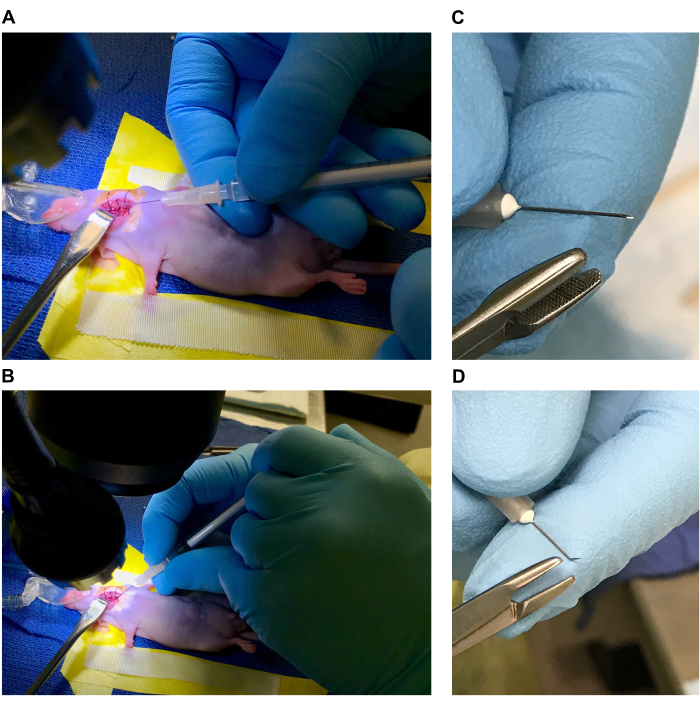
Abbildung 5: Vorbereitung von Nadel und Spritze. (A) Injektion mit einer geraden Nadel, wobei eine Spritze am Körper der Maus anliegt. (B) Injektion mit einer gebogenen Nadel, wobei eine Hand auf dem Operationstisch ruht. (C,D) Vorbereiten einer gebogenen Nadel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
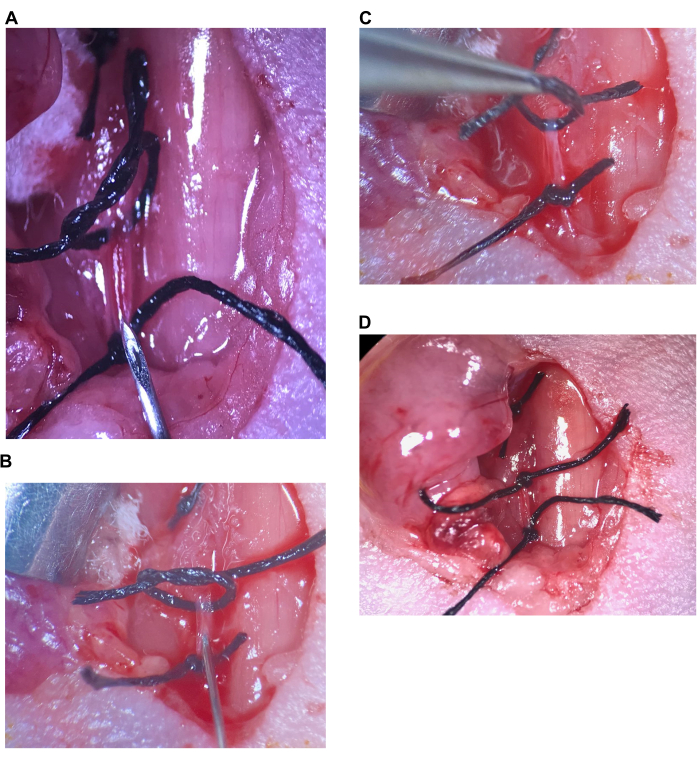
Abbildung 6: Intrakarotis-Injektion. (A) Die obere Naht ist locker, die untere Naht wird auf dem CCA festgezogen, die Nadel wird über der unteren Naht platziert. (B) Die Nadel wird direkt hinter der Fase eingeführt, die Arterie wird um die Nadel herum verschlossen. (C) Die obere Naht wird angehoben, um die Arterie nach oben zu knicken und einen Rückfluss zu verhindern. (D) Die obere Naht an der CCA wird festgezogen. Abkürzung: CCA = Arteria carotis communis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
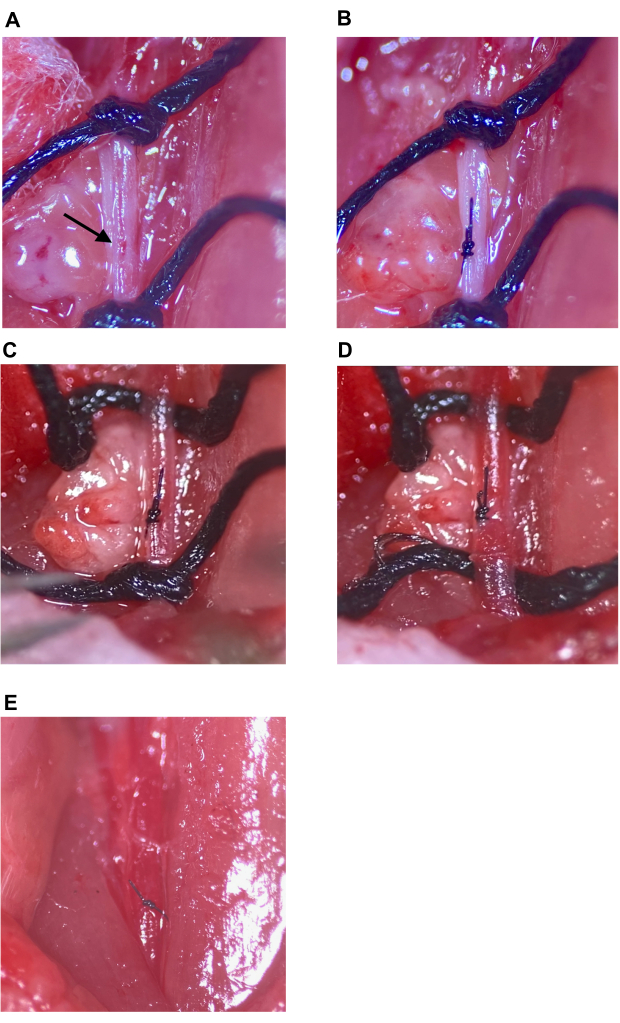
Abbildung 7: Reparatur der Injektionsstelle und Wiederherstellung der Durchblutung. (A) Die Injektionsstelle ist mit einem Pfeil gekennzeichnet. (B) Die Injektionsstelle wird mit einem chirurgischen Knoten verschlossen, mindestens vier Würfe. (C,D) Lockerung der oberen und unteren Nähte an der CCA nach der Reparatur der Injektionsstelle; Keine Blutung nach Lockerung der Naht. (E) Die Nähte werden entfernt, nachdem festgestellt wurde, dass die Injektionsstelle ausreichend repariert ist. Abkürzung: CCA = Arteria carotis communis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
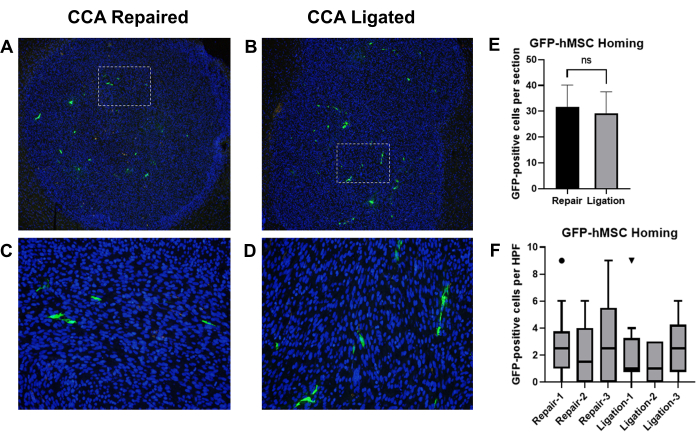
Abbildung 8: Intrakarotis-Injektion von GFP-BM-hMSCs und Vergleich des Homings mit intrakraniellen Gliomtumoren nach entweder CCA-Ligatur oder CCA-Reparatur mit wiederhergestellter Durchblutung. Hirngewebeschnitte von tumortragenden Mäusen wurden mit Anti-GFP-Primär- und Alexa Fluor 488-Sekundärantikörpern gefärbt, um GFP-BM-hMSCs zu markieren (grün). Die Zellkerne wurden mit Hoechst 33342 (blau) angefärbt. Repräsentative Low-Power-Felder von markierten Schnitten, die das Gesamt-Homing zum Tumor zeigen, und High-Power-Felder, die eine GFP-positive Zellverteilung nach (A,C) CCA-Reparatur oder (B,D) CCA-Ligation zeigen. (E) Das Gesamthoming von GFP-BM-hMSCs zu Tumoren wurde anhand der Gesamtzahl der GFP-positiven Zellen innerhalb der Tumorgrenze auf zwei verschiedenen Objektträgern bewertet und die Mittelwerte wurden mittels t-Test verglichen. Es wurde kein signifikanter Unterschied im gesamten Homing zwischen den alternativen Verfahren beobachtet (P = 0,6858). (F) Die Verteilung von GFP-BM-hMSCs im Tumor wurde durch Zählung von GFP-positiven Zellen über 10 Hochleistungsfelder innerhalb des Tumors untersucht. Der Vergleich der Medianwerte durch den Wilcoxon-Vorzeichen-Rang-Test zeigt keinen signifikanten Unterschied zwischen den Individuen, unabhängig vom Verfahren (P = 0,1914, 0,5000, 0,1641, 0,9512, 0,8828, 0,2207). Abkürzungen: GFP = grün fluoreszierendes Protein; GFP-BM-hMSCs = GFP-markierte humane mesenchymale Stammzellen aus dem Knochenmark; CCA = Arteria carotis communis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Intrakarotis-Injektionen wurden in den letzten Jahren zunehmend eingesetzt, um Hirntumoren Therapeutika zuzuführen. Daher ist es wichtig, Mausmodelle zu etablieren, die die intrakarotisfarbene Arterieninjektion beim Menschen für Forschungszwecke widerspiegeln. Früher wurden intrakarotisartige Injektionen bei Mäusen mit anschließender Ligatur der Arterie durchgeführt, was die Anzahl der Injektionen in die Arterie begrenzt11,12. Darüber hinaus kann ein Verschluss der Halsschlagader bei Mäusen bei bestimmten Mausstämmen, die keinen vollständigen Circle of Willis13 aufweisen, zu zerebraler Ischämie führen. Wir haben eine Methode zur Reparatur der injizierten Halsschlagader entwickelt, um die Einschränkungen früherer Methoden zu überwinden. Die Reparatur der Injektionsstelle führt zur Wiederherstellung des Blutflusses zur injizierten Arterie, wodurch die Wahrscheinlichkeit einer zerebralen Ischämie verringert und nachfolgende Injektionen in dieselbe Arteria carotis interna erleichtert werden.
Mehrere Schritte, die für den Erfolg entscheidend sind, erfordern einen sorgfältigen Umgang mit chirurgischen Instrumenten oder Gewebe, darunter: korrektes Einführen der Nadel in das Lumen der Arterie, um Blutungen während der Intrakarotis-Injektion zu vermeiden; sorgfältige Dissektion des Bindegewebes von der Injektionsstelle vor dem Einstechen der Nadel; Entfernung aller Klumpen und Luftblasen in der Spritze und der Nadel vor der Injektion; und korrekter Verschluss der Injektionsstelle, um ein Schließen des Lumens der Arterie während der Reparatur zu verhindern. Um Blutungen nach dem Einführen der Nadel zu vermeiden, stellen Sie sicher, dass die Nadel hinter der Fase in die Arterie eingeführt wird, um eine Abdichtung um den Nadelschaft zu bilden. Um einen Riss in der Rückwand der Arterie zu vermeiden, führen Sie die Nadel in einem flachen Winkel ein und bewegen Sie die Spritze und die Nadel leicht nach hinten, um die Nadelspitze von der arteriellen Rückwand fernzuhalten. Wenn die injizierte Lösung während der Injektion austritt, deutet dies darauf hin, dass die Nadel nur in das die Arterie umgebende Bindegewebe eingeführt wurde. Eine sorgfältige Dissektion des überschüssigen Bindegewebes von der Injektionsstelle vor der Injektion verhindert dieses Problem.
Was die Wahl der Naht- und Verschlusstechnik betrifft, so ist bei der ersten Injektion mit einer 33-G-Nadel und einem sauberen Einstich in die Arterie eine einfache Naht mit 9-0 Naht ausreichend, um die Arterie zu reparieren. Wenn eine größere Nadel für die Injektion verwendet wird (30 G usw.) oder beim Einführen der Nadel ein Reißen auftritt (z. B. wenn die Nadel nicht zentriert ist oder sich die Arterie bewegt, weil die Maus atmet), führt dies zu einem etwas größeren Loch, das repariert werden muss. Zwei einfache Nähte oder eine Acht reichen in der Regel aus, um diese Art von größerem Loch zu reparieren. Die Wahl zwischen diesen beiden Techniken basiert auf der Präferenz des Chirurgen in dieser Situation. Es ist wichtig zu beachten, dass die Reparaturtechnik in Situationen, in denen das Loch an der Injektionsstelle deutlich größer ist als in der oben genannten Situation, nicht bewertet wurde. Wenn sich der Riss an der Injektionsstelle seitlich ausdehnt (wodurch ein breiteres Loch entsteht, das mehr als ein Drittel des Umfangs der Arterie beträgt), kann die Reparatur mit dieser Methode zu einer Kontraktion der Arterie und einem erhöhten Thromboserisiko führen.
Wenn es beim Entfernen der Nähte zu Blutungen aus der reparierten Injektionsstelle kommt, kann dies auf die Dehnung der reparierten Stelle zurückzuführen sein, wenn die normale Durchblutung wieder aufgenommen wird. Dies kann behoben werden, indem die reparierte Injektionsstelle vorsichtig mit steriler Watte abgedeckt und 30 s lang leichter Druck ausgeübt wird. Wenn es alternativ zu Blutungen aus der reparierten Injektionsstelle ohne sichtbaren Blutfluss und einer proximalen aufgeblähten Arterie kommt, deutet dies darauf hin, dass die Nahtnadel während der Reparatur durch die Rückwand der Arterie geführt wurde. Öffnen Sie in diesem Fall während der Reparatur vorsichtig die Ränder der Injektionsstelle, führen Sie die Nahtnadel in einem flachen Winkel durch die Arterie und vergewissern Sie sich visuell, dass die Naht nicht durch die Rückwand gegangen ist, bevor Sie den Nahtknoten binden.
Mit diesen Maßnahmen ist die Methode der Reparatur an der Injektionsstelle präzise und wiederholbar für alle Tierkohorten, unabhängig von genetischem Hintergrund oder Alter. Unserer Erfahrung nach lag die Erfolgsquote bei 100%, wobei drei verschiedene Chirurgen den Eingriff durchführten. Mit ausreichender Erfahrung und sorgfältiger Befolgung des bereitgestellten Protokolls sehen wir keine Schwierigkeiten für andere Chirurgen, diesen Eingriff durchzuführen. Mit etwas Übung kann ein erfahrener Chirurg den Eingriff in 15-20 Minuten abschließen. Wenn das Experiment es zulässt, kann die Zeit pro Tier auch verkürzt werden, indem die oberen und unteren CCA-Nähte intakt bleiben und auf eine Reparatur der Injektionsstelle verzichtet wird. Wie oben erwähnt, wurden jedoch stammspezifische Unterschiede in der zerebralen Gefäßanatomie dokumentiert, und es ist wichtig, vor Beginn des Experiments zu überprüfen, ob der Stamm der Maus, der in dem Verfahren verwendet wird, dies tolerieren kann.
Da es sich um einen chirurgischen Eingriff handelt, muss die Genesung der Mäuse berücksichtigt werden. Stresstoleranz und Wunderholung sind wichtige Überlegungen, die je nach Mausstamm variieren. Darüber hinaus können Entzündungen an der Operationsstelle und die Bildung von Narbengewebe die Genesungszeit nach wiederholten Operationen verlängern. Wir haben erfolgreich mehrere Injektionen im Abstand von 7 Tagen durchgeführt, aber wenn häufigere Injektionen erforderlich sind, sollten diese in den spezifischen Mausstämmen, die verwendet werden sollen, sorgfältig bewertet werden. Gewaltsame Handhabung und Belastung des CCA (während der Isolierung, des Bindens und Entfernens von Nähten und der Injektion) können die Arterienwände schädigen und schwächen, was bei wiederholten Injektionen zu Rissen führt. Es ist wichtig, die Dissektion des stützenden Bindegewebes um die CCA und die Bifurkation herum zu minimieren und keine übermäßige Spannung auf die Arterie auszuüben.
Unsere Ergebnisse deuten darauf hin, dass sich in diesem speziellen Modell die CCA-Ligation oder die CCA-Reparatur mit wiederhergestellter Durchblutung nach der Injektion nicht in der Gesamthäufigkeit des Homings oder der Verteilung der injizierten BM-hMSCs über intrakranielle Tumoren unterscheiden. Während dies bei verschiedenen Mausstämmen unterschiedlich sein kann, bietet die Verwendung der Reparatur an der Injektionsstelle den Vorteil, dass der Blutfluss zur injizierten Arterie zurückgeführt wird, was nachfolgende Injektionen in dieselbe Arterie ermöglicht und vor allem den Injektionen der intrakarotisartigen Arterie bei menschlichen Patienten ähnelt. Die Wahl der Ligatur oder der Reparatur der injizierten Arterie hängt von der Art des Experiments und dem verwendeten Mausmodell ab. Wenn eine zweite Injektion erforderlich ist oder wenn das Mausmodell nicht über einen vollständigen Willis-Circle verfügt, sollte eine Reparatur an der Injektionsstelle durchgeführt werden. Die Möglichkeit, das CCA in Mausmodellen wieder zu injizieren, kann zusätzliche experimentelle Manipulationen erleichtern. Um beispielsweise mehrere Dosen eines potenziellen Therapeutikums zu testen, das im Laufe der Zeit verabreicht wird, ist die Reparatur der injizierten Arterie unerlässlich, um nachfolgende Injektionen durchzuführen. Diese Methode wäre auch nützlich in Experimenten, bei denen Kombinationen von Therapeutika injiziert werden, die zu unterschiedlichen Zeitpunkten injiziert werden müssen. Die erhöhte Flexibilität bei Intrakarotis-Injektionen, die durch die Reparatur der injizierten Arterie ermöglicht wird, verbessert den translationalen Nutzen von Maus-Hirntumormodellen.
Offenlegungen
Die Autoren haben keine relevanten Offenlegungen/Interessenkonflikte.
Danksagungen
Diese Studie wurde durch Zuschüsse des National Cancer Institute (R01CA115729, R01CA214749 und 1P50 CA127001) und durch die großzügigen philanthropischen Spenden an das MD Anderson Cancer Center Moon Shots Program™ der University of Texas, die Broach Foundation for Brain Cancer Research, den Elias Family Fund for Brain Tumor Research, den Priscilla Hiley Cancer Research Fund, den Bauman Family Curefest Brain Cancer Research Fund, Chuanwei Lu Fund, The Sweet Family Brain Cancer Research Fund, The Ira Schneider Memorial Cancer Research Foundation, The Jim & Pam Harris Fund, The Gene Pennebaker Fund for Brain Cancer Research, The Sorenson Fund for Brain Tumor Research, The Brian McCulloch Memorial Fund, The TLC Foundation from the Heart und der Mary Harris Pappas Endowed Fund for Glioblastoma Research, alles an F.F.L.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL syringes (low dead space) | Air-tite Products Co. | A1 | |
| 26 G; 1/2" needle | Air-tite Products Co. | N2612 | |
| 33 G; 1/2" needle | JBP, Air-tite Products Co. | JBP3313B | |
| 3 cm Petri dish | Falcon, Fisher Scientific | 08-772A | |
| 3M durapore surgical tape | Fisher Scientific | 19-071-152 | |
| 6-0 suture thread | Fine Science Tools | 18020-60 | |
| 70% Ethanol | Fisher Scientific | 04-355-122 | |
| 9-0 microsurgical suture with needle | Fine Science Tools | 12052-09 | |
| Analgesic for major surgery | |||
| Artificial tears/ophthalmic ointment | Covetrus | 8897 | |
| Bead Sterilizer | Fisher Scientific | 14-955-341 | |
| Betadine/Chlorhexidine | McKesson, Fisher Scientific | NC1696484 | |
| Blunt hook retractor | Fine Science Tools | 17022-13 | |
| Dissecting microscope | Zeiss Microscopy, LLC | 491903-0010-000 | |
| Electric heating pad | Insource, Fisher Scientific | NC0667724 | |
| Extra narrow scissors | Fine Science Tools | 14088-10 | |
| Fine forceps - Dumont #5 forceps with micro-blunted tips | Fine Science Tools | 11253-20 | |
| Fine forceps - Dumont #5/45 angled tip forceps with micro-blunted tips | Fine Science Tools | 11253-25 | |
| Isoflurane vaporizer (or Ketamine/Xylazine cocktail) | Kent Scientific | VetFlo-1231 | |
| Light source | Laxco, Fisher Scientific | AMPSILED21 | |
| Mouse anesthesia nose cone | Braintree Scientific, Inc | XENO- M | |
| Needle driver | Fine Science Tools | 12002-12 | |
| Sterile cotton swabs | Texwipe, Fisher Scientific | 18-366-472 | |
| Sterile gauze pads | Covidien, Fisher Scientific | 22-037-907 | |
| Sterile saline (0.9%) | KD Medical, Fisher Scientific | 50-103-1363 | |
| Sterile surgical drapes | Fisher Scientific | 50-129-6666 | |
| Sterile surgical/downdraft table | |||
| Sterile suture pack (any suitable diameter for mouse wound closure) | Ethicon, Fisher Scientific | 50-209-2811 | |
| Surgical tools | |||
| Vinyl lab tape | Fisher Scientific | 15-901 |
Referenzen
- Loya, J., Zhang, C., Cox, E., Achrol, A. S., Kesari, S. Biological intratumoral therapy for the high-grade glioma part i: Intratumoral delivery and immunotoxins. CNS Oncol. 8 (3), (2019).
- Garfield, J., Dayan, A. D. Postoperative intracavitary chemotherapy of malignant gliomas. A preliminary study using methotrexate. J Neurosurg. 39 (3), 315-322 (1973).
- Kroin, J. S., Penn, R. D. Intracerebral chemotherapy: Chronic microinfusion of cisplatin. Neurosurgery. 10 (3), 349-354 (1982).
- Sendelbeck, S. L., Urquhart, J. Spatial distribution of dopamine, methotrexate and antipyrine during continuous intracerebral microperfusion. Brain Res. 328 (2), 251-258 (1985).
- Alter, R. A., et al. Long-term benefit of intra-arterial bevacizumab for recurrent glioblastoma. J Exp Ther Oncol. 12 (1), 67-71 (2017).
- Angelov, L., et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary cns lymphoma: A multi-institutional experience. J Clin Oncol. 27 (21), 3503-3509 (2009).
- Chen, S. R., Chen, M. M., Ene, C., Lang, F. F., Kan, P. Perfusion-guided endovascular super-selective intra-arterial infusion for treatment of malignant brain tumors. J Neurointerv Surg. 14 (6), 533-538 (2022).
- Faltings, L., et al. Rechallenging recurrent glioblastoma with intra-arterial bevacizumab with blood brain-barrier disruption results in radiographic response. World Neurosurg. 131, 234-241 (2019).
- Srinivasan, V. M., et al. Advances in endovascular neuro-oncology: Endovascular selective intra-arterial (esia) infusion of targeted biologic therapy for brain tumors. J Neurointerv Surg. 12 (2), 197-203 (2020).
- Shinojima, N., et al. Tgf-β mediates homing of bone marrow-derived human mesenchymal stem cells to glioma stem cells. Cancer Res. 73 (7), 2333-2344 (2013).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of visualized experiments : JoVE. (120), e55085 (2017).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Benbenishty, A., et al. Maintaining unperturbed cerebral blood flow is key in the study of brain metastasis and its interactions with stress and inflammatory responses. Brain, behavior, and immunity. 62, 265-276 (2017).
- Doucette, T., et al. Mesenchymal stem cells display tumor-specific tropism in an rcas/ntv-a glioma model. Neoplasia. 13 (8), 716-725 (2011).
- Hata, N., et al. Platelet-derived growth factor bb mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 66 (1), 144-156 (2010).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 65 (8), 3307-3318 (2005).
- Qiao, Y., et al. Magnetic resonance and photoacoustic imaging of brain tumor mediated by mesenchymal stem cell labeled with multifunctional nanoparticle introduced via carotid artery injection. Nanotechnology. 29 (16), 165101 (2018).
- Yong, R. L., et al. Human bone marrow-derived mesenchymal stem cells for intravascular delivery of oncolytic adenovirus delta24-rgd to human gliomas. Cancer Res. 69 (23), 8932-8940 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten