Method Article
Facilitare la ripetizione delle iniezioni intracarotidei in modelli murini mediante una nuova tecnica di riparazione del sito di iniezione
In questo articolo
Riepilogo
La riparazione dell'arteria intracarotide in un modello murino dopo l'iniezione restituisce il flusso sanguigno all'arteria senza influire negativamente sulla distribuzione del materiale iniettato. La riparazione del sito di iniezione facilita le iniezioni successive attraverso la stessa arteria e previene l'ischemia cerebrale nei ceppi di topo privi di un Circle of Willis completo.
Abstract
Dati i recenti progressi nella somministrazione di nuove terapie antitumorali utilizzando metodi di somministrazione intraarteriosa selettiva endovascolare in neuro-oncologia, vi è un urgente bisogno di sviluppare metodi per iniezioni intracarotidei in modelli murini, compresi metodi per riparare l'arteria carotide nei topi dopo l'iniezione per consentire le iniezioni successive. Abbiamo sviluppato un metodo di iniezione intracarotidea in un modello murino per somministrare terapie nell'arteria carotide interna (ICA) con due procedure alternative.
Durante l'iniezione, l'ago viene inserito nell'arteria carotide comune (CCA) dopo aver legato una sutura attorno all'arteria carotide esterna (ECA) e le terapie iniettate vengono somministrate nell'ICA. Dopo l'iniezione, l'arteria carotide comune (CCA) può essere legata, il che limita il numero di iniezioni intracarotidei a una. La procedura alternativa descritta in questo articolo include una modifica in cui l'iniezione intracarotidea dell'arteria è seguita dalla riparazione del sito di iniezione del CCA, che ripristina il flusso sanguigno all'interno del CCA ed evita la complicanza dell'ischemia cerebrale osservata in alcuni modelli murini.
Abbiamo anche confrontato la somministrazione di cellule staminali mesenchimali umane derivate dal midollo osseo (BM-hMSC) con i tumori intracranici quando somministrate attraverso iniezione intracarotidea con e senza riparazione del sito di iniezione dopo l'iniezione. La somministrazione di BM-hMSC non differisce in modo significativo tra i metodi. I nostri risultati dimostrano che la riparazione del CCA nel sito di iniezione consente iniezioni ripetute attraverso la stessa arteria e non compromette la consegna e la distribuzione del materiale iniettato, fornendo così un modello con una maggiore flessibilità che emula più da vicino l'iniezione intracarotidea nell'uomo.
Introduzione
La somministrazione di terapie ai tumori cerebrali è impegnativa a causa dell'impermeabilità della barriera emato-encefalica (BBB) e della barriera emato-tumorale (BTB). L'iniezione intratumorale diretta di terapie per eludere la BBB può essere ottenuta attraverso l'uso di un catetere serbatoio Ommaya, una microinfusione a basso flusso per la somministrazione potenziata da convezione o un'iniezione locale nella cavità di resezione o nel tessuto adiacente1. Tuttavia, il volume totale di tessuto tumorale che viene raggiunto con questi metodi è limitato 2,3,4. Le iniezioni intraarteriose sono state utilizzate in precedenza per somministrare agenti terapeutici ai tumori cerebrali con l'obiettivo di raggiungere una parte maggiore del tumore 5,6,7,8 e in tempi recenti, i progressi sia nelle tecniche di somministrazione intraarteriosa che nei nuovi agenti terapeutici hanno dimostrato il vantaggio dell'utilizzo di questo approccio nel trattamento dei tumori cerebrali7, 9. Questi progressi includono lo sviluppo di microcateteri, la somministrazione endovascolare selettiva intraarteriosa (ESIA) con imaging avanzato, l'uso di agenti osmotici per interrompere la BBB e il BTB e lo sviluppo di terapie biologiche mirate. Pertanto, per condurre test preclinici di nuovi agenti terapeutici somministrati tramite iniezioni intraarteriose, sono necessari appropriati modelli di ricerca traslazionale 9,10.
Nei modelli murini di tumori cerebrali, gli agenti terapeutici somministrati per via intraperitoneale o endovenosa (attraverso la vena caudale) passano rispettivamente attraverso il fegato o il cuore e i polmoni, prima di essere distribuiti a tutto il corpo, compreso il cervello. Questi effetti di primo passaggio possono intrappolare e rimuovere l'agente, o diluire l'agente prima di raggiungere il cervello, e possono presentare tossicità dose-limitanti prima di raggiungere una dose terapeutica nel cervello. Al contrario, l'iniezione intracarotidea dell'arteria consente una consegna mirata al cervello prima della circolazione, bypassando il metabolismo di primo passaggio e limitando la consegna fuori bersaglio. Sebbene l'iniezione intracarotidea nei topi sia più laboriosa, la specificità e la riproducibilità della tecnica si traducono in una riduzione del numero di animali per completare le indagini11,12.
In generale, nei metodi precedentemente descritti di iniezione intracarotidea nell'arteria carotide nei topi, l'arteria carotide comune viene legata dopo l'iniezione e la circolazione al cervello è fornita dall'arteria carotide controlaterale e dalla circolazione cerebrale posteriore attraverso il circolo di Willis11,12. Questo metodo ha il limite intrinseco di consentire solo un massimo di una singola iniezione nell'arteria carotide interna o esterna. È anche fondamentale che i ceppi di topo utilizzati negli esperimenti in cui l'arteria carotide è legata abbiano un cerchio di Willis completo per prevenire l'ischemia cerebrale dovuta all'arteria legata13. È stato anche dimostrato che l'occlusione dell'arteria carotide riduce il flusso sanguigno cerebrale e limita la distribuzione delle particelle iniettate14. Inoltre, l'occlusione dell'arteria carotide nei topi dopo l'iniezione non emula l'iniezione intracarotidea nell'arteria carotide nei pazienti umani.
Il nostro gruppo ha precedentemente utilizzato iniezioni intracarotidi nell'arteria per fornire con successo cellule staminali mesenchimali al cervello 10,15,16,17,18,19. In questo articolo, descriviamo in dettaglio questo metodo di iniezione intracarotidea dell'arteria carotide e includiamo una modifica del metodo che abbiamo sviluppato, in cui il sito di iniezione viene riparato senza occludere l'arteria, evitando le limitazioni poste dalla legatura dell'arteria carotide post-iniezione. In questo metodo, l'arteria carotide comune (CCA) viene preparata per l'iniezione posizionando due suture, una alle due estremità del sito di iniezione previsto, e la sutura inferiore (sotto il sito di iniezione) viene stretta. L'arteria carotide esterna (ECA) viene sigillata utilizzando un'altra sutura. L'ago viene inserito nel CCA e le terapie vengono somministrate nell'arteria carotide interna (ICA). Successivamente, la sutura superiore del CCA viene stretta per evitare il riflusso dall'ICA. In questa fase, il CCA iniettato può essere legato o riparato. Se il CCA deve essere legato, le suture vengono strette e lasciate in posizione. Se il sito di iniezione viene riparato, le suture vengono rimosse dopo la riparazione e il flusso sanguigno viene ripristinato. I dettagli di queste procedure alternative sono forniti di seguito.
Protocollo
Tutti i passaggi descritti di seguito sono conformi al nostro protocollo, che segue le linee guida stabilite e approvate dal Comitato istituzionale per la cura e l'uso degli animali presso l'MD Anderson Cancer Center dell'Università del Texas.
1. Preparazione del tavolo operatorio e del mouse per la procedura chirurgica
- Preparazione del tavolo operatorio e del mouse per la procedura chirurgica (fare riferimento alla Figura 1A, B)
- Disporre il microscopio da dissezione e la fonte di luce davanti al vaporizzatore di isoflurano con un sistema di lavaggio attivo o posizionarlo su un tavolo discendente. Posizionare il termoforo elettrico sulla base del microscopio da dissezione (o preferibilmente sotto il microscopio se la base è solida e può trasmettere calore) e coprire con un telo chirurgico sterile.
NOTA: Tutti gli strumenti chirurgici e i teli devono essere sterilizzati in autoclave prima dell'uso e tutti i prodotti monouso devono essere sterili e confezionati singolarmente. I guanti sterili devono essere utilizzati durante l'installazione e la procedura e sostituiti quando necessario per mantenere la sterilità. - Preparare il letto (4-5" di lunghezza x 2" di larghezza) sul telo chirurgico utilizzando del nastro da laboratorio in vinile. Taglia un quadrato di garza di 1,5 pollici x 1,5 pollici, arrotolalo strettamente e posiziona la garza arrotolata sotto un pezzo di nastro vinilico da 3 pollici sulla "testa" del letto per formare un cuscino (l'inclinazione della testa con l'uso di un cuscino consente una maggiore estensione dell'area ventrale del collo).
- Stendere pezzi di nastro chirurgico da 4 pollici lungo i lati del letto (sopra il nastro in vinile). [Se si utilizza l'isoflurano, posizionare un cono nasale per anestesia con un peso (o un nastro) attaccato vicino alla testata del letto. Regolarlo per un posizionamento specifico una volta che il mouse è anestetizzato e trattenuto.] Vedere la Figura 1A, B.
- Usando un cacciatore ad ago o una pinza pesante, strappare piccoli pezzi di cotone da un batuffolo di cotone e arrotolarli in gomitoli di varie dimensioni da 0,5 a 1 mm di diametro (8-10 pezzi di cotone per topo). Tenere il cotone sul telo chirurgico vicino alla testata del letto.
- Utilizzando strumenti sterili, tagliare il filo di sutura 6-0 in pezzi di 1 cm (3-4 pezzi per topo). Posizionare le lunghezze di sutura preparate su un telo sterile. Preparare una siringa da 1 ml per la somministrazione di buprenorfina o altro analgesico adatto (come approvato dal protocollo dell'Institutional Animal Care and Use Committee [IACUC]). Sterilizzare tutti gli strumenti chirurgici secondo gli standard IACUC prima di collocare gli strumenti nel campo sterile.
- Disporre il microscopio da dissezione e la fonte di luce davanti al vaporizzatore di isoflurano con un sistema di lavaggio attivo o posizionarlo su un tavolo discendente. Posizionare il termoforo elettrico sulla base del microscopio da dissezione (o preferibilmente sotto il microscopio se la base è solida e può trasmettere calore) e coprire con un telo chirurgico sterile.
- Preparazione del topo per la procedura chirurgica (fare riferimento alla Figura 1C-F)
- Anestetizzare un topo seguendo i metodi approvati da IACUC per i principali interventi chirurgici di sopravvivenza (utilizzare isoflurano 1%-4%, in base alla sensibilità dei singoli topi, o un cocktail di 10 mg/mL di ketamina, 1 mg/mL di xilazina a 100-200 mg/kg (ketamina) di peso corporeo). Taglia il pelo o depila se necessario. Somministrare 0,5-1,0 mg/kg di buprenorfina ER (a rilascio prolungato) mediante iniezione sottocutanea 30 minuti prima dell'inizio della procedura chirurgica.
- Posizionare il mouse anestetizzato in modo che il cuscino poggi sotto il collo (Figura 1C). Il cuscino aiuta a estendere e sostenere il collo quando viene utilizzato con il cono nasale per anestesia. Se si utilizza il cocktail ketamina/xilazina, posizionare una barra dentale appesantita o uno strumento simile in bocca, dietro gli incisivi per inclinare la testa ed estendere il collo.
- Trattenere gli arti anteriori utilizzando il nastro chirurgico precedentemente posizionato lungo i lati del letto chirurgico (Figura 1D). Regolare la posizione del mouse sotto il microscopio in modo che la superficie ventrale del collo sia in vista e regolare l'ingrandimento per osservare comodamente il sito chirurgico (Figura 1E).
NOTA: L'ingrandimento del microscopio da dissezione deve essere regolato dal chirurgo in base al proprio livello di comfort per ogni passaggio. - Applicare lacrime artificiali utilizzando un batuffolo di cotone sterile. Disinfettare il sito chirurgico alternando tamponi circolari di betadina o clorexidina e alcol tre volte per disinfettante (Figura 1F).
- Confermare la profondità dell'anestesia assicurandosi che il topo non ritragga la zampa in risposta a un pizzicamento del dito del piede. Monitorare la frequenza respiratoria e assicurarsi che il topo non stia ansimando, poiché ciò è un'indicazione di anestesia eccessiva quando si utilizza l'isoflurano. Se necessario, regolare le velocità di flusso di ossigeno e isoflurano per raggiungere la profondità anestesiologica appropriata e una respirazione uniforme.
2. Procedura chirurgica (Figura 2, Figura 3, Figura 4, Figura 5, Figura 6 e Figura 7)
- Incisione e dissezione primaria
- Inizia praticando un'incisione longitudinale di 1 cm, iniziando solo cranialmente fino al manubrio (nodulo sporgente all'estremità cranica dello sterno) e continuando sulla trachea utilizzando una lama di bisturi sterile o uno strumento simile seguendo le linee guida IACUC approvate dall'utente (Figura 2A).
- Inserire la punta delle forbici chiuse nell'incisione e aprirla delicatamente per eseguire una dissezione smussata del tessuto connettivo sottocutaneo, separando le due ghiandole salivari. Con la pinza sottile, tirare delicatamente la ghiandola salivare destra attraverso l'incisione per appoggiarla sulla superficie cutanea preparata asetticamente o ritrarre la ghiandola salivare lateralmente utilizzando il divaricatore a uncino smussato (Figura 2B, C). Se la ghiandola esteriorizzata appare secca o appiccicosa, inumidirla con soluzione fisiologica sterile.
- Continuare la dissezione smussata del tessuto connettivo fino a quando i muscoli sternocleidomastoideo e digastrico sono visibili (Figura 2D).
NOTA: Il triangolo muscolare formato dal muscolo trachea/sternoioideo (sh), dal muscolo sternocleidomastoideo (sm) e dal muscolo digastrico (dg) (pancia caudale) verrà utilizzato per localizzare il CCA destro e la biforcazione dell'arteria carotide nel protocollo. In generale, il muscolo omoioideo più piccolo (oh) può anche essere visto giacere trasversalmente attraverso il CCA (Figura 2D); Tuttavia, questo muscolo varia di dimensioni e non è raro che il muscolo omoioideo sia del tutto assente nei topi giovani o piccoli.
- Isolamento CCA
- Utilizzando la pinza a punta angolata, continuare un'attenta dissezione del tessuto connettivo (aprendo le punte della pinza) vicino all'estremità caudale del triangolo muscolare per esporre l'arteria carotide comune, la vena giugulare e il nervo vago.
NOTA: L'arteria carotide comune è il vaso sanguigno più grande adiacente alla trachea e generalmente può essere facilmente identificata alla base del triangolo muscolare (Figura 2E, freccia). Fai molta attenzione alle pinze sottili attorno ai vasi sanguigni poiché le punte possono facilmente intaccare i vasi provocando un'emorragia eccessiva e potenzialmente letale. - Continuare un'attenta dissezione del tessuto connettivo attorno alla porzione dell'arteria carotide comune dalla base del triangolo muscolare fino al muscolo omoioideo. Usa i piccoli batuffoli di cotone sterili per controllare eventuali sanguinamenti minori e assorbire i liquidi secreti dalle ghiandole salivari secondo necessità.
- Sezionare con cura il tessuto connettivo per separare il CCA dal nervo vago. Prestare particolare attenzione per ridurre al minimo la manipolazione e il danneggiamento del nervo vago, facilmente identificabile come il fascio nervoso spesso e bianco adiacente al CCA (Figura 2F).
- Utilizzando la pinza a punta angolata, continuare un'attenta dissezione del tessuto connettivo (aprendo le punte della pinza) vicino all'estremità caudale del triangolo muscolare per esporre l'arteria carotide comune, la vena giugulare e il nervo vago.
- Preparazione CCA
- Una volta che il CCA è stato completamente mobilizzato dal muscolo sternocleidomastoideo, e dove visibile, fino al muscolo omoioideo, posizionare un pezzo di sutura 6-0 di 1 cm sulla pelle preparata asetticamente dello sterno del topo (per un facile recupero) e passare la pinza a punta angolata sotto il CCA (avendo cura di isolare il CCA dal nervo vago e dalla vena giugulare) (Figura 3A). Se il muscolo omoioideo non è presente, liberare l'area intorno al CCA a sufficienza per poter posizionare le suture sul CCA, craniale e caudale fino al sito di iniezione proposto e per inserire l'ago.
- Con la pinza fine nella mano sinistra, passare la sutura alla pinza a punta angolata, afferrando vicino all'estremità della sutura. Tirare delicatamente metà della lunghezza della sutura sotto il CCA con la pinza a punta angolata (Figura 3B).
- Ripetere questo processo con una seconda sutura, parallela alla prima sutura (Figura 3C).
- Legare liberamente ogni sutura attorno al CCA, ma non stringere i nodi o limitare il flusso sanguigno (Figura 3D).
- Isolamento e preparazione dell'arteria carotide esterna
- Utilizzando la pinza a punta angolata, rimuovere con cautela il tessuto connettivo all'estremità cranica del triangolo muscolare, craniale al muscolo omoioideo, per localizzare il CCA e la biforcazione in ECA e ICA (Figura 4A).
NOTA: L'ECA si inclina verso la linea mediana ed è leggermente più superficiale, mentre l'ICA si inclina lateralmente e si sposta più in profondità nel collo. Prestare particolare attenzione per evitare danni al nervo ipoglosso (HN) che attraversa l'ICA appena sopra la biforcazione. - Eliminare con cura il tessuto connettivo da tutti i lati dell'ECA vicino alla biforcazione. Una volta che una quantità sufficiente di tessuto connettivo è stata rimossa dall'ECA, posizionare un pezzo di sutura sulla pelle preparata in modo asettico sullo sterno del topo e far passare la pinza a punta angolata sotto l'ECA. Con la pinza sottile nella mano sinistra, passare la sutura alla pinza a punta angolata nello spazio tra l'ICA e l'ECA e tirare delicatamente metà della lunghezza della sutura (Figura 4B). Legare liberamente la sutura attorno all'ECA, ma non stringere il nodo.
NOTA: È importante che venga eliminato abbastanza tessuto connettivo dall'ECA da poter afferrare la sutura con la pinza a punta angolata senza afferrare inavvertitamente il tessuto connettivo che circonda le arterie, causando danni alle arterie quando la sutura viene recuperata.
- Utilizzando la pinza a punta angolata, rimuovere con cautela il tessuto connettivo all'estremità cranica del triangolo muscolare, craniale al muscolo omoioideo, per localizzare il CCA e la biforcazione in ECA e ICA (Figura 4A).
- Preparazione di aghi e siringhe
NOTA: Per questa fase, l'iniezione può essere eseguita con un ago dritto, che consente alla siringa di appoggiarsi e di essere stabilizzata dal corpo del topo (Figura 5A). In alternativa, l'iniezione può essere eseguita utilizzando un ago piegato vicino alla punta, che consente di tenere la siringa come una matita con la mano appoggiata sul tavolo operatorio (Figura 5B). Entrambe le tecniche funzionano bene e la scelta della tecnica è una preferenza personale.- Per preparare l'ago piegato, tenere un ago da 33 G, 1/2 pollice con lo smusso rivolto verso l'alto e afferrare la punta con un cacciavite sterile (Figura 5C). Piegare l'ago di circa 30-40° direttamente verso lo smusso (Figura 5D).
- Riempia la siringa con il volume appropriato della soluzione da iniettare (assicurarsi di tenere conto dello spazio nella cavità dell'ago se la soluzione iniettabile non viene aspirata attraverso l'ago per caricare la siringa). Inserire l'ago e rimuovere eventuali bolle d'aria. Assicurarsi che il menisco della soluzione sia visibile in corrispondenza dello smusso dell'ago.
- Iniezione intracarotidea
- Stringere il nodo della sutura attorno all'ECA. Quindi, far scorrere la sutura inferiore sul CCA verso il basso verso il muscolo sternocleidomastoideo il più lontano possibile e stringere il nodo. Assicurarsi che la sutura superiore del CCA rimanga allentata fino a dopo l'iniezione. Posizionare un batuffolo di cotone sterile nel bordo della cavità per assorbire il liquido secreto e il sangue durante l'iniezione.
- Tenendo la siringa nella mano destra e la pinza sottile nella mano sinistra, portare l'ago nell'arteria immediatamente sopra la sutura inferiore sul CCA. Con la pinza sottile, tirare delicatamente l'estremità libera della sutura inferiore in direzione caudale per esercitare un basso livello di tensione sul CCA (Figura 6A).
- Inserire l'ago nel CCA appena oltre lo smusso e rilasciare lentamente la tensione dalla sutura (Figura 6B).
NOTA: L'arteria ha un flusso sanguigno sostanziale e probabilmente sanguinerà nella cavità chirurgica quando l'ago viene inserito. Tuttavia, una volta che l'ago viene inserito oltre lo smusso, l'arteria formerà un sigillo attorno all'ago e l'emorragia si fermerà. Il sanguinamento continuo con l'ago in posizione indica che l'ago non è abbastanza lontano nell'arteria (lo spazio dallo smusso consente al sangue di fluire) o che l'ago è stato spinto attraverso la parte posteriore dell'arteria. Ora è importante tenere l'ago estremamente fermo per evitare di strappare l'arteria o lasciare che l'ago scivoli fuori. Monitorare continuamente gli animali con eventi di emorragia e, se il sanguinamento è significativo (ad esempio quando un animale perde la colorazione, appare cianotico, diventa freddo al tatto o qualsiasi altro endpoint umano descritto nel protocollo di utilizzo degli animali), è necessario applicare endpoint umani. - Utilizzare la mano sinistra per spingere lo stantuffo della siringa per iniettare la soluzione molto lentamente (Figura 5B, non meno di 15 secondi per iniettare 100 μL di soluzione). Non rimuovere l'ago al termine dell'iniezione della soluzione. Per evitare il riflusso, con la pinza sottile nella mano sinistra, afferrare la sutura superiore sul CCA (ancora legata in modo lasco) dal nodo e sollevare per attorcigliare l'arteria (Figura 6C).
- Rimuovi l'ago, metti da parte la siringa e raccogli la pinza a punta angolata con la mano destra. Mantenendo il nodo nell'arteria, stringere il nodo nella sutura superiore sul CCA (Figura 6D).
NOTA: A questo punto, non dovrebbero esserci ulteriori sanguinamenti nella cavità chirurgica. Dopo questo passaggio, sono disponibili due procedure alternative, come descritto nei passaggi 2.7 e 2.8 di seguito. Se il CCA deve essere legato, seguire il passaggio 2.7. Se il CCA deve essere riparato nel sito di iniezione, seguire la modifica elencata al punto 2.8.
- Legatura del CCA
- Nei casi che non richiedono il ripristino della circolazione nel CCA, lasciare l'arteria legata, lasciando entrambe le suture strette sul CCA. Tagliare le estremità della sutura e verificare che i nodi della sutura siano completamente serrati.
- Procedere con la chiusura e le procedure di analgesia descritte al punto 2.9.
- Alternativa alla legatura del CCA-Riparazione del sito di iniezione e ripristino della circolazione
- Utilizzando batuffoli di cotone sterili, assorbire il sangue residuo all'interno della cavità chirurgica. Individuare il sito di iniezione sul CCA (Figura 7A) e determinare il numero di suture necessarie per la chiusura. Irrigare accuratamente il sito di iniezione e il lume dell'area isolata del CCA per rimuovere il sangue coagulato.
- Usando la pinza a punta angolata, afferrare l'ago da sutura 9-0 per il corpo dell'ago vicino alla pressa. Mentre si utilizza la pinza sottile per sostenere l'arteria dal lato opposto, posizionare una singola sutura nel CCA penetrando la parete arteriosa di circa 1-1,5 mm lateralmente al sito di iniezione, perpendicolare all'arteria. Tenere l'arteria con la pinza sottile, aprendo il sito di iniezione e facendo passare l'ago e la sutura attraverso i lati destro e sinistro individualmente. In alternativa, tenere l'arteria, premendo delicatamente i lati insieme con la pinza sottile, passando l'ago e suturare attraverso entrambi i lati dell'arteria con un solo morso.
NOTA: Con entrambe le tecniche, fare attenzione che l'ago e la sutura non penetrino nella parete posteriore all'interno dell'arteria poiché ciò chiuderà il lume quando viene stretto. - Chiudere il sito di iniezione con un nodo da chirurgo eseguendo una legatura strumentale con la pinza fine e la pinza a punta angolata, utilizzando un minimo di quattro lanci (Figura 7B). In generale, utilizzare un'unica sutura semplice interrotta per chiudere il sito di iniezione di un ago da 33 G.
- Per ripristinare la circolazione utilizzando la pinza fine, slegare e rimuovere la sutura attorno all'ECA, seguita dalla sutura superiore sul CCA (Figura 7C, D). Quindi, allentare lentamente la sutura inferiore sul CCA ma non slegare immediatamente. Verificare che il sito di iniezione sia sufficientemente chiuso per prevenire sanguinamenti importanti con il ripristino della pressione sanguigna e del flusso (Figura 7D).
NOTA: Se si verifica un sanguinamento importante nel sito di iniezione, la sutura inferiore del CCA può essere rapidamente serrata nuovamente e il sito di iniezione può essere regolato o risuturato se necessario. - Rimuovere le suture CCA superiore e inferiore (Figura 7E). Andare al passaggio 2.9.
- Chiusura e analgesia
- Riposizionare la ghiandola salivare nella cavità e chiudere l'incisione con tre semplici suture interrotte utilizzando un impacco di sutura sterile. Rimuovere i sistemi di ritenuta del nastro chirurgico e consentire al mouse di riprendersi dall'anestesia su un termoforo.
NOTA: Le dosi di follow-up di analgesico devono essere somministrate in base alla frequenza e alla dose specificate nel protocollo IACUC approvato dall'utente. Si raccomanda una durata di guarigione di una settimana tra le iniezioni. Se sono necessarie iniezioni ripetute, la riparazione del sito di iniezione può essere utilizzata dopo la prima iniezione e la stessa procedura chirurgica può essere seguita per le iniezioni successive. L'iniezione successiva può essere somministrata nel CCA craniale al sito di iniezione riparato poiché la sutura ripetuta per riparare lo stesso sito di iniezione porterà probabilmente a cicatrici e coaguli di sangue.
- Riposizionare la ghiandola salivare nella cavità e chiudere l'incisione con tre semplici suture interrotte utilizzando un impacco di sutura sterile. Rimuovere i sistemi di ritenuta del nastro chirurgico e consentire al mouse di riprendersi dall'anestesia su un termoforo.
Risultati
Precedenti studi hanno dimostrato che le cellule staminali mesenchimali umane derivate dal midollo osseo (BM-hMSC) somministrate mediante iniezione intracarotidea hanno ospitato con successo gliomi intracranici nei topi19. Abbiamo impiegato questo modello per confrontare gli effetti della legatura del CCA rispetto alla riparazione del CCA con il ripristino della circolazione dopo l'iniezione intracarotidea di BM-hMSC in topi portatori di glioma. A topi nudi atimici sono state impiantate cellule di glioma U87, seguite dall'iniezione di BM-hMSC marcate con GFP con successiva legatura CCA o riparazione CCA con circolazione ripristinata. Dopo 3 giorni, i topi sono stati sacrificati e il cervello è stato raccolto, fissato ed è stata eseguita l'immunoistochimica per rilevare la GFP e sono state contate le cellule GFP-positive (Figura 8A-D).
L'homing complessivo delle GFP-BM-hMSC ai gliomi intracranici è stato valutato dal numero totale di cellule GFP-positive all'interno del confine tumorale su due diversi vetrini (sezioni distanti >75 μm) dallo stesso campione. Il confronto delle medie con il test t spaiato ha suggerito che non c'era alcuna differenza significativa tra l'homing medio osservato tra le due procedure (P = 0,6858) (Figura 8E). La dispersione delle GFP-BM-hMSC in tutto il tumore è stata valutata contando le cellule GFP-positive in 10 campi ad alta potenza all'interno del tumore. L'aumento del numero di cellule all'interno di campi ad alta potenza può indicare cambiamenti nella dispersione delle cellule in tutto il tumore derivanti dalla variazione della procedura. Il confronto dei valori mediani utilizzando il test Wilcoxon Signed Rank ha indicato che non vi era alcuna differenza significativa tra i conteggi mediani delle cellule GFP-positive nei campi ad alta potenza tra i gruppi di legatura CCA e i gruppi di riparazione CCA (Figura 8F).

Figura 1: Preparazione del tavolo operatorio e del topo per l'intervento chirurgico. (A,B) Letto chirurgico (etichette A. Nastro vinilico che forma il letto, B. Nastro chirurgico di contenzione degli arti anteriori, C. Cuscino, D. Peso, E. Cono per anestesia, F. Divaricatore a uncino smussato, G. Suture da 1 cm in etanolo al 70%, H. Pinze fini, I. Pinze a punta angolata, J. Forbici strette, K. Batuffoli di cotone sterili). (C, D) Posizionamento del mouse. (E,F) Sito chirurgico e disinfezione del sito chirurgico. Clicca qui per visualizzare una versione più grande di questa figura.
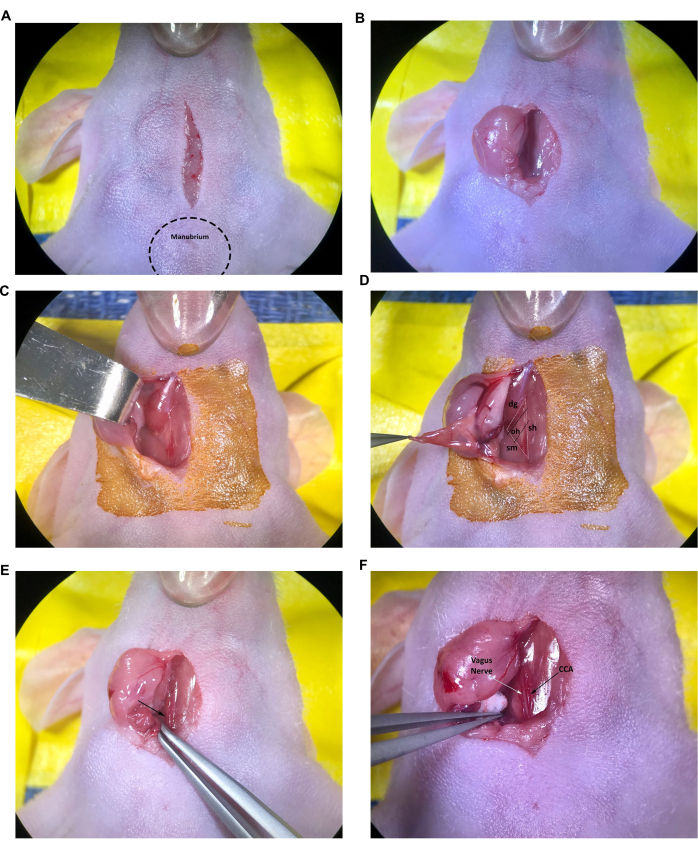
Figura 2: Incisione ed esposizione delle strutture nel sito di iniezione. (A) Incisione della linea mediana. (B,C) Retrazione della ghiandola salivare destra. (D) È visibile anche il triangolo muscolare formato dal muscolo trachea/sternoioideo, il muscolo sternocleidomastoideo e il muscolo digastrico, il muscolo omoioideo. (E) Arteria carotide comune, indicata dalla freccia. (F) Nervo vago e arteria carotide comune, indicati dalle frecce. Abbreviazioni: sh = trachea/muscolo sternoioide; sm = muscolo sternocleidomastoideo; DG = muscolo digastrico; oh = muscolo omoioideo; CCA = Arteria carotide comune. Clicca qui per visualizzare una versione più grande di questa figura.
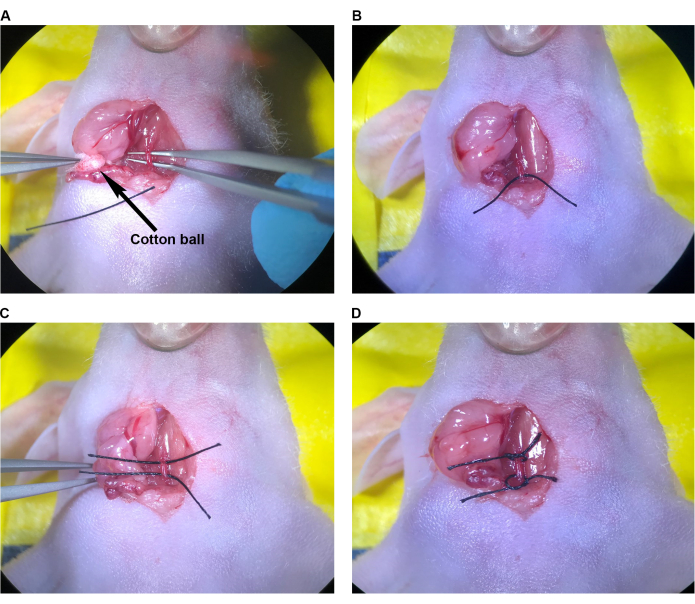
Figura 3: Preparazione del CCA per l'iniezione. (A) Pinze a punta angolata passate sotto il CCA. (B) La sutura è stata tirata a metà sotto il CCA utilizzando una pinza a punta angolata. (C) La seconda sutura è stata tirata a metà sotto il CCA. (D) Suturato legato in sciolti sa intorno al CCA. Abbreviazione: CCA = Arteria carotide comune. Clicca qui per visualizzare una versione più grande di questa figura.
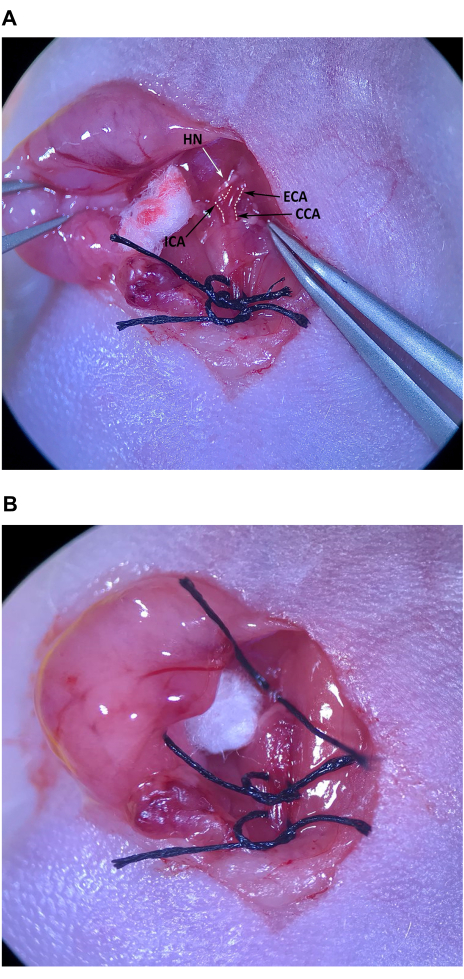
Figura 4: Isolamento e preparazione dell'arteria carotide esterna. (A) CCA, arteria carotide esterna e arteria carotide interna. (B) Sutura tirata a metà sotto l'ECA. Abbreviazioni: CCA Arteria carotide comune; ECA = arteria carotide esterna; ICA = arteria carotide interna. Clicca qui per visualizzare una versione più grande di questa figura.
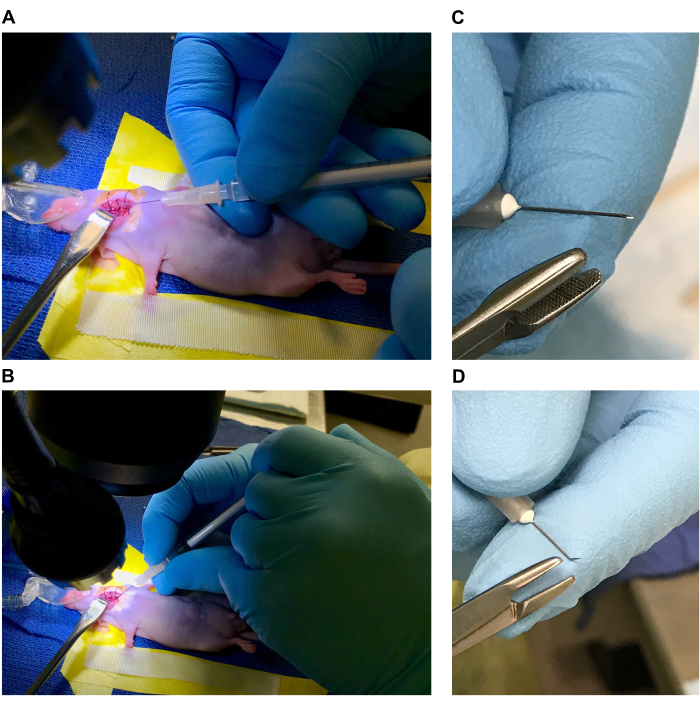
Figura 5: Preparazione dell'ago e della siringa. (A) Iniezione con un ago dritto con una siringa appoggiata contro il corpo del topo. (B) Iniezione con un ago piegato, con una mano appoggiata sul tavolo operatorio. (C, D) Preparare un ago piegato. Clicca qui per visualizzare una versione più grande di questa figura.
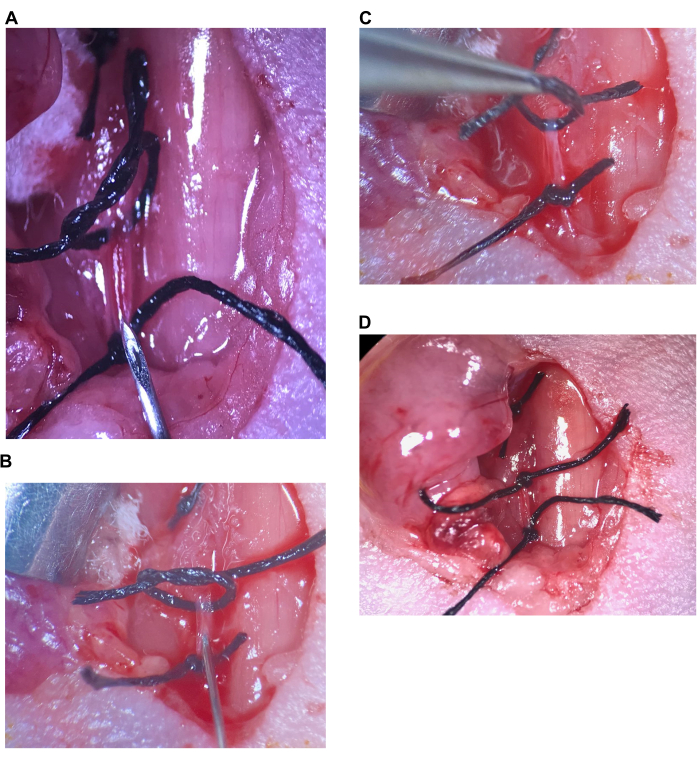
Figura 6: Iniezione intracarotidea. (A) La sutura superiore è allentata, la sutura inferiore è stretta sul CCA, l'ago è posizionato sopra la sutura inferiore. (B) L'ago viene inserito appena oltre lo smusso, l'arteria viene sigillata attorno all'ago. (C) La sutura superiore viene sollevata per piegare l'arteria verso l'alto e prevenire il riflusso. (D) La sutura superiore del CCA è stretta. Abbreviazione: CCA = Arteria carotide comune. Clicca qui per visualizzare una versione più grande di questa figura.
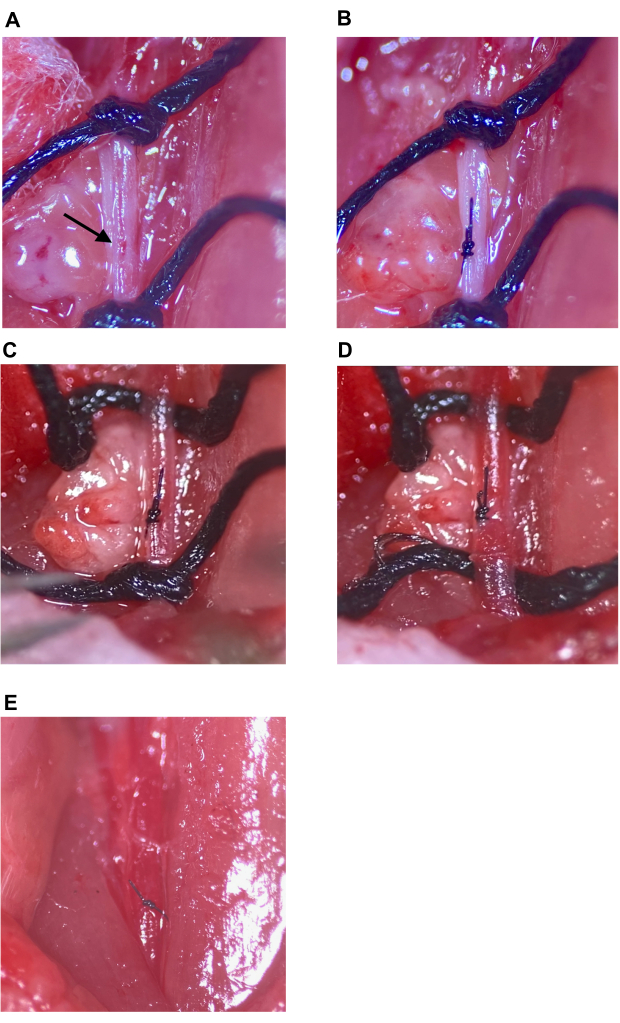
Figura 7: Riparazione del sito di iniezione e ripristino della circolazione. (A) Il sito di iniezione indicato con una freccia. (B) Il sito di iniezione si è chiuso con un nodo da chirurgo, un minimo di quattro lanci. (C, D) Allentamento delle suture superiori e inferiori sul CCA dopo la riparazione del sito di iniezione; Nessun sanguinamento osservato dopo l'allentamento della sutura. (E) Le suture vengono rimosse dopo che il sito di iniezione è stato determinato per essere sufficientemente riparato. Abbreviazione: CCA = Arteria carotide comune. Clicca qui per visualizzare una versione più grande di questa figura.
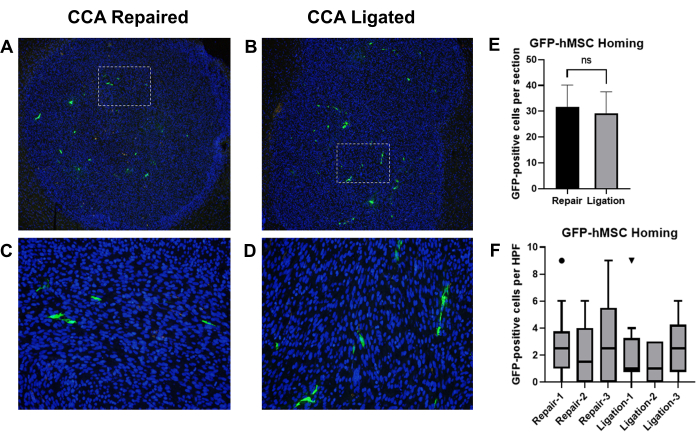
Figura 8: Iniezione intracarotidea di GFP-BM-hMSC e confronto dell'homing con i tumori del glioma intracranico dopo legatura CCA o riparazione CCA con circolazione ripristinata. Le sezioni di tessuto cerebrale di topi portatori di tumore sono state colorate con anticorpi primari anti-GFP e anticorpi secondari Alexa Fluor 488 per marcare GFP-BM-hMSC (verde). I nuclei sono stati colorati con Hoechst 33342 (blu). Campi rappresentativi a bassa potenza di sezioni marcate che mostrano l'homing complessivo al tumore e campi ad alta potenza che mostrano la distribuzione cellulare GFP-positiva dopo la riparazione del CCA (A,C) o la legatura del CCA (B,D). (E) L'homing complessivo delle GFP-BM-hMSC ai tumori è stato valutato in base al numero totale di cellule GFP-positive all'interno del confine tumorale su due diversi vetrini e le medie sono state confrontate mediante t-test. Non è stata osservata alcuna differenza significativa nell'homing complessivo tra le procedure alternative (P = 0,6858). (F) La dispersione delle GFP-BM-hMSC in tutto il tumore è stata valutata contando le cellule GFP-positive in 10 campi ad alta potenza all'interno del tumore. Il confronto dei valori mediani con il test Wilcoxon Signed Rank non indica differenze significative tra gli individui, indipendentemente dalla procedura (P = 0,1914, 0,5000, 0,1641, 0,9512, 0,8828, 0,2207). Abbreviazioni: GFP = proteina fluorescente verde; GFP-BM-hMSCs = cellule staminali mesenchimali umane derivate dal midollo osseo marcate con GFP; CCA = Arteria carotide comune. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Le iniezioni intracarotidi nell'arteria sono state utilizzate sempre di più negli ultimi anni per fornire terapie ai tumori cerebrali. Di conseguenza, è importante stabilire modelli murini che rispecchino le iniezioni intracarotidei dell'arteria nell'uomo a scopo di ricerca. In precedenza, le iniezioni intracarotidei nell'arteria carotidea nei topi venivano eseguite con successiva legatura dell'arteria, che limita il numero di iniezioni nell'arteria11,12. Inoltre, l'occlusione dell'arteria carotide nei topi può portare a ischemia cerebrale in alcuni ceppi di topi che non hanno un Circle of Willis13 completo. Abbiamo sviluppato un metodo per riparare l'arteria carotide iniettata per superare i limiti dei metodi precedenti. La riparazione del sito di iniezione provoca il ripristino del flusso sanguigno all'arteria iniettata, riducendo la possibilità di ischemia cerebrale e facilitando le successive iniezioni nella stessa arteria carotide interna.
Diversi passaggi, che sono fondamentali per il successo, richiedono un'attenta manipolazione degli strumenti chirurgici o dei tessuti, che includono: inserire correttamente l'ago nel lume dell'arteria per evitare sanguinamento durante l'iniezione intracarotidea; un'attenta dissezione del tessuto connettivo dal sito di iniezione prima dell'inserimento dell'ago; rimozione di tutti i grumi e le bolle d'aria nella siringa e nell'ago prima dell'iniezione; e la corretta chiusura del sito di iniezione per evitare la chiusura del lume dell'arteria durante la riparazione. Per evitare il sanguinamento dopo l'inserimento dell'ago, assicurarsi che l'ago sia inserito nell'arteria oltre lo smusso per formare un sigillo attorno allo stelo dell'ago. Per evitare una lacerazione della parete posteriore dell'arteria, inserire l'ago con un angolo poco profondo e far oscillare leggermente la siringa e l'ago all'indietro per mantenere la punta dell'ago lontana dalla parete posteriore arteriosa. Se la soluzione iniettata fuoriesce durante l'iniezione, ciò suggerisce che l'ago è stato inserito solo nel tessuto connettivo che circonda l'arteria; Un'attenta dissezione del tessuto connettivo in eccesso dal sito di iniezione prima dell'iniezione previene questo problema.
Per quanto riguarda la scelta della sutura e della tecnica di chiusura, se l'iniezione iniziale ha utilizzato un ago da 33 G e ha effettuato un inserimento pulito nell'arteria, una semplice sutura con sutura 9-0 è sufficiente per riparare l'arteria. Se si utilizza un ago più grande per l'iniezione (30 G, ecc.) o si verifica una lacerazione durante l'inserimento dell'ago (ad esempio, quando l'ago è decentrato o l'arteria si muove perché il topo respira), ciò si traduce in un foro leggermente più grande che deve essere riparato. Due semplici suture o una figura di otto sono solitamente sufficienti per riparare questo tipo di foro più grande. La scelta tra queste due tecniche si basa sulle preferenze del chirurgo in questa situazione. È importante notare che la tecnica di riparazione non è stata valutata in situazioni in cui il foro del sito di iniezione è significativamente più grande rispetto alla situazione sopra menzionata. Se la lacerazione nel sito di iniezione si estende lateralmente (praticando un foro più largo, superiore a un terzo della circonferenza dell'arteria), la riparazione con questo metodo può causare la contrazione dell'arteria e un aumento del rischio di trombosi.
Se c'è sanguinamento dal sito di iniezione riparato quando le suture vengono rimosse, potrebbe essere dovuto allo stiramento del sito riparato quando riprende la normale circolazione; Questo può essere risolto coprendo delicatamente il sito di iniezione riparato con cotone sterile e applicando una leggera pressione per 30 s. In alternativa, se c'è sanguinamento dal sito di iniezione riparato senza flusso sanguigno visibile e un'arteria dilatata prossimale, indica che l'ago di sutura è passato attraverso la parete posteriore dell'arteria durante la riparazione. In questo caso, aprire delicatamente i bordi del sito di iniezione durante la riparazione, far passare l'ago da sutura attraverso l'arteria con un angolo poco profondo e confermare visivamente che la sutura non sia passata attraverso la parete posteriore prima di legare il nodo di sutura.
Con queste misure in atto, il metodo di riparazione del sito di iniezione è preciso e ripetibile in coorti di animali, indipendentemente dal background genetico o dall'età. Nella nostra esperienza, il tasso di successo è stato del 100% con tre diversi chirurghi che hanno eseguito la procedura. Con un'adeguata esperienza e seguendo attentamente il protocollo fornito, non prevediamo alcuna difficoltà per altri chirurghi nell'eseguire questa procedura. Con la pratica, un chirurgo esperto può completare la procedura in 15-20 minuti. Se l'esperimento lo consente, il tempo per animale può anche essere ridotto lasciando intatte le suture CCA superiore e inferiore, rinunciando alla riparazione del sito di iniezione. Tuttavia, come notato sopra, sono state documentate differenze specifiche del ceppo nell'anatomia vascolare cerebrale ed è importante verificare che il ceppo del topo utilizzato nella procedura possa tollerarle prima di iniziare l'esperimento.
Poiché si tratta di una procedura chirurgica, è necessario tenere conto del recupero dei topi. La tolleranza allo stress e il recupero delle ferite sono considerazioni importanti che variano a seconda dei diversi ceppi di topi. Inoltre, l'infiammazione nel sito chirurgico e la formazione di tessuto cicatriziale possono aumentare i tempi di recupero dopo ripetuti interventi chirurgici. Abbiamo eseguito con successo più iniezioni a distanza di 7 giorni l'una dall'altra, ma se sono necessarie iniezioni più frequenti, dovrebbero essere valutate attentamente nei ceppi specifici di topo da utilizzare. La manipolazione energica e lo stress sul CCA (durante l'isolamento, la legatura e la rimozione delle suture e l'iniezione) possono danneggiare e indebolire le pareti arteriose portando a lacerazioni durante le iniezioni ripetute. È importante ridurre al minimo la dissezione del tessuto connettivo di supporto attorno al CCA e alla biforcazione e astenersi dall'applicare una tensione eccessiva all'arteria.
I nostri risultati suggeriscono che in questo particolare modello, la legatura del CCA o la riparazione del CCA con circolazione ripristinata dopo l'iniezione non differiscono nella frequenza di homing complessiva o nella distribuzione delle BM-hMSC iniettate nei tumori intracranici. Sebbene questo possa variare nei diversi ceppi di topo, l'uso della riparazione del sito di iniezione offre il vantaggio di restituire il flusso sanguigno all'arteria iniettata, consentendo successive iniezioni nella stessa arteria e, soprattutto, assomigliando alle iniezioni intracarotidi dell'arteria nei pazienti umani. La scelta di legare o riparare l'arteria iniettata si basa sul tipo di esperimento e sul modello murino utilizzato. Se è necessaria una seconda iniezione, o se il modello murino non ha un Circle of Willis completo, deve essere utilizzata la riparazione del sito di iniezione. La capacità di reiniettare il CCA in modelli murini può facilitare un'ulteriore manipolazione sperimentale. Ad esempio, per testare dosi multiple di una potenziale terapia somministrata nel tempo, la riparazione dell'arteria iniettata è essenziale per eseguire le iniezioni successive. Questo metodo sarebbe utile anche negli esperimenti che prevedono l'iniezione di combinazioni di agenti terapeutici che devono essere iniettati in momenti diversi. La maggiore flessibilità nelle iniezioni intracarotidei offerta dalla riparazione dell'arteria iniettata migliora l'utilità traslazionale dei modelli di tumore cerebrale di topo.
Divulgazioni
Gli autori non hanno divulgazioni/conflitti di interesse rilevanti.
Riconoscimenti
Questo studio è stato supportato da sovvenzioni del National Cancer Institute (R01CA115729, R01CA214749 e 1P50 CA127001) e dai generosi contributi filantropici all'Università del Texas MD Anderson Cancer Center Moon Shots Program™, alla Broach Foundation for Brain Cancer Research, all'Elias Family Fund for Brain Tumor Research, al Priscilla Hiley Cancer Research Fund, al Bauman Family Curefest Brain Cancer Research Fund, Chuanwei Lu Fund, The Sweet Family Brain Cancer Research Fund, The Ira Schneider Memorial Cancer Research Foundation, The Jim & Pam Harris Fund, The Gene Pennebaker Fund for Brain Cancer Research, The Sorenson Fund for Brain Tumor Research, Brian McCulloch Memorial Fund, la TLC Foundation from the Heart e il Mary Harris Pappas Endowed Fund for Glioblastoma Research, tutto a F.F.L.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL syringes (low dead space) | Air-tite Products Co. | A1 | |
| 26 G; 1/2" needle | Air-tite Products Co. | N2612 | |
| 33 G; 1/2" needle | JBP, Air-tite Products Co. | JBP3313B | |
| 3 cm Petri dish | Falcon, Fisher Scientific | 08-772A | |
| 3M durapore surgical tape | Fisher Scientific | 19-071-152 | |
| 6-0 suture thread | Fine Science Tools | 18020-60 | |
| 70% Ethanol | Fisher Scientific | 04-355-122 | |
| 9-0 microsurgical suture with needle | Fine Science Tools | 12052-09 | |
| Analgesic for major surgery | |||
| Artificial tears/ophthalmic ointment | Covetrus | 8897 | |
| Bead Sterilizer | Fisher Scientific | 14-955-341 | |
| Betadine/Chlorhexidine | McKesson, Fisher Scientific | NC1696484 | |
| Blunt hook retractor | Fine Science Tools | 17022-13 | |
| Dissecting microscope | Zeiss Microscopy, LLC | 491903-0010-000 | |
| Electric heating pad | Insource, Fisher Scientific | NC0667724 | |
| Extra narrow scissors | Fine Science Tools | 14088-10 | |
| Fine forceps - Dumont #5 forceps with micro-blunted tips | Fine Science Tools | 11253-20 | |
| Fine forceps - Dumont #5/45 angled tip forceps with micro-blunted tips | Fine Science Tools | 11253-25 | |
| Isoflurane vaporizer (or Ketamine/Xylazine cocktail) | Kent Scientific | VetFlo-1231 | |
| Light source | Laxco, Fisher Scientific | AMPSILED21 | |
| Mouse anesthesia nose cone | Braintree Scientific, Inc | XENO- M | |
| Needle driver | Fine Science Tools | 12002-12 | |
| Sterile cotton swabs | Texwipe, Fisher Scientific | 18-366-472 | |
| Sterile gauze pads | Covidien, Fisher Scientific | 22-037-907 | |
| Sterile saline (0.9%) | KD Medical, Fisher Scientific | 50-103-1363 | |
| Sterile surgical drapes | Fisher Scientific | 50-129-6666 | |
| Sterile surgical/downdraft table | |||
| Sterile suture pack (any suitable diameter for mouse wound closure) | Ethicon, Fisher Scientific | 50-209-2811 | |
| Surgical tools | |||
| Vinyl lab tape | Fisher Scientific | 15-901 |
Riferimenti
- Loya, J., Zhang, C., Cox, E., Achrol, A. S., Kesari, S. Biological intratumoral therapy for the high-grade glioma part i: Intratumoral delivery and immunotoxins. CNS Oncol. 8 (3), (2019).
- Garfield, J., Dayan, A. D. Postoperative intracavitary chemotherapy of malignant gliomas. A preliminary study using methotrexate. J Neurosurg. 39 (3), 315-322 (1973).
- Kroin, J. S., Penn, R. D. Intracerebral chemotherapy: Chronic microinfusion of cisplatin. Neurosurgery. 10 (3), 349-354 (1982).
- Sendelbeck, S. L., Urquhart, J. Spatial distribution of dopamine, methotrexate and antipyrine during continuous intracerebral microperfusion. Brain Res. 328 (2), 251-258 (1985).
- Alter, R. A., et al. Long-term benefit of intra-arterial bevacizumab for recurrent glioblastoma. J Exp Ther Oncol. 12 (1), 67-71 (2017).
- Angelov, L., et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary cns lymphoma: A multi-institutional experience. J Clin Oncol. 27 (21), 3503-3509 (2009).
- Chen, S. R., Chen, M. M., Ene, C., Lang, F. F., Kan, P. Perfusion-guided endovascular super-selective intra-arterial infusion for treatment of malignant brain tumors. J Neurointerv Surg. 14 (6), 533-538 (2022).
- Faltings, L., et al. Rechallenging recurrent glioblastoma with intra-arterial bevacizumab with blood brain-barrier disruption results in radiographic response. World Neurosurg. 131, 234-241 (2019).
- Srinivasan, V. M., et al. Advances in endovascular neuro-oncology: Endovascular selective intra-arterial (esia) infusion of targeted biologic therapy for brain tumors. J Neurointerv Surg. 12 (2), 197-203 (2020).
- Shinojima, N., et al. Tgf-β mediates homing of bone marrow-derived human mesenchymal stem cells to glioma stem cells. Cancer Res. 73 (7), 2333-2344 (2013).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of visualized experiments : JoVE. (120), e55085 (2017).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Benbenishty, A., et al. Maintaining unperturbed cerebral blood flow is key in the study of brain metastasis and its interactions with stress and inflammatory responses. Brain, behavior, and immunity. 62, 265-276 (2017).
- Doucette, T., et al. Mesenchymal stem cells display tumor-specific tropism in an rcas/ntv-a glioma model. Neoplasia. 13 (8), 716-725 (2011).
- Hata, N., et al. Platelet-derived growth factor bb mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 66 (1), 144-156 (2010).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 65 (8), 3307-3318 (2005).
- Qiao, Y., et al. Magnetic resonance and photoacoustic imaging of brain tumor mediated by mesenchymal stem cell labeled with multifunctional nanoparticle introduced via carotid artery injection. Nanotechnology. 29 (16), 165101 (2018).
- Yong, R. L., et al. Human bone marrow-derived mesenchymal stem cells for intravascular delivery of oncolytic adenovirus delta24-rgd to human gliomas. Cancer Res. 69 (23), 8932-8940 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon