Method Article
تحسين خرائط الكثافة عن طريق إزالة غالبية الجسيمات في المداخن النهائية للمجهر الإلكتروني المبرد أحادي الجسيمات
* These authors contributed equally
In This Article
Summary
تعمل طريقة اختيار الجسيمات المتقدمة ل cryo-EM ، وهي CryoSieve ، على تحسين دقة خريطة الكثافة عن طريق إزالة غالبية الجسيمات في الأكوام النهائية ، كما هو موضح من خلال تطبيقها على مجموعة بيانات في العالم الحقيقي.
Abstract
على مدى العقد الماضي ، أدت التطورات في التكنولوجيا والمنهجية في مجال المجهر الإلكتروني المبرد (cryo-EM) وتحليل الجسيمات المفردة (SPA) إلى تحسين قدرتنا بشكل كبير على الفحص الهيكلي عالي الدقة للجزيئات البيولوجية الكبيرة. وقد بشر هذا التقدم بعصر جديد من الرؤى الجزيئية ، ليحل محل علم البلورات بالأشعة السينية باعتباره الطريقة السائدة ويقدم إجابات على الأسئلة الطويلة الأمد في علم الأحياء. نظرا لأن cryo-EM لا يعتمد على التبلور ، وهو قيد كبير على علم البلورات بالأشعة السينية ، فإنه يلتقط جزيئات متفاوتة الجودة. وبالتالي ، فإن اختيار الجسيمات أمر بالغ الأهمية ، حيث تؤثر جودة الجسيمات المختارة بشكل مباشر على دقة خريطة الكثافة المعاد بناؤها. يعمل النهج التكراري المبتكر لاختيار الجسيمات ، المسمى CryoSieve ، على تحسين جودة خرائط الكثافة المعاد بناؤها بشكل كبير عن طريق تقليل عدد الجسيمات في المكدس النهائي بشكل فعال. تظهر الأدلة التجريبية أن هذه الطريقة يمكن أن تقضي على غالبية الجسيمات في المداخن النهائية ، مما يؤدي إلى تحسن ملحوظ في جودة خرائط الكثافة. توضح هذه المقالة سير العمل التفصيلي لهذا النهج وتعرض تطبيقه على مجموعة بيانات في العالم الحقيقي.
Introduction
أصبح المجهر الإلكتروني المبرد (cryo-EM) تحليل الجسيمات المفردة (SPA) طريقة مهيمنة لتحديد خرائط الكثافة ثلاثية الأبعاد عالية الدقة للجزيئات البيولوجية الكبيرة. نظرا لسلسلة من الابتكارات التكنولوجية1،2،3،4،5،6 ، المسماة ثورة القرار7 ، فإن cryo-EM لديه القدرة على تحديد هياكل الجزيئات البيولوجية الكبيرة بدقة ذرية تصل إلى معدل غير مسبوق. يمثل هذا الاختراق بداية حقبة جديدة في الرؤى الجزيئية ، متجاوزا علم البلورات بالأشعة السينية باعتباره التقنية السائدة والإجابة على الأسئلة البيولوجية طويلة الأمد.
يختلف Cryo-EM SPA عن علم البلورات بالأشعة السينية من خلال عدم الحاجة إلى تبلور الجزيئات البيولوجية الكبيرة. بدلا من ذلك، يتجمد المحلول الذي يحتوي على الجزيئات الحيوية الكبيرة المستهدفة بسرعة في الجليد الزجاجي. ثم يتم تصويره بحزمة إلكترونية لإنتاج سلسلة من الصور المجهرية ، متجاوزا الحاجة إلى التبلور8. بعد ذلك ، يتم استخدام خوارزميات انتقاء الجسيمات لاستخراج الجسيمات الخام الفردية من هذه الصور المجهرية4،9،10،11،12. نظرا لأن cryo-EM لا يعتمد على التبلور ، فمن الطبيعي أن تكون الجسيمات المستخرجة تالفة في الغالب أو في حالات مطابقة غير مرغوب فيها ، مما يستلزم جولات متعددة من اختيار الجسيمات لتحقيق خريطة كثافة عالية الدقة. في معالجة صور cryo-EM SPA ، يعد اختيار الجسيمات أمرا بالغ الأهمية للحصول على خرائط كثافة عالية الدقة13.
في cryo-EM SPA ، تشتمل طرق اختيار الجسيمات القياسية على تصنيف ثنائي الأبعاد (2D) وثلاثي الأبعاد (3D)14. يصنف تصنيف 2D الجسيمات إلى عدد محدد مسبقا من المجموعات ، مما ينتج عنه صورة متوسطة ودقة 2D تقديرية لكل فئة. يمكن للباحثين بعد ذلك فحص هذه الفئات بصريا ، وإزالة الجسيمات من مجموعات منخفضة الدقة لاستخدام الجسيمات المتبقية في عمليات إعادة البناء التي تهدف إلى تحقيق دقة أعلى. بمجرد إنشاء أوضاع الجسيمات باستخدام خوارزميات الصقل ، سيشرع الباحثون في تصنيف 3D ، وتجميع الجسيمات في فئات متعددة. يتيح ذلك الفحص البصري لخريطة الكثافة المعاد بناؤها لكل فئة ، مما يسمح باستبعاد الجسيمات غير المرغوب فيها ، مثل تلك الموجودة في المطابقات غير المرغوب فيها. بعد جولات متعددة من التصنيف ، يتم الحصول على مجموعة نهائية تضم جزيئات عالية الجودة نسبيا. هذه المداخن النهائية مفيدة في إنتاج خرائط كثافة الدقة الذرية أو شبه الذرية.
أثبتت تشو وزملاؤها أنه يمكن إجراء مزيد من اختيار الجسيمات على هذه المداخن النهائية15. يمكن تطبيق CryoSieve15 ، وهي طريقة تكرارية مبتكرة لاختيار الجسيمات ، لتحسين جودة خريطة الكثافة النهائية عن طريق تقليل عدد الجسيمات بشكل كبير. في حين أن معايير وبرامج فرز الجسيمات الأخرى ، مثل طريقة الارتباط المتبادل (NCC)16 ، ونهج اتساق الرسم البياني الزاوي (AGC)17 ، وتصنيف عدم المحاذاة5 ، قيد الاستخدام حاليا داخل المجال ، فقد ثبت أن هذه الطريقة تتفوق على هذه الخوارزميات من حيث الفعالية.
في هذه الدراسة ، نقدم دليلا مفصلا للعملية برمتها. كدراسة حالة ، قمنا بتطبيق هذه الطريقة الجديدة على مجموعة بيانات أداة تشذيب هيماجلوتينين الإنفلونزا (إدخال EMPYAR: 10097) 18 ، والتي تتضمن 130000 جسيم في مكدسها النهائي. نجح الإجراء الذي أجريناه في التخلص من حوالي 73.8٪ من الجسيمات من المكدس النهائي لمجموعة البيانات هذه ، مما أدى إلى تحسين دقة خريطة الكثافة المعاد بناؤها من 4.11 Å إلى 3.62 Å. بالإضافة إلى أداة تشذيب هيماجلوتينين للأنفلونزا ، يتم عرض النتائج من مجموعات بيانات متعددة في المنشور السابق15 ، والتي تعرض مجموعة متنوعة من الدقة والأوزان الجزيئية للجزيئات الحيوية.
Protocol
1. التثبيت
- فحص وتكوين بيئة تسريع GPU
- افتح الجهاز وأدخل الأمر: nvidia-smi. تأكد من أن الأمر يعرض بنجاح جميع المعلومات حول بطاقة (بطاقات) GPU وأن إصدار CUDA أعلى من 10.2. قم بتنفيذ الأمر: conda -V للتحقق مما إذا كان Conda مثبتا (الشكل التكميلي 1).
- تكوين البيئة الظاهرية
- أدخل الأمر التالي لإعداد البيئة الافتراضية ، مع استبدال CRYOSIEVE_ENV باسم البيئة الذي تريده: كوندا إنشاء -n CRYOSIEVE_ENV python = 3.8 cudatoolkit = 10.2 cupy = 10.0 pytorch = 1.10 -c pytorch -c conda-forge. انتظر بضع دقائق حتى يتم تكوين البيئة بنجاح (الشكل التكميلي 2).
ملاحظة: يتمتع المستخدمون بالمرونة لتعديل اسم البيئة حسب الحاجة. الأمر المقدم خاص ب CUDA 10.2. إذا كنت ترغب في إصدار CUDA مختلف ، فاضبط رقم الإصدار ل cudatoolkit.
- أدخل الأمر التالي لإعداد البيئة الافتراضية ، مع استبدال CRYOSIEVE_ENV باسم البيئة الذي تريده: كوندا إنشاء -n CRYOSIEVE_ENV python = 3.8 cudatoolkit = 10.2 cupy = 10.0 pytorch = 1.10 -c pytorch -c conda-forge. انتظر بضع دقائق حتى يتم تكوين البيئة بنجاح (الشكل التكميلي 2).
- تثبيت كريوسيف
- قم بتنشيط البيئة عن طريق تنفيذ الأمر: conda تنشيط CRYOSIEVE_ENV. قم بتثبيت البرنامج عن طريق التشغيل: pip install cryosieve أو conda install -c mxhulab cryosieve (الشكل التكميلي 3). أدخل cryosieve -h وتأكد من عرض معلومات المساعدة بشكل صحيح (الشكل التكميلي 4).
2. غربلة الجسيمات
- استرجاع البيانات
- قم بتنزيل مجموعة بيانات المكدس النهائي EMPIAR-10097 من EMPIAR (انظر جدول المواد). قم بتنزيل ملف النجمة وملف القناع (mask.mrc) والنموذج الأولي (لخطوة إعادة التقدير ؛ initial.mrc) من Github (انظر جدول المواد). ضع كل هذه الملفات في مجلد معا (الشكل التكميلي 5).
ملاحظة: يستخدم المستودع الموجود في https://github.com/mxhulab/cryosieve-demos Git Large File Storage (Git LFS). يعد تثبيت Git LFS أمرا ضروريا لاستنساخ المستودع بأكمله. بدلا من ذلك ، قم بالوصول إلى الملف عبر رابط GitHub وانقر فوق الزر تنزيل ملف خام لتنزيل ملف فردي.
- قم بتنزيل مجموعة بيانات المكدس النهائي EMPIAR-10097 من EMPIAR (انظر جدول المواد). قم بتنزيل ملف النجمة وملف القناع (mask.mrc) والنموذج الأولي (لخطوة إعادة التقدير ؛ initial.mrc) من Github (انظر جدول المواد). ضع كل هذه الملفات في مجلد معا (الشكل التكميلي 5).
- عملية غربلة الجسيمات
- افتح الجهاز واستخدم الأمر: cd FILEPATH للانتقال إلى المجلد حيث توجد مجموعة البيانات. قم بتنشيط بيئة Conda عن طريق: conda تنشيط CRYOSIEVE_ENV.
- أدخل الأمر التالي لبدء تجربة غربلة الجسيمات: cryosieve --reconstruct_software relion_reconstruct --postprocess_software relion_postprocess --i T40_HA_130K-Equalized_run-data_CryoSPARC_refined.star --o output/ --mask mask.mrc --angpix 1.3099979 --num_iters 10 --frequency_start 40 --frequency_end 3 --retention_ratio 0.8 --sym C3 --num_gpus 1 - التوازن (الشكل التكميلي 5). أثناء التنفيذ ، سيعرض الجهاز سجلات الإخراج لكل تكرار.
ملاحظة: يمكن العثور على تعليمات مفصلة لكل خيار في الملف التكميلي 1. يتم تفصيل وقت المعالجة والحد الأدنى لمتطلبات التنفيذ في الملف التكميلي 2. تم تحسين T40_HA_130K-Equalized_run-data_CryoSPARC_refined.star بواسطة CryoSPARC من T40_HA_130K-Equalized_run-data.star (تم تنزيله من EMPIAR) للتخفيف من الآثار الناجمة عن التقدم في تقنيات تقدير الاتجاه.
3. العثور على التكرار الأمثل
- التحقق من الحلول
- استخدم الأمر: grep "+ FINAL RESOLUTION:" output / _postprocess * .txt لطباعة نتائج الدقة ل 10 تكرارات للغربلة (الشكل 1). نظرا لأن مكدس الجسيمات الذي تمت تصفيتهفي التكرار 7 لديه أعلى دقة مع أقل عدد من الجسيمات ، فمن المحتمل أن يوفر النتيجة المثلى.
ملاحظة: لتجنب نقل المعلومات غير المقصودة من الجسيمات المهملة إلى الجسيمات المحتفظ بها15 وللتأكد من أن نشر مكدس الجسيمات التكرار السابع هو الأمثل بالفعل ، يطلب من المستخدمين تنفيذ خطوة إعادة تقدير للتكرارات القريبة. في هذا البروتوكول ، تخضع التكرارات 4 و 5 و 6 و 7 و 8 للتحقق.
- استخدم الأمر: grep "+ FINAL RESOLUTION:" output / _postprocess * .txt لطباعة نتائج الدقة ل 10 تكرارات للغربلة (الشكل 1). نظرا لأن مكدس الجسيمات الذي تمت تصفيتهفي التكرار 7 لديه أعلى دقة مع أقل عدد من الجسيمات ، فمن المحتمل أن يوفر النتيجة المثلى.
- استيراد الجسيمات المنخل
- افتح واجهة الويب CryoSPARC واتبع الخطوات التالية: أدخل مساحة عمل وانقر على زر المنشئ في أعلى يمين اللوحة. في اللوحة ، حدد وانقر على خيار استيراد مكدس الجسيمات . في قسم المعلمات من لوحة استيراد رصة الجسيمات، حدد مسار تعريف الجسيمات كملف _iter{n}.star الموجود في مجلد مخرجات النتائج المكتملة ومسار بيانات الجسيمات إلى المجلد حيث يتم تخزين ملف mrcs. انقر على زر مهمة قائمة الانتظار ، ثم انقر على زر قائمة الانتظار لبدء العملية. استخدم نفس الطريقة لاستيراد التكرارات المتبقية التي تحتاج إلى إعادة تقدير (الشكل التكميلي 6 أ).
- استيراد النموذج الأولي
- انقر فوق الزر Builder في أعلى يمين اللوحة. في اللوحة ، حدد وانقر على خيار استيراد وحدات تخزين 3D .
- حدد مسار بيانات وحدة التخزين كملف initial.mrc. انقر فوق الزر Queue Job ، ثم انقر فوق الزر Queue لبدء العملية (الشكل التكميلي 6B).
ملاحظة: يمكن أيضا إنشاء النموذج الأولي من خلال إعادة البناء الأولي (الملف التكميلي 3).
- صقل متجانس (بناء وظيفة)
- انقر فوق الزر Builder في أعلى يمين اللوحة. في اللوحة ، حدد وانقر على خيار التحسين المتجانس .
ملاحظة: التحسين غير الموحد قابل للتطبيق أيضا.
- انقر فوق الزر Builder في أعلى يمين اللوحة. في اللوحة ، حدد وانقر على خيار التحسين المتجانس .
- صقل متجانس (استيراد الجسيمات)
- في اللوحة الرئيسية على اليسار ، افتح المهمة لاستيراد مكدس الجسيماتللتكرار 5 (أو التكرار المطلوب). اسحب وحدة الجسيمات المستوردة من الجانب الأيمن من اللوحة الرئيسية وأفلتها في قسم مكدسات الجسيمات في المنشئ على اليمين. أغلق مهمة استيراد مكدس الجسيمات بالنقر فوق علامة X الحمراء في الزاوية اليمنى العليا من اللوحة الرئيسية.
- افتح المهمة لاستيراد وحدات تخزين 3D. اسحب وحدة وحدات التخزين المستوردة من الجانب الأيمن من اللوحة الرئيسية وقم بإفلاتها في قسم وحدة التخزين الأولية في المنشئ على اليمين.
- صقل متجانس (تعديل المعلمات)
- ضمن أضعاف المعلمات ، حدد موقع خيار التماثل واضبطه على C3. ابحث عن خيار فرض إعادة تقسيم GS وقم بتعطيله. انقر على زر مهمة قائمة الانتظار ، ثم انقر على زر قائمة الانتظار لبدء التحسين المتجانس. إجراء تحسين متجانس للتكرارات المتبقية باستخدام نفس الطريقة (الشكل التكميلي 6C-D).
ملاحظة: يعد خيار فرض إعادة تقسيم GS أمرا بالغ الأهمية. يضمن تعطيل هذا الخيار احتفاظ CryoSPARC بالتقسيم القياسي الذهبي الذي يقدمه الملف النجمي ، وتجنب الإفراط في التجهيز. يمكن العثور على الأساس المنطقي التفصيلي لتعطيل Force Re-do GS Split في الملف التكميلي 4.
- ضمن أضعاف المعلمات ، حدد موقع خيار التماثل واضبطه على C3. ابحث عن خيار فرض إعادة تقسيم GS وقم بتعطيله. انقر على زر مهمة قائمة الانتظار ، ثم انقر على زر قائمة الانتظار لبدء التحسين المتجانس. إجراء تحسين متجانس للتكرارات المتبقية باستخدام نفس الطريقة (الشكل التكميلي 6C-D).
- انتظر حتى تنتهي جميع الوظائف من العمل للحصول على النتائج. بناء على النتائج ، تم التأكيد على أن مكدس الجسيمات الذي تمت تصفيته فيالتكرار 6 هو النتيجة المثلى الفعلية.
ملاحظة: من الطبيعي أن يكون للنتائج التي تم الحصول عليها انحرافات عشوائية طفيفة عن النتائج المقدمة في هذا البروتوكول. هذه الانحرافات لا تؤثر على الاستنتاج العام.
النتائج
في هذا البروتوكول ، استخدمنا مجموعة بيانات تقليم الهيماجلوتينين للأنفلونزا (إدخال EMPYAR: 10097) كدليل على فعالية هذه العملية. نظرا للاتجاه المفضل للعينة ، يتطلب الحصول على البيانات إمالة 40 درجة. يظهر البروتين تناظر C3 وله وزن جزيئي يبلغ 150 كيلو دالتون.
لقد قمنا بتنفيذ البروتوكول الموضح سابقا لمعالجة مكدس الجسيمات النهائي. أزال تدريجيا 20٪ من الجسيمات في كل تكرار ، مما أدى إلى نسبة احتفاظ تبلغ 80.0٪ و 64.0٪ و 51.2٪ وهكذا. كما هو موضح في الشكل 1 والشكل 2 ، تحسنت دقة الجسيمات المحتفظ بها في البداية ولكنها انخفضت في النهاية. من بين التكرارات ، تم تحديدالتكرار 6 على أنه المجموعة الفرعية المثلى ، التي تحتوي على أقل عدد من الجسيمات حتى الآن تحقق أعلى دقة. نجحت خوارزميتنا في تحديد مجموعة فرعية من الجسيمات التي تضم 26.2٪ فقط من المكدس الأصلي ، مما أدى إلى تحسين الدقة من 4.19 Å إلى 3.62 Å (أعيد تقديرها بواسطة CryoSPARC) ، كما هو موضح في الشكل 2. علاوة على ذلك ، تمت مقارنة خرائط الكثافة قبل وبعد استخدام CryoSieve في الشكل 3. يتم أيضا عرض منحنى ارتباط فورييه شل (FSC) من نموذج إلى خريطة ومنحنى FSC نصف الخرائط لخرائط الكثافة المعاد بناؤها قبل وبعد الطريقة (الشكل 3A-B). كما تمت مقارنة خرائط الكثافة الخام وخرائط الكثافة الحادة التي تم الحصول عليها ، مع تطبيق مستوى الكنتور المكافئ (الشكل 3C). تمت مقارنة السلاسل الجانبية لخرائط الكثافة الحادة ، مما يدل على تحسين خرائط الكثافة المعاد بناؤها. كما تم اعتماد عامل روزنتال هندرسون B المقدر لمعايير جودة الجسيمات19. بعد إزالة غالبية الجسيمات في المكدس النهائي ، ارتفع عامل Rosenthal-Henderson B من 226.9 Å2 إلى 146.2 Å2 (الشكل 3D). كما تم استخدام الدقة المحلية والعامل Bالمحلي 20 و ResLog21 للمقارنة ، مما يشير إلى أن CryoSieve يعزز بالفعل جودة خرائط الكثافة والجسيمات (الشكل 4).
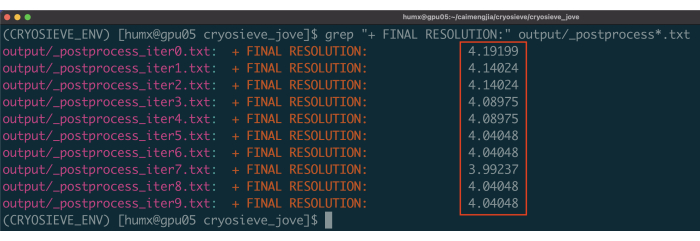
الشكل 1: دقة كل تكرار. يتم تمييز القرارات التي تم الإبلاغ عنها في مربعات حمراء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
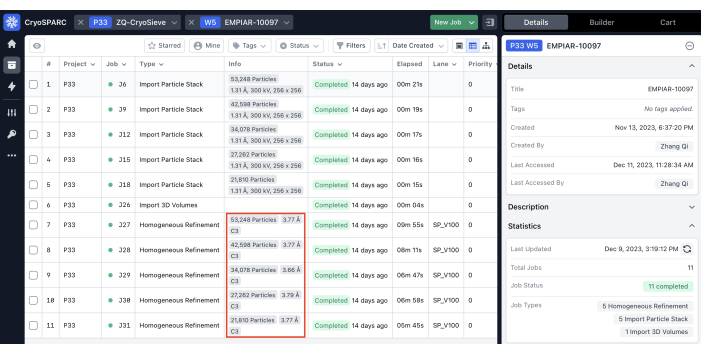
الشكل 2: دقة كل تكرار. يتم تمييز الدقة المحددة بواسطة وظائف التحسين المتجانسة في المربعات الحمراء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
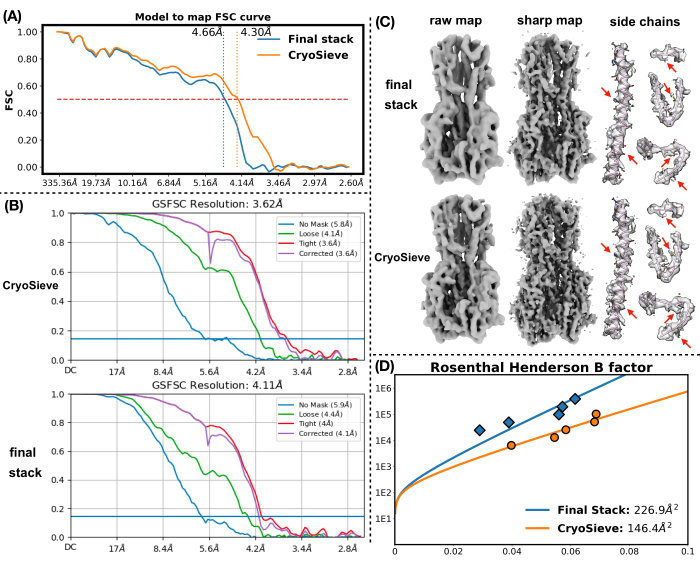
الشكل 3: خرائط الكثافة. (أ) مقارنة منحنى FSC من نموذج إلى خريطة لخرائط الكثافة المعاد بناؤها قبل وبعد استخدام CryoSieve. يمثل المحور ص FSC ، بينما يمثل المحور السيني الدقة. يشير الخط الأحمر المتقطع إلى عتبة 0.5 ل FSC. يوضح الخط المتقطع الرأسي دقة خرائط الكثافة التي تم الحصول عليها تحت عتبة 0.5. (ب) تم الحصول على منحنى FSC لأنصاف الخرائط من خرائط الكثافة المعاد بناؤها قبل وبعد استخدام CryoSieve عبر CryoSPARC. يمثل المحور ص FSC ، بينما يمثل المحور السيني الدقة. (ج) عرضت خرائط الكثافة الخام وخرائط الكثافة الحادة لكل من الجسيمات المحتفظ بها بواسطة CryoSieve والمجموعة الكاملة من الجسيمات في المداخن النهائية. تم تطبيق مستوى الكنتور المكافئ 0.65 لخرائط الكثافة الأولية. تم تطبيق مستوى الكنتور المكافئ 0.84 لخرائط الكثافة الحادة. تم الحصول على خرائط الكثافة الحادة مباشرة بواسطة CryoSPARC. تمت معالجة خرائط الكثافة الحادة تلقائيا ، أولا مرجحة FSC (بناء على FSCs المقدمة من CryoSPARC). بعد ذلك ، تم شحذ العامل B باستخدام عوامل B المحددة تلقائيا (232.0 Å2 لجميع الجسيمات في المكدس النهائي و 160.8 Å2 ل CryoSieve). تمت مقارنة السلاسل الجانبية في خرائط الكثافة الحادة ، مع دمج النماذج الذرية كمرجع. تبرز الأسهم الحمراء المناطق المحسنة. (د) تم عرض عامل روزنتال-هندرسون B المقدر لكل من الجسيمات المحتفظ بها بواسطة CryoSieve والمجموعة الكاملة من الجسيمات في المداخن النهائية. يمثل المحور ص عدد الجسيمات المستخدمة ، ويمثل المحور السيني مقلوب مربع الدقة. بالانتقال من أعلى إلى أسفل ، تمثل كل نقطة نصف جزيئات النقطة السابقة. تم تحديد القرارات عن طريق الصقل. تم تحديد العوامل B باستخدام تقريب المربعات الصغرى للنقاط المقاسة ، كما هو موضح في منحنيات التركيب. يشار إلى العوامل B المقدرة لروزنتال وهندرسون في الأساطير: يمثل اللون البرتقالي الجسيمات التي يحتفظ بها CryoSieve ، بينما يشير اللون الأزرق إلى جميع الجسيمات في المكدس النهائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
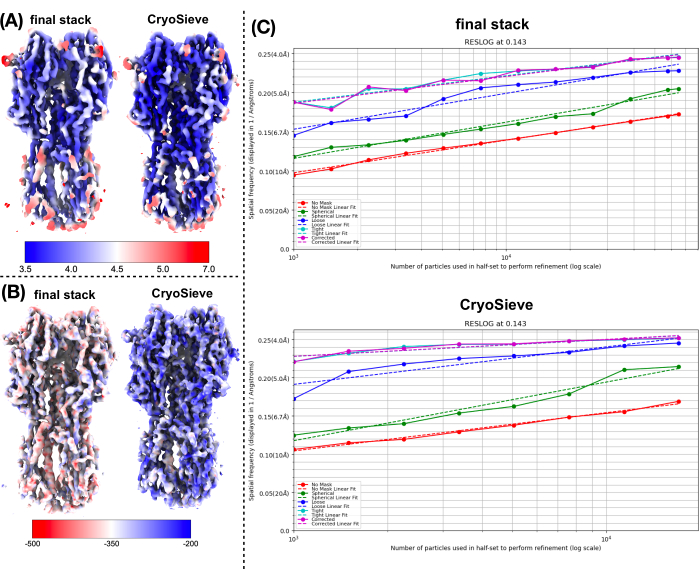
الشكل 4: مقارنة المقاييس المختلفة لخرائط الكثافة. (أ) مقارنة خرائط الاستبانة المحلية قبل وبعد استخدام CryoSieve الذي تم الحصول عليه بواسطة CryoSPARC. تتراوح الدقة المحلية بين 7 Å (أحمر) و 3.5 Å (أزرق). (B) مقارنة خرائط الكثافة قبل وبعد استخدام CryoSieve ، ملونة بخريطة العامل B المحلية التي تم الحصول عليها بواسطة LocBFactor باستخدام نطاق دقة [20-3.5] Å. (C) ، مقارنة مخططات ResLog قبل وبعد استخدام CryoSieve التي تم الحصول عليها بواسطة CryoSPARC. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: استخدام الأوامر nvidia-smi و conda -V للتحقق من المتطلبات الأساسية. إذا تم استيفاء المتطلبات الأساسية ، فإن كتابة الأمر nvidia-smi سيعرض إصدار برنامج تشغيل GPU وإصدار CUDA وحالة بطاقات GPU. وبالمثل ، يجب أن يؤدي إدخال الأمر conda -V إلى عرض الإصدار المثبت من Conda بشكل صحيح. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 2: عملية إنشاء بيئات تسريع GPU جديدة. تعرض الشاشة الإخراج الناتج الناتج عن الأمر المستخدم لإنشاء بيئة Conda. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 3: تركيب CryoSieve في بيئة تسريع GPU. بعد تنشيط بيئة Conda التي تم إنشاؤها حديثا ، تعرض الشاشة الإخراج الناتج عن تنفيذ الأمر لتثبيت CryoSieve باستخدام Pip. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 4: معلومات المساعدة. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 5: عملية التشغيل. عند تنفيذ CryoSieve من خلال سطر الأوامر ، تعرض الشاشة بعد ذلك معلومات تتعلق بعملية التشغيل. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 6: تكوين وظائف CryoSPARC. (أ) استيراد كومة الجسيمات. (ب) استيراد أحجام 3D. (ج-د) صقل متجانس. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 1: خيارات CryoSieve. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 2: وقت المعالجة والحد الأدنى من المتطلبات لتشغيل Cryosieve. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 3: توليد النموذج الأولي بواسطة CryoSPARC. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 4: الأساس المنطقي لتعطيل إعادة تقسيم القوة GS. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 5: خيارات كريوسييف-csrefine. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 6: خيارات عامل التبريد-csrhbfactor. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يقف Cryo-EM كتقنية محورية لتوضيح هياكل الجزيئات البيولوجية. في هذه العملية ، بعد جمع البيانات عبر الفحص المجهري ، يعد استخراج الجسيمات من الصور المجهرية أمرا ضروريا ، يليه تصنيفها على مراحل متعددة لتجميع المكدس النهائي. ويتمثل أحد التحديات الشائعة في غلبة الجسيمات التالفة أو المطابقة بشكل غير مرغوب فيه، مما يؤكد الحاجة إلى الاختيار المتكرر للجسيمات للحصول على خرائط عالية الكثافة. وهذا يجعل اختيار الجسيمات خطوة حاسمة في cryo-EM SPA لتحقيق خرائط كثافة عالية الجودة. تشمل تقنيات اختيار الجسيمات الحالية خوارزمية التحقق الإحصائي غير المائل22 ، والنهج القائم على درجة z23 ، وطريقة تقدير الدقة الزاوية24.
يظهر CryoSieve كأداة قيمة في هذا السياق ، وهو بارع في التخلص من عدد كبير من الجسيمات الدخيلة من المكدس النهائي. لا يعزز هذا التخفيض الكفاءة الحسابية لإعادة الإعمار فحسب ، بل يبسط العملية أيضا. وهو يوفر مجموعة شاملة لاختيار الجسيمات، حيث يتوقف مدى تجاهل الجسيمات وما يترتب على ذلك من تحسن في الاستبانة إلى حد كبير على نوعية البيانات الأولية والمنهجيات المستخدمة في معالجة البيانات.
في هذه المخطوطة ، قدمنا سير عمل كامل لغربلة الجسيمات باستخدام مجموعة بيانات الحالة الحقيقية لأداة تشذيب الهيماجلوتينين للأنفلونزا (إدخال EMPYAR: 10097). يمكن تلخيص الخطوات التي تمت تغطيتها ومناقشتها هنا على أنها غربلة الجسيمات وإعادة تقديرها. حقق الحجم النهائي المعاد بناؤه ثلاثي الأبعاد دقة 3.62 Å ، وكانت السلاسل الجانبية في حلزونات ألفا أكثر وضوحا في الحجم بعد المعالجة مقارنة بخريطة الكثافة المنشورة.
CryoSieve هي طريقة مفتوحة المصدر متوفرة على GitHub (https://github.com/mxhulab/cryosieve). يمكن أيضا العثور على برنامج تعليمي مفصل على صفحته الرئيسية. يمكن للمستخدمين تثبيته واستخدامه باتباع البرنامج التعليمي. بالإضافة إلى ذلك ، يتم توفير وحدتين ، cryosieve-csrefine و cryosieve-csrhbfactor. تم تصميم وحدة cryosieve-csrefine خصيصا لأتمتة التنفيذ المتسلسل للعمليات المختلفة داخل CryoSPARC (الملف التكميلي 5). وتشمل هذه العمليات استيراد مداخن الجسيمات وإجراء وظائف التحسين المتجانس أو الصقل غير المنتظم. من ناحية أخرى ، تم تصميم وحدة cryosieve-csrhbfactor لأتمتة تحديد عامل Rosenthal-Henderson B من خلال الاستفادة من قدرات cryosieve-csrefine (الملف التكميلي 6).
في الوقت الحاضر ، يقتصر تطبيق هذه الطريقة على سيناريوهات التشكل الفردية. وبالتالي ، في الحالات التي تمثل فيها الجسيمات توافقات متعددة ، تكون قدراتها محدودة. ينصح المستخدمون بالانخراط في البداية في تصنيف 3D لفصل جزيئات المطابقات المتباينة قبل توظيفها لاختيار الجسيمات المكررة. علاوة على ذلك ، على الرغم من أن الطريقة توضح الكفاءة في تصفية أكثر من 50٪ من الجسيمات من المكدس النهائي ، إلا أن أصول هذه الجسيمات المهملة والأسباب الكامنة وراء مساهمتها الضئيلة في جودة إعادة الإعمار لا تزال غير واضحة. تتطلب هذه الفجوة في الفهم إجراء بحث إضافي لمعالجة هذا القيد بشكل شامل وربما تصحيحه.
هناك ثلاث طرق موجودة ممكنة لفرز الجسيمات أو غربلة الجسيمات. بادئ ذي بدء ، يمكن ل cisTEM4 الإبلاغ عن درجة لكل صورة جسيم واحدة بعد تحسين 3D. يمكن للمستخدمين فرز الجسيمات باستخدام درجة cisTEM لتجاهل الجسيمات. نهج اتساق الرسم البياني الزاوي (AGC)17 هو أيضا طريقة للتخلص من الجسيمات المنحرفة. علاوة على ذلك ، فإن تصنيف عدم المحاذاة5 هو طريقة تقليدية للتخلص من الجسيمات باستخدام تصنيف 3D. قارنا جودة الجسيمات المحتفظ بها بهذه الطرق مع CryoSieve ووجدنا أن الجسيمات المحتفظ بها من CryoSieve ذات جودةأعلى 15. تتفوق الطريقة المعروضة هنا بشكل كبير على الطرق البديلة وتحقق أقل عدد من الجسيمات بنفس الدقة.
كما هو موضح في النتيجة ، فإن غالبية الجسيمات في المكدس النهائي cryo-EM لا تساهم في إعادة بناء خريطة الكثافة. بعبارة أخرى ، من بين جميع الجسيمات التي تم جمعها أثناء التقاط الصور ، فإن قلة مختارة فقط ، وهي أفضل مجموعة فرعية ، تساهم بالفعل في إعادة البناء النهائية. وبالتالي ، فإن نسبة هذه المجموعة الفرعية النهائية إلى العدد الإجمالي للجسيمات المجمعة يمكن أن تكون بمثابة مقياس كمي لتقييم جودة العينة. كلما زادت هذه النسبة ، كانت جودة العينة أفضل. على الرغم من التطورات التقنية التي جعلت cryo-EM في متناول علماء الأحياء الهيكلية ، لا يزال إعداد العينات يمثل عنق الزجاجة الرئيسي في سير العمل. وبالتالي يركز العلماء والمهندسون جهودهم على هذا التحدي25. في تحليل الجسيمات المفردة (SPA) ، يتكون تحضير العينة من خطوتين حاسمتين: تحسين العينة وإعداد الشبكة. الأول ينطوي على تنقية العينة مع الحفاظ على حالتها الكيميائية الحيوية المثلى. يستلزم هذا الأخير إعداد العينة للتحليل في المجهر ، بما في ذلك المعالجة الكيميائية أو البلازما للشبكة ، وترسب العينة ، والتزجيج. تم اقتراح العديد من التقنيات لمعالجة عدم الاستقرار الجزيئي ، لكن فعالية نهج واحد على الآخر تعتمد على خصائص العينة25,26. في الوقت الحالي ، تتأثر نتائج إعداد الشبكة بشدة بخبرة المستخدم وتجربته ، مما قد يجعل العملية تستغرق وقتا طويلا وصعبة27,28. تشكل المتغيرات العديدة التي تمت مواجهتها في إعداد العينة والشبكة تحديات في إقامة علاقات السبب والنتيجة ، حيث لا يمكن للباحثين تقييم العينة إلا على المستوى الجزيئي باستخدام المجهر. نتيجة لذلك ، لا تزال الإحصاءات الكمية من مقارنات بين بروتوكولات إعداد العينات والشبكة المختلفة غير موجودة ، ومن الضروري اتباع نهج منهجي للتحقيق في الاتجاهات وفهم الآليات الأساسية لسلوك العينة29.
Disclosures
جميع المؤلفين الآخرين يعلنون عدم وجود مصالح متنافسة.
Acknowledgements
تم دعم هذا العمل من قبل أكاديمية Shenzhen للبحوث والترجمة (إلى M.H.) ، ومركز الابتكار المتقدم للبيولوجيا الهيكلية (إلى M.H.) ، ومركز بكين لأبحاث الحدود للبنية البيولوجية (إلى M.H.) ، والبرنامج الوطني للبحث والتطوير الرئيسي في الصين (رقم 2021YFA1001300) (إلى C.B.) ، والمؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 12271291) (إلى C.B.) ، والمؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 12071244) (إلى Z.S.).
Materials
| Name | Company | Catalog Number | Comments |
| CryoSPARC | Structura Biotechnology Inc. Toronto, Canada | CryoSPARC (Cryo-EM Single Particle Ab-Initio Reconstruction and Classification) is a state of the art HPC software solution for complete processing of single-particle cryo-electron microscopy (cryo-EM) data. CryoSPARC is useful for solving cryo-EM structures of membrane proteins, viruses, complexes, flexible molecules, small particles, phase plate data and negative stain data. | |
| EMPIAR-10097 Dataset | https://ftp.ebi.ac.uk/empiar/world_availability/10097/data/Particle-Stack/T40_HA_130K-Equalized-Particle-Stack.mrcs | This dataset comprises single-particle cryo-EM data of the Influenza Hemagglutinin trimer, characterized by its highly preferred orientation, collected using a 40-degree tilted collection strategy. | |
| initial.mrc | https://github.com/mxhulab/cryosieve-demos/tree/master/EMPIAR-10097 | ||
| mask.mrc | https://github.com/mxhulab/cryosieve-demos/tree/master/EMPIAR-10097 | ||
| RELION | 4.0-beta-2 | RELION (REgularised LIkelihood OptimisatioN) is an open-source software for cryo-electron microscopy (cryo-EM) data processing, particularly for refining macromolecular structures. Utilizing a Bayesian approach, it excels in separating signal from noise, enabling high-resolution structure determination. RELION supports single-particle analysis, tomography, and sub-tomogram averaging, and has become widely used in structural biology due to its effectiveness and user-friendly interface. | |
| T40_HA_130K-Equalized_run-data_CryoSPARC_refined.star | https://github.com/mxhulab/cryosieve-demos/tree/master/EMPIAR-10097 | Metadata file for the final stack of particles from EMPIAR-10097 |
References
- Bai, X. C., Fernandez, I. S., Mcmullan, G., Scheres, S. H. Ribosome structures to near-atomic resolution from thirty thousand cryo-em particles. elife. 2, 00461 (2013).
- Campbell, M. G., et al. Movies of ice-embedded particles enhance resolution in electron cryo-microscopy. Structure. 20 (11), 1823-1828 (2012).
- Li, X., et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-em. Nat Meth. 10 (6), 584-590 (2013).
- Grant, T., Rohou, A., Grigorieff, N. Cis tem, user-friendly software for single-particle image processing. eLife. 7, e35383 (2018).
- Scheres, S. H. Relion: Implementation of a bayesian approach to cryo-em structure determination. J Str Biol. 180 (3), 519-530 (2012).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. Cryosparc: Algorithms for rapid unsupervised cryo-em structure determination. Nat Meth. 14 (3), 290-296 (2017).
- Kühlbrandt, W. The resolution revolution. Science. 343 (6178), 1443-1444 (2014).
- Dubochet, J., et al. Cryo-electron microscopy of vitrified specimens. Quart Rev Biophys. 21 (2), 129-228 (1988).
- Wagner, T., et al. Sphire-cryolo is a fast and accurate fully automated particle picker for cryo-EM. Comm Biol. 2 (1), 218 (2019).
- Bepler, T., et al. Positive-unlabeled convolutional neural networks for particle picking in cryo-electron micrographs. Nat Meth. 16 (11), 1153-1160 (2019).
- Wang, F., et al. Deeppicker: A deep learning approach for fully automated particle picking in cryo-em. J Str Biol. 195 (3), 325-336 (2016).
- Heimowitz, A., Andén, J., Singer, A. Apple picker: Automatic particle picking, a low-effort cryo-em framework. J Str Biol. 204 (2), 215-227 (2018).
- Glaeser, R. M. How good can single-particle cryo-em become? What remains before it approaches its physical limits. Ann Rev Biophys. 48, 45-61 (2019).
- Diiorio, M. C., Kulczyk, A. W. A robust single-particle cryo-electron microscopy (cryo-em) processing workflow with cryosparc, relion, and scipion. J Vis Exp. (179), e63387 (2022).
- Zhu, J., et al. A minority of final stacks yields superior amplitude in single-particle cryo-em. Nat Comm. 14 (1), 7822 (2023).
- Zhou, Y., Moscovich, A., Bendory, T., Bartesaghi, A. Unsupervised particle sorting for high-resolution single-particle cryo-em. Inv Probl. 36 (4), 044002 (2020).
- Méndez, J., Garduno, E., Carazo, J. M., Sorzano, C. O. S. Identification of incorrectly oriented particles in cryo-em single particle analysis. J Str Biol. 213 (3), 107771 (2021).
- Tan, Y. Z., et al. Addressing preferred specimen orientation in single-particle cryo-em through tilting. Nat Meth. 14 (8), 793-796 (2017).
- Rosenthal, P. B., Henderson, R. Optimal determination of particle orientation, absolute hand, and contrast loss in single-particle electron cryomicroscopy. J Mol Biol. 333 (4), 721-745 (2003).
- Kaur, S., et al. Local computational methods to improve the interpretability and analysis of cryo-em maps. Nat Comm. 12 (1), 1240 (2021).
- Stagg, S. M., Noble, A. J., Spilman, M., Chapman, M. S. Reslog plots as an empirical metric of the quality of cryo-em reconstructions. J Str Biol. 185 (3), 418-426 (2014).
- Vargas, J., Otón, J., Marabini, R., Carazo, J. M., Sorzano, C. Particle alignment reliability in single particle electron cryomicroscopy: A general approach. Sci Rep. 6 (1), 21626 (2016).
- Vargas, J., et al. Particle quality assessment and sorting for automatic and semiautomatic particle-picking techniques. J Str Biol. 183 (3), 342-353 (2013).
- Vargas, J., Melero, R., Gomez-Blanco, J., Carazo, J. -. M., Sorzano, C. O. S. Quantitative analysis of 3d alignment quality: Its impact on soft-validation, particle pruning and homogeneity analysis. Sci Rep. 7 (1), 6307 (2017).
- Carragher, B., et al. Current outcomes when optimizing 'standard'sample preparation for single-particle cryo-em. J Microsc. 276 (1), 39-45 (2019).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallographica Sec D: Str Biol. 74 (6), 560-571 (2018).
- Glaeser, R. M. How good can cryo-em become. Nat Meth. 13 (1), 28-32 (2016).
- Kim, L. Y., et al. Benchmarking cryo-em single particle analysis workflow. Front Mol Biosci. 5, 50 (2018).
- Weissenberger, G., Henderikx, R. J., Peters, P. J. Understanding the invisible hands of sample preparation for cryo-em. Nat Meth. 18 (5), 463-471 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved