Method Article
Tek Parçacıklı Kriyojenik Elektron Mikroskobu Son Yığınlarındaki Parçacıkların Çoğunu Kaldırarak Yoğunluk Haritalarının Geliştirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Cryo-EM için gelişmiş bir parçacık seçim yöntemi olan CryoSieve, gerçek dünyadaki bir veri seti üzerindeki uygulamasıyla gösterildiği gibi, nihai yığınlardaki parçacıkların çoğunu kaldırarak yoğunluk haritası çözünürlüğünü iyileştirir.
Özet
Son on yılda, kriyojenik elektron mikroskobu (kriyo-EM) tek parçacık analizi (SPA) alanındaki teknoloji ve metodolojideki gelişmeler, biyolojik makromoleküllerin yüksek çözünürlüklü yapısal incelemesi için kapasitemizi önemli ölçüde geliştirmiştir. Bu ilerleme, baskın yöntem olarak X-ışını kristalografisinin yerini alarak ve biyolojide uzun süredir devam eden sorulara cevaplar sağlayarak yeni bir moleküler içgörü çağını başlattı. Cryo-EM, X-ışını kristalografisinin önemli bir sınırlaması olan kristalleşmeye bağlı olmadığından, değişen kalitedeki parçacıkları yakalar. Sonuç olarak, seçilen parçacıkların kalitesi yeniden yapılandırılmış yoğunluk haritasının çözünürlüğünü doğrudan etkilediğinden, parçacıkların seçimi çok önemlidir. CryoSieve olarak adlandırılan, parçacık seçimi için yenilikçi bir yinelemeli yaklaşım, son yığındaki parçacık sayısını etkili bir şekilde azaltarak yeniden yapılandırılmış yoğunluk haritalarının kalitesini önemli ölçüde artırır. Deneysel kanıtlar, bu yöntemin nihai yığınlardaki parçacıkların çoğunu ortadan kaldırabildiğini ve yoğunluk haritalarının kalitesinde kayda değer bir artışa yol açtığını göstermektedir. Bu makale, bu yaklaşımın ayrıntılı iş akışını özetler ve uygulamasını gerçek dünyadaki bir veri kümesinde gösterir.
Giriş
Kriyojenik elektron mikroskobu (cryo-EM) tek parçacık analizi (SPA), biyolojik makromoleküllerin yüksek çözünürlüklü üç boyutlu yoğunluk haritalarını belirlemek için baskın bir yöntem haline gelmiştir. Çözünürlükdevrimi 7 olarak adlandırılan bir dizi teknolojik yenilik 1,2,3,4,5,6 nedeniyle, cryo-EM, biyolojik makromoleküllerin yapılarını benzeri görülmemiş bir oranda atomik çözünürlüğe kadar belirleme yeteneğine sahiptir. Bu atılım, moleküler içgörülerde yeni bir çağın başlangıcını işaret ediyor, baskın teknik olarak X-ışını kristalografisini geride bırakıyor ve uzun süredir devam eden biyolojik soruları yanıtlıyor.
Cryo-EM SPA, biyolojik makromoleküllerin kristalizasyonunu gerektirmeyerek X-ışını kristalografisinden ayrılır. Bunun yerine, hedef biyolojik makromolekülleri içeren bir çözelti camsı buz içinde hızla dondurulur. Daha sonra, kristalleşme ihtiyacını atlayarak bir dizi mikrograf üretmek için bir elektron ışını ile görüntülenir8. Daha sonra, bu mikrograflardan 4,9,10,11,12 ayrı ayrı ham parçacıkları çıkarmak için parçacık toplama algoritmaları kullanılır. Cryo-EM kristalleşmeye bağlı olmadığından, ekstrakte edilen partiküllerin ağırlıklı olarak hasar görmesi veya istenmeyen konformasyonel durumlarda olması doğaldır, bu da yüksek çözünürlüklü bir yoğunluk haritası elde etmek için birden fazla partikül seçimi turu gerektirir. Cryo-EM SPA görüntü işlemede, partikül seçimi bu nedenle yüksek çözünürlüklü yoğunluk haritaları elde etmek için çok önemlidir13.
Cryo-EM SPA'da standart parçacık seçim yöntemleri, iki boyutlu (2D) ve üç boyutlu (3D) sınıflandırmayıiçerir 14. 2D sınıflandırması, parçacıkları önceden tanımlanmış sayıda gruba ayırarak her sınıf için ortalama bir görüntü ve tahmini bir 2D çözünürlük verir. Araştırmacılar daha sonra bu sınıfları görsel olarak inceleyebilir, daha yüksek çözünürlük elde etmeyi amaçlayan rekonstrüksiyonlarda kalanları kullanmak için daha düşük çözünürlük gruplarından parçacıkları çıkarabilirler. İyileştirme algoritmaları kullanılarak parçacık pozları oluşturulduktan sonra, araştırmacılar parçacıkları birden çok sınıfa ayırarak 3D sınıflandırmaya devam edecekler. Bu, her sınıf için yeniden yapılandırılmış yoğunluk haritasının görsel olarak incelenmesini sağlayarak, istenmeyen konformasyonlardan olanlar gibi istenmeyen parçacıkların hariç tutulmasına izin verir. Birden fazla sınıflandırma turunun ardından, nispeten yüksek kaliteli parçacıklardan oluşan nihai bir yığın elde edilir. Bu son yığınlar, atomik veya atoma yakın çözünürlüklü yoğunluk haritalarının üretilmesinde etkilidir.
Zhu ve meslektaşları, bu son yığınlar15 üzerinde daha fazla parçacık seçimi yapılabileceğini gösterdiler. Parçacık seçimi için yenilikçi bir yinelemeli yöntem olan CryoSieve15, parçacık sayısını önemli ölçüde azaltarak nihai yoğunluk haritasının kalitesini artırmak için uygulanabilir. Normalleştirilmiş çapraz korelasyon (NCC) yöntemi16, açısal grafik tutarlılığı (AGC) yaklaşımı17 ve hizalamama sınıflandırması5 gibi diğer parçacık sıralama kriterleri ve yazılımları şu anda sahada kullanılıyor olsa da, bu yöntemin etkinlik açısından bu algoritmalardan daha iyi performans gösterdiği gösterilmiştir.
Bu çalışmada, tüm süreç için ayrıntılı bir rehber sunuyoruz. Bir vaka çalışması olarak, bu yeni yöntemi, son yığınında 130.000 parçacık içeren influenza hemaglutinin trimerinin (EMPIAR girişi: 10097)18 veri setine uyguladık. Prosedürümüz, bu veri setinin son yığınından parçacıkların yaklaşık% 73.8'ini başarıyla attı ve yeniden yapılandırılmış yoğunluk haritasının çözünürlüğünü 4.11 Å'den 3.62 Å'ye yükseltti. İnfluenza hemaglutinin trimerine ek olarak, çoklu veri kümelerinden elde edilen sonuçlar, biyomoleküllerin çeşitli çözünürlüklerini ve moleküler ağırlıklarını sergileyen önceki yayın15'te sunulmuştur.
Protokol
1. Kurulum
- GPU hızlandırma ortamını kontrol edin ve yapılandırın
- Terminali açın ve şu komutu girin: nvidia-smi. Komutun GPU kartlarıyla ilgili tüm bilgileri başarıyla görüntülediğinden ve CUDA sürümünün 10.2'den yüksek olduğundan emin olun. Conda'nın kurulu olup olmadığını kontrol etmek için conda -V komutunu yürütün (Ek Şekil 1).
- Sanal ortamı yapılandırma
- Sanal ortamı ayarlamak için aşağıdaki komutu girin, CRYOSIEVE_ENV yerine istediğiniz ortam adını yazın: conda create -n CRYOSIEVE_ENV python=3.8 cudatoolkit=10.2 cupy=10.0 pytorch=1.10 -c pytorch -c conda-forge. Ortam başarıyla yapılandırılana kadar birkaç dakika bekleyin (Ek Şekil 2).
NOT: Kullanıcılar, ortam adını gerektiği gibi değiştirme esnekliğine sahiptir. Sağlanan komut CUDA 10.2'ye özgüdür. Farklı bir CUDA sürümü isteniyorsa, cudatoolkit için sürüm numarasını ayarlayın.
- Sanal ortamı ayarlamak için aşağıdaki komutu girin, CRYOSIEVE_ENV yerine istediğiniz ortam adını yazın: conda create -n CRYOSIEVE_ENV python=3.8 cudatoolkit=10.2 cupy=10.0 pytorch=1.10 -c pytorch -c conda-forge. Ortam başarıyla yapılandırılana kadar birkaç dakika bekleyin (Ek Şekil 2).
- CryoSieve'i yükleyin
- Şu komutu çalıştırarak ortamı etkinleştirin: conda activate CRYOSIEVE_ENV. Yazılımı şu komutu çalıştırarak yükleyin: pip install cryosieve veya conda install -c mxhulab cryosieve (Ek Şekil 3). cryosieve -h girin ve yardım bilgilerinin doğru şekilde görüntülendiğinden emin olun (Ek Şekil 4).
2. Parçacık eleme
- Verileri alma
- EMPIAR-10097 son yığın veri setini EMPIAR'dan indirin (Malzeme Tablosuna bakın). Github'dan yıldız dosyasını, maske dosyasını (mask.mrc) ve ilk modeli (yeniden tahmin adımı için; initial.mrc) indirin (Malzeme Tablosuna bakın). Tüm bu dosyaları birlikte bir klasöre yerleştirin (Ek Şekil 5).
NOT: https://github.com/mxhulab/cryosieve-demos'daki depo, Git Büyük Dosya Depolama'yı (Git LFS) kullanır. Git LFS'yi yüklemek, tüm depoyu klonlamak için çok önemlidir. Alternatif olarak, GitHub bağlantısı aracılığıyla dosyaya erişin ve tek bir dosyayı indirmek için Ham dosyayı indir düğmesine tıklayın.
- EMPIAR-10097 son yığın veri setini EMPIAR'dan indirin (Malzeme Tablosuna bakın). Github'dan yıldız dosyasını, maske dosyasını (mask.mrc) ve ilk modeli (yeniden tahmin adımı için; initial.mrc) indirin (Malzeme Tablosuna bakın). Tüm bu dosyaları birlikte bir klasöre yerleştirin (Ek Şekil 5).
- Proses partikül eleme
- Terminali açın ve şu komutu kullanın: cd FILEPATH veri kümesinin bulunduğu klasöre gitmek için. Conda ortamını şu şekilde etkinleştirin: conda CRYOSIEVE_ENV etkinleştirin.
- Parçacık eleme deneyimizi başlatmak için aşağıdaki komutu girin: cryosieve --reconstruct_software relion_reconstruct --postprocess_software relion_postprocess --i T40_HA_130K-Equalized_run-data_CryoSPARC_refined.star --o output/ --mask mask.mrc --angpix 1.3099979 --num_iters 10 --frequency_start 40 --frequency_end 3 --retention_ratio 0.8 --sym C3 --num_gpus 1 --balance (Ek Şekil 5). Yürütme sırasında terminal, her yineleme için çıkış günlüklerini görüntüler.
NOT: Her seçenek için ayrıntılı talimatlar Ek Dosya 1'de bulunabilir. İşlem süresi ve yürütme için minimum gereksinimler Ek Dosya 2'de ayrıntılı olarak açıklanmıştır. T40_HA_130K-Equalized_run-data_CryoSPARC_refined.star, oryantasyon tahmin tekniklerindeki ilerlemelerin getirdiği etkileri azaltmak için T40_HA_130K-Equalized_run-data.star'dan (EMPIAR'dan indirildi) CryoSPARC tarafından rafine edildi.
3. En uygun yinelemeyi bulma
- Çözünürlükleri kontrol edin
- Şu komutu kullanın: grep "+ FINAL RESOLUTION:" output/_postprocess*.txt 10 eleme yinelemesi için çözünürlük sonuçlarını yazdırmak için (Şekil 1). 7. yinelemede filtrelenen parçacık yığını, en az parçacıkla en yüksek çözünürlüğe sahip olduğundan, en iyi sonucu vermesi muhtemeldir.
NOT: Atılan parçacıklardan tutulan parçacıklara15 kasıtsız bilgi aktarımını önlemek ve parçacık yığını gönderilerinin 7. yinelemenin gerçekten optimum olduğundan emin olmak için, kullanıcıların yakındaki yinelemeler için bir yeniden tahmin adımı yürütmeleri gerekir. Bu protokolde 4, 5, 6, 7 ve 8 numaralı yinelemeler doğrulamaya tabi tutulur.
- Şu komutu kullanın: grep "+ FINAL RESOLUTION:" output/_postprocess*.txt 10 eleme yinelemesi için çözünürlük sonuçlarını yazdırmak için (Şekil 1). 7. yinelemede filtrelenen parçacık yığını, en az parçacıkla en yüksek çözünürlüğe sahip olduğundan, en iyi sonucu vermesi muhtemeldir.
- Elenmiş parçacıkları içe aktarın
- CryoSPARC web arayüzünü açın ve şu adımları izleyin: Bir çalışma alanına girin ve panelin sağ üst köşesindeki Oluşturucu düğmesine tıklayın. Panelde, Parçacık Yığınını İçe Aktar seçeneğini seçin ve tıklayın. Parçacık Yığını İçe Aktarma panelinin Parametreler bölümünde, tamamlanan sonuçların çıktı klasöründe bulunan _iter{n}.star dosyası olarak Parçacık meta yolunu ve mrcs dosyasının depolandığı klasörün parçacık veri yolunu belirtin. Queue Job (İşi Kuyrukla ) düğmesine tıklayın, ardından işlemi başlatmak için Queue (Kuyruk ) düğmesine tıklayın. Yeniden tahmin edilmesi gereken kalan yinelemeleri içe aktarmak için aynı yolu kullanın (Ek Şekil 6A).
- İlk modeli içe aktar
- Panelin sağ üst köşesindeki Oluşturucu düğmesine tıklayın. Panelde, 3D Birimleri İçe Aktar seçeneğini seçin ve tıklayın.
- Birim veri yolunu initial.mrc dosyası olarak belirtin. Kuyruk İşi düğmesine tıklayın, ardından işlemi başlatmak için Kuyruk düğmesine tıklayın (Ek Şekil 6B).
NOT: İlk model, ab initio rekonstrüksiyonu yoluyla da oluşturulabilir (Ek Dosya 3).
- Homojen iyileştirme (Yapı işi)
- Panelin sağ üst köşesindeki Oluşturucu düğmesine tıklayın. Panelde, Homojen İyileştirme seçeneğini seçin ve tıklayın.
NOT: Tekdüze olmayan iyileştirme de geçerlidir.
- Panelin sağ üst köşesindeki Oluşturucu düğmesine tıklayın. Panelde, Homojen İyileştirme seçeneğini seçin ve tıklayın.
- Homojen arıtma (İthalat partikülleri)
- Soldaki ana panelde, 5. yinelemenin (veya istenen yinelemenin) parçacık yığınını içe aktarmak için işi açın. İçe aktarılan parçacık modülünü ana panelin sağ tarafından sürükleyin ve Oluşturucu'nun sağdaki Parçacık yığınları bölümüne bırakın. Ana panelin sağ üst köşesindeki kırmızı X işaretine tıklayarak Parçacık Yığınını İçe Aktar işini kapatın.
- 3B hacimleri içe aktarmak için işi açın. İçe aktarılan birimler modülünü ana panelin sağ tarafından sürükleyin ve Oluşturucu'nun sağdaki İlk birim bölümüne bırakın.
- Homojen arıtma (Parametreleri değiştirin)
- Parametreler katlamasının altında, Simetri seçeneğini bulun ve C3 olarak ayarlayın. GS bölmesini yeniden yapmaya zorla seçeneğini bulun ve devre dışı bırakın. Queue Job (İşi Kuyrukla ) düğmesine tıklayın, ardından Homojen İyileştirme'yi başlatmak için Queue (Kuyruk) düğmesine tıklayın. Aynı yöntemi kullanarak kalan yinelemeler için Homojen İyileştirme gerçekleştirin (Ek Şekil 6C-D).
NOT: GS bölmeyi yeniden yapmaya zorla seçeneği çok önemlidir. Bu seçeneğin devre dışı bırakılması, CryoSPARC'ın yıldız eğe tarafından verilen altın standart bölmeyi korumasını sağlayarak aşırı sığdırmayı önler. Force Re-do GS Split'i devre dışı bırakmak için ayrıntılı bir gerekçe Ek Dosya 4'te bulunabilir.
- Parametreler katlamasının altında, Simetri seçeneğini bulun ve C3 olarak ayarlayın. GS bölmesini yeniden yapmaya zorla seçeneğini bulun ve devre dışı bırakın. Queue Job (İşi Kuyrukla ) düğmesine tıklayın, ardından Homojen İyileştirme'yi başlatmak için Queue (Kuyruk) düğmesine tıklayın. Aynı yöntemi kullanarak kalan yinelemeler için Homojen İyileştirme gerçekleştirin (Ek Şekil 6C-D).
- Sonuçları almak için tüm işlerin çalışması bitene kadar bekleyin. Sonuçlara dayanarak, 6. iterasyonda filtrelenen partikül yığınının gerçek optimal sonuç olduğu doğrulanmıştır.
NOT: Elde edilen sonuçların, bu protokolde sağlanan sonuçlardan küçük rastgele sapmalara sahip olması normaldir. Bu sapmalar genel sonucu etkilemez.
Sonuçlar
Bu protokolde, bu işlemin etkinliğinin bir göstergesi olarak influenza hemaglutinin trimer veri setini (EMPIAR girişi: 10097) kullandık. Numunenin tercih edilen oryantasyonu nedeniyle, veri toplama işlemi 40°'de eğilmeyi gerektirdi. Protein C3 simetrisi sergiler ve 150 kDa'lık bir moleküler ağırlığa sahiptir.
Son parçacık yığınını işlemek için daha önce açıklanan protokolü uyguladık. Her yinelemede parçacıkların %20'sini aşamalı olarak kaldırdı ve bu da %80,0, %64,0, %51,2 vb. bir tutma oranıyla sonuçlandı. Şekil 1 ve Şekil 2'de gösterildiği gibi, tutulan parçacıkların çözünürlüğü başlangıçta iyileşti, ancak sonunda azaldı. Yinelemeler arasında, 6. yineleme, en az parçacığı içeren ancak en yüksek çözünürlüğü elde eden en optimal alt küme olarak tanımlandı. Algoritmamız, orijinal yığının yalnızca %26,2'sini içeren bir parçacık alt kümesini başarıyla tanımladı ve Şekil 2'de gösterildiği gibi 4,19 Å'den 3,62 Å'ye (CryoSPARC tarafından yeniden tahmin edildi) iyileştirilmiş bir çözünürlükle sonuçlandı. Ayrıca, CryoSieve kullanılmadan önceki ve sonraki yoğunluk haritaları Şekil 3'te karşılaştırılmıştır. Modelden haritaya Fourier Kabuk Korelasyonu (FSC) eğrisi ve yöntemden önce ve sonra yeniden yapılandırılmış yoğunluk haritalarının yarı haritalı FSC eğrisi de gösterilmiştir (Şekil 3A-B). Elde edilen ham yoğunluk haritaları ve keskin yoğunluk haritaları da karşılaştırılmış ve eşdeğer kontur seviyesi uygulanmıştır (Şekil 3C). Keskin yoğunluk haritalarının yan zincirleri karşılaştırıldı ve yeniden yapılandırılmış yoğunluk haritalarının gelişimini gösterdi. Partikül kalitesi19 kriterleri için tahmini Rosenthal-Henderson B-faktörü de benimsenmiştir. Son yığındaki parçacıkların çoğunu çıkardıktan sonra, Rosenthal-Henderson B-faktörü 226.9 Å2'den 146.2 Å2'ye yükseldi (Şekil 3D). Karşılaştırma için yerel çözünürlük, yerel B-faktörü20 ve ResLog21 de kullanıldı, bu da CryoSieve'in hem yoğunluk haritalarının hem de parçacıkların kalitesini gerçekten geliştirdiğini gösteriyor (Şekil 4).
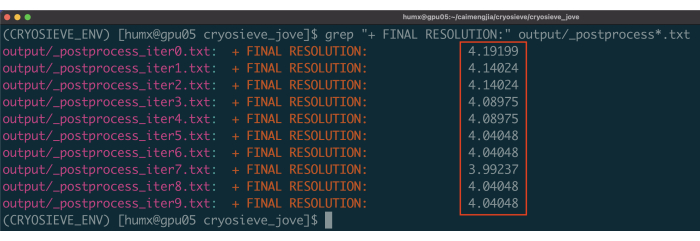
Şekil 1: Her yinelemenin çözümleri. Bildirilen kararlar kırmızı kutularla vurgulanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
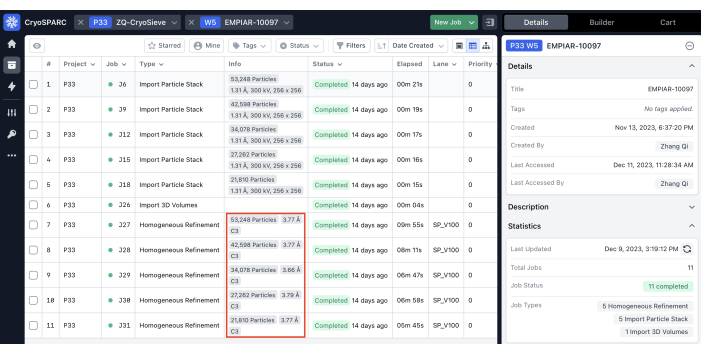
Şekil 2: Her yinelemenin çözümleri. Homojen iyileştirme işleriyle tanımlanan çözünürlükler kırmızı kutularla vurgulanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
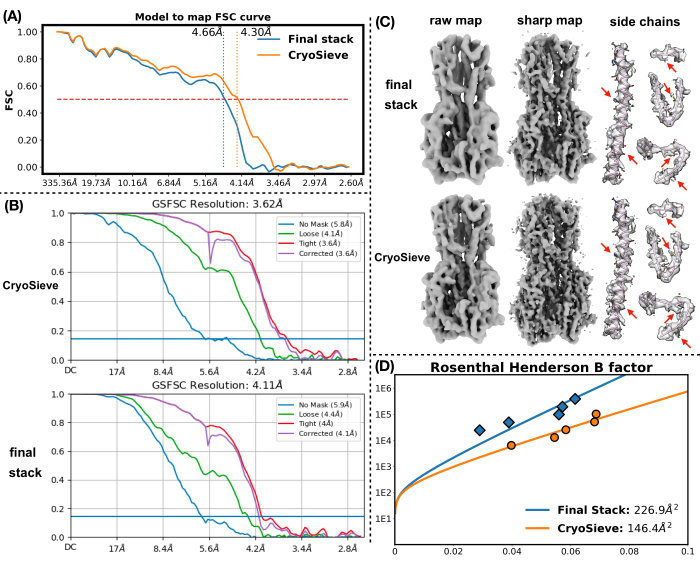
Şekil 3: Yoğunluk haritaları. (A) CryoSieve kullanılmadan önce ve sonra yeniden yapılandırılmış yoğunluk haritalarının modelden haritaya FSC eğrisinin karşılaştırılması. Y ekseni FSC'yi temsil ederken, x ekseni çözünürlüğü temsil eder. Kırmızı kesikli çizgi, FSC için 0,5 eşiğini gösterir. Dikey kesikli çizgi, 0,5 eşiği altında elde edilen yoğunluk haritalarının çözünürlüğünü gösterir. (B) Yarım haritalar FSC eğrisi, CryoSPARC aracılığıyla CryoSieve kullanılmadan önce ve sonra yeniden yapılandırılmış yoğunluk haritalarından elde edilmiştir. Y ekseni FSC'yi temsil ederken, x ekseni çözünürlüğü temsil eder. (C) Hem CryoSieve tarafından tutulan parçacıklar hem de son yığınlardaki tüm parçacık seti için ham yoğunluk haritaları ve keskin yoğunluk haritaları gösterildi. Ham yoğunluk haritaları için 0.65 eşdeğer izohips seviyesi uygulanmıştır. Keskin yoğunluk haritaları için 0.84 eşdeğer izohips seviyesi uygulanmıştır. Keskin yoğunluk haritaları doğrudan CryoSPARC ile elde edildi. Keskin yoğunluk haritaları, ilk olarak FSC ağırlıklı (CryoSPARC tarafından verilen FSC'lere dayanarak) otomatik olarak işlendi. Daha sonra, B-faktörü otomatik olarak belirlenen B-faktörleri (son yığındaki tüm parçacıklar için 232.0 Å2 ve CryoSieve için 160.8 Å2 ) kullanılarak keskinleştirildi. Keskin yoğunluk haritalarındaki yan zincirler, referans için atomik modeller dahil edilerek karşılaştırıldı. Kırmızı oklar geliştirilmiş bölgeleri vurgular. (D) Tahmini Rosenthal-Henderson B-faktörü, hem CryoSieve tarafından tutulan parçacıklar hem de son yığınlardaki tüm parçacık seti için gösterilmiştir. Y ekseni, kullanılan parçacık sayısını temsil eder ve x ekseni, çözünürlüğün karesinin tersini temsil eder. Yukarıdan aşağıya doğru hareket ederken, her nokta bir öncekinin parçacıklarının yarısını temsil eder. Kararlar rafine edilerek belirlendi. B-faktörleri, uydurma eğrileri ile gösterildiği gibi, ölçülen noktaların en küçük kareler yaklaşımı kullanılarak belirlendi. Tahmini Rosenthal ve Henderson'ın B-faktörleri efsanelerde belirtilmiştir: turuncu, CryoSieve tarafından tutulan parçacıkları temsil ederken, mavi, son yığındaki tüm parçacıkları gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
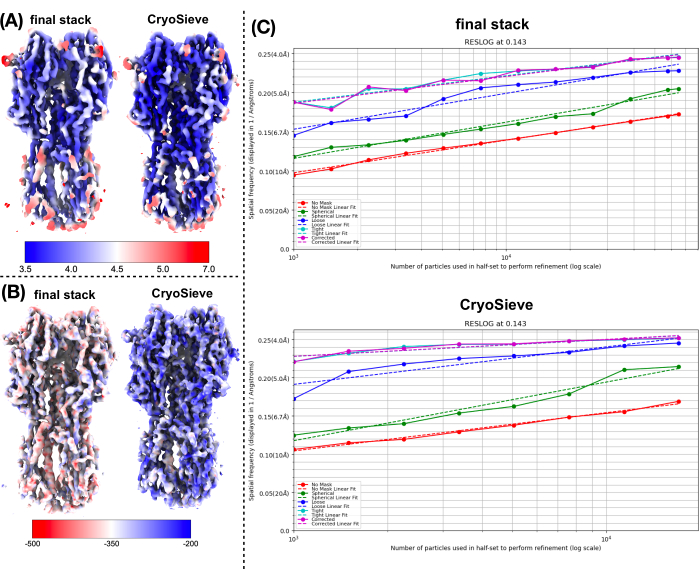
Şekil 4: Yoğunluk haritalarının çeşitli metriklerinin karşılaştırılması. (A) CryoSPARC tarafından elde edilen CryoSieve kullanılmadan önce ve sonra yerel çözünürlük haritalarının karşılaştırılması. Yerel çözünürlük 7 ş(kırmızı) ile 3,5 ş(mavi) arasında değişir. (B) CryoSieve kullanılmadan önce ve sonra, LocBFactor tarafından [20-3.5] şçözünürlük aralığı kullanılarak elde edilen yerel B-faktör haritası ile renklendirilmiş yoğunluk haritalarının karşılaştırılması. (C), CryoSPARC tarafından elde edilen CryoSieve kullanılmadan önce ve sonra ResLog grafiklerinin karşılaştırılması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Önkoşulları doğrulamak için nvidia-smi ve conda -V komutlarını kullanma. Önkoşullar karşılanırsa, nvidia-smi komutunu yazmak GPU sürücü sürümünü, CUDA sürümünü ve GPU kartlarının durumunu görüntüler. Benzer şekilde, conda -V komutunun girilmesi, Conda'nın kurulu sürümünü doğru şekilde göstermelidir. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: Yeni GPU hızlandırma ortamları oluşturma süreci. Ekran, Conda ortamını oluşturmak için kullanılan komut tarafından oluşturulan çıktıyı görüntüler. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 3: CryoSieve'in GPU hızlandırma ortamına kurulumu. Yeni oluşturulan Conda ortamını etkinleştirdikten sonra, ekranda Pip kullanarak CryoSieve'i kurma komutunun yürütülmesinden kaynaklanan çıktı görüntülenir. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 4: Yardım bilgileri. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 5: Çalışan süreç. CryoSieve'i komut satırı üzerinden çalıştırdıktan sonra, ekranda çalışan işlemle ilgili bilgiler görüntülenir. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 6: CryoSPARC'ın işlerinin yapılandırması. (A) Parçacık yığınını içe aktarın. (B) 3B ciltleri içe aktarın. (C-D) Homojen arıtma. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 1: CryoSieve Seçenekleri. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 2: Cryosieve'i çalıştırmak için işlem süresi ve minimum gereksinim. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 3: CryoSPARC ile ilk modelin oluşturulması. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 4: GS bölmesini yeniden yapmaya zorlamanın devre dışı bırakılmasının gerekçesi. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 5: Cryosieve-csrefine seçenekleri. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 6: cryosieve-csrhbfactor seçenekleri. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Cryo-EM, biyolojik moleküllerin yapılarını aydınlatmak için çok önemli bir teknik olarak durmaktadır. Bu süreçte, mikroskopi yoluyla veri toplandıktan sonra, mikrograflardan parçacık ekstraksiyonu ve ardından nihai yığını derlemek için birden çok aşamada sınıflandırılması esastır. Yaygın bir zorluk, hasarlı veya istenmeyen şekilde uyumlu parçacıkların baskınlığıdır ve yüksek çözünürlüklü yoğunluk haritaları elde etmek için tekrarlanan parçacık seçimine duyulan ihtiyacın altını çizer. Bu, partikül seçimini cryo-EM SPA'da yüksek kaliteli yoğunluk haritaları elde etmek için kritik bir adım haline getirir. Mevcut parçacık seçim teknikleri arasında istatistiksel eğimsiz doğrulama algoritması22, z-skoru tabanlı yaklaşım23 ve açısal doğruluk tahmin yöntemi24 bulunur.
CryoSieve, bu bağlamda, son yığından önemli sayıda yabancı parçacığı ortadan kaldırmada usta olan değerli bir araç olarak ortaya çıkıyor. Bu azalma yalnızca yeniden yapılandırmanın hesaplama verimliliğini artırmakla kalmaz, aynı zamanda süreci de kolaylaştırır. Parçacık seçimi için kapsamlı bir paket sunar, burada parçacık atma derecesi ve bunun sonucunda çözünürlükteki iyileşme, büyük ölçüde ilk veri kalitesine ve veri işlemede kullanılan metodolojilere bağlıdır.
Bu yazıda, influenza hemaglutinin trimerinin gerçek vaka veri setini kullanarak partikül elemenin eksiksiz bir iş akışını sunduk (EMPIAR girişi: 10097). Burada ele alınan ve tartışılan adımlar, parçacık eleme ve poz yeniden tahmini olarak özetlenebilir. Son 3D yeniden yapılandırılmış hacim, 3.62 Å'lik bir çözünürlüğe ulaştı ve alfa sarmallarındaki yan zincirler, yayınlanan yoğunluk haritasına kıyasla işlem sonrası hacimde daha netti.
CryoSieve, GitHub'da (https://github.com/mxhulab/cryosieve) bulunan açık kaynaklı bir yöntemdir. Ayrıntılı bir eğitim de ana sayfasında bulunabilir. Kullanıcılar öğreticiyi takip ederek yükleyebilir ve kullanabilir. Ek olarak, cryosieve-csrefine ve cryosieve-csrhbfactor olmak üzere iki modül sağlanır. Cryosieve-csrefine modülü, CryoSPARC (Ek Dosya 5) içindeki çeşitli işlemlerin sıralı olarak yürütülmesini otomatikleştirmek için özel olarak hazırlanmıştır. Bu işlemler, parçacık yığınlarının içe aktarılmasını ve ab initio, homojen arıtma veya tekdüze olmayan arıtma işlerinin yürütülmesini içerir. Öte yandan, cryosieve-csrhbfactor modülü, cryosieve-csrefine'in yeteneklerinden yararlanarak Rosenthal-Henderson B-faktörünün belirlenmesini otomatikleştirmek için tasarlanmıştır (Ek Dosya 6).
Şu anda, bu yöntemin uygulaması tek konformasyon senaryolarıyla sınırlıdır. Sonuç olarak, parçacıkların birden fazla konformasyonu temsil ettiği durumlarda, yetenekleri sınırlıdır. Kullanıcılara, rafine parçacık seçimi için kullanmadan önce, farklı konformasyonlara sahip parçacıkları ayırmak için başlangıçta 3D sınıflandırmaya girmeleri tavsiye edilir. Ayrıca, yöntem, son yığından parçacıkların %50'sinden fazlasını filtrelemede yeterlilik gösterse de, atılan bu parçacıkların kökenleri ve yeniden yapılandırma kalitesine ihmal edilebilir katkılarının altında yatan nedenler belirsizliğini korumaktadır. Anlayıştaki bu boşluk, bu sınırlamayı kapsamlı bir şekilde ele almak ve potansiyel olarak düzeltmek için ek araştırmalar gerektirmektedir.
Parçacık ayıklama veya parçacık eleme için mevcut üç olası yöntem vardır. Her şeyden önce, cisTEM4, 3D iyileştirmeden sonra her bir parçacık görüntüsü için bir puan rapor edebilir. Kullanıcılar, parçacıkları atmak için cisTEM skorunu kullanarak parçacıkları sıralayabilir. Açısal grafik tutarlılığı (AGC) yaklaşımı17 aynı zamanda yanlış hizalanmış parçacıkları atmak için bir yöntemdir. Ayrıca, hizalamama sınıflandırması5, 3D sınıflandırmayı kullanarak parçacıkları atmanın geleneksel bir yoludur. Bu yöntemlerle tutulan partiküllerin kalitesini CryoSieve ile karşılaştırdık ve CryoSieve'in tutulan partiküllerinin daha yüksek kalitede olduğunu bulduk15. Burada sunulan yöntem, alternatif yöntemlerden önemli ölçüde daha iyi performans gösterir ve aynı çözünürlükte en az sayıda parçacık elde eder.
Sonuçta gösterildiği gibi, bir kriyo-EM son yığınındaki parçacıkların çoğu, yoğunluk haritasının yeniden yapılandırılmasına katkıda bulunmaz. Başka bir deyişle, görüntü elde etme sırasında toplanan tüm parçacıklar arasında, yalnızca seçilmiş birkaç tane, yani en iyi alt küme, aslında son yeniden yapılandırmaya katkıda bulunur. Sonuç olarak, bu son alt kümenin toplanan toplam parçacık sayısına oranı, numune kalitesini değerlendirmek için nicel bir metrik olarak hizmet edebilir. Bu oran ne kadar yüksek olursa, numune kalitesi o kadar iyi olur. Cryo-EM'yi yapısal biyologlar için daha erişilebilir hale getiren teknik gelişmelere rağmen, numune hazırlama iş akışında önemli bir darboğaz olmaya devam etmektedir. Bilim adamları ve mühendisler bu nedenle çabalarını bu zorluğa odaklamaktadırlar25. Tek partikül analizinde (SPA), numune hazırlama iki önemli adımdan oluşur: numune optimizasyonu ve ızgara hazırlama. İlki, optimal biyokimyasal durumunu korurken numunenin saflaştırılmasını içerir. Sonuncusu, ızgaranın kimyasal veya plazma işlemi, numune biriktirme ve vitrifikasyon dahil olmak üzere numunenin mikroskopta analiz için hazırlanmasını gerektirir. Makromoleküler kararsızlığı ele almak için çok sayıda teknik önerilmiştir, ancak bir yaklaşımın diğerine göre etkinliği, numunenin özelliklerinebağlıdır 25,26. Şu anda, şebeke hazırlama sonuçları, kullanıcının uzmanlığından ve deneyiminden büyük ölçüde etkilenmekte ve bu da süreci zaman alıcı ve zorlu hale getirebilmektedir27,28. Numune ve ızgara hazırlamada karşılaşılan çok sayıda değişken, neden-sonuç ilişkilerinin kurulmasında zorluklar doğurur, çünkü araştırmacılar numuneyi yalnızca mikroskop kullanarak moleküler düzeyde değerlendirebilirler. Sonuç olarak, farklı numune ve ızgara hazırlama protokollerinin karşılaştırılmasından elde edilen nicel istatistikler hala eksiktir ve eğilimleri araştırmak ve numune davranışının temel mekanizmalarını anlamak için sistematik bir yaklaşım gereklidir29.
Açıklamalar
Diğer tüm yazarlar hiçbir rekabet çıkarı beyan etmez.
Teşekkürler
Bu çalışma, Shenzhen Araştırma ve Çeviri Akademisi (M.H.'ye), Yapısal Biyoloji için İleri İnovasyon Merkezi (M.H.'ye), Pekin Biyolojik Yapı için Sınır Araştırma Merkezi (M.H.'ye), Çin Ulusal Anahtar Ar-Ge Programı (No.2021YFA1001300) (C.B.'ye), Çin Ulusal Doğa Bilimleri Vakfı (No.12271291) (C.B.'ye), ve Çin Ulusal Doğa Bilimleri Vakfı (No.12071244) (Z.S.'ye).
Malzemeler
| Name | Company | Catalog Number | Comments |
| CryoSPARC | Structura Biotechnology Inc. Toronto, Canada | CryoSPARC (Cryo-EM Single Particle Ab-Initio Reconstruction and Classification) is a state of the art HPC software solution for complete processing of single-particle cryo-electron microscopy (cryo-EM) data. CryoSPARC is useful for solving cryo-EM structures of membrane proteins, viruses, complexes, flexible molecules, small particles, phase plate data and negative stain data. | |
| EMPIAR-10097 Dataset | https://ftp.ebi.ac.uk/empiar/world_availability/10097/data/Particle-Stack/T40_HA_130K-Equalized-Particle-Stack.mrcs | This dataset comprises single-particle cryo-EM data of the Influenza Hemagglutinin trimer, characterized by its highly preferred orientation, collected using a 40-degree tilted collection strategy. | |
| initial.mrc | https://github.com/mxhulab/cryosieve-demos/tree/master/EMPIAR-10097 | ||
| mask.mrc | https://github.com/mxhulab/cryosieve-demos/tree/master/EMPIAR-10097 | ||
| RELION | 4.0-beta-2 | RELION (REgularised LIkelihood OptimisatioN) is an open-source software for cryo-electron microscopy (cryo-EM) data processing, particularly for refining macromolecular structures. Utilizing a Bayesian approach, it excels in separating signal from noise, enabling high-resolution structure determination. RELION supports single-particle analysis, tomography, and sub-tomogram averaging, and has become widely used in structural biology due to its effectiveness and user-friendly interface. | |
| T40_HA_130K-Equalized_run-data_CryoSPARC_refined.star | https://github.com/mxhulab/cryosieve-demos/tree/master/EMPIAR-10097 | Metadata file for the final stack of particles from EMPIAR-10097 |
Referanslar
- Bai, X. C., Fernandez, I. S., Mcmullan, G., Scheres, S. H. Ribosome structures to near-atomic resolution from thirty thousand cryo-em particles. elife. 2, 00461(2013).
- Campbell, M. G., et al. Movies of ice-embedded particles enhance resolution in electron cryo-microscopy. Structure. 20 (11), 1823-1828 (2012).
- Li, X., et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-em. Nat Meth. 10 (6), 584-590 (2013).
- Grant, T., Rohou, A., Grigorieff, N. Cis tem, user-friendly software for single-particle image processing. eLife. 7, e35383(2018).
- Scheres, S. H. Relion: Implementation of a bayesian approach to cryo-em structure determination. J Str Biol. 180 (3), 519-530 (2012).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. Cryosparc: Algorithms for rapid unsupervised cryo-em structure determination. Nat Meth. 14 (3), 290-296 (2017).
- Kühlbrandt, W. The resolution revolution. Science. 343 (6178), 1443-1444 (2014).
- Dubochet, J., et al. Cryo-electron microscopy of vitrified specimens. Quart Rev Biophys. 21 (2), 129-228 (1988).
- Wagner, T., et al. Sphire-cryolo is a fast and accurate fully automated particle picker for cryo-EM. Comm Biol. 2 (1), 218(2019).
- Bepler, T., et al. Positive-unlabeled convolutional neural networks for particle picking in cryo-electron micrographs. Nat Meth. 16 (11), 1153-1160 (2019).
- Wang, F., et al. Deeppicker: A deep learning approach for fully automated particle picking in cryo-em. J Str Biol. 195 (3), 325-336 (2016).
- Heimowitz, A., Andén, J., Singer, A. Apple picker: Automatic particle picking, a low-effort cryo-em framework. J Str Biol. 204 (2), 215-227 (2018).
- Glaeser, R. M. How good can single-particle cryo-em become? What remains before it approaches its physical limits. Ann Rev Biophys. 48, 45-61 (2019).
- Diiorio, M. C., Kulczyk, A. W. A robust single-particle cryo-electron microscopy (cryo-em) processing workflow with cryosparc, relion, and scipion. J Vis Exp. (179), e63387(2022).
- Zhu, J., et al. A minority of final stacks yields superior amplitude in single-particle cryo-em. Nat Comm. 14 (1), 7822(2023).
- Zhou, Y., Moscovich, A., Bendory, T., Bartesaghi, A. Unsupervised particle sorting for high-resolution single-particle cryo-em. Inv Probl. 36 (4), 044002(2020).
- Méndez, J., Garduno, E., Carazo, J. M., Sorzano, C. O. S. Identification of incorrectly oriented particles in cryo-em single particle analysis. J Str Biol. 213 (3), 107771(2021).
- Tan, Y. Z., et al. Addressing preferred specimen orientation in single-particle cryo-em through tilting. Nat Meth. 14 (8), 793-796 (2017).
- Rosenthal, P. B., Henderson, R. Optimal determination of particle orientation, absolute hand, and contrast loss in single-particle electron cryomicroscopy. J Mol Biol. 333 (4), 721-745 (2003).
- Kaur, S., et al. Local computational methods to improve the interpretability and analysis of cryo-em maps. Nat Comm. 12 (1), 1240(2021).
- Stagg, S. M., Noble, A. J., Spilman, M., Chapman, M. S. Reslog plots as an empirical metric of the quality of cryo-em reconstructions. J Str Biol. 185 (3), 418-426 (2014).
- Vargas, J., Otón, J., Marabini, R., Carazo, J. M., Sorzano, C. Particle alignment reliability in single particle electron cryomicroscopy: A general approach. Sci Rep. 6 (1), 21626(2016).
- Vargas, J., et al. Particle quality assessment and sorting for automatic and semiautomatic particle-picking techniques. J Str Biol. 183 (3), 342-353 (2013).
- Vargas, J., Melero, R., Gomez-Blanco, J., Carazo, J. -M., Sorzano, C. O. S. Quantitative analysis of 3d alignment quality: Its impact on soft-validation, particle pruning and homogeneity analysis. Sci Rep. 7 (1), 6307(2017).
- Carragher, B., et al. Current outcomes when optimizing 'standard'sample preparation for single-particle cryo-em. J Microsc. 276 (1), 39-45 (2019).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallographica Sec D: Str Biol. 74 (6), 560-571 (2018).
- Glaeser, R. M. How good can cryo-em become. Nat Meth. 13 (1), 28-32 (2016).
- Kim, L. Y., et al. Benchmarking cryo-em single particle analysis workflow. Front Mol Biosci. 5, 50(2018).
- Weissenberger, G., Henderikx, R. J., Peters, P. J. Understanding the invisible hands of sample preparation for cryo-em. Nat Meth. 18 (5), 463-471 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır