Method Article
إجراء مبسط وموحد لتوليد ناقلات الفيروسات المرتبطة بالغدينو عالية الجودة باستخدام منصة مصنع الخلايا
In This Article
Summary
مع استمرار تطور مجال العلاج الجيني ، هناك حاجة متزايدة لطرق مبتكرة يمكنها مواجهة هذه التحديات. هنا ، يتم تقديم طريقة فريدة من نوعها ، والتي تبسط عملية توليد ناقلات AAV عالية الغلة وعالية النقاء باستخدام منصة مصنع الخلايا ، وتلبية معايير الجودة للدراسات في الجسم الحي .
Abstract
تتطلب أبحاث العلاج الجيني قبل السريرية ، لا سيما في القوارض والنماذج الحيوانية الكبيرة ، إنتاج ناقلات AAV ذات إنتاجية عالية ونقاوة. غالبا ما تتضمن الأساليب التقليدية في مختبرات الأبحاث استخداما مكثفا لأطباق زراعة الخلايا لزراعة الخلايا HEK293T ، وهي عملية يمكن أن تكون شاقة وإشكالية. هنا ، يتم تقديم طريقة داخلية فريدة ، والتي تبسط هذه العملية باستخدام منصة مصنع خلايا معينة (أو مداخن الخلايا ، CF10). يؤدي تكامل التقسيم ثنائي الطور من البولي إيثيلين جلايكول / المائي مع الطرد المركزي الفائق المتدرج لليوديكسانول إلى تحسين كل من إنتاجية ونقاء ناقلات AAV المتولدة. يتم التحقق من نقاء ناقلات AAV من خلال SDS-PAGE وتلطيخ الفضة ، في حين يتم تحديد نسبة الجسيمات الكاملة إلى الفارغة باستخدام المجهر الإلكتروني النافذ (TEM). يوفر هذا النهج منصة فعالة لمصنع الخلايا لإنتاج ناقلات AAV بإنتاجية عالية ، إلى جانب طريقة تنقية محسنة لتلبية متطلبات الجودة للدراسات في الجسم الحي .
Introduction
أصبحت ناقلات الفيروسات المرتبطة بالغدي (AAV) أداة لا غنى عنها في أبحاث العلاج الجيني ، حيث تقدم مزيجا فريدا من الفعالية والسلامة لتوصيل الجينات1. كانت الطرق التقليدية لتوليد AAVs في الإعدادات المختبرية محورية في تعزيز فهمنا وتطبيقنا للعلاج الجيني2. ومع ذلك ، فإن هذه الأساليب ، على الرغم من أنها أساسية ، تظهر بعض القيود والتحديات ، لا سيما من حيث العائد وكفاءة الوقت وجودة النواقل المنتجة ، ولا سيما نسبة الجسيمات الكاملة إلى الجسيماتالفارغة 3.
يتضمن الإجراء التقليدي لإنتاج AAV في المقام الأول نقل خلايا HEK2934. تتطلب هذه العملية ، التي تتم عادة في أطباق زراعة الخلايا ، نقل الخلايا ببلازميد يحتوي على الجين محل الاهتمام جنبا إلى جنب مع البلازميد المساعد وبلازميد القفيصة AAV 5,6. بعد النقل ، تنتج الخلايا جزيئات AAV ، والتي يتم حصادها وتنقيتهابعد ذلك 5,6. غالبا ما تتضمن عملية التنقية الطرد المركزي الفائق ، وهي خطوة حاسمة في الحصول على ناقلات AAV عالية النقاء7. يعد الطرد المركزي الفائق ، خاصة باستخدام كلوريد السيزيوم (CsCl) أو تدرج اليوديكسانول ، طريقة قياسية لفصل جزيئات AAV عن الحطام الخلوي والشوائب الأخرى8. هذه الخطوة ضرورية لتحقيق النقاء والتركيز المطلوبين لنواقل AAV ، مما يؤثر بشكل مباشر على فعاليتها في توصيل الجينات8. على الرغم من استخدامه على نطاق واسع ، فإن أجهزة الطرد المركزي الفائقة التقليدية لها عيوبها. على سبيل المثال ، يمكن أن تكون إنتاجية ناقلات AAV من هذه الطريقة متغيرة وغالبا ما تكون منخفضة ، مما يشكل تحديات كبيرة عندما تكون هناك حاجة إلى كميات كبيرة من ناقلات العيار العالي ، خاصة للدراسات في الجسم الحي أو النماذج الحيوانية الكبيرة9.
جانب آخر مهم لجودة ناقل AAV هو نسبة الجسيمات الكاملة إلى الجسيماتالفارغة 10. غالبا ما تحتوي مستحضرات AAV على مزيج من هذه الجسيمات ؛ ومع ذلك ، تحتوي الجسيمات الكاملة فقط على المادة الوراثية العلاجية. يمكن أن يؤدي وجود نسبة عالية من الجسيمات الفارغة إلى تقليل كفاءة توصيل الجينات بشكل كبير10. وبالتالي فإن تقييم وتحسين نسبة الجسيمات الكاملة إلى الجسيمات الفارغة هو معلمة رئيسية في تقييم فعالية ناقلات AAV. الطرق التقليدية ، على الرغم من قدرتها على إنتاج ناقلات AAV ، غالبا ما تكافح للسيطرة على هذه النسبة باستمرار ، مما يؤدي إلى اختلافات في قوة المتجهات10.
هنا ، يتم تقديم طريقة فريدة من نوعها ، والتي تبسط عملية توليد ناقلات AAV عالية الغلة وعالية النقاء باستخدام منصة مصنع الخلايا الخالية من استخدام مزارع الخلايا HEK293T كثيفة العمالة في أطباق الخلايا ، ودمج التقسيم ثنائي الطور من البولي إيثيلين جلايكول / المائي مع الطرد المركزي الفائق التدرج اليوديكسانول. يتم تأكيد نقاء ناقل AAV عبر SDS-PAGE وتلطيخ الفضة ، ويتم تحديد نسبة الجسيمات الكاملة إلى الفارغة باستخدام المجهر الإلكتروني النافذ (TEM) ، مما يلبي معايير الجودة للدراسات في الجسم الحي 11.
Protocol
يتم سرد تفاصيل الكواشف والبلازميدات والمعدات المستخدمة في الدراسة في جدول المواد. يتم توفير تكوين المخازن المؤقتة المستخدمة في الملف التكميلي 1.
1. إعداد البلازميد
- تحويل البلازميدات (pAAV-GOI ، pHelper ، pAAV-Cap) في الإشريكية القولونية.
ملاحظة: يمكن استخدام أي سلالة من E.coli لتضخيم البلازميد. بالنسبة لبعض البلازميدات ، يمكن للخلايا المختصة الخاصة مثل NEB المستقرة تحسين إنتاج البلازميد. البلازميدات الثلاثة المستخدمة في هذا البروتوكول هي pAAV-GOI: pAAV-CMV-GFP ، pHelper: pAdDeltaF6 ، و pAAV-Cap: pAAV-RC6. - تنمو البكتيريا في وسط LB الذي يحتوي على المضادات الحيوية الانتقائية المناسبة في الحجم الأمثل عند 37 درجة مئوية لمدة 16-18 ساعة.
ملاحظة: عند استخدام الخلايا المستقرة NEB ، قم بالزراعة عند 30 درجة مئوية لمدة 18-20 ساعة. - حصاد الحمض النووي البلازميد عن طريق الطرد المركزي للإشريكية القولونية. وسط الاستزراع عند 4000 × جم ، 4 درجات مئوية ، لمدة 15 دقيقة.
- صب بعناية السائل الطافي من زجاجة الطرد المركزي في حاوية النفايات وتنقية الحمض النووي البلازميد من بيليه مع مجموعة تنقية البلازميد على نطاق واسع خالية من السموم الداخلية.
ملاحظة: تأكد من سكبه ببطء وتجنب الرش. - قياس تركيز الحمض النووي ونقاوته باستخدام مقياس الطيف الضوئي.
ملاحظة: تحقق من نقاء الحمض النووي عن طريق التحقق من نسبة OD260 / OD280 . تبلغ نسبة الحمض النووي النقي حوالي 1.8. يجب أن يكون تركيز الحمض النووي أعلى من 1 ميكروغرام / ميكرولتر لخطوة النقل المشترك اللاحقة. اصنع مخزون الجلسرين البكتيري عن طريق إضافة 500 ميكرولتر من المزرعة الليلية إلى 500 ميكرولتر من 50٪ من الجلسرين في المبرد وتخزينها عند -80 درجة مئوية.
2. تحضير الخلايا HEK293T
- HEK293T البذور الخلايا التي تحتوي على وسائط جلوكوز عالية DMEM تحتوي على 10٪ FBS في مصنع خلايا من 10 طبقات (CF10) واترك الخلايا تنمو في الحاضنة طوال الليل.
ملاحظة: يجب أن تكون ممرات الخلايا 293T أقل من 10 للحصول على الحالة المثلى لإنتاج AAV قوي. إذا أمكن ، لا تضيف المضادات الحيوية إلى وسائط الثقافة في هذا الوقت. يحتوي CF10 على ما يقرب من 42 ضعف مساحة سطح النمو لطبق زراعة الخلايا 150 مم. قم بزرع نفس كثافة الخلية في طبق زراعة الخلايا 150 مم للسماح بفحص نمو الخلايا تحت المجهر. قم بإعداد معلق خلية 1075 مل ، وأضف معلق خلية 25 مل إلى طبق 150 مم ، وأضف الباقي إلى CF10. - تحقق من التقاء الخلية في اليوم التالي قبل النقل.
ملاحظة: يجب أن تصل الخلايا إلى التقاء 80٪ -90٪ في وقت النقل من خلال المراقبة تحت المجهر.
3. النقل الثلاثي لبلازميدات AAV
- احسب كمية كل بلازميد مطلوب (pAAV-GOI ، pHelper ، pAAV-serotype) للحصول على نسبة مولية 1.2: 1: 1 مع 2.5-5 مجم من إجمالي الحمض النووي لكل CF10.
ملاحظة: قد تكون النسبة المولية للبلازميدات الثلاثة متغيرة لتحقيق الفعالية المثلى للنقل. من الأفضل اختباره في إعداد صغير الحجم قبل الانتقال إلى إعداد CF10 هذا. يتم استخدام pAAV-CMV-GFP و pAdDeltaF6 و pAAV-RC6 لصنع فيروس AAV6-CMV-GFP كمثال. يتم سرد صيغة حاسبة جزيرة الأمير إدوارد في الجدول 1. - قسمة 350 مل من OptiMEM في زجاجة معقمة سعة 500 مل.
- أضف جميع الحمض النووي البلازميد الثلاثة إلى الزجاجة التي تحتوي على Opti-MEM. تخلط جيدا.
- أضف 15 مل من محلول بولي إيثيل إنيمين (PEI) 1 مجم / مل (1: 3 ميكروغرام من الحمض النووي إلى نسبة PEI ميكروغرام). رج خليط OptiMEM / DNA / PEI لأعلى ولأسفل بقوة لمدة 30 ثانية.
ملاحظة: لا بأس في عمل فقاعات. - احتضان الخليط في درجة حرارة الغرفة لمدة 10-15 دقيقة.
ملاحظة: الحضانة الأطول يمكن أن تقلل من كفاءة النقل. - أضف محلول OptiMEM / DNA / PEI إلى زجاجة سعة 1 لتر تحتوي على 700 مل من الجلوكوز المنخفض DMEM مع 10 mM HEPES و 2٪ FBS. تخلط جيدا.
ملاحظة: في هذه الدراسة ، أظهر انخفاض الجلوكوز في DMEM إنتاجا أفضل لناقلات AAV بعد النقل المشترك. تساعد إضافة HEPES في الحفاظ على الخلايا في حالة أفضل. تخلط عن طريق تدوير الزجاجة ببطء. تجنب خلق الكثير من الفقاعات. - أخرج CF10 من الحاضنة وقم بتفريغ الوسائط في حاوية نفايات.
ملاحظة: ضع CF10 على السطح داخل غطاء المحرك وارفع جانبا واحدا تدريجيا لأعلى ، وقم بتفريغ الوسائط ببطء دون فصل الخلايا. - أضف بعناية خليط transfectant إلى CF10. تأكد من تغطية جميع الطبقات العشر بالوسائط.
ملاحظة: أضف 25 مل من خليط الترانس إلى طبق 150 مم. مراقبة الخلايا يوميا حتى الحصاد. أضف خليط النقل المتبقي إلى CF10 عن طريق سكبه ببطء. قم بتدوير CF10 بعناية فائقة وتأكد من حجم متساو لكل طبقة. - أعد CF10 إلى الحاضنة لمدة 72-96 ساعة.
ملاحظة: تحقق من طبق الشاشة مقاس 150 مم لتحديد وقت حصاد متجهات AAV. عندما تصبح الخلايا منفصلة بسهولة مع حمولة كاملة من AAV ، فقد حان الوقت للحصاد.
4. حصاد ناقلات AAV
- حصاد الفيروس بعد 3-4 أيام من الانتقال عن طريق هز CF10 بقوة. صب الوسائط في أنابيب مخروطية سعة 250 مل وقم بتدوير الفيروس عند 4000 × جم لمدة 20 دقيقة عند 4 درجات مئوية.
ملاحظة: بالنسبة للنمط المصلي AAV6 المستخدم في هذا البروتوكول ، سيبقى 80٪ AAV مرتبطا في الغالب بالمواد الخلوية في الحبيبات. وتم إفراز 20٪ AAV في وسائل الإعلام. قد تختلف هذه النسب بالنسبة للأنماط المصلية الأخرى AAV. - أوضح مرشح طاف مع وحدة تصفية 0.45 ميكرومتر وحفظه لهطول الأمطار.
- شطف CF10 مع 500 مل من العازلة DPBS 1x وأجهزة الطرد المركزي في 4000 × غرام لمدة 20 دقيقة عند 4 درجات مئوية.
- تخلص من المادة الطافية باستخدام نظام تفريغ وماصة شفط. أضف 20 مل من محلول تحلل AAV لكل CF10 عند -80 درجة مئوية حتى التنقية.
ملاحظة: انقل محلول AAV إلى أنبوب مخروطي سعة 50 مل لاستخراج AAV لاحقا. - أخرج المادة الطافية المفلترة ، وأضف محلول كلوريد الصوديوم PEG-2.5 M بنسبة 40٪ للحصول على تركيز نهائي قدره 8٪ PEG ، واحتضانها في غرفة باردة على دوار مداري لمدة 3 ساعات على الأقل أو طوال الليل.
ملاحظة: بالنسبة للطاف سعة 100 مل ، أضف محلول كلوريد الصوديوم 25 مل 40٪ PEG-2.5 M. - ترسيب الفيروس عن طريق الطرد المركزي عند 4000 × جم لمدة 30 دقيقة عند 4 درجات مئوية.
ملاحظة: انقل الخليط إلى أنابيب مخروطية سعة 250 مل للطرد المركزي. - نضح لإزالة طاف وإضافة 5-10 مل من المخزن المؤقت لإعادة تعليق AAV HEPES لتعليق الكريات. انقله إلى أنبوب مخروطي سعة 50 مل لمواصلة تنقية المصب ، أو قم بتخزينه عند -80 درجة مئوية.
5. استخراج AAV
- قم بإذابة حبيبات الفيروس في حمام مائي بدرجة حرارة 37 درجة مئوية لمدة 10-15 دقيقة باستخدام الخفق.
ملاحظة: دوامة تحلل AAV لتذوب بالكامل. - تجمد في -80 درجة مئوية 100٪ حمام إيثانول لمدة 20-30 دقيقة.
ملاحظة: بدلا من ذلك ، يمكن إجراء دورة التجميد باستخدام دورق إيثانول بارد 100٪ محاط بالثلج الجاف. - قم بإجراء التجميد / الذوبان 3-4 مرات ، والدوامة بينهما إذا لزم الأمر.
ملاحظة: يمكن إيقاف هذه الدورة مؤقتا عند خطوة التجميد. قم بتخزين محلول AAV عند -80 درجة مئوية حتى يعمل المصب. - قم بإذابة محلول AAV (من الخطوة 5.3) وأعيد تعليق AAV (من الخطوة 4.7) "في حمام مائي 37 درجة مئوية لمدة 10-15 دقيقة باستخدام شاكر ودوامة.
ملاحظة: تأكد من الذوبان تماما واخلطه. - أضف نيوكلياز البنزوناز (250 وحدة / ميكرولتر) إلى محلول AAV وإعادة تعليق AAV لتركيز نهائي قدره 50 وحدة / مل. دوامة الحل.
- احتضان في حمام مائي 37 درجة مئوية مع رج لمدة 30 دقيقة.
ملاحظة: أخرج 10٪ من حصص ديوكسي كولات الصوديوم في حمام مائي لإتاحة الوقت للذوبان والإحماء والخلط جيدا. - يضاف 10٪ ديوكسي كولات الصوديوم للحصول على تركيز نهائي قدره 0.5٪ ويحتضن عند 37 درجة مئوية مع الخفق لمدة 30 دقيقة.
ملاحظة: تم استخدام ديوكسي كولات الصوديوم لتعزيز إطلاق AAV من الخلايا. - قم بتوزيع محلول AAV الخام في أنابيب طرد مركزي سعة 2 مل وأجهزة طرد مركزي عند 14000 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- انقل المادة الطافية إلى أنبوب مخروطي سعة 50 مل.
ملاحظة: استخدم ماصة سعة 1 مل لنقل المادة الطافية. تخلص من الكريات. - أضف كمية متساوية من الكلوروفورم واستخلص AAV عن طريق الدوامة لمدة 1-2 دقيقة.
ملاحظة: يجب أن يصبح المحلول معتما ، أبيض ، يشبه الحليب. - انقل المحلول اللبني إلى أنابيب طرد مركزي سعة 2 مل ووزعه بالتساوي. أجهزة الطرد المركزي عند 14000 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- قم بسحب الطبقة الوردية العلوية بعناية ونقلها في أنبوب مخروطي جديد سعة 50 مل.
ملاحظة: لا تزعج طبقات الكلوروفورم / البروتين. - قياس الحجم النهائي باستخدام ماصة. وفقا لمخطط حجم AAV-PEG-Sulfate الخام (الجدول 2) ، امزج الأحجام المناسبة بنسبة 50٪ (NH4) 2SO4 و 40٪ محلول PEG. دوامة لمدة 2 دقيقة.
- انقل الخليط إلى أنابيب طرد مركزي سعة 2 مل لتوزيعها بالتساوي. جهاز طرد مركزي عند 14000 × جم لمدة 10 دقائق عند 4 درجات مئوية
- اجمع الطبقة السفلية باستخدام إبرة 22 جم ومحقنة 3 مل. اجمع AAV في أنبوب مخروطي سعة 50 مل وقم بتخزينه عند 4 درجات مئوية لتدرجات اليوديكسانول اللاحقة للطرد المركزي.
6. تنقية AAV عن طريق الطرد المركزي الفائق التدرج اليوديكسانول
- قم بإعداد تدرجات اليوديكسانول طازجة قبل تحميل AAV وفقا لعدد أنابيب الطرد المركزي الفائقة المستخدمة (الجدول 3).
ملاحظة: تم استخدام الفينول الأحمر لمراقبة الطبقات. - قم بتراكب كل محلول في أنبوب سريع الإغلاق من مادة البولي بروبيلين المستديرة ببطء باستخدام حقنة سعة 10 مل متصلة بإبرة طويلة مثقوبة 16 جم. تجنب الفقاعات.
- أضف بعناية ما يصل إلى 17 مل من محلول AAV أعلى التدرج باستخدام حقنة 22 جرام. استخدم المخزن المؤقت لغسيل الكلى AAV لتعبئة الأنبوب.
ملاحظة: أضف محلول AAV عن طريق تحميل قطرات على الحائط في أنبوب الطرد المركزي الفائق. لا تزعج طبقات التدرج. - ختم أنابيب الطرد المركزي الفائقة مع تسرب كهربائي.
ملاحظة: قم بموازنة الأنابيب قبل إرسالها إلى أجهزة الطرد المركزي الفائقة بفرق ±0.2 جم. - أجهزة طرد مركزي عند 350000 × جم لمدة 2 ساعة في دوار Ti70 عند 4 درجات مئوية.
- قم بإزالة الأنابيب بعناية من الدوار وضعها في رف أنابيب الطرد المركزي الفائق.
ملاحظة: تأكد من عدم إزعاج التدرجات. - اجمع كسور AAV باتباع الخطوات التالية:
- تثبيت الأنبوب على حامل الحامل.
- ثقب أنابيب الطرد المركزي الفائقة أسفل واجهة 40٪ -60٪ بقليل بإبرة 19 جرام متصلة بحقنة 10 مل.
ملاحظة: يجب أن تكون فتحة الإبرة لأعلى ، وتواجه التدرج بنسبة 40٪. - لكمة ثقب في الجزء العلوي من الأنبوب بإبرة 16 جرام.
- جمع ما يصل إلى 5 مل لكل أنبوب. تجنب جمع تلوث البروتين عند واجهة 25٪ -40٪.
- كرر لكل أنبوب طرد مركزي فائق.
ملاحظة: انقل كسور AAV إلى أنبوب مخروطي سعة 50 مل.
7. الجولة الثانية من تدرجات اليوديكسانول الطرد المركزي الفائق
ملاحظة: هذه الخطوة اختيارية. هذه الخطوة هي تقليل نسبة AAV الفارغة للحصول على قفيصة AAV كاملة عالية الجودة.
- تمييع AAV >1: 1 مع العازلة لغسيل الكلى AAV.
ملاحظة: AAV التي تم جمعها من الجولة الأولى من الطرد المركزي الفائق كانت في طبقة يوديكسانول 40٪. يجب تخفيفه بنسبة 50٪ على الأقل ليكون قابلا للتحميل فوق طبقة اليوديكسانول 30٪. - قم بتراكب كل محلول (الجدول 4) في أنبوب طرد مركزي فائق باستخدام إبرة مثقوبة 16 جم وقم بتوصيل حقنة سعة 10 مل ببطء. تجنب الفقاعات.
- أضف بعناية 20 مل من محلول AAV المخفف أعلى التدرج باستخدام حقنة 22 جرام. استخدم المخزن المؤقت لغسيل الكلى AAV لتعبئة الأنبوب.
- كرر الخطوات من 6.4 إلى 6.7.
8. غسيل الكلى AAV والتركيز
- انقل فيروس AAV إلى كاسيت غسيل الكلى باستخدام إبرة 18 G جديدة ومحقنة 10 مل. حقن الفيروس ببطء في الكاسيت وإزالة الهواء منه.
- أضف قضيب تقليب إلى الدورق الذي يحتوي على مخزن غسيل الكلى AAV وضعه على طبق تحريك.
- ضع كاسيت غسيل الكلى في المخزن المؤقت لغسيل الكلى باستخدام عوامة عائمة. يقلب على حرارة 4 درجات مئوية. تغيير 2-3 مرات العازلة لغسيل الكلى AAV.
ملاحظة: استخدم مساحة كافية من المخزن المؤقت للسماح للدرج بالطفو وإجراء تبديل المخزن المؤقت. غطي الدورق بورق الألمنيوم. - باستخدام حقنة سعة 10 مل متصلة بإبرة 18 جم ، اجمع الفيروس من الكاسيت إلى وحدة مرشح بالطرد المركزي.
- أجهزة الطرد المركزي عند 4000 × جم لمدة 15-30 دقيقة عند 4 درجات مئوية.
ملاحظة: شطف AAV مع العازلة لغسيل الكلى AAV 2-3 مرات. ركز AAV حتى ~ 200 ميكرولتر من المتبقي أعلى الفلتر. - اجمع AAV المركز من وحدة التصفية. اشطف الفلتر ب 300 ميكرولتر أخرى من محلول غسيل الكلى AAV وانقله إلى AAV المركز.
- قم بتصفية الفيروس من خلال مرشح حقنة 0.22 ميكرومتر باستخدام حقنة 1 مل من السل. لضمان أقل قدر من فقدان الحجم ، استخدم حقنة 10 مل لدفع الهواء عبر الفلتر 2-3 مرات.
- قم بتخزين فيروس AAV المنقى في درجة حرارة 4 درجات مئوية مؤقتا للمعايرة.
ملاحظة: قم بمعايرة الفيروس ، القسمة ، وتخزينها في -80 درجة مئوية في غضون 1 أسبوع.
9. معايرة فيروس AAV
ملاحظة: تم استخدام تفاعل البوليميراز الكمي المتسلسل TaqMan (qPCR) لمعايرة AAV المنقى .
- عالج ناقلات AAV باستخدام DNase I واحتضانها عند 37 درجة مئوية لمدة 30 دقيقة ، ثم احتضانها عند 95 درجة مئوية لمدة 10 دقائق.
ملاحظة: كمثال على تفاعل 10 ميكرولتر ، يتم استخدام عينة فيروس AAV 2 ميكرولتر ، و 1 ميكرولتر DNase ، و 1 ميكرولتر DNase buffer ، و 6 μL H2O. يمكن إجراؤه في جهاز تدوير حراري مع أنابيب PCR. - قم بإعداد مجموعات التمهيدي التي تستهدف منطقة إدراج AAV.
ملاحظة: يمكن أن تكون الأهداف هي المروج وجين التحوير والمراسل في بناء AAV. يتم سرد الاشعال في الجدول 5. - تحضير معايير بلازميد الحمض النووي (10 ، 1 ، 0.1 ، 0.01 ، 0.001 ، و 0.0001 بيكوغرام / ميكرولتر) والتحكم السلبي (H2O).
- قم بإعداد المزيج الرئيسي qPCR ، بما في ذلك الاشعال ، وفقا لتعليمات الشركة المصنعة.
- ضع المعايير والعينات في ثلاث نسخ على لوحة PCR. أضف مزيج qPCR إلى المعايير والعينات. أغلق اللوحة وقم بإجراء تفاعل qPCR وفقا لتعليمات الشركة الصانعة.
ملاحظة: تعتمد ظروف التفاعل على المواد / الكواشف والجهاز. دورات PCR سريعة وتقليدية قابلة للتطبيق. - حساب عيار فيروس AAV.
ملاحظة: تركيز العينة في هذا البروتوكول هو تخفيف 1/10 من العينات الأصلية. - قسمة الفيروس AAV في أنابيب 1.5 مل وتخزينها في 4 درجة مئوية لمدة تصل إلى شهر واحد وتخزينها في -80 درجة مئوية على المدى الطويل.
ملاحظة: تجنب دورات التجميد / الذوبان للتخزين. عند استخدامها في التجارب في الجسم الحي ، لا تستخدم ذوبان الجليد على الحصص مرتين.
10. مراقبة جودة AAV
ملاحظة: تم تمييز فيروسات AAV من حيث النقاء بواسطة صبغة الفضة SDS-PAGE باستخدام هلام SDS-PAGE وتم تلطيخها باستخدام مجموعة تلطيخ متاحة تجاريا.
- تشويه 3 × 109 vg من عينة فيروس AAV مع المخزن المؤقت Laemmli.
ملاحظة: استخدم فيروس AAV مرجعي كعنصر تحكم. يتم استخدام القفيصة الكاملة المرجعية AAV6-CMV-GFP. - قم بتحميل AAV المشوه على جل SDS-PAGE متدرج 4٪ -20٪ وقم بتشغيله عند 180 فولت لمدة 50 دقيقة.
- إزالة هلام من لوحة الكهربائي. وصمة عار الجل مع مجموعة تلطيخ الفضة وفقا لتعليمات الشركة الصانعة.
- تحقق من بروتينات قفيصة AAV VP1 و VP2 و VP3.
ملاحظة: يحتوي فيروس AAV النقي على بروتين قفيصة VP1 و VP2 و VP3 فقط. إذا لم تكن نقية ، فستكون شرائط البروتين الأخرى مرئية على الجل.
ملاحظة: تم إجراء المجهر الإلكتروني النافذ (TEM) لفيروسات AAV المؤتلفة ذات اللون السلبي لتقييم السلامة المورفولوجية والنسبة الكاملة / الفارغة. - التقط شبكة EM بملقط واستلق على المقعد مع توجيه الجانب اللامع من الشبكة لأعلى.
- ماصة 5 ميكرولتر من عينة AAV على الشبكة واتركها تجف عن طريق التبخر.
ملاحظة: قم بتخفيف AAV إذا لزم الأمر. 1012 vg / mL هو عيار متوسط. قد يستغرق تجفيف الشبكة من 30 إلى 60 دقيقة. - اغسل الشبكة عن طريق السحب ، قطرة قطرة ، مع حوالي 200 ميكرولتر من H2O على الشبكة.
- قم بإزالة الماء الزائد عن طريق وضع ورقة كروماتوغرافيا عموديا ببطء بجوار الشبكة.
- ماصة 5 ميكرولتر من محلول خلات اليورانيل 2٪ على الشبكة. احتضان لمدة 5 دقائق والفتيل قبالة كما ذكر أعلاه. اترك الشبكة حتى تجف.
- تصور جسيمات AAV تحت المجهر الإلكتروني النافذ (عند تكبير 50000 ضعف). ستظهر القفيصات الفيروسية ذات الجينوم الفيروسي كأشكال سداسية بيضاء متجانسة ، بينما ستظهر القفيصات الفارغة كأشكال سداسية ذات حافة بيضاء ولكن مركزها مظلم.
- عد عشوائيا ما لا يقل عن 100 جسيم لتحديد النسبة المئوية التقريبية للجسيمات الكاملة مقابل الجسيمات. جزيئات AAV فارغة.
النتائج
في هذا البروتوكول التفصيلي خطوة بخطوة ، يتم عرض منصة موحدة لصنع فيروس AAV عالي الجودة وعالي الجودة مع CF10 في بيئة معملية أبحاث واسعة النطاق. بالمقارنة مع أطباق زراعة الخلايا التقليدية ، يوفر CF10 طريقة ملائمة لزراعة كميات كبيرة من الخلايا وإنتاج فيروس AAV (الشكل 1). تم اختبار العديد من ظروف المزرعة لتحديد ما إذا كانت الخلايا في البيئة المثلى يمكن أن تعزز الإنتاج الفيروسي. أظهر DMEM منخفض الجلوكوز المكمل ب 10 mM HEPES و 2٪ FBS أفضل إنتاج AAV.
تم اختبار العديد من البروتوكولات لتنقية AAVs. معظم الإجراءات لها غلة منخفضة من الفيروس وشوائب قفيصة AAV. هنا ، تم تطوير بروتوكول تنقية منقح ، يجمع بين AAV من كل من كريات الخلايا ووسائط الاستزراع (الشكل 2). لقد وجدنا أن 80٪ من AAV كانت في الخلايا ، و 20٪ أخرى من AAV كانت في وسائط الثقافة ، والتي تم إفرازها من الخلايا. تمت معالجة كلا الجزأين من AAV باستخدام DNase لإزالة الحمض النووي الحر. تم استخدام ديوكسي كولات الصوديوم لمزيد من إطلاق AAV من الخلايا. ثم تم استخراج AAVs باستخراج الكلوروفورم متبوعا بتقسيم مائي على مرحلتين. سمحت هذه الخطوات بإزالة معظم ملوثات البروتين. AAV لا يزال قابل للذوبان في مرحلة كبريتات الأمونيوم.
تمت إزالة الملوثات المتبقية باستخدام الطرد المركزي الفائق المتدرج لليوديكسانول المتقطع (الشكل 3 أ). كان التدرج مفيدا أيضا في إزالة قفيصات AAV الفارغة ، خاصة مع الجولة الثانية من الطرد المركزي الفائق التدرج اليوديكسانول.
تم تحديد نقاء فيروس AAV عن طريق تلطيخ الفضة. عندما تم الحصول على ثلاثة نطاقات رئيسية تتوافق مع بروتين قفيصة AAV ، VP1 و VP2 و VP3 ، بنقاوة أكبر من 90٪ ، كان فيروس AAV مناسبا للاستخدام في الجسم الحي (الشكل 3B). تم الوصول إلى نسبة القفيصة الكاملة AAV إلى القفيصة الفارغة بواسطة TEM (الشكل 3C). فقط قفيصة كاملة مع إدخال جين التحوير من شأنه أن يسمح بالتعبير عن الجينات المحورة في الأنسجة المستهدفة. يمكن أن يؤدي جزء كبير من القفيصة الفارغة أيضا إلى استجابة مناعية لقفيصة AAV. تعد فحوصات الجودة هذه ضرورية لكل فيروس AAV يتم إنتاجه وتنقيته قبل الاستخدام.
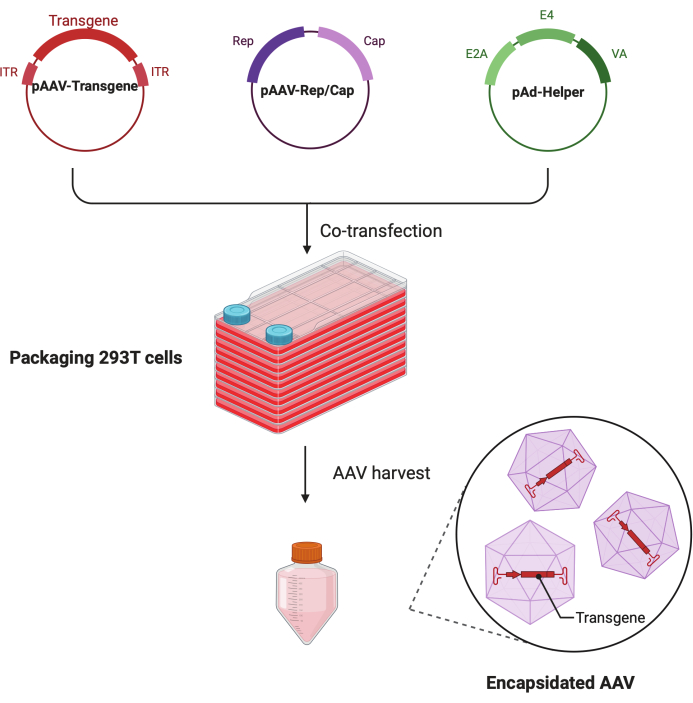
الشكل 1: رسم تخطيطي لإنتاج AAV بواسطة طريقة النقل الثلاثي للخلايا HEK293T. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
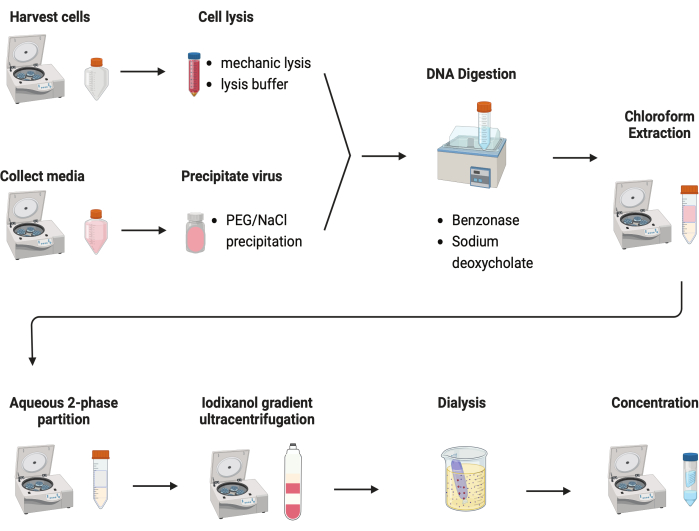
الشكل 2: رسم تخطيطي لتنقية AAV. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
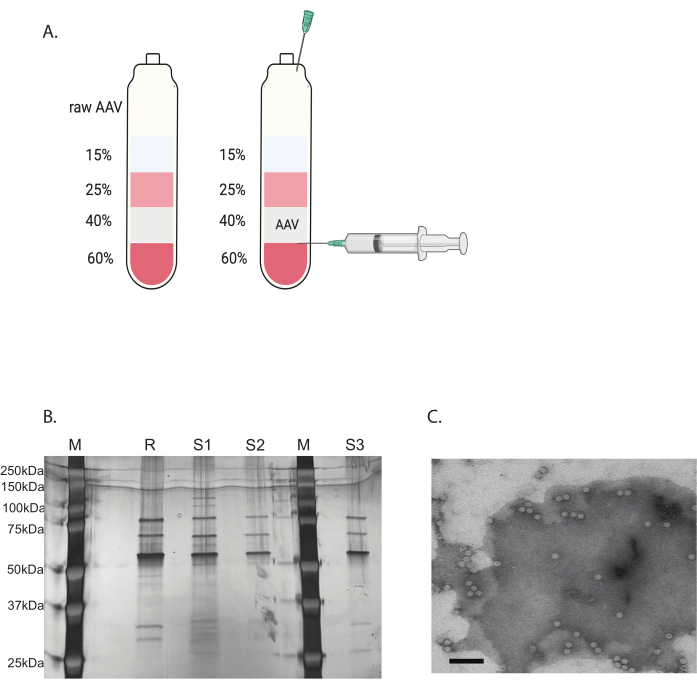
الشكل 3: تنقية AAV عن طريق الطرد المركزي الفائق التدرج اليوديكسانول والتحقق من نقاء فيروس AAV. (أ) طبقات تدرج اليوديكسانول وموضع الإبرة للحصاد. (ب) جل تمثيلي يقيم محتوى القفيصة ونقاوتها. M: علامة جزيئية. R: مرجع AAV6 قفيصة كاملة ؛ S1: قفيصة AAVDJ مصنوعة داخليا مع جولة واحدة من الطرد المركزي الفائق ؛ S2: قفيصة AAVDJ مصنوعة داخليا مع جولتين من الطرد المركزي الفائق ؛ S3: قفيصة AAV6 مصنوعة داخليا. ج: صورة المجهر الإلكتروني ل AAV. الفيروس الذي تم جمعه بعد التنقية. تظهر القفيصات الفيروسية التي تحتوي على جينوم فيروسي على شكل أشكال سداسية بيضاء متجانسة ، بينما تظهر القفيصات الفارغة على شكل أشكال سداسية ذات حافة بيضاء ولكن مركزها مظلم. شريط المقياس: 100 نانومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: حاسبة PEI لتغليف AAV. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: مخطط حجم خام AAV-PEG-Sulfate. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 3: تحضير تدرج اليوديكسانول. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 4: تحضير الجولة الثانية من تدرج اليوديكسانول. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 5: بادئات المعايرة بالتحليل الحجمي AAV. الرجاء الضغط هنا لتنزيل هذا الجدول.
الملف التكميلي 1: تركيبات المخازن المؤقتة المستخدمة للدراسة. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
هنا ، يتم تقديم بروتوكول متقدم تقنيا للإنتاج على نطاق واسع لنواقل AAV عالية العيار وعالية الجودة باستخدام منصة مصنع الخلايا (CF10) ، مما يمثل تحسنا كبيرا مقارنة بطرق طبق زراعة الخلايا التقليدية. يبسط استخدام مصانع الخلايا عملية زراعة كميات كبيرة من الخلايا ، مما يسهل إنتاج فيروسات AAV بشكل أكثر كفاءة1. أيضا ، من خلال تحسين ظروف الاستزراع ، لا سيما مع انخفاض الجلوكوز DMEM المكمل ب 10 mM HEPES و 2٪ FBS ، تم تأكيد إنتاج فيروسي محسن بشكل كبير ، مما يشير إلى الدور الحاسم للبيئة الخلوية في إنتاج الفيروس.
يعالج بروتوكول التنقية المنقح ، الذي يجمع بين AAV من كل من كريات الخلايا ووسائط الاستزراع ، القضية الشائعة المتمثلة في انخفاض غلة الفيروس والشوائب التي شوهدت في العديد من البروتوكولات الحالية. خطوات استخراج الكلوروفورم والتقسيم المائي على مرحلتين تزيل بشكل فعال معظم ملوثات البروتين ، مع بقاء AAV قابلة للذوبان في مرحلة كبريتات الأمونيوم. يمكن أن يعزى التحسن في كل من إنتاجية ونقاء ناقلات AAV باستخدام التقسيم ثنائي الطور PG / المائي جنبا إلى جنب مع الطرد المركزي الفائق للتدرج اليوديكسانول ، على عكس طرق الطرد المركزي الفائق المتدرجة التقليدية ، إلى الفصل الأولي المعزز باستخدام PEG / التقسيم المائي على مرحلتين ، والنقاء المكرر باستخدام الطرد المركزي الفائق التدرج اليوديكسانول وتقليل التنقية المشتركة للملوثات12. أولا ، إدخال PEG / التقسيم المائي على مرحلتين قبل الطرد المركزي الفائق يحسن بشكل كبير الفصل الأولي لجزيئات AAV من الحطام الخلوي والملوثات الأخرى. PEG ، بوليمر عالي الوزن الجزيئي ، عند مزجه بمحلول مائي ، يخلق مرحلتين متميزتين13. تميل ناقلات AAV إلى التقسيم بشكل تفضيلي إلى إحدى هذه المراحل (عادة المرحلة الغنية ب PEG) ، بينما يتم تقسيم العديد من الملوثات والشوائب إلى13 مرحلة أخرى. يركز هذا التقسيم الانتقائي بشكل فعال جزيئات AAV ويزيل جزءا كبيرا من الشوائب حتى قبل الطرد المركزي الفائق ، وبالتالي زيادة العائد وتقليل حمل الملوثات الذي يدخل خطوةالطرد المركزي الفائق 13. ثانيا ، يعمل الطرد المركزي الفائق التدرج اليوديكسانول على تحسين نقاء ناقلات AAV. يسمح Iodixanol ، وهو وسيط تدرج غير أيوني ، متساوي الأسمولية ، بفصل أكثر لطفا وتحكما مقارنة بتدرجات CsCl التقليدية14. في هذا التدرج ، تهاجر جزيئات AAV إلى موضع في التدرج يتوافق مع كثافة الطفو14. والأهم من ذلك ، أن هذه العملية فعالة في فصل قفيصات AAV الكاملة (التي تحتوي على الحمولة الجينية) عن القفيصات الفارغة (التي تفتقر إلى المادة الوراثية) ، وهو محدد حاسم لجودة النواقل. تحافظ طبيعة الأيزو أسمولار في يوديكسانول أيضا على سلامة قفيصات AAV بشكل أفضل من العوامل المفرطة الأسمولية مثل CsCl ، مما قد يؤدي إلى زيادة غلة النواقل الوظيفيةالسليمة 14. أخيرا ، يمكن لطرق الطرد المركزي الفائقة التقليدية ، خاصة تلك التي تستخدم تدرجات CsCl ، في بعض الأحيان أن تشارك في تنقية الملوثات التي لها كثافات طفو مماثلة لناقلات AAV15. باستخدام تقسيم PEG كخطوة أولية ، يتم تقليل حمل هذه الملوثات بشكل كبير قبل الطرد المركزيالفائق 13. هذا الانخفاض في حمل الملوثات يعني أن تدرج اليوديكسانول يمكن أن يعمل بشكل أكثر فعالية وانتقائية في تنقية ناقلات AAV ، مما يؤدي إلى نقاء أعلى15.
يتم تقييم نقاء وجودة ناقلات AAV بدقة من خلال تلطيخ الفضة و TEM11. تشير ملاحظة ثلاثة نطاقات رئيسية تتوافق مع بروتينات قفيصة AAV VP1 و VP2 و VP3 ، بنقاوة تتجاوز 90٪ ، إلى مدى ملاءمة ناقلات AAV هذه للاستخدام في الجسم الحي . يعد تحليل TEM لتحديد نسبة القفيصة الكاملة إلى الفارغة أمرا بالغ الأهمية بشكل خاص ، حيث يمكن أن تؤدي نسبة عالية من القفيصات الفارغة إلى انخفاض كفاءة توصيل الجينات والاستجابات المناعية المحتملة11. وعلى الرغم من أن فحص الجودة هذا ضروري، إلا أنه يزيد من التعقيد الإجرائي وقد يتطلب خبرة تقنية إضافية.
في الختام ، يقدم البروتوكول تطورات تقنية كبيرة في إنتاج ناقلات AAV ، لا سيما من حيث قابلية التوسع والنقاء. ومع ذلك ، فإن التعقيدات المرتبطة بعملية التنقية والحاجة إلى المعدات والخبرات المتخصصة قد لا تزال تشكل قيدا بسيطا على تطبيقها في بعض إعدادات البحث. ومن شأن المزيد من الصقل والتبسيط لهذه التقنيات أن يجعل هذا النهج أكثر سهولة وقابلية للتطبيق على نطاق واسع في مجال أبحاث العلاج الجيني.
Disclosures
يعلن المؤلفون أن البحث قد أجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
Acknowledgements
صمم TZ التجارب. أجرى TZ و VD و SB و JP التجارب. تولت TZ و VD البيانات وحللت البيانات. كتب TZ و YX المخطوطة. قام TZ و GG بمراجعة المخطوطة. تم دعم هذا العمل من قبل مستشفى UPMC للأطفال في بيتسبرغ.
Materials
| Name | Company | Catalog Number | Comments |
| 293T/17 cells | ATTC | CRL-11268 | |
| 0.5 M EDTA | MilliporeSigma | 324506-100ml | |
| 1 mL Henke-Ject syringe | Fisher Scientific | 14-817-211 | |
| 10% pluronic F68 solution | Fisher Scientific | 24-040-032 | |
| 10x Tris/Glycine/SDS Buffer | Biorad | 1610732 | |
| 1M HEPES | Fisher Scientific | 15-630-080 | |
| 2% Uranyl Acetate Solution | Electron Microscopy Sciences | 22400-2 | |
| 4%–20% Precast Protein Gels | biorad | 4561094 | |
| 40% PEG solution | Sigma | P1458-50ML | |
| AAV6 reference full capsids | Charles River Laboratories | RS-AAV6-FL | |
| Accutase Cell Detachment Solution | Fisher Scientific | A6964-100ML | |
| Benzonase | Sigma | E1014-25KU | |
| BioLite Cell Culture Treated Dishes 150 mm | Fisher Scientific | 12-556-003 | |
| Centrifugal Filter Unit | MilliporeSigma | UFC905024 | |
| Corning PES Syringe Filters | Fisher Scientific | 09-754-29 | |
| Dialysis Cassettes, 10 K MWCO | Fisher Scientific | PI66810 | |
| Disposable PES Filter Units 1 L 0.2 µm | Fisher Scientific | FB12566506 | |
| Disposable PES Filter Units 1 L 0.45 µm | Fisher Scientific | FB12566507 | |
| Disposable PES Filter Units 500 mL 0.2 µm | Fisher Scientific | FB12566504 | |
| DMEM high glucose | Fisher Scientific | 10-569-044 | |
| DMEM low glucose | Fisher Scientific | 10567022 | |
| DNase | NEB | M0303S | |
| DPBS 1x | Fisher Scientific | 14-190-250 | |
| Fetal Bovin Serum (FBS) | Biowest | S1620 | |
| Formvar/Carbon 300 Mesh, Cu | Electron Microscopy Sciences | FCF300-Cu-50 | |
| glycerol | Sigma | G5516-1L | |
| KCl | Sigma | P9541-500G | |
| LB agar | Sigma | L2897-250G | |
| LB broth | Fisher Scientific | BP9732-500 | |
| MgCL2·6H2O | Sigma | M9272-100G | |
| NEB stable competent cells | NEB | C3040H | |
| Nest Biofactory 10 chamber | MidSci | 771302 | |
| NucleoBond Xtra Maxi EF | Macherey-Nagel | 740424 | |
| Opti-MEM | Fisher Scientific | 31-985-088 | |
| OptiPrep Density Gradient Medium | Millipore Sigma | D1556-250ml | |
| pAAV-CMV-GFP | Addgene | 105530 | |
| pAAV-DJ | Cell BioLab | VPK-420-DJ | |
| pAAV-RC6 | Cell BioLab | VPK-426 | |
| pAdDeltaF6 | Addgene | 112867 | |
| PEG 8000 | Promega | V3011 | |
| PEI Max | Polysciences, Inc | 49553-93-7 | |
| Pen-Strep | Fisher Scientific | 15-140-163 | |
| Phenol red | Millipore Sigma | 1.07242.0100 | |
| Pierce Silver Stain Kit | Thermo Fisher Scientific | 24612 | |
| QuickSeal tube | Fisher Scientific | NC9144589 | |
| Sodium Chloride | Sigma | 1162245000 | |
| sodium deoxycholate | Millipore Sigma | D6750-100G | |
| Taqman Fast Advanced Master Mix | Thermo Fisher Scientific | 4444557 | |
| Type 70 Ti Fixed-Angle Titanium Rotor | Beckman Coulter | 337922 | |
| Western Blotting Substrate | ThermoFisher | 32209 |
References
- Arjomandnejad, M., Dasgupta, I., Flotte, T. R., Keeler, A. M. Immunogenicity of recombinant adeno-associated virus (AAV) vectors for gene transfer. BioDrugs. 37 (3), 311-329 (2023).
- Liu, Y., Siriwon, N., A Rohrs, J., Wang, P. Generation of targeted adeno-associated virus (AAV) vectors for human gene therapy. Curr Pharm Des. 21 (22), 3248-3256 (2015).
- Bilal, A. S., et al. Optimization of large-scale Adeno-Associated Virus (AAV) production. Curr Protoc. 3 (5), e757(2023).
- Rashnonejad, A., Chermahini, G. A., Li, S., Ozkinay, F., Gao, G. Large-scale production of adeno-associated viral vector serotype-9 carrying the human survival motor neuron gene. Mol Biotechnol. 58, 30-36 (2016).
- Challis, R. C., et al. Systemic AAV vectors for widespread and targeted gene delivery in rodents. Nat Protoc. 14 (2), 379-414 (2019).
- Challis, R. C., et al. Publisher Correction: Systemic AAV vectors for widespread and targeted gene delivery in rodents. Nat Protoc. 14 (8), 2597-2597 (2019).
- Mueller, C., Ratner, D., Zhong, L., Esteves-Sena, M., Gao, G. Production and discovery of novel recombinant adeno-associated viral vectors. Curr Protoc Microbiol. 26 (1), 14(2012).
- Guo, P., Wiersch, J., Xiao, X., Gittes, G. Simplified purification of AAV and delivery to the pancreas by intraductal administration. Methods Mol Biol. 1950, 373-387 (2019).
- Berns, K. I., Srivastava, A. Next generation of adeno-associated virus vectors for gene therapy for human liver diseases. Gastroenterol Clin North Am. 48 (2), 319-330 (2019).
- Khasa, H., Kilby, G., Chen, X., Wang, C. Analytical band centrifugation for the separation and quantification of empty and full AAV particles. Mol Ther Methods Clin Dev. 21, 585-591 (2021).
- Chen, H. Comparative observation of the recombinant adeno-associated virus 2 using transmission electron microscopy and atomic force microscopy. Microsc Microanal. 13 (5), 384-389 (2007).
- Burnham, B., et al. Analytical ultracentrifugation as an approach to characterize recombinant adeno-associated viral vectors. Hum Gene Ther Methods. 26 (6), 228-242 (2015).
- Kato, M., et al. In situ-formable, dynamic crosslinked poly (ethylene glycol) carrier for localized adeno-associated virus infection and reduced off-target effects. Commun Biol. 6 (1), 508(2023).
- Sena-Esteves, M., Gao, G. Enrichment of fully packaged virions in column-purified recombinant adeno-associated virus (rAAV) preparations by iodixanol gradient centrifugation followed by anion-exchange column chromatography. Cold Spring Harb Protoc. 2020 (2), 095638(2020).
- Matsumoto, M., Wangelin, J. R., Murphy, M. L. Purification of avian encephalomyelitis virus by ultracentrifugation in a nonlinear cesium chloride gradient. Avian Dis. 22 (3), 496-502 (1978).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved