Method Article
Cell Factory Platform을 활용하여 고역가, 고품질 아데노 관련 바이러스 벡터를 생성하기 위한 간소화되고 표준화된 절차
요약
유전자 치료 분야가 계속 발전함에 따라 이러한 문제를 해결할 수 있는 혁신적인 방법에 대한 필요성이 커지고 있습니다. 여기에서는 cell factory 플랫폼을 사용하여 고수율 및 고순도 AAV 벡터를 생성하는 프로세스를 간소화하여 in vivo 연구의 품질 표준을 충족하는 고유한 방법을 제시합니다.
초록
전임상 유전자 치료 연구, 특히 설치류 및 대형 동물 모델에서는 수율과 순도가 높은 AAV 벡터의 생산이 필요합니다. 연구 실험실의 전통적인 접근 방식은 종종 HEK293T 세포를 배양하기 위해 세포 배양 접시를 광범위하게 사용하는 것을 포함하는데, 이는 힘들고 문제가 될 수 있는 과정입니다. 여기에서는 특정 셀 팩토리(또는 셀 스택, CF10) 플랫폼으로 이 프로세스를 단순화하는 고유한 사내 방법을 제시합니다. 폴리에틸렌 글리콜/수용성 2상 분할과 요오딕사놀 그래디언트 초원심분리의 통합은 생성된 AAV 벡터의 수율과 순도를 모두 향상시킵니다. AAV 벡터의 순도는 SDS-PAGE 및 은 염색을 통해 검증되며, 전체 입자와 빈 입자의 비율은 투과 전자 현미경(TEM)을 사용하여 결정됩니다. 이 접근법은 in vivo 연구에 대한 품질 요구를 충족하기 위해 개선된 정제 방법과 함께 높은 수율로 AAV 벡터를 생산할 수 있는 효율적인 cell factory 플랫폼을 제공합니다.
서문
아데노 관련 바이러스(AAV) 벡터는 유전자 치료 연구에서 없어서는 안 될 도구가 되었으며, 유전자 전달을 위한 효능과 안전성의 고유한 조합을 제공합니다1. 실험실 환경에서 AAV를 생성하는 전통적인 방법은 유전자 치료에 대한 이해와 응용을 발전시키는 데 중추적인 역할을 해왔다2. 그러나 이러한 방법은 기초적이기는 하지만 특히 수율, 시간 효율성 및 생성된 벡터의 품질, 특히 전체 입자와 빈 입자의 비율 측면에서 특정 한계와 과제를 나타냅니다3.
AAV 생산을 위한 기존 절차는 주로 HEK293 세포의 transfection을 포함합니다4. 일반적으로 세포 배양 접시에서 수행되는 이 과정에서는 관심 유전자가 포함된 플라스미드와 도우미 플라스미드 및 AAV 캡시드 플라스미드 5,6으로 세포를 transfection해야 합니다. 형질주입 후, 세포는 AAV 입자를 생성하고, 그런 다음 이를 수확하고 정제합니다 5,6. 정제 과정에는 종종 초원심분리가 포함되는데, 이는 고순도 AAV 벡터를 얻기 위한 중요한 단계이다7. 특히 염화세슘(CsCl) 또는 요오딕산올 구배를 사용하는 초원심분리는 세포 파편 및 기타 불순물에서 AAV 입자를 분리하는 표준 방법입니다8. 이 단계는 AAV 벡터의 원하는 순도와 농도를 달성하는 데 매우 중요하며, 이는 유전자 전달에서의 효능에 직접적인 영향을 미친다8. 널리 사용됨에도 불구하고 기존의 초원심분리에는 단점이 있습니다. 예를 들어, 이 방법에서 AAV 벡터의 수율은 가변적일 수 있고 종종 낮을 수 있으며, 이는 특히 in vivo 연구 또는 대형 동물 모델에서 대량의 high-titer 벡터가 필요한 경우 상당한 문제를 제기합니다9.
AAV 벡터 품질의 또 다른 중요한 측면은 전체 입자와 빈 입자10의 비율입니다. AAV 제제에는 종종 이러한 입자의 혼합물이 포함되어 있습니다. 그러나 전체 입자에만 치료용 유전 물질이 포함되어 있습니다. 빈 입자의 비율이 높으면 유전자 전달의 효율성이 크게 감소할 수 있다10. 따라서 full particles 대 empty particle의 비율을 평가하고 최적화하는 것은 AAV 벡터의 효능을 평가하는 데 있어 중요한 파라미터입니다. 전통적인 방법은 AAV 벡터를 생성할 수 있지만, 종종 이 비율을 일관되게 제어하는 데 어려움을 겪어 벡터 효능(vector potency)10의 변동을 초래한다.
여기에서는 노동 집약적인 HEK293T 세포 배양을 세포 접시에서 사용하지 않는 세포 공장 플랫폼을 사용하여 폴리에틸렌 글리콜/수성 2상 분할을 요오딕사놀 그래디언트 초원심분리와 통합하는 고수율 및 고순도 AAV 벡터를 생성하는 프로세스를 간소화하는 고유한 방법을 제시합니다. AAV 벡터 순도는 SDS-PAGE 및 은 염색을 통해 확인되며, 투과 전자 현미경(TEM)을 사용하여 전체 대 비어 있는 입자 비율을 측정하여 in vivo 연구11의 품질 표준을 충족합니다.
프로토콜
연구에 사용된 시약, 플라스미드 및 장비의 세부 사항은 재료 표에 나열되어 있습니다. 사용된 버퍼의 구성은 보충 파일 1에 제공됩니다.
1. 플라스미드 준비
- E. coli에서 플라스미드(pAAV-GOI, pHelper, pAAV-Cap)를 형질전환합니다.
참고: 모든 E.coli 균주를 플라스미드 증폭에 사용할 수 있습니다. 일부 플라스미드의 경우, NEB 안정과 같은 특수 유능한 세포가 플라스미드 수율을 향상시킬 수 있습니다. 이 프로토콜에 사용되는 3개의 플라스미드는 pAAV-GOI: pAAV-CMV-GFP, pHelper: pAdDeltaF6 및 pAAV-Cap: pAAV-RC6입니다. - 적절한 선택적 항생제를 함유한 LB 배지에서 37°C에서 16-18시간 동안 최적의 부피로 박테리아를 성장시킵니다.
참고: NEB 안정 세포를 사용하는 경우 30°C에서 18-20시간 동안 배양하십시오. - E. coli를 원심분리하여 플라스미드 DNA를 수확합니다. 배양 배지 4000 x g, 4 °C에서 15분 동안
- 원심분리기 병의 상층액을 폐기물 용기에 조심스럽게 붓고 대규모 내독소가 없는 플라스미드 정제 키트로 펠릿의 플라스미드 DNA를 정제합니다.
알림: 천천히 붓고 튀지 않도록 하십시오. - 분광 광도계를 사용하여 DNA 농도와 순도를 측정합니다.
NOTE: OD260/OD280 비율을 확인하여 DNA 순도를 확인하십시오. 순수 DNA의 비율은 약 1.8입니다. DNA 농도는 추후 co-transfection 단계에서 1μg/μL 이상이어야 합니다. 하룻밤 배양액 500μL를 극저온 내 50% 글리세롤 500μL에 첨가하여 박테리아 글리세롤 스톡을 만들고 -80°C에서 보관합니다.
2. HEK293T 세포 준비
- 10% FBS를 함유한 DMEM 고포도당 배지로 HEK293T 세포를 10층 세포 공장(CF10)에 파종하고 세포가 밤새 인큐베이터에서 자라도록 합니다.
참고: 293T 셀의 통로는 견고한 AAV 생산을 위한 최적의 조건을 갖기 위해 10개 미만이어야 합니다. 가능하면 지금은 배양 배지에 항생제를 추가하지 마십시오. CF10은 150mm 세포 배양 접시의 약 42배의 성장 표면적을 가지고 있습니다. 현미경으로 세포 성장을 확인할 수 있도록 150mm 세포 배양 접시에 동일한 세포 밀도를 파종합니다. 1075mL 세포 현탁액을 준비하고, 25mL 세포 현탁액을 150mm 접시에 추가하고, 나머지를 CF10에 넣습니다. - transfection 다음날 세포 밀도를 확인하십시오.
참고: 세포는 현미경으로 관찰하여 transfection 시점에 80%-90% 밀도에 도달해야 합니다.
3. AAV 플라스미드의 triple-transfection
- CF10당 2.5-5mg의 총 DNA와 1.2:1:1 몰 비율을 갖기 위해 필요한 각 플라스미드(pAAV-GOI, pHelper, pAAV-serotype)의 양을 계산합니다.
참고: 3개의 플라스미드의 몰 비율은 최적의 transfection 효능을 위해 가변적일 수 있습니다. 이 CF10 설정으로 이동하기 전에 소규모 설정에서 테스트하는 것이 좋습니다. 예를 들어 pAAV-CMV-GFP, pAdDeltaF6 및 pAAV-RC6는 AAV6-CMV-GFP 바이러스를 만드는 데 사용됩니다. PEI 계산기 공식은 표 1에 나열되어 있습니다. - 350mL의 OptiMEM을 멸균된 500mL 병에 분취합니다.
- Opti-MEM이 들어 있는 병에 3개의 플라스미드 DNA를 모두 추가합니다. 잘 섞는다.
- 1mg/mL 폴리에틸렌시민(PEI) 용액 15mL(DNA 대 μg PEI 비율 1:3μg)를 추가합니다. OptiMEM/DNA/PEI 혼합물을 30초 동안 위아래로 세게 흔듭니다.
참고: 비눗방울을 만드는 것은 괜찮습니다. - 혼합물을 실온에서 10-15분 동안 배양합니다.
참고: 배양 시간이 길어지면 transfection 효율이 감소할 수 있습니다. - 10mM HEPES 및 10% FBS가 있는 700mL의 DMEM 저포도당이 들어 있는 2L 병에 OptiMEM/DNA/PEI 용액을 추가합니다. 잘 섞는다.
참고: 이 연구에서, DMEM의 낮은 포도당은 co-transfection 후 더 나은 AAV 벡터 생성을 보여주었습니다. HEPES를 추가하면 세포를 더 나은 상태로 유지하는 데 도움이 됩니다. 병을 천천히 돌려 섞는다. 거품을 너무 많이 만들지 마십시오. - 인큐베이터에서 CF10을 꺼내 배지를 진공 청소기로 청소하여 폐기물 용기에 넣습니다.
알림: 후드 내부 표면에 CF10을 내려놓고 한쪽을 서서히 들어 올려 셀을 분리하지 않고 미디어를 천천히 진공 청소기로 빼냅니다. - 형질주입제 혼합물을 CF10에 조심스럽게 첨가합니다. 10개의 레이어가 모두 미디어로 덮여 있는지 확인합니다.
참고: 150mm 접시에 transfectant 혼합물 25mL를 추가합니다. 수확할 때까지 매일 세포를 모니터링하십시오. 남은 transfectant 혼합물을 천천히 부어 CF10에 추가합니다. CF10을 매우 조심스럽게 회전하고 각 레이어에 대해 동일한 볼륨을 보장합니다. - CF10을 72-96시간 동안 인큐베이터에 다시 넣습니다.
참고: 150mm 모니터 접시를 확인하여 AAV 벡터를 수확할 시기를 결정하십시오. AAV가 가득 차면 세포가 매우 쉽게 분리되면 수확할 때입니다.
4. AAV 벡터 수집
- 형질주입 후 3-4일 후에 CF10을 세게 흔들어 바이러스를 채취합니다. 배지를 250mL 코니컬 튜브에 붓고 4000 x g 에서 4°C에서 20분 동안 바이러스를 회전시킵니다.
참고: 이 프로토콜에 사용된 AAV6 혈청형의 경우 80% AAV는 대부분 펠릿의 세포 물질에 결합된 상태로 유지됩니다. 그리고 20%의 AAV는 언론에 유출되었습니다. 이러한 비율은 다른 AAV 혈청형에 따라 다를 수 있습니다. - 0.45μm 필터 장치로 정화된 상층액을 여과하고 침전을 위해 저장합니다.
- CF10을 500mL의 DPBS 1x 완충액으로 헹구고 4000 x g 에서 4°C에서 20분 동안 원심분리기를 헹굽니다.
- 진공 시스템과 흡입 피펫을 사용하여 상층액을 폐기합니다. 정제할 때까지 -80°C에서 CF10당 AAV 용해 완충액 20mL를 추가합니다.
참고: 나중에 AAV 추출을 위해 AAV 용해물을 50mL 코니컬 튜브로 옮깁니다. - 여과된 상층액을 꺼내고 40% PEG-2.5M NaCl 용액을 첨가하여 최종 농도 8% PEG를 만들고 궤도 회전기의 냉장실에서 최소 3시간 또는 밤새 배양합니다.
참고: 100mL 상층액의 경우 25mL 40% PEG-2.5M NaCl 용액을 추가합니다. - 4000 x g 에서 4 ° C에서 30 분 동안 원심 분리하여 바이러스를 침전시킵니다.
참고: 원심분리를 위해 혼합물을 250mL 코니컬 튜브로 옮깁니다. - 흡인하여 상층액을 제거하고 5-10mL의 AAV HEPES 재현탁 완충액을 추가하여 펠릿을 부유시킵니다. 50mL 코니컬 튜브에 옮겨 다운스트림 정제를 계속하거나 -80°C에서 보관합니다.
5. AAV 추출
- 바이러스 펠릿을 37°C 수조에서 셰이커로 10-15분 동안 해동합니다.
알림: AAV 용해물을 소용돌이치게 하여 완전히 녹입니다. - -80 °C 100% 에탄올 욕조에서 20-30분 동안 얼립니다.
알림: 또는 드라이아이스로 둘러싸인 차가운 100% 에탄올 비커로 동결 사이클을 수행할 수 있습니다. - 동결/해동을 3-4회 수행하고 필요한 경우 그 사이에 와류를 수행합니다.
알림: 이 주기는 고정 단계에서 일시 중지할 수 있습니다. 다운스트림 작업이 완료될 때까지 AAV 용해물을 -80°C에서 보관합니다. - AAV 용해물(5.3단계에서)과 재현탁 AAV(4.7단계에서)"를 37°C 수조에서 셰이커와 와류로 10-15분 동안 해동합니다.
알림: 완전히 녹여 섞어야 합니다. - 벤조나아제 뉴클레아제(250 units/μL)를 AAV 용해물 및 재현탁 AAV에 첨가하여 최종 농도 50 units/mL를 만듭니다. Vortex 솔루션.
- 37°C 수조에서 30분 동안 흔들어 배양합니다.
알림: 수조에서 10% 데옥시콜산나트륨 분취액을 꺼내 녹이고 예열하고 완전히 섞을 시간을 줍니다. - 최종 농도가 0.5%가 되도록 10% 데옥시콜산나트륨을 첨가하고 쉐이커를 37°C에서 30분 동안 배양합니다.
참고: 소듐 데옥시콜레이트는 세포에서 AAV 방출을 향상시키는 데 사용되었습니다. - 원시 AAV 용액을 2mL 원심분리기 튜브에 분배하고 4°C에서 10분 동안 14,000 x g 에서 원심분리합니다.
- 상층액을 50mL 원뿔형 튜브에 옮깁니다.
참고: 1mL 피펫을 사용하여 상층액을 이송합니다. 펠릿을 버리십시오. - 같은 양의 클로로포름을 추가하고 1-2분 동안 소용돌이치면서 AAV를 추출합니다.
알림: 용액은 불투명하고 흰색이며 우유처럼 되어야 합니다. - 유백색 용액을 2mL 원심분리기 튜브에 옮기고 고르게 분포시킵니다. 14,000 x g 에서 4 °C에서 10분 동안 원심분리합니다.
- 상단 분홍색 층을 조심스럽게 피펫팅하여 새 50mL 코니컬 튜브에 옮깁니다.
알림: 클로로포름/단백질 층을 방해하지 마십시오. - 피펫을 사용하여 최종 부피를 측정합니다. 원시 AAV-PEG-Sulfate 부피 차트 (표 2)에 따라 50 % (NH4) 2SO4 및 40 % PEG 용액의 적절한 부피를 혼합하십시오. 2분 동안 소용돌이
- 혼합물을 2mL 원심분리기 튜브로 옮겨 고르게 분포시킵니다. 14,000 x g 에서 4 °C에서 10분 동안 원심분리기
- 22G 바늘과 3mL 주사기를 사용하여 바닥층을 채취합니다. AAV를 50mL 원뿔형 튜브에 수집하고 나중에 요오드옥산올 그래디언트의 초원심분리를 위해 4°C에서 보관합니다.
6. iodixanol 기온변화도 ultracentrifugation에 의하여 AAV 정화
- 사용된 초원심분리 튜브의 수에 따라 AAV를 로드하기 전에 요오딕사놀 구배를 새로 준비합니다(표 3).
참고 : 페놀 레드는 층을 관찰하는 데 사용되었습니다. - 16G의 펀트 긴 바늘이 부착된 10mL 주사기를 사용하여 각 용액을 둥근 폴리프로필렌 초원심분리기 퀵 씰 튜브에 천천히 오버레이합니다. 거품을 피하십시오.
- 22G 주사기로 그래디언트 위에 최대 17mL의 AAV 용액을 조심스럽게 추가합니다. AAV 투석 버퍼를 사용하여 튜브를 보충합니다.
알림: 초원심분리기 튜브의 벽에 방울을 적재하여 AAV 용액을 추가합니다. 그라디언트 레이어를 방해하지 마십시오. - 초원심분리기 튜브를 전기 밀봉기로 밀봉합니다.
알림: ±0.2g 차이로 초원심분리기로 보내기 전에 튜브의 균형을 맞추십시오. - 4 °C의 Ti70 로터에서 350,000 x g 에서 2시간 동안 원심분리기.
- 로터에서 튜브를 조심스럽게 제거하고 초원심분리기 튜브 랙에 넣습니다.
참고: 그라디언트가 방해받지 않도록 하십시오. - 아래 단계에 따라 AAV 분획을 수집합니다.
- 스탠드 홀더에서 튜브를 고정합니다.
- 10mL 주사기에 부착된 19G 바늘로 40%-60% 계면 약간 아래에 있는 초원심분리기 튜브를 뚫습니다.
알림: 바늘의 개구부는 40% 기울기를 향하도록 위로 향해야 합니다. - 16G 바늘로 튜브 상단에 구멍을 뚫습니다.
- 튜브당 최대 5mL를 수집합니다. 25%-40% 계면에서 단백질 오염을 수집하지 마십시오.
- 각 초원심분리기 튜브에 대해 반복합니다.
참고: AAV 분획을 50mL 코니컬 튜브로 옮깁니다.
7. 두 번째 라운드 요오딕사놀 그라디언트 초원심분리
참고: 이 단계는 선택 사항입니다. 이 단계는 더 높은 품질의 전체 AAV 캡시드를 위해 빈 AAV 비율을 줄이는 것입니다.
- AAV 투석 완충액으로 AAV >1:1로 희석합니다.
참고 : 초원심 분리의 첫 번째 라운드에서 수집 된 AAV는 40 % 요오드화 산올 층에있었습니다. 30% 요오드옥산올 층 위에 적재할 수 있도록 최소 50% 희석해야 합니다. - 16G 펀트 바늘을 사용하여 각 용액(표 4)을 초원심분리 튜브에 오버레이하고 10mL 주사기를 천천히 부착합니다. 거품을 피하십시오.
- 22G 주사기로 그래디언트 위에 희석된 AAV 용액 20mL를 조심스럽게 추가합니다. AAV 투석 버퍼를 사용하여 튜브를 보충합니다.
- 6.4에서 6.7까지 반복합니다.
8. AAV 투석 및 집중
- 새로운 18G 바늘과 10mL 주사기를 사용하여 AAV 바이러스를 투석 카세트로 옮깁니다. 카세트에 바이러스를 천천히 주입하고 공기를 제거합니다.
- AAV 투석 버퍼가 들어 있는 비커에 교반 막대를 추가하고 교반 플레이트에 놓습니다.
- 플로트 부표로 투석 카세트를 투석 버퍼에 넣습니다. 4 °C에서 저어줍니다. AAV 투석 버퍼를 2-3배 변경합니다.
주: 카세트가 부동할 수 있도록 충분한 버퍼를 사용하고 버퍼 교환을 수행합니다. 알루미늄 호일로 비커를 덮습니다. - 18G 바늘이 부착된 10mL 주사기를 사용하여 카세트의 바이러스를 원심 필터 장치로 수집합니다.
- 4,000 x g 에서 4 °C에서 15-30분 동안 원심분리기.
알림: AAV 투석 버퍼로 AAV를 2-3회 헹굽니다. ~200μL의 잔량이 필터 위에 올 때까지 AAV를 농축합니다. - 필터 장치에서 농축된 AAV를 수집합니다. 다른 300μL의 AAV 투석 버퍼로 필터를 헹구고 농축된 AAV로 옮깁니다.
- 1mL 투베르쿨린 루어 슬립 주사기를 사용하여 0.22μm 주사기 필터를 통해 바이러스를 여과합니다. 부피 손실을 최소화하려면 10mL 주사기를 사용하여 필터를 통해 공기를 2-3회 밀어 넣습니다.
- 적정을 위해 정제된 AAV 바이러스를 4°C에서 임시로 보관합니다.
참고: 바이러스를 적정하고 분주하여 1주일 이내에 -80°C에서 보관하십시오.
9. AAV 바이러스 적정
참고: TaqMan 정량 중합효소 연쇄 반응(qPCR)을 사용하여 정제된 AAV를 적정했습니다.
- AAV 벡터를 DNase I로 처리하고 37°C에서 30분 동안 배양한 다음 95°C에서 10분 동안 배양합니다.
참고: 10 μL 반응의 예로, 2 μL AAV 바이러스 샘플, 1 μL DNase, 1 μL DNase 완충액 및 6 μLH2O가 사용됩니다. PCR 튜브가 있는 Thermocycler에서 수행할 수 있습니다. - AAV 삽입 영역을 타겟으로 하는 프라이머 세트를 준비합니다.
주의: 표적은 AAV 구조체의 promoter, transgene 및 reporter가 될 수 있습니다. 프라이머는 표 5에 기재되어 있다. - DNA 플라스미드 표준물질(10, 1, 0.1, 0.01, 0.001, 0.0001pg/μL)과 음성 대조군(H2O)을 준비합니다.
- 제조업체의 지침에 따라 프라이머를 포함한 qPCR 마스터 믹스를 준비합니다.
- 표준물질과 샘플을 PCR 플레이트에 삼중으로 놓습니다. qPCR 혼합물을 표준물질 및 샘플에 추가합니다. 플레이트를 밀봉하고 제조업체의 지침에 따라 qPCR 반응을 수행합니다.
참고: 반응 조건은 재료/시약 및 기기에 따라 다릅니다. 빠르고 전통적인 PCR 주기를 적용할 수 있습니다. - AAV 바이러스 역가를 계산합니다.
참고: 이 프로토콜의 샘플 농도는 원래 샘플에서 1/10 희석됩니다. - AAV 바이러스를 1.5mL 튜브에 분취하고 4°C에서 최대 1개월 동안 보관하고 -80°C에서 장기간 보관합니다.
알림: 스토리지의 동결/해동 주기를 피하십시오. in vivo 실험에 사용하는 경우 2회 이상의 부분 표본을 해동하지 마십시오.
10. AAV의 품질 관리
참고: AAV 바이러스는 SDS-PAGE 겔을 사용하여 SDS-PAGE 은 염색으로 순도를 특성화하고 시판되는 염색 키트를 사용하여 염색했습니다.
- Laemmli 완충액을 사용하여 AAV 바이러스 샘플 3 x 109 vg를 변성시킵니다.
참고: 참조 AAV 바이러스를 대조군으로 사용하십시오. AAV6-CMV-GFP 레퍼런스 풀 캡시드가 사용됩니다. - 변성된 AAV를 4%-20% 그래디언트 SDS-PAGE 겔에 로드하고 180V에서 50분 동안 실행합니다.
- 전기영동판에서 겔을 제거합니다. 제조업체의 지침에 따라 은 염색 키트로 젤을 염색하십시오.
- AAV 캡시드 단백질 VP1, VP2 및 VP3를 확인합니다.
참고: 순수 AAV 바이러스에는 VP1, VP2 및 VP3 캡시드 단백질만 포함되어 있습니다. 순수하지 않은 경우 다른 단백질 밴드가 겔에서 볼 수 있습니다.
참고: 음성 염색 재조합 AAV 비리온의 투과 전자 현미경(TEM)을 수행하여 형태학적 무결성과 전체/빈 비율을 평가했습니다. - 핀셋으로 EM 그리드를 집어 들고 그리드의 반짝이는 면이 위를 향하도록 벤치에 앉습니다.
- 5μL의 AAV 샘플을 그리드에 피펫하고 증발로 건조시킵니다.
알림: 필요한 경우 AAV를 희석하십시오. 1012 vg/mL는 평균 역가입니다. 그리드를 건조시키는 데 30-60분이 소요될 수 있습니다. - 약 200 μL의 H2O를 그리드에 피펫팅하여 한 방울 씻습니다.
- 크로마토그래피 종이를 그리드 옆에 세로로 천천히 놓아 과도한 물을 제거합니다.
- 5μL의 2% 우라닐 아세테이트 용액을 그리드에 피펫합니다. 5분 동안 배양하고 위에서 언급한 대로 씻어냅니다. 그리드가 건조되도록 합니다.
- 투과 전자 현미경(50,000배 확대)으로 AAV 입자를 시각화합니다. 바이러스 게놈이 있는 바이러스 캡시드는 균일한 흰색 육각형으로 나타나고, 빈 캡시드는 흰색 테두리가 있지만 중심이 어두운 육각형으로 나타납니다.
- 최소 100개의 입자를 무작위로 계산하여 전체 입자와 전체 입자의 대략적인 백분율을 결정합니다. 빈 AAV 입자.
결과
이 상세한 단계별 프로토콜에서는 대규모 연구 실험실 환경에서 CF10을 사용하여 고역가 및 고품질 AAV 바이러스를 만들 수 있는 표준화된 플랫폼을 시연합니다. 기존 세포 배양 접시와 비교했을 때 CF10은 많은 양의 세포를 배양하고 AAV 바이러스를 생산할 수 있는 편리한 방법을 제공합니다(그림 1). 최적의 환경에서 세포가 바이러스 생성을 촉진할 수 있는지 여부를 결정하기 위해 여러 배양 조건을 테스트했습니다. 10mM HEPES와 2% FBS가 보충된 저포도당 DMEM은 최상의 AAV 생성을 보여주었습니다.
AAV를 정제하기 위해 여러 프로토콜을 테스트했습니다. 대부분의 시술은 바이러스 수율이 낮고 AAV 캡시드의 불순물이 있습니다. 여기에서 세포 펠릿과 배양 배지의 AAV를 결합한 수정된 정제 프로토콜이 개발되었습니다(그림 2). 우리는 AAV의 80%가 세포에 있었고 또 다른 20%의 AAV가 세포에서 분비된 배양 배지에 있었다는 것을 발견했습니다. AAV의 두 부분을 DNase로 처리하여 유리 DNA를 제거했습니다. 소듐 데옥시콜레이트를 사용하여 세포로부터 AAV를 추가로 방출하였다. 그런 다음 클로로포름 추출로 AAV를 추출한 후 수성 2상 분할을 수행했습니다. 이러한 단계를 통해 대부분의 단백질 오염 물질을 제거할 수 있었습니다. AAV는 황산 암모늄 단계에서 용해된 상태로 유지됩니다.
나머지 오염 물질은 불연속 요오딕사놀 구배 초원심분리로 제거했습니다(그림 3A). 그래디언트는 특히 두 번째 요오딕사놀 그래디언트 초원심분리에서 빈 AAV 캡시드를 제거하는 데 도움이 되었습니다.
AAV 바이러스의 순도는 은 염색에 의해 결정되었습니다. 순도가 90% 이상인 AAV 캡시드 단백질인 VP1, VP2, VP3에 해당하는 3개의 주요 띠를 얻었을 때 AAV 바이러스는 in vivo 사용에 적합했습니다(그림 3B). AAV 전체 캡시드 대 빈 캡시드 비율은 TEM에 의해 액세스되었습니다(그림 3C). 전이유전자 삽입체가 있는 전체 capsid만이 표적 조직에서 전이유유전자의 발현을 허용할 것입니다. 빈 캡시드의 높은 부분은 또한 AAV 캡시드에 대한 면역 반응을 유도할 수 있습니다. 이러한 품질 검사는 사용 전에 생산 및 정제되는 각 AAV 바이러스에 대해 필요합니다.
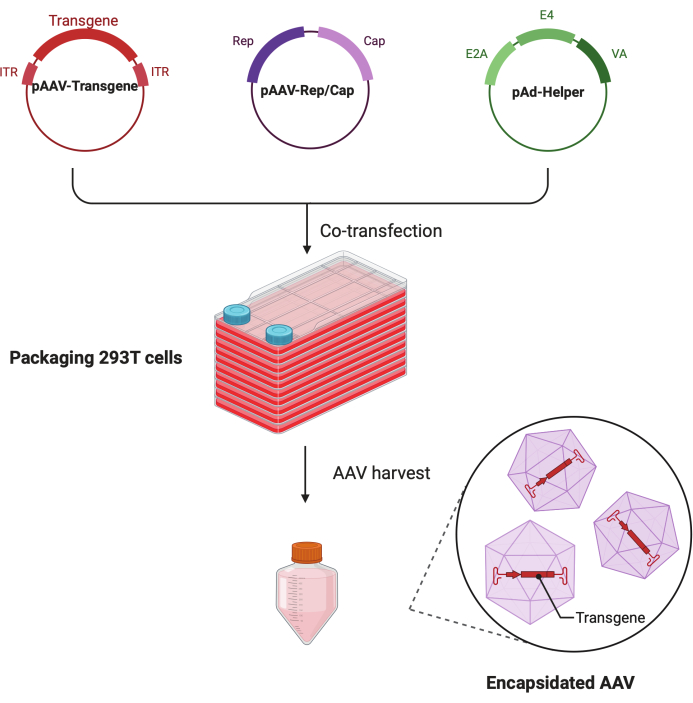
그림 1: HEK293T세포 삼중 형질주입 방법에 의한 AAV 생산의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
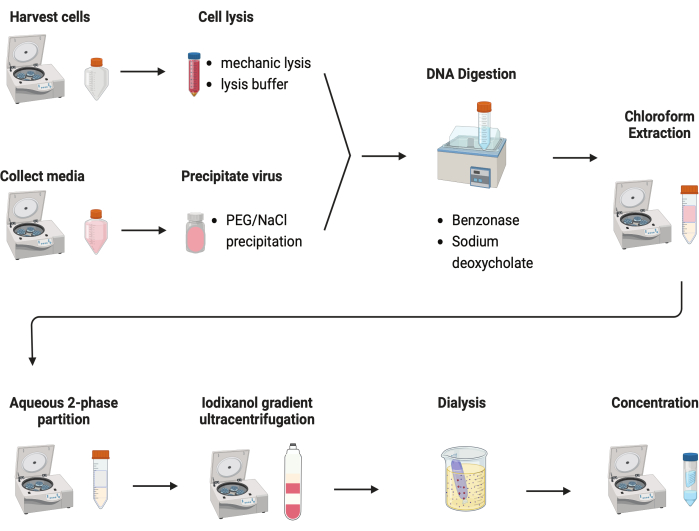
그림 2: AAV 정제의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
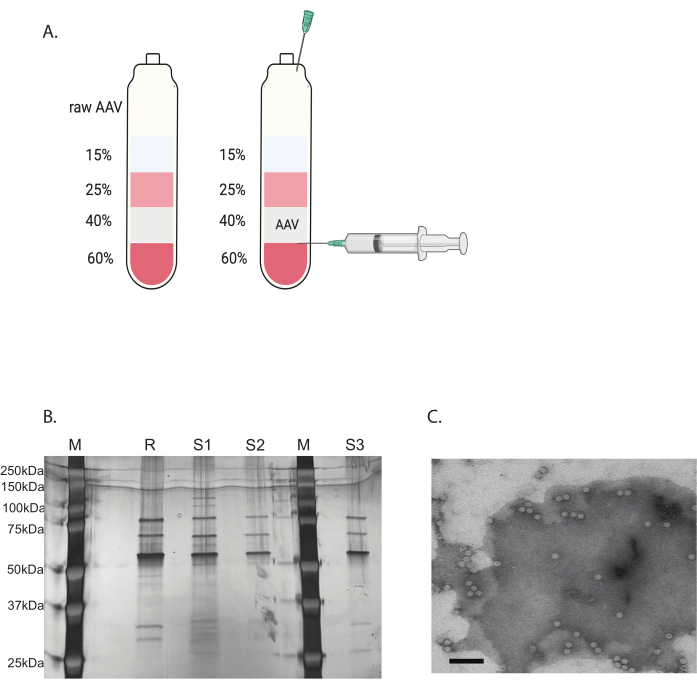
그림 3: 요오딕사놀 그래디언트 초원심분리를 통한 AAV 정제 및 AAV 바이러스 순도 검증. (A) 요오딕사놀 그래디언트 층 및 수확을 위한 바늘의 위치. (B) 캡시드 함량 및 순도를 평가하는 대표 겔. M : 분자 마커; R: 참조 AAV6 전체 캡시드; S1 : 한 번의 초 원심 분리로 사내에서 만든 AAVDJ 캡시드; S2 : 두 차례의 초 원심 분리로 사내에서 AAVDJ 캡시드를 제작했습니다. S3 : 자체 제작 AAV6 캡시드. (C) AAV의 전자 현미경 이미지. 정제 후 포집된 바이러스. 바이러스 게놈을 포함하는 바이러스 캡시드는 균일한 흰색 육각형으로 나타나고, 빈 캡시드는 흰색 테두리가 있지만 중심이 어두운 육각형으로 나타납니다. 스케일 바: 100 nm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: AAV 패키징을 위한 PEI 계산기. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 원시 AAV-PEG-Sulfate 부피 차트. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 3: 요오딕사놀 그래디언트의 제조. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 4: 2차 요오딕사놀 그래디언트의 제조. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 5: AAV 적정 프라이머. 이 표를 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 연구에 사용된 완충액의 구성. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에서는 cell factory 플랫폼(CF10)을 사용하여 high-titer 및 고품질 AAV 벡터의 대량 생산을 위한 기술적으로 발전된 프로토콜이 소개되어 기존 cell culture dish 방법에 비해 크게 개선되었습니다. 세포 공장의 사용은 많은 양의 세포를 배양하는 과정을 단순화하여 AAV 바이러스의 생산을 보다 효율적으로 촉진합니다1. 또한, 특히 10mM HEPES 및 2% FBS가 보충된 저포도당 DMEM을 사용하여 배양 조건을 최적화함으로써 바이러스 생산이 크게 향상되었음을 확인했으며, 이는 바이러스 수율에서 세포 환경의 중요한 역할을 나타냅니다.
세포 펠릿과 배양 배지의 AAV를 결합한 개정된 정제 프로토콜은 많은 기존 프로토콜에서 볼 수 있는 낮은 바이러스 수율과 불순물이라는 일반적인 문제를 해결합니다. 클로로포름 추출 및 수성 2상 분할 단계는 대부분의 단백질 오염 물질을 효과적으로 제거하며, AAV는 황산암모늄 단계에서 용해된 상태로 유지됩니다. 기존의 그래디언트 초원심분리 방법과 달리 요오딕사놀 그래디언트 초원심분리와 결합된 PEG/수성 2상 분할을 사용하여 AAV 벡터의 수율과 순도를 모두 개선한 것은 PEG/수용성 2상 분할을 통한 향상된 초기 분리, 요오딕사놀 그래디언트 초원심분리를 통한 정제된 순도 및 오염 물질 동시 정제의 감소에 기인할 수 있습니다12. 첫째, 초원심분리 전에 PEG/수성 2상 분할을 도입하면 세포 파편 및 기타 오염 물질에서 AAV 입자의 초기 분리가 크게 개선됩니다. 고분자량 중합체인 PEG는 수용액과 혼합될 때 두 개의 별개의 상을 생성한다13. AAV 벡터는 이러한 상 중 하나(일반적으로 PEG가 풍부한 상)로 우선적으로 분할되는 경향이 있는 반면, 많은 오염 물질과 불순물은 다른13개의 상으로 분할됩니다. 이러한 선택적 분할은 AAV 입자를 효과적으로 농축하고 초원심분리 전에도 불순물의 상당 부분을 제거하여 수율을 높이고 초원심분리 단계13으로 유입되는 오염 물질 부하를 줄입니다. 둘째, 요오딕사놀 그래디언트 초원심분리는 AAV 벡터의 순도를 더욱 정교하게 만듭니다. 비이온성 이소삼투압 그래디언트 매질인 요오딕사놀은 기존 CsCl 그래디언트에 비해 더 부드럽고 제어된 분리를 가능하게 합니다14. 이 그래디언트에서, AAV 입자는 그들의 부력 밀도(14)에 해당하는 그래디언트의 위치로 이동한다. 중요한 것은 이 과정이 벡터 품질의 중요한 결정 요인인 빈 캡시드(유전 물질 결핍)에서 전체 AAV 캡시드(유전자 페이로드 포함)를 분리하는 데 효과적이라는 것입니다. 요오딕사놀의 이소삼투압 특성은 또한 CsCl과 같은 고삼투압제보다 AAV 캡시드의 무결성을 더 잘 보존하여 잠재적으로 온전한 기능성 벡터의 수율을 높일 수 있다14. 마지막으로, 기존의 초원심분리 방법, 특히 CsCl 그래디언트를 사용하는 방법은 때때로 AAV 벡터와 유사한 부력 밀도를 가진 오염 물질을 공동 정제할 수 있습니다15. PEG 분할을 예비 단계로서 사용함으로써, 이러한 오염 물질의 부하가 초원심분리(13) 전에 크게 감소된다. 이러한 오염 물질 부하의 감소는 요오딕사놀 그래디언트가 AAV 벡터를 정제하는 데 보다 효과적이고 선택적으로 작용하여 더 높은 순도로 이어질 수 있음을 의미합니다15.
AAV 벡터의 순도와 품질은 은 염색 및 TEM11을 통해 엄격하게 평가됩니다. 순도가 90%를 초과하는 AAV 캡시드 단백질 VP1, VP2 및 VP3에 해당하는 3개의 주요 띠를 관찰한 것은 이러한 AAV 벡터가 in vivo 사용에 적합함을 나타냅니다. full-to-empty capsid 비율을 결정하기 위한 TEM 분석은 특히 중요한데, 빈 capsid의 비율이 높으면 유전자 전달 효율이 감소하고 잠재적인 면역 반응이 발생할 수 있기 때문입니다11. 이 품질 검사는 필수적이지만 절차상의 복잡성을 가중시키고 추가적인 기술 전문 지식이 필요할 수 있습니다.
결론적으로, 이 프로토콜은 AAV 벡터 생산, 특히 확장성 및 순도 측면에서 상당한 기술적 발전을 제공합니다. 그러나 정제 공정과 관련된 복잡성과 특수 장비 및 전문 지식에 대한 필요성은 특정 연구 환경에서 적용하는 데 여전히 사소한 제한 사항이 될 수 있습니다. 이러한 기술을 더욱 정교화하고 단순화하면 이 접근 방식을 유전자 치료 연구 분야에서 더 쉽게 접근할 수 있고 널리 적용할 수 있습니다.
공개
저자는 연구가 잠재적인 이해 상충으로 해석될 수 있는 상업적 또는 재정적 관계가 없는 상태에서 수행되었다고 선언합니다.
감사의 말
TZ가 실험을 설계했습니다. TZ, VD, SB 및 JP가 실험을 수행했습니다. TZ와 VD는 데이터를 생성하고 분석하였다. TZ와 YX가 원고를 썼다. TZ와 GG는 원고를 수정했다. 이 연구는 피츠버그 UPMC 아동병원의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 293T/17 cells | ATTC | CRL-11268 | |
| 0.5 M EDTA | MilliporeSigma | 324506-100ml | |
| 1 mL Henke-Ject syringe | Fisher Scientific | 14-817-211 | |
| 10% pluronic F68 solution | Fisher Scientific | 24-040-032 | |
| 10x Tris/Glycine/SDS Buffer | Biorad | 1610732 | |
| 1M HEPES | Fisher Scientific | 15-630-080 | |
| 2% Uranyl Acetate Solution | Electron Microscopy Sciences | 22400-2 | |
| 4%–20% Precast Protein Gels | biorad | 4561094 | |
| 40% PEG solution | Sigma | P1458-50ML | |
| AAV6 reference full capsids | Charles River Laboratories | RS-AAV6-FL | |
| Accutase Cell Detachment Solution | Fisher Scientific | A6964-100ML | |
| Benzonase | Sigma | E1014-25KU | |
| BioLite Cell Culture Treated Dishes 150 mm | Fisher Scientific | 12-556-003 | |
| Centrifugal Filter Unit | MilliporeSigma | UFC905024 | |
| Corning PES Syringe Filters | Fisher Scientific | 09-754-29 | |
| Dialysis Cassettes, 10 K MWCO | Fisher Scientific | PI66810 | |
| Disposable PES Filter Units 1 L 0.2 µm | Fisher Scientific | FB12566506 | |
| Disposable PES Filter Units 1 L 0.45 µm | Fisher Scientific | FB12566507 | |
| Disposable PES Filter Units 500 mL 0.2 µm | Fisher Scientific | FB12566504 | |
| DMEM high glucose | Fisher Scientific | 10-569-044 | |
| DMEM low glucose | Fisher Scientific | 10567022 | |
| DNase | NEB | M0303S | |
| DPBS 1x | Fisher Scientific | 14-190-250 | |
| Fetal Bovin Serum (FBS) | Biowest | S1620 | |
| Formvar/Carbon 300 Mesh, Cu | Electron Microscopy Sciences | FCF300-Cu-50 | |
| glycerol | Sigma | G5516-1L | |
| KCl | Sigma | P9541-500G | |
| LB agar | Sigma | L2897-250G | |
| LB broth | Fisher Scientific | BP9732-500 | |
| MgCL2·6H2O | Sigma | M9272-100G | |
| NEB stable competent cells | NEB | C3040H | |
| Nest Biofactory 10 chamber | MidSci | 771302 | |
| NucleoBond Xtra Maxi EF | Macherey-Nagel | 740424 | |
| Opti-MEM | Fisher Scientific | 31-985-088 | |
| OptiPrep Density Gradient Medium | Millipore Sigma | D1556-250ml | |
| pAAV-CMV-GFP | Addgene | 105530 | |
| pAAV-DJ | Cell BioLab | VPK-420-DJ | |
| pAAV-RC6 | Cell BioLab | VPK-426 | |
| pAdDeltaF6 | Addgene | 112867 | |
| PEG 8000 | Promega | V3011 | |
| PEI Max | Polysciences, Inc | 49553-93-7 | |
| Pen-Strep | Fisher Scientific | 15-140-163 | |
| Phenol red | Millipore Sigma | 1.07242.0100 | |
| Pierce Silver Stain Kit | Thermo Fisher Scientific | 24612 | |
| QuickSeal tube | Fisher Scientific | NC9144589 | |
| Sodium Chloride | Sigma | 1162245000 | |
| sodium deoxycholate | Millipore Sigma | D6750-100G | |
| Taqman Fast Advanced Master Mix | Thermo Fisher Scientific | 4444557 | |
| Type 70 Ti Fixed-Angle Titanium Rotor | Beckman Coulter | 337922 | |
| Western Blotting Substrate | ThermoFisher | 32209 |
참고문헌
- Arjomandnejad, M., Dasgupta, I., Flotte, T. R., Keeler, A. M. Immunogenicity of recombinant adeno-associated virus (AAV) vectors for gene transfer. BioDrugs. 37 (3), 311-329 (2023).
- Liu, Y., Siriwon, N., A Rohrs, J., Wang, P. Generation of targeted adeno-associated virus (AAV) vectors for human gene therapy. Curr Pharm Des. 21 (22), 3248-3256 (2015).
- Bilal, A. S., et al. Optimization of large-scale Adeno-Associated Virus (AAV) production. Curr Protoc. 3 (5), e757(2023).
- Rashnonejad, A., Chermahini, G. A., Li, S., Ozkinay, F., Gao, G. Large-scale production of adeno-associated viral vector serotype-9 carrying the human survival motor neuron gene. Mol Biotechnol. 58, 30-36 (2016).
- Challis, R. C., et al. Systemic AAV vectors for widespread and targeted gene delivery in rodents. Nat Protoc. 14 (2), 379-414 (2019).
- Challis, R. C., et al. Publisher Correction: Systemic AAV vectors for widespread and targeted gene delivery in rodents. Nat Protoc. 14 (8), 2597-2597 (2019).
- Mueller, C., Ratner, D., Zhong, L., Esteves-Sena, M., Gao, G. Production and discovery of novel recombinant adeno-associated viral vectors. Curr Protoc Microbiol. 26 (1), 14(2012).
- Guo, P., Wiersch, J., Xiao, X., Gittes, G. Simplified purification of AAV and delivery to the pancreas by intraductal administration. Methods Mol Biol. 1950, 373-387 (2019).
- Berns, K. I., Srivastava, A. Next generation of adeno-associated virus vectors for gene therapy for human liver diseases. Gastroenterol Clin North Am. 48 (2), 319-330 (2019).
- Khasa, H., Kilby, G., Chen, X., Wang, C. Analytical band centrifugation for the separation and quantification of empty and full AAV particles. Mol Ther Methods Clin Dev. 21, 585-591 (2021).
- Chen, H. Comparative observation of the recombinant adeno-associated virus 2 using transmission electron microscopy and atomic force microscopy. Microsc Microanal. 13 (5), 384-389 (2007).
- Burnham, B., et al. Analytical ultracentrifugation as an approach to characterize recombinant adeno-associated viral vectors. Hum Gene Ther Methods. 26 (6), 228-242 (2015).
- Kato, M., et al. In situ-formable, dynamic crosslinked poly (ethylene glycol) carrier for localized adeno-associated virus infection and reduced off-target effects. Commun Biol. 6 (1), 508(2023).
- Sena-Esteves, M., Gao, G. Enrichment of fully packaged virions in column-purified recombinant adeno-associated virus (rAAV) preparations by iodixanol gradient centrifugation followed by anion-exchange column chromatography. Cold Spring Harb Protoc. 2020 (2), 095638(2020).
- Matsumoto, M., Wangelin, J. R., Murphy, M. L. Purification of avian encephalomyelitis virus by ultracentrifugation in a nonlinear cesium chloride gradient. Avian Dis. 22 (3), 496-502 (1978).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유