Method Article
Cell Factory Platformを利用した高力価で高品質なアデノ随伴ウイルスベクターを生成するための合理化および標準化された手順
要約
遺伝子治療の分野が進化し続ける中、これらの課題に対処できる革新的な方法の必要性が高まっています。ここでは、細胞工場プラットフォームを使用して高収量で高純度のAAVベクターを生成するプロセスを効率化し、 in vivo 研究の品質基準を満たす独自の方法を紹介します。
要約
前臨床遺伝子治療研究、特にげっ歯類や大動物モデルでは、高収率で高純度のAAVベクターの作製が必要です。研究室での従来のアプローチでは、細胞培養皿を多用してHEK293T細胞を培養することが多く、このプロセスは面倒で問題となる可能性があります。ここでは、特定のセルファクトリ(またはセルスタック、CF10)プラットフォームでこのプロセスを簡素化する独自の社内方法を紹介します。ポリエチレングリコール/水性二相分配とヨージキサノールグラジエント超遠心分離の統合により、生成されたAAVベクターの収率と純度の両方が向上します。AAVベクターの純度はSDS-PAGEおよび銀染色によって検証され、満杯粒子と空粒子の比率は透過型電子顕微鏡(TEM)を使用して決定されます。このアプローチは、AAVベクターを高収率で生産するための効率的な細胞工場プラットフォームを提供するとともに、 in vivo 研究の品質要求を満たすための改良された精製方法を提供します。
概要
アデノ随伴ウイルス(AAV)ベクターは、遺伝子治療研究に不可欠なツールとなり、遺伝子導入の有効性と安全性を独自に組み合わせています1。実験室でAAVを生成する従来の方法は、遺伝子治療の理解と応用を進める上で極めて重要でした2。しかし、これらの方法は基礎的なものであるが、特に収率、時間効率、および生成されるベクターの品質、特に満杯粒子と空粒子の比率3の点で、一定の制限と課題を示す。
従来のAAV産生の手順は、主にHEK293細胞のトランスフェクションを伴います4。このプロセスは、通常、細胞培養皿で行われ、目的の遺伝子を含むプラスミドを細胞にトランスフェクションし、ヘルパープラスミドおよびAAVキャプシドプラスミド5,6とともにトランスフェクションする必要があります。トランスフェクション後、細胞はAAV粒子を産生し、それを回収して精製します5,6。精製プロセスには、高純度AAVベクターを得るための重要なステップである超遠心分離がしばしば含まれます7。超遠心分離、特に塩化セシウム(CsCl)またはヨージキサノールグラジエントを使用する方法は、AAV粒子を細胞の破片やその他の不純物から分離するための標準的な方法です8。このステップは、遺伝子導入におけるAAVベクターの有効性に直接影響するAAVベクターの所望の純度と濃度を達成するために重要です8。その広範な使用にもかかわらず、従来の超遠心分離には欠点があります。例えば、この方法によるAAVベクターの収量は変動し、しばしば低くなる可能性があるため、特にin vivo研究や大型動物モデル9の場合、大量の高力価ベクターが必要な場合に重大な課題が生じます。
AAVベクトル品質のもう一つの重要な側面は、満杯の粒子と空の粒子の比率である10。AAV製剤には、多くの場合、これらの粒子の混合物が含まれています。しかし、治療用遺伝物質を含むのは完全な粒子のみです。空粒子の割合が高いと、遺伝子送達の効率が著しく低下する可能性があります10。したがって、満杯の粒子と空の粒子の比率を評価して最適化することは、AAV ベクトルの有効性を評価するための重要なパラメーターです。従来の方法は、AAVベクトルを生成することができますが、この比率を一貫して制御するのが難しいことが多く、ベクトルの効力のばらつきにつながります10。
ここでは、細胞皿に労働集約的なHEK293T細胞培養を使用せずに、細胞工場プラットフォームを使用して高収量で高純度のAAVベクターを生成するプロセスを効率化し、ポリエチレングリコール/水性二相分配とiodixanol勾配超遠心分離を統合した独自の方法を紹介します。AAVベクターの純度はSDS-PAGEと銀染色によって確認され、透過型電子顕微鏡(TEM)を使用してフル粒子とエンプティ粒子の比率が決定され、 in vivo 研究の品質基準を満たしています11。
プロトコル
本試験で使用した試薬、プラスミド、および機器の詳細は、 材料表に記載されています。使用されるバッファーの構成は、 補足ファイル 1 に記載されています。
1. プラスミドの調製
- プラスミド(pAAV-GOI、pHelper、pAAV-Cap)を 大腸菌で形質転換します。
注:プラスミド増幅には、任意の 大腸菌 株を使用することができます。一部のプラスミドでは、NEB stableなどの特殊なコンピテントセルがプラスミドの収量を向上させることができます。このプロトコルで使用される3つのプラスミドは、pAAV-GOI:pAAV-CMV-GFP、pHelper:pAdDeltaF6、およびpAAV-Cap:pAAV-RC6です。 - 適切な選択的抗生物質を含むLB培地で、37°Cで16〜18時間、最適な量で細菌を増殖させます。
注:NEB安定細胞を使用する場合は、30°Cで18〜20時間培養してください。 - 大腸菌を遠心分離してプラスミドDNAを回収します。培地を4000 x g、4°C、15分間保存します。
- 遠心分離ボトルから上清液を廃棄物容器に慎重に注ぎ、大規模なエンドトキシンフリープラスミド精製キットでペレットからプラスミドDNAを精製します。
注意: 水しぶきを避けてゆっくりと注ぐようにしてください。 - 分光光度計を使用してDNA濃度と純度を測定します。
注:OD260/OD280 比をチェックして、DNAの純度を確認してください。純粋なDNAの比率は約1.8です。DNA濃度は、後のコトランスフェクションステップで1 μg/μL以上である必要があります。クライオバイアル中の500 μLの50%グリセロールに500 μLの一晩培養液を加えてバクテリアのグリセリンストックを作製し、-80 °Cで保存します。
2. HEK293T細胞の準備
- 10%FBSを含むDMEM高グルコース培地でHEK293T細胞を10層細胞工場(CF10)に播種し、細胞をインキュベーターで一晩成長させます。
注:293Tセルの継代は、堅牢なAAV生産に最適な条件を得るためには、10未満である必要があります。可能であれば、この時点では培地に抗生物質を追加しないでください。CF10は、150 mmの細胞培養皿の約42倍の増殖表面積を持っています。150 mmの細胞培養皿に同じ細胞密度を播種して、顕微鏡で細胞の成長を確認できるようにします。1075 mLの細胞懸濁液を調製し、25 mLの細胞懸濁液を150 mmのディッシュに加え、残りをCF10に加えます。 - トランスフェクションの翌日に細胞の密度を確認してください。
注:細胞は、顕微鏡で観察することにより、トランスフェクション時に80%〜90%のコンフルエントに達するはずです。
3. AAVプラスミドのトリプルトランスフェクション
- CF10あたり2.5〜5 mgの総DNAで1.2:1:1のモル比を持つために必要な各プラスミド(pAAV-GOI、pHelper、pAAV-血清型)の量を計算します。
注:3つのプラスミドのモル比は、最適なトランスフェクション効果を得るために変動する可能性があります。このCF10の設定に移行する前に、小規模な設定でテストすることをお勧めします。例として、pAAV-CMV-GFP、pAdDeltaF6、およびpAAV-RC6を使用してAAV6-CMV-GFPウイルスを作成します。PEI 計算機の式を 表 1 に示します。 - 350 mLのOptiMEMを滅菌済みの500 mLボトルに分注します。
- Opti-MEMの入ったボトルに3つのプラスミドDNAをすべて加えます。よく混ぜます。
- 1 mg/mL ポリエチレンイミン(PEI)溶液 15 mL (1:3 μg の DNA と μg の PEI 比) を加えます。OptiMEM/DNA/PEI混合物を上下に激しく30秒間振とうします。
注:泡を作っても大丈夫です。 - 混合物を室温で10〜15分間インキュベートします。
注:インキュベーションが長くなると、トランスフェクション効率が低下する可能性があります。 - OptiMEM/DNA/PEI溶液を、10 mM HEPESおよび2% FBSを含む700 mLのDMEM低グルコースを含む1 Lボトルに加えます。よく混ぜます。
注:この研究では、DMEM中の低グルコースは、同時トランスフェクション後のAAVベクター産生が良好であることを示しました。HEPESの添加は、細胞をより良い状態に保つのに役立ちます。ボトルをゆっくりと回転させて混ぜます。バブルをたくさん作らないようにしましょう。 - CF10をインキュベーターから取り出し、メディアを真空にして廃棄物容器に入れます。
注意: CF10をフードの内側の表面に置き、片側を徐々に上に持ち上げ、セルを取り外しずにゆっくりとメディアを真空にします。 - トランスフェクタント混合物をCF10に慎重に加えます。10 層すべてがメディアで覆われていることを確認します。
注:25 mLのトランスフェクタント混合物を150 mmの皿に加えます。収穫まで毎日細胞を監視します。残りのトランスフェクタント混合物をゆっくりと注いでCF10に加えます。CF10を慎重に回転させ、各レイヤーの体積が等しくなるようにします。 - CF10をインキュベーターに72〜96時間戻します。
注意: 150 mmモニターディッシュをチェックして、AAVベクターをいつ収穫するかを決定します。AAVの全負荷で細胞が非常に簡単に剥離するようになったら、収穫の時期です。
4. AAVベクターの採取
- トランスフェクションの3〜4日後に、CF10を激しく振ってウイルスを採取します。培地を250 mLのコニカルチューブに注ぎ、ウイルスを4000 x g で4°Cで20分間スピンダウンします。
注:このプロトコルで使用されるAAV6血清型の場合、80%のAAVはペレット内の細胞物質にほとんど結合したままになります。そして、20%のAAVはメディアに隠されました。これらの割合は、他のAAV血清型では異なる場合があります。 - 0.45 μmのフィルターユニットで上清を清澄化し、沈殿用に保存します。
- CF10を500 mLのDPBS 1xバッファーですすぎ、4000 x gで4000 x g 、4°Cで20分間遠心分離します。
- 真空システムと吸引ピペットを使用して上清を捨てます。精製するまで、CF10あたり20 mLのAAV溶解バッファーを-80°Cで加えます。
注:AAVライセートを50 mLコニカルチューブに移し、後でAAVを抽出します。 - ろ過した上清を取り出し、40% PEG-2.5 M NaCl溶液を添加して最終濃度8% PEGにし、軌道回転子の冷蔵室で少なくとも3時間または一晩インキュベートします。
注:100 mLの上清には、25 mLの40%PEG-2.5 M NaCl溶液を加えます。 - 4000 x g で4°Cで30分間遠心分離することにより、ウイルスを沈殿させます。
注:遠心分離のために混合物を250mLコニカルチューブに移します。 - 吸引して上清を除去し、5〜10 mLのAAV HEPES再懸濁緩衝液を加えてペレットを懸濁します。50 mLのコニカルチューブに移して下流の精製を続けるか、-80°Cで保存します。
5. AAV抽出
- ウイルスペレットを37°Cの水浴でシェーカーで10〜15分間解凍します。
注:AAVライセートをボルテックスして完全に溶融します。 - -80°Cの100%エタノール浴で20〜30分間凍結します。
注:あるいは、凍結サイクルは、ドライアイスに囲まれた冷たい100%エタノールビーカーで行うことができます。 - 凍結/解凍を3〜4回行い、必要に応じてその間に渦巻きます。
注意: このサイクルは、フリーズステップで一時停止できます。AAVライセートは、下流の作業まで-80°Cで保存します。 - AAVライセート(ステップ5.3から)と再懸濁AAV(ステップ4.7から)を37°Cの水浴でシェーカーを使用して10〜15分間解凍し、ボルテックスします。
注意: 完全に溶けて混ぜることを確認してください。 - ベンゾナーゼヌクレアーゼ(250ユニット/μL)をAAVライセートに添加し、AAVを再懸濁して最終濃度を50ユニット/mLにします。解決策をボルテックスします。
- 37°Cの水浴で30分間振とうしながらインキュベートします。
注:10%デオキシコール酸ナトリウムアリコートを水浴で取り出して、溶解し、ウォームアップし、完全に混合する時間を確保します。 - 10%デオキシコール酸ナトリウムを添加して最終濃度を0.5%にし、シェーカーをつけた状態で37°Cで30分間インキュベートします。
注:デオキシコール酸ナトリウムは、細胞からのAAV放出を促進するために使用されました。 - 生AAV溶液を2 mLの遠心チューブに分配し、14,000 x g で4°Cで10分間遠心分離します。
- 上清を50mLの円錐管に移します。
注:1mLピペットを使用して上清を移します。ペレットを捨てます。 - 同量のクロロホルムを添加し、1〜2分間ボルテックスしてAAVを抽出します。
注:溶液は不透明で、白く、ミルクのようになるはずです。 - 乳液を2mLの遠心チューブに移し、均等に分配します。14,000 x g で4°Cで10分間遠心分離します。
- 上部のピンクの層を慎重にピペットで取り出し、新しい50mLのコニカルチューブに移します。
注:クロロホルム/タンパク質層を乱さないでください。 - ピペットを使用して最終容量を測定します。生のAAV-PEG-硫酸塩ボリュームチャート(表2)に従って、50%(NH4)2SO4 と40%PEG溶液の適切な量を混合します。2分間渦巻きます。
- 混合物を2 mLの遠心分離チューブに移し、均等に分配します。14,000 x g で 4 °C で 10 分間遠心分離します
- 22 Gの針と3 mLのシリンジを使用して最下層を回収します。AAVを50 mLのコニカルチューブに集め、4°Cで保存して、後でヨージキサノールグラジエント超遠心分離を行います。
6. ヨージキサノールグラジエント超遠心分離法によるAAV精製
- AAVをロードする前に、使用する超遠心チューブの数に応じて、iodixanolグラジエントを新たに調製してください(表3)。
注:フェノールレッドは、層を観察するために使用されました。 - 16 Gのパントロングニードルを取り付けた10 mLシリンジを使用して、各溶液をラウンドトップポリプロピレン超遠心分離機クイックシールチューブにゆっくりと重ねます。泡を避けてください。
- 22 Gシリンジでグラジエントの上に最大17 mLのAAV溶液を慎重に追加します。AAV透析バッファーを使用してチューブを補充します。
注:超遠心チューブの壁に液滴を装填して、AAV溶液を追加します。グラデーションレイヤーを邪魔しないでください。 - 超遠心チューブを電気シーラーで密封します。
注:チューブを超遠心分離機に送る前に、チューブのバランスを±0.2 g差で調整してください。 - Ti70ローターで350,000 x g で2時間、4°Cで遠心分離します。
- チューブをローターから慎重に取り外し、超遠心チューブラックに入れます。
注意: グラデーションが乱されていないことを確認してください。 - 以下の手順に従ってAAVフラクションを収集します。
- スタンドホルダーでチューブを安定させます。
- 10mLシリンジに取り付けた19Gの針で、40%〜60%の界面のわずかに下にある超遠心チューブに穴を開けます。
注意: 針の開口部は、40%の勾配に面して上向きにする必要があります。 - チューブの上部に16Gの針で穴を開けます。
- チューブあたり最大5mLを収集します。25%〜40%の界面でのタンパク質汚染の収集を避けてください。
- 各超遠心チューブについて繰り返します。
注:AAVフラクションを50mLコニカルチューブに移します。
7. 第2ラウンドのiodixanolのグラジエントのultracentrifugationの
注: この手順はオプションです。このステップは、空のAAV比を減らして、より高品質のフルAAVキャプシドを実現することです。
- AAVをAAV透析バッファーで>1:1に希釈します。
注:最初の超遠心分離ラウンドから収集されたAAVは、40%のヨージキサノール層にありました。30%のヨージキサノール層の上に装填できるように、少なくとも50%希釈する必要があります。 - 16 Gのパント針を使用して各溶液(表4)を超遠心チューブに重ね、10 mLシリンジをゆっくりと取り付けます。泡を避けてください。
- 20 mLの希釈AAV溶液をグラジエントの上に22 Gシリンジで慎重に加えます。AAV透析バッファーを使用してチューブを補充します。
- 手順 6.4 から 6.7 を繰り返します。
8. AAV透析と濃縮
- 新しい18G針と10mLシリンジを使用して、AAVウイルスを透析カセットに移します。ウイルスをゆっくりとカセットに注入し、カセットから空気を取り除きます。
- AAV透析バッファーの入ったビーカーに攪拌子を加え、攪拌板の上に置きます。
- 透析カセットをフロートブイで透析バッファーに入れます。4°Cで攪拌します。 AAV透析バッファーの2〜3倍に変更します。
注意: カセットが浮いてバッファ交換を実行するのに十分なバッファを使用してください。ビーカーをアルミホイルで覆います。 - 18Gの針を取り付けた10mLのシリンジを使用して、カセットからウイルスを遠心フィルターユニットに集めます。
- 4,000 x g で4°Cで15〜30分間遠心分離します。
注:AAVをAAV透析バッファーで2〜3回すすぎます。AAVを~200μLの残りがフィルターの上部に来るまで濃縮します。 - 濃縮されたAAVをフィルターユニットから収集します。フィルターをさらに300μLのAAV透析バッファーですすぎ、濃縮AAVに移します。
- 1 mL のツベルクリン ルアー スリップ シリンジを使用して、0.22 μm シリンジ フィルターでウイルスをろ過します。体積損失を最小限に抑えるには、10 mLシリンジを使用してフィルターに空気を2〜3回押し込みます。
- 精製したAAVウイルスを4°Cで一時的に保存し、滴定します。
注:ウイルスを滴定し、分注し、1週間以内に-80°Cで保存してください。
9. AAVウイルス滴定
注:TaqMan 定量的ポリメラーゼ連鎖反応(qPCR)を使用して、精製された AAV を滴定しました。
- AAVベクターをDNase Iで処理し、37°Cで30分間インキュベートした後、95°Cで10分間インキュベートします。
注:10 μLの反応例として、2 μL AAVウイルスサンプル、1 μL DNase、1 μL DNaseバッファー、および6 μL H2Oを使用します。PCRチューブを備えたサーモサイクラーで行うことができます。 - AAVインサート領域をターゲットとするプライマーセットを調製します。
注:ターゲットは、AAVコンストラクトのプロモーター、導入遺伝子、およびレポーターであり得る。プライマーを 表5に示します。 - DNAプラスミド標準試料(10、1、0.1、0.01、0.001、0.0001 pg/μL)とネガティブコントロール(H2O)を調製します。
- プライマーを含むqPCRマスターミックスを、製造元の指示に従って調製します。
- 標準試料とサンプルをPCRプレート上に三重に置きます。qPCRミックスを標準試料およびサンプルに加えます。プレートを密封し、製造元の指示に従ってqPCR反応を行います。
注:反応条件は、材料/試薬および装置によって異なります。高速で従来のPCRサイクルが適用できます。 - AAVウイルス力価を計算します。
注:このプロトコルのサンプル濃度は、元のサンプルから1/10希釈されています。 - AAVウイルスを1.5mLチューブに分注し、4°Cで最大1ヶ月間保存し、-80°Cで長期保存します。
注意: ストレージの凍結/解凍サイクルは避けてください。 in vivo 実験に使用する場合は、2回以上の解凍液を使用しないでください。
10. AAVの品質管理
注:AAVウイルスは、SDS-PAGEゲルを用いたSDS-PAGE銀染色による純度評価と、市販の染色キットを用いた染色を行いました。
- Laemmli バッファーで AAV ウイルス サンプルの 3 x 109 vg を変性させます。
注:対照として参照AAVウイルスを使用します。AAV6-CMV-GFPリファレンスフルキャプシドが使用されます。 - 変性させたAAVを4%〜20%のグラジエントSDS-PAGEゲルにロードし、180Vで50分間泳動します。
- 電気泳動プレートからゲルを取り出します。製造元の指示に従って、銀染色キットでゲルを染色します。
- AAVキャプシドタンパク質VP1、VP2、およびVP3を確認します。
注:純粋なAAVウイルスには、VP1、VP2、およびVP3キャプシドタンパク質のみが含まれています。純粋でない場合、他のタンパク質バンドがゲル上に見えます。
注:ネガティブ染色された組換えAAVビリオンの透過型電子顕微鏡(TEM)は、形態学的完全性およびフル/エンプティ比を評価するために行われた。 - ピンセットでEMグリッドを手に取り、グリッドの光沢のある面を上に向けてベンチに置きます。
- 5 μLのAAVサンプルをグリッドにピペットで移し、蒸発させて乾燥させます。
注意: 必要に応じてAAVを希釈します。1012 vg/mL は平均力価です。グリッドを乾燥させるのに30〜60分かかる場合があります。 - ピペッティングでグリッドを洗浄し、約200 μLのH2Oをグリッド上に一滴ずつ入れます。
- グリッドの隣にクロマトグラフィーペーパーを垂直にゆっくりと置いて、余分な水分を取り除きます。
- 5 μLの2%酢酸ウラニル溶液をグリッドにピペットで移します。5分間インキュベートし、上記のように吸い取ります。グリッドを乾かします。
- 透過型電子顕微鏡(50,000倍倍)でAAV粒子を可視化します。ウイルスゲノムを持つウイルスキャプシドは均質な白い六角形として表示され、空のカプシドは白い縁を持つが中心が暗い六角形として表示されます。
- 少なくとも 100 個の粒子をランダムに数えて、完全な 粒子と完全な粒子のおおよそのパーセンテージを決定します。空の AAV パーティクル。
結果
この詳細なステップバイステップのプロトコルでは、標準化されたプラットフォームを使用して、大規模な研究室環境でCF10を使用して高力価で高品質のAAVウイルスを作製できることが実証されています。従来の細胞培養ディッシュと比較して、CF10は大量の細胞を培養し、AAVウイルスを産生する便利な方法を提供します(図1)。最適な環境にある細胞がウイルス産生を促進できるかどうかを判断するために、いくつかの培養条件を試験しました。10 mM HEPESと2% FBSを補充した低グルコースDMEMは、最高のAAV産生を示しました。
AAVを精製するために、いくつかのプロトコルが試験されました。ほとんどの手順では、ウイルス収量が低く、AAVカプシドの不純物が見られます。ここでは、細胞ペレットと培地の両方からのAAVを組み合わせた改訂された精製プロトコルが開発されました(図2)。その結果、AAVの80%が細胞内にあり、さらに20%のAAVが細胞から分泌される培地中に存在していることが分かりました。AAVの両方の部分をDNaseで処理して、遊離DNAを除去しました。デオキシコール酸ナトリウムを使用して、細胞からAAVをさらに放出しました。次に、クロロホルム抽出と続いて水性二相分配法でAAVを抽出しました。これらの手順により、ほとんどのタンパク質汚染物質を除去することができました。AAVは硫酸アンモニウム相に可溶性です。
残りの汚染物質は、不連続なヨージキサノールグラジエント超遠心分離法で除去しました(図3A)。グラジエントは、特に2回目のiodixanol gradient超遠心分離で、空のAAVカプシドの除去にも役立ちました。
AAVウイルスの純度は、銀染色によって決定されました。AAVキャプシドタンパク質に対応する3つの主要なバンド、VP1、VP2、およびVP3が90%を超える純度で得られた場合、AAVウイルスは in vivo での使用に適していました(図3B)。AAVのフルキャプシドと空のキャプシドの比率は、TEMによってアクセスされました(図3C)。導入遺伝子を挿入したフルキャプシドのみが、標的組織での導入遺伝子の発現を可能にします。空のカプシドの大部分も、AAVカプシドに対する免疫応答を誘導する可能性があります。これらの品質チェックは、使用前に製造および精製される各AAVウイルスに必要です。
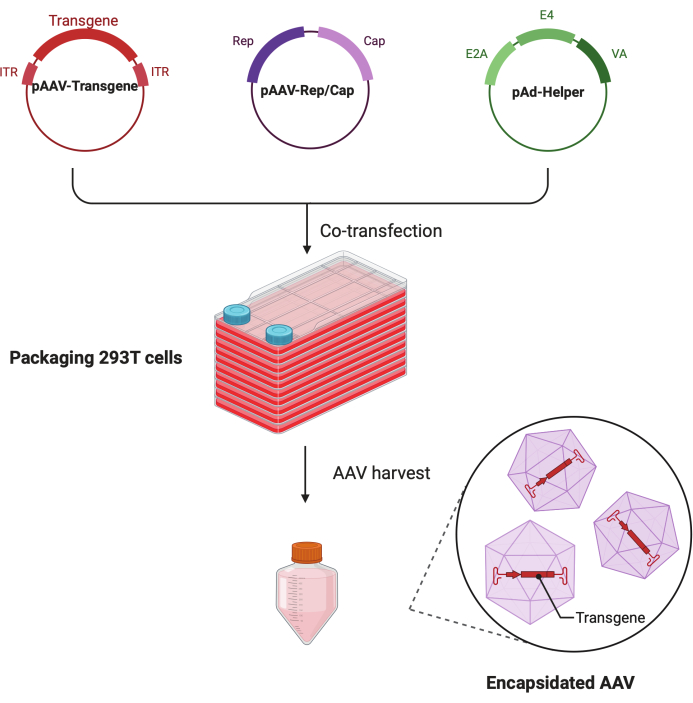
図1:HEK293T細胞トリプルトランスフェクション法によるAAV産生の概略図。この図の拡大版を見るには、ここをクリックしてください。
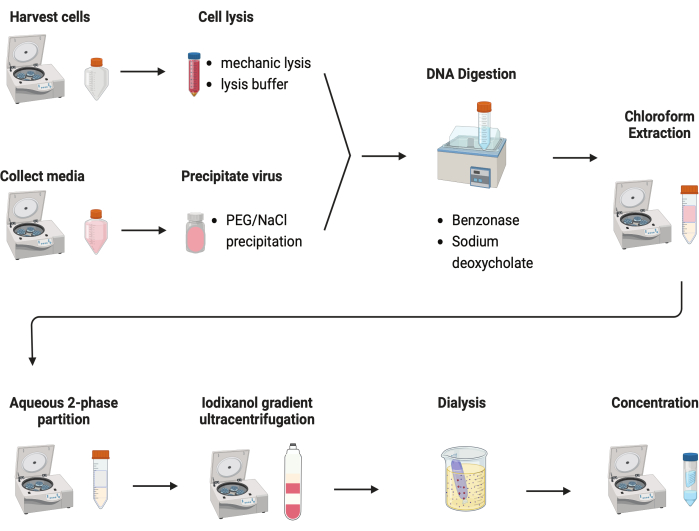
図2:AAV精製の概略図。この図の拡大版を表示するには、ここをクリックしてください。
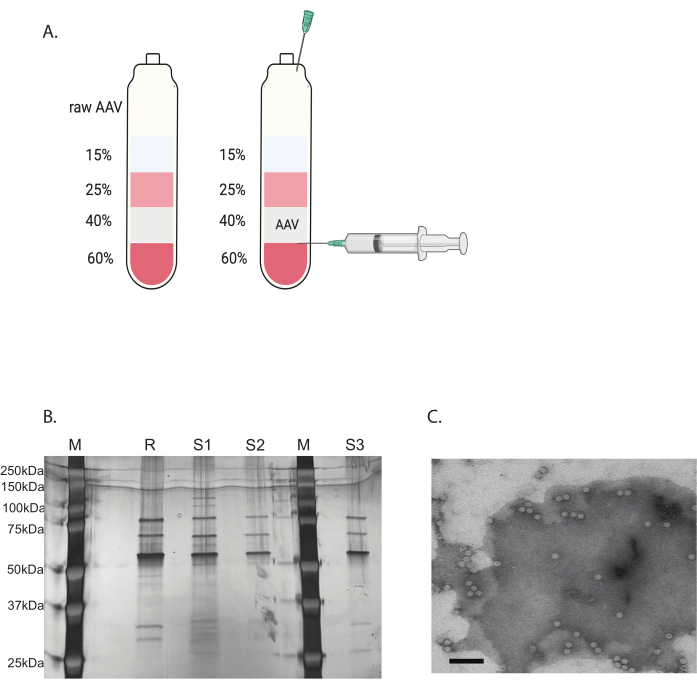
図3:ヨージキサノールグラジエント超遠心分離法によるAAV精製とAAVウイルス純度検証(A)ヨウジキサノールグラジエント層と採取用針の位置。(B)カプシド含有量と純度を評価する代表的なゲル。M:分子マーカー;R:参照AAV6フルキャプシド;S1:自社製AAVDJキャプシドと1ラウンドの超遠心分離。S2:自社製AAVDJキャプシドと2ラウンドの超遠心分離。S3:自社製AAV6キャプシド。(C)AAVの電子顕微鏡画像。精製後に収集されたウイルス。ウイルスゲノムを含むウイルスカプシドは均質な白い六角形として表示され、空のカプシドは白い縁を持つが中心が暗い六角形として表示されます。スケールバー:100nm。この図の拡大版を表示するには、ここをクリックしてください。
表1:AAVパッケージ用のPEI計算機。この表をダウンロードするには、ここをクリックしてください。
表2:生のAAV-PEG-硫酸塩ボリュームチャート。この表をダウンロードするには、ここをクリックしてください。
表3:ヨージキサノールグラジエントの調製。この表をダウンロードするには、ここをクリックしてください。
表4:第2ラウンドのヨージキサノールグラジエントの調製。この表をダウンロードするには、ここをクリックしてください。
表5:AAV滴定プライマー。この表をダウンロードするには、ここをクリックしてください。
補足ファイル1:研究に使用したバッファーの組成。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここでは、細胞工場プラットフォーム(CF10)を使用して高力価で高品質なAAVベクターを大規模に生産するための技術的に高度なプロトコールを紹介します。これは、従来の細胞培養ディッシュ法に比べて大幅に改善されています。細胞工場の使用は、大量の細胞を培養するプロセスを簡素化し、AAVウイルスの産生をより効率的に促進します1。また、培養条件を最適化することにより、特に低グルコースDMEMに10 mM HEPESと2% FBSを添加すると、ウイルス産生が有意に増加することが確認され、ウイルス収量における細胞環境の重要な役割が示されました。
改訂された精製プロトコルは、細胞ペレットと培養培地の両方からのAAVを組み合わせたもので、多くの既存のプロトコルに見られる低ウイルス収量と不純物という共通の問題に対処しています。クロロホルム抽出と水性二相分配のステップにより、ほとんどのタンパク質汚染物質が効果的に除去され、AAVは硫酸アンモニウム相に可溶性のままです。従来のグラジエント超遠心分離法とは対照的に、PEG/水性二相分配とヨージキサノール勾配超遠心分離を組み合わせたAAVベクターの収量と純度の両方の向上は、PEG/水性二相分配による初期分離の強化、ヨージキサノール勾配超遠心分離による精製純度、および汚染物質の共精製の減少に起因する可能性があります12.まず、超遠心分離の前にPEG/水性二相分配を導入することで、細胞の破片やその他の汚染物質からのAAV粒子の初期分離が大幅に改善されます。高分子量ポリマーであるPEGは、水溶液と混合すると、2つの異なる相13を生成する。AAV ベクターは、これらの相の 1 つ (通常は PEG リッチ相) に優先的に分配する傾向がありますが、多くの汚染物質や不純物は他の13 に分配されます。この選択的分配により、AAV粒子が効果的に濃縮され、超遠心分離前であってもかなりの部分の不純物が除去されるため、収率が向上し、超遠心分離ステップ13に入る汚染物質負荷が減少します。次に、ヨージキサノールグラジエント超遠心分離により、AAVベクターの純度がさらに向上します。ヨウオジキサノールは、非イオン性の等浸透圧グラジエント培地であり、従来のCsClグラジエントと比較して、より穏やかで制御された分離を可能にします14。この勾配では、AAV粒子は、その浮力密度14に対応する勾配内の位置に移動する。重要なことに、このプロセスは、ベクターの品質の重要な決定要因である空のカプシド(遺伝物質を含まない)から完全なAAVカプシド(遺伝的ペイロードを含む)を分離するのに効果的です。また、ヨウジキサノールの等浸透圧性は、CsClのような高浸透圧剤よりもAAVカプシドの完全性をよりよく保持し、無傷の機能的なベクターのより高い収率につながる可能性があります14。最後に、従来の超遠心分離法、特にCsClグラジエントを使用する方法では、AAVベクター15と同様の浮力密度を持つ汚染物質を共精製できる場合があります。予備ステップとしてPEG分配を使用することにより、超遠心分離13の前に、そのような汚染物質の負荷が大幅に減少する。この汚染物質負荷の減少は、イオジキサノールグラジエントがAAVベクターの精製においてより効果的かつ選択的に機能できることを意味し、より高い純度15につながります。
AAVベクターの純度と品質は、銀染色とTEM11によって厳密に評価されます。AAVキャプシドタンパク質VP1、VP2、VP3に対応する3つの主要なバンドが90%を超える純度で観察されたことは、これらのAAVベクターの in vivo 使用への適合性を示しています。空キャプシドの割合が高いと、遺伝子送達効率が低下し、免疫応答が可能になる可能性があるため、フルキャプシドとエンプティキャプシドの比率を決定するためのTEM分析は特に重要です11。この品質チェックは不可欠ですが、手続きの複雑さを増し、追加の技術的専門知識が必要になる場合があります。
結論として、このプロトコルは、AAVベクターの製造において、特にスケーラビリティと純度の点で、大幅な技術的進歩を提供します。しかし、精製プロセスに関連する複雑さや、特殊な機器や専門知識の必要性は、特定の研究環境での応用には依然として小さな制限となる場合があります。これらの技術をさらに洗練し、簡素化することで、このアプローチを遺伝子治療研究の分野においてよりアクセスしやすく、広く適用できるようになる可能性があります。
開示事項
著者らは、この研究は、潜在的な利益相反と解釈される可能性のある商業的または金銭的関係がない状態で実施されたと宣言します。
謝辞
TZが実験を設計しました。TZ、VD、SB、およびJPが実験を行いました。TZとVDがデータを生成し、データを分析しました。TZとYXが原稿を書きました。TZとGGが原稿を改訂しました。この活動は、ピッツバーグのUPMC小児病院の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 293T/17 cells | ATTC | CRL-11268 | |
| 0.5 M EDTA | MilliporeSigma | 324506-100ml | |
| 1 mL Henke-Ject syringe | Fisher Scientific | 14-817-211 | |
| 10% pluronic F68 solution | Fisher Scientific | 24-040-032 | |
| 10x Tris/Glycine/SDS Buffer | Biorad | 1610732 | |
| 1M HEPES | Fisher Scientific | 15-630-080 | |
| 2% Uranyl Acetate Solution | Electron Microscopy Sciences | 22400-2 | |
| 4%–20% Precast Protein Gels | biorad | 4561094 | |
| 40% PEG solution | Sigma | P1458-50ML | |
| AAV6 reference full capsids | Charles River Laboratories | RS-AAV6-FL | |
| Accutase Cell Detachment Solution | Fisher Scientific | A6964-100ML | |
| Benzonase | Sigma | E1014-25KU | |
| BioLite Cell Culture Treated Dishes 150 mm | Fisher Scientific | 12-556-003 | |
| Centrifugal Filter Unit | MilliporeSigma | UFC905024 | |
| Corning PES Syringe Filters | Fisher Scientific | 09-754-29 | |
| Dialysis Cassettes, 10 K MWCO | Fisher Scientific | PI66810 | |
| Disposable PES Filter Units 1 L 0.2 µm | Fisher Scientific | FB12566506 | |
| Disposable PES Filter Units 1 L 0.45 µm | Fisher Scientific | FB12566507 | |
| Disposable PES Filter Units 500 mL 0.2 µm | Fisher Scientific | FB12566504 | |
| DMEM high glucose | Fisher Scientific | 10-569-044 | |
| DMEM low glucose | Fisher Scientific | 10567022 | |
| DNase | NEB | M0303S | |
| DPBS 1x | Fisher Scientific | 14-190-250 | |
| Fetal Bovin Serum (FBS) | Biowest | S1620 | |
| Formvar/Carbon 300 Mesh, Cu | Electron Microscopy Sciences | FCF300-Cu-50 | |
| glycerol | Sigma | G5516-1L | |
| KCl | Sigma | P9541-500G | |
| LB agar | Sigma | L2897-250G | |
| LB broth | Fisher Scientific | BP9732-500 | |
| MgCL2·6H2O | Sigma | M9272-100G | |
| NEB stable competent cells | NEB | C3040H | |
| Nest Biofactory 10 chamber | MidSci | 771302 | |
| NucleoBond Xtra Maxi EF | Macherey-Nagel | 740424 | |
| Opti-MEM | Fisher Scientific | 31-985-088 | |
| OptiPrep Density Gradient Medium | Millipore Sigma | D1556-250ml | |
| pAAV-CMV-GFP | Addgene | 105530 | |
| pAAV-DJ | Cell BioLab | VPK-420-DJ | |
| pAAV-RC6 | Cell BioLab | VPK-426 | |
| pAdDeltaF6 | Addgene | 112867 | |
| PEG 8000 | Promega | V3011 | |
| PEI Max | Polysciences, Inc | 49553-93-7 | |
| Pen-Strep | Fisher Scientific | 15-140-163 | |
| Phenol red | Millipore Sigma | 1.07242.0100 | |
| Pierce Silver Stain Kit | Thermo Fisher Scientific | 24612 | |
| QuickSeal tube | Fisher Scientific | NC9144589 | |
| Sodium Chloride | Sigma | 1162245000 | |
| sodium deoxycholate | Millipore Sigma | D6750-100G | |
| Taqman Fast Advanced Master Mix | Thermo Fisher Scientific | 4444557 | |
| Type 70 Ti Fixed-Angle Titanium Rotor | Beckman Coulter | 337922 | |
| Western Blotting Substrate | ThermoFisher | 32209 |
参考文献
- Arjomandnejad, M., Dasgupta, I., Flotte, T. R., Keeler, A. M. Immunogenicity of recombinant adeno-associated virus (AAV) vectors for gene transfer. BioDrugs. 37 (3), 311-329 (2023).
- Liu, Y., Siriwon, N., A Rohrs, J., Wang, P. Generation of targeted adeno-associated virus (AAV) vectors for human gene therapy. Curr Pharm Des. 21 (22), 3248-3256 (2015).
- Bilal, A. S., et al. Optimization of large-scale Adeno-Associated Virus (AAV) production. Curr Protoc. 3 (5), e757(2023).
- Rashnonejad, A., Chermahini, G. A., Li, S., Ozkinay, F., Gao, G. Large-scale production of adeno-associated viral vector serotype-9 carrying the human survival motor neuron gene. Mol Biotechnol. 58, 30-36 (2016).
- Challis, R. C., et al. Systemic AAV vectors for widespread and targeted gene delivery in rodents. Nat Protoc. 14 (2), 379-414 (2019).
- Challis, R. C., et al. Publisher Correction: Systemic AAV vectors for widespread and targeted gene delivery in rodents. Nat Protoc. 14 (8), 2597-2597 (2019).
- Mueller, C., Ratner, D., Zhong, L., Esteves-Sena, M., Gao, G. Production and discovery of novel recombinant adeno-associated viral vectors. Curr Protoc Microbiol. 26 (1), 14(2012).
- Guo, P., Wiersch, J., Xiao, X., Gittes, G. Simplified purification of AAV and delivery to the pancreas by intraductal administration. Methods Mol Biol. 1950, 373-387 (2019).
- Berns, K. I., Srivastava, A. Next generation of adeno-associated virus vectors for gene therapy for human liver diseases. Gastroenterol Clin North Am. 48 (2), 319-330 (2019).
- Khasa, H., Kilby, G., Chen, X., Wang, C. Analytical band centrifugation for the separation and quantification of empty and full AAV particles. Mol Ther Methods Clin Dev. 21, 585-591 (2021).
- Chen, H. Comparative observation of the recombinant adeno-associated virus 2 using transmission electron microscopy and atomic force microscopy. Microsc Microanal. 13 (5), 384-389 (2007).
- Burnham, B., et al. Analytical ultracentrifugation as an approach to characterize recombinant adeno-associated viral vectors. Hum Gene Ther Methods. 26 (6), 228-242 (2015).
- Kato, M., et al. In situ-formable, dynamic crosslinked poly (ethylene glycol) carrier for localized adeno-associated virus infection and reduced off-target effects. Commun Biol. 6 (1), 508(2023).
- Sena-Esteves, M., Gao, G. Enrichment of fully packaged virions in column-purified recombinant adeno-associated virus (rAAV) preparations by iodixanol gradient centrifugation followed by anion-exchange column chromatography. Cold Spring Harb Protoc. 2020 (2), 095638(2020).
- Matsumoto, M., Wangelin, J. R., Murphy, M. L. Purification of avian encephalomyelitis virus by ultracentrifugation in a nonlinear cesium chloride gradient. Avian Dis. 22 (3), 496-502 (1978).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved