Method Article
Una procedura semplificata e standardizzata per la generazione di vettori virali adeno-associati ad alto titolo e di alta qualità utilizzando una piattaforma di fabbrica cellulare
In questo articolo
Riepilogo
Con la continua evoluzione del campo della terapia genica, c'è una crescente necessità di metodi innovativi in grado di affrontare queste sfide. Qui viene presentato un metodo unico, che semplifica il processo di generazione di vettori AAV ad alto rendimento e ad alta purezza utilizzando una piattaforma di fabbrica cellulare, soddisfacendo gli standard di qualità per gli studi in vivo .
Abstract
La ricerca preclinica sulla terapia genica, in particolare nei roditori e nei modelli animali di grandi dimensioni, richiede la produzione di vettori AAV con elevata resa e purezza. Gli approcci tradizionali nei laboratori di ricerca spesso comportano l'uso estensivo di piastre di coltura cellulare per coltivare HEK293T cellule, un processo che può essere sia laborioso che problematico. Qui viene presentato un metodo interno unico, che semplifica questo processo con una specifica piattaforma di fabbrica di celle (o stack di celle, CF10). Un'integrazione di polietilenglicole/partizione acquosa a due fasi con ultracentrifugazione a gradiente di iodixanolo migliora sia la resa che la purezza dei vettori AAV generati. La purezza dei vettori AAV viene verificata mediante SDS-PAGE e colorazione con argento, mentre il rapporto tra particelle piene e vuote viene determinato utilizzando la microscopia elettronica a trasmissione (TEM). Questo approccio offre un'efficiente piattaforma di cell factory per la produzione di vettori AAV ad alto rendimento, abbinata a un metodo di purificazione migliorato per soddisfare le esigenze di qualità degli studi in vivo .
Introduzione
I vettori di virus adeno-associati (AAV) sono diventati uno strumento indispensabile nella ricerca sulla terapia genica, offrendo una combinazione unica di efficacia e sicurezza per la consegna genica1. I metodi tradizionali per la generazione di AAV in laboratorio sono stati fondamentali per far progredire la nostra comprensione e applicazione della terapia genica2. Tuttavia, questi metodi, sebbene fondamentali, presentano alcune limitazioni e sfide, soprattutto in termini di resa, efficienza temporale e qualità dei vettori prodotti, in particolare il rapporto tra particelle piene e vuote3.
La procedura convenzionale per la produzione di AAV prevede principalmente la trasfezione di cellule HEK2934. Questo processo, tipicamente condotto in piastre di coltura cellulare, richiede che le cellule siano trasfettate con un plasmide contenente il gene di interesse insieme al plasmide helper e al plasmide del capside AAV 5,6. Dopo la trasfezione, le cellule producono particelle AAV, che vengono poi raccolte e purificate 5,6. Il processo di purificazione spesso comporta l'ultracentrifugazione, una fase fondamentale per ottenere vettori AAV ad alta purezza7. L'ultracentrifugazione, in particolare utilizzando il cloruro di cesio (CsCl) o il gradiente di iodixanolo, è un metodo standard per separare le particelle AAV dai detriti cellulari e da altre impurità8. Questo passaggio è fondamentale per raggiungere la purezza e la concentrazione desiderate dei vettori AAV, che influisce direttamente sulla loro efficacia nella consegna genica8. Nonostante il suo uso diffuso, l'ultracentrifugazione tradizionale ha i suoi svantaggi. Ad esempio, la resa dei vettori AAV con questo metodo può essere variabile e spesso bassa, il che pone sfide significative quando sono necessarie grandi quantità di vettori ad alto titolo, in particolare per studi in vivo o modelli animali di grandi dimensioni9.
Un altro aspetto critico della qualità del vettore AAV è il rapporto tra particelle piene e vuote10. I preparati AAV contengono spesso una miscela di queste particelle; Tuttavia, solo le particelle complete contengono il materiale genetico terapeutico. La presenza di un'alta percentuale di particelle vuote può ridurre significativamente l'efficienza della consegna genica10. La valutazione e l'ottimizzazione del rapporto tra particelle piene e vuote è quindi un parametro chiave nella valutazione dell'efficacia dei vettori AAV. I metodi tradizionali, sebbene in grado di produrre vettori AAV, spesso faticano a controllare questo rapporto in modo coerente, portando a variazioni nella potenza del vettore10.
Qui viene presentato un metodo unico, che semplifica il processo di generazione di vettori AAV ad alto rendimento e ad alta purezza utilizzando una piattaforma di fabbrica cellulare priva di utilizzo di colture cellulari di HEK293T ad alta intensità di lavoro in piastre cellulari, integrando il partizionamento bifase di polietilenglicole/acquoso con ultracentrifugazione a gradiente di iodixanolo. La purezza del vettore AAV è confermata tramite SDS-PAGE e colorazione con argento e il rapporto particelle pieno-vuoto è determinato utilizzando la microscopia elettronica a trasmissione (TEM), soddisfacendo gli standard di qualità per gli studi in vivo 11.
Protocollo
I dettagli dei reagenti, dei plasmidi e delle attrezzature utilizzate nello studio sono elencati nella Tabella dei materiali. La composizione dei buffer utilizzati è fornita nel File supplementare 1.
1. Preparazione del plasmide
- Plasmidi trasformabili (pAAV-GOI, pHelper, pAAV-Cap) in E. coli.
NOTA: Qualsiasi ceppo di E.coli può essere utilizzato per l'amplificazione plasmidica. Per alcuni plasmidi, speciali cellule competenti come NEB stable possono migliorare la resa plasmidica. I tre plasmidi utilizzati in questo protocollo sono pAAV-GOI: pAAV-CMV-GFP, pHelper: pAdDeltaF6 e pAAV-Cap: pAAV-RC6. - Far crescere i batteri in terreni LB contenenti gli antibiotici selettivi appropriati in volume ottimale a 37 °C per 16-18 ore.
NOTA: Quando si utilizzano cellule stabili NEB, coltura a 30 °C per 18-20 ore. - Raccogliere il DNA plasmidico centrifugando l'E. coli. terreno di coltura a 4000 x g, 4 °C, per 15 min.
- Versare con cura il liquido surnatante dal flacone della centrifuga in un contenitore di scarto e purificare il DNA plasmidico dal pellet con un kit di purificazione plasmidico privo di endotossine su larga scala.
NOTA: Assicurati di versarlo lentamente ed evitare schizzi. - Misurare la concentrazione e la purezza del DNA utilizzando uno spettrofotometro.
NOTA: Controllare la purezza del DNA controllando il rapporto OD260/OD280 . Il rapporto per il DNA puro è di circa 1,8. La concentrazione di DNA deve essere superiore a 1 μg/μL per la successiva fase di co-trasfezione. Preparare scorte di glicerolo batterico aggiungendo 500 μl di coltura notturna a 500 μl di glicerolo al 50% in un crioviale e conservare a -80 °C.
2. Preparazione HEK293T celle
- Seminare HEK293T cellule con DMEM ad alto contenuto di glucosio contenente il 10% di FBS in una fabbrica di cellule a 10 strati (CF10) e lasciare che le cellule crescano nell'incubatore durante la notte.
NOTA: I passaggi delle celle 293T devono essere inferiori a 10 per avere le condizioni ottimali per una robusta produzione di AAV. Se possibile, non aggiungere antibiotici ai terreni di coltura in questo momento. Il CF10 ha una superficie di crescita circa 42 volte superiore a quella di una piastra di coltura cellulare da 150 mm. Seminare la stessa densità cellulare in una piastra di coltura cellulare da 150 mm per consentire di controllare la crescita cellulare al microscopio. Preparare una sospensione cellulare da 1075 mL, aggiungere 25 mL di sospensione cellulare a un piatto da 150 mm e aggiungere il resto al CF10. - Controllare la confluenza cellulare il giorno successivo prima della trasfezione.
NOTA: Le cellule dovrebbero raggiungere l'80%-90% di confluenza al momento della trasfezione osservando al microscopio.
3. Tripla trasfezione di plasmidi AAV
- Calcolare la quantità di ciascun plasmide necessaria (pAAV-GOI, pHelper, pAAV-sierotipo) per avere un rapporto molare 1,2: 1: 1 con 2,5-5 mg di DNA totale per CF10.
NOTA: Il rapporto molare dei tre plasmidi potrebbe essere variabile per un'efficacia di trasfezione ottimale. È meglio testarlo in un ambiente su piccola scala prima di passare a questo settaggio CF10. pAAV-CMV-GFP, pAdDeltaF6 e pAAV-RC6 vengono utilizzati per produrre il virus AAV6-CMV-GFP come esempio. La formula del calcolatore PEI è elencata nella Tabella 1. - Aliquotare 350 mL di OptiMEM in un flacone sterile da 500 mL.
- Aggiungere tutti e tre i DNA plasmidici nel flacone contenente l'Opti-MEM. Mescola bene.
- Aggiungere 15 mL di soluzione di polietilenimmina (PEI) da 1 mg/mL (rapporto 1:3 μg di DNA per μg di PEI). Agitare energicamente la miscela OptiMEM/DNA/PEI su e giù per 30 s.
NOTA: Va bene fare le bolle. - Incubare la miscela a temperatura ambiente per 10-15 minuti.
NOTA: Un'incubazione più lunga può ridurre l'efficienza della trasfezione. - Aggiungere la soluzione OptiMEM/DNA/PEI al flacone da 1 L contenente 700 ml di DMEM a basso contenuto di glucosio con 10 mM di HEPES e 2% di FBS. Mescola bene.
NOTA: In questo studio, il basso glucosio nel DMEM ha mostrato una migliore produzione del vettore AAV dopo la co-trasfezione. L'aggiunta di HEPES aiuta a mantenere le cellule in condizioni migliori. Mescolare ruotando lentamente la bottiglia. Evita di creare troppe bolle. - Estrarre il CF10 dall'incubatrice e aspirare il terreno in un contenitore per rifiuti.
NOTA: Appoggiare il CF10 sulla superficie all'interno della cappa e sollevare gradualmente un lato verso l'alto, aspirare lentamente il supporto senza staccare le celle. - Aggiungere con cautela la miscela di trasfettante al CF10. Assicurarsi che tutti e dieci gli strati siano coperti da un supporto.
NOTA: Aggiungere 25 ml di miscela di trasfettante nel piatto da 150 mm. Monitorare le cellule quotidianamente fino al raccolto. Aggiungere la miscela di trasfettante rimanente nel CF10 versando lentamente. Ruotare il CF10 con molta attenzione e garantire un volume uguale per ogni strato. - Rimettere il CF10 nell'incubatrice per 72-96 ore.
NOTA: Controllare la parabola del monitor da 150 mm per decidere quando raccogliere i vettori AAV. Quando le cellule si staccano molto facilmente con un carico completo di AAV, è il momento di raccogliere.
4. Raccolta di vettori AAV
- Raccogliere il virus 3-4 giorni dopo la trasfezione agitando energicamente il CF10. Versare il terreno nelle provette coniche da 250 ml e centrifugare il virus a 4000 x g per 20 minuti a 4 °C.
NOTA: Per il sierotipo AAV6 utilizzato in questo protocollo, l'80% di AAV rimarrà per lo più legato al materiale cellulare nel pellet. E il 20% di AAV è stato secreto nei media. Queste proporzioni possono differire per altri sierotipi di AAV. - Filtrare il surnatante chiarificato con un'unità filtrante da 0,45 μm e conservarlo per le precipitazioni.
- Sciacquare il CF10 con 500 mL di tampone DPBS 1x e centrifugare a 4000 x g per 20 minuti a 4 °C.
- Eliminare il surnatante utilizzando un sistema a vuoto e una pipetta di aspirazione. Aggiungere 20 mL di tampone di lisi AAV per CF10 a -80 °C fino alla purificazione.
NOTA: Trasferire il lisato di AAV in una provetta conica da 50 mL per la successiva estrazione di AAV. - Estrarre il surnatante filtrato, aggiungere una soluzione di NaCl al 40% di PEG-2,5 M per una concentrazione finale dell'8% di PEG e incubare in una cella frigorifera su un rotatore orbitale per almeno 3 ore o durante la notte.
NOTA: Per 100 mL di surnatante, aggiungere 25 mL di soluzione di NaCl PEG-2,5 M al 40%. - Far precipitare il virus centrifugando a 4000 x g per 30 minuti a 4 °C.
NOTA: Trasferire la miscela in provette coniche da 250 ml per la centrifugazione. - Aspirare per rimuovere il surnatante e aggiungere 5-10 ml di tampone di risospensione AAV HEPES per sospendere i pellet. Trasferire in una provetta conica da 50 mL per continuare la purificazione a valle, oppure conservarla a -80 °C.
5. Estrazione AAV
- Scongelare il pellet di virus in un bagno d'acqua a 37 °C per 10-15 minuti con uno shaker.
NOTA: Agitare il lisato AAV per scioglierlo completamente. - Congelare in bagno di etanolo al 100% a -80 °C per 20-30 min.
NOTA: In alternativa, il ciclo di congelamento può essere eseguito con un becher freddo di etanolo al 100% circondato da ghiaccio secco. - Eseguire il congelamento/scongelamento 3-4 volte e, se necessario, un vortice intermedio.
NOTA: Questo ciclo può essere messo in pausa nella fase di congelamento. Conservare il lisato AAV a -80 °C fino al lavoro a valle. - Scongelare il lisato di AAV (dal punto 5.3) e l'AAV risospeso (dal punto 4.7)" in un bagno d'acqua a 37 °C per 10-15 minuti con un agitatore e un vortice.
NOTA: Assicurati che si sciolga completamente e mescolalo. - Aggiungere la nucleasi benzasi (250 unità/μL) al lisato di AAV e l'AAV risospeso per una concentrazione finale di 50 unità/mL. Vortex la soluzione.
- Incubare a bagnomaria a 37 °C agitando per 30 minuti.
NOTA: Estrarre le aliquote di desossicolato di sodio al 10% a bagnomaria per consentire lo scioglimento, il riscaldamento e la miscelazione accurata. - Aggiungere il 10% di desossicolato di sodio per una concentrazione finale dello 0,5% e incubare a 37 °C con agitatore acceso per 30 minuti.
NOTA: Il desossicolato di sodio è stato utilizzato per migliorare il rilascio di AAV dalle cellule. - Distribuire la soluzione grezza di AAV in provette da centrifuga da 2 mL e centrifugare a 14.000 x g per 10 minuti a 4 °C.
- Trasferire il surnatante in una provetta conica da 50 mL.
NOTA: Utilizzare una pipetta da 1 ml per trasferire il surnatante. Scartare i pellet. - Aggiungere una quantità uguale di cloroformio ed estrarre AAV agitando per 1-2 minuti.
NOTA: La soluzione deve diventare opaca, bianca, simile al latte. - Trasferire la soluzione lattiginosa in provette da centrifuga da 2 ml e distribuirla uniformemente. Centrifugare a 14.000 x g per 10 min a 4 °C.
- Pipettare con cura lo strato rosa superiore e trasferirlo in una nuova provetta conica da 50 mL.
NOTA: Non disturbare gli strati di cloroformio/proteine. - Misurare il volume finale utilizzando una pipetta. Secondo la tabella dei volumi grezzi di AAV-PEG-Solfato (Tabella 2), miscelare volumi appropriati di soluzione di SO4 al 50% (NH4)2e PEG al 40%. Vortice per 2 min.
- Trasferire la miscela in provette da centrifuga da 2 ml per distribuirla uniformemente. Centrifugare a 14.000 x g per 10 min a 4 °C
- Raccogliere lo strato inferiore utilizzando un ago da 22 G e una siringa da 3 mL. Raccogliere l'AAV in una provetta conica da 50 mL e conservarla a 4 °C per la successiva ultracentrifugazione con gradienti di iodixanolo.
6. Purificazione di AAV mediante ultracentrifugazione con gradiente di iodixanolo
- Preparare i gradienti di iodixanolo prima di caricare l'AAV in base al numero di provette per ultracentrifugazione utilizzate (Tabella 3).
NOTA: Il rosso fenolo è stato utilizzato per osservare gli strati. - Sovrapporre lentamente ciascuna soluzione in una provetta per ultracentrifuga in polipropilene a chiusura rapida con una siringa da 10 ml collegata con un ago lungo puntato da 16 G. Evita le bolle.
- Aggiungere con cautela fino a 17 ml di soluzione di AAV sopra il gradiente con una siringa da 22 G. Utilizzare il tampone per dialisi AAV per rabboccare il tubo.
NOTA: Aggiungere la soluzione AAV caricando le gocce contro la parete nella provetta dell'ultracentrifuga. Non disturbare i livelli di sfumatura. - Sigillare le provette dell'ultracentrifuga con un sigillante elettrico.
NOTA: Bilanciare le provette prima di inviarle all'ultracentrifuga con una differenza di ±0,2 g. - Centrifugare a 350.000 x g per 2 ore in un rotore Ti70 a 4 °C.
- Rimuovere con cautela le provette dal rotore e posizionarle nel rack delle provette per ultracentrifuga.
NOTA: Assicurarsi che le pendenze non vengano disturbate. - Raccogli le frazioni AAV seguendo i passaggi seguenti:
- Stabilizzare il tubo su un supporto per supporto.
- Forare le provette dell'ultracentrifuga leggermente al di sotto dell'interfaccia 40%-60% con un ago da 19 G collegato a una siringa da 10 mL.
NOTA: L'apertura dell'ago deve essere rivolta verso l'alto, rivolta verso la pendenza del 40%. - Praticare un foro nella parte superiore del tubo con un ago da 16 G.
- Raccogliere fino a 5 mL per provetta. Evitare di raccogliere la contaminazione proteica all'interfaccia 25%-40%.
- Ripetere l'operazione per ogni provetta per ultracentrifuga.
NOTA: Trasferire le frazioni AAV in una provetta conica da 50 mL.
7. Secondo ciclo di ultracentrifugazione con gradienti di iodixanolo
NOTA: Questo passaggio è facoltativo. Questo passaggio consiste nel ridurre il rapporto AAV vuoto per un capside AAV completo di qualità superiore.
- Diluire AAV >1:1 con tampone per dialisi AAV.
NOTA: L'AAV raccolto dal primo ciclo di ultracentrifugazione era al 40% di strato di iodixanolo. Dovrebbe essere diluito di almeno il 50% per poter essere caricato sopra lo strato di iodixanolo al 30%. - Sovrapporre ciascuna soluzione (Tabella 4) in una provetta per ultracentrifugazione utilizzando un ago puntato da 16 G e collegare lentamente una siringa da 10 mL. Evita le bolle.
- Aggiungere con cautela 20 ml di soluzione diluita di AAV sopra il gradiente con una siringa da 22 G. Utilizzare il tampone per dialisi AAV per rabboccare il tubo.
- Ripetere i passaggi da 6.4 a 6.7.
8. Dialisi e concentrazione AAV
- Trasferire il virus AAV nella cassetta per dialisi utilizzando un nuovo ago da 18 G e una siringa da 10 mL. Iniettare lentamente il virus nella cassetta e rimuovere l'aria da essa.
- Aggiungere una barra di agitazione al becher contenente il tampone per dialisi AAV e posizionarlo su una piastra di agitazione.
- Inserire la cassetta per dialisi nel tampone per dialisi con una boa galleggiante. Mescolare a 4 °C. Cambiare 2-3 volte il tampone per dialisi AAV.
NOTA: Utilizzare una quantità di buffer sufficiente per consentire alla cassetta di galleggiare ed eseguire la sostituzione del buffer. Coprire il bicchiere con un foglio di alluminio. - Utilizzando una siringa da 10 ml collegata con un ago da 18 G, raccogliere il virus dalla cassetta in un'unità di filtro centrifuga.
- Centrifugare a 4.000 x g per 15-30 min a 4 °C.
NOTA: Inserire l'AAV con il tampone per dialisi AAV 2-3 volte. Concentrare l'AAV fino a quando ~200 μL di rimanenza si trovano sopra il filtro. - Raccogliere l'AAV concentrato dall'unità filtrante. Sciacquare il filtro con altri 300 μl di tampone per dialisi AAV e trasferirlo nell'AAV concentrato.
- Filtrare il virus attraverso una siringa da 0,22 μm utilizzando una siringa a slittamento luer da 1 mL di tubercolina. Per garantire la minima perdita di volume, utilizzare la siringa da 10 ml per spingere l'aria attraverso il filtro 2-3 volte.
- Conservare temporaneamente il virus AAV purificato a 4 °C per la titolazione.
NOTA: Titolare il virus, aliquotare e conservare a -80 °C entro 1 settimana.
9. Titolazione del virus AAV
NOTA: La reazione a catena della polimerasi quantitativa (qPCR) TaqMan è stata utilizzata per titolare l'AAV purificato.
- Trattare i vettori AAV con DNasi I e incubare a 37 °C per 30 minuti, quindi incubare a 95 °C per 10 minuti.
NOTA: Come esempio di reazione da 10 μL, vengono utilizzati 2 μL di campione di virus AAV, 1 μL di DNasi, 1 μL di tampone DNasi e 6 μL di H2O. Può essere eseguito in un termociclatore con provette per PCR. - Preparare i set di primer mirati alla regione di inserimento AAV.
NOTA: I bersagli potrebbero essere il promotore, il transgene e il reporter nel costrutto AAV. Gli inneschi sono elencati nella Tabella 5. - Preparare gli standard dei plasmidi del DNA (10, 1, 0,1, 0,01, 0,001 e 0,0001 pg/μL) e un controllo negativo (H2O).
- Preparare la master mix qPCR, compresi i primer, secondo le istruzioni del produttore.
- Posizionare gli standard e i campioni in triplicato su una piastra PCR. Aggiungere la miscela qPCR agli standard e ai campioni. Sigillare la piastra ed eseguire la reazione qPCR secondo le istruzioni del produttore.
NOTA: Le condizioni di reazione dipendono dai materiali/reagenti e dallo strumento. Sono applicabili cicli di PCR rapidi e convenzionali. - Calcola il titolo del virus AAV.
NOTA: La concentrazione del campione in questo protocollo è di 1/10 di diluizione rispetto ai campioni originali. - Aliquotare il virus AAV in provette da 1,5 mL e conservare a 4 °C per un massimo di un mese e conservare a -80 °C a lungo termine.
NOTA: Evitare cicli di congelamento/scongelamento per la conservazione. Se utilizzato per esperimenti in vivo , non utilizzare scongelare oltre due aliquote.
10. Controllo di qualità di AAV
NOTA: I virus AAV sono stati caratterizzati per la purezza mediante colorazione d'argento SDS-PAGE utilizzando un gel SDS-PAGE e colorati utilizzando un kit di colorazione disponibile in commercio.
- Denaturare 3 x 109 vg di campione di virus AAV con tampone Laemmli.
NOTA: Utilizzare un virus AAV di riferimento come controllo. Viene utilizzato il capside completo di riferimento AAV6-CMV-GFP. - Caricare l'AAV denaturato su un gel SDS-PAGE con gradiente 4%-20% e farlo funzionare a 180 V per 50 minuti.
- Rimuovere il gel dalla piastra per elettroforesi. Colorare il gel con un kit per la colorazione dell'argento secondo le istruzioni del produttore.
- Controllare le proteine del capside AAV VP1, VP2 e VP3.
NOTA: Il virus AAV puro contiene solo la proteina del capside VP1, VP2 e VP3. Se non puro, altre bande proteiche sarebbero visibili sul gel.
NOTA: La microscopia elettronica a trasmissione (TEM) di virioni AAV ricombinanti colorati negativamente è stata eseguita per valutare l'integrità morfologica e il rapporto pieno/vuoto. - Raccogli una griglia EM con una pinzetta e siediti sulla panca con il lato lucido della griglia rivolto verso l'alto.
- Pipettare 5 μL di campione AAV sulla griglia e lasciarlo asciugare per evaporazione.
NOTA: Diluire l'AAV se necessario. 1012 vg/mL è un titolo medio. Potrebbero essere necessari 30-60 minuti per asciugare la griglia. - Lavare la griglia pipettandola, goccia a goccia, con circa 200 μL di H2O sulla griglia.
- Rimuovere l'acqua in eccesso posizionando lentamente una carta per cromatografia verticalmente accanto alla griglia.
- Pipet 5 μL di soluzione di acetato di uranile al 2% sulla griglia. Incubare per 5 minuti e rimuovere con lo stoppino come menzionato sopra. Lasciare asciugare la griglia.
- Visualizza le particelle AAV sotto un microscopio elettronico a trasmissione (con un ingrandimento di 50.000 volte). I capsidi virali con un genoma virale appariranno come esagoni bianchi omogenei, mentre i capsidi vuoti appariranno come esagoni con un bordo bianco ma un centro scuro.
- Conta casualmente almeno 100 particelle per determinare la percentuale approssimativa di pieno vs. particelle AAV vuote.
Risultati
In questo dettagliato protocollo passo-passo, viene dimostrata una piattaforma standardizzata per la produzione di virus AAV ad alto titolo e di alta qualità con il CF10 in un laboratorio di ricerca su larga scala. Rispetto alle piastre convenzionali per colture cellulari, il CF10 offre un modo conveniente per coltivare grandi quantità di cellule e produrre il virus AAV (Figura 1). Sono state testate diverse condizioni di coltura per determinare se le cellule in un ambiente ottimale possono promuovere la produzione virale. Un DMEM a basso contenuto di glucosio integrato con 10 mM di HEPES e 2% di FBS ha mostrato la migliore produzione di AAV.
Sono stati testati diversi protocolli per purificare gli AAV. La maggior parte delle procedure ha una bassa resa virale e l'impurità dei capsidi AAV. In questo caso, è stato sviluppato un protocollo di purificazione rivisto, che combina l'AAV sia da pellet cellulari che da terreni di coltura (Figura 2). Abbiamo scoperto che l'80% dell'AAV era nelle cellule e un altro 20% dell'AAV era nei terreni di coltura, che sono stati secreti dalle cellule. Entrambe le parti dell'AAV sono state trattate con DNasi per rimuovere il DNA libero. Il desossicolato di sodio è stato utilizzato per rilasciare ulteriormente AAV dalle cellule. Gli AAV sono stati quindi estratti con estrazione di cloroformio seguita da una partizione acquosa a due fasi. Questi passaggi hanno permesso di rimuovere la maggior parte dei contaminanti proteici. L'AAV rimane solubile nella fase di solfato di ammonio.
I contaminanti rimanenti sono stati rimossi con un'ultracentrifugazione discontinua con gradiente di iodixanolo (Figura 3A). Il gradiente è stato utile anche per rimuovere i capsidi AAV vuoti, in particolare con il secondo ciclo di ultracentrifugazione con gradiente di iodixanolo.
La purezza del virus AAV è stata determinata mediante colorazione con argento. Quando sono state ottenute tre bande principali corrispondenti alla proteina del capside AAV, VP1, VP2 e VP3, con una purezza superiore al 90%, il virus AAV era adatto per l'uso in vivo (Figura 3B). Il rapporto tra capside pieno AAV e capside vuoto è stato raggiunto da TEM (Figura 3C). Solo un capside completo con un inserto transgenico consentirebbe l'espressione del transgene nel tessuto bersaglio. Un'alta porzione del capside vuoto potrebbe anche indurre una risposta immunitaria al capside AAV. Questi controlli di qualità sono necessari per ogni virus AAV prodotto e purificato prima dell'uso.
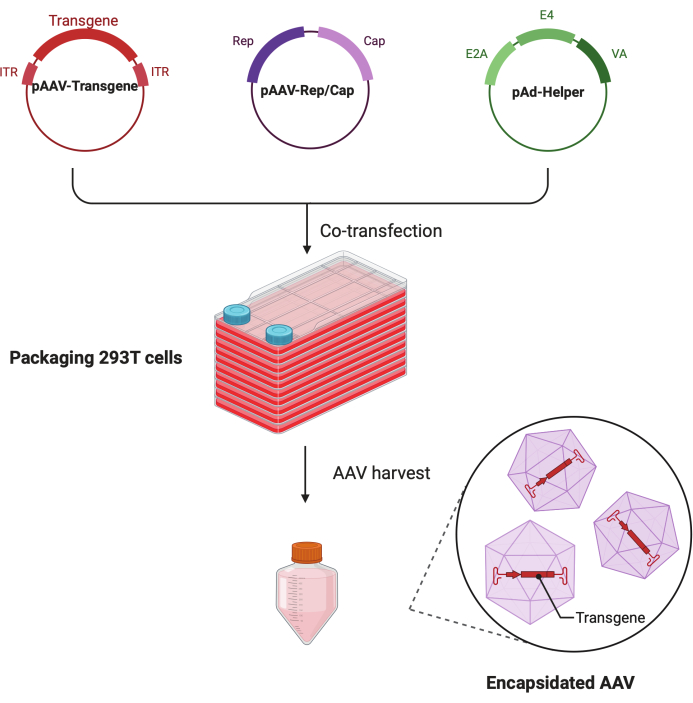
Figura 1: Illustrazione schematica della produzione di AAV con il metodo di tripla trasfezione delle cellule HEK293T. Fare clic qui per visualizzare una versione più grande di questa figura.
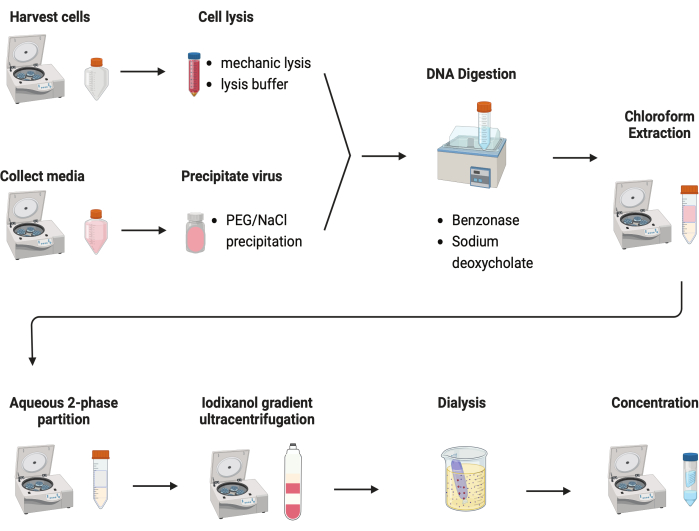
Figura 2: Illustrazione schematica della purificazione AAV. Fare clic qui per visualizzare una versione più grande di questa figura.
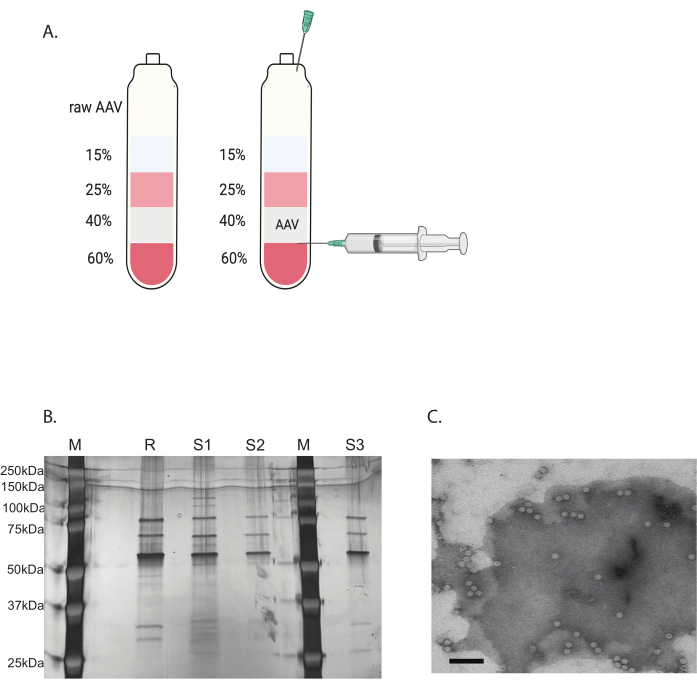
Figura 3: Purificazione dell'AAV mediante ultracentrifugazione a gradiente di iodixanolo e verifica della purezza del virus AAV. (A) Strati di gradiente di iodisxanolo e posizione dell'ago per la raccolta. (B) Gel rappresentativo che valuta il contenuto e la purezza del capside. M: marcatore molecolare; R: riferimento AAV6 capside completo; S1: capside AAVDJ prodotto internamente con un ciclo di ultracentrifugazione; S2: capside AAVDJ prodotto internamente con due cicli di ultracentrifugazione; S3: capside AAV6 realizzato internamente. (C) Immagine al microscopio elettronico di AAV. Virus raccolto dopo la purificazione. I capsidi virali contenenti un genoma virale appaiono come esagoni bianchi omogenei, mentre i capsidi vuoti appaiono come esagoni con un bordo bianco ma un centro scuro. Barra della scala: 100 nm. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Calcolatore PEI per imballaggi AAV. Clicca qui per scaricare questa tabella.
Tabella 2: Grafico del volume grezzo di AAV-PEG-solfato. Clicca qui per scaricare questa tabella.
Tabella 3: Preparazione del gradiente di iodixanolo. Clicca qui per scaricare questa tabella.
Tabella 4: Preparazione del gradiente di iodixanolo del secondo round. Clicca qui per scaricare questa tabella.
Tabella 5: Primer di titolazione AAV. Clicca qui per scaricare questa tabella.
File supplementare 1: Composizioni dei tamponi utilizzati per lo studio. Clicca qui per scaricare questo file.
Discussione
In questo caso, viene introdotto un protocollo tecnicamente avanzato per la produzione su larga scala di vettori AAV ad alto titolo e di alta qualità utilizzando una piattaforma di fabbrica cellulare (CF10), che rappresenta un miglioramento significativo rispetto ai metodi convenzionali su piastra per colture cellulari. L'uso di fabbriche di cellule semplifica il processo di coltivazione di grandi volumi di cellule, facilitando la produzione di virus AAV in modo più efficiente1. Inoltre, ottimizzando le condizioni di coltura, in particolare con DMEM a basso contenuto di glucosio integrato con 10 mM di HEPES e 2% di FBS, è stata confermata una produzione virale significativamente migliorata, indicando il ruolo cruciale dell'ambiente cellulare nella resa del virus.
Il protocollo di purificazione rivisto, che combina AAV da pellet cellulari e terreni di coltura, affronta il problema comune delle basse rese virali e dell'impurità presenti in molti protocolli esistenti. Le fasi di estrazione del cloroformio e di partizione acquosa a due fasi rimuovono efficacemente la maggior parte dei contaminanti proteici, con l'AAV che rimane solubile nella fase di solfato di ammonio. Il miglioramento sia della resa che della purezza dei vettori AAV utilizzando il PEG/ripartizione acquosa bifase combinata con l'ultracentrifugazione a gradiente di iodixanolo, rispetto ai tradizionali metodi di ultracentrifugazione a gradiente, può essere attribuito a una maggiore separazione iniziale con PEG/partizione acquosa a due fasi, a una purezza raffinata con l'ultracentrifugazione a gradiente di iodixanolo e alla riduzione della co-purificazione dei contaminanti12. In primo luogo, l'introduzione del PEG/partizione acquosa a due fasi prima dell'ultracentrifugazione migliora significativamente la separazione iniziale delle particelle AAV dai detriti cellulari e da altri contaminanti. Il PEG, un polimero ad alto peso molecolare, quando miscelato con una soluzione acquosa, crea due fasi distinte13. I vettori AAV hanno una propensione a partizionare preferenzialmente in una di queste fasi (comunemente la fase ricca di PEG), mentre molti contaminanti e impurezze sono suddivisi nelle altre13. Questa suddivisione selettiva concentra efficacemente le particelle AAV e rimuove una parte sostanziale delle impurità anche prima dell'ultracentrifugazione, aumentando così la resa e riducendo il carico di contaminanti che entra nella fase13 dell'ultracentrifugazione. In secondo luogo, l'ultracentrifugazione con gradiente di iodixanolo affina ulteriormente la purezza dei vettori AAV. Lo iodisxanolo, un mezzo a gradiente iso-osmolare non ionico, consente una separazione più delicata e controllata rispetto ai tradizionali gradienti di CsCl14. In questo gradiente, le particelle AAV migrano in una posizione nel gradiente che corrisponde alla loro densità di galleggiamento14. È importante sottolineare che questo processo è efficace nel separare i capsidi AAV pieni (contenenti il carico genetico) dai capsidi vuoti (privi di materiale genetico), che è un fattore determinante per la qualità del vettore. La natura iso-osmolare dello iodixanolo preserva anche l'integrità dei capsidi AAV meglio degli agenti iperosmolari come il CsCl, portando potenzialmente a rese più elevate di vettori funzionali intatti14. Infine, i metodi di ultracentrifugazione tradizionali, in particolare quelli che utilizzano gradienti di CsCl, possono talvolta co-purificare contaminanti che hanno densità di galleggiamento simili ai vettori AAV15. Utilizzando il partizionamento PEG come fase preliminare, il carico di tali contaminanti viene notevolmente ridotto prima dell'ultracentrifugazione13. Questa riduzione del carico di contaminanti significa che il gradiente di iodixanolo può funzionare in modo più efficace e selettivo nella purificazione dei vettori AAV, portando a una maggiore purezza15.
La purezza e la qualità dei vettori AAV sono rigorosamente valutate attraverso la colorazione con argento e TEM11. L'osservazione di tre bande principali corrispondenti alle proteine del capside AAV VP1, VP2 e VP3, con una purezza superiore al 90%, indica l'idoneità di questi vettori AAV per l'uso in vivo . L'analisi TEM per determinare il rapporto capside pieno/vuoto è particolarmente cruciale, poiché un'elevata percentuale di capsidi vuoti può portare a una riduzione dell'efficienza del rilascio genico e a potenziali risposte immunitarie11. Questo controllo di qualità, sebbene essenziale, aumenta la complessità procedurale e può richiedere ulteriori competenze tecniche.
In conclusione, il protocollo offre significativi progressi tecnici nella produzione di vettori AAV, in particolare in termini di scalabilità e purezza. Tuttavia, le complessità associate al processo di purificazione e la necessità di attrezzature e competenze specializzate possono ancora rappresentare un limite minore per la sua applicazione in determinati contesti di ricerca. Un ulteriore perfezionamento e semplificazione di queste tecniche potrebbe rendere questo approccio più accessibile e ampiamente applicabile nel campo della ricerca sulla terapia genica.
Divulgazioni
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che possano essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
TZ ha progettato gli esperimenti. TZ, VD, SB e JP hanno eseguito gli esperimenti. TZ e VD hanno generato dati e li hanno analizzati. TZ e YX hanno scritto il manoscritto. TZ e GG hanno rivisto il manoscritto. Questo lavoro è stato sostenuto dall'UPMC Children's Hospital di Pittsburgh.
Materiali
| Name | Company | Catalog Number | Comments |
| 293T/17 cells | ATTC | CRL-11268 | |
| 0.5 M EDTA | MilliporeSigma | 324506-100ml | |
| 1 mL Henke-Ject syringe | Fisher Scientific | 14-817-211 | |
| 10% pluronic F68 solution | Fisher Scientific | 24-040-032 | |
| 10x Tris/Glycine/SDS Buffer | Biorad | 1610732 | |
| 1M HEPES | Fisher Scientific | 15-630-080 | |
| 2% Uranyl Acetate Solution | Electron Microscopy Sciences | 22400-2 | |
| 4%–20% Precast Protein Gels | biorad | 4561094 | |
| 40% PEG solution | Sigma | P1458-50ML | |
| AAV6 reference full capsids | Charles River Laboratories | RS-AAV6-FL | |
| Accutase Cell Detachment Solution | Fisher Scientific | A6964-100ML | |
| Benzonase | Sigma | E1014-25KU | |
| BioLite Cell Culture Treated Dishes 150 mm | Fisher Scientific | 12-556-003 | |
| Centrifugal Filter Unit | MilliporeSigma | UFC905024 | |
| Corning PES Syringe Filters | Fisher Scientific | 09-754-29 | |
| Dialysis Cassettes, 10 K MWCO | Fisher Scientific | PI66810 | |
| Disposable PES Filter Units 1 L 0.2 µm | Fisher Scientific | FB12566506 | |
| Disposable PES Filter Units 1 L 0.45 µm | Fisher Scientific | FB12566507 | |
| Disposable PES Filter Units 500 mL 0.2 µm | Fisher Scientific | FB12566504 | |
| DMEM high glucose | Fisher Scientific | 10-569-044 | |
| DMEM low glucose | Fisher Scientific | 10567022 | |
| DNase | NEB | M0303S | |
| DPBS 1x | Fisher Scientific | 14-190-250 | |
| Fetal Bovin Serum (FBS) | Biowest | S1620 | |
| Formvar/Carbon 300 Mesh, Cu | Electron Microscopy Sciences | FCF300-Cu-50 | |
| glycerol | Sigma | G5516-1L | |
| KCl | Sigma | P9541-500G | |
| LB agar | Sigma | L2897-250G | |
| LB broth | Fisher Scientific | BP9732-500 | |
| MgCL2·6H2O | Sigma | M9272-100G | |
| NEB stable competent cells | NEB | C3040H | |
| Nest Biofactory 10 chamber | MidSci | 771302 | |
| NucleoBond Xtra Maxi EF | Macherey-Nagel | 740424 | |
| Opti-MEM | Fisher Scientific | 31-985-088 | |
| OptiPrep Density Gradient Medium | Millipore Sigma | D1556-250ml | |
| pAAV-CMV-GFP | Addgene | 105530 | |
| pAAV-DJ | Cell BioLab | VPK-420-DJ | |
| pAAV-RC6 | Cell BioLab | VPK-426 | |
| pAdDeltaF6 | Addgene | 112867 | |
| PEG 8000 | Promega | V3011 | |
| PEI Max | Polysciences, Inc | 49553-93-7 | |
| Pen-Strep | Fisher Scientific | 15-140-163 | |
| Phenol red | Millipore Sigma | 1.07242.0100 | |
| Pierce Silver Stain Kit | Thermo Fisher Scientific | 24612 | |
| QuickSeal tube | Fisher Scientific | NC9144589 | |
| Sodium Chloride | Sigma | 1162245000 | |
| sodium deoxycholate | Millipore Sigma | D6750-100G | |
| Taqman Fast Advanced Master Mix | Thermo Fisher Scientific | 4444557 | |
| Type 70 Ti Fixed-Angle Titanium Rotor | Beckman Coulter | 337922 | |
| Western Blotting Substrate | ThermoFisher | 32209 |
Riferimenti
- Arjomandnejad, M., Dasgupta, I., Flotte, T. R., Keeler, A. M. Immunogenicity of recombinant adeno-associated virus (AAV) vectors for gene transfer. BioDrugs. 37 (3), 311-329 (2023).
- Liu, Y., Siriwon, N., A Rohrs, J., Wang, P. Generation of targeted adeno-associated virus (AAV) vectors for human gene therapy. Curr Pharm Des. 21 (22), 3248-3256 (2015).
- Bilal, A. S., et al. Optimization of large-scale Adeno-Associated Virus (AAV) production. Curr Protoc. 3 (5), e757(2023).
- Rashnonejad, A., Chermahini, G. A., Li, S., Ozkinay, F., Gao, G. Large-scale production of adeno-associated viral vector serotype-9 carrying the human survival motor neuron gene. Mol Biotechnol. 58, 30-36 (2016).
- Challis, R. C., et al. Systemic AAV vectors for widespread and targeted gene delivery in rodents. Nat Protoc. 14 (2), 379-414 (2019).
- Challis, R. C., et al. Publisher Correction: Systemic AAV vectors for widespread and targeted gene delivery in rodents. Nat Protoc. 14 (8), 2597-2597 (2019).
- Mueller, C., Ratner, D., Zhong, L., Esteves-Sena, M., Gao, G. Production and discovery of novel recombinant adeno-associated viral vectors. Curr Protoc Microbiol. 26 (1), 14(2012).
- Guo, P., Wiersch, J., Xiao, X., Gittes, G. Simplified purification of AAV and delivery to the pancreas by intraductal administration. Methods Mol Biol. 1950, 373-387 (2019).
- Berns, K. I., Srivastava, A. Next generation of adeno-associated virus vectors for gene therapy for human liver diseases. Gastroenterol Clin North Am. 48 (2), 319-330 (2019).
- Khasa, H., Kilby, G., Chen, X., Wang, C. Analytical band centrifugation for the separation and quantification of empty and full AAV particles. Mol Ther Methods Clin Dev. 21, 585-591 (2021).
- Chen, H. Comparative observation of the recombinant adeno-associated virus 2 using transmission electron microscopy and atomic force microscopy. Microsc Microanal. 13 (5), 384-389 (2007).
- Burnham, B., et al. Analytical ultracentrifugation as an approach to characterize recombinant adeno-associated viral vectors. Hum Gene Ther Methods. 26 (6), 228-242 (2015).
- Kato, M., et al. In situ-formable, dynamic crosslinked poly (ethylene glycol) carrier for localized adeno-associated virus infection and reduced off-target effects. Commun Biol. 6 (1), 508(2023).
- Sena-Esteves, M., Gao, G. Enrichment of fully packaged virions in column-purified recombinant adeno-associated virus (rAAV) preparations by iodixanol gradient centrifugation followed by anion-exchange column chromatography. Cold Spring Harb Protoc. 2020 (2), 095638(2020).
- Matsumoto, M., Wangelin, J. R., Murphy, M. L. Purification of avian encephalomyelitis virus by ultracentrifugation in a nonlinear cesium chloride gradient. Avian Dis. 22 (3), 496-502 (1978).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon