Method Article
قياس الفلورة عالي الدقة لتقييم التغيرات الديناميكية في إمكانات غشاء الميتوكوندريا في الخلايا المناعية البشرية
In This Article
Summary
طرق دراسة الطاقة الحيوية للميتوكوندريا تحت تركيزات الركيزة ذات الصلة من الناحية الفسيولوجية في الخلايا المناعية محدودة. نحن نقدم بروتوكولا مفصلا يستخدم قياس الفلور عالي الدقة لتقييم التغيرات في استجابة غشاء الميتوكوندريا المحتمل للطلب على الطاقة في الخلايا التائية البشرية ، وحيدات الخلايا ، والخلايا أحادية النواة المحيطية.
Abstract
تظهر الخلايا أحادية النواة المحيطية (PBMCs) تغيرات قوية في القدرة التنفسية للميتوكوندريا استجابة للصحة والمرض. في حين أن هذه التغييرات لا تعكس دائما ما يحدث في الأنسجة الأخرى ، مثل العضلات الهيكلية ، فإن هذه الخلايا هي مصدر قيم يمكن الوصول إليه للميتوكوندريا القابلة للحياة من البشر. تتعرض PBMCs لإشارات نظامية تؤثر على حالة الطاقة الحيوية الخاصة بها. وبالتالي ، فإن توسيع أدواتنا لاستجواب استقلاب الميتوكوندريا في هذه الفئة من السكان سيوضح الآليات المتعلقة بتطور المرض. غالبا ما تقتصر المقايسات الوظيفية للميتوكوندريا على استخدام مخرجات الجهاز التنفسي بعد تركيزات الركيزة القصوى والمثبطات وغير المقرنة لتحديد النطاق الكامل للقدرة التنفسية ، والتي قد لا يمكن تحقيقها في الجسم الحي. يؤدي تحويل أدينوسين ثنائي الفوسفات (ADP) إلى أدينوسين ثلاثي الفوسفات (ATP) بواسطة ATP-synthase إلى انخفاض في إمكانات غشاء الميتوكوندريا (mMP) وزيادة في استهلاك الأكسجين. لتوفير تحليل أكثر تكاملا لديناميكيات الميتوكوندريا ، توضح هذه المقالة استخدام قياس الفلورة عالي الدقة لقياس الاستجابة المتزامنة لاستهلاك الأكسجين وإمكانات غشاء الميتوكوندريا (mMP) لتركيزات ADP ذات الصلة من الناحية الفسيولوجية. تستخدم هذه التقنية رباعي ميثيل رودامين ميثيل إستر (TMRM) لقياس استقطاب mMP استجابة لمعايرة ADP بعد فرط الاستقطاب الأقصى مع ركائز معقدة I و II. يمكن استخدام هذه التقنية لتحديد كيفية تأثير التغيرات في الحالة الصحية ، مثل الشيخوخة وأمراض التمثيل الغذائي ، على حساسية استجابة الميتوكوندريا للطلب على الطاقة في PBMCs والخلايا التائية والوحيدات من البشر.
Introduction
تعتمد قدرة الخلية على العمل والبقاء على قيد الحياة في فترة الإجهاد الفسيولوجي إلى حد كبير على قدرتها على تلبية المتطلبات النشطة لاستعادة التوازن 1,2. يرتفع الطلب على الطاقة استجابة لمجموعة متنوعة من المحفزات. على سبيل المثال ، زيادة تقلص العضلات أثناء التمرين يزيد من استخدام ATP والجلوكوز بواسطة العضلات الهيكلية ، ويزيد ارتفاع تخليق البروتين بعد الإصابة من استخدام ATP من قبل الخلايا المناعية لإنتاج السيتوكين وانتشاره3،4،5،6. يؤدي الارتفاع الحاد في الطلب على الطاقة إلى سلسلة من عمليات الطاقة الحيوية لاستعادة نسبة ATP / ADP. عند استهلاك ATP ، ترتفع مستويات ADP وتحفز F1F0 ATP-synthase (المركب V) ، الأمر الذي يتطلب قوة دافعة بروتونية لدفع دورانه الميكانيكي والتحويل التحفيزي ل ADP إلى ATP داخل الميتوكوندريا7. القوة الدافعة البروتونية هي تدرج كهروكيميائي تم إنشاؤه عن طريق ضخ البروتونات أثناء نقل الإلكترونات من الركائز إلى الأكسجين من خلال نظام نقل الإلكترون (ETS) داخل غشاء الميتوكوندريا الداخلي. يخلق الاختلاف الناتج في تركيز البروتون (دلتا pH) والإمكانات الكهربائية (جهد الغشاء) القوة الدافعة البروتونية التي تدفع تخليق ATP واستهلاك الأكسجين استجابة للطلب على الطاقة مما يقلل من نسبة ATP / ADP أو يرفع مستويات ADP. يمكن تحديد تقارب الميتوكوندريا مع ADP من خلال حساب Km أو EC50 للتنفس المحفز ADP للميتوكوندريا المعزولة أو الخلايا المتداخلة 8,9. أظهرت هذه الطريقة أن الألياف العضلية المتداخلة من البشر الأكبر سنا تتطلب تركيزا أكبر من ADP لتحفيز 50٪ من قدرتها القصوى على الفسفرة التأكسدية مقارنة بالأشخاص الأصغر سنا9. وبالمثل ، تتطلب شيخوخة العضلات الهيكلية للفأر المزيد من ADP لخفض إنتاج أنواع الأكسجين التفاعلية للميتوكوندريا (ROS) 10,11. بالإضافة إلى ذلك ، يتم تقليل حساسية ADP في ألياف العضلات المتداخلة للفئران المصابة بالسمنة التي يسببها النظام الغذائي بالنسبة إلى الضوابط ويتم تعزيزها في وجود الأنسولين وبعد استهلاك النترات 12,13. وبالتالي ، فإن قدرة الميتوكوندريا على الاستجابة للطلب على الطاقة تختلف في ظل ظروف فسيولوجية مختلفة ، ولكن لم يتم استكشاف ذلك من قبل في سياق الخلايا المناعية.
تستخدم خلايا الدم أحادية النواة المحيطية (PBMCs) بشكل شائع للتحقيق في الطاقة الحيوية الخلوية في البشر14،15،16،17،18،19،20. ويرجع ذلك إلى حد كبير إلى سهولة الحصول على الخلايا من عينات الدم غير المتخثرة في الدراسات السريرية ، واستجابة الخلايا للاضطرابات الأيضية ، والأساليب التي طورتها مجموعات مختلفة لاستجواب استقلاب الميتوكوندريا باستخدام مثبطات و uncouplers لتحديد السعة القصوى والحد الأدنى لتنفس الميتوكوندريا21,22. وقد أدت هذه الأساليب إلى تقدير أدوار الطاقة الحيوية في الشيخوخة ، وأمراض التمثيل الغذائي ، ووظيفة المناعة14،20،23،24. غالبا ما يتم تقليل القدرة التنفسية للميتوكوندريا في العضلات الهيكلية و PBMCs في ظل ظروف قصور القلب18,25. ترتبط الطاقة الحيوية PBMC أيضا بعوامل الخطر القلبية الأيضية لدى البالغين الأصحاء17 وتستجيب لعلاجات مثل نيكوتيناميد ريبوسيد18. تشمل PBMCs العدلات والخلايا الليمفاوية (الخلايا البائية والخلايا التائية) والوحيدات والخلايا القاتلة الطبيعية والخلايا المتغصنة ، والتي تساهم جميعها في قدرة الميتوكوندريا PBMC26،27،28. بالإضافة إلى ذلك ، تلعب الطاقة الحيوية الخلوية دورا حاسما في تنشيط الخلايا المناعية وتكاثرها وتجديدها23. ومع ذلك ، فإن أحد قيود هذه الطرق هو أن الخلايا لا تعمل تحت نطاق فسيولوجي من الركائز. لذلك هناك حاجة إلى طرق إضافية لاستجواب وظيفة الميتوكوندريا في تركيزات الركيزة الأكثر صلة بما تختبره الخلايا في الجسم الحي.
إمكانات غشاء الميتوكوندريا (mMP) هي المكون الرئيسي للقوة الدافعة للبروتونية وهي ضرورية لمجموعة متنوعة من عمليات الميتوكوندريا التي تتجاوز إنتاج ATP ، مثل تنظيم تدفق الجهاز التنفسي ، وإنتاج أنواع الأكسجين التفاعلية ، واستيراد البروتين والأيونات ، والالتهام الذاتي ، وموت الخلايا المبرمج. يمكن تقييم mMP باستخدام مجسات كهروكيميائية أو أصباغ فلورية حساسة للتغيرات في استقطاب الغشاء مثل JC-1 و Rhod123 و DiOC6 ورباعي ميثيل رودامين (TMRE) أو ميثيل استر (TMRM) وسافرانين. الأخيران هما أصباغ كاتيونية محبة للدهون تم استخدامها بنجاح في قياس الفلورة عالي الدقة لمتجانسات الأنسجة ، والميتوكوندريا المعزولة ، والأنسجة النفاذية11،29،30،31،32،33. في هذه التقنية ، يتم استخدام TMRM في وضع التبريد ، حيث تتعرض الخلايا لتركيز عال من TMRM الذي يتراكم في مصفوفة الميتوكوندريا عند الاستقطاب (ارتفاع mMP والقوة الدافعة) ، مما يؤدي إلى إخماد مضان TMRM الخلوي. عندما تزيل الميتوكوندريا استقطابها استجابة ل ADP أو uncouplers ، يتم إطلاق الصبغة من المصفوفة ، مما يزيد من إشارة الفلورسنت TMRM34,35. الغرض من هذه الطريقة هو قياس التغيرات في تنفس الميتوكوندريا و mMP في وقت واحد استجابة لمعايرة ADP في PBMCs المشتقة من الإنسان ، والوحيدات المنتشرة ، والخلايا التائية ، ويمكن أيضا تطبيقها على الخلايا التائية الطحالية للفأر.
Protocol
تمت الموافقة على جمع عينات الدم لتطوير البيانات والأساليب المعروضة هنا من قبل مجلس المراجعة الداخلية بجامعة واشنطن. تشمل النتائج التمثيلية أيضا بيانات من ذكور الفئران C57BL / 6J (5-7 أشهر) التي تم شراؤها من مختبرات جاكسون. تمت الموافقة على جميع الإجراءات الحيوانية من قبل مكتب رعاية بجامعة واشنطن. نظرة عامة على البروتوكول موضحة في الشكل 1. يمكن العثور على إعداد الكاشف لهذا البروتوكول في الملف التكميلي 1.
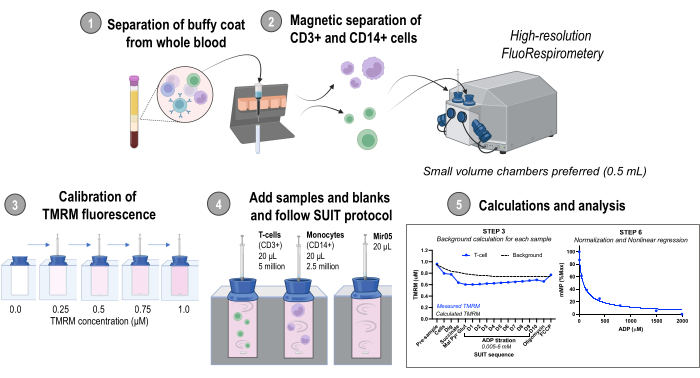
الشكل 1: نظرة عامة على البروتوكول. سير العمل باستخدام قياس الفلور عالي الدقة لتقييم التغيرات في إمكانات غشاء الميتوكوندريا في الخلايا الوحيدة المعزولة (CD14 +) والخلايا التائية (CD3 +) من عينات الدم البشري الطازجة. الاختصارات: TMRM ، رباعي ميثيل رودامين ميثيل استر ؛ SUIT ، معايرة مثبطات الركيزة ؛ ADP ، أدينوسين ثنائي الفوسفات. حفر ، ديجيتونين. مال ، مالات. بير ، البيروفات. تخمة ، الغلوتامات. D1-10 ، 10 معايرات ADP متتالية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. فصل معطف بافي عن الدم الكامل
ملاحظة: تم تعديل عزل الخلية من Kramer et al.27.
- اسمح ل RPMI وتدرج الكثافة وأجهزة الطرد المركزي بالوصول إلى درجة حرارة الغرفة. تعقيم خزانة ومواد السلامة الحيوية قبل البدء.
- اجمع الدم الوريدي في ثلاثة أنابيب 10 مل K2EDTA. عكس الأنابيب 3 مرات على الأقل.
- أجهزة الطرد المركزي الأنابيب في 500 × ز 10 دقيقة (22 درجة مئوية ، 9 تسارع [acc] ، 2 تباطؤ [dec]).
- قم بإزالة 1 مل من البلازما من كل أنبوب وتخزينها في -80 درجة مئوية للتحليلات المستقبلية.
- نقل البلازما ونصف طبقة خلايا الدم الحمراء من كل أنبوب إلى أنبوب مخروطي واحد سعة 50 مل. أضف RPMI حتى علامة 40 مل. عكس 3 مرات على الأقل.
- ضع ببطء 10 mL من محلول البلازما في أربعة أنابيب مخروطية سعة 15 mL تحتوي على 3 mL من تدرج الكثافة.
- جهاز طرد مركزي عند 700 × جم لمدة 30 دقيقة (22 درجة مئوية ، 5 حسب الطلب ، 2 ديسمبر).
- اجمع كل البلازما والمعطف المنتفخ الذي يحتوي على الخلايا أحادية النواة المحيطية (PBMCs) دون تعطيل خلايا الدم الحمراء.
- أجهزة الطرد المركزي عند 500 × جم لمدة 10 دقائق (22 درجة مئوية ، 5 حسب الطلب ، 5 ديسمبر) ونضح المادة الطافية.
- اغسل حبيبات PBMC 1x-2x عن طريق تعليقها في 10 مل من RPMI والطرد المركزي عند 500 × جم لمدة 10 دقائق (22 درجة مئوية ، 5 acc ، 5 ديسمبر).
2. الفصل المغناطيسي لخلايا CD14 + و CD3 +
- ضع عمودا في المجال المغناطيسي لفاصل الخلايا المغناطيسية (انظر جدول المواد). اغسل العمود ب 3 مل من RP-5.
- أعد تعليق حبيبات PBMC في 80 ميكرولتر من RP-5 و 20 ميكرولتر من الميكروبيدات المضادة ل CD14 (انظر جدول المواد). احتضان لمدة 15 دقيقة على حرارة 4 درجات مئوية.
- أعد تعليق الخلايا ب 1 مل من RP-5 وقم بتحميل التعليق على العمود. اجمع الخلايا غير المسماة التي تتدفق عبر أنبوب مخروطي سعة 15 مل يسمى "التدفق من خلال 1". انتظر حتى يمر كل تعليق الخلية عبر العمود ، ثم استمر في الغسيل باستخدام 3 مل من RP-5 3x ، مع جمع كل التدفق.
- قم بإزالة العمود بعناية من المجال المغناطيسي وضعه على أنبوب مخروطي جديد سعة 15 مل. أضف 5 مل من RP-5 واستخدم المكبس على الفور لتطهير محتويات العمود في أنبوب تجميع يسمى "CD14 +".
- أجهزة الطرد المركزي "التدفق من خلال 1" عند 500 × جم لمدة 10 دقائق (22 درجة مئوية ، 5 acc ، 5 dec) ونضح المادة الطافية.
- باستخدام خلايا من Flow-through 1 ، كرر الخطوات 2.2-2.5 باستخدام الميكروبيدات المضادة ل CD3 (انظر جدول المواد) لعزل الخلايا التائية.
- أنابيب الطرد المركزي التي تحتوي على الخلايا التائية (CD3 +) والوحيدات (CD14 +) عند 300 × غرام لمدة 5 دقائق. نضح المادة الطافية وإعادة تعليق الحبيبات في 1 مل من RP-5.
- تحديد تركيز الخلية باستخدام مقياس الدم أو عداد الخلايا التلقائي.
ملاحظة: يمكن حساب الخلايا بإضافة 10 ميكرولتر من تخفيف الخلية بنسبة 1:10 أو 1:20 إلى مقياس الدم. يمكن للمرء أن يشير إلى البروتوكولات المنشورة مسبقا لحساب الخلايا باستخدام مقياس الدم36. - ماصة 2.5 مليون خلية وحيدة أو 5 ملايين خلية تائية في أنبوب طرد مركزي جديد. أجهزة طرد مركزي لمدة 30 ثانية عند 2000 × جم ، تستنشق المادة الطافية وتعيد تعليق الخلايا في MiR05 لحجم إجمالي قدره 20 ميكرولتر وتركيز نهائي يبلغ 125 مليون خلية وحيدة أو 250 مليون خلية تائية لكل مل.
ملاحظة: تم اختيار التركيز النهائي لحقن 2.5 مليون خلية وحيدة أو 5 ملايين خلية تائية بحجم 20 ميكرولتر. كما تم اختبار الخلايا التائية الفأرية المعزولة من الطحال باستخدام هذه الطريقة. تم العثور على الإجراء في الملف التكميلي 1.
3. قياس الفلورة عالي الدقة - معايرة مضان الأكسجين و TMRM
ملاحظة: تم تكييف هذه الطريقة من العمل السابق الذي تم إجراؤه على الألياف النفاذية بواسطة فرعون وآخرون .11. يتم استخدام تركيز عال غير مثبط ل TMRM لوضع التبريد ، حيث يتم عكس العلاقة بين تركيز mMP و TMRM في المصفوفة. وبالتالي ، يؤدي انخفاض mMP إلى إطلاق صبغة TMRM من المصفوفة وزيادة في التألق32.
- قم بتركيب غرف سعة 0.5 مل في مقياس التنفس O2K وفقا لتعليمات الشركة المصنعة (انظر جدول المواد). قم بتشغيل الجهاز وتوصيله بالبرنامج الذي توفره الشركة المصنعة للحصول على البيانات.
- اضبط درجة الحرارة على 37 درجة مئوية وسرعة التحريك إلى 750 دورة في الدقيقة.
- اغسل الغرف بالماء المقطر 3x. استبدل الماء ب 0.54 مل من Mir05 ، وأغلق السدادات بالكامل ، وقم بإزالة المخزن المؤقت الزائد باستخدام نظام الشفط المتكامل (ISS). ارفع السدادات للسماح لأكسجين الغرفة بالتوازن مع أكسجين الغرفة باستخدام فاصل سدادة.
- بمجرد استقرار تدفق الأكسجين ، قم بإجراء معايرة الأكسجين في الهواء (R1) وفقا لتعليمات الشركة المصنعة.
ملاحظة: قد يستغرق الأمر >30 دقيقة حتى يستقر تدفق الأكسجين. تتطلب مستشعرات الأكسجين تحديد الأكسجين من نقطة الصفر (R0) وتدفق الأكسجين في الخلفية من 50-200 ميكرومتر من تجارب منفصلة باستخدام معايرة الديثيونيت. يمكن العثور على طرق محددة في دليل الشركة المصنعة. - أغلق الحجرة عن طريق إغلاق السدادات.
ملاحظة: على عكس التجارب التي تستخدم الألياف النفاذية ، لا تتطلب الغرف فرط الأوكسجين ل PBMCs. يوفر إغلاق الغرفة بعد معايرة R1 أكسجينا كافيا للتجربة. يجب الحفاظ على مستويات الأكسجين بين 50-250 ميكرومتر. إذا انخفض تركيز الأكسجين إلى ما دون العتبة ، فيمكن فتح الحجرة جزئيا بحيث يمكن لأكسجين الغرفة أن يتوازن مع أكسجين هواء الغرفة. - معايرة TMRM
- استخدم مستشعرات الفلور LED الخضراء (على سبيل المثال 525 نانومتر) مع مجموعة مرشحات AmR (انظر جدول المواد). اضبط كسب مقياس الفلور على 1000 والشدة على 1000. قم بتشغيل مستشعرات الفلو وابدأ في تسجيل خط الأساس.
- حقن 2.5 ميكرولتر من 0.05 mM TMRM والسماح للإشارة بالاستقرار (~ 2 دقيقة) قبل الحقن التالي 2.5 ميكرولتر حتى يتم إجراء ما مجموعه 4 حقن لتركيز TMRM الكلي من 1 μM TMRM في الغرفة. استخدم حقنة هاميلتون لجميع الحقن.
- قم بمعايرة مستشعر الفلو عن طريق اختيار إشارة الفلورسنت (الجهد) لكل حقنة تمثل 0 و 0.25 و 0.5 و 0.75 و 1.0 ميكرومتر من TMRM لمعايرة من خمس نقاط.
4. بروتوكول معايرة مثبطات الركيزة (SUIT)
ملاحظة: قم بإجراء تجارب فارغة حيث يتم حقن 20 ميكرولتر من Mir05 في الغرفة بدلا من 20 ميكرولتر من تعليق الخلية ، حيث ستتغير إشارة TMRM استجابة للحقن وحدها (تمت مناقشتها في النتائج التمثيلية). اسمح لإشارة تدفق الأكسجين بالاستقرار (حوالي 2-3 دقائق) قبل الحقن التالي لكل من التجارب الفارغة والعينة. ويرد في الجدول 1 بروتوكول المعايرة بالتحليل الحجمي التالي والملاحظات المتوقعة.
- بمجرد استقرار تدفق الأكسجين ، حدد وتسمية كل من تدفق الأكسجين وإشارة TMRM "خلية مسبقة".
- حقن معلق الخلية التي تحتوي إما على 5 ملايين خلية تائية أو 2.5 مليون خلية وحيدة في ~ 20 ميكرولتر وقياس لمدة 10 دقائق. حدد وقم بتسمية كل من تدفق الأكسجين وإشارة TMRM باسم "الخلية".
- تتخلل الخلايا عن طريق حقن 2 ميكرولتر من 1 ملغ / مل ديجيتونين (التركيز النهائي: 4 ميكروغرام / مل). انتظر لمدة 20 دقيقة. حدد وقم بتسمية كل من تدفق الأكسجين وإشارة TMRM على أنها "حفر".
ملاحظة: يقترح تحسين تركيز الديجيتونين في تجارب منفصلة. - أضف 2.5 ميكرولتر من سكسينات 1 م (التركيز النهائي: 5 مللي مول). حدد وتسمية كل من تدفق الأكسجين وإشارة TMRM باسم "SUCC".
- بمجرد استقرار تدفق الأكسجين ، أضف 5 ميكرولتر من 100 mM malate (التركيز النهائي: 1.0 mM) ، و 5 μL من 1 M glutamate (التركيز النهائي: 10 mM) ، و 5 μL من 500 mM pyruvate (التركيز النهائي: 5 mM). حدد وقم بتسمية كل من تدفق الأكسجين وإشارة TMRM باسم "MPG".
- بمجرد استقرار تدفق الأكسجين، قم بمعايرة جزيء ADP . حدد معدلات كل معايرة بالتحليل الحجمي وقم بتسميتها "D" بالتتابع من 1 إلى 10، بناء على عدد عمليات المعايرة. استخدم مخطط المعايرة بالتحليل الحجمي في الجدول 2.
- بمجرد استقرار تدفق الأكسجين، قم بإجراء سلسلة من المعايرة بالتحليل الحجمي 1 ميكرولتر من 0.25 مللي متر من سيانيد الكربونيل p- (ثلاثي فلوروميثوكسي) فينيل هيدرازون (FCCP) حتى تصل إشارة الفلورسنت إلى الحد الأقصى. حدد وقم بتسمية كل من تدفق الأكسجين وإشارة TMRM التي تمثل الحد الأدنى من إمكانات الغشاء وقم بتسميتها "FCCP".
ملاحظة: عادة ما يكون تركيز FCCP من 0.5-1.0 ميكرومتر مطلوبا لاستنفاد إمكانات غشاء الميتوكوندريا.
تنبيه: FCCP سام. ارجع إلى صحيفة بيانات السلامة (SDS) للتعامل معها بشكل صحيح. - اختياري: بمجرد استقرار تدفق الأكسجين ، قم بحقن 1 ميكرولتر من 0.25 مللي متر روتينون لتثبيط المركب I وتحديد القدرة التنفسية من خلال المركب II.
ملاحظة: لم تعد التغييرات في جهد الغشاء ذات صلة بعد المعايرة بالتحليل الحجمي باستخدام جهاز فك التوصيل.
تنبيه: روتينون سام. ارجع إلى SDS للتعامل السليم. - بمجرد استقرار تدفق الأكسجين ، قم بحقن 1 ميكرولتر من 1.25 mM (التركيز النهائي: 2.5 μM) من Antimycin A لتثبيط تنفس الميتوكوندريا.
تنبيه: مضاد الميسين أ سام. ارجع إلى SDS للتعامل السليم.
5. حساب إمكانات غشاء الميتوكوندريا وتحليلها
- باستخدام تجارب فارغة ، سجل قيم TMRM المعايرة (micromolar TMRM) قبل حقن العينة الفارغة ("العينة المسبقة") ولكل حقنة. انظر الشكل 2.
- لكل تجربة فارغة ، احسب نسبة الخلفية عن طريق تعيين تركيز TMRM "قبل العينة" على 1.0. احسب الانخفاض النسبي اللاحق في TMRM. احسب متوسط نسبة الخلفية من جميع التجارب الفارغة.
ملاحظة: قد يعتمد عدد التجارب الفارغة المراد تضمينها على دقة الأداة. راجع مثال الحساب في الجدول 3 من خمس تجارب فارغة مختلفة، حيث انخفض الانحراف المعياري لمتوسط نسبة الخلفية بين 0 و0.016 لكل معايرة بالتحليل الحجمي. - حساب الخلفية: احسب الخلفية لكل تجربة عينة بضرب TMRM "قبل العينة" لتجربة العينة في متوسط نسبة الخلفية لكل حقنة. انظر مثال الحساب في الجدول 3.
- تصحيح الخلفية: اطرح خلفية التجربة إلى قيم TMRM المقاسة للعينة. انظر مثال الحساب في الجدول 4.
- تصحيح FCCP: اطرح mMP المصحح في الخلفية FCCP من كل حقنة. انظر مثال الحساب في الجدول 4.
- منحنى حساسية ADP: تطبيع الانخفاض المدفوع ب ADP في mMP عن طريق تعيين أعلى وأدنى جهد غشاء بنسبة 100٪ و 0٪ على التوالي ، باستخدام قيم mMP التي تم جمعها خلال معايرة ADP. قم بملاءمة البيانات في نموذج انحدار ملاءمة غير خطي باستخدام البرنامج الإحصائي المفضل لحساب التركيز المثبط نصف الأقصى (IC50) ل ADP على mMP.
ملاحظة: يناسب المنحنى [المانع] مقابل الاستجابة الطبيعية - المنحدر المتغير في المنشور.
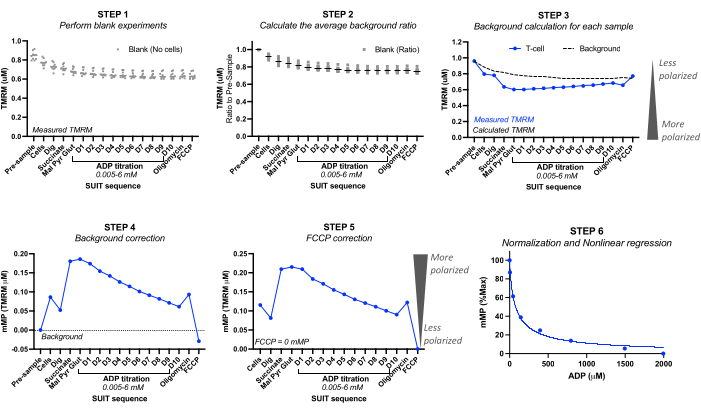
الشكل 2: حساب جهد غشاء الميتوكوندريا (mMP) وحساسية ADP من مضان TMRM. خطوات حساب جهد غشاء الميتوكوندريا (mMP) وحساسية ADP من قياسات مضان TMRM بواسطة قياس الفلورة عالي الدقة لعينة واحدة من الخلايا التائية (n = 1). الخطوة 1: يتم قياس مضان TMRM في عينات فارغة كما هو الحال في العينة البيولوجية. الخطوة 2: حدد النسبة في إشارة TMRM مع كل معايرة بالنسبة للإشارة قبل العينة لكل تجربة فارغة. احسب المتوسط لكل معايرة لجميع التجارب الفارغة. الخطوة 3: احسب الخلفية لكل تجربة عينة بضرب مضان "ما قبل العينة" في متوسط نسبة الخلفية لكل معايرة. الخطوة 4: احسب الفرق بين الخلفية وعينة مضان TMRM لكل معايرة للتعبير عن البيانات على صورة mMP أو امتصاص TMRM للميتوكوندريا. الخطوة 5: تصحيح mMP بحيث يعكس فك الارتباط الكامل مع FCCP صفر mMP. الخطوة 6: إجراء الانحدار غير الخطي لرسم التغييرات في mMP مع زيادة تركيزات ADP. تم إجراء القياسات في غرف سعة 0.5 مل ، تحتوي إحداها على 5 ملايين خلية تائية من متطوع سليم. يتم التعبير عن متوسط البيانات كمتوسط ± SEM. يتم التعبير عن نقاط البيانات الفردية لنسخة متماثلة واحدة بدون أشرطة خطأ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
لتوضيح الاختلافات في تركيز الخلايا الأمثل للفحص ، تم تحميل 5 ملايين خلية تائية في غرفة واحدة سعة 0.5 مل (10 ملايين خلية / مل) ، وتم تحميل 1.25 مليون خلية في غرفة أخرى (2.5 مليون خلية / مل) تحتوي على 1 ميكرومتر TMRM (الشكل 3A-G). كما أدرجت ثلاث تجارب فارغة لحساب خلفية آلية استعراض آلية استعراض الأسلحة المؤقتة. وجدنا أن التركيز العالي للخلايا التائية أدى إلى تغيير أكثر وضوحا في مضان TMRM بالنسبة للخلفية (الشكل 3B ، D). بالإضافة إلى ذلك ، سمح لنا تركيز الخلية العالي باكتشاف الزيادة المتوقعة في استهلاك الأكسجين والنضوب المتزامن ل mMP استجابة لإضافة FCCP (الشكل 3E ، F). أدى استخدام تركيز منخفض من الخلايا إلى تغيير ضعيف في التألق الموازي للخلفية. نظرا لأن حساب mMP يطرح الخلفية من الإشارة ، فإن تركيز الخلية المنخفض لا يسمح بتحديد التغييرات في mMP استجابة للركائز وأجهزة فك التوصيل. بالإضافة إلى استخدام التركيزات الأعلى للخلايا في هذا الفحص ، نوصي بالحفاظ على تركيز الخلية ثابتا لكل نوع خلية بين التجارب.
للتحقق من تأثير ATP-synthase في تبديد mMP مع معايرة ADP ، أجرينا تجارب متوازية على PBMCs والخلايا التائية حيث تلقت غرفة واحدة oligomycin قبل معايرة ADP (الشكل 4). لم نجد أي تبديد ل mMP استجابة ل ADP في الخلايا المعالجة بقليل الميزوميسين ، مما يشير إلى أن الانخفاض التدريجي في mMP مع ADP هو نتيجة لتدفق البروتون من خلال ATP-synthase (الشكل 4A-F). قارنا أيضا حساسية ADP بين الخلايا التائية و PBMCs لنفس المشارك ووجدنا أن حساسية ADP أقل (أعلى EC50) في جزء الخلايا التائية (الشكل 4G ، H).
أجرينا سلسلة من التجارب الفارغة لتحديد تأثير الوقت أو بروتوكول SUIT على مضان TMRM. وجدنا أن إشارة TMRM في التجارب الفارغة تتأثر في الغالب بمعايرة SUIT (الشكل 5A) بدلا من توقيت المعايرات (الشكل 5B).
قارنا التغيرات المدفوعة ب ADP في معدلات استهلاك الأكسجين (OCR) وفي mMP في الخلايا التائية والوحيدات من 11 متطوعا صحيا يسكنون المجتمع (الشكل 6A-H). على غرار نتائج التجارب المنشورة سابقا باستخدام التدفق خارج الخلية والمقايسات الأنزيمية ، أظهرت الخلايا الوحيدة قدرة تنفسية أكبر للميتوكوندريا من الخلايا الليمفاوية26,27 (الشكل 6A ، H). ومع ذلك ، لم نكتشف زيادة نموذجية في الاستجابة للجرعة في التعرف الضوئي على الحروف مع ADP في أي من نوعي الخلايا (الشكل 6C ، D) ، على عكس ما تظهره هذه الطريقة عند استخدام الأنسجة الأيضية العالية مثل كبد الفأر (الشكل 7A-H). من ناحية أخرى ، سمح لنا استخدام TMRM باكتشاف انخفاض تدريجي في mMP مع ADP في الخلايا المناعية البشرية (الشكل 6E-G) وفي الخلايا التائية الطحالية من الفئران (الشكل 7E-H). على الرغم من أننا لم نقارن مباشرة الخلايا التائية البشرية والفأرية باستخدام نفس بروتوكول المعايرة ، فقد وجدنا أن IC50 للخلايا التائية للفأر كان أقل بعامل 10 مقارنة بالخلايا التائية المنتشرة من البشر.
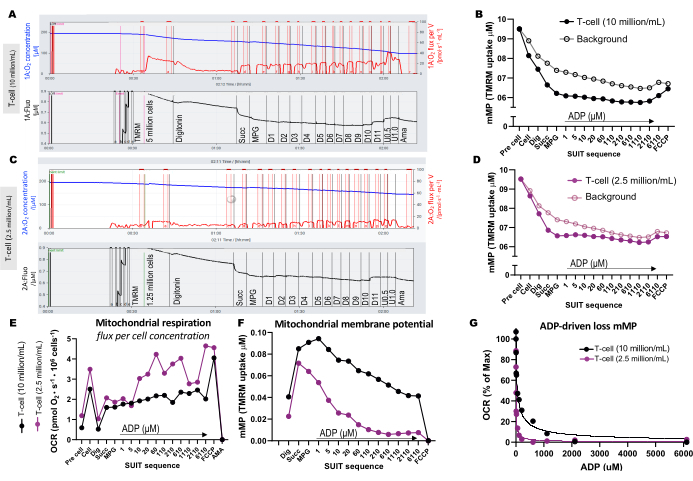
الشكل 3: تجارب قياس الفلورة عالية الاستبانة. (A-D) تتبع تجارب قياس الفلورة عالية الدقة باستخدام تركيزات الخلايا التائية من 10 ملايين خلية / مل و 2.5 مليون خلية / مل في غرف 0.5 مل. أ: 10 ملايين خلية/مل في حجرات سعة 0.5 مل. ج: 2.5 مليون خلية/مل في حجرات سعة 0.5 مل. يظهر تدفق الأكسجين (pmol / s / mL) في اللوحة العلوية (أحمر) ، وتظهر إشارة TMRM المعايرة في اللوحة السفلية (أسود). تم رسم التغييرات في TMRM في جميع أنحاء SUIT للعينة وخلفيتها المحسوبة للغرف التي تحتوي على (B) 10 ملايين خلية / مل و (D) 2.5 مليون خلية / مل. (ه) لكل تركيز خلية، تم حساب تدفق الأكسجين (pmol/s/million خلية) وجهد غشاء الميتوكوندريا (F). (ز) تم رسم منحنى حساسية ADP وملاءمته لنموذج الانحدار غير الخطي (الخطوط الصلبة). الاختصارات: mMP, غشاء الميتوكوندريا المحتملة; TMRM ، رباعي ميثيل رودامين ميثيل استر ؛ SUIT ، معايرة مثبطات الركيزة ؛ ADP ، أدينوسين ثنائي الفوسفات. حفر ، ديجيتونين. مال ، مالات. بير ، البيروفات. تخمة ، الغلوتامات. D1-11، 11 معايرة متتالية للفريق العامل المخصص المعني بالتنمية (ADP)؛ U ، فك اقتران FCCP من 0.5 و 1.0 ميكرومتر ؛ AMA ، أنتيميسين أ. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
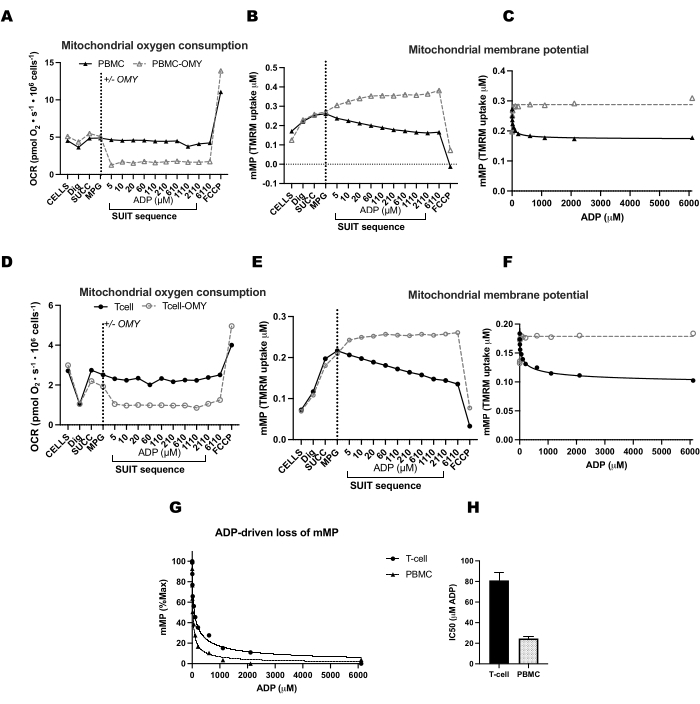
الشكل 4: يؤدي ATP-synthase إلى انخفاض جهد الغشاء المدفوع ب ADP في الخلايا التائية و PBMCs. (أ-ح) تم اختبار البروتوكول الموصوف هنا في PBMCs والخلايا التائية. تم حقن غرفتين O2K مع PBMCs ، وتم حقن غرفتين من O2K إضافية بخلايا T من نفس المشارك. بعد حقن ركائز مالات ، بيروفات ، وغلوتامات في جميع الغرف ، تلقت غرفة واحدة من PBMCs والخلايا التائية oligomycin. منع Oligomycin أي ارتفاع مدفوع ب ADP في التنفس في (A) PBMCs و (D) الخلايا التائية أو انخفاض في إمكانات غشاء الميتوكوندريا في (B ، C) PBMCs و (E ، F) الخلايا التائية. (ز ، ح) كانت حساسية ADP أكبر في PBMCs مقارنة بالخلايا التائية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
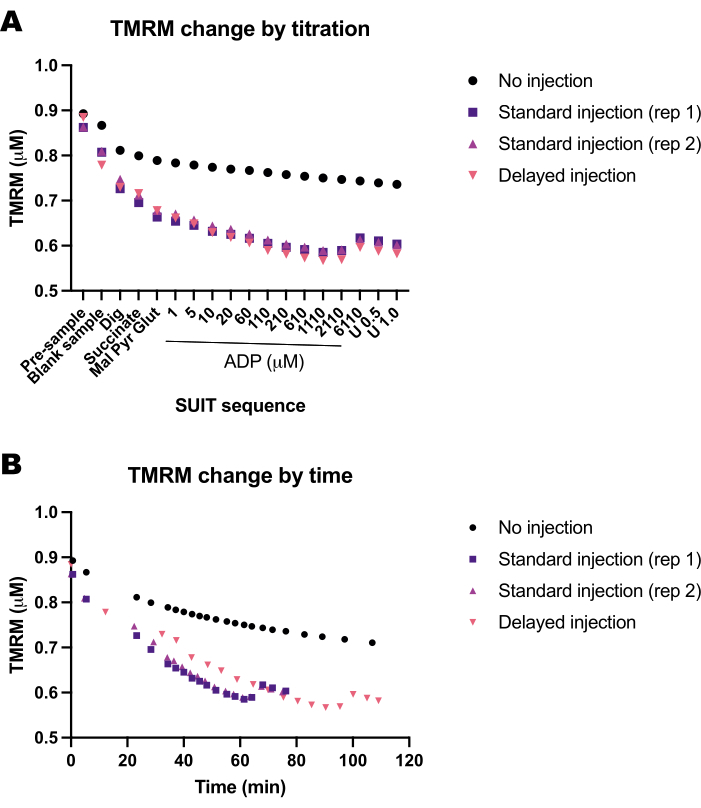
الشكل 5: تظهر التجارب الفارغة التغير في مضان TMRM استجابة للوقت ومعايرة الركائز وأجهزة فك التوصيل والمثبطات (SUIT). (أ) التغير في مضان TMRM استجابة للمعايرة. (ب) التغير في مضان TMRM استجابة للوقت. أجريت التجارب في غرف 0.5 مل مملوءة ب Mir05 تحتوي على 1 ميكرومتر TMRM. لم تتلق غرفة واحدة أي معايرة SUIT (بدون حقن) ؛ تلقت غرفتان في صكين مختلفين بروتوكول بدلة قياسي (حقن قياسي) ؛ تلقت غرفة واحدة نفس معايرة SUIT ولكن مع تأخير بين كل حقنة (الحقن المتأخر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
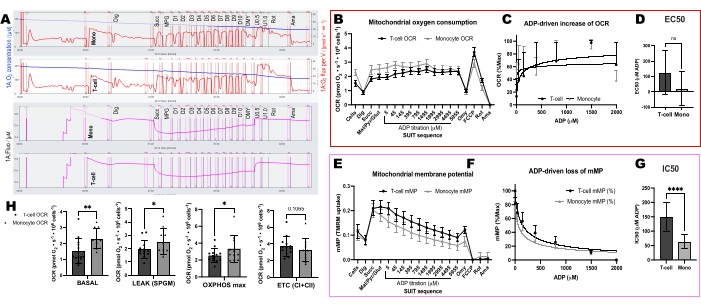
الشكل 6: الاختلافات في حساسية ADP بين الخلايا التائية والوحيدات باستخدام OCR و mMP. (أ) تتبع تجربة قياس الفلورة عالية الدقة من عينة الخلية الوحيدة والخلايا التائية للموضوع. (ب) استهلاك الأكسجين في الخلايا الوحيدة (ن = 11) والخلايا التائية (ن = 13) من دم المتطوعين الأصحاء. (ج، د) تركيب الانحدار غير الخطي للارتفاع المرسوم في التنفس باستخدام معايرة ADP لحساب EC50. ه: القياس المتزامن لجهد غشاء الميتوكوندريا. (و ، ز) تركيب الانحدار غير الخطي للانخفاض المرسوم في إمكانات غشاء الميتوكوندريا مع معايرة ADP لحساب IC50. (ح) بارامترات القدرة التنفسية للوحيدات والخلايا التائية. يتم التعبير عن البيانات كمتوسط ± SEM للرسوم البيانية الخطية ومتوسط ± SD للرسوم البيانية الشريطية. يتم التعبير عن الفروق ذات الدلالة الإحصائية بعد اختبارات t ك * p < 0.05. ** p < 0.01 ، و **** p < ل 0.0001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
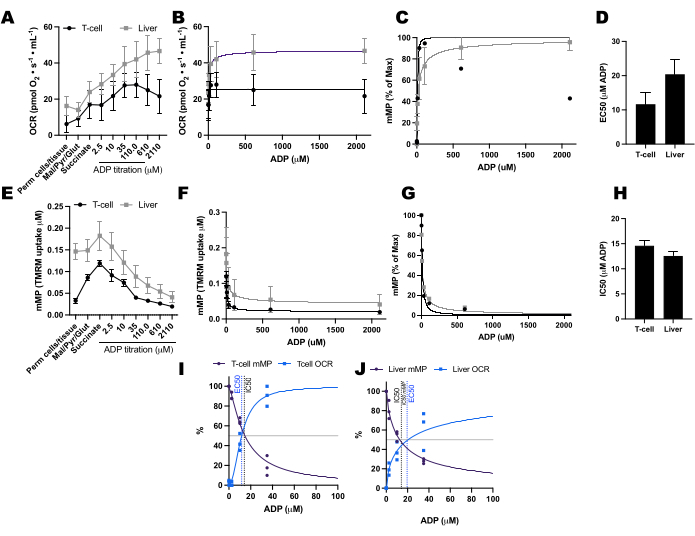
الشكل 7: مقارنة استجابة جزيء ADP في التنفس وجهد غشاء الميتوكوندريا (mMP) في الخلايا التائية الطحالية للفأر والكبد. (A-D) الاستجابة في التنفس في الخلايا التائية الطحالية للفأر النفاذية والكبد. (ه-ح) الاستجابة في mMP في الخلايا التائية الطحالية للفأر المتغلغلة والكبد. تم تشريح الكبد الطازج والطحال من ثلاثة فئران بعد خلع عنق الرحم. تم عزل الخلايا التائية الطحالية باستخدام فصل الحبيبات المغناطيسية المترافقة بالأجسام المضادة. خضعت كلتا العينتين لنفس بروتوكول SUIT في وجود 1 μM TMRM. (ط، ي) مقارنة EC50 محسوبة من الزيادة في استهلاك الأكسجين (OCR) و IC50 من الانخفاض في mMP استجابة ل ADP. N = 3 لكل مجموعة. يتم التعبير عن البيانات كمتوسط ± SEM. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: مثال على بروتوكول SUIT لتقييم إمكانات غشاء الميتوكوندريا في الخلايا التائية المعزولة حديثا والوحيدات باستخدام غرف 0.5 مل. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: معايرة ADP الموصى بها لحجرة 0.5 مل. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 3: حساب متوسط نسبة الخلفية باستخدام خمس تجارب فارغة مستقلة. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 4: حساب جهد غشاء الميتوكوندريا (mMP) من تجربة العينة. الرجاء الضغط هنا لتنزيل هذا الجدول.
الشكل التكميلي 1: تأثير Mir05 و DMSO على تنفس الميتوكوندريا وجهد الغشاء. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 1: إعداد الكاشف وبروتوكول عزل الخلايا التائية من طحال الفأر. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يستخدم هذا البروتوكول قياس الفلورة عالي الدقة لقياس حساسية استجابة الميتوكوندريا للطلب على الطاقة عن طريق قياس تبديد mMP استجابة لزيادة مستويات ADP في PBMCs ، وحيدات ، والخلايا التائية. يتم ذلك عن طريق إضافة ركائز معقدة I و II لزيادة جهد غشاء الميتوكوندريا ومعايرة ADP لتحفيز ATP-synthase تدريجيا لاستخدام تدرج البروتون لتوليد ATP.
تشمل الخطوات الحاسمة في البروتوكول ضبط كسب وشدة الفلوروفور على 1000 والتأكد من الحصول على إشارة الفلورسنت TMRM أثناء معايرة TMRM. نظرا لأن مضان TMRM ينخفض بعد كل معايرة (أحد قيود هذه الطريقة) ، فمن الضروري إجراء تجارب الخلفية باستخدام عينات فارغة. لقد وجدنا أيضا أن DMSO له تأثير مثبط على التنفس الميتوكوندريا وإمكانات الغشاء ، وبالتالي ، نوصي بتخفيف محلول عمل TMRM في Mir05 (الشكل التكميلي 1).
بعض التعديلات التي يمكن استخدامها عند تجربة هذا البروتوكول هي ضبط تركيزات الخلايا واستخدام غرفة 2 مل القياسية. ومع ذلك ، فإن غرفة 0.5 مل مفضلة للخلايا التائية والوحيدات بسبب التركيز العالي للخلايا اللازمة للاستجابة المثلى في إمكانات الغشاء وتدفق الأكسجين. قد يكون التركيز المنخفض للخلايا هو الأمثل عند اختبار الخلايا ذات السعة التنفسية الأكبر ، مثل البلاعم.
تشمل القيود الإضافية للطريقة المعروضة هنا متطلبات ما لا يقل عن 5 ملايين خلية تائية و 2.5 مليون خلية وحيدة. يمكننا في كثير من الأحيان الحصول على خلايا كافية من ~ 20 مل من الدم من المشاركين الأصحاء ، ولكن هذه الأرقام يمكن أن تختلف حسب الحالة الصحية والعمر والجنس26. بالإضافة إلى ذلك ، كما هو الحال في معظم طرق تقييم قدرة الميتوكوندريا ، يجب عزل الخلايا حديثا. ومع ذلك ، يمكن تجربة هذه الطريقة في الخلايا المحفوظة بالتبريد في المستقبل. بالمقارنة مع العائد من دم الإنسان ، فإن إنتاج الخلايا التائية من طحال الفئران السليمة مرتفع بما يكفي لإجراء هذا الفحص.
تعتمد الخلايا التائية المنتشرة ، وخاصة الذاكرة طويلة العمر (TM) والخلايا التنظيمية (Treg) ، على الفسفرة التأكسدية للحصول على الطاقة37. في حين أن الطلب على الطاقة واستهلاك الأكسجين منخفضان (على سبيل المثال ، مقارنة بعضلات الراحة) ، فإن بقائهم ضروري لاستجابة مناعية فعالة لإعادة العدوى والسرطان38،39،40. يؤدي انخفاض الفسفرة التأكسدية للخلايا التائية إلى ضعف القدرة التكاثرية ويعزز استنفاد الخلايا التائية والشيخوخة 5,41. بالإضافة إلى ذلك ، يعزز فرط استقطاب الميتوكوندريا الإنتاج المستدام للسيتوكينات (IL-4 و IL-21) بواسطة الخلايا التائية CD4 المستجيبة أثناء التنشيط42. عند الإصابة ، يمكن أن تصل متطلبات الطاقة لتنشيط وتكاثر الخلايا المناعية إلى 25٪ -30٪ من معدل الأيض الأساسي43. لذلك ، تعمل الخلايا المناعية في نطاق واسع ومتطرف من متطلبات الطاقة ، ويمكن لهذا البروتوكول اختبار استجابات الميتوكوندريا ضمن هذا النطاق.
الالتهاب المزمن هو سمة شائعة للسمنة والسكري والشيخوخة. المستويات غير المنظمة للهرمونات المنتشرة والدهون والجلوكوز لها تأثيرات جهازية وبالتالي يمكن أن تؤثر على كيفية استجابة الميتوكوندريا لتحدي نشط. هنا ، قدمنا طريقة لتقييم حساسية ADP للميتوكوندريا في تعميم PBMCs. هناك حاجة إلى مزيد من الدراسات لتحديد كيفية تعديل حساسية ADP في أمراض التمثيل الغذائي وكيف تؤثر على الحالة الصحية.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نود أن نشكر المتطوعين الطيبين الذين تبرعوا بالدم لهذا المشروع. كما نعرب عن خالص تقديرنا للدكتورة إلين شور وفريقها لتزويدنا بعينات إضافية من دراستهم. نود أيضا أن نشكر أندرو كيرش على مراجعة المخطوطة وتحريرها للتأكد من وضوحها. تم دعم هذا العمل من قبل مصادر التمويل التالية: P01AG001751 ، R01AG078279 ، P30AR074990 ، P30DK035816 ، P30DK017047 ، R01DK089036 ، K01HL154761 ، T32AG066574.
Materials
| Name | Company | Catalog Number | Comments |
| Adenosine Diphosphate | Sigma-Aldrich | A5285 | Fluorespirometry |
| Antimycin A | Sigma-Aldrich | A8674 | Fluorespirometry |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A6003 | Mir05 buffer |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | Cell isolation |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920 | Fluorespirometry |
| Cell strainers | Fisher Scientific | 22-363-548 | Isolation of T-cells from mouse spleen protocol |
| CD14 Microbeads, human | Miltenyi Biotec | 130-050-201 | Cell isolation |
| CD3 Microbeads, human | Miltenyi Biotec | 130-050-101 | Cell isolation |
| DatLab | Oroboros | Version 8 | |
| Digitonin | Sigma-Aldrich | D141 | Fluorespirometry |
| D-Sucrose | Sigma-Aldrich | 84097 | Mir05 buffer |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N′,N′-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | Mir05 buffer |
| Filter Set AmR | Oroboros | 44321-01 | |
| HBSS (10x) | Gibco | 12060-040 | |
| HEPES sodium salt | Sigma-Aldrich | H7523 | Mir05 buffer |
| Histopaque 1077 | Sigma-Aldrich | 10771 | Cell isolation |
| K2EDTA blood collection tubes | BD Vacutainer | 366643 | Cell isolation |
| Lactobionic acid | Sigma-Aldrich | 153516 | Mir05 buffer |
| L-Glutamic acid | Sigma-Aldrich | G1626 | Fluorespirometry |
| L-Malic Acid | Sigma-Aldrich | M1000 | Fluorespirometry |
| LS Columns | Miltenyi Biotec | 130-042-401 | Cell isolation |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | M9272 | Mir05 buffer |
| Multi-MACS stand and MidiMACS Separator | Miltenyi Biotec | 130-042-301 | Cell isolation |
| O2k-Fluo Smart-Module | Oroboros | 12100-03 | |
| O2k-FluoRespirometer series J | Oroboros | 10201-03 | |
| O2k-sV-Module (0.5 chamber) | Oroboros | 11200-01 | |
| Oligomycin | Sigma-Aldrich | 04876 | Fluorespirometry |
| Pan T Cell Isolation Kit II, mouse | Miltenyi | 130095130 | Isolation of T-cells from mouse spleen protocol |
| Potassium dihydrogen phosphate (KH2PO4) | Sigma-Aldrich | P0662 | Mir05 buffer |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473 | Mir05 buffer |
| Prism | GraphPad | Version 10 | |
| Rotenone | Sigma-Aldrich | R8875 | Fluorespirometry |
| RPMI Buffer | Corning | 17-105-CV | Cell isolation |
| Sodium Pyruvate | Sigma-Aldrich | P2256 | Fluorespirometry |
| Succinate disodium salt | Sigma-Aldrich | S2378 | Fluorespirometry |
| Taurine | Sigma-Aldrich | T0625 | Mir05 buffer |
| Tetramethyrhodamine methyl ester perchlorite | Sigma-Aldrich | T5428 | Fluorespirometry |
References
- Eisner, V., Picard, M., Hajnóczky, G. Mitochondrial dynamics in adaptive and maladaptive cellular stress responses. Nat Cell Biol. 20 (7), 755-765 (2018).
- Sokolova, I. Bioenergetics in environmental adaptation and stress tolerance of aquatic ectotherms: linking physiology and ecology in a multi-stressor landscape. J Exp Biol. 224, 236802 (2021).
- Buttgereit, F., Brand, M. D. A hierarchy of ATP-consuming processes in mammalian cells). Biochem J. 312, 163-167 (1995).
- Schmid, D., Burmester, G. R., Tripmacher, R., Kuhnke, A., Buttgereit, F. Bioenergetics of human peripheral blood mononuclear cell metabolism in quiescent, activated, and glucocorticoid-treated states. Biosci Rep. 20 (4), 289-302 (2000).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21 (9), 1022-1033 (2020).
- Nelson, S. R., Li, A., Beck-Previs, S., Kennedy, G. G., Warshaw, D. M. Imaging ATP consumption in resting skeletal muscle: One molecule at a time. Biophys J. 119 (6), 1050-1055 (2020).
- Meyrat, A., von Ballmoos, C. ATP synthesis at physiological nucleotide concentrations. Sci Rep. 9 (1), 3070 (2019).
- Gouspillou, G., et al. Accurate determination of the oxidative phosphorylation affinity for ADP in isolated mitochondria. PLoS One. 6 (6), e20709 (2011).
- Holloway, G. P., et al. Age-associated impairments in mitochondrial ADP sensitivity contribute to redox stress in senescent human skeletal muscle. Cell Rep. 22 (11), 2837-2848 (2018).
- Pharaoh, G., Brown, J., Ranjit, R., Ungvari, Z., Van Remmen, H. Reduced adenosine diphosphate sensitivity in skeletal muscle mitochondria increases reactive oxygen species production in mouse models of aging and oxidative stress but not denervation. JCSM Rapid Commun. 4 (1), 75-89 (2021).
- Pharaoh, G., et al. The mitochondrially targeted peptide elamipretide (SS-31) improves ADP sensitivity in aged mitochondria by increasing uptake through the adenine nucleotide translocator (ANT). Geroscience. 45 (6), 3529-3548 (2023).
- Brunetta, H. S., Petrick, H. L., Vachon, B., Nunes, E. A., Holloway, G. P. Insulin rapidly increases skeletal muscle mitochondrial ADP sensitivity in the absence of a high lipid environment. Biochem J. 478 (13), 2539-2553 (2021).
- Brunetta, H. S., et al. Nitrate consumption preserves HFD-induced skeletal muscle mitochondrial ADP sensitivity and lysine acetylation: A potential role for SIRT1. Redox Biol. 52, 102307 (2022).
- Tyrrell, D. J., et al. Blood-cell bioenergetics are associated with physical function and inflammation in overweight/obese older adults. Exp Gerontol. 70, 84-91 (2015).
- Liepinsh, E., et al. Low-intensity exercise stimulates bioenergetics and increases fat oxidation in mitochondria of blood mononuclear cells from sedentary adults. Physiol Rep. 8 (12), e14489 (2020).
- Hedges, C. P., et al. Peripheral blood mononuclear cells do not reflect skeletal muscle mitochondrial function or adaptation to high-intensity interval training in healthy young men. J Appl Physiol. 126 (2), 454-461 (2019).
- DeConne, T. M., Muñoz, E. R., Sanjana, F., Hobson, J. C., Martens, C. R. Cardiometabolic risk factors are associated with immune cell mitochondrial respiration in humans. Am J Physiol Heart Circ Physiol. 319 (2), H481-H487 (2020).
- Zhou, B., et al. Boosting NAD level suppresses inflammatory activation of PBMCs in heart failure. J Clin Invest. 130 (11), 6054-6063 (2020).
- Altintas, M. M., DiBartolo, S., Tadros, L., Samelko, B., Wasse, H. Metabolic changes in peripheral blood mononuclear cells isolated from patients with end stage renal disease. Front Endocrinol (Lausanne). 12, 629239 (2021).
- Pence, B. D., Yarbro, J. R. Aging impairs mitochondrial respiratory capacity in classical monocytes). Exp Gerontol. 108, 112-117 (2018).
- vander Windt, G. J. W., Chang, C. H., Pearce, E. L. Measuring bioenergetics in T Cells using a Seahorse extracellular flux analyzer. Curr Protoc Immunol. 113, 11-14 (2016).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab Invest. 93 (6), 690-700 (2013).
- Buck, M. D., et al. Mitochondrial dynamics controls T Cell fate through metabolic programming. Cell. 166 (1), 63-76 (2016).
- Quinn, K. M., et al. Metabolic characteristics of CD8. Nat Commun. 11 (1), 2857 (2020).
- Scandalis, L., et al. Skeletal muscle mitochondrial respiration and exercise intolerance in patients with heart failure with preserved ejection fraction. JAMA Cardiol. 8 (6), 575-584 (2023).
- Rausser, S., et al. Mitochondrial phenotypes in purified human immune cell subtypes and cell mixtures. Elife. 10, e70899 (2021).
- Kramer, P. A., et al. Bioenergetics and the oxidative burst: protocols for the isolation and evaluation of human leukocytes and platelets. J Vis Exp. (85), e51301 (2014).
- Kramer, P. A., Ravi, S., Chacko, B., Johnson, M. S., Darley-Usmar, V. M. A review of the mitochondrial and glycolytic metabolism in human platelets and leukocytes: implications for their use as bioenergetic biomarkers. Redox Biol. 2, 206-210 (2014).
- Teodoro, J. S., Machado, I. F., Castela, A. C., Rolo, A. P., Palmeira, C. M. The evaluation of mitochondrial membrane potential using fluorescent dyes or a membrane-permeable cation (TPP+) electrode in isolated mitochondria and intact cells. Methods Mol Biol. 2184, 197-213 (2020).
- Hassan, H., Zakaria, F., Makpol, S., Karim, N. A. A link between mitochondrial dysregulation and idiopathic autism spectrum disorder (ASD): Alterations in mitochondrial respiratory capacity and membrane potential. Curr Issues Mol Biol. 43 (3), 2238-2252 (2021).
- Williams, A. S., et al. Disruption of Acetyl-Lysine turnover in muscle mitochondria promotes insulin resistance and redox stress without overt respiratory dysfunction. Cell Metab. 31 (1), 131-147 (2020).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods Enzymol. 542, 163-181 (2014).
- Chowdhury, S. R., Djordjevic, J., Albensi, B. C., Fernyhough, P. Simultaneous evaluation of substrate-dependent oxygen consumption rates and mitochondrial membrane potential by TMRM and safranin in cortical mitochondria. Biosci Rep. 36 (1), 00286 (2015).
- Vianello, C., et al. High-throughput microscopy analysis of mitochondrial membrane potential in 2D and 3D models. Cells. 12 (7), (2023).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- JoVE, Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE. , (2023).
- Geltink, R. I. K., Kyle, R. L., Pearce, E. L. Unraveling the complex interplay between T cell metabolism and function. Annu Rev Immunol. 36, 461-488 (2018).
- Sukumar, M., et al. Inhibiting glycolytic metabolism enhances CD8+ T cell memory and antitumor function. J Clin Invest. 123 (10), 4479-4488 (2013).
- Gerriets, V. A., et al. Foxp3 and Toll-like receptor signaling balance T. Nat Immunol. 17 (12), 1459-1466 (2016).
- MacIver, N. J., Michalek, R. D., Rathmell, J. C. Metabolic regulation of T lymphocytes. Annu Rev Immunol. 31, 259-283 (2013).
- Desdín-Micó, G., et al. T cells with dysfunctional mitochondria induce multimorbidity and premature senescence. Science. 368 (6497), 1371-1376 (2020).
- Yang, R., et al. Mitochondrial Ca2+ and membrane potential, an alternative pathway for Interleukin 6 to regulate CD4 cell effector function. Elife. 4, 06376 (2015).
- Straub, R. H., Cutolo, M., Buttgereit, F., Pongratz, G. Energy regulation and neuroendocrine-immune control in chronic inflammatory diseases. J Intern Med. 267 (6), 543-560 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved