Method Article
İnsan bağışıklık hücrelerinde mitokondriyal membran potansiyelindeki dinamik değişiklikleri değerlendirmek için yüksek çözünürlüklü florespirometri
Bu Makalede
Özet
Bağışıklık hücrelerinde fizyolojik olarak ilgili substrat konsantrasyonları altında mitokondriyal biyoenerjetik çalışma yöntemleri sınırlıdır. İnsan T hücrelerinde, monositlerde ve periferik mononükleer hücrelerde mitokondriyal membran potansiyelinin enerji talebine tepkisindeki değişiklikleri değerlendirmek için yüksek çözünürlüklü florespirometri kullanan ayrıntılı bir protokol sunuyoruz.
Özet
Periferik mononükleer hücreler (PBMC'ler), sağlık ve hastalığa yanıt olarak mitokondriyal solunum kapasitesinde güçlü değişiklikler sergiler. Bu değişiklikler her zaman iskelet kası gibi diğer dokularda meydana gelenleri yansıtmasa da, bu hücreler insan deneklerden erişilebilir ve değerli bir canlı mitokondri kaynağıdır. PBMC'ler, biyoenerjetik durumlarını etkileyen sistemik sinyallere maruz kalırlar. Bu nedenle, bu popülasyondaki mitokondriyal metabolizmayı sorgulamak için araçlarımızı genişletmek, hastalığın ilerlemesi ile ilgili mekanizmaları aydınlatacaktır. Mitokondrinin fonksiyonel tahlilleri genellikle, in vivo olarak elde edilemeyebilecek tüm solunum kapasitesi aralığını belirlemek için maksimum substrat, inhibitör ve birleştirici konsantrasyonlarını takiben solunum çıktılarının kullanılmasıyla sınırlıdır. Adenozin difosfatın (ADP) ATP-sentaz tarafından adenozin trifosfata (ATP) dönüştürülmesi, mitokondriyal membran potansiyelinde (mMP) bir azalmaya ve oksijen tüketiminde bir artışa neden olur. Mitokondriyal dinamiklerin daha entegre bir analizini sağlamak için bu makale, oksijen tüketiminin ve mitokondriyal membran potansiyelinin (mMP) fizyolojik olarak ilgili ADP konsantrasyonlarına eşzamanlı tepkisini ölçmek için yüksek çözünürlüklü florespirometrinin kullanımını açıklamaktadır. Bu teknik, kompleks I ve II substratları ile maksimum hiperpolarizasyonu takiben ADP titrasyonlarına yanıt olarak mMP polarizasyonunu ölçmek için tetrametilrodamin metilester (TMRM) kullanır. Bu teknik, yaşlanma ve metabolik hastalık gibi sağlık durumundaki değişikliklerin, insan deneklerden alınan PBMC'lerde, T hücrelerinde ve monositlerde enerji talebine mitokondriyal yanıtın duyarlılığını nasıl etkilediğini ölçmek için kullanılabilir.
Giriş
Bir hücrenin fizyolojik stres döneminde işlev görme ve hayatta kalma yeteneği, büyük ölçüde homeostazı eski haline getirmek için enerji gereksinimini karşılama yeteneğine bağlıdır 1,2. Enerji talebi, çeşitli uyaranlara yanıt olarak artar. Örneğin, egzersiz sırasında artan kas kasılması, iskelet kası tarafından ATP ve glikoz kullanımını arttırır ve enfeksiyonu takiben protein sentezindeki artış, ATP'nin sitokin üretimi ve proliferasyonu için bağışıklık hücreleri tarafından kullanımını artırır 3,4,5,6. Enerji talebindeki bir artış, ATP/ADP oranını eski haline getirmek için bir dizi biyoenerjetik süreci tetikler. ATP tüketildikçe, ADP seviyeleri yükselir ve mekanik dönüşünü ve ADP'nin mitokondri7 içinde ATP'ye katalitik dönüşümünü sağlamak için bir protonmotor kuvvet gerektiren F1F0 ATP-sentazı (kompleks V) uyarır. Protonmotor kuvvet, elektronların iç mitokondriyal zar içindeki elektron taşıma sistemi (ETS) yoluyla substratlardan oksijene aktarılması sırasında protonların pompalanmasıyla oluşturulan bir elektrokimyasal gradyandır. Proton konsantrasyonunda (delta pH) ve elektrik potansiyelinde (membran potansiyeli) ortaya çıkan fark, enerji talebine yanıt olarak ATP sentezini ve oksijen tüketimini yönlendiren protonmotor kuvveti oluşturur, ATP/ADP oranını düşürür veya ADP seviyelerini yükseltir. Mitokondrinin ADP'ye afinitesi, izole mitokondri veya geçirgenhücrelerin ADP ile uyarılan solunumunun Km veya EC50'sinin hesaplanmasıyla belirlenebilir 8,9. Bu yöntem, yaşlı insanlardan alınan geçirgen kas liflerinin, maksimum oksidatif fosforilasyon kapasitelerinin% 50'sini uyarmak için genç deneklere göre daha yüksek bir ADP konsantrasyonu gerektirdiğini göstermiştir9. Benzer şekilde, yaşlanan fare iskelet kası, mitokondriyal reaktif oksijen türlerinin (ROS) üretimini azaltmak için daha fazla ADP gerektirir10,11. Ek olarak, diyete bağlı obezitesi olan farelerin geçirgen kas liflerinde kontrollere göre ADP duyarlılığı azalır ve insülin varlığında ve nitrat tüketimini takiben artar12,13. Bu nedenle, mitokondrinin enerji talebine cevap verme kapasitesi farklı fizyolojik koşullar altında değişir, ancak bu daha önce bağışıklık hücreleri bağlamında araştırılmamıştır.
Periferik kan mononükleer hücreleri (PBMC'ler), insan deneklerde hücresel biyoenerjetik araştırmak için yaygın olarak kullanılır 14,15,16,17,18,19,20. Bu, büyük ölçüde, klinik çalışmalarda hücrelerin pıhtılaşmamış kan örneklerinden kolayca elde edilebilmesi, hücrelerin metabolik bozulmalara yanıt vermesi ve mitokondriyal solunumun maksimum ve minimum kapasitesini belirlemek için inhibitörler ve ayrıştırıcılar kullanarak mitokondriyal metabolizmayı sorgulamak için çeşitli gruplar tarafından geliştirilen yöntemlerden kaynaklanmaktadır21,22. Bu yöntemler, biyoenerjetiklerin yaşlanma, metabolik hastalık ve bağışıklık fonksiyonundaki rollerinin takdir edilmesine yol açmıştır 14,20,23,24. Mitokondriyal solunum kapasitesi genellikle kalp yetmezliği koşulları altında iskelet kası ve PBMC'lerde azalır18,25. PBMC biyoenerjetik ayrıca sağlıklı yetişkinlerde17 kardiyometabolik risk faktörleri ile ilişkilidir ve nikotinamid ribozid18 gibi tedavilere yanıt verir. PBMC'ler, tümü PBMC mitokondriyal kapasitesine katkıda bulunan nötrofilleri, lenfositleri (B hücreleri ve T hücreleri), monositleri, doğal öldürücü hücreleri ve dendritik hücreleri içerir 26,27,28. Ek olarak, hücresel biyoenerjetik, bağışıklık hücresi aktivasyonu, çoğalması ve yenilenmesinde çok önemli bir rol oynar23. Bununla birlikte, bu yöntemlerin bir sınırlaması, hücrelerin fizyolojik bir substrat aralığı altında işlev görmemesidir. Bu nedenle, hücrelerin in vivo olarak deneyimledikleriyle daha ilgili olan substrat konsantrasyonlarında mitokondriyal fonksiyonu sorgulamak için ek yöntemler gereklidir.
Mitokondriyal membran potansiyeli (mMP), bir protonmotor kuvvetin ana bileşenidir ve ATP üretiminin ötesinde, solunum akışının düzenlenmesi, reaktif oksijen türleri üretimi, protein ve iyon ithalatı, otofaji ve apoptoz gibi çeşitli mitokondriyal süreçler için gereklidir. mMP, JC-1, Rhod123, DiOC6, tetrametil rodamin (TMRE) veya metil ester (TMRM) ve safranin gibi membran polarizasyonundaki değişikliklere duyarlı elektrokimyasal problar veya floresan boyalar ile değerlendirilebilir. Son ikisi, doku homojenatlarının, izole mitokondrilerin ve geçirgen dokuların yüksek çözünürlüklü florespirometrisinde başarıyla kullanılan lipofilik katyonik boyalardır 11,29,30,31,32,33. Bu teknikte TMRM, hücrelerin polarize olduğunda (yüksek mMP ve protonmotor kuvvet) mitokondriyal matriste biriken yüksek konsantrasyonda TMRM'ye maruz kaldığı ve sitozolik TMRM floresansının söndürülmesiyle sonuçlanan söndürme modunda kullanılır. Mitokondri, ADP'ye veya ayrıştırıcılara yanıt olarak depolarize olduğunda, boya matristen salınır ve TMRM floresan sinyalini34,35 arttırır. Bu yöntemin amacı, insan kaynaklı PBMC'lerde, dolaşımdaki monositlerde ve T hücrelerinde ADP titrasyonlarına yanıt olarak mitokondriyal solunum ve mMP'deki değişiklikleri aynı anda ölçmektir ve ayrıca fare splenik T hücrelerine de uygulanabilir.
Protokol
Burada sunulan veri ve yöntem geliştirme için kan örneklerinin toplanması, Washington Üniversitesi Dahili İnceleme Kurulu tarafından onaylanmıştır. Temsili sonuçlar ayrıca Jackson Laboratuvarları'ndan satın alınan erkek C57BL / 6J farelerinden (5-7 aylık) elde edilen verileri de içerir. Tüm hayvan prosedürleri Washington Üniversitesi Hayvan Refahı Ofisi tarafından onaylandı. Protokole genel bakış Şekil 1'de gösterilmiştir. Bu protokol için reaktif hazırlığı Ek Dosya 1'de bulunabilir.
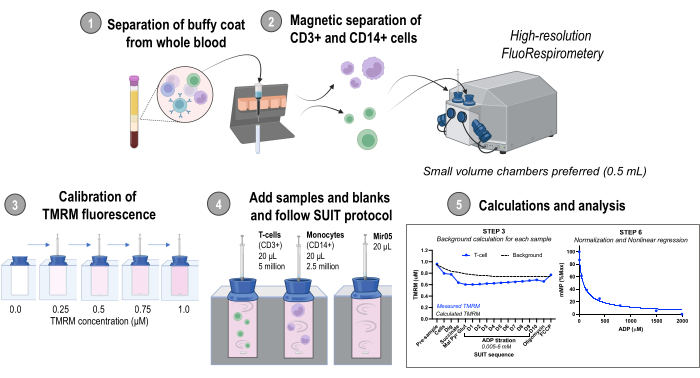
Şekil 1: Protokole genel bakış. Taze insan kan örneklerinden izole edilmiş monositlerde (CD14+) ve T hücrelerinde (CD3+) mitokondriyal membran potansiyelindeki değişiklikleri değerlendirmek için yüksek çözünürlüklü florespirometri kullanan iş akışı. Kısaltmalar: TMRM, tetrametilrodamin metil ester; SUIT, substrat-birleştirici-inhibitör titrasyonları; ADP, adenozin difosfat; Kazı, digitonin; Mal, malat; Pira, piruvat; Glut, glutamat; D1-10, 10 ardışık ADP titrasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Buffy ceketin tam kandan ayrılması
NOT: Hücre izolasyonu Kramer ve ark.27'den değiştirilmiştir.
- RPMI, yoğunluk gradyanı ve santrifüjün oda sıcaklığına ulaşmasına izin verin. Başlamadan önce biyogüvenlik kabinini ve malzemelerini sterilize edin.
- Venöz kanı üç adet 10 mL K2EDTA tüpüne toplayın. Tüpleri en az 3 kez ters çevirin.
- Tüpleri 500 x g 10 dakikada (22 °C, 9 hızlanma [acc], 2 yavaşlama [dec]) santrifüjleyin.
- Her tüpten 1 mL plazma çıkarın ve gelecekteki analizler için -80 °C'de saklayın.
- Plazmayı ve kırmızı kan hücresi tabakasının yarısını her tüpten 50 mL'lik tek bir konik tüpe aktarın. 40 mL işaretine kadar RPMI ekleyin. En az 3 kez ters çevirin.
- 10 mL plazma çözeltisini, 3 mL yoğunluk gradyanı içeren dört adet 15 mL konik tüpe yavaşça katmanlayın.
- 700 x g'da 30 dakika (22 °C, 5 acc, 2 aralık) santrifüjleyin.
- Kırmızı kan hücrelerini bozmadan tüm plazmayı ve periferik mononükleer hücreleri (PBMC'ler) içeren buffy kılıfı toplayın.
- 500 x g'da 10 dakika (22 °C, 5 acc, 5 dec) santrifüjleyin ve süpernatanı aspire edin.
- PBMC peletini 1x-2x'i 10 mL RPMI'de yeniden süspanse ederek ve 500 x g'da 10 dakika (22 °C, 5 acc, 5 aralık) santrifüjleyerek yıkayın.
2. CD14 + ve CD3 + hücrelerinin manyetik olarak ayrılması
- Manyetik hücre ayırıcısının manyetik alanına bir sütun yerleştirin ( Malzeme Tablosuna bakın). Kolonu 3 mL RP-5 ile yıkayın.
- PBMC peletini 80 μL RP-5 ve 20 μL anti-CD14 mikro boncuk içinde yeniden süspanse edin ( Malzeme Tablosuna bakın). 4 °C'de 15 dakika inkübe edin.
- Hücreleri 1 mL RP-5 ile yeniden süspanse edin ve süspansiyonu kolona yükleyin. "Akış 1" etiketli 15 mL'lik konik bir tüpe akan etiketlenmemiş hücreleri toplayın. Tüm hücre süspansiyonu kolondan geçene kadar bekleyin, ardından tüm akışı toplayarak 3 mL RP-5 3x ile yıkamaya devam edin.
- Sütunu manyetik alandan dikkatlice çıkarın ve 15 mL'lik yeni bir konik tüpe yerleştirin. 5 mL RP-5 ekleyin ve kolon içeriğini "CD14+" etiketli bir toplama tüpüne boşaltmak için hemen pistonu kullanın.
- "Flow-through 1" i 500 x g'da 10 dakika (22 °C, 5 acc, 5 dec) santrifüjleyin ve süpernatanı aspire edin.
- Akış 1'deki hücreleri kullanarak, T hücrelerini izole etmek için anti-CD3 mikro boncukları (Malzeme Tablosuna bakın) kullanarak 2.2-2.5 adımlarını tekrarlayın.
- T hücreleri (CD3+) ve monositler (CD14+) içeren santrifüj tüpleri 300 x g'da 5 dakika. Süpernatanı aspire edin ve peleti 1 mL RP-5 içinde yeniden süspanse edin.
- Bir hemositometre veya otomatik hücre sayacı kullanarak hücre konsantrasyonunu belirleyin.
NOT: Hücreler, bir hemositometreye 1:10 veya 1:20'lik bir hücre seyreltmesinin 10 μL eklenmesiyle sayılabilir. Bir hemositometre36 kullanarak hücreleri saymak için daha önce yayınlanmış protokollere başvurulabilir. - 2,5 milyon monosit veya 5 milyon T hücresini yeni bir santrifüj tüpüne pipetleyin. 2000 x g'da 30 saniye santrifüjleyin, süpernatanı aspire edin ve hücreleri MiR05'te toplam 20 μL hacim ve mL başına 125 milyon monosit veya 250 milyon T hücresi nihai konsantrasyon için yeniden süspanse edin.
NOT: Nihai konsantrasyon, 20 μL'lik bir hacimde 2,5 milyon monosit veya 5 milyon T hücresi enjekte etmek için seçilmiştir. Dalaktan izole edilen fare T hücreleri de bu yöntem kullanılarak test edilmiştir. Prosedür Ek Dosya 1'de bulunur.
3. Yüksek çözünürlüklü florespirometri - Oksijen ve TMRM floresan kalibrasyonu
NOT: Bu yöntem, Pharaoh ve ark.11 tarafından geçirgenleştirilmiş lifler üzerinde yapılan önceki çalışmalardan uyarlanmıştır. Matristeki mMP ve TMRM konsantrasyonunun ilişkisinin ters çevrildiği söndürme modu için yüksek, inhibitör olmayan bir TMRM konsantrasyonu kullanılır. Bu nedenle, mMP'deki bir azalma, matristen TMRM boyasının salınmasına ve floresan32'de bir artışa yol açar.
- O0.5K solunum cihazına üreticinin talimatlarına göre 2 mL'lik odalar takın ( Malzeme Tablosuna bakın). Cihazı açın ve veri toplama için üretici tarafından sağlanan yazılıma bağlayın.
- Sıcaklığı 37 °C'ye ayarlayın ve karıştırma hızını 750 rpm'ye ayarlayın.
- Odaları 3 kez damıtılmış suyla yıkayın. Suyu 0,54 mL Mir05 ile değiştirin, tıpaları tamamen kapatın ve entegre emme sistemi (ISS) ile fazla tamponu çıkarın. Bir durdurucu-ara parça kullanarak oda oksijeninin oda oksijeni ile dengelenmesini sağlamak için durdurucuları kaldırın.
- Oksijen akışı stabil hale geldiğinde, hava oksijen kalibrasyonunu (R1) üreticinin talimatlarına göre gerçekleştirin.
NOT: Oksijen akışının stabilize olması >30 dakika sürebilir. Oksijen sensörleri, ditiyonit titrasyonları kullanılarak yapılan ayrı deneylerden sıfır noktası oksijen (R0) ve 50-200 μM arasında arka plan oksijen akısının belirlenmesini gerektirir. Özel yöntemler üreticinin kılavuzunda bulunabilir. - Tıpaları kapatarak hazneyi kapatın.
NOT: Geçirgen liflerin kullanıldığı deneylerin aksine, odalar PBMC'ler için hiperoksijenasyon gerektirmez. R1 kalibrasyonundan sonra haznenin sızdırmaz hale getirilmesi, deney için yeterli oksijen sağlar. Oksijen seviyeleri 50-250 μM arasında tutulmalıdır. Oksijen konsantrasyonu eşiğin altına düşerse, oda oksijeninin oda havasındaki oksijen ile dengelenebilmesi için hazne kısmen açılabilir. - TMRM kalibrasyonu
- AmR filtre seti ile Yeşil LED fluo sensörlerini (örn. 525 nm) kullanın (Malzeme Tablosuna bakın). Florometre Kazancını 1000'e ve Yoğunluğu 1000'e ayarlayın. Fluo sensörlerini açın ve taban çizgisini kaydetmeye başlayın.
- 2.5 μL 0.05 mM TMRM enjekte edin ve odadaki toplam 1 μM TMRM konsantrasyonu için toplam 4 enjeksiyon yapılana kadar bir sonraki 2.5 μL enjeksiyondan önce sinyalin stabilize olmasına izin verin (~ 2 dakika). Tüm enjeksiyonlar için bir Hamilton şırınga kullanın.
- Beş noktalı kalibrasyon için 0, 0.25, 0.5, 0.75 ve 1.0 μM TMRM'yi temsil eden her enjeksiyon için floresan sinyali (voltaj) seçerek fluo sensörünü kalibre edin.
4. Substrat-birleştirici-inhibitör titrasyonu (SUIT) protokolü
NOT: TMRM sinyali tek başına enjeksiyonlara yanıt olarak değişeceğinden, 20 μL hücre süspansiyonu yerine odaya 20 μL Mir05 enjekte edildiği boş deneyler yapın (temsili sonuçlarda tartışılmıştır). Hem boş hem de numune deneyleri için bir sonraki enjeksiyondan önce oksijen akısı sinyalinin stabilize olmasına (yaklaşık 2-3 dakika) izin verin. Aşağıdaki titrasyon protokolü ve beklenen gözlemler Tablo 1'de yer almaktadır.
- Oksijen akışı stabil olduğunda, hem oksijen akışını hem de TMRM sinyalini "ön hücre" olarak seçin ve etiketleyin.
- ~ 20 μL'de 5 milyon T hücresi veya 2.5 milyon monosit içeren hücre süspansiyonunu enjekte edin ve yaklaşık 10 dakika ölçün. Hem oksijen akışını hem de TMRM sinyalini seçin ve "Hücre" olarak etiketleyin.
- 2 μL 1 mg / mL digitonin enjekte ederek hücreleri geçirgen hale getirin (son konsantrasyon: 4 μg / mL). 20 dakika bekleyin. Hem oksijen akışını hem de TMRM sinyalini seçin ve "Dig" olarak etiketleyin.
NOT: Digitonin konsantrasyonunun ayrı deneylerde optimize edilmesi önerilir. - 2.5 μL 1 M süksinat ekleyin (son konsantrasyon: 5 mM). Hem oksijen akışını hem de TMRM sinyalini seçin ve "SUCC" olarak etiketleyin.
- Oksijen akışı stabil olduğunda, 5 μL 100 mM malat (son konsantrasyon: 1.0 mM), 5 μL 1 M glutamat (son konsantrasyon: 10 mM) ve 5 μL 500 mM piruvat (son konsantrasyon: 5 mM) ekleyin. Hem oksijen akısını hem de TMRM sinyalini seçin ve "MPG" olarak etiketleyin.
- Oksijen akışı stabil olduğunda, ADP'yi titre edin. Her titrasyon için oranları seçin ve titrasyon sayısına bağlı olarak bunları 1 ile 10 arasında sırayla "D" olarak etiketleyin. Tablo 2'deki titrasyon şemasını kullanın.
- Oksijen akışı stabil hale geldiğinde, floresan sinyali maksimuma ulaşana kadar 0,25 mM karbonil siyanür p- (tri-flurometoksi) fenil-hidrazon (FCCP) 1 μL'lik bir dizi titrasyon gerçekleştirin. Minimum membran potansiyelini temsil eden hem oksijen akısını hem de TMRM sinyalini seçin ve etiketleyin ve "FCCP" olarak etiketleyin.
NOT: Mitokondriyal membran potansiyelini tüketmek için genellikle 0.5-1.0 μM'lik FCCP konsantrasyonu gereklidir.
DİKKAT: FCCP toksiktir. Doğru kullanım için güvenlik bilgi formuna (SDS) bakın. - İSTEĞE BAĞLI: Oksijen akışı stabil olduğunda, kompleks I'i inhibe etmek ve kompleks II yoluyla solunum kapasitesini belirlemek için 1 μL 0.25 mM rotenon enjekte edin.
NOT: Membran potansiyelindeki değişiklikler, birleştirici ile titre edildikten sonra artık geçerli değildir.
DİKKAT: Rotenon toksiktir. Doğru kullanım için SDS'ye bakın. - Oksijen akışı stabil olduğunda, mitokondriyal solunumu inhibe etmek için 1 μL 1.25 mM (nihai konsantrasyon: 2.5 μM) Antimisin A enjekte edin.
DİKKAT: Antimisin A toksiktir. Doğru kullanım için SDS'ye bakın.
5. Mitokondriyal membran potansiyelinin hesaplanması ve analizi
- Boş deneyleri kullanarak, boş numunenin enjeksiyonundan önce ("ön numune") ve enjeksiyonların her biri için kalibre edilmiş TMRM değerlerini (mikromolar TMRM) kaydedin. Şekil 2'ye bakın.
- Her boş deney için, "ön örnekleme" TMRM konsantrasyonunu 1,0 olarak ayarlayarak arka plan oranını hesaplayın. TMRM'de müteakip oransal düşüşü hesaplayın. Tüm boş deneylerden ortalama arka plan oranını hesaplayın.
NOT: Dahil edilecek boş deneylerin sayısı, cihazın hassasiyetine bağlı olabilir. Tablo 3'te , ortalama arka plan oranının standart sapmasının her titrasyon için 0 ile 0,016 arasında düştüğü beş farklı boş deneyden elde edilen hesaplama örneğine bakın. - Arka plan hesaplaması: Örnek deneyin "ön örnek" TMRM'sini her enjeksiyon için ortalama arka plan oranıyla çarparak her bir örnek deneyinin arka planını hesaplayın. Tablo 3'teki hesaplama örneğine bakın.
- Arka plan düzeltmesi: Deneyin arka planını, numunenin ölçülen TMRM değerlerine çıkarın. Tablo 4'teki hesaplama örneğine bakın.
- FCCP düzeltmesi: Her enjeksiyondan FCCP arka plan düzeltmeli mMP'yi çıkarın. Tablo 4'teki hesaplama örneğine bakın.
- ADP duyarlılık eğrisi: ADP titrasyonu boyunca toplanan mMP değerlerini kullanarak en yüksek ve en düşük membran potansiyelini sırasıyla %100 ve %0 olarak ayarlayarak mMP'deki ADP kaynaklı azalmayı normalleştirin. mMP'de ADP'nin yarı maksimal inhibitör konsantrasyonunu (IC50) hesaplamak için tercih edilen istatistiksel yazılımı kullanarak verileri doğrusal olmayan bir uyum regresyon modeline sığdırın.
NOT: Eğri, [İnhibitör] ve normalleştirilmiş yanıta uyar - Prizmada değişken eğim.
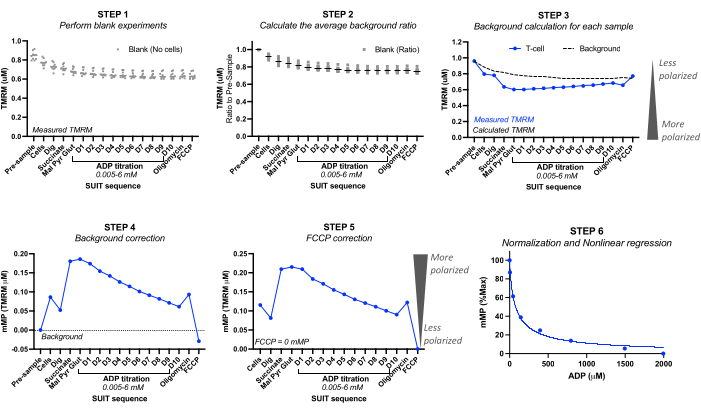
Şekil 2: TMRM floresansından mitokondriyal membran potansiyelinin (mMP) ve ADP duyarlılığının hesaplanması. Bir T hücresi örneğinin (n = 1) yüksek çözünürlüklü florespirometrisi ile TMRM floresan ölçümlerinden mitokondriyal membran potansiyelini (mMP) ve ADP duyarlılığını hesaplama adımları. Adım 1: TMRM floresansı, biyolojik numunede yapıldığı gibi boş numunelerde ölçülür. Adım 2: Her boş deney için numuneden önceki sinyale göre her titrasyonda TMRM sinyalindeki oranı belirleyin. Tüm boş deneylerin her titrasyonu için ortalamayı hesaplayın. 3. Adım: "Ön numune" floresansını her titrasyon için ortalama arka plan oranıyla çarparak her numune deneyinin arka planını hesaplayın. Adım 4: Verileri mMP veya mitokondriyal TMRM alımı olarak ifade etmek için her titrasyon için arka plan ve numune TMRM floresansı arasındaki farkı hesaplayın. Adım 5: mMP'yi, FCCP ile tam ayırma sıfır mMP'yi yansıtacak şekilde düzeltin. Adım 6: Artan ADP konsantrasyonları ile mMP'deki değişikliklerin grafiğini çıkarmak için doğrusal olmayan regresyon gerçekleştirin. Ölçümler, biri sağlıklı bir gönüllüden 5 milyon T hücresi içeren 0.5 mL'lik odalarda gerçekleştirildi. Ortalama veriler ortalama ± SEM olarak ifade edilir. Tek bir çoğaltmanın tek veri noktaları, hata çubukları olmadan ifade edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Test için optimal hücre konsantrasyonundaki farklılıkları göstermek için, 5 milyon T hücresi bir 0.5 mL'lik odaya (10 milyon hücre / mL) yüklendi ve 1.25 milyon hücre, 1 μM TMRM içeren başka bir odaya (2.5 milyon hücre / mL) yüklendi (Şekil 3A-G). TMRM arka planını hesaplamak için üç boş deney de dahil edildi. Daha yüksek bir T hücresi konsantrasyonunun, arka plana göre TMRM floresansında daha belirgin bir değişikliğe yol açtığını bulduk (Şekil 3B, D). Ek olarak, daha yüksek bir hücre konsantrasyonu, FCCP ilavesine yanıt olarak oksijen tüketiminde beklenen artışı ve mMP'nin eşzamanlı tükenmesini tespit etmemize izin verdi (Şekil 3E, F). Düşük bir hücre konsantrasyonunun kullanılması, arka plana paralel olarak floresanda zayıf bir değişiklik sağladı. mMP'nin hesaplanması arka planı sinyalden çıkardığından, düşük bir hücre konsantrasyonu, substratlara ve ayrıştırıcılara yanıt olarak mMP'deki değişikliklerin belirlenmesine izin vermez. Bu tahlilde daha yüksek hücre konsantrasyonlarını kullanmanın yanı sıra, deneyler arasında her hücre tipi için hücre konsantrasyonunu sabit tutmanızı öneririz.
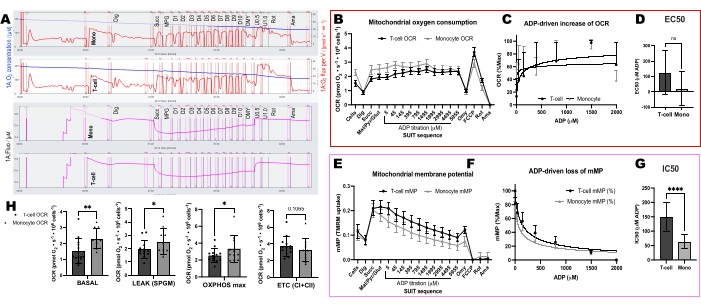
ADP titrasyonları ile mMP'nin dağılmasında ATP-sentazın etkisini doğrulamak için, bir odanın ADP titrasyonundan önce oligomisin aldığı PBMC'ler ve T hücreleri üzerinde paralel deneyler yaptık (Şekil 4). Oligomisin ile tedavi edilen hücrelerde ADP'ye yanıt olarak mMP dağılımı bulamadık, bu da ADP'li mMP'deki kademeli azalmanın ATP-sentaz yoluyla proton akışının bir sonucu olduğunu düşündürmektedir (Şekil 4A-F). Aynı katılımcının T hücreleri ve PBMC'leri arasındaki ADP duyarlılığını da karşılaştırdık ve T hücresi fraksiyonunda ADP duyarlılığının daha düşük (daha yüksek EC50) olduğunu bulduk (Şekil 4G, H).
Zamanın veya SUIT protokolünün TMRM floresansı üzerindeki etkisini belirlemek için bir dizi boş deney gerçekleştirdik. Boş deneylerdeki TMRM sinyalinin, titrasyonların zamanlamasının (Şekil 5B) aksine çoğunlukla SUIT titrasyonlarından (Şekil 5A) etkilendiğini bulduk.
Sağlıklı, toplumda yaşayan 11 gönüllüden alınan T hücreleri ve monositlerde oksijen tüketim oranlarında (OCR) ve mMP'de ADP kaynaklı değişiklikleri karşılaştırdık (Şekil 6A-H). Hücre dışı akı ve enzimatik tahliller kullanılarak daha önce yayınlanmış deneylerin sonuçlarına benzer şekilde, monositler lenfositlerden daha büyük bir mitokondriyal solunum kapasitesi sergilemiştir26,27 (Şekil 6A,H). Bununla birlikte, fare karaciğeri gibi yüksek metabolik dokular kullanıldığında bu yöntemin gösterdiğinin aksine, her iki hücre tipinde de ADP ile OCR'de tipik bir doz-yanıt artışı tespit etmedik (Şekil 6C, D). Öte yandan, TMRM kullanımı, insan bağışıklık hücrelerinde (Şekil 6E-G) ve farelerden alınan splenik T hücrelerinde (Şekil 7E-H) ADP ile mMP'de kademeli bir düşüş tespit etmemizi sağladı. Aynı titrasyon protokolünü kullanarak insan ve fare T hücrelerini doğrudan karşılaştırmamış olsak da, fare T hücrelerinin IC50'sinin, insan deneklerden dolaşımdaki T hücrelerine kıyasla 10 kat daha düşük olduğunu bulduk.
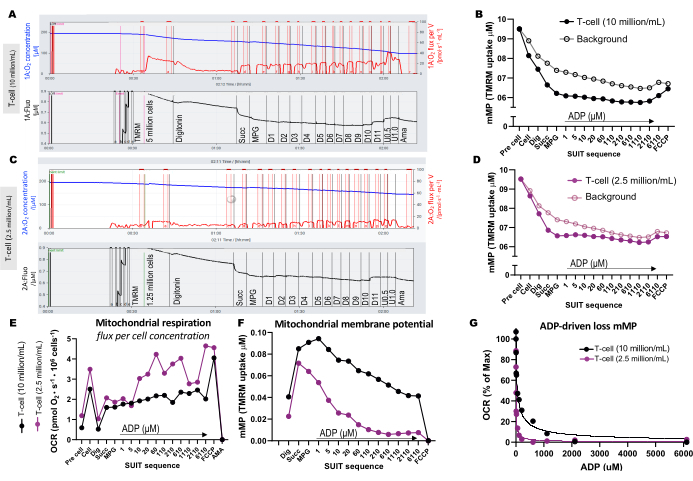
Şekil 3: Yüksek çözünürlüklü florespirometri deneyleri. (AD) 0.5 mL'lik odalarda 10 milyon hücre/mL ve 2.5 milyon hücre/mL T-hücresi konsantrasyonları kullanılarak yapılan yüksek çözünürlüklü florespirometri deneylerinin izi. (A) 0.5 mL'lik odalarda 10 milyon hücre / mL. (C) 0,5 mL'lik odalarda 2,5 milyon hücre / mL. Oksijen akışı (pmol/s/mL) üst panelde (kırmızı) ve kalibre edilmiş TMRM sinyali alt panelde (siyah) gösterilir. Numune ve hesaplanan arka planı için SUIT boyunca TMRM'deki değişiklikler, (B) 10 milyon hücre/mL ve (D) 2.5 milyon hücre/mL içeren odalar için çizildi. (E) Her hücre konsantrasyonu için oksijen akısı (pmol/s/milyon hücre) ve (F) mitokondriyal membran potansiyeli hesaplandı. (G) ADP duyarlılık eğrisi çizildi ve doğrusal olmayan bir regresyon modeline (düz çizgiler) uygun hale getirildi. Kısaltmalar: mMP, mitokondriyal membran potansiyeli; TMRM, tetrametilrodamin metil ester; SUIT, substrat-birleştirici-inhibitör titrasyonları; ADP, adenozin difosfat; Kazı, digitonin; Mal, malat; Pira, piruvat; Glut, glutamat; D1-11, 11 ardışık ADP titrasyonu; U, 0,5 ve 1,0 μM'lik birleştirici FCCP; AMA, antimisin A. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
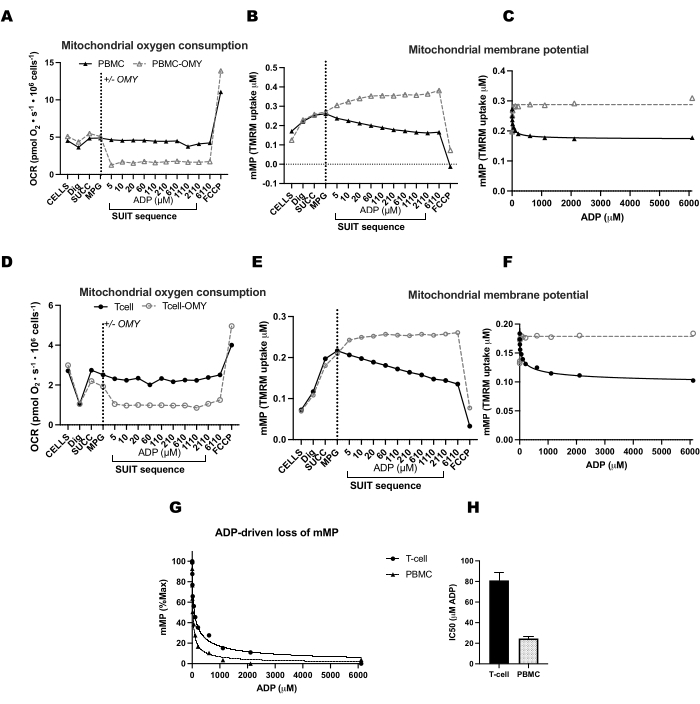
Şekil 4: ATP-sentaz, T hücrelerinde ve PBMC'lerde membran potansiyelinde ADP kaynaklı azalmaya neden olur. (AH) Burada açıklanan protokol PBMC'lerde ve T hücrelerinde test edilmiştir. İki O2K odasına PBMC'ler enjekte edildi ve ek bir O2K'nın iki odasına aynı katılımcıdan T hücreleri enjekte edildi. Tüm odalara malat, piruvat ve glutamat substratları enjekte edildikten sonra, bir PBMC ve T hücresi odası oligomisin aldı. Oligomisin, (A) PBMC'lerde ve (D) T hücrelerinde solunumda ADP kaynaklı herhangi bir artışı veya (B, C) PBMC'lerde ve (E, F) T hücrelerinde mitokondriyal membran potansiyelinde azalmayı önledi. (G,H) ADP duyarlılığı PBMC'lerde T hücrelerine kıyasla daha yüksekti. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
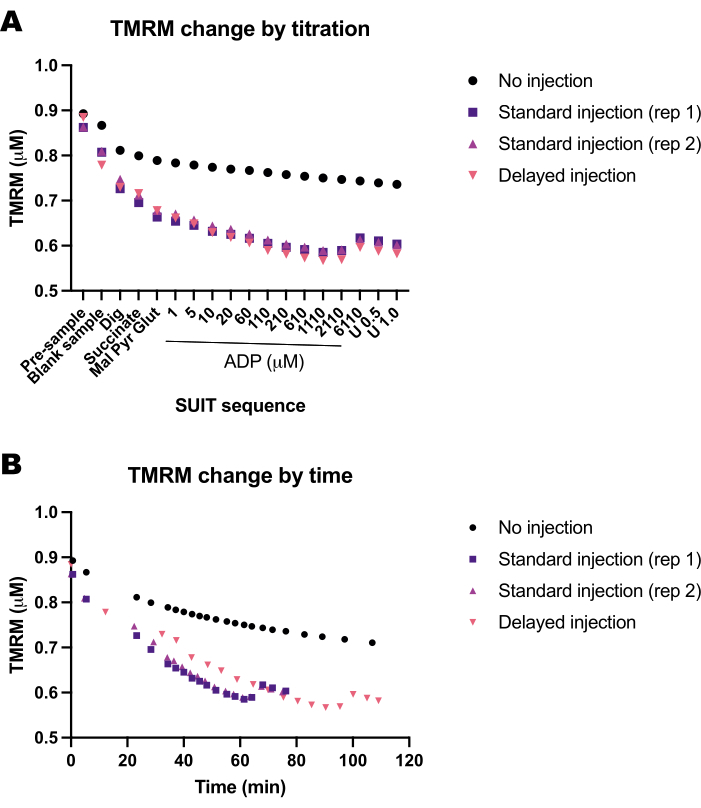
Şekil 5: Boş deneyler, substratların, birleştiricilerin ve inhibitörlerin (SUIT) zamana ve titrasyonlarına yanıt olarak TMRM floresansındaki değişimi göstermektedir. (A) Titrasyona yanıt olarak TMRM floresansındaki değişiklik. (B) Zamana tepki olarak TMRM floresansındaki değişiklik. Deneyler, 1 μM TMRM içeren Mir05 ile doldurulmuş 0.5 mL'lik odalarda gerçekleştirilmiştir. Bir odaya herhangi bir SUIT titrasyonu uygulanmadı (enjeksiyon yok); iki farklı cihazdaki iki odacık, standart bir giysi protokolü (standart enjeksiyon) aldı; bir oda aynı SUIT titrasyonlarını aldı, ancak her enjeksiyon arasında bir gecikme oldu (gecikmeli enjeksiyon). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 6: OCR ve mMP kullanılarak T hücreleri ve monositler arasındaki ADP duyarlılığındaki farklılıklar. (A) Bir deneğin monosit ve T hücresi örneğinden yüksek çözünürlüklü florespirometri deneyinin izi. (B) Sağlıklı gönüllülerin kanından monositlerde (n = 11) ve T hücrelerinde (n = 13) oksijen tüketimi. (C,D) Bir EC50'yi hesaplamak için ADP titrasyonları ile solunumdaki çizilen artışın doğrusal olmayan regresyon uydurması. (E) Mitokondriyal membran potansiyelinin eşzamanlı ölçümü. (F,G) Bir IC50'yi hesaplamak için ADP titrasyonları ile mitokondriyal membran potansiyelindeki çizilen düşüşün doğrusal olmayan regresyon uydurması. (H) Monositlerin ve T hücrelerinin solunum kapasitesi parametreleri. Veriler, çizgi grafikler için ortalama ± SEM ve çubuk grafikler için ortalama ± SD olarak ifade edilir. T-testlerini takiben istatistiksel olarak anlamlı farklılıklar *p < 0.05 olarak ifade edilmiştir. **p < 0.01 ve ****p < 0.0001 için. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
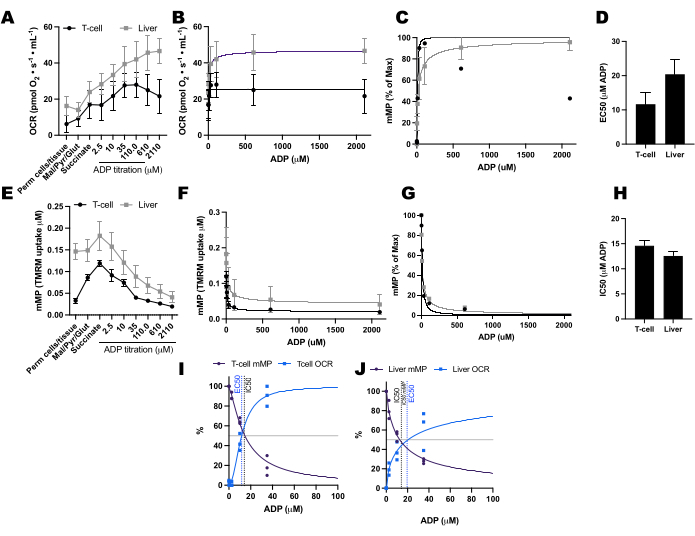
Şekil 7: Solunumda ADP yanıtı ile geçirgen fare splenik T hücreleri ve karaciğerde mitokondriyal membran potansiyelinin (mMP) karşılaştırılması. (AD) Geçirgen fare splenik T hücreleri ve karaciğerde solunumda yanıt. (E-H) Geçirgen fare splenik T hücreleri ve karaciğerde mMP'de yanıt. Servikal çıkığı takiben üç fareden taze karaciğer ve dalak diseke edildi. Splenik Pan T-hücreleri, antikor konjuge manyetik boncuk ayrımı kullanılarak izole edildi. Her iki örneğe de 1 μM TMRM varlığında aynı SUIT protokolü uygulandı. (I,J) ADP'ye yanıt olarak oksijen tüketimindeki (OCR) artıştan ve mMP'deki azalmadan hesaplanan EC50 ve IC50 karşılaştırması. N = grup başına 3. Veriler ortalama ± SEM olarak ifade edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: 0.5 mL odacıkları kullanarak yeni izole edilmiş T hücrelerinde ve monositlerde mitokondriyal membran potansiyelini değerlendirmek için örnek SUIT protokolü. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: 0,5 mL oda için önerilen ADP titrasyonu. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 3: Beş bağımsız boş deney kullanarak ortalama arka plan oranının hesaplanması. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 4: Örnek deneyden mitokondriyal membran potansiyelinin (mMP) hesaplanması. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Ek Şekil 1: Mir05 ve DMSO'nun mitokondriyal solunum ve membran potansiyeli üzerindeki etkisi. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 1: Fare dalağından T hücrelerini izole etmek için reaktif hazırlama ve protokol. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, PBMC'lerde, monositlerde ve T hücrelerinde artan ADP seviyelerine yanıt olarak mMP'nin dağılımını ölçerek mitokondriyal yanıtın enerji talebine duyarlılığını ölçmek için yüksek çözünürlüklü florespirometri kullanır. Bu, mitokondriyal membran potansiyelini en üst düzeye çıkarmak için kompleks I ve II substratları eklenerek ve ATP-sentazı ATP üretimi için proton gradyanını kullanmak üzere kademeli olarak uyarmak için ADP'yi titre ederek yapılır.
Protokoldeki kritik adımlar, floroforun kazancının ve yoğunluğunun 1000'e ayarlanmasını ve TMRM titrasyonu sırasında bir TMRM floresan sinyalinin alındığından emin olmayı içerir. TMRM floresansı her titrasyondan sonra azaldığından (bu yöntemin bir sınırlaması), boş numuneler kullanarak arka plan deneyleri yapmak zorunludur. Ayrıca DMSO'nun mitokondriyal solunum ve membran potansiyeli üzerinde inhibitör bir etkiye sahip olduğunu bulduk ve bu nedenle TMRM'nin çalışma çözeltisinin Mir05'te seyreltilmesini öneriyoruz (Ek Şekil 1).
Bu protokolü denerken kullanılabilecek bazı modifikasyonlar, hücre konsantrasyonlarını ayarlamak ve standart 2 mL'lik odayı kullanmaktır. Bununla birlikte, 0.5 mL'lik oda, membran potansiyeli ve oksijen akışında optimal yanıt için gereken yüksek hücre konsantrasyonu nedeniyle T hücreleri ve monositler için tercih edilir. Makrofajlar gibi daha yüksek solunum kapasitesine sahip hücreleri test ederken daha düşük bir hücre konsantrasyonu optimal olabilir.
Burada sunulan yöntemin ek sınırlamaları, en az 5 milyon T hücresi ve 2,5 milyon monosit gereksinimini içerir. Sağlıklı katılımcılardan genellikle ~ 20 mL kandan yeterli hücre elde edebiliriz, ancak bu sayılar sağlık durumuna, yaşa ve cinsiyete göre değişebilir26. Ek olarak, mitokondriyal kapasiteyi değerlendiren çoğu yöntemde olduğu gibi, hücrelerin taze olarak izole edilmesi gerekir. Bununla birlikte, bu yöntem gelecekte dondurularak saklanmış hücrelerde denenebilir. İnsan kanından elde edilen verimle karşılaştırıldığında, sağlıklı farelerin dalaklarından elde edilen T hücresi verimi, bu testi yapmak için yeterince yüksektir.
Dolaşımdaki T hücreleri, özellikle uzun ömürlü hafıza (TM) ve düzenleyici (Treg) hücreler, enerji için oksidatif fosforilasyona güvenir37. Enerji talepleri ve oksijen tüketimleri düşük olsa da (örneğin, dinlenme kasıyla karşılaştırıldığında), hayatta kalmaları, yeniden enfeksiyon ve kansere karşı etkili bir bağışıklık tepkisi için gereklidir 38,39,40. T hücresi oksidatif fosforilasyonundaki bir azalma, proliferatif kapasitenin bozulmasına neden olur ve T hücresi tükenmesini ve yaşlanmasını teşvik eder 5,41. Ek olarak, mitokondriyal hiperpolarizasyon, aktivasyon 42 sırasında efektör CD4 T-hücreleri tarafından sürekli bir sitokin (IL-4 ve IL-21) üretimini teşvik eder. Enfeksiyon üzerine, bağışıklık hücrelerinin aktivasyonu ve çoğalması için enerji gereksinimi, bazal metabolik hızın %25-30'u kadar yüksek olabilir43. Bu nedenle, bağışıklık hücreleri geniş ve aşırı bir enerji talebi yelpazesinde işlev görür ve bu protokol bu aralıktaki mitokondriyal tepkileri test edebilir.
Kronik inflamasyon, obezite, diyabet ve yaşlanmanın ortak bir özelliğidir. Dolaşımdaki hormonların, lipitlerin ve glikozun düzensiz seviyeleri sistemik etkilere sahiptir ve bu nedenle mitokondrinin enerjik bir zorluğa nasıl tepki verdiğini etkileyebilir. Burada, dolaşımdaki PBMC'lerde mitokondriyal ADP duyarlılığını değerlendirmek için bir yöntem sunduk. Metabolik hastalıkta ADP duyarlılığının nasıl modüle edilebileceğini ve sağlık durumunu nasıl etkilediğini belirlemek için daha ileri çalışmalara ihtiyaç vardır.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu proje için kan bağışında bulunan nazik gönüllülere teşekkür ederiz. Ayrıca, Dr. Ellen Schur ve ekibine, çalışmalarından bize ek örnekler sağladıkları için içten takdirlerimizi sunarız. Ayrıca, makaleyi gözden geçirdiği ve okunabilirlik açısından düzenlediği için Andrew Kirsh'e teşekkür ederiz. Bu çalışma aşağıdaki finansman kaynakları tarafından desteklenmiştir: P01AG001751, R01AG078279, P30AR074990, P30DK035816, P30DK017047, R01DK089036, K01HL154761, T32AG066574.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adenosine Diphosphate | Sigma-Aldrich | A5285 | Fluorespirometry |
| Antimycin A | Sigma-Aldrich | A8674 | Fluorespirometry |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A6003 | Mir05 buffer |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | Cell isolation |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920 | Fluorespirometry |
| Cell strainers | Fisher Scientific | 22-363-548 | Isolation of T-cells from mouse spleen protocol |
| CD14 Microbeads, human | Miltenyi Biotec | 130-050-201 | Cell isolation |
| CD3 Microbeads, human | Miltenyi Biotec | 130-050-101 | Cell isolation |
| DatLab | Oroboros | Version 8 | |
| Digitonin | Sigma-Aldrich | D141 | Fluorespirometry |
| D-Sucrose | Sigma-Aldrich | 84097 | Mir05 buffer |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N′,N′-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | Mir05 buffer |
| Filter Set AmR | Oroboros | 44321-01 | |
| HBSS (10x) | Gibco | 12060-040 | |
| HEPES sodium salt | Sigma-Aldrich | H7523 | Mir05 buffer |
| Histopaque 1077 | Sigma-Aldrich | 10771 | Cell isolation |
| K2EDTA blood collection tubes | BD Vacutainer | 366643 | Cell isolation |
| Lactobionic acid | Sigma-Aldrich | 153516 | Mir05 buffer |
| L-Glutamic acid | Sigma-Aldrich | G1626 | Fluorespirometry |
| L-Malic Acid | Sigma-Aldrich | M1000 | Fluorespirometry |
| LS Columns | Miltenyi Biotec | 130-042-401 | Cell isolation |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | M9272 | Mir05 buffer |
| Multi-MACS stand and MidiMACS Separator | Miltenyi Biotec | 130-042-301 | Cell isolation |
| O2k-Fluo Smart-Module | Oroboros | 12100-03 | |
| O2k-FluoRespirometer series J | Oroboros | 10201-03 | |
| O2k-sV-Module (0.5 chamber) | Oroboros | 11200-01 | |
| Oligomycin | Sigma-Aldrich | 04876 | Fluorespirometry |
| Pan T Cell Isolation Kit II, mouse | Miltenyi | 130095130 | Isolation of T-cells from mouse spleen protocol |
| Potassium dihydrogen phosphate (KH2PO4) | Sigma-Aldrich | P0662 | Mir05 buffer |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473 | Mir05 buffer |
| Prism | GraphPad | Version 10 | |
| Rotenone | Sigma-Aldrich | R8875 | Fluorespirometry |
| RPMI Buffer | Corning | 17-105-CV | Cell isolation |
| Sodium Pyruvate | Sigma-Aldrich | P2256 | Fluorespirometry |
| Succinate disodium salt | Sigma-Aldrich | S2378 | Fluorespirometry |
| Taurine | Sigma-Aldrich | T0625 | Mir05 buffer |
| Tetramethyrhodamine methyl ester perchlorite | Sigma-Aldrich | T5428 | Fluorespirometry |
Referanslar
- Eisner, V., Picard, M., Hajnóczky, G. Mitochondrial dynamics in adaptive and maladaptive cellular stress responses. Nat Cell Biol. 20 (7), 755-765 (2018).
- Sokolova, I. Bioenergetics in environmental adaptation and stress tolerance of aquatic ectotherms: linking physiology and ecology in a multi-stressor landscape. J Exp Biol. 224, 236802 (2021).
- Buttgereit, F., Brand, M. D. A hierarchy of ATP-consuming processes in mammalian cells). Biochem J. 312, 163-167 (1995).
- Schmid, D., Burmester, G. R., Tripmacher, R., Kuhnke, A., Buttgereit, F. Bioenergetics of human peripheral blood mononuclear cell metabolism in quiescent, activated, and glucocorticoid-treated states. Biosci Rep. 20 (4), 289-302 (2000).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21 (9), 1022-1033 (2020).
- Nelson, S. R., Li, A., Beck-Previs, S., Kennedy, G. G., Warshaw, D. M. Imaging ATP consumption in resting skeletal muscle: One molecule at a time. Biophys J. 119 (6), 1050-1055 (2020).
- Meyrat, A., von Ballmoos, C. ATP synthesis at physiological nucleotide concentrations. Sci Rep. 9 (1), 3070 (2019).
- Gouspillou, G., et al. Accurate determination of the oxidative phosphorylation affinity for ADP in isolated mitochondria. PLoS One. 6 (6), e20709 (2011).
- Holloway, G. P., et al. Age-associated impairments in mitochondrial ADP sensitivity contribute to redox stress in senescent human skeletal muscle. Cell Rep. 22 (11), 2837-2848 (2018).
- Pharaoh, G., Brown, J., Ranjit, R., Ungvari, Z., Van Remmen, H. Reduced adenosine diphosphate sensitivity in skeletal muscle mitochondria increases reactive oxygen species production in mouse models of aging and oxidative stress but not denervation. JCSM Rapid Commun. 4 (1), 75-89 (2021).
- Pharaoh, G., et al. The mitochondrially targeted peptide elamipretide (SS-31) improves ADP sensitivity in aged mitochondria by increasing uptake through the adenine nucleotide translocator (ANT). Geroscience. 45 (6), 3529-3548 (2023).
- Brunetta, H. S., Petrick, H. L., Vachon, B., Nunes, E. A., Holloway, G. P. Insulin rapidly increases skeletal muscle mitochondrial ADP sensitivity in the absence of a high lipid environment. Biochem J. 478 (13), 2539-2553 (2021).
- Brunetta, H. S., et al. Nitrate consumption preserves HFD-induced skeletal muscle mitochondrial ADP sensitivity and lysine acetylation: A potential role for SIRT1. Redox Biol. 52, 102307 (2022).
- Tyrrell, D. J., et al. Blood-cell bioenergetics are associated with physical function and inflammation in overweight/obese older adults. Exp Gerontol. 70, 84-91 (2015).
- Liepinsh, E., et al. Low-intensity exercise stimulates bioenergetics and increases fat oxidation in mitochondria of blood mononuclear cells from sedentary adults. Physiol Rep. 8 (12), e14489 (2020).
- Hedges, C. P., et al. Peripheral blood mononuclear cells do not reflect skeletal muscle mitochondrial function or adaptation to high-intensity interval training in healthy young men. J Appl Physiol. 126 (2), 454-461 (2019).
- DeConne, T. M., Muñoz, E. R., Sanjana, F., Hobson, J. C., Martens, C. R. Cardiometabolic risk factors are associated with immune cell mitochondrial respiration in humans. Am J Physiol Heart Circ Physiol. 319 (2), H481-H487 (2020).
- Zhou, B., et al. Boosting NAD level suppresses inflammatory activation of PBMCs in heart failure. J Clin Invest. 130 (11), 6054-6063 (2020).
- Altintas, M. M., DiBartolo, S., Tadros, L., Samelko, B., Wasse, H. Metabolic changes in peripheral blood mononuclear cells isolated from patients with end stage renal disease. Front Endocrinol (Lausanne). 12, 629239 (2021).
- Pence, B. D., Yarbro, J. R. Aging impairs mitochondrial respiratory capacity in classical monocytes). Exp Gerontol. 108, 112-117 (2018).
- vander Windt, G. J. W., Chang, C. H., Pearce, E. L. Measuring bioenergetics in T Cells using a Seahorse extracellular flux analyzer. Curr Protoc Immunol. 113, 11-14 (2016).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab Invest. 93 (6), 690-700 (2013).
- Buck, M. D., et al. Mitochondrial dynamics controls T Cell fate through metabolic programming. Cell. 166 (1), 63-76 (2016).
- Quinn, K. M., et al. Metabolic characteristics of CD8. Nat Commun. 11 (1), 2857 (2020).
- Scandalis, L., et al. Skeletal muscle mitochondrial respiration and exercise intolerance in patients with heart failure with preserved ejection fraction. JAMA Cardiol. 8 (6), 575-584 (2023).
- Rausser, S., et al. Mitochondrial phenotypes in purified human immune cell subtypes and cell mixtures. Elife. 10, e70899 (2021).
- Kramer, P. A., et al. Bioenergetics and the oxidative burst: protocols for the isolation and evaluation of human leukocytes and platelets. J Vis Exp. (85), e51301 (2014).
- Kramer, P. A., Ravi, S., Chacko, B., Johnson, M. S., Darley-Usmar, V. M. A review of the mitochondrial and glycolytic metabolism in human platelets and leukocytes: implications for their use as bioenergetic biomarkers. Redox Biol. 2, 206-210 (2014).
- Teodoro, J. S., Machado, I. F., Castela, A. C., Rolo, A. P., Palmeira, C. M. The evaluation of mitochondrial membrane potential using fluorescent dyes or a membrane-permeable cation (TPP+) electrode in isolated mitochondria and intact cells. Methods Mol Biol. 2184, 197-213 (2020).
- Hassan, H., Zakaria, F., Makpol, S., Karim, N. A. A link between mitochondrial dysregulation and idiopathic autism spectrum disorder (ASD): Alterations in mitochondrial respiratory capacity and membrane potential. Curr Issues Mol Biol. 43 (3), 2238-2252 (2021).
- Williams, A. S., et al. Disruption of Acetyl-Lysine turnover in muscle mitochondria promotes insulin resistance and redox stress without overt respiratory dysfunction. Cell Metab. 31 (1), 131-147 (2020).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods Enzymol. 542, 163-181 (2014).
- Chowdhury, S. R., Djordjevic, J., Albensi, B. C., Fernyhough, P. Simultaneous evaluation of substrate-dependent oxygen consumption rates and mitochondrial membrane potential by TMRM and safranin in cortical mitochondria. Biosci Rep. 36 (1), 00286 (2015).
- Vianello, C., et al. High-throughput microscopy analysis of mitochondrial membrane potential in 2D and 3D models. Cells. 12 (7), (2023).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- JoVE, Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE. , (2023).
- Geltink, R. I. K., Kyle, R. L., Pearce, E. L. Unraveling the complex interplay between T cell metabolism and function. Annu Rev Immunol. 36, 461-488 (2018).
- Sukumar, M., et al. Inhibiting glycolytic metabolism enhances CD8+ T cell memory and antitumor function. J Clin Invest. 123 (10), 4479-4488 (2013).
- Gerriets, V. A., et al. Foxp3 and Toll-like receptor signaling balance T. Nat Immunol. 17 (12), 1459-1466 (2016).
- MacIver, N. J., Michalek, R. D., Rathmell, J. C. Metabolic regulation of T lymphocytes. Annu Rev Immunol. 31, 259-283 (2013).
- Desdín-Micó, G., et al. T cells with dysfunctional mitochondria induce multimorbidity and premature senescence. Science. 368 (6497), 1371-1376 (2020).
- Yang, R., et al. Mitochondrial Ca2+ and membrane potential, an alternative pathway for Interleukin 6 to regulate CD4 cell effector function. Elife. 4, 06376 (2015).
- Straub, R. H., Cutolo, M., Buttgereit, F., Pongratz, G. Energy regulation and neuroendocrine-immune control in chronic inflammatory diseases. J Intern Med. 267 (6), 543-560 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır