Method Article
Fluorespirométrie à haute résolution pour évaluer les changements dynamiques du potentiel de la membrane mitochondriale dans les cellules immunitaires humaines
Dans cet article
Résumé
Les méthodes d’étude de la bioénergétique mitochondriale sous des concentrations de substrat physiologiquement pertinentes dans les cellules immunitaires sont limitées. Nous fournissons un protocole détaillé qui utilise la fluorespirométrie à haute résolution pour évaluer les changements dans la réponse du potentiel de la membrane mitochondriale à la demande d’énergie dans les cellules T humaines, les monocytes et les cellules mononucléées périphériques.
Résumé
Les cellules mononucléées périphériques (PBMC) présentent des changements robustes dans la capacité respiratoire mitochondriale en réponse à la santé et à la maladie. Bien que ces changements ne reflètent pas toujours ce qui se passe dans d’autres tissus, tels que les muscles squelettiques, ces cellules sont une source accessible et précieuse de mitochondries viables provenant de sujets humains. Les PBMC sont exposés à des signaux systémiques qui ont un impact sur leur état bioénergétique. Ainsi, l’élargissement de nos outils pour interroger le métabolisme mitochondrial dans cette population permettra d’élucider les mécanismes liés à la progression de la maladie. Les essais fonctionnels des mitochondries se limitent souvent à utiliser les débits respiratoires suivant les concentrations maximales de substrat, d’inhibiteur et de découpleur pour déterminer toute la gamme de la capacité respiratoire, ce qui peut ne pas être réalisable in vivo. La conversion de l’adénosine diphosphate (ADP) en adénosine triphosphate (ATP) par l’ATP-synthase entraîne une diminution du potentiel de membrane mitochondriale (mMP) et une augmentation de la consommation d’oxygène. Afin de fournir une analyse plus intégrée de la dynamique mitochondriale, cet article décrit l’utilisation de la fluorespirométrie à haute résolution pour mesurer la réponse simultanée de la consommation d’oxygène et du potentiel de membrane mitochondriale (mMP) à des concentrations physiologiquement pertinentes d’ADP. Cette technique utilise l’ester méthylique de tétraméthylrhodamine (TMRM) pour mesurer la polarisation des mMP en réponse aux titrages de l’ADP après une hyperpolarisation maximale avec des substrats complexes I et II. Cette technique peut être utilisée pour quantifier comment les changements dans l’état de santé, tels que le vieillissement et les maladies métaboliques, affectent la sensibilité de la réponse mitochondriale à la demande d’énergie dans les PBMC, les lymphocytes T et les monocytes de sujets humains.
Introduction
La capacité d’une cellule à fonctionner et à survivre dans une période de stress physiologique dépend en grande partie de sa capacité à répondre aux besoins énergétiques nécessaires pour restaurer l’homéostasie 1,2. La demande d’énergie augmente en réponse à une variété de stimuli. Par exemple, l’augmentation de la contraction musculaire pendant l’exercice augmente l’utilisation de l’ATP et du glucose par les muscles squelettiques, et une augmentation de la synthèse des protéines après une infection augmente l’utilisation de l’ATP par les cellules immunitaires pour la production et la prolifération des cytokines 3,4,5,6. Un pic de demande d’énergie déclenche une série de processus bioénergétiques pour restaurer le rapport ATP/ADP. Au fur et à mesure que l’ATP est consommé, les niveaux d’ADP augmentent et stimulent la F1F0 ATP-synthase (complexe V), qui nécessite une force protonmotrice pour entraîner sa rotation mécanique et sa conversion catalytique de l’ADP en ATP dans la mitochondrie7. La force protonmotrice est un gradient électrochimique créé par le pompage de protons lors du transfert d’électrons des substrats à l’oxygène à travers le système de transport d’électrons (ETS) à l’intérieur de la membrane mitochondriale interne. La différence résultante de concentration de protons (delta pH) et de potentiel électrique (potentiel membranaire) crée la force protonmotrice qui stimule la synthèse de l’ATP et la consommation d’oxygène en réponse à la demande d’énergie, réduisant le rapport ATP/ADP ou augmentant les niveaux d’ADP. L’affinité des mitochondries pour l’ADP peut être déterminée par le calcul du Km ou EC50 de la respiration stimulée par l’ADP de mitochondries isolées ou de cellules perméabilisées 8,9. Cette méthode a montré que les fibres musculaires perméabilisées des humains âgés nécessitent une plus grande concentration d’ADP pour stimuler 50% de leur capacité maximale de phosphorylation oxydative que celles des sujets plus jeunes9. De même, le vieillissement du muscle squelettique de la souris nécessite plus d’ADP pour réduire la production d’espèces réactives de l’oxygène (ROS) mitochondriales10,11. De plus, la sensibilité à l’ADP est réduite dans les fibres musculaires perméabilisées des souris atteintes d’obésité induite par l’alimentation par rapport aux témoins et est augmentée en présence d’insuline et après une consommation de nitrate12,13. Ainsi, la capacité des mitochondries à répondre à la demande d’énergie varie dans différentes conditions physiologiques, mais cela n’a pas été exploré auparavant dans le contexte des cellules immunitaires.
Les cellules mononucléées du sang périphérique (PBMC) sont couramment utilisées pour étudier la bioénergétique cellulaire chez les sujets humains 14,15,16,17,18,19,20. Cela est dû en grande partie au fait que les cellules sont facilement obtenables à partir d’échantillons de sang non coagulé dans les études cliniques, à la réactivité des cellules aux perturbations métaboliques et aux méthodes développées par divers groupes pour interroger le métabolisme mitochondrial en utilisant des inhibiteurs et des découpleurs pour déterminer la capacité maximale et minimale de la respiration mitochondriale21,22. Ces méthodes ont permis d’apprécier les rôles de la bioénergétique dans le vieillissement, les maladies métaboliques et la fonction immunitaire 14,20,23,24. La capacité respiratoire mitochondriale est souvent réduite dans les muscles squelettiques et les PBMC dans des conditions d’insuffisance cardiaque18,25. La bioénergétique des PBMC est également corrélée aux facteurs de risque cardiométaboliques chez les adultes en bonne santé17 et répond à des traitements tels que le nicotinamide riboside18. Les PBMC comprennent les neutrophiles, les lymphocytes (cellules B et lymphocytes T), les monocytes, les cellules tueuses naturelles et les cellules dendritiques, qui contribuent tous à la capacité mitochondriale des PBMC 26,27,28. De plus, la bioénergétique cellulaire joue un rôle crucial dans l’activation, la prolifération et le renouvellement des cellules immunitaires23. Cependant, l’une des limites de ces méthodes est que les cellules ne fonctionnent pas sous une gamme physiologique de substrats. Des méthodes supplémentaires sont donc nécessaires pour interroger la fonction mitochondriale dans des concentrations de substrat plus pertinentes pour ce que les cellules ressentent in vivo.
Le potentiel membranaire mitochondrial (mMP) est le composant majeur d’une force protonmotrice et est essentiel pour une variété de processus mitochondriaux au-delà de la production d’ATP, tels que la régulation du flux respiratoire, la production d’espèces réactives de l’oxygène, l’importation de protéines et d’ions, l’autophagie et l’apoptose. La mMP peut être évaluée à l’aide de sondes électrochimiques ou de colorants fluorescents sensibles aux changements de polarisation membranaire tels que JC-1, Rhod123, DiOC6, tétraméthylrhodamine (TMRE) ou ester méthylique (TMRM) et safranine. Les deux derniers sont des colorants cationiques lipophiles qui ont été utilisés avec succès dans la fluorespirométrie à haute résolution des homogénats de tissus, des mitochondries isolées et des tissus perméabilisés 11,29,30,31,32,33. Dans cette technique, la TMRM est utilisée en mode de trempe, où les cellules sont exposées à une forte concentration de TMRM qui s’accumule dans la matrice mitochondriale lorsqu’elle est polarisée (mMP et force protonmotrice élevées), ce qui entraîne l’extinction de la fluorescence cytosolique de la TMRM. Lorsque les mitochondries se dépolarisent en réponse à l’ADP ou aux découpleurs, le colorant est libéré de la matrice, augmentant le signal fluorescent TMRM34,35. Le but de cette méthode est de mesurer simultanément les changements dans la respiration mitochondriale et la mMP en réponse aux titrages ADP dans les PBMC d’origine humaine, les monocytes circulants et les lymphocytes T, et elle peut également être appliquée aux lymphocytes T spléniques de souris.
Protocole
La collecte d’échantillons de sang pour le développement des données et des méthodes présentées dans le présent document a été approuvée par le Conseil d’examen interne de l’Université de Washington. Les résultats représentatifs comprennent également des données provenant de souris C57BL/6J mâles (âgées de 5 à 7 mois) achetées auprès de Jackson Laboratories. Toutes les procédures animales ont été approuvées par le Bureau du bien-être animal de l’Université de Washington. La figure 1 illustre la vue d’ensemble du protocole. La préparation des réactifs pour ce protocole se trouve dans le fichier supplémentaire 1.
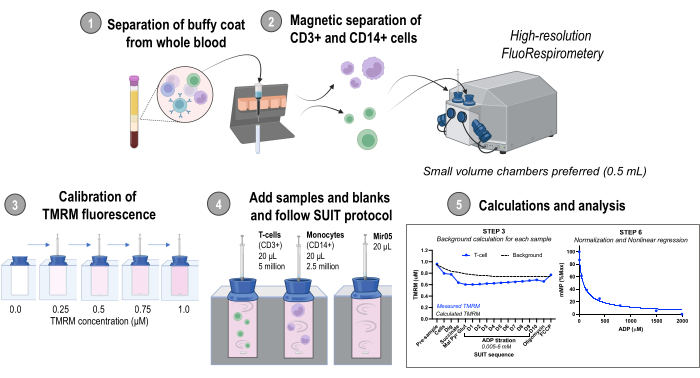
Figure 1 : Vue d’ensemble du protocole. Flux de travail utilisant la fluorespirométrie à haute résolution pour évaluer les changements dans le potentiel de la membrane mitochondriale dans les monocytes isolés (CD14+) et les lymphocytes T (CD3+) à partir d’échantillons de sang humain frais. Abréviations : TMRM, ester méthylique de tétraméthylrhodamine ; SUIT, titrages substrat-découpleur-inhibiteur ; ADP, adénosine diphosphate ; Creuser, digitonine ; Mal, malate ; Pyr, pyruvate ; Glutamate, glutamate ; D1-10, 10 titrages ADP consécutifs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Séparation de la couche leucocytaire du sang total
REMARQUE : L’isolement cellulaire est modifié à partir de Kramer et al.27.
- Laissez le RPMI, le gradient de densité et la centrifugeuse atteindre la température ambiante. Stérilisez l’enceinte de biosécurité et les matériaux avant de commencer.
- Prélever le sang veineux dans trois tubes K2EDTA de 10 mL. Retournez les tubes au moins 3 fois.
- Centrifuger les tubes à 500 x g 10 min (22 °C, 9 accélération [acc], 2 décélération [déc]).
- Retirer 1 mL de plasma de chaque tube et conserver à -80 °C pour des analyses ultérieures.
- Transférez le plasma et la moitié de la couche de globules rouges de chaque tube dans un seul tube conique de 50 ml. Ajouter l’IPRP jusqu’à 40 ml. Retournez au moins 3 fois.
- Disposez lentement 10 mL de la solution de plasma dans quatre tubes coniques de 15 mL contenant 3 mL du gradient de densité.
- Centrifugeuse à 700 x g pendant 30 min (22 °C, 5 acc, 2 déc).
- Prélever tout le plasma et la couche leucocytaire contenant les cellules mononucléées périphériques (PBMC) sans perturber les globules rouges.
- Centrifuger à 500 x g pendant 10 min (22 °C, 5 acc, 5 déc) et aspirer le surnageant.
- Laver la pastille PBMC 1x-2x en la remettant en suspension dans 10 mL de RPMI et en la centrifugant à 500 x g pendant 10 min (22 °C, 5 acc, 5 déc).
2. Séparation magnétique des cellules CD14+ et CD3+
- Placez une colonne dans le champ magnétique d’un séparateur de cellules magnétiques (voir le tableau des matériaux). Laver la colonne avec 3 mL de RP-5.
- Remettre en suspension la pastille de PBMC dans 80 μL de RP-5 et 20 μL de microbilles anti-CD14 (voir le Tableau des matières). Incuber pendant 15 min à 4 °C.
- Remettez les cellules en suspension avec 1 mL de RP-5 et chargez la suspension sur la colonne. Prélever les cellules non marquées qui s’écoulent dans un tube conique de 15 mL étiqueté « Flow-through 1 ». Attendez que toute la suspension cellulaire ait traversé la colonne, puis poursuivez le lavage avec 3 ml de RP-5 3x, en recueillant tout le flux.
- Retirez délicatement la colonne du champ magnétique et placez-la sur un nouveau tube conique de 15 ml. Ajouter 5 mL de RP-5 et utiliser immédiatement le piston pour purger le contenu de la colonne dans un tube de collecte étiqueté « CD14+ ».
- Centrifuger « Flow-through 1 » à 500 x g pendant 10 min (22 °C, 5 acc, 5 déc) et aspirer le surnageant.
- À l’aide des cellules de la séquence 1, répétez les étapes 2.2 à 2.5 à l’aide de microbilles anti-CD3 (voir le Tableau des matières) pour isoler les cellules T.
- Tubes à centrifuger contenant des lymphocytes T (CD3+) et des monocytes (CD14+) à 300 x g pendant 5 min. Aspirer le surnageant et remettre la pastille en suspension dans 1 mL de RP-5.
- Déterminez la concentration cellulaire à l’aide d’un hémocytomètre ou d’un compteur automatique de cellules.
REMARQUE : Les cellules peuvent être comptées en ajoutant 10 μL d’une dilution cellulaire de 1:10 ou 1:20 à un hémocytomètre. On peut se référer à des protocoles précédemment publiés pour compter les cellules à l’aide d’un hémocytomètre36. - Pipetez 2,5 millions de monocytes ou 5 millions de lymphocytes T dans un nouveau tube à centrifuger. Centrifuger pendant 30 s à 2000 x g, aspirer le surnageant et remettre en suspension les cellules dans MiR05 pour un volume total de 20 μL et une concentration finale de 125 millions de monocytes ou 250 millions de lymphocytes T par mL.
REMARQUE : La concentration finale a été choisie pour injecter 2,5 millions de monocytes ou 5 millions de lymphocytes T dans un volume de 20 μL. Des lymphocytes T de souris isolés de la rate ont également été testés à l’aide de cette méthode. La procédure se trouve dans le Dossier supplémentaire 1.
3. Fluorespirométrie à haute résolution - Étalonnage de l’oxygène et de la fluorescence TMRM
REMARQUE : Cette méthode a été adaptée de travaux antérieurs réalisés sur les fibres perméabilisées par Pharaoh et al.11. Une concentration élevée et non inhibitrice de TMRM est utilisée pour le mode d’extinction, où la relation entre la concentration de mMP et de TMRM dans la matrice est inversée. Ainsi, une diminution de la mMP entraîne la libération de colorant TMRM de la matrice et une augmentation de la fluorescence32.
- Installez les chambres de 0,5 mL dans le respiromètre O2K conformément aux instructions du fabricant (voir le tableau des matériaux). Allumez l’instrument et connectez-le au logiciel fourni par le fabricant pour l’acquisition de données.
- Réglez la température à 37 °C et la vitesse d’agitation à 750 tr/min.
- Lavez les chambres avec de l’eau distillée 3 fois. Remplacez l’eau par 0,54 ml de Mir05, fermez complètement les bouchons et éliminez l’excès de tampon avec le système d’aspiration intégré (ISS). Soulevez les bouchons pour permettre à l’oxygène ambiant de s’équilibrer avec l’oxygène de la chambre à l’aide d’un bouchon-entretoise.
- Une fois que le flux d’oxygène est stable, effectuez l’étalonnage de l’oxygène de l’air (R1) selon les instructions du fabricant.
REMARQUE : Cela peut prendre >30 minutes pour que le flux d’oxygène se stabilise. Les capteurs d’oxygène nécessitent la détermination de l’oxygène du point zéro (R0) et du flux d’oxygène de fond de 50 à 200 μM à partir d’expériences distinctes utilisant des titrages de dithionite. Les méthodes spécifiques peuvent être trouvées dans le manuel du fabricant. - Scellez la chambre en fermant les bouchons.
REMARQUE : Contrairement aux expériences utilisant des fibres perméabilisées, les chambres ne nécessitent pas d’hyperoxygénation pour les PBMC. Les niveaux d’oxygène doivent être maintenus entre 50 et 250 μM. Si la concentration d’oxygène tombe en dessous du seuil, la chambre peut être partiellement ouverte afin que l’oxygène de la chambre puisse s’équilibrer avec l’oxygène de l’air ambiant. - Étalonnage TMRM
- Utilisez les capteurs fluo à LED vertes (ex. 525 nm) avec le jeu de filtres AmR (voir tableau des matériaux). Réglez le gain du fluorimètre sur 1000 et l’intensité sur 1000. Allumez les capteurs fluo et commencez à enregistrer la ligne de base.
- Injecter 2,5 μL de TMRM 0,05 mM et laisser le signal se stabiliser (~2 min) avant l’injection suivante de 2,5 μL jusqu’à ce qu’un total de 4 injections soient effectuées pour une concentration TMRM totale de 1 μM TMRM dans la chambre. Utilisez une seringue Hamilton pour toutes les injections.
- Étalonnez le capteur fluo en sélectionnant le signal fluorescent (tension) pour chaque injection représentant 0, 0,25, 0,5, 0,75 et 1,0 μM de TMRM pour un étalonnage en cinq points.
4. Protocole de titrage substrat-découplage-inhibiteur (SUIT)
REMARQUE : Effectuez des expériences à blanc où 20 μL de Mir05 sont injectés dans la chambre au lieu de 20 μL de suspension cellulaire, car le signal TMRM changera en réponse aux injections seules (discuté dans les résultats représentatifs). Laisser le signal de flux d’oxygène se stabiliser (environ 2 à 3 minutes) avant la prochaine injection pour les expériences à blanc et sur échantillon. Le protocole de titrage suivant et les observations attendues se trouvent dans le tableau 1.
- Une fois que le flux d’oxygène est stable, sélectionnez et étiquetez le flux d’oxygène et le signal TMRM « pré-cellule ».
- Injecter la suspension cellulaire contenant soit 5 millions de lymphocytes T, soit 2,5 millions de monocytes dans ~20 μL et mesurer pendant environ 10 min. Sélectionnez et étiquetez le flux d’oxygène et le signal TMRM comme « Cell ».
- Perméabiliser les cellules en injectant 2 μL de 1 mg/mL de digitonine (concentration finale : 4 μg/mL). Attendez 20 min. Sélectionnez et étiquetez le flux d’oxygène et le signal TMRM comme « Dig ».
REMARQUE : Il est suggéré d’optimiser la concentration de digitonine dans des expériences séparées. - Ajouter 2,5 μL de succinate 1 M (concentration finale : 5 mM). Sélectionnez et étiquetez le flux d’oxygène et le signal TMRM comme « SUCC ».
- Une fois que le flux d’oxygène est stable, ajoutez 5 μL de 100 mM de malate (concentration finale : 1,0 mM), 5 μL de glutamate 1 M (concentration finale : 10 mM) et 5 μL de 500 mM de pyruvate (concentration finale : 5 mM). Sélectionnez et étiquetez le flux d’oxygène et le signal TMRM comme « MPG ».
- Une fois que le flux d’oxygène est stable, titrez l’ADP. Sélectionnez les taux pour chaque titrage et étiquetez-les « D » séquentiellement de 1 à 10, en fonction du nombre de titrages. Utilisez le schéma de titrage du tableau 2.
- Une fois que le flux d’oxygène est stable, effectuez une série de titrages de 1 μL de cyanure de carbonyle p-(tri-flurométoxy) phényl-hydrazone (FCCP) jusqu’à ce que le signal fluorescent atteigne son maximum. Sélectionnez et étiquetez à la fois le flux d’oxygène et le signal TMRM représentant le potentiel membranaire minimum et étiquetez-le « FCCP ».
REMARQUE : Une concentration de FCCP de 0,5 à 1,0 μM est généralement nécessaire pour épuiser le potentiel de la membrane mitochondriale.
ATTENTION : FCCP est toxique. Reportez-vous à la fiche de données de sécurité (FDS) pour une manipulation appropriée. - FACULTATIF : Une fois que le flux d’oxygène est stable, injecter 1 μL de roténone à 0,25 mM pour inhiber le complexe I et déterminer la capacité respiratoire à travers le complexe II.
REMARQUE : Les modifications du potentiel de la membrane ne sont plus pertinentes après le titrage avec le découpleur.
ATTENTION : La roténone est toxique. Reportez-vous à la FDS pour une manipulation appropriée. - Une fois que le flux d’oxygène est stable, injecter 1 μL de 1,25 mM (concentration finale : 2,5 μM) d’antimycine A pour inhiber la respiration mitochondriale.
ATTENTION : L’antimycine A est toxique. Reportez-vous à la FDS pour une manipulation appropriée.
5. Calcul et analyse du potentiel de la membrane mitochondriale
- À l’aide d’expériences à blanc, consigner les valeurs TMRM calibrées (TMRM micromolaires) avant l’injection de l’échantillon à blanc (« pré-échantillon ») et pour chacune des injections. Voir la figure 2.
- Pour chaque expérience à blanc, calculer le rapport de fond en fixant la concentration TMRM « avant l’échantillon » à 1,0. Calculez la diminution proportionnelle subséquente de la TMRM. Calculez le rapport de fond moyen de toutes les expériences à blanc.
REMARQUE : Le nombre d’expériences à blanc à inclure peut dépendre de la précision de l’instrument. Voir l’exemple de calcul du tableau 3 à partir de cinq expériences à blanc différentes, où l’écart-type du rapport de fond moyen se situait entre 0 et 0,016 pour chaque titrage. - Calcul du bruit de fond : Calculez le bruit de fond pour chaque expérience d’échantillon en multipliant le TMRM « pré-échantillon » de l’expérience par le rapport de bruit de fond moyen pour chaque injection. Voir l’exemple de calcul dans le tableau 3.
- Correction du bruit de fond : Soustraire le bruit de fond de l’expérience aux valeurs TMRM mesurées de l’échantillon. Voir l’exemple de calcul dans le Tableau 4.
- Correction FCCP : soustrayez le mMP corrigé en arrière-plan FCCP de chaque injection. Voir l’exemple de calcul dans le Tableau 4.
- Courbe de sensibilité ADP : normalisez la diminution de la mMP induite par l’ADP en fixant le potentiel de membrane le plus élevé et le plus bas à 100 % et 0 %, respectivement, à l’aide des valeurs de mMP collectées tout au long du titrage de l’ADP. Ajustez les données dans un modèle de régression d’ajustement non linéaire à l’aide du logiciel statistique préféré pour calculer la concentration inhibitrice demi-maximale (CI50) de l’ADP sur mMP.
REMARQUE : La courbe correspond à la réponse [Inhibiteur] par rapport à la réponse normalisée - Pente variable dans Prism.
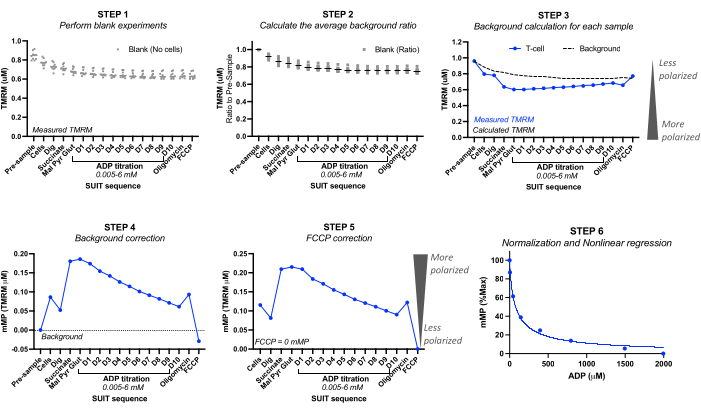
Figure 2 : Calcul du potentiel de membrane mitochondriale (mMP) et de la sensibilité ADP à partir de la fluorescence TMRM. Étapes de calcul du potentiel de membrane mitochondriale (mMP) et de la sensibilité ADP à partir de mesures de fluorescence TMRM par fluorespirométrie à haute résolution d’un échantillon de lymphocytes T (n = 1). Étape 1 : La fluorescence TMRM est mesurée dans des échantillons vierges comme c’est le cas pour l’échantillon biologique. Étape 2 : Déterminer le rapport entre le signal TMRM et le signal antérieur à l’échantillon pour chaque expérience à blanc. Calculer la moyenne pour chaque titrage de toutes les expériences à blanc. Étape 3 : Calculez le bruit de fond pour chaque expérience d’échantillon en multipliant la fluorescence « pré-échantillon » par le rapport de fond moyen pour chaque titrage. Étape 4 : Calculez la différence entre la fluorescence de fond et la fluorescence TMRM de l’échantillon pour chaque titrage afin d’exprimer les données sous forme de mMP ou d’absorption mitochondriale de TMRM. Étape 5 : Corrigez mMP de sorte que le découplage complet avec FCCP reflète zéro mMP. Étape 6 : Effectuer une régression non linéaire pour représenter graphiquement les changements de mMP avec l’augmentation des concentrations d’ADP. Les mesures ont été effectuées dans des chambres de 0,5 ml, dont l’une contenait 5 millions de lymphocytes T provenant d’un volontaire sain. Les données moyennées sont exprimées en moyenne ± MEB. Les points de données uniques d’une seule réplication sont exprimés sans barres d’erreur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Pour illustrer les différences de concentration cellulaire optimale pour l’essai, 5 millions de cellules T ont été chargées dans une chambre de 0,5 mL (10 millions de cellules/mL), et 1,25 million de cellules ont été chargées dans une autre chambre (2,5 millions de cellules/mL) contenant 1 μM TMRM (figure 3A-G). Trois expériences à blanc ont également été incluses pour calculer le bruit de fond de la TMRM. Nous avons constaté qu’une concentration plus élevée de lymphocytes T entraînait un changement plus distinct de la fluorescence TMRM par rapport au bruit de fond (Figure 3B,D). De plus, une concentration cellulaire plus élevée nous a permis de détecter l’augmentation attendue de la consommation d’oxygène et l’appauvrissement simultané du mMP en réponse à l’ajout de FCCP (Figure 3E,F). L’utilisation d’une faible concentration de cellules a produit un faible changement de fluorescence parallèle au bruit de fond. Étant donné que le calcul de la mMP soustrait le bruit de fond du signal, une faible concentration cellulaire ne permet pas de déterminer les changements de la mMP en réponse aux substrats et aux découpleurs. En plus d’utiliser les concentrations plus élevées de cellules dans cet essai, nous recommandons de maintenir la concentration cellulaire constante pour chaque type de cellule entre les expériences.
Pour valider l’influence de l’ATP-synthase dans la dissipation de mMP avec les titrages ADP, nous avons mené des expériences parallèles sur des PBMC et des lymphocytes T où une chambre a reçu de l’oligomycine avant le titrage de l’ADP (Figure 4). Nous n’avons trouvé aucune dissipation de mMP en réponse à l’ADP dans les cellules traitées avec l’oligomycine, ce qui suggère que la diminution progressive de mMP avec l’ADP est le résultat du flux de protons à travers l’ATP-synthase (Figure 4A-F). Nous avons également comparé la sensibilité à l’ADP entre les lymphocytes T et les PBMC du même participant et avons constaté que la sensibilité à l’ADP était plus faible (EC50 plus élevée) dans la fraction des lymphocytes T (Figure 4G,H).
Nous avons mené une série d’expériences à blanc pour déterminer l’influence du temps ou du protocole SUIT sur la fluorescence de TMRM. Nous avons constaté que le signal TMRM dans les expériences à blanc est principalement influencé par les titrages SUIT (Figure 5A) par opposition au timing des titrages (Figure 5B).
Nous avons comparé les changements induits par l’ADP dans les taux de consommation d’oxygène (OCR) et dans les mMP dans les lymphocytes T et les monocytes de 11 volontaires en bonne santé vivant dans la communauté (Figure 6A-H). À l’instar des résultats d’expériences précédemment publiées utilisant des flux extracellulaires et des tests enzymatiques, les monocytes présentaient une capacité respiratoire mitochondriale supérieure à celle des lymphocytes26,27 (Figure 6A,H). Cependant, nous n’avons pas détecté d’augmentation dose-réponse typique de l’OCR avec l’ADP dans l’un ou l’autre type de cellule (Figure 6C,D), contrairement à ce que cette méthode montre lors de l’utilisation de tissus hautement métaboliques comme le foie de souris (Figure 7A-H). D’autre part, l’utilisation de la TMRM nous a permis de détecter un déclin progressif de la mMP avec l’ADP dans les cellules immunitaires humaines (Figure 6E-G) et dans les lymphocytes T spléniques de souris (Figure 7E-H). Bien que nous n’ayons pas comparé directement les lymphocytes T humains et de souris en utilisant le même protocole de titrage, nous avons constaté que la CI50 des lymphocytes T de souris était inférieure d’un facteur 10 par rapport à celle des lymphocytes T circulants de sujets humains.
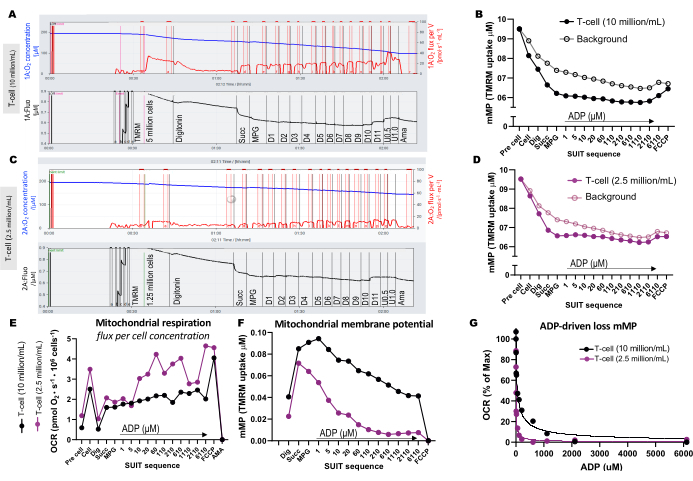
Figure 3 : Expériences de fluorespirométrie à haute résolution. (A-D) Trace d’expériences de fluorespirométrie à haute résolution utilisant des concentrations de cellules T de 10 millions de cellules/mL et de 2,5 millions de cellules/mL dans des chambres de 0,5 mL. (A) 10 millions de cellules/mL dans des chambres de 0,5 mL. (C) 2,5 millions de cellules/mL dans des chambres de 0,5 mL. Le flux d’oxygène (pmol/s/mL) est indiqué dans le panneau supérieur (rouge) et le signal TMRM calibré est affiché dans le panneau inférieur (noir). Les changements de TMRM dans l’ensemble de la SUIT pour l’échantillon et son bruit de fond calculé ont été tracés pour les chambres contenant (B) 10 millions de cellules/mL et (D) 2,5 millions de cellules/mL. (E) Pour chaque concentration cellulaire, le flux d’oxygène (pmol/s/million de cellules) et le potentiel de membrane mitochondriale (F) ont été calculés. (G) La courbe de sensibilité de l’ADP a été tracée et ajustée à un modèle de régression non linéaire (lignes continues). Abréviations : mMP, potentiel de membrane mitochondriale ; TMRM, ester méthylique de tétraméthylrhodamine ; SUIT, titrages substrat-découpleur-inhibiteur ; ADP, adénosine diphosphate ; Creuser, digitonine ; Mal, malate ; Pyr, pyruvate ; Glutamate, glutamate ; D1-11, 11 titrages ADP consécutifs ; U, découpleur FCCP de 0,5 et 1,0 μM ; AMA, antimycine A. Veuillez cliquer ici pour voir une version agrandie de cette figure.
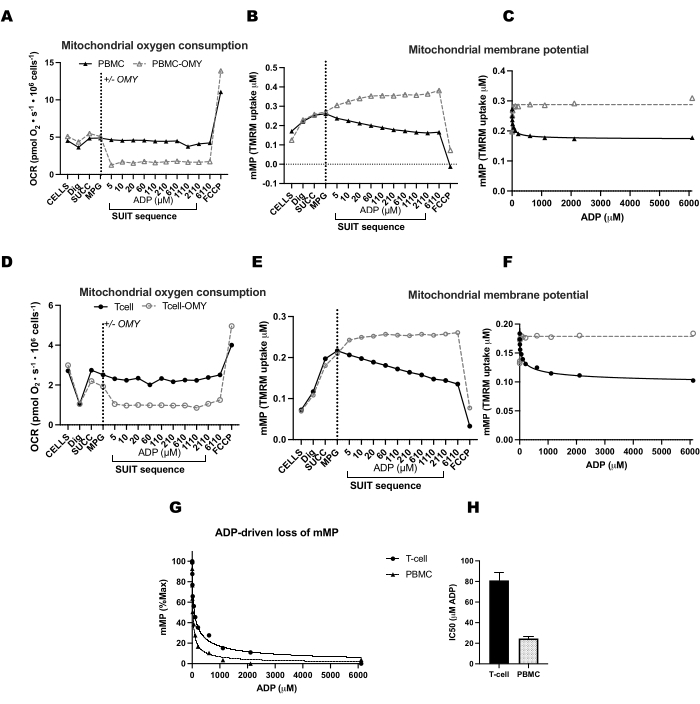
Figure 4 : L’ATP-synthase entraîne une diminution du potentiel membranaire induite par l’ADP dans les lymphocytes T et les PBMC. (A-H) Le protocole décrit ici a été testé sur des PBMC et des lymphocytes T. Deux chambres O2K ont été injectées avec des PBMC, et deux chambres d’un O2K supplémentaire ont été injectées avec des cellules T provenant du même participant. Après avoir injecté des substrats de malate, de pyruvate et de glutamate dans toutes les chambres, une chambre de PBMC et de lymphocytes T a reçu de l’oligomycine. L’oligomycine a empêché toute augmentation de la respiration induite par l’ADP dans les PBMC (A) et les lymphocytes T (D) ou le déclin du potentiel de la membrane mitochondriale dans les PBMC (B,C) et les lymphocytes T (E,F). (G,H) La sensibilité à l’ADP était plus élevée chez les PBMC que chez les lymphocytes T. Veuillez cliquer ici pour voir une version agrandie de cette figure.
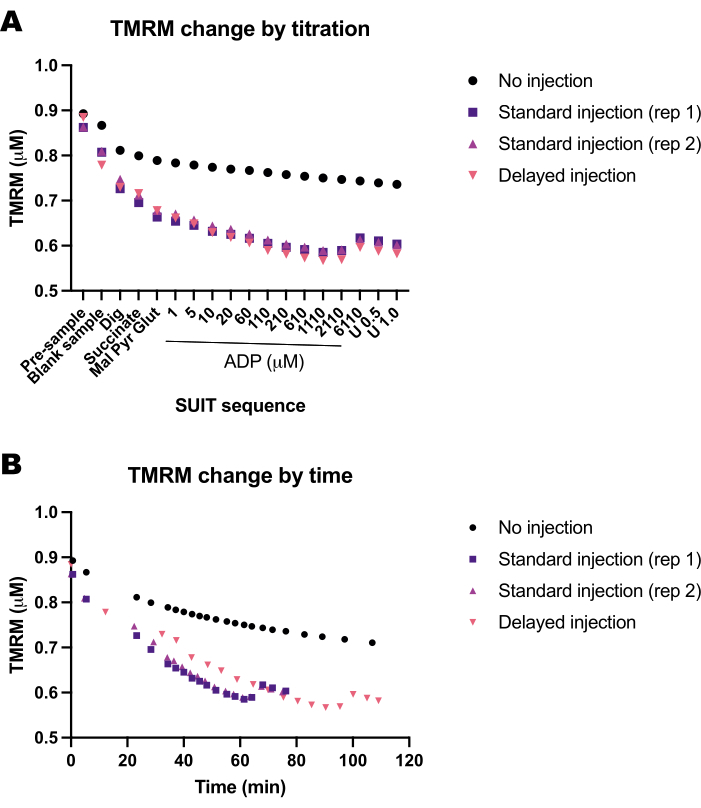
Figure 5 : Des expériences à blanc montrent le changement de fluorescence TMRM en réponse au temps et aux titrages des substrats, des découpleurs et des inhibiteurs (SUIT). (A) Changement de la fluorescence TMRM en réponse au titrage. (B) Changement de la fluorescence TMRM en réponse au temps. Les expériences ont été menées dans des chambres de 0,5 mL remplies de Mir05 contenant 1 μM de TMRM. Une chambre n’a reçu aucun titrage SUIT (pas d’injection) ; deux chambres dans deux instruments différents ont reçu un protocole de combinaison standard (injection standard) ; une chambre a reçu les mêmes titrages SUIT mais avec un délai entre chaque injection (injection retardée). Veuillez cliquer ici pour voir une version agrandie de cette figure.
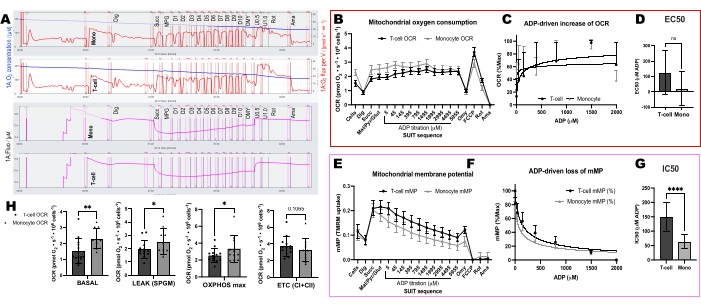
Figure 6 : Différences de sensibilité ADP entre les lymphocytes T et les monocytes à l’aide de l’OCR et du mMP. (A) Trace d’une expérience de fluorespirométrie à haute résolution à partir d’un échantillon de monocytes et de lymphocytes T d’un sujet. (B) Consommation d’oxygène dans les monocytes (n = 11) et les lymphocytes T (n = 13) à partir du sang de volontaires sains. (C, D) Ajustement par régression non linéaire de l’augmentation de la respiration tracée avec des titrages ADP pour calculer une EC50. (E) Mesure simultanée du potentiel de la membrane mitochondriale. (F,G) Ajustement par régression non linéaire de la baisse tracée du potentiel de la membrane mitochondriale avec des titrages ADP pour calculer une CI50. (H) Paramètres de la capacité respiratoire des monocytes et des lymphocytes T. Les données sont exprimées en moyenne ± MEB pour les graphiques linéaires et en moyenne ± SD pour les graphiques à barres. Les différences statistiquement significatives après les tests t sont exprimées par *p < 0,05. **p < 0,01 et ****p < pour 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
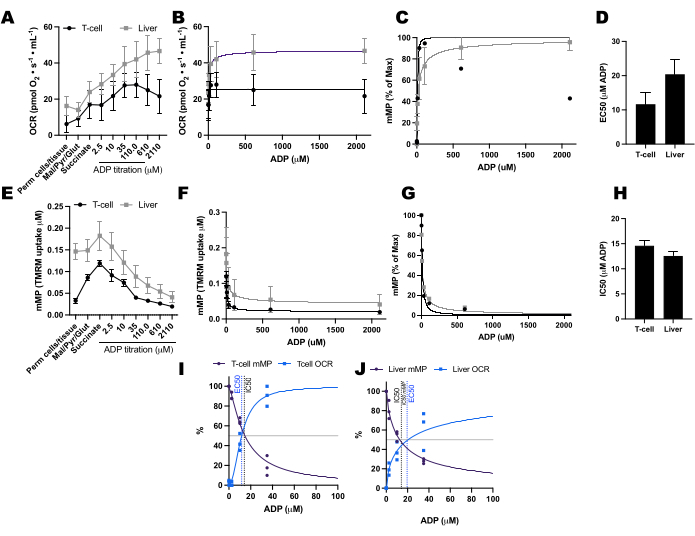
Figure 7 : Comparaison de la réponse ADP dans la respiration et le potentiel de membrane mitochondriale (mMP) dans les lymphocytes T spléniques et le foie de souris perméabilisés. (A-D) Réponse respiratoire dans les lymphocytes T spléniques et le foie de souris perméabilisés. (E-H) Réponse en mMP dans les lymphocytes T spléniques et le foie de souris perméabilisés. Le foie et la rate frais ont été disséqués chez trois souris à la suite d’une luxation cervicale. Les lymphocytes Pan T spléniques ont été isolés à l’aide d’une séparation par billes magnétiques conjuguées à des anticorps. Les deux échantillons ont été soumis au même protocole SUIT en présence d’une TMRM de 1 μM. (I,J) Comparaison de la CE50 calculée à partir de l’augmentation de la consommation d’oxygène (OCR) et de la CI50 de la diminution de la mMP en réponse à l’ADP. N = 3 par groupe. Les données sont exprimées en moyenne ± MEB. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Exemple de protocole SUIT pour évaluer le potentiel de la membrane mitochondriale dans les lymphocytes T et les monocytes fraîchement isolés à l’aide des chambres de 0,5 ml. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Titrage ADP recommandé pour une chambre de 0,5 mL. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Calcul du rapport de fond moyen à l’aide de cinq expériences indépendantes sur les blancs. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4 : Calcul du potentiel de membrane mitochondriale (mMP) à partir d’une expérience d’échantillon. Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire 1 : Effet de Mir05 et du DMSO sur la respiration mitochondriale et le potentiel membranaire. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 1 : Préparation de réactifs et protocole d’isolement des lymphocytes T de la rate de souris. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Ce protocole utilise la fluorespirométrie à haute résolution pour mesurer la sensibilité de la réponse mitochondriale à la demande d’énergie en mesurant la dissipation de mMP en réponse à l’augmentation des niveaux d’ADP dans les PBMC, les monocytes et les lymphocytes T. Cela se fait en ajoutant des substrats complexes I et II pour maximiser le potentiel de la membrane mitochondriale et en titrant l’ADP pour stimuler progressivement l’ATP-synthase à utiliser le gradient de protons pour la génération d’ATP.
Les étapes critiques du protocole comprennent le réglage du gain et de l’intensité du fluorophore à 1000 et l’assurance qu’un signal fluorescent TMRM est acquis pendant le titrage TMRM. Étant donné que la fluorescence TMRM diminue après chaque titrage (une limitation de cette méthode), il est impératif d’effectuer des expériences de fond en utilisant des échantillons vierges. Nous avons également constaté que le DMSO a un effet inhibiteur sur la respiration mitochondriale et le potentiel membranaire et, par conséquent, nous recommandons de diluer la solution de travail de TMRM dans Mir05 (Figure supplémentaire 1).
Certaines modifications qui peuvent être utilisées lors de l’essai de ce protocole sont l’ajustement des concentrations cellulaires et l’utilisation de la chambre standard de 2 ml. Cependant, la chambre de 0,5 mL est préférée pour les lymphocytes T et les monocytes en raison de la forte concentration de cellules nécessaires pour une réponse optimale en potentiel membranaire et en flux d’oxygène. Une concentration plus faible de cellules peut être optimale lors de l’analyse de cellules ayant une plus grande capacité respiratoire, comme les macrophages.
Parmi les autres limitations de la méthode présentée ici, citons l’exigence d’au moins 5 millions de lymphocytes T et de 2,5 millions de monocytes. Nous pouvons souvent obtenir suffisamment de cellules à partir de ~20 ml de sang de participants en bonne santé, mais ces chiffres peuvent varier selon l’état de santé, l’âge et le sexe26. De plus, comme dans la plupart des méthodes d’évaluation de la capacité mitochondriale, les cellules doivent être fraîchement isolées. Cependant, cette méthode pourrait être testée dans des cellules cryopréservées à l’avenir. En comparaison avec le rendement du sang humain, le rendement des lymphocytes T de la rate de souris saines est suffisamment élevé pour effectuer ce test.
Les lymphocytes T circulants, en particulier les cellules à mémoire à longue durée de vie (TM) et les cellules régulatrices (Treg), dépendent de la phosphorylation oxydative pour produire de l’énergie37. Bien que leur demande énergétique et leur consommation d’oxygène soient faibles (par exemple, par rapport à celles des muscles au repos), leur survie est essentielle pour une réponse immunitaire efficace à la réinfection et au cancer 38,39,40. Une réduction de la phosphorylation oxydative des lymphocytes T entraîne une altération de la capacité de prolifération et favorise l’épuisement et la sénescence des lymphocytes T 5,41. De plus, l’hyperpolarisation mitochondriale favorise une production soutenue de cytokines (IL-4 et IL-21) par les lymphocytes T CD4 effecteurs lors de l’activation42. Lors de l’infection, les besoins énergétiques nécessaires à l’activation et à la prolifération des cellules immunitaires peuvent atteindre 25 à 30 % du taux métabolique de base43. Par conséquent, les cellules immunitaires fonctionnent dans une gamme large et extrême de demandes énergétiques, et ce protocole peut tester les réponses mitochondriales dans cette plage.
L’inflammation chronique est une caractéristique commune de l’obésité, du diabète et du vieillissement. Les niveaux déréglés d’hormones circulantes, de lipides et de glucose ont des impacts systémiques et peuvent donc affecter la façon dont les mitochondries réagissent à un défi énergétique. Ici, nous avons présenté une méthode pour évaluer la sensibilité mitochondriale à l’ADP dans les PBMC circulants. D’autres études sont nécessaires pour déterminer comment la sensibilité à l’ADP peut être modulée dans les maladies métaboliques et comment elle affecte l’état de santé.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Nous tenons à remercier les aimables bénévoles qui ont donné du sang pour ce projet. Nous exprimons également notre sincère gratitude à la Dre Ellen Schur et à son équipe pour nous avoir fourni des échantillons supplémentaires de leur étude. Nous tenons également à remercier Andrew Kirsh d’avoir revu le manuscrit et de l’avoir révisé pour en assurer la lisibilité. Ce travail a été soutenu par les sources de financement suivantes : P01AG001751, R01AG078279, P30AR074990, P30DK035816, P30DK017047, R01DK089036, K01HL154761, T32AG066574.
matériels
| Name | Company | Catalog Number | Comments |
| Adenosine Diphosphate | Sigma-Aldrich | A5285 | Fluorespirometry |
| Antimycin A | Sigma-Aldrich | A8674 | Fluorespirometry |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A6003 | Mir05 buffer |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | Cell isolation |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920 | Fluorespirometry |
| Cell strainers | Fisher Scientific | 22-363-548 | Isolation of T-cells from mouse spleen protocol |
| CD14 Microbeads, human | Miltenyi Biotec | 130-050-201 | Cell isolation |
| CD3 Microbeads, human | Miltenyi Biotec | 130-050-101 | Cell isolation |
| DatLab | Oroboros | Version 8 | |
| Digitonin | Sigma-Aldrich | D141 | Fluorespirometry |
| D-Sucrose | Sigma-Aldrich | 84097 | Mir05 buffer |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N′,N′-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | Mir05 buffer |
| Filter Set AmR | Oroboros | 44321-01 | |
| HBSS (10x) | Gibco | 12060-040 | |
| HEPES sodium salt | Sigma-Aldrich | H7523 | Mir05 buffer |
| Histopaque 1077 | Sigma-Aldrich | 10771 | Cell isolation |
| K2EDTA blood collection tubes | BD Vacutainer | 366643 | Cell isolation |
| Lactobionic acid | Sigma-Aldrich | 153516 | Mir05 buffer |
| L-Glutamic acid | Sigma-Aldrich | G1626 | Fluorespirometry |
| L-Malic Acid | Sigma-Aldrich | M1000 | Fluorespirometry |
| LS Columns | Miltenyi Biotec | 130-042-401 | Cell isolation |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | M9272 | Mir05 buffer |
| Multi-MACS stand and MidiMACS Separator | Miltenyi Biotec | 130-042-301 | Cell isolation |
| O2k-Fluo Smart-Module | Oroboros | 12100-03 | |
| O2k-FluoRespirometer series J | Oroboros | 10201-03 | |
| O2k-sV-Module (0.5 chamber) | Oroboros | 11200-01 | |
| Oligomycin | Sigma-Aldrich | 04876 | Fluorespirometry |
| Pan T Cell Isolation Kit II, mouse | Miltenyi | 130095130 | Isolation of T-cells from mouse spleen protocol |
| Potassium dihydrogen phosphate (KH2PO4) | Sigma-Aldrich | P0662 | Mir05 buffer |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473 | Mir05 buffer |
| Prism | GraphPad | Version 10 | |
| Rotenone | Sigma-Aldrich | R8875 | Fluorespirometry |
| RPMI Buffer | Corning | 17-105-CV | Cell isolation |
| Sodium Pyruvate | Sigma-Aldrich | P2256 | Fluorespirometry |
| Succinate disodium salt | Sigma-Aldrich | S2378 | Fluorespirometry |
| Taurine | Sigma-Aldrich | T0625 | Mir05 buffer |
| Tetramethyrhodamine methyl ester perchlorite | Sigma-Aldrich | T5428 | Fluorespirometry |
Références
- Eisner, V., Picard, M., Hajnóczky, G. Mitochondrial dynamics in adaptive and maladaptive cellular stress responses. Nat Cell Biol. 20 (7), 755-765 (2018).
- Sokolova, I. Bioenergetics in environmental adaptation and stress tolerance of aquatic ectotherms: linking physiology and ecology in a multi-stressor landscape. J Exp Biol. 224, 236802 (2021).
- Buttgereit, F., Brand, M. D. A hierarchy of ATP-consuming processes in mammalian cells). Biochem J. 312, 163-167 (1995).
- Schmid, D., Burmester, G. R., Tripmacher, R., Kuhnke, A., Buttgereit, F. Bioenergetics of human peripheral blood mononuclear cell metabolism in quiescent, activated, and glucocorticoid-treated states. Biosci Rep. 20 (4), 289-302 (2000).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21 (9), 1022-1033 (2020).
- Nelson, S. R., Li, A., Beck-Previs, S., Kennedy, G. G., Warshaw, D. M. Imaging ATP consumption in resting skeletal muscle: One molecule at a time. Biophys J. 119 (6), 1050-1055 (2020).
- Meyrat, A., von Ballmoos, C. ATP synthesis at physiological nucleotide concentrations. Sci Rep. 9 (1), 3070 (2019).
- Gouspillou, G., et al. Accurate determination of the oxidative phosphorylation affinity for ADP in isolated mitochondria. PLoS One. 6 (6), e20709 (2011).
- Holloway, G. P., et al. Age-associated impairments in mitochondrial ADP sensitivity contribute to redox stress in senescent human skeletal muscle. Cell Rep. 22 (11), 2837-2848 (2018).
- Pharaoh, G., Brown, J., Ranjit, R., Ungvari, Z., Van Remmen, H. Reduced adenosine diphosphate sensitivity in skeletal muscle mitochondria increases reactive oxygen species production in mouse models of aging and oxidative stress but not denervation. JCSM Rapid Commun. 4 (1), 75-89 (2021).
- Pharaoh, G., et al. The mitochondrially targeted peptide elamipretide (SS-31) improves ADP sensitivity in aged mitochondria by increasing uptake through the adenine nucleotide translocator (ANT). Geroscience. 45 (6), 3529-3548 (2023).
- Brunetta, H. S., Petrick, H. L., Vachon, B., Nunes, E. A., Holloway, G. P. Insulin rapidly increases skeletal muscle mitochondrial ADP sensitivity in the absence of a high lipid environment. Biochem J. 478 (13), 2539-2553 (2021).
- Brunetta, H. S., et al. Nitrate consumption preserves HFD-induced skeletal muscle mitochondrial ADP sensitivity and lysine acetylation: A potential role for SIRT1. Redox Biol. 52, 102307 (2022).
- Tyrrell, D. J., et al. Blood-cell bioenergetics are associated with physical function and inflammation in overweight/obese older adults. Exp Gerontol. 70, 84-91 (2015).
- Liepinsh, E., et al. Low-intensity exercise stimulates bioenergetics and increases fat oxidation in mitochondria of blood mononuclear cells from sedentary adults. Physiol Rep. 8 (12), e14489 (2020).
- Hedges, C. P., et al. Peripheral blood mononuclear cells do not reflect skeletal muscle mitochondrial function or adaptation to high-intensity interval training in healthy young men. J Appl Physiol. 126 (2), 454-461 (2019).
- DeConne, T. M., Muñoz, E. R., Sanjana, F., Hobson, J. C., Martens, C. R. Cardiometabolic risk factors are associated with immune cell mitochondrial respiration in humans. Am J Physiol Heart Circ Physiol. 319 (2), H481-H487 (2020).
- Zhou, B., et al. Boosting NAD level suppresses inflammatory activation of PBMCs in heart failure. J Clin Invest. 130 (11), 6054-6063 (2020).
- Altintas, M. M., DiBartolo, S., Tadros, L., Samelko, B., Wasse, H. Metabolic changes in peripheral blood mononuclear cells isolated from patients with end stage renal disease. Front Endocrinol (Lausanne). 12, 629239 (2021).
- Pence, B. D., Yarbro, J. R. Aging impairs mitochondrial respiratory capacity in classical monocytes). Exp Gerontol. 108, 112-117 (2018).
- vander Windt, G. J. W., Chang, C. H., Pearce, E. L. Measuring bioenergetics in T Cells using a Seahorse extracellular flux analyzer. Curr Protoc Immunol. 113, 11-14 (2016).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab Invest. 93 (6), 690-700 (2013).
- Buck, M. D., et al. Mitochondrial dynamics controls T Cell fate through metabolic programming. Cell. 166 (1), 63-76 (2016).
- Quinn, K. M., et al. Metabolic characteristics of CD8. Nat Commun. 11 (1), 2857 (2020).
- Scandalis, L., et al. Skeletal muscle mitochondrial respiration and exercise intolerance in patients with heart failure with preserved ejection fraction. JAMA Cardiol. 8 (6), 575-584 (2023).
- Rausser, S., et al. Mitochondrial phenotypes in purified human immune cell subtypes and cell mixtures. Elife. 10, e70899 (2021).
- Kramer, P. A., et al. Bioenergetics and the oxidative burst: protocols for the isolation and evaluation of human leukocytes and platelets. J Vis Exp. (85), e51301 (2014).
- Kramer, P. A., Ravi, S., Chacko, B., Johnson, M. S., Darley-Usmar, V. M. A review of the mitochondrial and glycolytic metabolism in human platelets and leukocytes: implications for their use as bioenergetic biomarkers. Redox Biol. 2, 206-210 (2014).
- Teodoro, J. S., Machado, I. F., Castela, A. C., Rolo, A. P., Palmeira, C. M. The evaluation of mitochondrial membrane potential using fluorescent dyes or a membrane-permeable cation (TPP+) electrode in isolated mitochondria and intact cells. Methods Mol Biol. 2184, 197-213 (2020).
- Hassan, H., Zakaria, F., Makpol, S., Karim, N. A. A link between mitochondrial dysregulation and idiopathic autism spectrum disorder (ASD): Alterations in mitochondrial respiratory capacity and membrane potential. Curr Issues Mol Biol. 43 (3), 2238-2252 (2021).
- Williams, A. S., et al. Disruption of Acetyl-Lysine turnover in muscle mitochondria promotes insulin resistance and redox stress without overt respiratory dysfunction. Cell Metab. 31 (1), 131-147 (2020).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods Enzymol. 542, 163-181 (2014).
- Chowdhury, S. R., Djordjevic, J., Albensi, B. C., Fernyhough, P. Simultaneous evaluation of substrate-dependent oxygen consumption rates and mitochondrial membrane potential by TMRM and safranin in cortical mitochondria. Biosci Rep. 36 (1), 00286 (2015).
- Vianello, C., et al. High-throughput microscopy analysis of mitochondrial membrane potential in 2D and 3D models. Cells. 12 (7), (2023).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- JoVE, Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE. , (2023).
- Geltink, R. I. K., Kyle, R. L., Pearce, E. L. Unraveling the complex interplay between T cell metabolism and function. Annu Rev Immunol. 36, 461-488 (2018).
- Sukumar, M., et al. Inhibiting glycolytic metabolism enhances CD8+ T cell memory and antitumor function. J Clin Invest. 123 (10), 4479-4488 (2013).
- Gerriets, V. A., et al. Foxp3 and Toll-like receptor signaling balance T. Nat Immunol. 17 (12), 1459-1466 (2016).
- MacIver, N. J., Michalek, R. D., Rathmell, J. C. Metabolic regulation of T lymphocytes. Annu Rev Immunol. 31, 259-283 (2013).
- Desdín-Micó, G., et al. T cells with dysfunctional mitochondria induce multimorbidity and premature senescence. Science. 368 (6497), 1371-1376 (2020).
- Yang, R., et al. Mitochondrial Ca2+ and membrane potential, an alternative pathway for Interleukin 6 to regulate CD4 cell effector function. Elife. 4, 06376 (2015).
- Straub, R. H., Cutolo, M., Buttgereit, F., Pongratz, G. Energy regulation and neuroendocrine-immune control in chronic inflammatory diseases. J Intern Med. 267 (6), 543-560 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon