Method Article
Fluorespirometria ad alta risoluzione per valutare i cambiamenti dinamici del potenziale di membrana mitocondriale nelle cellule immunitarie umane
In questo articolo
Riepilogo
I metodi per studiare la bioenergetica mitocondriale in concentrazioni di substrato fisiologicamente rilevanti nelle cellule immunitarie sono limitati. Forniamo un protocollo dettagliato che utilizza la fluorespirometria ad alta risoluzione per valutare i cambiamenti nella risposta del potenziale della membrana mitocondriale alla domanda di energia nelle cellule T umane, nei monociti e nelle cellule mononucleate periferiche.
Abstract
Le cellule mononucleate periferiche (PBMC) mostrano robusti cambiamenti nella capacità respiratoria mitocondriale in risposta alla salute e alla malattia. Sebbene questi cambiamenti non riflettano sempre ciò che accade in altri tessuti, come il muscolo scheletrico, queste cellule sono una fonte accessibile e preziosa di mitocondri vitali da soggetti umani. Le PBMC sono esposte a segnali sistemici che influiscono sul loro stato bioenergetico. Pertanto, l'espansione dei nostri strumenti per interrogare il metabolismo mitocondriale in questa popolazione chiarirà i meccanismi legati alla progressione della malattia. I saggi funzionali dei mitocondri sono spesso limitati all'utilizzo delle uscite respiratorie seguendo le concentrazioni massime di substrato, inibitore e disaccoppiatore per determinare l'intero intervallo di capacità respiratoria, che potrebbe non essere raggiungibile in vivo. La conversione dell'adenosina difosfato (ADP) in adenosina trifosfato (ATP) da parte dell'ATP-sintasi determina una diminuzione del potenziale di membrana mitocondriale (mMP) e un aumento del consumo di ossigeno. Per fornire un'analisi più integrata della dinamica mitocondriale, questo articolo descrive l'uso della fluorespirometria ad alta risoluzione per misurare la risposta simultanea del consumo di ossigeno e del potenziale di membrana mitocondriale (mMP) a concentrazioni fisiologicamente rilevanti di ADP. Questa tecnica utilizza l'estere metilmetil-rodamina (TMRM) per misurare la polarizzazione mMP in risposta alle titolazioni ADP dopo la massima iperpolarizzazione con substrati complessi I e II. Questa tecnica può essere utilizzata per quantificare come i cambiamenti nello stato di salute, come l'invecchiamento e le malattie metaboliche, influenzano la sensibilità della risposta mitocondriale alla domanda di energia nelle PBMC, nelle cellule T e nei monociti di soggetti umani.
Introduzione
La capacità di una cellula di funzionare e sopravvivere in un periodo di stress fisiologico dipende in gran parte dalla sua capacità di soddisfare il fabbisogno energetico per ripristinare l'omeostasi 1,2. La domanda di energia aumenta in risposta a una varietà di stimoli. Ad esempio, l'aumento della contrazione muscolare durante l'esercizio aumenta l'utilizzo di ATP e glucosio da parte del muscolo scheletrico e un aumento della sintesi proteica a seguito di infezione aumenta l'utilizzo di ATP da parte delle cellule immunitarie per la produzione e la proliferazione di citochine 3,4,5,6. Un picco nella domanda di energia innesca una serie di processi bioenergetici per ripristinare il rapporto ATP/ADP. Man mano che l'ATP viene consumato, i livelli di ADP aumentano e stimolano F1F0 ATP-sintasi (complesso V), che richiede una forza protomotrice per guidare la sua rotazione meccanica e la conversione catalitica di ADP in ATP all'interno del mitocondrio7. La forza protonatrice è un gradiente elettrochimico creato dal pompaggio di protoni durante il trasferimento di elettroni dai substrati all'ossigeno attraverso il sistema di trasporto degli elettroni (ETS) all'interno della membrana mitocondriale interna. La differenza risultante nella concentrazione di protoni (delta pH) e nel potenziale elettrico (potenziale di membrana) crea la forza protonatrice che guida la sintesi di ATP e il consumo di ossigeno in risposta alla domanda di energia, riducendo il rapporto ATP/ADP o aumentando i livelli di ADP. L'affinità dei mitocondri con l'ADP può essere determinata dal calcolo del Km o EC50 della respirazione stimolata dall'ADP di mitocondri isolati o cellule permeabilizzate 8,9. Questo metodo ha dimostrato che le fibre muscolari permeabilizzate degli esseri umani più anziani richiedono una maggiore concentrazione di ADP per stimolare il 50% della loro massima capacità di fosforilazione ossidativa rispetto a quelle dei soggetti più giovani9. Allo stesso modo, l'invecchiamento del muscolo scheletrico del topo richiede più ADP per ridurre la produzione di specie reattive dell'ossigeno mitocondriale (ROS)10,11. Inoltre, la sensibilità all'ADP è ridotta nelle fibre muscolari permeabilizzate dei topi con obesità indotta dalla dieta rispetto ai controlli ed è aumentata in presenza di insulina e dopo il consumo di nitrati12,13. Pertanto, la capacità dei mitocondri di rispondere alla domanda di energia varia in diverse condizioni fisiologiche, ma questo non è stato precedentemente esplorato nel contesto delle cellule immunitarie.
Le cellule mononucleate del sangue periferico (PBMC) sono comunemente utilizzate per studiare la bioenergetica cellulare in soggetti umani 14,15,16,17,18,19,20. Ciò è in gran parte dovuto al fatto che le cellule sono facilmente ottenibili da campioni di sangue non coagulato negli studi clinici, alla reattività delle cellule alle perturbazioni metaboliche e ai metodi sviluppati da vari gruppi per interrogare il metabolismo mitocondriale utilizzando inibitori e disaccoppiatori per determinare la capacità massima e minima della respirazione mitocondriale21,22. Questi metodi hanno portato ad un apprezzamento dei ruoli della bioenergetica nell'invecchiamento, nelle malattie metaboliche e nella funzione immunitaria 14,20,23,24. La capacità respiratoria mitocondriale è spesso ridotta nel muscolo scheletrico e nelle PBMC in condizioni di insufficienza cardiaca 18,25. I bioenergetici PBMC sono anche correlati con fattori di rischio cardiometabolico negli adulti sani17 e rispondono a trattamenti come la nicotinamide riboside18. Le PBMC includono neutrofili, linfociti (cellule B e cellule T), monociti, cellule natural killer e cellule dendritiche, che contribuiscono alla capacità mitocondriale delle PBMC 26,27,28. Inoltre, la bioenergetica cellulare svolge un ruolo cruciale nell'attivazione, proliferazione e rinnovamento delle cellule immunitarie23. Tuttavia, una limitazione di questi metodi è che le cellule non funzionano sotto una gamma fisiologica di substrati. Sono quindi necessari metodi aggiuntivi per interrogare la funzione mitocondriale in concentrazioni di substrato che sono più rilevanti per ciò che le cellule sperimentano in vivo.
Il potenziale di membrana mitocondriale (mMP) è il componente principale di una forza protonmotrice ed è essenziale per una varietà di processi mitocondriali oltre alla produzione di ATP, come la regolazione del flusso respiratorio, la produzione di specie reattive dell'ossigeno, l'importazione di proteine e ioni, l'autofagia e l'apoptosi. L'mMP può essere valutato con sonde elettrochimiche o coloranti fluorescenti sensibili ai cambiamenti nella polarizzazione della membrana come JC-1, Rhod123, DiOC6, tetrametil rodamina (TMRE) o estere metilico (TMRM) e safranina. Gli ultimi due sono coloranti cationici lipofili che sono stati utilizzati con successo nella fluorespirometria ad alta risoluzione di omogeneizzati tissutali, mitocondri isolati e tessuti permeabilizzati 11,29,30,31,32,33. In questa tecnica, il TMRM viene utilizzato in modalità quench, in cui le cellule sono esposte a un'alta concentrazione di TMRM che si accumula nella matrice mitocondriale quando polarizzata (elevata mMP e forza protomotrice), con conseguente quenching della fluorescenza citosolica del TMRM. Quando i mitocondri si depolarizzano in risposta all'ADP o ai disaccoppiatori, il colorante viene rilasciato dalla matrice, aumentando il segnale fluorescente TMRM34,35. Lo scopo di questo metodo è quello di misurare simultaneamente i cambiamenti nella respirazione mitocondriale e nella mMP in risposta alle titolazioni di ADP in PBMC di derivazione umana, monociti circolanti e cellule T, e può anche essere applicato a cellule T spleniche di topo.
Protocollo
La raccolta di campioni di sangue per lo sviluppo dei dati e dei metodi qui presentati è stata approvata dall'Internal Review Board dell'Università di Washington. I risultati rappresentativi includono anche i dati dei topi maschi C57BL/6J (5-7 mesi) acquistati dai Jackson Laboratories. Tutte le procedure per gli animali sono state approvate dall'Ufficio per il benessere degli animali dell'Università di Washington. La panoramica del protocollo è illustrata nella Figura 1. La preparazione dei reagenti per questo protocollo è disponibile nel file supplementare 1.
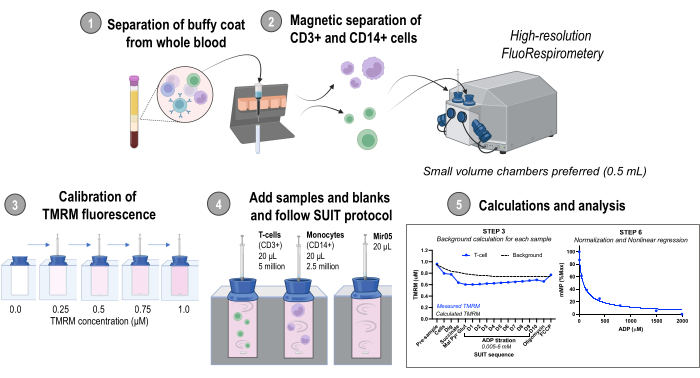
Figura 1: Panoramica del protocollo. Flusso di lavoro che utilizza la fluorespirometria ad alta risoluzione per valutare i cambiamenti nel potenziale di membrana mitocondriale in monociti isolati (CD14+) e cellule T (CD3+) da campioni di sangue umano fresco. Abbreviazioni: TMRM, estere metilico tetrametilrodamina; SUIT, titolazioni substrato-disaccoppiatore-inibitore; ADP, adenosina difosfato; Scavare, digitonina; Mal, malato; Pyr, piruvato; Glut, glutammato; D1-10, 10 titolazioni ADP consecutive. Clicca qui per visualizzare una versione più grande di questa figura.
1. Separazione del buffy coat dal sangue intero
NOTA: L'isolamento cellulare è modificato da Kramer et al.27.
- Lasciare che l'RPMI, il gradiente di densità e la centrifuga raggiungano la temperatura ambiente. Sterilizzare la cabina di biosicurezza e i materiali prima di iniziare.
- Raccogliere il sangue venoso in tre provette da 10 mL K2EDTA. Capovolgere i tubi almeno 3 volte.
- Centrifugare le provette a 500 x g 10 min (22 °C, 9 accelerazione [acc], 2 decelerazione [dec]).
- Rimuovere 1 mL di plasma da ciascuna provetta e conservarlo a -80 °C per analisi future.
- Trasferire il plasma e metà dello strato di globuli rossi da ciascuna provetta in un'unica provetta conica da 50 mL. Aggiungere RPMI fino a 40 ml. Capovolgere almeno 3 volte.
- Stratificare lentamente 10 mL della soluzione al plasma in quattro provette coniche da 15 mL contenenti 3 mL del gradiente di densità.
- Centrifugare a 700 x g per 30 min (22 °C, 5 acc, 2 dec).
- Raccogli tutto il plasma e il buffy coat contenente le cellule mononucleate periferiche (PBMC) senza distruggere i globuli rossi.
- Centrifugare a 500 x g per 10 min (22 °C, 5 acc, 5 dec) e aspirare il surnatante.
- Lavare il pellet di PBMC 1x-2x risospendendolo in 10 mL di RPMI e centrifugando a 500 x g per 10 min (22 °C, 5 acc, 5 dec).
2. Separazione magnetica di cellule CD14+ e CD3+
- Posizionare una colonna nel campo magnetico di un separatore di celle magnetiche (vedere la Tabella dei materiali). Lavare la colonna con 3 mL di RP-5.
- Risospendere il pellet PBMC in 80 μl di RP-5 e 20 μl di microsfere anti-CD14 (vedere la tabella dei materiali). Incubare per 15 minuti a 4 °C.
- Risospendere le cellule con 1 mL di RP-5 e caricare la sospensione sulla colonna. Raccogliere le cellule non marcate che fluiscono in una provetta conica da 15 ml etichettata "Flow-through 1". Attendere che tutta la sospensione cellulare sia passata attraverso la colonna, quindi continuare il lavaggio con 3 mL di RP-5 3x, raccogliendo tutto il flusso.
- Rimuovere con cautela la colonna dal campo magnetico e posizionarla su una nuova provetta conica da 15 mL. Aggiungere 5 mL di RP-5 e utilizzare immediatamente lo stantuffo per spurgare il contenuto della colonna in una provetta di raccolta etichettata "CD14+".
- Centrifugare "Flow-through 1" a 500 x g per 10 min (22 °C, 5 acc, 5 dec) e aspirare il surnatante.
- Utilizzando le cellule del Flow-through 1, ripetere i passaggi 2.2-2.5 utilizzando microsfere anti-CD3 (vedere la Tabella dei materiali) per isolare le cellule T.
- Provette da centrifuga contenenti cellule T (CD3+) e monociti (CD14+) a 300 x g per 5 min. Aspirare il surnatante e risospendere il pellet in 1 mL di RP-5.
- Determinare la concentrazione cellulare utilizzando un emocitometro o un contatore automatico di cellule.
NOTA: Le cellule possono essere contate aggiungendo 10 μL di una diluizione cellulare di 1:10 o 1:20 a un emocitometro. Si può fare riferimento a protocolli precedentemente pubblicati per contare le cellule utilizzando un emocitometro36. - Pipettare 2,5 milioni di monociti o 5 milioni di cellule T in una nuova provetta da centrifuga. Centrifugare per 30 s a 2000 x g, aspirare il surnatante e risospendere le cellule in MiR05 per un volume totale di 20 μL e una concentrazione finale di 125 milioni di monociti o 250 milioni di cellule T per mL.
NOTA: La concentrazione finale è stata selezionata per iniettare 2,5 milioni di monociti o 5 milioni di cellule T in un volume di 20 μL. Anche le cellule T di topo isolate dalla milza sono state testate utilizzando questo metodo. La procedura si trova nel file supplementare 1.
3. Fluorespirometria ad alta risoluzione - Calibrazione della fluorescenza di ossigeno e TMRM
NOTA: Questo metodo è stato adattato da precedenti lavori condotti su fibre permeabilizzate da Pharaoh et al.11. Un'elevata concentrazione non inibitoria di TMRM viene utilizzata per la modalità quench, in cui la relazione tra mMP e concentrazione di TMRM nella matrice è invertita. Pertanto, una diminuzione di mMP porta al rilascio del colorante TMRM dalla matrice e ad un aumento della fluorescenza32.
- Installare camere da 0,5 mL nel respirometro O2K secondo le istruzioni del produttore (vedere la Tabella dei materiali). Accendere lo strumento e collegarlo al software fornito dal produttore per l'acquisizione dei dati.
- Regolare la temperatura a 37 °C e la velocità di agitazione a 750 giri/min.
- Lavare le camere con acqua distillata 3 volte. Sostituire l'acqua con 0,54 ml di Mir05, chiudere completamente i tappi e rimuovere il tampone in eccesso con il sistema di aspirazione integrato (ISS). Sollevare i tappi per consentire all'ossigeno ambiente di equilibrarsi con l'ossigeno della camera utilizzando un distanziatore per tappo.
- Una volta che il flusso di ossigeno è stabile, eseguire la calibrazione dell'ossigeno nell'aria (R1) secondo le istruzioni del produttore.
NOTA: Potrebbero essere necessari >30 minuti prima che il flusso di ossigeno si stabilizzi. I sensori di ossigeno richiedono la determinazione dell'ossigeno di punto zero (R0) e del flusso di ossigeno di fondo da 50 a 200 μM da esperimenti separati utilizzando titolazioni di ditionite. I metodi specifici sono disponibili nel manuale del produttore. - Sigillare la camera chiudendo i tappi.
NOTA: A differenza degli esperimenti che utilizzano fibre permeabili, le camere non richiedono iperossigenazione per le PBMC. La sigillatura della camera dopo la calibrazione R1 fornisce ossigeno sufficiente per l'esperimento. I livelli di ossigeno devono essere mantenuti tra 50 e 250 μM. Se la concentrazione di ossigeno scende al di sotto della soglia, la camera può essere parzialmente aperta in modo che l'ossigeno della camera possa equilibrarsi con l'ossigeno dell'aria ambiente. - Taratura TMRM
- Utilizzare i fluo-sensori LED verdi (es. 525 nm) con il set di filtri AmR (vedi Tabella dei materiali). Impostare il guadagno del fluorimetro su 1000 e l'intensità su 1000. Accendi i sensori di fluo e inizia a registrare la linea di base.
- Iniettare 2,5 μL di TMRM da 0,05 mM e lasciare che il segnale si stabilizzi (~2 min) prima della successiva iniezione di 2,5 μL fino a quando non vengono eseguite un totale di 4 iniezioni per una concentrazione totale di TMRM di 1 μM TMRM nella camera. Utilizzare una siringa Hamilton per tutte le iniezioni.
- Calibrare il sensore di fluo selezionando il segnale fluorescente (tensione) per ciascuna iniezione che rappresenta 0, 0,25, 0,5, 0,75 e 1,0 μM di TMRM per una calibrazione a cinque punti.
4. Protocollo di titolazione SUIT (Substrate-Uncoupler-Inhibitor)
NOTA: Eseguire esperimenti in bianco in cui 20 μL di Mir05 vengono iniettati nella camera invece di 20 μL di sospensione cellulare, poiché il segnale TMRM cambierà in risposta alle sole iniezioni (discusso nei risultati rappresentativi). Lasciare che il segnale del flusso di ossigeno si stabilizzi (circa 2-3 minuti) prima dell'iniezione successiva sia per gli esperimenti in bianco che per quelli con campione. Il seguente protocollo di titolazione e le osservazioni previste sono riportati nella Tabella 1.
- Una volta che il flusso di ossigeno è stabile, selezionare ed etichettare sia il flusso di ossigeno che il segnale TMRM come "pre-cella".
- Iniettare la sospensione cellulare contenente 5 milioni di cellule T o 2,5 milioni di monociti in ~20 μL e misurare per circa 10 minuti. Selezionare ed etichettare sia il flusso di ossigeno che il segnale TMRM come "Cella".
- Permeabilizzare le cellule iniettando 2 μL di 1 mg/mL di digitonina (concentrazione finale: 4 μg/mL). Attendere 20 min. Selezionare ed etichettare sia il flusso di ossigeno che il segnale TMRM come "Dig".
NOTA: Si consiglia di ottimizzare la concentrazione di digitonina in esperimenti separati. - Aggiungere 2,5 μl di 1 M succinato (concentrazione finale: 5 mM). Selezionare ed etichettare sia il flusso di ossigeno che il segnale TMRM come "SUCC".
- Una volta che il flusso di ossigeno è stabile, aggiungere 5 μL di malato 100 mM (concentrazione finale: 1,0 mM), 5 μL di glutammato 1 M (concentrazione finale: 10 mM) e 5 μL di piruvato 500 mM (concentrazione finale: 5 mM). Selezionare ed etichettare sia il flusso di ossigeno che il segnale TMRM come "MPG".
- Una volta che il flusso di ossigeno è stabile, titolare l'ADP. Selezionare le dosi per ogni titolazione ed etichettarle "D" in sequenza da 1 a 10, a seconda del numero di titolazioni. Utilizzare lo schema di titolazione riportato nella Tabella 2.
- Una volta che il flusso di ossigeno è stabile, eseguire una serie di titolazioni da 1 μL di 0,25 mM di cianuro di carbonile p-(tri-flurometossi) fenil-idrazone (FCCP) fino a quando il segnale fluorescente non raggiunge il suo massimo. Selezionare ed etichettare sia il flusso di ossigeno che il segnale TMRM che rappresenta il potenziale minimo di membrana ed etichettarlo come "FCCP".
NOTA: Di solito è necessaria una concentrazione di FCCP di 0,5-1,0 μM per esaurire il potenziale di membrana mitocondriale.
ATTENZIONE: FCCP è tossico. Fare riferimento alla scheda di sicurezza (SDS) per una corretta gestione. - OPZIONALE: Una volta che il flusso di ossigeno è stabile, iniettare 1 μL di rotenone 0,25 mM per inibire il complesso I e determinare la capacità respiratoria attraverso il complesso II.
NOTA: Le variazioni del potenziale di membrana non sono più rilevanti dopo la titolazione con il disaccoppiatore.
ATTENZIONE: Il rotenone è tossico. Fare riferimento a SDS per una corretta gestione. - Una volta che il flusso di ossigeno è stabile, iniettare 1 μL di 1,25 mM (concentrazione finale: 2,5 μM) di Antimicina A per inibire la respirazione mitocondriale.
ATTENZIONE: L'antimicina A è tossica. Fare riferimento a SDS per una corretta gestione.
5. Calcolo del potenziale di membrana mitocondriale e analisi
- Utilizzando esperimenti in bianco, registrare i valori TMRM calibrati (TMRM micromolare) prima dell'iniezione del campione bianco ("pre-campione") e per ciascuna delle iniezioni. Vedere la Figura 2.
- Per ogni esperimento in bianco, calcolare il rapporto di fondo impostando la concentrazione di TMRM "pre-campione" su 1,0. Calcola la successiva diminuzione proporzionale del TMRM. Calcola il rapporto medio di sfondo da tutti gli esperimenti vuoti.
NOTA: Il numero di esperimenti in bianco da includere può dipendere dalla precisione dello strumento. Si veda l'esempio di calcolo nella Tabella 3 di cinque diversi esperimenti in bianco, in cui la deviazione standard del rapporto medio di fondo è scesa tra 0 e 0,016 per ogni titolazione. - Calcolo del background: calcola il background per ogni esperimento campione moltiplicando il TMRM "pre-campione" dell'esperimento campione moltiplicato per il rapporto medio di fondo per ogni iniezione. Vedere l'esempio di calcolo nella Tabella 3.
- Correzione dello sfondo: sottrae lo sfondo dell'esperimento ai valori TMRM misurati del campione. Vedere l'esempio di calcolo nella Tabella 4.
- Correzione FCCP: sottrae l'mMP corretto in background FCCP da ogni iniezione. Vedere l'esempio di calcolo nella Tabella 4.
- Curva di sensibilità ADP: normalizza la diminuzione di mMP guidata dall'ADP impostando il potenziale di membrana più alto e più basso rispettivamente come 100% e 0%, utilizzando i valori mMP raccolti durante la titolazione ADP. Inserire i dati in un modello di regressione di adattamento non lineare utilizzando il software statistico preferito per calcolare la concentrazione inibitoria semimassimale (IC50) di ADP su mMP.
NOTA: La curva si adatta alla risposta [Inibitore] rispetto alla risposta normalizzata - Pendenza variabile in Prism.
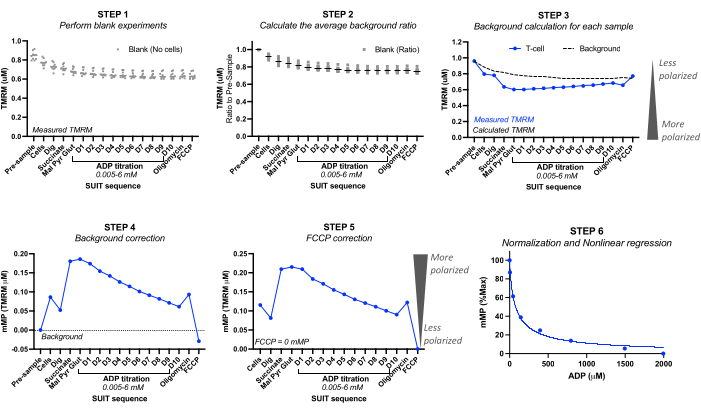
Figura 2: Calcolo del potenziale di membrana mitocondriale (mMP) e della sensibilità all'ADP dalla fluorescenza TMRM. Passaggi per il calcolo del potenziale di membrana mitocondriale (mMP) e della sensibilità all'ADP dalle misurazioni della fluorescenza TMRM mediante fluorespirometria ad alta risoluzione di un campione di cellule T (n = 1). Fase 1: La fluorescenza TMRM viene misurata in campioni bianchi come fatto nel campione biologico. Fase 2: Determinare il rapporto nel segnale TMRM ad ogni titolazione rispetto al segnale prima del campione per ogni esperimento in bianco. Calcolare la media per ogni titolazione di tutti gli esperimenti in bianco. Passaggio 3: calcolare il background per ogni esperimento campione moltiplicando la fluorescenza "pre-campione" per il rapporto medio di fondo per ogni titolazione. Passaggio 4: calcolare la differenza tra la fluorescenza TMRM di fondo e quella del campione per ogni titolazione per esprimere i dati come assorbimento di TMRM mMP o mitocondriale. Passaggio 5: Correggere mMP in modo che il disaccoppiamento completo con FCCP rifletta zero mMP. Passaggio 6: eseguire la regressione non lineare per rappresentare graficamente le variazioni in mMP con l'aumento delle concentrazioni di ADP. Le misurazioni sono state eseguite in camere da 0,5 mL, una contenente 5 milioni di cellule T di un volontario sano. I dati medi sono espressi come media ± SEM. I singoli punti dati di una singola replica sono espressi senza barre di errore. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
Per illustrare le differenze nella concentrazione ottimale delle cellule per il test, 5 milioni di cellule T sono state caricate in una camera da 0,5 mL (10 milioni di cellule/mL) e 1,25 milioni di cellule sono state caricate in un'altra camera (2,5 milioni di cellule/mL) contenente 1 μM di TMRM (Figura 3A-G). Sono stati inclusi anche tre esperimenti in bianco per calcolare il background TMRM. Abbiamo scoperto che una maggiore concentrazione di cellule T ha comportato un cambiamento più distinguibile nella fluorescenza TMRM rispetto al fondo (Figura 3B, D). Inoltre, una maggiore concentrazione cellulare ci ha permesso di rilevare l'aumento previsto del consumo di ossigeno e la simultanea deplezione del mMP in risposta all'aggiunta di FCCP (Figura 3E, F). L'uso di una bassa concentrazione di cellule ha prodotto un debole cambiamento nella fluorescenza che è parallelo allo sfondo. Poiché il calcolo di mMP sottrae il fondo dal segnale, una bassa concentrazione di celle non consente di determinare le variazioni di mMP in risposta a substrati e disaccoppiatori. Oltre a utilizzare le concentrazioni più elevate di cellule in questo saggio, si consiglia di mantenere costante la concentrazione cellulare per ogni tipo di cellula tra un esperimento e l'altro.
Per convalidare l'influenza dell'ATP-sintasi nella dissipazione di mMP con titolazioni ADP, abbiamo condotto esperimenti paralleli su PBMC e cellule T in cui una camera ha ricevuto oligomicina prima della titolazione ADP (Figura 4). Non abbiamo riscontrato alcuna dissipazione di mMP in risposta all'ADP nelle cellule trattate con oligomicina, suggerendo che la graduale diminuzione di mMP con ADP è il risultato del flusso di protoni attraverso l'ATP-sintasi (Figura 4A-F). Abbiamo anche confrontato la sensibilità all'ADP tra le cellule T e le PBMC dello stesso partecipante e abbiamo scoperto che la sensibilità all'ADP era inferiore (EC50 più alta) nella frazione delle cellule T (Figura 4G, H).
Abbiamo condotto una serie di esperimenti in bianco per determinare l'influenza del tempo o del protocollo SUIT sulla fluorescenza TMRM. Abbiamo scoperto che il segnale TMRM negli esperimenti in bianco è principalmente influenzato dalle titolazioni SUIT (Figura 5A) rispetto alla tempistica delle titolazioni (Figura 5B).
Abbiamo confrontato i cambiamenti indotti dall'ADP nei tassi di consumo di ossigeno (OCR) e nel mMP nelle cellule T e nei monociti di 11 volontari sani che vivono in comunità (Figura 6A-H). Analogamente ai risultati di esperimenti precedentemente pubblicati utilizzando il flusso extracellulare e saggi enzimatici, i monociti hanno mostrato una maggiore capacità respiratoria mitocondriale rispetto ai linfociti26,27 (Figura 6A,H). Tuttavia, non abbiamo rilevato un tipico aumento dose-risposta nell'OCR con ADP in entrambi i tipi di cellule (Figura 6C, D), contrariamente a quanto mostrato da questo metodo quando si utilizzano tessuti altamente metabolici come il fegato di topo (Figura 7A-H). D'altra parte, l'uso del TMRM ci ha permesso di rilevare un graduale declino della mMP con ADP nelle cellule immunitarie umane (Figura 6E-G) e nelle cellule T spleniche dei topi (Figura 7E-H). Sebbene non abbiamo confrontato direttamente le cellule T umane e di topo utilizzando lo stesso protocollo di titolazione, abbiamo scoperto che l'IC50 delle cellule T di topo era inferiore di un fattore 10 rispetto a quello delle cellule T circolanti di soggetti umani.
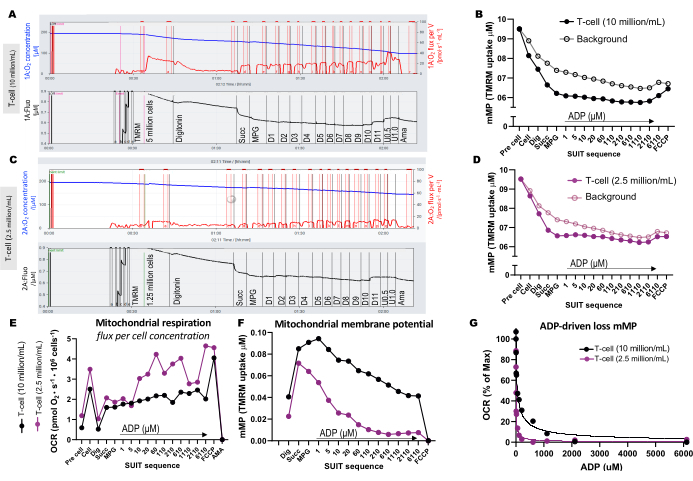
Figura 3: Esperimenti di fluorespirometria ad alta risoluzione. (A-D) Traccia di esperimenti di fluorespirometria ad alta risoluzione utilizzando concentrazioni di cellule T di 10 milioni di cellule/mL e 2,5 milioni di cellule/mL in camere da 0,5 mL. (A) 10 milioni di cellule/mL in camere da 0,5 mL. (C) 2,5 milioni di cellule/mL in camere da 0,5 mL. Il flusso di ossigeno (pmol/s/mL) è mostrato nel pannello superiore (rosso) e il segnale TMRM calibrato è mostrato nel pannello inferiore (nero). Le variazioni del TMRM in tutto il SUIT per il campione e il suo background calcolato sono stati tracciati per le camere contenenti (B) 10 milioni di cellule/mL e (D) 2,5 milioni di cellule/mL. (E) Per ogni concentrazione cellulare, sono stati calcolati il flusso di ossigeno (pmol/s/milione di cellule) e (F) il potenziale di membrana mitocondriale. (G) La curva di sensibilità ADP è stata tracciata e adattata a un modello di regressione non lineare (linee continue). Abbreviazioni: mMP, potenziale di membrana mitocondriale; TMRM, estere metilico di tetrametilrodammina; SUIT, titolazioni substrato-disaccoppiatore-inibitore; ADP, adenosina difosfato; Scavare, digitonina; Mal, malato; Pyr, piruvato; Glut, glutammato; D1-11, 11 titolazioni ADP consecutive; U, disaccoppiatore FCCP di 0,5 e 1,0 μM; AMA, antimicina A. Clicca qui per visualizzare una versione più grande di questa figura.
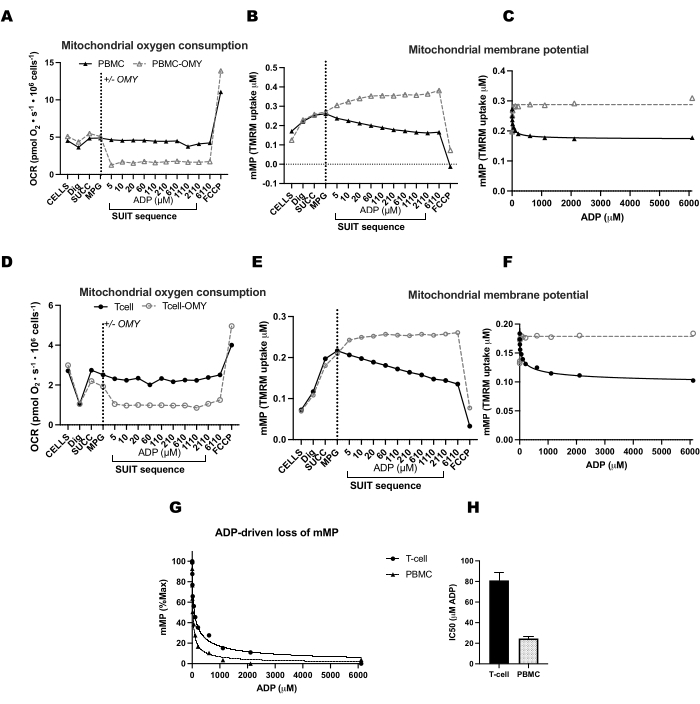
Figura 4: L'ATP-sintasi guida la diminuzione del potenziale di membrana guidata dall'ADP nelle cellule T e nelle PBMC. (A-H) Il protocollo qui descritto è stato testato in PBMC e cellule T. Due camere di O2K sono state iniettate con PBMC e due camere di un ulteriore O2K sono state iniettate con cellule T dello stesso partecipante. Dopo aver iniettato i substrati malato, piruvato e glutammato in tutte le camere, una camera di PBMC e cellule T ha ricevuto oligomicina. L'oligomicina ha impedito qualsiasi aumento della respirazione guidato dall'ADP nelle (A) PBMC e (D) nelle cellule T o il declino del potenziale di membrana mitocondriale nelle (B,C) PBMC e nelle (E,F) cellule T. (G,H) La sensibilità all'ADP era maggiore nelle PBMC rispetto alle cellule T. Clicca qui per visualizzare una versione più grande di questa figura.
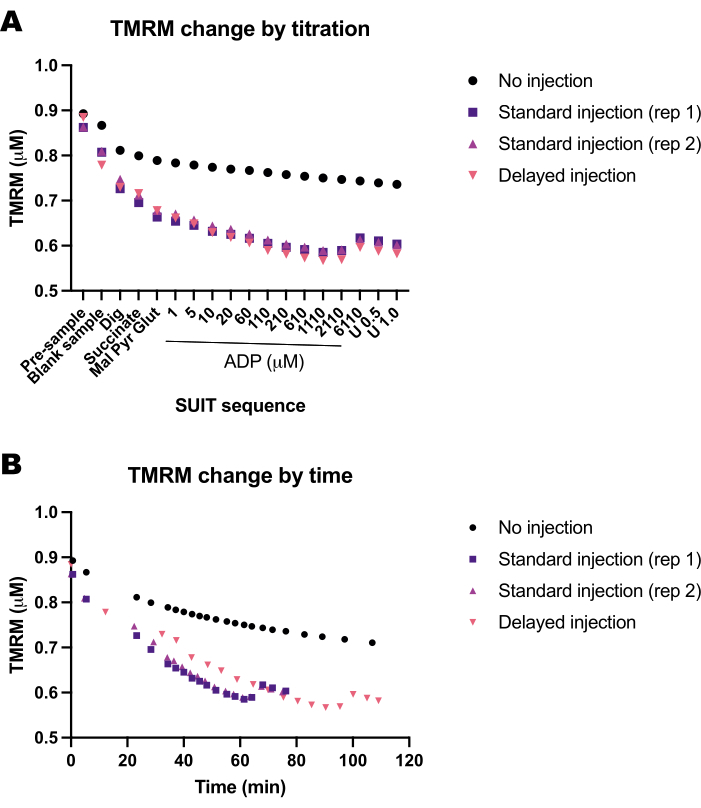
Figura 5: Esperimenti in bianco mostrano la variazione della fluorescenza TMRM in risposta al tempo e alle titolazioni di substrati, disaccoppiatori e inibitori (SUIT). (A) Variazione della fluorescenza del TMRM in risposta alla titolazione. (B) Variazione della fluorescenza TMRM in risposta al tempo. Gli esperimenti sono stati condotti in camere da 0,5 mL riempite con Mir05 contenenti 1 μM di TMRM. Una camera non ha ricevuto alcuna titolazione SUIT (nessuna iniezione); due camere in due strumenti diversi hanno ricevuto un protocollo di tuta standard (iniezione standard); una camera ha ricevuto le stesse titolazioni SUIT ma con un ritardo tra ogni iniezione (iniezione ritardata). Clicca qui per visualizzare una versione più grande di questa figura.
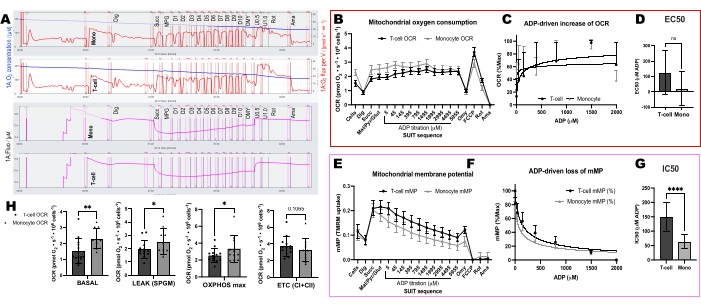
Figura 6: Differenze nella sensibilità all'ADP tra cellule T e monociti utilizzando OCR e mMP. (A) Traccia dell'esperimento di fluorespiromemia ad alta risoluzione dal campione di monociti e cellule T di un soggetto. (B) Consumo di ossigeno nei monociti (n= 11) e nelle cellule T (n= 13) dal sangue di volontari sani. (C, D) Adattamento di regressione non lineare dell'aumento tracciato della respirazione con titolazioni ADP per calcolare un EC50. (E) Misurazione simultanea del potenziale di membrana mitocondriale. (F,G) Adattamento di regressione non lineare del declino tracciato del potenziale di membrana mitocondriale con titolazioni ADP per calcolare un IC50. (H) Parametri della capacità respiratoria dei monociti e delle cellule T. I dati sono espressi come media ± SEM per i grafici a linee e media ± SD per i grafici a barre. Le differenze statisticamente significative dopo i test t sono espresse come *p < 0,05. **p < 0,01 e ****p < per 0,0001. Clicca qui per visualizzare una versione più grande di questa figura.
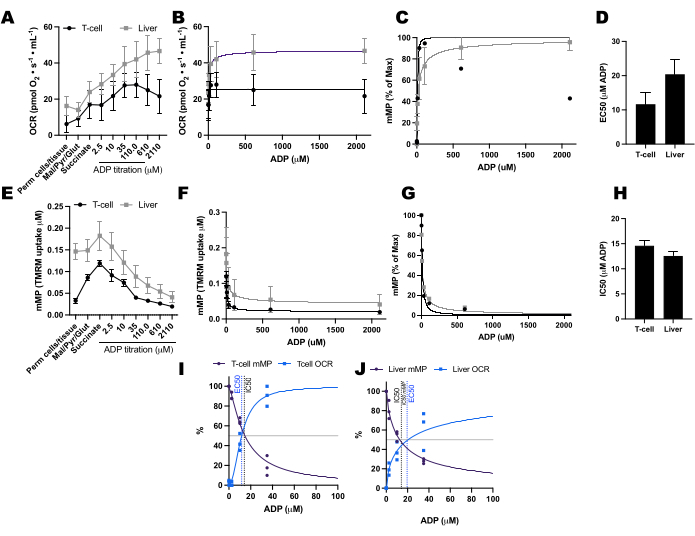
Figura 7: Confronto della risposta ADP nella respirazione e del potenziale di membrana mitocondriale (mMP) nelle cellule T spleniche di topo permeabilizzate e nel fegato. (A-D) Risposta nella respirazione nelle cellule T spleniche di topo permeabilizzate e nel fegato. (E-H) Risposta in mMP nelle cellule T spleniche di topo permeabilizzate e nel fegato. Il fegato e la milza freschi sono stati sezionati da tre topi dopo la lussazione cervicale. Le cellule T Pan spleniche sono state isolate utilizzando la separazione di biglie magnetiche coniugate con anticorpi. Entrambi i campioni sono stati sottoposti allo stesso protocollo SUIT in presenza di TMRM da 1 μM. (I,J) Confronto tra EC50 calcolato dall'aumento del consumo di ossigeno (OCR) e IC50 dalla diminuzione di mMP in risposta all'ADP. N = 3 per gruppo. I dati sono espressi come media ± SEM. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Esempio di protocollo SUIT per valutare il potenziale di membrana mitocondriale in cellule T e monociti appena isolati utilizzando le camere da 0,5 mL. Clicca qui per scaricare questa tabella.
Tabella 2: Titolazione ADP consigliata per camera da 0,5 mL. Clicca qui per scaricare questa tabella.
Tabella 3: Calcolo del rapporto medio di fondo utilizzando cinque esperimenti in bianco indipendenti. Clicca qui per scaricare questa tabella.
Tabella 4: Calcolo del potenziale di membrana mitocondriale (mMP) dall'esperimento del campione. Clicca qui per scaricare questa tabella.
Figura 1 supplementare: Effetto di Mir05 e DMSO sulla respirazione mitocondriale e sul potenziale di membrana. Clicca qui per scaricare questo file.
File supplementare 1: Preparazione del reagente e protocollo per l'isolamento delle cellule T dalla milza di topo. Clicca qui per scaricare questo file.
Discussione
Questo protocollo utilizza la fluorespirometria ad alta risoluzione per misurare la sensibilità della risposta mitocondriale alla domanda di energia misurando la dissipazione di mMP in risposta all'aumento dei livelli di ADP in PBMC, monociti e cellule T. Questo viene fatto aggiungendo substrati complessi I e II per massimizzare il potenziale di membrana mitocondriale e titolando l'ADP per stimolare gradualmente l'ATP-sintasi a utilizzare il gradiente protonico per la generazione di ATP.
Le fasi critiche del protocollo includono l'impostazione del guadagno e dell'intensità del fluoroforo su 1000 e l'acquisizione di un segnale fluorescente TMRM durante la titolazione TMRM. Poiché la fluorescenza TMRM diminuisce dopo ogni titolazione (una limitazione di questo metodo), è imperativo eseguire esperimenti in background utilizzando campioni bianchi. Abbiamo anche scoperto che il DMSO ha un effetto inibitorio sulla respirazione mitocondriale e sul potenziale di membrana e, pertanto, raccomandiamo di diluire la soluzione di lavoro di TMRM in Mir05 (Figura 1 supplementare).
Alcune modifiche che possono essere utilizzate quando si prova questo protocollo sono la regolazione delle concentrazioni cellulari e l'utilizzo della camera standard da 2 ml. Tuttavia, la camera da 0,5 mL è preferita per le cellule T e i monociti a causa dell'elevata concentrazione di cellule necessarie per una risposta ottimale nel potenziale di membrana e nel flusso di ossigeno. Una concentrazione più bassa di cellule può essere ottimale quando si testano cellule con una maggiore capacità respiratoria, come i macrofagi.
Ulteriori limitazioni del metodo qui presentato includono la necessità di almeno 5 milioni di cellule T e 2,5 milioni di monociti. Spesso possiamo ottenere abbastanza cellule da ~20 ml di sangue da partecipanti sani, ma questi numeri possono variare in base allo stato di salute, all'età e al sesso26. Inoltre, come nella maggior parte dei metodi di valutazione della capacità mitocondriale, le cellule devono essere appena isolate. Tuttavia, questo metodo potrebbe essere provato in futuro nelle cellule crioconservate. Rispetto alla resa del sangue umano, la resa delle cellule T della milza di topi sani è abbastanza alta per condurre questo test.
Le cellule T circolanti, in particolare le cellule a memoria (TM) e regolatorie (Treg), si basano sulla fosforilazione ossidativa per produrre energia37. Sebbene la loro richiesta di energia e il consumo di ossigeno siano bassi (ad esempio, rispetto a quelli del muscolo a riposo), la loro sopravvivenza è essenziale per un'efficace risposta immunitaria alla reinfezione e al cancro 38,39,40. Una riduzione della fosforilazione ossidativa delle cellule T provoca una ridotta capacità proliferativa e promuove l'esaurimento e la senescenza delle cellule T 5,41. Inoltre, l'iperpolarizzazione mitocondriale promuove una produzione sostenuta di citochine (IL-4 e IL-21) da parte delle cellule T effettrici CD4 durante l'attivazione42. Dopo l'infezione, il fabbisogno energetico per l'attivazione e la proliferazione delle cellule immunitarie può raggiungere il 25%-30% del tasso metabolico basale43. Pertanto, le cellule immunitarie funzionano in una gamma ampia ed estrema di richieste energetiche e questo protocollo può testare le risposte mitocondriali all'interno di tale intervallo.
L'infiammazione cronica è una caratteristica comune dell'obesità, del diabete e dell'invecchiamento. I livelli disregolati di ormoni, lipidi e glucosio circolanti hanno un impatto sistemico e possono quindi influenzare il modo in cui i mitocondri rispondono a una sfida energetica. Qui, abbiamo presentato un metodo per valutare la sensibilità all'ADP mitocondriale nelle PBMC circolanti. Sono necessari ulteriori studi per determinare in che modo la sensibilità all'ADP possa essere modulata nelle malattie metaboliche e in che modo influisca sullo stato di salute.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Ringraziamo i gentili volontari che hanno donato il sangue per questo progetto. Estendiamo anche il nostro sincero apprezzamento alla dottoressa Ellen Schur e al suo team per averci fornito ulteriori campioni dal loro studio. Vorremmo anche ringraziare Andrew Kirsh per aver esaminato il manoscritto e averlo modificato per verificarne la leggibilità. Questo lavoro è stato sostenuto dalle seguenti fonti di finanziamento: P01AG001751, R01AG078279, P30AR074990, P30DK035816, P30DK017047, R01DK089036, K01HL154761, T32AG066574.
Materiali
| Name | Company | Catalog Number | Comments |
| Adenosine Diphosphate | Sigma-Aldrich | A5285 | Fluorespirometry |
| Antimycin A | Sigma-Aldrich | A8674 | Fluorespirometry |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A6003 | Mir05 buffer |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | Cell isolation |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920 | Fluorespirometry |
| Cell strainers | Fisher Scientific | 22-363-548 | Isolation of T-cells from mouse spleen protocol |
| CD14 Microbeads, human | Miltenyi Biotec | 130-050-201 | Cell isolation |
| CD3 Microbeads, human | Miltenyi Biotec | 130-050-101 | Cell isolation |
| DatLab | Oroboros | Version 8 | |
| Digitonin | Sigma-Aldrich | D141 | Fluorespirometry |
| D-Sucrose | Sigma-Aldrich | 84097 | Mir05 buffer |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N′,N′-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | Mir05 buffer |
| Filter Set AmR | Oroboros | 44321-01 | |
| HBSS (10x) | Gibco | 12060-040 | |
| HEPES sodium salt | Sigma-Aldrich | H7523 | Mir05 buffer |
| Histopaque 1077 | Sigma-Aldrich | 10771 | Cell isolation |
| K2EDTA blood collection tubes | BD Vacutainer | 366643 | Cell isolation |
| Lactobionic acid | Sigma-Aldrich | 153516 | Mir05 buffer |
| L-Glutamic acid | Sigma-Aldrich | G1626 | Fluorespirometry |
| L-Malic Acid | Sigma-Aldrich | M1000 | Fluorespirometry |
| LS Columns | Miltenyi Biotec | 130-042-401 | Cell isolation |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | M9272 | Mir05 buffer |
| Multi-MACS stand and MidiMACS Separator | Miltenyi Biotec | 130-042-301 | Cell isolation |
| O2k-Fluo Smart-Module | Oroboros | 12100-03 | |
| O2k-FluoRespirometer series J | Oroboros | 10201-03 | |
| O2k-sV-Module (0.5 chamber) | Oroboros | 11200-01 | |
| Oligomycin | Sigma-Aldrich | 04876 | Fluorespirometry |
| Pan T Cell Isolation Kit II, mouse | Miltenyi | 130095130 | Isolation of T-cells from mouse spleen protocol |
| Potassium dihydrogen phosphate (KH2PO4) | Sigma-Aldrich | P0662 | Mir05 buffer |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473 | Mir05 buffer |
| Prism | GraphPad | Version 10 | |
| Rotenone | Sigma-Aldrich | R8875 | Fluorespirometry |
| RPMI Buffer | Corning | 17-105-CV | Cell isolation |
| Sodium Pyruvate | Sigma-Aldrich | P2256 | Fluorespirometry |
| Succinate disodium salt | Sigma-Aldrich | S2378 | Fluorespirometry |
| Taurine | Sigma-Aldrich | T0625 | Mir05 buffer |
| Tetramethyrhodamine methyl ester perchlorite | Sigma-Aldrich | T5428 | Fluorespirometry |
Riferimenti
- Eisner, V., Picard, M., Hajnóczky, G. Mitochondrial dynamics in adaptive and maladaptive cellular stress responses. Nat Cell Biol. 20 (7), 755-765 (2018).
- Sokolova, I. Bioenergetics in environmental adaptation and stress tolerance of aquatic ectotherms: linking physiology and ecology in a multi-stressor landscape. J Exp Biol. 224, 236802 (2021).
- Buttgereit, F., Brand, M. D. A hierarchy of ATP-consuming processes in mammalian cells). Biochem J. 312, 163-167 (1995).
- Schmid, D., Burmester, G. R., Tripmacher, R., Kuhnke, A., Buttgereit, F. Bioenergetics of human peripheral blood mononuclear cell metabolism in quiescent, activated, and glucocorticoid-treated states. Biosci Rep. 20 (4), 289-302 (2000).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21 (9), 1022-1033 (2020).
- Nelson, S. R., Li, A., Beck-Previs, S., Kennedy, G. G., Warshaw, D. M. Imaging ATP consumption in resting skeletal muscle: One molecule at a time. Biophys J. 119 (6), 1050-1055 (2020).
- Meyrat, A., von Ballmoos, C. ATP synthesis at physiological nucleotide concentrations. Sci Rep. 9 (1), 3070 (2019).
- Gouspillou, G., et al. Accurate determination of the oxidative phosphorylation affinity for ADP in isolated mitochondria. PLoS One. 6 (6), e20709 (2011).
- Holloway, G. P., et al. Age-associated impairments in mitochondrial ADP sensitivity contribute to redox stress in senescent human skeletal muscle. Cell Rep. 22 (11), 2837-2848 (2018).
- Pharaoh, G., Brown, J., Ranjit, R., Ungvari, Z., Van Remmen, H. Reduced adenosine diphosphate sensitivity in skeletal muscle mitochondria increases reactive oxygen species production in mouse models of aging and oxidative stress but not denervation. JCSM Rapid Commun. 4 (1), 75-89 (2021).
- Pharaoh, G., et al. The mitochondrially targeted peptide elamipretide (SS-31) improves ADP sensitivity in aged mitochondria by increasing uptake through the adenine nucleotide translocator (ANT). Geroscience. 45 (6), 3529-3548 (2023).
- Brunetta, H. S., Petrick, H. L., Vachon, B., Nunes, E. A., Holloway, G. P. Insulin rapidly increases skeletal muscle mitochondrial ADP sensitivity in the absence of a high lipid environment. Biochem J. 478 (13), 2539-2553 (2021).
- Brunetta, H. S., et al. Nitrate consumption preserves HFD-induced skeletal muscle mitochondrial ADP sensitivity and lysine acetylation: A potential role for SIRT1. Redox Biol. 52, 102307 (2022).
- Tyrrell, D. J., et al. Blood-cell bioenergetics are associated with physical function and inflammation in overweight/obese older adults. Exp Gerontol. 70, 84-91 (2015).
- Liepinsh, E., et al. Low-intensity exercise stimulates bioenergetics and increases fat oxidation in mitochondria of blood mononuclear cells from sedentary adults. Physiol Rep. 8 (12), e14489 (2020).
- Hedges, C. P., et al. Peripheral blood mononuclear cells do not reflect skeletal muscle mitochondrial function or adaptation to high-intensity interval training in healthy young men. J Appl Physiol. 126 (2), 454-461 (2019).
- DeConne, T. M., Muñoz, E. R., Sanjana, F., Hobson, J. C., Martens, C. R. Cardiometabolic risk factors are associated with immune cell mitochondrial respiration in humans. Am J Physiol Heart Circ Physiol. 319 (2), H481-H487 (2020).
- Zhou, B., et al. Boosting NAD level suppresses inflammatory activation of PBMCs in heart failure. J Clin Invest. 130 (11), 6054-6063 (2020).
- Altintas, M. M., DiBartolo, S., Tadros, L., Samelko, B., Wasse, H. Metabolic changes in peripheral blood mononuclear cells isolated from patients with end stage renal disease. Front Endocrinol (Lausanne). 12, 629239 (2021).
- Pence, B. D., Yarbro, J. R. Aging impairs mitochondrial respiratory capacity in classical monocytes). Exp Gerontol. 108, 112-117 (2018).
- vander Windt, G. J. W., Chang, C. H., Pearce, E. L. Measuring bioenergetics in T Cells using a Seahorse extracellular flux analyzer. Curr Protoc Immunol. 113, 11-14 (2016).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab Invest. 93 (6), 690-700 (2013).
- Buck, M. D., et al. Mitochondrial dynamics controls T Cell fate through metabolic programming. Cell. 166 (1), 63-76 (2016).
- Quinn, K. M., et al. Metabolic characteristics of CD8. Nat Commun. 11 (1), 2857 (2020).
- Scandalis, L., et al. Skeletal muscle mitochondrial respiration and exercise intolerance in patients with heart failure with preserved ejection fraction. JAMA Cardiol. 8 (6), 575-584 (2023).
- Rausser, S., et al. Mitochondrial phenotypes in purified human immune cell subtypes and cell mixtures. Elife. 10, e70899 (2021).
- Kramer, P. A., et al. Bioenergetics and the oxidative burst: protocols for the isolation and evaluation of human leukocytes and platelets. J Vis Exp. (85), e51301 (2014).
- Kramer, P. A., Ravi, S., Chacko, B., Johnson, M. S., Darley-Usmar, V. M. A review of the mitochondrial and glycolytic metabolism in human platelets and leukocytes: implications for their use as bioenergetic biomarkers. Redox Biol. 2, 206-210 (2014).
- Teodoro, J. S., Machado, I. F., Castela, A. C., Rolo, A. P., Palmeira, C. M. The evaluation of mitochondrial membrane potential using fluorescent dyes or a membrane-permeable cation (TPP+) electrode in isolated mitochondria and intact cells. Methods Mol Biol. 2184, 197-213 (2020).
- Hassan, H., Zakaria, F., Makpol, S., Karim, N. A. A link between mitochondrial dysregulation and idiopathic autism spectrum disorder (ASD): Alterations in mitochondrial respiratory capacity and membrane potential. Curr Issues Mol Biol. 43 (3), 2238-2252 (2021).
- Williams, A. S., et al. Disruption of Acetyl-Lysine turnover in muscle mitochondria promotes insulin resistance and redox stress without overt respiratory dysfunction. Cell Metab. 31 (1), 131-147 (2020).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods Enzymol. 542, 163-181 (2014).
- Chowdhury, S. R., Djordjevic, J., Albensi, B. C., Fernyhough, P. Simultaneous evaluation of substrate-dependent oxygen consumption rates and mitochondrial membrane potential by TMRM and safranin in cortical mitochondria. Biosci Rep. 36 (1), 00286 (2015).
- Vianello, C., et al. High-throughput microscopy analysis of mitochondrial membrane potential in 2D and 3D models. Cells. 12 (7), (2023).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- JoVE, Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE. , (2023).
- Geltink, R. I. K., Kyle, R. L., Pearce, E. L. Unraveling the complex interplay between T cell metabolism and function. Annu Rev Immunol. 36, 461-488 (2018).
- Sukumar, M., et al. Inhibiting glycolytic metabolism enhances CD8+ T cell memory and antitumor function. J Clin Invest. 123 (10), 4479-4488 (2013).
- Gerriets, V. A., et al. Foxp3 and Toll-like receptor signaling balance T. Nat Immunol. 17 (12), 1459-1466 (2016).
- MacIver, N. J., Michalek, R. D., Rathmell, J. C. Metabolic regulation of T lymphocytes. Annu Rev Immunol. 31, 259-283 (2013).
- Desdín-Micó, G., et al. T cells with dysfunctional mitochondria induce multimorbidity and premature senescence. Science. 368 (6497), 1371-1376 (2020).
- Yang, R., et al. Mitochondrial Ca2+ and membrane potential, an alternative pathway for Interleukin 6 to regulate CD4 cell effector function. Elife. 4, 06376 (2015).
- Straub, R. H., Cutolo, M., Buttgereit, F., Pongratz, G. Energy regulation and neuroendocrine-immune control in chronic inflammatory diseases. J Intern Med. 267 (6), 543-560 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon