Method Article
تحفيز النبض عبر الجمجمة لمرضى الزهايمر
In This Article
Summary
توضح هذه المقالة إجراء تحفيز النبض عبر الجمجمة في مرضى الزهايمر. يناقش بالتفصيل المؤشرات والمنهجية والآفاق المستقبلية.
Abstract
تحفيز النبض عبر الجمجمة (TPS) هو علاج غير جراحي للتعديل العصبي مع علامة Conformité Européenne (CE) لعلاج مرض الزهايمر (AD). أظهرت الدراسات التجريبية الأولية آثارا واعدة على الوظيفة المعرفية. تركز هذه المقالة على إجراء علاج المرضى المصابين بمرض الزهايمر باستخدام جهاز TPS الموجه بالرنين المغناطيسي والتنقل العصبي. يتم وصف البروتوكول الواجب اتباعه لهذا بالتفصيل ، بما في ذلك الإجراءات اللازمة وإعدادات الجهاز. كما يتم توفير لمحة موجزة عن النتائج السريرية التمثيلية المنشورة حتى الآن. بالإضافة إلى التحسينات السريرية الكبيرة في الإدراك والعاطفة ، يتم تقديم الأحداث الضائرة (AE) والأحداث الضائرة المحتملة للجهاز (ADE) لتوفير بيانات السلامة. أخيرا ، تمت مناقشة الطريقة بشكل نقدي. في المستقبل ، يجب إجراء تجارب معشاة ذات شواهد لاستبعاد أي آثار وهمي. هناك أيضا نقص في الدراسات طويلة الأجل مع عدد أكبر من المرضى. على الرغم من هذه الأسئلة التي لم يتم حلها ، فإن TPS لديه القدرة على أن يكون علاجا مساعدا لمرضى الزهايمر عند استخدامه في بيئة خاضعة للرقابة وموجهة علميا.
Introduction
أصبحت تقنيات تحفيز الدماغ غير الجراحي (NiBS) محور اهتمام متزايد بأبحاث الخرف ، حيث تقدم استراتيجيات علاجية محتملة للتخفيف من العجز المعرفي والوظيفي المرتبط بالأمراض التنكسية العصبية. تشير الأدلة المتراكمة إلى أن NiBS يمكن أن يعزز الوظيفة المعرفية أو يبطئ التدهور المعرفي لدى الأفراد المصابين بمرض الزهايمر (AD) عبر مراحل مختلفة من الحالة1،2. من بين هذه التقنيات ، يتميز تحفيز النبض عبر الجمجمة (TPS) بشكل خاص بقدرته على تقديم تحفيز دماغ شديد التركيز ومستهدف بدقة ، ليس فقط على سطح القشرة ولكن أيضا في مناطق الدماغالعميقة 3،4. الآثار الجانبية المرتبطة ب TPS نادرة ومعتدلة في شدة وعابرة 3,5.
تم تطوير العلاج بالموجات فوق الصوتية العلاجية والعلاج بالموجات الصدمية خارج الجسم (ESWT) في البداية في مجالات جراحة العظام وأمراض القلب ، وقد ثبت أنه يعزز التئام الأنسجة ويحسن تدفق الدم. في جراحة العظام ، تم تطبيق ESWT بشكل خاص لعلاج الأمراض العضلية الهيكلية مثل اعتلال الأوتار ومشاكل التئام العظام ، بينما في أمراض القلب ، تم استكشافه لآثاره على صحة الأوعيةالدموية 6،7. تم تكييف TPS للتطبيقات العصبية ، لا سيما في أبحاث مرض الزهايمر ، مما يدل على نتائج واعدة في معالجة التدهور المعرفي والإعاقاتالوظيفية 8،3،4. تستخدم هذه التقنية موجات الصدمة للتخفيف من أعراض مرضى الزهايمر ، كما يتضح من البيانات التجريبية من مجموعة العمل في هذا البرنامجالتعليمي 5. تختلف موجات الصدمة عن الموجات فوق الصوتية من حيث أنها لا تنطوي على حمل متناوب عالي التردد9. يوضح ملف تعريف موجة الصدمة الذي تم إنشاؤه ، كما هو موضح في الشكل 1 ، بوضوح نبضة الضغط المفرد والتسطيح اللاحق للسعة أثناء TPS ، جنبا إلى جنب مع خاصية السعة عالية التردد للموجات فوق الصوتية. بسبب الإجهاد المتناوب عالي التردد ، تمتص الأنسجة طاقة الموجات فوق الصوتية ، مما قد يؤدي إلى ارتفاع درجة حرارة الأنسجة - وهو تأثير لم يلاحظ مع موجات الصدمة. في تطبيقات أخرى ، يتم استخدام موجات الصدمة عالية الطاقة ، بينما في TPS ، تكون الطاقة التي يتم إدخالها في الأنسجة منخفضة الطاقة9. تم الإبلاغ عن الآثار المحتملة على مرض الزهايمر لأول مرة كتحسينات في اتحاد إنشاء سجل لمرض الزهايمر (CERAD) 3 ، بالإضافة إلى زيادة سمك القشرة في العديد من المناطق10 والتغييرات في اتصال شبكة MR11.
آليات عمل TPS قيد التحقيق حاليا ، حيث تركز الأبحاث على كيفية تعديل هذه التقنية غير الغازية لنشاط الدماغ على المستوى الخلوي ، مما قد يؤدي إلى عمليات النقل الميكانيكي التي يمكن أن تعزز المرونة العصبية وتحسن الوظيفة المعرفية3،4. في العلاج بالموجات الصدمية ، تعمل الطاقة الفيزيائية على منطقة الأنسجة الموضعية وتحفز النقل الميكانيكي12 ، مما يحفز إطلاق عوامل النمو13،14 وأكسيد النيتريك15. هذه التأثيرات ، بدورها ، يمكن أن تعزز الدورة الدموية وتعزز تكوين الأوعية الجديدة16.
الهدف من TPS هو توفير علاج إضافي آمن ويمكن أن يؤدي إلى تحسين الأعراض. يمكن أن تشمل المناطق المحفزة القشرة الأمامية الثنائية ، والقشرة الجدارية الجانبية الثنائية ، والقشرة الأولية الممتدة ، والقشرة الصدغية الثنائية. يتكون بروتوكول العلاج المعتاد من ست جلسات مع 6,000 نبضة على مدار أسبوعين كدورة علاج أولى.
يعتبر الإجراء آمنا ، حيث تم الإبلاغ عن أحداث ضارة في حوالي 4٪ من الجلسات التي تتميز بالشدة الذاتية المعتدلة العابرة وبدون علاقة سببية واضحة بالأحداث الضائرة المتعلقة بالجهاز (ADEs)5.
في حين أن هذه النتائج الأولية مشجعة ، فمن الأهمية بمكان للباحثين والأطباء تقييم ما إذا كانت TPS مناسبة لتطبيقاتهم المحددة. تشمل العوامل التي يجب مراعاتها مرحلة مرض الزهايمر ، واستجابة المريض للعلاجات الأخرى ، وتوافر المرافق التي يمكنها إدارة TPS بأمان تحت إشراف الخبراء. بالنسبة للأفراد في المراحل المبكرة إلى المتوسطة من مرض الزهايمر, TPS قد تقدم فوائد معرفية محتملة مع الحد الأدنى من الآثار الجانبية, ولكن لا يعتبر بعد العلاج المستقل. بدلا من ذلك ، قد يكمل العلاجات الحالية مثل التدخلات الدوائية أو التدريب المعرفي. لا توجد حتى الآن نتائج التجارب المعشاة ذات الشواهد. ومع ذلك ، قد يكون ل TPS القدرة على ذلك كعلاج إضافي لمرضى الزهايمر تحت الاستخدام الخاضع للرقابة والاستكشاف العلمي.
Protocol
كان تحليل جميع المرضى الذين عولجوا بنظام الحماية من الإشعاع السليم جزءا من السجل المحلي الذي وافقت عليه لجنة الأخلاقيات التابعة للغرفة الطبية الإقليمية (Ärztekammer Nordrhein, Nr. 2021026). علاوة على ذلك ، وقع جميع المرضى على موافقة خطية على العلاج. تم علاج ما مجموعه 11 مريضا ب TPS (تسعة رجال وامرأتين ، الفئة العمرية 59-77 سنة ، M = 69.82). قبل العلاج ، خضع جميع المرضى لعملية موافقة مستنيرة مفصلة ، تم خلالها إبلاغهم جيدا بالفوائد والمخاطر المحتملة لتحفيز النبض عبر الجمجمة (TPS) باستخدام نظام NEUROLITH.
1. اختيار المريض وإعداده
- قبل البدء في هذا التحفيز ، يعد اختيار المريض والموافقة المستنيرة أمرا بالغ الأهمية. استخدم علامة CE لمرض الزهايمر. تأكيد التشخيص باستخدام المؤشرات الحيوية السائل الدماغي النخاعي على أساس متلازمة الزهايمر السريرية. إجراء علاج المرض وفقا للإرشادات الوطنية أو الدولية من قبل طبيب أعصاب أو طبيب.
ملاحظة: يمكن تقديم TPS كإضافة في إطار الاستكشاف العلمي. نظرا لأن TPS تم إعطاؤه كعلاج إضافي ، استمر جميع المرضى في خطط العلاج الطبي المعتادة طوال فترة العلاج. كان بعض المرضى يتناولون الأدوية المضادة للخرف و / أو مضادات الذهان خلال جلسات TPS. ومع ذلك، لم تكن هذه الأدوية جزءا من بروتوكول الدراسة ولم يتم تعديلها أو توحيدها كجزء من التدخل. - استخدم معايير الاستبعاد التالية ل TPS: هو بطلان العلاج مع الأمراض داخل المخ ذات الصلة التي لا علاقة لها بمرض الزهايمر ، بما في ذلك اعتلال الدماغ الوعائي ، والتخثر في منطقة العلاج ، و Fazekas من الدرجة 3 ، والأورام ، وتشوهات الأوعية الدموية ، والغرسات المعدنية ، والاعتلال الوعائي الدماغي النشواني (CAA) كما هو محدد في معايير بوسطن. موانع الاستعمال الإضافية هي تاريخ من العلاج بالأجسام المضادة أو مستمرها ، أو اضطرابات تخثر الدم أو مضادات التخثر عن طريق الفم ، أو العلاج بالكورتيكوستيرويد في غضون ستة أسابيع قبل التطبيق الأول ، أو الصرع (إما نوبات متعددة أو نوبة واحدة مع تركيز النوبة) ، وأجهزة تنظيم ضربات القلب غير المعتمدة لعلاج TPS ، والإغماء المتكرر ، والاضطرابات السلوكية العاطفية الشديدة التي تؤثر على الحياة اليومية مثل العدوان أو الذهان ، الحمل والحالات الطبية التي قد تؤدي إلى عدم الامتثال للبروتوكول. فيما يتعلق بمعايير التشخيص والاستبعاد ، بما في ذلك التصوير بالرنين المغناطيسي ، وتخطيط كهربية الدماغ ، وتحليل السائل الدماغي النخاعي ، والاختبارات المعملية ، والتقييمات المعرفية والعاطفية التفصيلية في العمل.
2. الاختبار النفسي العصبي
- إجراء الاختبار النفسي العصبي قبل التحفيز الأول (خط الأساس) وبعد التحفيز الأخير (بعد التحفيز). تم استخدام مقياس تقييم مرض الزهايمر (ADAS) لهذه الدراسة.
- قبل البدء في ADAS ، قم بإعداد بيئة الاختبار للتأكد من أنها هادئة ومريحة وخالية من الانحرافات. قم بإجراء التقييم مع طبيب مدرب أو أخصائي علم النفس العصبي ، الذي يتبع تنسيقا منظما لتقييم مجالات معرفية محددة.
- يتكون ADAS من مكونين رئيسيين: المقياس الفرعي المعرفي (ADAS-Cog) والمقياس الفرعي غير المعرفي. استخدم ADAS-Cog ، الأكثر استخداما ، لتقييم الذاكرة واللغة والتوجيه والتطبيق العملي من خلال سلسلة من المهام ، كما هو موضح أدناه.
- تذكر الكلمات: قدم للمريض قائمة بالكلمات واطلب استدعاؤها على الفور وبعد التأخير.
- تسمية الأشياء والأصابع: أظهر للمريض سلسلة من الأشياء واطلب تسميتها بشكل صحيح.
- الأوامر التالية: اطلب من المريض القيام بإجراءات محددة بناء على التعليمات الشفهية لتقييم الفهم والتطبيق العملي.
- البناء البصري: تكليف المريض بنسخ الأشكال الهندسية لتقييم المهارات البصرية المكانية.
- الممارسة الفكرية: اطلب من المريض إثبات استخدام الأشياء الشائعة (مثل قلم رصاص أو مشط).
- التوجيه: اسأل المريض عن التاريخ الحالي ويوم الأسبوع والموقع.
- التعرف على الكلمات: اطلب من المريض التعرف على الكلمات المعروضة مسبقا من قائمة الكلمات المشتتة.
- القدرة اللغوية: تقييم طلاقة المريض وفهمه من خلال المحادثات المنظمة وبناء الجمل.
- استخدم المقياس الفرعي غير المعرفي لتقييم الأعراض السلوكية مثل تغيرات المزاج أو اللامبالاة أو الهياج.
- من أجل الاتساق ، اطلب من الطبيب الذي يدير الاختبار الالتزام الصارم بالتعليمات الموضحة في دليل ADAS. سجل كل مهمة بناء على الأداء ، مع وجود درجات أعلى تشير إلى ضعف أكبر.
- بعد جلسة التحفيز الأخيرة ، كرر ADAS باستخدام نسخة موازية من الاختبار للتأكد من أن النتائج تعكس تغييرات حقيقية في الوظيفة المعرفية بدلا من تأثيرات الممارسة.
3. إعداد الجهاز والبيئة
- قم بتشغيل الجهاز. حدد موقع مفتاح الطاقة الرئيسي في الجزء الخلفي من الجهاز وقم بتشغيله.
- اضغط على زر الاستعداد على اللوحة الأمامية. سيستغرق الجهاز حوالي 5 دقائق للتهيئة.
- ضع المريض. تأكد من أن المريض جالس بشكل مريح ، مع دعم محتمل للرقبة. اطلب من المريض ارتداء نظارات التعرف على عدسات الكشف. ثبت النظارات على رأس المريض باستخدام شريط لاصق أو حزام لإبقائها في مكانها.
- قم بإعداد الكاميرا. قم بمحاذاة الكاميرا للتأكد من أن رأس المريض مرئي بالكامل داخل الإطار. هذه الكاميرا ضرورية للتتبع والمعايرة.
4. اختبار الجهد العالي (الصيانة اليومية)
- قم بإجراء اختبار الجهد العالي (اختبار HV). قم بإجراء هذا الاختبار مرة كل 24 ساعة. اتبع التعليمات التي تظهر على الشاشة لإكمال الاختبار بالضغط على زر الزناد الموجود على أداة التطبيق المحمولة.
5. إعداد قبضة
- قم بإعداد المقبض عن طريق وضع قطرة من زيت السيليكون على غشاء المقابضة.
- قم بتوصيل غشاء التوصيل المملوء مسبقا (قطعة المسافة) بالمقبض ، مما يضمن أنه آمن لتحقيق الأداء الأمثل.
6. معايرة للمرضى الجدد
- قم بتحميل بيانات التصوير بالرنين المغناطيسي للمريض. بالنسبة للمرضى الجدد ، تأكد من توفر فحوصات التصوير بالرنين المغناطيسي المطلوبة (صور عالية الدقة T1 للرأس من الجبهة إلى الخلف ، تغطي الأذن إلى الأذن).
- أدخل جهاز التخزين الخارجي (USB أو CD) الذي يحتوي على بيانات التصوير بالرنين المغناطيسي في منفذ USB الخاص بالنظام.
- إنشاء ملف تعريف للمريض. حدد مريض جديد في النظام وأدخل المعلومات المطلوبة. عند إنشاء ملف تعريف جديد للمريض في النظام، يتم استيراد بعض المعلومات تلقائيا من التصوير بالرنين المغناطيسي المضغوط، بينما يجب إدخال التفاصيل الأخرى يدويا.
- بعد إدخال القرص المضغوط في النظام ، يتم استرداد الاسم الكامل للمريض وتاريخ ميلاده تلقائيا من البيانات الوصفية الموجودة على قرص التصوير بالرنين المغناطيسي. أدخل خطة العلاج يدويا في النظام. حدد بروتوكول مرض الزهايمر (AD) الذي تم تكوينه مسبقا ، المخزن بالفعل في النظام. يتضمن هذا البروتوكول الإعدادات التالية: تردد 4 هرتز ، ومستوى طاقة 0.2 mJ / mm2 ، و 6,000 نبضة لكل جلسة. يمكن استخدام البروتوكول كما هو أو تعديله بناء على تفضيلات الطبيب.
- قم بتحميل بيانات التصوير بالرنين المغناطيسي وتحقق من جودة الصور. للتحقق من جودة بيانات التصوير بالرنين المغناطيسي ، قم بالتمرير يدويا عبر الشرائح الفردية لصور التصوير بالرنين المغناطيسي داخل النظام. تأكد من أن جميع الهياكل التشريحية حادة ومحددة جيدا وتحقق من عدم وجود قطع أثرية أو تشوهات للحركة. تأكد من أن الدقة الإجمالية للصور المرجحة T1 كافية للتنقل العصبي الدقيق. اضبط تحديدات الصور حسب الضرورة وتابع المعايرة.
- لمعايرة الصور، استخدم قلم المعايرة لإجراء معايرة من 3 نقاط باستخدام المسارات التالية.
المسار 1: من الجبهة إلى مؤخرة الرأس.
المسار 2: من أذن إلى أخرى.
المسار 3: قم بإجراء حركات دائرية أو متعرجة عبر الجزء العلوي من الرأس. - تأكد من أن عدسات الكشف تواجه الكاميرا في جميع الأوقات أثناء المعايرة.
- تأكد من أن نموذج الرأس ثلاثي الأبعاد على الشاشة يتماشى بشكل صحيح مع رأس المريض عن طريق تدويره للتحقق من نقاط الاتصال.
7. إعداد منطقة العلاج (اختياري)
- تحديد مناطق العلاج بناء على الاحتياجات المحددة للمريض. في هذه الدراسة ، تم استخدام بروتوكول مرض الزهايمر الذي تم تكوينه مسبقا بما في ذلك الفص الجبهي الثنائي والفص الجداري الثنائي وprecuneus. بالإضافة إلى ذلك ، أضف إلى البروتوكول الأولي القشرة الصدغية الثنائية. استخدم صور التصوير بالرنين المغناطيسي والمعالم التشريحية المحددة للدماغ لتحديد المناطق المراد تحفيزها.
- اضبط حجم وشكل وعدد مناطق العلاج على الشاشة. لضبط عائد الاستثمار، يتم تنفيذ العملية بالكامل باستخدام عناصر التحكم في شاشة اللمس.
- ابدأ بالوصول إلى وحدة تخطيط العلاج على الواجهة الرئيسية للنظام. ضمن هذه الوحدة، حدد خيار تعديل عائد الاستثمار لتمكين تحرير مناطق العلاج. بمجرد الدخول في وضع الضبط ، يعرض النظام عائد استثمار افتراضي على الشاشة.
- لوضع عائد الاستثمار على المنطقة التشريحية المطلوبة، مثل الفص الجبهي أو الفص الجداري أو القشرة الصدغية أو القشرة الصدغية، استخدم أزرار الأسهم على شاشة اللمس. تسمح الأزرار بتحريك عائد الاستثمار بشكل تدريجي في جميع الاتجاهات (لأعلى ، لأسفل ، لليسار ، لليمين) لمحاذاة دقيقة مع منطقة الدماغ المستهدفة.
- بعد تحديد موضع عائد الاستثمار، اضبط أبعاده (الحجم والعمق والشكل) باستخدام عناصر التحكم المخصصة التي تظهر على الشاشة:
ضبط العمق (الزر أ): اضغط على زر العمق واضبط مستوى اختراق عائد الاستثمار ليتناسب مع متطلبات العلاج.
ضبط العرض (الزر B): استخدم زر ضبط العرض لتوسيع الحجم الأفقي لعائد الاستثمار أو تقليصه.
ضبط الارتفاع (الزر C): قم بتعديل البعد الرأسي لعائد الاستثمار من خلال النقر على عنصر التحكم في ضبط الارتفاع. احفظ الإعدادات بمجرد اكتمالها.
8. إجراء العلاج
- ضع كمية وفيرة من جل الموجات فوق الصوتية بالتتابع على فروة رأس المريض لنقل الطاقة الأمثل.
- ابدأ العلاج. حدد وضع العلاج على الجهاز وتأكد من توصيل الغشاء المملوء مسبقا بشكل صحيح. يتم التحقق من التثبيت الصحيح للغشاء المملوء مسبقا من خلال التأكد من أنه يستقر بشكل صحيح في مكانه على المقبض. اختياري يمكن للمريض استخدام حماية السمع أثناء الجلسة.
- أمسك القبضة بشكل عمودي على فروة رأس المريض ، مع التأكد من تحريكها بالتساوي عبر السطح. يوضح الشكل 2 المحاذاة المثالية بين المريض و NEUROLITH أثناء TPS. يوضح الشكل 3 مثالا على مناطق الاهتمام (ROI) ونمذجة الأنسجة المحفزة في التصوير بالرنين المغناطيسي للمريض. يوضح الشكل 4 رسما توضيحيا للجهاز المحمول أثناء التحفيز.
- راقب التحفيز. عالج كل منطقة حتى تتحول المناطق المستهدفة على الشاشة إلى اللون الأخضر ، مما يشير إلى التغطية المناسبة. استمر في تحريك قبضة اليد مع إبقاء عدسات الكشف في مرأى من الكاميرا لضمان التتبع المستمر.
ملاحظة: إذا تحولت نظارات التعرف قليلا أثناء العلاج ، فيمكن متابعة الجلسة. ومع ذلك ، إذا تمت إزالة النظارات ، فستكون إعادة المعايرة مطلوبة. - اختتم الجلسة. لإنهاء العلاج ، اضغط على زر الإيقاف على الجهاز. يتم تحقيق نقطة نهاية الجلسة عند الوصول إلى 6000 نبضة.
9. إجراءات ما بعد العلاج
- نظف المعدات. نظف المقبض والغشاء القابل للفصل باستخدام مناديل معتمدة (تجنب المنظفات التي تحتوي على الكحول).
- رعاية المرضى: نظف منطقة فروة الرأس برفق لإزالة أي جل بالموجات فوق الصوتية المتبقي. إذا لزم الأمر ، جفف شعر المريض بمنشفة أو مجفف شعر. بعد العلاج ، ينصح المرضى بالبقاء في مكان قريب لمدة 10-15 دقيقة القادمة في حالة تعرضهم لأي آثار جانبية متأخرة أو خفيفة ، مثل الدوخة أو الصداع أو عدم الراحة في فروة الرأس ، على الرغم من عدم الحاجة إلى ملاحظة نشطة. شجع المرضى على البقاء رطبا ، لأن هذا يدعم الشفاء والرفاهية بشكل عام. نصح المريض بتجنب النشاط البدني المكثف لبقية اليوم ، خاصة إذا شعر بالتعب أو يعاني من أي إزعاج خفيف بعد الجلسة.
- تخزين بيانات العلاج: احفظ جميع بيانات العلاج ، بما في ذلك المناطق المحددة ، واضبطها للجلسات المستقبلية. يجب توثيق أي ملاحظات أثناء العلاج أو الملاحظات.
النتائج
خفف تحفيز النبض عبر الجمجمة من أعراض مرضى الزهايمر كما هو موضح في البيانات التجريبية غير المنضبطة من 11 مريضا (تسعة رجال وامرأتين ، الفئة العمرية 59-77 عاما ، M = 69.82) التي نشرتها مجموعة العمل في هذا البرنامجالتعليمي 1. تضمنت المناطق المحفزة القشرة الأمامية الثنائية ، والقشرة الجدارية الجانبية الثنائية ، والقشرة الممتدة قبل الركون. تمت إضافة القشرة الصدغية الثنائية إلى البروتوكول. تم إعطاء العلاج في ست جلسات أولية مع 6,000 نبضة على مدار أسبوعين كدورة علاج أولى.
تضمن بروتوكول العلاج أثناء التحفيز 4 هرتز و 0.20 مللي جول / مم2 و 6000 نبضة. أبلغ ثلاثة من كل 11 مريضا (27٪) عن أحداث سلبية في ثلاث جلسات من أصل 75 جلسة إجمالية (4٪). وشملت هذه آلام الفك (NRS 4/10) ، والغثيان (NRS 7/10) ، والنعاس (NRS 10/10). ومع ذلك ، لم يدم أي من هذه أكثر من 24 ساعة ، ولا يمكن أن يعزى جميعها بشكل مباشر إلى التحفيز كأحداث سلبية للجهاز (ADEs).
لوحظ اختلاف كبير في النتيجة الإجمالية ل ADAS بعد التحفيز مقارنة بخط الأساس ، مع تحسن من 30.2 إلى 25.8 (ص = 0.01) ، وفي درجة ADAS-Cog ، والتي تحسنت من 25.8 إلى 23.3 (ص = 0.04 ؛ ص = 0.04 ؛ الشكل 5). في حين أن بعض المرضى أظهروا تحسنا طفيفا فقط ، فإن أفضل تحسن في المريض كان 40٪ ، مما أدى إلى تحسن عام بنسبة 15.76٪ في الدرجة الإجمالية ل ADAS و 8.65٪ في درجة ADAS Cog (الشكل 6). علاوة على ذلك ، تم اكتشاف اختلاف كبير في أعراض الاكتئاب في مقياس فرعي تم الإبلاغ عنه ذاتيا من اختبار ADAS. أظهر اختبار t أحادي الذيل انخفاضا كبيرا في أعراض الاكتئاب ، كما تم قياسه بواسطة مقياس فرعي تم الإبلاغ عنه ذاتيا لاختبار ADAS. قبل التحفيز ، كان المتوسط 0.7 (SD = 1.1) ، وبعد التحفيز ، انخفض إلى 0.2 (SD = 0.4 ؛ t (8) = 1.859 ، p < 0.01).
تم الانتهاء من مقياس التصنيف الذاتي قبل وبعد فترة العلاج التي استغرقت أسبوعين. يسمح هذا المقياس للمرضى بالإبلاغ عن شدة الأعراض وأي أحداث سلبية متصورة على مقياس تصنيف رقمي من 0 إلى 10 ، مع أرقام أعلى تشير إلى شدة أكبر من الأعراض. كان متوسط التحسن الذاتي في شدة الأعراض ، كما تم قياسه بواسطة NRS ، من 5.7 إلى 3.4 (ص = 0.023).
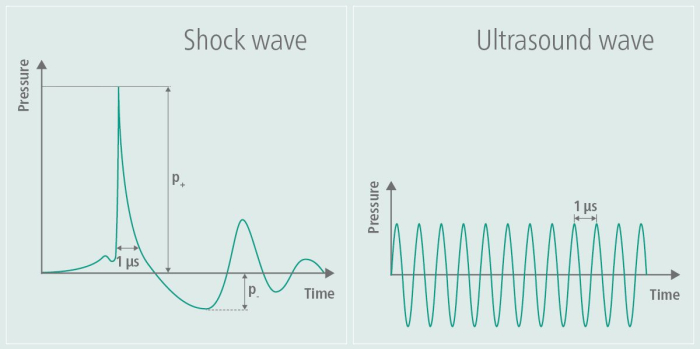
الشكل 1: موجة الصدمة أثناء التحفيز. يوضح الرسم البياني سعة TPS على الجانب الأيسر من الصورة ويقارنها بسعة الموجات فوق الصوتية على الجانب الأيمن من الصورة. أثناء TPS ، يتم إنشاء نبضة ضغط فردية ، متبوعة بتسطيح لاحق للسعة. في المقابل ، لا يتم تسطيح سعة الموجات فوق الصوتية مرة أخرى ولكن يتم الحفاظ عليها ، مما يؤدي إلى تذبذبات مستمرة عالية التردد بمرور الوقت. تم تعديل هذا الرقم من9. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
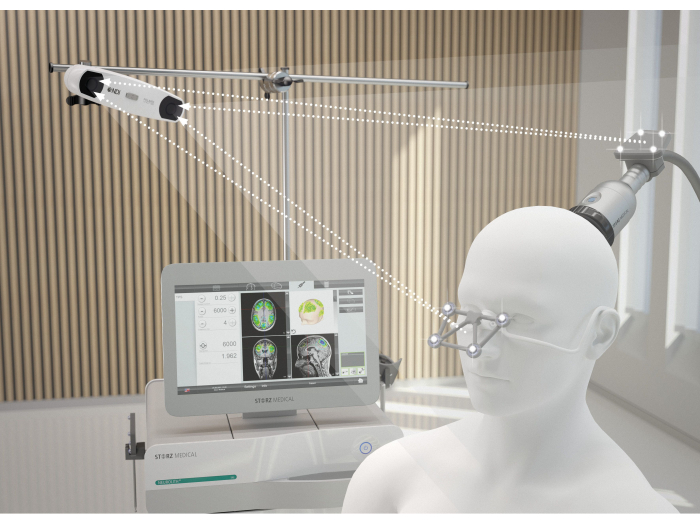
الشكل 2: نظام الملاحة بالرنين المغناطيسي. توضح الصورة المحاذاة المثالية بين المريض و NEUROLITH أثناء TPS. تتصل الكاميرا ثلاثية الأبعاد بعدسات الكشف عن النظارات الواقية وعدسات القبضة. فقط إذا كان هذا الإرسال مضمونا ، يتم التعرف على القبضة في الموضع المكاني الصحيح وتصور التحفيز على الشاشة دون إزعاج. تم تعديل هذا الرقم من9. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
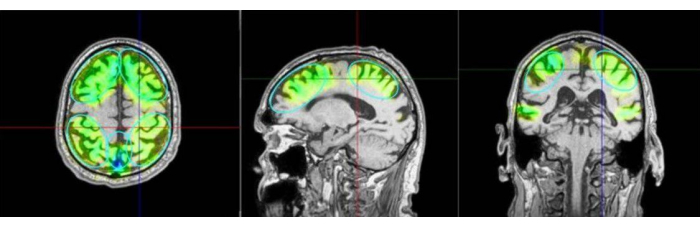
الشكل 3: مناطق الاهتمام والمناطق المحفزة. تظهر الصورة مثالا على مناطق الاهتمام (ROI) ونمذجة الأنسجة المحفزة في التصوير بالرنين المغناطيسي للمريض. تميز الألوان أيضا عدد النبضات المطبقة في المناطق المعنية من precuneus ، وكذلك المناطق الأمامية والجدارية يتبع اللون الأخضر الفيروز والأزرق والبنفسجي. يشير البنفسجي إلى الشدة المفرطة ويجب تجنبها. يتم تصور المناطق المحفزة كبيانات محاكاة من نظام الملاحة مثل المناطق التي تم الوصول إليها بشكل أساسي ، ولكن لا يتم قياس ذلك على أنه تنشيط حقيقي للدماغ. تمت إضافة تحفيز زمني إضافي في بروتوكول Kempen على الرغم من أنه لم يتم تعريفه مسبقا على أنه عائد استثمار. اليسار: منظر محوري ، وسط: منظر سهمي ، يمين: منظر إكليلي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
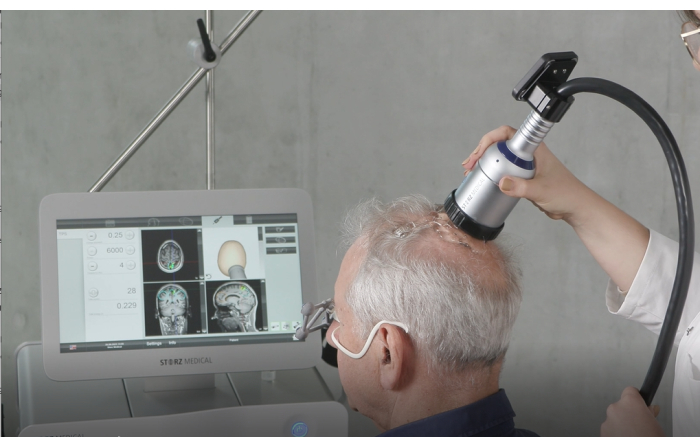
الشكل 4: جهاز محمول. يوضح هذا الشكل الجهاز المحمول قيد الاستخدام أثناء التحفيز. تشمل الخطوات التحضيرية الحاسمة وضع كمية كافية من هلام الموجات فوق الصوتية على فروة رأس المريض لضمان النقل الأمثل للطاقة والتحقق من أن الغشاء المملوء مسبقا متصل بشكل آمن وصحيح. أثناء العلاج ، يتم تثبيت القبضة بشكل عمودي على فروة الرأس وتحريكها بالتساوي عبر السطح للحفاظ على التحفيز الثابت. تم تعديل هذا الرقم من9. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
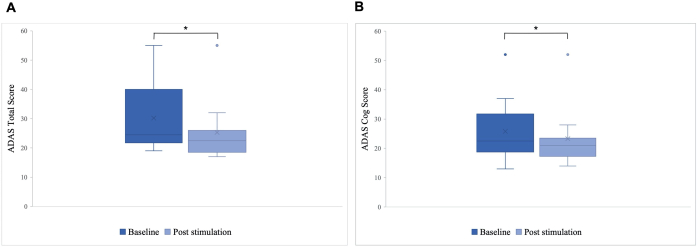
الشكل 5: مقياس تقييم مرض الزهايمر (ADAS) قبل التحفيز الأول. متوسط درجة مجموعة المرضى في مقياس تقييم مرض الزهايمر (ADAS) قبل التحفيز الأول (الأزرق الداكن) وبعد التحفيز الأخير (الأزرق الفاتح). تشير الدرجة الأقل إلى أداء أفضل. يوضح مخطط الصندوق توزيع بيانات المرضى. (أ) مجموع الدرجات الإحصائية للنظام القياسي. يمثل الخط متوسط المجموعة (خط الأساس = 24.5 ، ما بعد التحفيز = 22.5) ، ويمثل الصليب متوسط الدرجات (خط الأساس M = 30.2 (SD 11.55) ، M بعد التحفيز = 25.8 (SD 10.71) ، * p = 0.01). (ب) درجة ترس ADAS. يمثل الخط متوسط المجموعة (خط الأساس = 22.5 ، ما بعد التحفيز = 21) ، ويمثل الصليب متوسط الدرجات (خط الأساس M = 25.8 (SD 10.77) ، M بعد التحفيز = 23.3 (SD 10.27) ، * p = 0.04). تم تعديل هذا الرقم من5. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
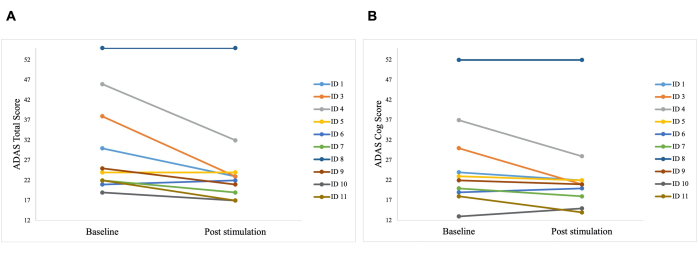
الشكل 6: نتائج الاختبارات الفردية للمرضى في ADAS. نتائج الاختبارات الفردية للمرضى في مقياس تقييم مرض الزهايمر (ADAS) قبل التحفيز الأول (خط الأساس) وبعد التحفيز الأخير (بعد التحفيز). تشير الدرجة الأقل إلى أداء أفضل. يمثل كل سطر مريضا واحدا. (أ) الدرجات الفردية لكل مريض في الدرجة الإجمالية ل ADAS. كان أفضل تحسن هو 15 نقطة (معرف 3). (ب) الدرجات الفردية لكل مريض في المقياس الفرعي لدرجة ترس ADAS. كان أفضل تحسن هو 14 نقطة (معرف 3 ومعرف 4). تم تعديل هذا الرقم من5. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
بشكل عام ، يعد TPS علاجا محتملا لمرض الزهايمر. من وجهة نظر عملية ، تم تصميم عملية التحفيز لتكون سهلة الاستخدام للمشغل. القدرة على تحديد مناطق الاهتمام في بداية الإجراء ، جنبا إلى جنب مع تصور عدد النبضات المطبقة من خلال العلامات المرمزة بالألوان أثناء العلاج ، تبسط بشكل كبير التعامل مع واجهة المستخدم. يمكن أيضا تحديد وتعديل إعدادات المناطق ذات الاهتمام بحرية حسب الحاجة. يتم تصور المناطق المحفزة بوضوح كبيانات محاكاة ، على الرغم من أن التطوير الإضافي من قبل الشركة المصنعة ضروري لعرض المناطق العميقة المتأثرة بالجهاز بمستويات طاقة أقل.
تشمل الخطوات الحاسمة في بروتوكول TPS الوضع الدقيق لجهاز التحفيز فوق مناطق الدماغ المستهدفة ، وضمان الشدة الصحيحة وتواتر موجات النبض ، والمراقبة الدقيقة لاستجابات المرضى. قد تتضمن استكشاف الأخطاء وإصلاحها ضمان الاتصال الأمثل بين المقبض وفروة الرأس لمنع فقدان الطاقة أو التحفيز دون المستوى الأمثل. إذا لوحظ عدم الراحة أو الآثار الجانبية ، فقد تكون هناك حاجة إلى تعديلات الشدة أو تغيير الموضع.
أظهرت البيانات المنشورة غير المنضبطة تحسينات معرفية سريرية5،3 ، بالإضافة إلى زيادة سمك القشرة القشرية في العديد من مناطق الدماغ10 والتغيرات في اتصال شبكة MR11. كما تم الإبلاغ عن تحسن في الحالة المزاجية 5,4. بالمقارنة مع طرق تحفيز الدماغ الأخرى غير الغازية ، تقدم TPS العديد من المزايا المميزة. أولا ، فهو يجمع بين موجات الصدمة الميكانيكية والملاحة العصبية الدقيقة ، مما يسمح بالتطبيق المستهدف لمناطق الدماغ المصابة. على عكس TMS ، الذي عادة ما يحفز الطبقات القشرية السطحية فقط ، فإن عمق اختراق TPS يجعله مناسبا بشكل خاص لعلاج الأمراض التنكسية العصبية مثل مرض الزهايمر ، حيث تشارك هياكل الدماغ الأعمق. بالإضافة إلى ذلك ، يبدو أن TPS لديه ملف أمان موات ، مع الحد الأدنى من الآثار الجانبية العابرة التي تم الإبلاغ عنها في 4٪ فقط من جلسات العلاج ، مما يشير إلى أنه قد يكون خيارا أكثر تحملا للمرضى الذين يعانون من AD 5 المعتدلإلى الشديد.
للتحقيق الشامل في آليات العمل وإجراء تحليل مفصل لعوامل الخطر المحتملة المرتبطة بعلاج TPS ، يلزم إجراء دراسات تأسيسية إضافية.
في دراسة حديثة نشرتها هذه المجموعة البحثية ، تم فحص نشاط شبكة الدماغ لدى مرضى الزهايمر قبل وبعد تحفيز النبض عبر الجمجمة (TPS) 17. تشير النتائج إلى أن TPS يمكن أن تعدل تذبذبات الدماغ والاتصال ، مما قد يحسن الوظيفة المعرفية في مرض الزهايمر. تتمثل إحدى الآليات المقترحة في أن زيادة تذبذبات جاما بعد TPS قد تسهل التصفية الغليمفاوية في الدماغ. يجب إجراء مزيد من التحقيق في هذا التأثير المحتمل على التصفية الغليمفاوية في الدراسات المستقبلية. بالإضافة إلى ذلك ، هناك حاجة إلى مزيد من الدراسات الميكانيكية لتوضيح كيفية تأثير TPS على فسيولوجيا شبكة الدماغ وما إذا كانت آثارها العصبية يمكن أن تبطئ أو توقف تطور مرض الزهايمر.
تعد الدراسات التي أجريت على قبل السريرية والتي تستكشف آثار TPS على كل من الأدمغة السليمة والمريضة أمرا بالغ الأهمية لاكتساب فهم أعمق للآليات الأساسية. من المهم ملاحظة أن تقنيات NiBS المختلفة تعمل من خلال آليات متميزة1. لذلك ، من الضروري التحقيق فيما إذا كانت التأثيرات الموصوفة للعلاج بالموجات فوق الصوتية18 والعلاج بالموجات الصدمية6 على الأنسجة تلعب دورا في علاج TPS وكيف تلعب. وصف الأول التأثير المحتمل ل TPS على عمليات النقل الميكانيكي ، فضلا عن قدرته على إحداث تغيرات في الأوعية الدموية والخلوية والجزيئية ، والتي يجب التحقيق فيها بدقة. علاوة على ذلك ، فإن تعديل العمليات الالتهابية العصبية ، مع التركيز بشكل خاص على ديناميكيات الحاجز الدموي الدماغي ، يمثل مجالا مثيرا للاهتمام للبحث المستقبلي. يمكن أن يوفر فهم هذه التأثيرات رؤى قيمة حول الآليات الأساسية ويساعد في تحسين TPS للتطبيقات العلاجية. علاوة على ذلك ، يساهم هذا في استكشاف التطبيق المحتمل لعلاج TPS في إدارة الأمراض التنكسية العصبية الأخرى.
يظهر TPS وعدا كنهج علاجي. ومع ذلك ، يجب معالجة العديد من القيود. التجارب السريرية الخاضعة للرقابة مع مجموعات الغفل ضرورية لتحديد الآثار المحددة ل TPS بدقة. يتمثل التحدي الكبير في التباين العالي بين الأفراد في الاستجابة للتحفيز ، والذي قد يتأثر بعوامل مثل مرحلة مرض الزهايمر (AD) ووجود الأمراضالمصاحبة 4. بالإضافة إلى ذلك ، لا يزال البروتوكول الأمثل للعلاج طويل الأمد غير محدد. تشمل الأساليب الحالية جلسات معززة واحدة شهرية أو تكرار دورة علاج من 12 جلسة في غضون عام ، ولكن لا توجد أدلة تدعم تفوق نهج واحد على الآخر. يجب أن تعطي الأبحاث السريرية المستقبلية الأولوية لتحديد معايير التحفيز المثلى ، وتقييم كيفية تأثير العوامل الخاصة بالمريض (على سبيل المثال ، مرحلة مرض الزهايمر) على النتائج العلاجية ، والتحقيق في الآثار طويلة المدى واستدامة علاج TPS.
Disclosures
تلقى المؤلف لارس فويتيكي سابقا منحا تمويلية ودعما مؤسسيا من مؤسسة البحوث الألمانية ، ومؤسسة هيلد أولريش لپاركينسون فور باركنسون ، ومؤسسة باركنسون ألمانيا ، BMBF / ERA-NETNEURON ، DFG Forschergruppe (FOR1328) ، Deutsche Parkinson Vereinigung (DPV) ، Forschungskommission ، Medizinische Fakultät ، HHU Düsseldorf ، UCB. ميدترونيك ، يو سي بي ، تيفا ، أليرجان ، ميرز ، أبفي ، روش ، بيال ، ميرك ، نوفارتيس ، ديسيتين ، سبيكتروم. المؤلف لارس وجيتكي يمتلك أسهما في شركة BioNTech SE. المؤلف لارس وجيتكي هو مستشار للشركات التالية: TEVA و UCB Schwarz و Desitin و Medtronic و Abbott / Abbvie و MEDA و Boehringer I و Storz Medical و Kyowa Kirinon و Guidepoint و Merck و Merz و Synergia و BIAL و Zambon و Sapio Life و STADA و Inomed و Vertanical. المؤلف سيلين كونت مستشارة في Storz Medical. ويعلن المؤلفون الباقون أن البحث أجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
Acknowledgements
نشكر المرضى على امتثالهم ومشاركتهم. تم ضمان المساعدة الفنية وجمع البيانات بمساعدة فيرونيكا هيرش وميكايلا ويسلر (المساعدين التقنيين الطبيين).
Materials
| Name | Company | Catalog Number | Comments |
| Disinfectant Wipes: mikrozid universal wipes | schülke | GTIN: 4032651957774 | Used to clean the hand piece after each session to ensure hygiene |
| Dry Towels: Wisch-/Pflegetuch Kolibri | IGEFA Handelsgesellschaft mbH & Co. KG | PZN: 10417600 | Used to dry the patient's skin after the ultrasound gel has been cleaned |
| Handpiece | Storz Medical | HW 030816.01 (114) | Used to hold the device during treatment |
| NEUROLITH | Storz Medical | SN: 19880_0015 | The NEUROLITH system with TPS is a CE-certified device |
| Patient Chair | Adjustable chair for optimal patient positioning during the treatment | ||
| silicone oil | Storz Medical | 13330 | Applied onto the membrane of the handpiece before attaching the prefilled coupling membrane (the distance piece) to the handpiece |
| Sonosid Ultrasound Gel | Asid Bonz GmbH | PZN: 5362311 | Applied to the scalp to ensure optimal transmission of acoustic pulses through the skull |
| Wash Gloves: Esemtan wash mitts | schülke | GTIN: 4032651297016 | For removing the ultrasound gel from the patient post-treatment |
References
- Koch, G., et al. The emerging field of non-invasive brain stimulation in Alzheimer's disease. Brain. Epub ahead of print. , (2024).
- Menardi, A., et al. Toward noninvasive brain stimulation 2.0 in Alzheimer's disease. Ageing Res Rev. 75, 101555 (2022).
- Beisteiner, R., et al. Transcranial pulse stimulation with ultrasound in Alzheimer's disease-a new navigated focal brain therapy. Adv Sci. 7 (3), 1902583 (2019).
- Matt, E., Dörl, G., Beisteiner, R. Transcranial pulse stimulation (TPS) improves depression in AD patients on state-of-the-art treatment. Alzheimer's Dement. 8 (1), e12245 (2022).
- Cont, C., et al. Retrospective real-world pilot data on transcranial pulse stimulation in mild to severe Alzheimer's patients. Front Neurol. 13, 948204 (2022).
- Guo, J., Hai, H., Ma, Y. Application of extracorporeal shock wave therapy in nervous system diseases: A review. Front Neurol. 13, 963849 (2022).
- Khanna, A., Nelmes, R. T., Gougoulias, N., Maffulli, N., Gray, J. The effects of LIPUS on soft-tissue healing: a review of literature. Br Med Bull. 89, 169-182 (2009).
- Chen, X., You, J., Ma, H., Zhou, M., Huang, C. Transcranial pulse stimulation in Alzheimer's disease. CNS Neurosci Ther. 30 (2), e14372 (2024).
- . Website of Manufacturer Available from: https://www.storzmedical.com/en/physics-and-technology (2025)
- Popescu, T., Pernet, C., Beisteiner, R. Transcranial ultrasound pulse stimulation reduces cortical atrophy in Alzheimer's patients: a follow-up study. Alzheimer's Dement. 7 (1), e12121 (2021).
- Dörl, G., Matt, E., Beisteiner, R. Functional specificity of TPS brain stimulation effects in patients with Alzheimer's disease: A follow-up fMRI analysis. Neurol Ther. 11 (3), 1391-1398 (2022).
- d'Agostino, M. C., Craig, K., Tibalt, E., Respizzi, S. Shock wave as biological therapeutic tool: From mechanical stimulation to recovery and healing, through mechanotransduction. Int J Surg. 24, 147-153 (2015).
- Yahata, K., et al. Low-energy extracorporeal shock wave therapy for promotion of vascular endothelial growth factor expression and angiogenesis and improvement of locomotor and sensory functions after spinal cord injury. J Neurosurg. 25 (6), 745-755 (2016).
- Hatanaka, K., et al. Molecular mechanisms of the angiogenic effects of low-energy shock wave therapy: roles of mechanotransduction. Am J Physiol. 311 (3), C378-C385 (2016).
- Mariotto, S., et al. Extracorporeal shock waves: from lithotripsy to anti-inflammatory action by NO production. Nitric oxide. 12 (2), 89-96 (2005).
- Flournoy, J., Ashkanani, S., Chen, Y. Mechanical regulation of signal transduction in angiogenesis. Front Cell Dev Biol. 10, 933474 (2022).
- Wojtecki, L., Cont, C., Stute, N., Galli, A., Schulte, C., Trenado, C. Electrical brain networks before and after transcranial pulsed shockwave stimulation in Alzheimer's patients. Geroscience. Epub ahead of print. , (2024).
- Sarica, C., et al. Human studies of transcranial ultrasound neuromodulation: A systematic review of effectiveness and safety. Brain Stimul. 15 (3), 737-746 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved