Method Article
Transkranielle Pulsstimulation für Alzheimer-Patienten
In diesem Artikel
Zusammenfassung
In diesem Artikel wird das Verfahren der transkraniellen Pulsstimulation bei Patienten mit Alzheimer-Krankheit beschrieben. Es werden die Indikationen, die Methodik und die Zukunftsaussichten im Detail diskutiert.
Zusammenfassung
Die transkranielle Pulsstimulation (TPS) ist eine nicht-invasive Neuromodulationstherapie mit der CE-Kennzeichnung (Conformité Européenne) zur Behandlung der Alzheimer-Krankheit (AD). Erste Pilotstudien haben vielversprechende Effekte auf die kognitive Funktion gezeigt. Dieser Artikel konzentriert sich auf das Verfahren zur Behandlung von Patienten mit AD mit einem MRT-gesteuerten, neuronavigierten TPS-Gerät. Das hierfür zu befolgende Protokoll wird ausführlich beschrieben, einschließlich der notwendigen Verfahren und Geräteeinstellungen. Außerdem wird ein kurzer Überblick über die bisher veröffentlichten repräsentativen klinischen Ergebnisse gegeben. Zusätzlich zu signifikanten klinischen Verbesserungen der Kognition und des Affekts werden unerwünschte Ereignisse (UE) und mögliche unerwünschte Produktereignisse (ADE) vorgestellt, um Sicherheitsdaten zu liefern. Abschließend wird die Methode kritisch diskutiert. In Zukunft sollen randomisierte kontrollierte Studien durchgeführt werden, um Placebo-Effekte auszuschließen. Auch mangelt es derzeit an Langzeitstudien mit einer größeren Anzahl von Patienten. Trotz dieser ungeklärten Fragen hat TPS das Potenzial als Zusatzbehandlung für Alzheimer-Patienten, wenn es in einem kontrollierten, wissenschaftlich geleiteten Umfeld eingesetzt wird.
Einleitung
Nichtinvasive Hirnstimulationstechniken (NiBS) sind in der Demenzforschung zu einem wachsenden Interessenschwerpunkt geworden und bieten potenzielle therapeutische Strategien zur Milderung kognitiver und funktioneller Defizite im Zusammenhang mit neurodegenerativen Erkrankungen. Immer mehr Hinweise deuten darauf hin, dass NiBS die kognitive Funktion verbessern oder den kognitiven Verfall bei Personen mit Alzheimer-Krankheit (AD) in verschiedenen Stadien der Erkrankung verlangsamen kann 1,2. Unter diesen Techniken zeichnet sich die transkranielle Pulsstimulation (TPS) besonders durch ihre Fähigkeit aus, eine hochfokussierte und präzise gezielte Hirnstimulation nicht nur auf der kortikalen Oberfläche, sondern auch in tieferen Hirnregionen zu ermöglichen 3,4. Nebenwirkungen im Zusammenhang mit TPS sind selten, mäßig schwer und vorübergehend 3,5.
Ursprünglich in den Bereichen Orthopädie und Kardiologie entwickelt, fördern die therapeutische Ultraschalltherapie und die extrakorporale Stoßwellentherapie (ESWT) nachweislich die Heilung des Gewebes und verbessern die Durchblutung. In der Orthopädie wurde die ESWT insbesondere zur Behandlung von Erkrankungen des Bewegungsapparates wie Tendinopathien und Knochenheilungsproblemen eingesetzt, während sie in der Kardiologie auf ihre Auswirkungen auf die Gefäßgesundheit untersucht wurde 6,7. TPS wurde für neurologische Anwendungen angepasst, insbesondere in der Alzheimer-Forschung, und hat sich als vielversprechend bei der Behandlung von kognitivem Verfall und funktionellen Beeinträchtigungen erwiesen 8,3,4. Bei dieser Technik werden Stoßwellen verwendet, um die Symptome von Patienten mit Alzheimer-Krankheit zu lindern, wie Pilotdaten aus der Arbeitsgruppe dieses Tutorialszeigen 5. Stoßwellen unterscheiden sich von Ultraschallwellen dadurch, dass sie keine hochfrequente Wechselbelastungbeinhalten 9. Das erzeugte Stoßwellenprofil, wie in Abbildung 1 dargestellt, veranschaulicht deutlich den singulären Druckimpuls und die anschließende Abflachung der Amplitude während der TPS, zusammen mit der für Ultraschall charakteristischen höherfrequenten Amplitude. Durch die hochfrequente Wechselbelastung wird die Energie der Ultraschallwellen vom Gewebe absorbiert, was zu einer Gewebeerwärmung führen kann – ein Effekt, der bei Stoßwellen nicht beobachtet wird. In anderen Anwendungen werden hochenergetische Stoßwellen verwendet, während bei TPS die in das Gewebe eingebrachte Energieniederenergetisch ist 9. Die potenziellen Auswirkungen auf die Alzheimer-Krankheit wurden zunächst als Verbesserungen im Consortium to Establish a Registry for Alzheimer's Disease (CERAD)3 sowie als erhöhte kortikale Dicke in mehreren Bereichen10 und Veränderungen in der MR-Netzwerk-Konnektivität11 berichtet.
Die Wirkmechanismen von TPS werden derzeit untersucht, wobei sich die Forschung darauf konzentriert, wie diese nicht-invasive Technik die Gehirnaktivität auf zellulärer Ebene moduliert und möglicherweise Mechanotransduktionsprozesse auslöst, die die Neuroplastizität und die kognitive Funktion verbessern könnten 3,4. Bei der Stoßwellentherapie wirkt die physikalische Energie auf den lokalisierten Gewebebereich und induziert die Mechanotransduktion12, wodurch die Freisetzung der Wachstumsfaktoren13, 14 und Stickstoffmonoxid15 stimuliert wird. Diese Effekte wiederum können die Durchblutung verbessern und die Neoangiogenese fördern16.
Das Ziel der TPS ist es, eine Zusatztherapie anzubieten, die sicher ist und zu einer Verbesserung der Symptome führen kann. Zu den stimulierten Bereichen gehören der bilaterale frontale Kortex, der bilaterale parietale Kortex, der erweiterte Precuneus-Kortex und der bilaterale temporale Kortex. Das übliche Behandlungsprotokoll besteht aus sechs Sitzungen mit 6.000 Impulsen über 2 Wochen als erster Behandlungszyklus.
Das Verfahren gilt als sicher, da in etwa 4 % der Sitzungen unerwünschte Ereignisse berichtet wurden, die durch einen moderaten subjektiven Schweregrad gekennzeichnet waren, der vorübergehend ist und keinen klaren kausalen Zusammenhang mit unerwünschten produktbezogenen Ereignissen (ADEs) aufweist5.
Obwohl diese ersten Ergebnisse ermutigend sind, ist es für Forscher und Kliniker von entscheidender Bedeutung, zu beurteilen, ob TPS für ihre spezifischen Anwendungen geeignet ist. Zu den zu berücksichtigenden Faktoren gehören das Stadium der Alzheimer-Krankheit, das Ansprechen der Patienten auf andere Behandlungen und die Verfügbarkeit von Einrichtungen, die TPS unter fachkundiger Anleitung sicher verabreichen können. Für Personen in den frühen bis mittelschweren Stadien der Alzheimer-Krankheit kann TPS potenzielle kognitive Vorteile mit minimalen Nebenwirkungen bieten, wird aber noch nicht als eigenständige Behandlung angesehen. Stattdessen kann es bestehende Therapien wie pharmakologische Interventionen oder kognitives Training ergänzen. Ergebnisse randomisiert-kontrollierter Studien fehlen bisher. TPS könnte jedoch das Potenzial haben, bei kontrollierter Anwendung und wissenschaftlicher Erforschung als Zusatzbehandlung für Alzheimer-Patienten eingesetzt zu werden.
Protokoll
Die Analyse aller mit TPS behandelten Patienten wurde in das lokale Register aufgenommen, das von der Ethikkommission der Ärztekammer Nordrhein (Nr. 2021026) genehmigt wurde. Darüber hinaus unterschrieben alle Patienten eine schriftliche Einwilligung zur Behandlung. Insgesamt wurden 11 Patienten mit TPS behandelt (neun Männer, zwei Frauen, Alter 59-77 Jahre, M = 69,82). Vor der Behandlung durchliefen alle Patienten ein ausführliches Aufklärungsverfahren, in dem sie umfassend über die möglichen Vorteile und Risiken der transkraniellen Pulsstimulation (TPS) mit dem NEUROLITH-System aufgeklärt wurden.
1. Patientenauswahl und -vorbereitung
- Bevor mit dieser Stimulation begonnen wird, sind die Auswahl des Patienten und die Einwilligungserklärung entscheidend. Verwenden Sie das CE-Zeichen für die Alzheimer-Krankheit. Bestätigen Sie die Diagnose anhand von Liquor-Biomarkern auf der Grundlage des klinischen Alzheimer-Syndroms. Führen Sie die Krankheitsbehandlung nach nationalen oder internationalen Richtlinien durch einen Neurologen oder Psychiater durch.
HINWEIS: TPS kann als Add-on im Rahmen der wissenschaftlichen Erforschung angeboten werden. Da TPS als Zusatzbehandlung verabreicht wurde, setzten alle Patienten ihre regulären medizinischen Behandlungspläne während der gesamten Behandlung fort. Einige Patienten nahmen während der TPS-Sitzungen Antidemenzmedikamente und/oder Antipsychotika ein; Diese Medikamente waren jedoch nicht Teil des Studienprotokolls und wurden im Rahmen der Intervention nicht modifiziert oder standardisiert. - Verwenden Sie die folgenden Ausschlusskriterien für TPS: Die Behandlung ist kontraindiziert bei relevanten intrazerebralen Pathologien, die nicht mit der Alzheimer-Krankheit zusammenhängen, einschließlich vaskulärer Enzephalopathie, Thrombose im Behandlungsbereich, Fazekas Grad 3, Tumoren, Gefäßmissbildungen, Metallimplantaten und zerebraler Amyloid-Angiopathie (CAA), wie in den Boston-Kriterien definiert. Weitere Kontraindikationen sind eine Antikörpertherapie in der Vorgeschichte oder eine laufende Antikörpertherapie, Blutgerinnungsstörungen oder orale Antikoagulation, Kortikosteroidbehandlung innerhalb von sechs Wochen vor der ersten Anwendung, Epilepsie (entweder mehrere Anfälle oder ein einzelner Anfall mit Anfallsfokus), Herzschrittmacher, die nicht für die TPS-Therapie zugelassen sind, rezidivierende Synkopen, schwere affektive Verhaltensstörungen, die sich auf das tägliche Leben auswirken, wie Aggressionen oder Psychosen, Schwangerschaft und Erkrankungen, die zur Nichteinhaltung des Protokolls führen können. In Bezug auf Diagnose- und Ausschlusskriterien, einschließlich MRT, EEG, Liquoranalyse, Labortests und detaillierte kognitive und affektive Beurteilungen in der Abklärung.
2. Neuropsychologische Tests
- Führen Sie neuropsychologische Tests vor der ersten Stimulation (Baseline) und nach der letzten Stimulation (Poststimulation) durch. Für diese Studie wurde die Alzheimer Disease Assessment Scale (ADAS) verwendet.
- Bevor Sie mit dem ADAS beginnen, bereiten Sie die Testumgebung vor, um sicherzustellen, dass sie ruhig, komfortabel und frei von Ablenkungen ist. Führen Sie die Bewertung mit einem ausgebildeten Kliniker oder Neuropsychologen durch, der einem strukturierten Format folgt, um bestimmte kognitive Bereiche zu bewerten.
- Das ADAS besteht aus zwei Hauptkomponenten: der kognitiven Subskala (ADAS-Cog) und der nicht-kognitiven Subskala. Verwenden Sie das ADAS-Cog, das am häufigsten verwendet wird, um Gedächtnis, Sprache, Orientierung und Praxis durch eine Reihe von Aufgaben zu bewerten, wie unten beschrieben.
- Worterinnerung: Präsentieren Sie dem Patienten eine Liste von Wörtern und bitten Sie ihn, diese sofort und verzögert abzurufen.
- Objekte und Finger benennen: Zeigen Sie dem Patienten eine Reihe von Gegenständen und bitten Sie ihn, diese richtig zu benennen.
- Folgende Befehle: Bitten Sie den Patienten, bestimmte Handlungen auf der Grundlage verbaler Anweisungen auszuführen, um das Verständnis und die Praxis zu bewerten.
- Visuo-Konstruktion: TAufgabe des Patienten mit dem Kopieren geometrischer Figuren, um die visuell-räumlichen Fähigkeiten zu bewerten.
- Ideelle Praxis: Bitten Sie den Patienten, die Verwendung von alltäglichen Gegenständen (z. B. einem Bleistift oder einem Kamm) zu demonstrieren.
- Orientierung: Befragen Sie den Patienten nach dem aktuellen Datum, dem Wochentag und dem Ort.
- Worterkennung: Bitten Sie den Patienten, zuvor präsentierte Wörter aus einer Liste von Distraktorwörtern zu erkennen.
- Sprachfähigkeit: Bewerten Sie die Sprachgewandtheit und das Verständnis des Patienten durch strukturierte Gespräche und Satzbau.
- Verwenden Sie die nicht-kognitive Subskala, um Verhaltenssymptome wie Stimmungsschwankungen, Apathie oder Unruhe zu beurteilen.
- Bitten Sie aus Gründen der Konsistenz den Arzt, der den Test durchführt, sich strikt an die Anweisungen im ADAS-Handbuch zu halten. Bewerten Sie jede Aufgabe basierend auf der Leistung, wobei höhere Bewertungen auf eine größere Beeinträchtigung hinweisen.
- Wiederholen Sie nach der letzten Stimulationssitzung das ADAS mit einer parallelen Version des Tests, um sicherzustellen, dass die Ergebnisse echte Veränderungen der kognitiven Funktion und keine Praxiseffekte widerspiegeln.
3. Vorbereitung des Gerätes und der Umgebung
- Schalten Sie das Gerät ein. Suchen Sie den Hauptschalter an der Rückseite des Geräts und schalten Sie ihn ein.
- Drücken Sie die Standby-Taste auf der Vorderseite. Die Initialisierung des Geräts dauert ca. 5 Minuten.
- Positionieren Sie den Patienten. Stellen Sie sicher, dass der Patient bequem sitzt, mit möglicher Nackenstütze. Lassen Sie den Patienten eine Erkennungsbrille mit Detektionsgläsern tragen. Befestigen Sie die Brille mit Klebeband oder einem Band am Kopf des Patienten, um sie an Ort und Stelle zu halten.
- Richten Sie die Kamera ein. Richten Sie die Kamera so aus, dass der Kopf des Patienten vollständig im Rahmen sichtbar ist. Diese Kamera ist entscheidend für die Verfolgung und Kalibrierung.
4. Hochspannungstest (Tägliche Wartung)
- Führen Sie den Hochspannungstest (HV-Test) durch. Führen Sie diesen Test alle 24 Stunden durch. Befolgen Sie die Anweisungen auf dem Bildschirm, um den Test abzuschließen, indem Sie die Auslösetaste am Handheld-Applikator drücken.
5. Vorbereitung des Handstücks
- Bereiten Sie das Handstück vor, indem Sie einen Tropfen Silikonöl auf die Membran des Handstücks auftragen.
- Befestigen Sie die vorgefüllte Kupplungsmembran (das Distanzstück) am Handstück und stellen Sie sicher, dass sie für eine optimale Leistung sicher ist.
6. Kalibrierung für neue Patienten
- Laden Sie die MRT-Daten des Patienten. Für neue Patienten stellen Sie sicher, dass die erforderlichen MRT-Scans (T1-gewichtete, hochauflösende Bilder des Kopfes von der Stirn bis zum Rücken, von Ohr zu Ohr) verfügbar sind.
- Stecken Sie das externe Speichergerät (USB oder CD) mit den MRT-Daten in den USB-Anschluss des Systems.
- Erstellen Sie ein Patientenprofil. Wählen Sie im System Neuer Patient und geben Sie die erforderlichen Informationen ein. Beim Anlegen eines neuen Patientenprofils im System werden einige Informationen automatisch von der MRT-CD importiert, während andere Details manuell eingegeben werden müssen.
- Nach dem Einlegen der CD in das System werden automatisch der vollständige Name und das Geburtsdatum des Patienten aus den Metadaten auf der MRT-CD abgerufen. Geben Sie den Behandlungsplan manuell in das System ein. Wählen Sie das vorkonfigurierte Alzheimer-Protokoll (AD) aus, das bereits im System gespeichert ist. Dieses Protokoll umfasst die folgenden Einstellungen: eine Frequenz von 4 Hz, ein Energieniveau von 0,2 mJ/mm2 und 6.000 Impulse pro Sitzung. Das Protokoll kann entweder unverändert verwendet oder an die Präferenzen des Arztes angepasst werden.
- Laden Sie die MRT-Daten und überprüfen Sie die Qualität der Bilder. Um die Qualität der MRT-Daten zu überprüfen, scrollen Sie manuell durch die einzelnen Schichten der MRT-Bilder innerhalb des Systems. Stellen Sie sicher, dass alle anatomischen Strukturen scharf und gut definiert sind, und prüfen Sie, ob keine Bewegungsartefakte oder Verzerrungen vorhanden sind. Vergewissern Sie sich, dass die Gesamtauflösung der T1-gewichteten Bilder für eine genaue Neuronavigation ausreicht. Passen Sie die Bildauswahl nach Bedarf an und fahren Sie mit der Kalibrierung fort.
- Um die Bilder zu kalibrieren, verwenden Sie den Kalibrierungsstift, um eine 3-Punkt-Kalibrierung unter Verwendung der folgenden Pfade durchzuführen.
Weg 1: Von der Stirn bis zum Hinterkopf.
Weg 2: Von einem Ohr zum anderen.
Pfad 3: Führen Sie kreisende oder Zickzackbewegungen über die Oberseite des Kopfes aus. - Stellen Sie sicher, dass die Detektionsobjektive während der Kalibrierung immer auf die Kamera gerichtet sind.
- Vergewissern Sie sich, dass das 3D-Kopfmodell auf dem Bildschirm richtig mit dem Kopf des Patienten ausgerichtet ist, indem Sie es drehen, um die Kontaktpunkte zu überprüfen.
7. Einrichtung der Behandlungsregion (optional)
- Definieren Sie Behandlungsregionen basierend auf den spezifischen Bedürfnissen des Patienten. Für diese Studie wurde das vorkonfigurierte Alzheimer-Protokoll verwendet, das den bilateralen Frontallappen, den bilateralen Parietallappen und den Precuneus umfasst. Fügen Sie zusätzlich zum ursprünglichen Protokoll den bilateralen temporalen Kortex hinzu. Verwenden Sie die MRT-Bilder und spezifische anatomische Orientierungspunkte des Gehirns, um die zu stimulierenden Regionen zu definieren.
- Passen Sie die Größe, Form und Anzahl der Behandlungsbereiche auf dem Display an. Um die ROIs anzupassen, wird der Prozess vollständig über die Touch-Display-Steuerung durchgeführt.
- Beginnen Sie mit dem Zugriff auf das Modul Behandlungsplanung über die Hauptschnittstelle des Systems. Wählen Sie in diesem Modul die Option ROI-Anpassung , um die Bearbeitung von Behandlungsregionen zu aktivieren. Sobald sich das System im Anpassungsmodus befindet, zeigt es einen Standard-ROI auf dem Bildschirm an.
- Um den ROI über dem gewünschten anatomischen Bereich zu positionieren, z. B. dem Frontallappen, dem Parietallappen, dem Precuneus oder dem temporalen Kortex, verwenden Sie die Pfeiltasten auf dem Touch-Display. Mit den Tasten kann der ROI inkrementell in alle Richtungen (oben, unten, links, rechts) verschoben werden, um eine präzise Ausrichtung auf die Zielhirnregion zu gewährleisten.
- Nachdem Sie die ROI positioniert haben, passen Sie ihre Abmessungen (Größe, Tiefe und Form) mit den entsprechenden Steuerelementen auf dem Bildschirm an:
Tiefeneinstellung (Taste A): Tippen Sie auf die Tiefentaste und passen Sie den ROI-Eindringgrad an die Behandlungsanforderungen an.
Breitenanpassung (Schaltfläche B): Verwenden Sie die Schaltfläche für die Breitenanpassung, um die horizontale Größe des ROI zu vergrößern oder zu verkleinern.
Höhenverstellung (Taste C): Ändern Sie die vertikale Dimension des ROI, indem Sie auf den Regler für die Höhenverstellung tippen. Speichern Sie die Einstellungen, sobald Sie fertig sind.
8. Durchführung der Behandlung
- Tragen Sie nacheinander eine großzügige Menge Ultraschallgel auf die Kopfhaut des Patienten auf, um eine optimale Energieübertragung zu gewährleisten.
- Beginnen Sie mit der Behandlung. Wählen Sie am Gerät den Behandlungsmodus aus und vergewissern Sie sich, dass die vorgefüllte Membran korrekt angebracht ist. Die korrekte Befestigung der vorgefüllten Membran wird überprüft, indem sichergestellt wird, dass sie richtig auf dem Handstück einrastet. Optional kann der Patient während der Sitzung einen Gehörschutz tragen.
- Halten Sie das Handstück senkrecht zur Kopfhaut des Patienten und stellen Sie sicher, dass es gleichmäßig über die Oberfläche bewegt wird. Abbildung 2 veranschaulicht die ideale Ausrichtung zwischen Patient und NEUROLITH während der TPS. Abbildung 3 zeigt ein Beispiel für die Regions of Interest (ROI) und die Modellierung von Gewebe, das im MRT eines Patienten stimuliert wird. Abbildung 4 zeigt eine Illustration des Handgeräts während der Stimulation.
- Überwachen Sie die Stimulation. Behandeln Sie jede Region, bis die Zielbereiche auf dem Display grün werden, um die richtige Abdeckung anzuzeigen. Bewegen Sie das Handstück weiter, während Sie die Detektionsobjektive im Blick auf die Kamera halten, um eine kontinuierliche Verfolgung zu gewährleisten.
HINWEIS: Wenn sich die Erkennungsbrille während der Behandlung leicht verschiebt, kann die Sitzung fortgesetzt werden. Wird die Brille jedoch entfernt, ist eine erneute Kalibrierung erforderlich. - Schließen Sie die Sitzung ab. Um die Behandlung zu beenden, drücken Sie die Stopp-Taste am Gerät. Der Endpunkt der Sitzung wird bei Erreichen von 6000 Impulsen erreicht.
9. Verfahren nach der Behandlung
- Reinigen Sie das Gerät. Reinigen Sie das Handstück und die abnehmbare Membran mit zugelassenen Tüchern (vermeiden Sie Reinigungsmittel auf Alkoholbasis).
- Patientenversorgung: Reinigen Sie den Kopfhautbereich sanft, um alle verbleibenden Ultraschallgele zu entfernen. Trocknen Sie die Haare des Patienten bei Bedarf mit einem Handtuch oder Haartrockner. Weisen Sie die Patienten nach der Behandlung an, für die nächsten 10-15 Minuten in der Nähe zu bleiben, falls sie verzögerte oder leichte Nebenwirkungen wie Schwindel, Kopfschmerzen oder Kopfhautbeschwerden bemerken, obwohl keine aktive Beobachtung erforderlich ist. Ermutigen Sie die Patienten, hydratisiert zu bleiben, da dies die allgemeine Genesung und das Wohlbefinden unterstützt. Raten Sie dem Patienten, intensive körperliche Aktivität für den Rest des Tages zu vermeiden, insbesondere wenn er sich nach der Sitzung müde fühlt oder leichte Beschwerden verspürt.
- Speicherung von Behandlungsdaten: Speichern Sie alle Behandlungsdaten, einschließlich definierter Regionen, und passen Sie sie für zukünftige Sitzungen an. Alle Beobachtungen während der Behandlung oder Rückmeldungen sollten dokumentiert werden.
Ergebnisse
Die transkranielle Pulsstimulation linderte die Symptome von Alzheimer-Patienten, wie unkontrollierte Pilotdaten von 11 Patienten (neun Männer, zwei Frauen, Altersgruppe 59-77 Jahre, M = 69,82) zeigen, die von der Arbeitsgruppe dieses Tutorialsveröffentlicht wurden 1. Zu den stimulierten Bereichen gehörten der bilaterale frontale Kortex, der bilaterale parietale Kortex und der erweiterte Precuneus-Kortex. Der bilaterale temporale Kortex wurde in das Protokoll aufgenommen. Die Behandlung wurde in sechs ersten Sitzungen mit 6.000 Impulsen über 2 Wochen als erster Behandlungszyklus verabreicht.
Das Behandlungsprotokoll während der Stimulation umfasste 4 Hz, 0,20 mJ/mm2 und 6000 Impulse. Drei von 11 Patienten (27 %) berichteten über unerwünschte Ereignisse in drei von insgesamt 75 Sitzungen (4 %). Dazu gehörten Kieferschmerzen (NRS 4/10), Übelkeit (NRS 7/10) und Schläfrigkeit (NRS 10/10). Keines davon dauerte jedoch länger als 24 Stunden, und nicht alle konnten als unerwünschte Geräteereignisse (ADEs) direkt auf die Stimulation zurückgeführt werden.
Ein signifikanter Unterschied wurde im ADAS-Gesamtscore nach der Stimulation im Vergleich zum Ausgangswert beobachtet, mit einer Verbesserung von 30,2 auf 25,8 (p = 0,01), und im ADAS-Cog-Score, der sich von 25,8 auf 23,3 verbesserte (p = 0,04; Abbildung 5). Während einige Patienten nur geringfügige Verbesserungen zeigten, betrug die beste Verbesserung bei einem Patienten 40 %, was zu einer Gesamtverbesserung von 15,76 % im ADAS-Gesamtscore und 8,65 % im ADAS-Cog-Score führte (Abbildung 6). Darüber hinaus wurde ein signifikanter Unterschied in den depressiven Symptomen in einer selbstberichteten Subskala des ADAS-Tests festgestellt. Ein einseitiger t-Test zeigte eine signifikante Verringerung der depressiven Symptome, gemessen an einer selbstberichteten Subskala des ADAS-Tests. Vor der Stimulation lag der Mittelwert bei 0,7 (SD = 1,1) und sank nach der Stimulation auf 0,2 (SD = 0,4; t (8) = 1,859, p < 0,01).
Eine subjektive Bewertungsskala wurde vor und nach dem Behandlungszeitraum von zwei Wochen durchgeführt. Diese Skala ermöglicht es den Patienten, den Schweregrad der Symptome und alle wahrgenommenen unerwünschten Ereignisse auf einer numerischen Bewertungsskala von 0 bis 10 zu melden, wobei höhere Zahlen eine höhere Symptomintensität anzeigen. Die mittlere subjektive Verbesserung der Symptomschwere, gemessen mit dem NRS, lag zwischen 5,7 und 3,4 (p = 0,023).
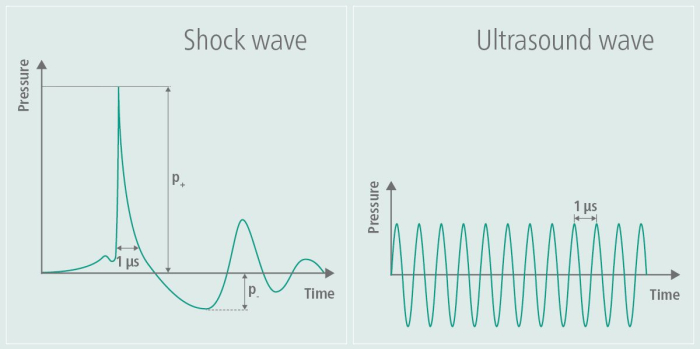
Abbildung 1: Stoßwelle während der Stimulation. Die Grafik veranschaulicht die Amplitude eines TPS auf der linken Seite des Bildes und vergleicht sie mit der Amplitude eines Ultraschalls auf der rechten Seite des Bildes. Bei der TPS wird ein singulärer Druckimpuls erzeugt, gefolgt von einer anschließenden Abflachung der Amplitude. Im Gegensatz dazu flacht die Amplitude des Ultraschalls nicht wieder ab, sondern bleibt erhalten, was zu kontinuierlichen hochfrequenten Schwingungen über die Zeit führt. Diese Zahl wurde von9 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
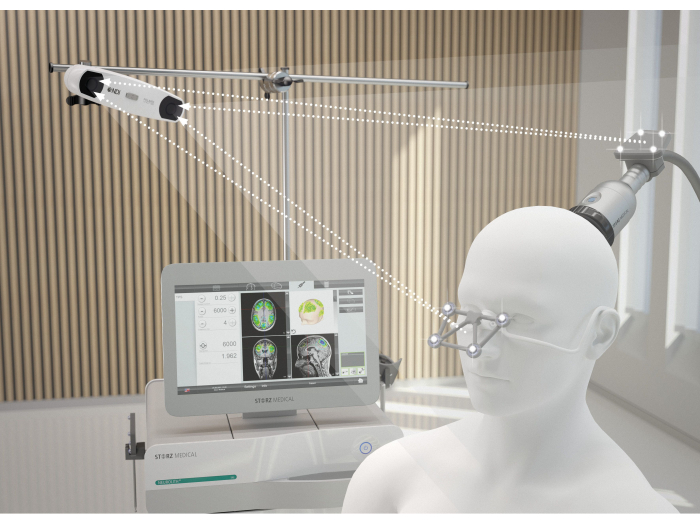
Abbildung 2: MRT-Navigationssystem. Das Bild veranschaulicht die ideale Ausrichtung zwischen Patient und NEUROLITH während der TPS. Die 3D-Kamera kontaktiert die Detektionslinsen der Brille und die des Handstücks. Nur wenn diese Übertragung gewährleistet ist, wird das Handstück in der richtigen räumlichen Position erkannt und die Visualisierung der Stimulation auf dem Bildschirm ist ungestört. Diese Zahl wurde von9 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
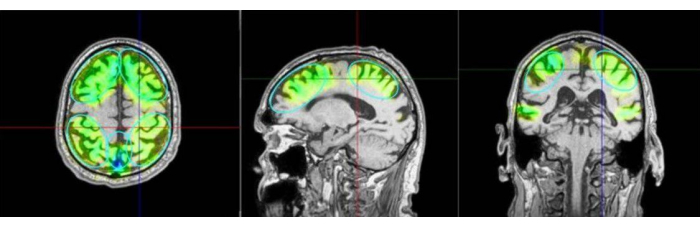
Abbildung 3: Interessante Regionen und stimulierte Gebiete. Das Bild zeigt ein Beispiel für die Regions of Interest (ROI) und die Modellierung des auf dem MRT eines Patienten stimulierten Gewebes. Die Farben unterscheiden ferner die Anzahl der Impulse, die in den jeweiligen Bereichen des Precuneus sowie in den frontalen und parietalen Regionen angewendet werden. Auf die grüne Färbung folgen Türkis, Blau und Violett. Violett zeigt eine übermäßige Intensität an und muss vermieden werden. Stimulierte Areale werden als simulierte Daten aus dem Navigationssystem als hauptsächlich erreichte Areale visualisiert, dies wird jedoch nicht als real angewandte Hirnaktivierung gemessen. Im Kempen-Protokoll wird eine zusätzliche zeitliche Stimulation hinzugefügt, die jedoch nicht als ROI vordefiniert ist. Links: axiale Ansicht, Mitte: sagittale Ansicht, rechts: koronale Ansicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
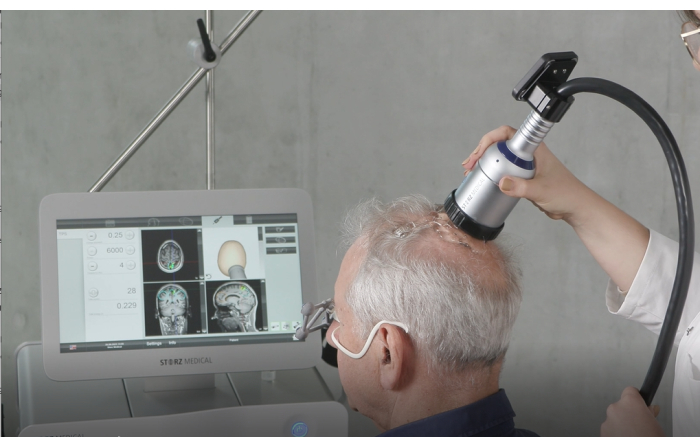
Abbildung 4: Handheld-Gerät. Diese Abbildung zeigt das Handgerät im Einsatz während der Stimulation. Zu den kritischen Vorbereitungsschritten gehören das Auftragen einer ausreichenden Menge Ultraschallgel auf die Kopfhaut des Patienten, um eine optimale Energieübertragung zu gewährleisten, und die Überprüfung, ob die vorgefüllte Membran sicher und korrekt befestigt ist. Während der Behandlung wird das Handstück senkrecht zur Kopfhaut gehalten und gleichmäßig über die Oberfläche bewegt, um eine gleichmäßige Stimulation zu gewährleisten. Diese Zahl wurde von9 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
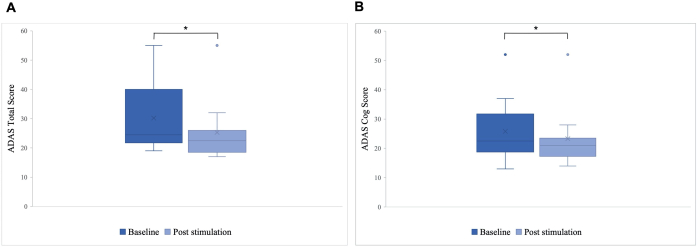
Abbildung 5: Alzheimer's Disease Assessment Scale (ADAS) vor der ersten Stimulation. Mittelwert des Scores der Patientengruppe auf der Alzheimer's Disease Assessment Scale (ADAS) vor der ersten Stimulation (dunkelblau) und nach der letzten Stimulation (hellblau). Eine niedrigere Bewertung deutet auf eine bessere Leistung hin. Das Boxplot zeigt die Verteilung der Patientendaten. (A) ADAS-Gesamtpunktzahl. Die Linie stellt den Median der Gruppe dar (Ausgangswert = 24,5, Nachstimulation = 22,5), und das Kreuz stellt die Mittelwerte dar (M Ausgangswert = 30,2 (SD 11,55), M nach der Stimulation = 25,8 (SD 10,71), *p = 0,01). (B) ADAS-Zahnrad-Punktzahl. Die Linie stellt den Median der Gruppe dar (Ausgangswert = 22,5, Nachstimulation = 21), und das Kreuz stellt die Mittelwerte dar (M Ausgangswert = 25,8 (SD 10,77), M nach der Stimulation = 23,3 (SD 10,27), *p = 0,04). Diese Zahl wurde von5 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
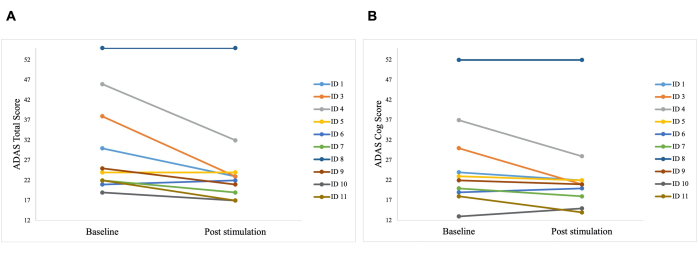
Abbildung 6: Individuelle Testergebnisse der Patienten in ADAS. Individuelle Testergebnisse der Patienten in der Alzheimer's Disease Assessment Scale (ADAS) vor der ersten Stimulation (Baseline) und nach der letzten Stimulation (Post-Stimulation). Eine niedrigere Bewertung deutet auf eine bessere Leistung hin. Jede Linie steht für einen Patienten. (A) Individuelle Punktzahlen jedes Patienten in der ADAS-Gesamtpunktzahl. Die beste Verbesserung war 15 Punkte (ID 3). (B) Individuelle Scores jedes Patienten im ADAS-Cog-Score auf der Subskala. Die beste Verbesserung waren 14 Punkte (ID 3 und ID 4). Diese Zahl wurde von5 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Insgesamt ist TPS eine mögliche Behandlung der Alzheimer-Krankheit. Aus praktischer Sicht ist der Stimulationsprozess so konzipiert, dass er für den Bediener benutzerfreundlich ist. Die Möglichkeit, zu Beginn des Eingriffs interessante Bereiche zu definieren, sowie die Visualisierung der Anzahl der während der Behandlung applizierten Impulse durch farbcodierte Markierungen vereinfachen die Handhabung der Benutzeroberfläche erheblich. Auch die Einstellung der interessierenden Regionen kann frei gewählt und bei Bedarf angepasst werden. Stimulierte Bereiche werden als simulierte Daten übersichtlich visualisiert, obwohl eine Weiterentwicklung durch den Hersteller notwendig ist, um tiefere Bereiche, die vom Gerät betroffen sind, bei niedrigeren Energieniveaus darzustellen.
Zu den kritischen Schritten im TPS-Protokoll gehören die präzise Platzierung des Stimulationsgeräts über den Zielhirnregionen, die Sicherstellung der richtigen Intensität und Frequenz der Pulswellen und die sorgfältige Überwachung der Patientenreaktionen. Die Fehlerbehebung kann darin bestehen, einen optimalen Kontakt zwischen dem Handstück und der Kopfhaut sicherzustellen, um Energieverlust oder suboptimale Stimulation zu vermeiden. Wenn Beschwerden oder Nebenwirkungen beobachtet werden, können Intensitätsanpassungen oder eine Neupositionierung erforderlich sein.
Veröffentlichte unkontrollierte Datenhaben klinische kognitive Verbesserungen 5,3 sowie eine erhöhte kortikale Dicke in mehreren Hirnarealen10 und Veränderungen der MR-Netzwerkkonnektivität11 gezeigt. Es wurde auch über eine Verbesserung der Stimmung berichtet 5,4. Im Vergleich zu anderen nicht-invasiven Hirnstimulationsverfahren bietet die TPS mehrere entscheidende Vorteile. Zunächst kombiniert es mechanische Stoßwellen mit präziser Neuronavigation und ermöglicht so eine gezielte Anwendung auf betroffene Hirnregionen. Im Gegensatz zur TMS, die in der Regel nur oberflächliche kortikale Schichten stimuliert, eignet sich TPS aufgrund seiner Eindringtiefe besonders für die Behandlung neurodegenerativer Erkrankungen wie Alzheimer, bei denen tiefere Gehirnstrukturen beteiligt sind. Darüber hinaus scheint TPS ein günstiges Sicherheitsprofil zu haben, wobei nur in 4 % der Behandlungssitzungen minimale und vorübergehende Nebenwirkungen berichtet wurden, was darauf hindeutet, dass es für Patienten mit mittelschwerer bis schwerer AD5 eine verträglichere Option sein könnte.
Um die Wirkmechanismen gründlich zu untersuchen und eine detaillierte Analyse potenzieller Risikofaktoren im Zusammenhang mit der TPS-Therapie durchzuführen, sind zusätzliche Grundlagenstudien erforderlich.
In einer kürzlich veröffentlichten Studie dieser Forschungsgruppe wurde die Netzwerkaktivität des Gehirns bei Alzheimer-Patienten vor und nach der transkraniellen Pulsstimulation (TPS) untersucht17. Die Ergebnisse deuten darauf hin, dass TPS die Oszillationen und die Konnektivität des Gehirns modulieren kann, was möglicherweise die kognitive Funktion bei der Alzheimer-Krankheit verbessert. Einer der vorgeschlagenen Mechanismen ist, dass die erhöhten Gamma-Oszillationen nach TPS die glymphatische Clearance im Gehirn erleichtern können. Dieser mögliche Effekt auf die glymphatische Clearance sollte in zukünftigen Studien weiter untersucht werden. Darüber hinaus sind weitere mechanistische Studien erforderlich, um zu klären, wie TPS die Physiologie des Gehirnnetzwerks beeinflusst und ob seine neuroprotektiven Wirkungen das Fortschreiten der Alzheimer-Krankheit verlangsamen oder stoppen können.
Präklinische Tierversuche, die die Auswirkungen von TPS sowohl auf gesunde als auch auf kranke Gehirne untersuchen, sind entscheidend für ein tieferes Verständnis der zugrunde liegenden Mechanismen. Es ist wichtig zu beachten, dass verschiedene NiBS-Techniken über unterschiedliche Mechanismen funktionieren1. Daher ist es wichtig zu untersuchen, ob und wie die für die Ultraschalltherapie18 und die Stoßwellentherapie6 beschriebenen Effekte auf das Gewebe bei der TPS-Therapie eine Rolle spielen. Ersterer beschrieb den möglichen Einfluss von TPS auf Mechanotransduktionsprozesse sowie sein Potenzial, vaskuläre, zelluläre und molekulare Veränderungen zu induzieren, die gründlich untersucht werden müssen. Darüber hinaus stellt die Modulation neuroinflammatorischer Prozesse, mit besonderem Schwerpunkt auf der Dynamik der Blut-Hirn-Schranke, ein faszinierendes Gebiet für zukünftige Forschungen dar. Das Verständnis dieser Effekte könnte wertvolle Einblicke in die zugrunde liegenden Mechanismen liefern und dazu beitragen, TPS für therapeutische Anwendungen zu optimieren. Darüber hinaus trägt dies dazu bei, die potenzielle Anwendung der TPS-Behandlung bei der Behandlung anderer neurodegenerativer Erkrankungen zu erforschen.
TPS ist als therapeutischer Ansatz vielversprechend; Es müssen jedoch einige Einschränkungen beachtet werden. Kontrollierte klinische Studien mit Placebogruppen sind unerlässlich, um die spezifischen Wirkungen von TPS genau abzugrenzen. Eine große Herausforderung ist die hohe interindividuelle Variabilität in der Reaktion auf Stimulation, die durch Faktoren wie das Stadium der Alzheimer-Krankheit (AD) und das Vorhandensein von Komorbiditäten beeinflusst werdenkann 4. Darüber hinaus bleibt das optimale Protokoll für die Langzeitbehandlung undefiniert. Zu den derzeitigen Ansätzen gehören monatliche Einzelauffrischungssitzungen oder die Wiederholung eines Behandlungszyklus von 12 Sitzungen innerhalb eines Jahres, aber es fehlen Beweise für die Überlegenheit eines Ansatzes gegenüber dem anderen. Zukünftige klinische Forschung sollte sich auf die Identifizierung optimaler Stimulationsparameter, die Bewertung, wie patientenspezifische Faktoren (z. B. das Stadium der Alzheimer-Therapie) die therapeutischen Ergebnisse beeinflussen, und die Untersuchung der Langzeiteffekte und der Nachhaltigkeit der TPS-Therapie konzentrieren.
Offenlegungen
Autor Lars Wojtecki erhielt zuvor Fördergelder und institutionelle Unterstützung von der Hilde-Ulrichs-Stiftung für Parkinsonforschung und dem ParkinsonFonds Deutschland, BMBF/ERA-NETNEURON, DFG Forschergruppe (FOR1328), Deutsche Parkinson Vereinigung (DPV), Forschungskommission, Medizinische Fakultät, HHU Düsseldorf, UCB; Medtronic, UCB, Teva, Allergan, Merz, Abbvie, Roche, Bial, Merck, Novartis, Desitin, Spectrum. Autor Lars Wojtecki besaß Aktien der Firma BioNTech SE. Autor Lars Wojtecki ist Berater für die folgenden Unternehmen: TEVA, UCB Schwarz, Desitin, Medtronic, Abbott/Abbvie, MEDA, Boehringer I, Storz Medical, Kyowa Kirin, Guidepoint, Merck, Merz, Synergia, BIAL, Zambon, Sapio Life, STADA, Inomed und Vertanical. Die Autorin Celine Cont ist Beraterin bei Storz Medical. Die übrigen Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Wir danken den Patientinnen und Patienten für ihre Compliance und Teilnahme. Die technische Betreuung und Datenerfassung wurde mit Hilfe von Veronika Hirsch und Michaela Wessler (Medizinisch-Technische Assistentinnen) sichergestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Disinfectant Wipes: mikrozid universal wipes | schülke | GTIN: 4032651957774 | Used to clean the hand piece after each session to ensure hygiene |
| Dry Towels: Wisch-/Pflegetuch Kolibri | IGEFA Handelsgesellschaft mbH & Co. KG | PZN: 10417600 | Used to dry the patient's skin after the ultrasound gel has been cleaned |
| Handpiece | Storz Medical | HW 030816.01 (114) | Used to hold the device during treatment |
| NEUROLITH | Storz Medical | SN: 19880_0015 | The NEUROLITH system with TPS is a CE-certified device |
| Patient Chair | Adjustable chair for optimal patient positioning during the treatment | ||
| silicone oil | Storz Medical | 13330 | Applied onto the membrane of the handpiece before attaching the prefilled coupling membrane (the distance piece) to the handpiece |
| Sonosid Ultrasound Gel | Asid Bonz GmbH | PZN: 5362311 | Applied to the scalp to ensure optimal transmission of acoustic pulses through the skull |
| Wash Gloves: Esemtan wash mitts | schülke | GTIN: 4032651297016 | For removing the ultrasound gel from the patient post-treatment |
Referenzen
- Koch, G., et al. The emerging field of non-invasive brain stimulation in Alzheimer's disease. Brain. Epub ahead of print. , (2024).
- Menardi, A., et al. Toward noninvasive brain stimulation 2.0 in Alzheimer's disease. Ageing Res Rev. 75, 101555 (2022).
- Beisteiner, R., et al. Transcranial pulse stimulation with ultrasound in Alzheimer's disease-a new navigated focal brain therapy. Adv Sci. 7 (3), 1902583 (2019).
- Matt, E., Dörl, G., Beisteiner, R. Transcranial pulse stimulation (TPS) improves depression in AD patients on state-of-the-art treatment. Alzheimer's Dement. 8 (1), e12245 (2022).
- Cont, C., et al. Retrospective real-world pilot data on transcranial pulse stimulation in mild to severe Alzheimer's patients. Front Neurol. 13, 948204 (2022).
- Guo, J., Hai, H., Ma, Y. Application of extracorporeal shock wave therapy in nervous system diseases: A review. Front Neurol. 13, 963849 (2022).
- Khanna, A., Nelmes, R. T., Gougoulias, N., Maffulli, N., Gray, J. The effects of LIPUS on soft-tissue healing: a review of literature. Br Med Bull. 89, 169-182 (2009).
- Chen, X., You, J., Ma, H., Zhou, M., Huang, C. Transcranial pulse stimulation in Alzheimer's disease. CNS Neurosci Ther. 30 (2), e14372 (2024).
- . Website of Manufacturer Available from: https://www.storzmedical.com/en/physics-and-technology (2025)
- Popescu, T., Pernet, C., Beisteiner, R. Transcranial ultrasound pulse stimulation reduces cortical atrophy in Alzheimer's patients: a follow-up study. Alzheimer's Dement. 7 (1), e12121 (2021).
- Dörl, G., Matt, E., Beisteiner, R. Functional specificity of TPS brain stimulation effects in patients with Alzheimer's disease: A follow-up fMRI analysis. Neurol Ther. 11 (3), 1391-1398 (2022).
- d'Agostino, M. C., Craig, K., Tibalt, E., Respizzi, S. Shock wave as biological therapeutic tool: From mechanical stimulation to recovery and healing, through mechanotransduction. Int J Surg. 24, 147-153 (2015).
- Yahata, K., et al. Low-energy extracorporeal shock wave therapy for promotion of vascular endothelial growth factor expression and angiogenesis and improvement of locomotor and sensory functions after spinal cord injury. J Neurosurg. 25 (6), 745-755 (2016).
- Hatanaka, K., et al. Molecular mechanisms of the angiogenic effects of low-energy shock wave therapy: roles of mechanotransduction. Am J Physiol. 311 (3), C378-C385 (2016).
- Mariotto, S., et al. Extracorporeal shock waves: from lithotripsy to anti-inflammatory action by NO production. Nitric oxide. 12 (2), 89-96 (2005).
- Flournoy, J., Ashkanani, S., Chen, Y. Mechanical regulation of signal transduction in angiogenesis. Front Cell Dev Biol. 10, 933474 (2022).
- Wojtecki, L., Cont, C., Stute, N., Galli, A., Schulte, C., Trenado, C. Electrical brain networks before and after transcranial pulsed shockwave stimulation in Alzheimer's patients. Geroscience. Epub ahead of print. , (2024).
- Sarica, C., et al. Human studies of transcranial ultrasound neuromodulation: A systematic review of effectiveness and safety. Brain Stimul. 15 (3), 737-746 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten