Method Article
Alzheimer Hastaları için Transkraniyal Nabız Stimülasyonu
Bu Makalede
Özet
Bu makale, Alzheimer hastalığı olan hastalarda transkraniyal nabız stimülasyonu prosedürünü açıklamaktadır. Endikasyonları, metodolojiyi ve gelecekteki beklentileri ayrıntılı olarak tartışır.
Özet
Transkraniyal nabız stimülasyonu (TPS), Alzheimer hastalığının (AD) tedavisi için Conformité Européenne (CE) işaretli noninvaziv bir nöromodülasyon tedavisidir. İlk pilot çalışmalar, bilişsel işlev üzerinde umut verici etkiler göstermiştir. Bu makale, MRG kılavuzluğunda, nöro-navigasyonlu bir TPS cihazı kullanarak AD'li hastaları tedavi etme prosedürüne odaklanmaktadır. Bunun için izlenecek protokol, gerekli prosedürler ve cihaz ayarları dahil olmak üzere ayrıntılı olarak açıklanmıştır. Bugüne kadar yayınlanan temsili klinik sonuçlara kısa bir genel bakış da sunulmaktadır. Biliş ve duygulanımdaki önemli klinik gelişmelere ek olarak, güvenlik verileri sağlamak için advers olaylar (AE) ve olası advers cihaz olayları (ADE) sunulmaktadır. Son olarak, yöntem eleştirel bir şekilde tartışılmaktadır. Gelecekte, herhangi bir plasebo etkisini dışlamak için randomize kontrollü çalışmalar yapılmalıdır. Ayrıca şu anda daha fazla sayıda hasta ile uzun süreli çalışmaların eksikliği vardır. Bu çözülmemiş sorulara rağmen, TPS, kontrollü, bilimsel olarak yönlendirilen bir ortamda kullanıldığında Alzheimer hastaları için yardımcı bir tedavi potansiyeline sahiptir.
Giriş
Noninvaziv beyin stimülasyonu (NiBS) teknikleri, nörodejeneratif hastalıklarla ilişkili bilişsel ve işlevsel eksiklikleri azaltmak için potansiyel terapötik stratejiler sunan, demans araştırmalarında artan bir ilgi odağı haline gelmiştir. Biriken kanıtlar, NiBS'nin Alzheimer hastalığı (AD) olan bireylerde durumun çeşitli aşamalarında bilişsel işlevi artırabileceğini veya bilişsel gerilemeyi yavaşlatabileceğini düşündürmektedir 1,2. Bu teknikler arasında, Transkraniyal Nabız Stimülasyonu (TPS), yalnızca kortikal yüzeyde değil, aynı zamanda daha derin beyin bölgelerinde de yüksek düzeyde odaklanmış ve hassas bir şekilde hedeflenmiş beyin stimülasyonu sağlama yeteneği ile özellikle dikkat çekicidir 3,4. TPS ile ilişkili yan etkiler nadirdir, orta şiddette ve geçicidir 3,5.
Başlangıçta ortopedi ve kardiyoloji alanlarında geliştirilen terapötik ultrason tedavisi ve ekstrakorporeal şok dalgası tedavisinin (ESWT) doku iyileşmesini desteklediği ve kan akışını iyileştirdiği gösterilmiştir. Ortopedide ESWT özellikle tendinopatiler ve kemik iyileşmesi sorunları gibi kas-iskelet sistemi rahatsızlıklarını tedavi etmek için uygulanırken, kardiyolojide damar sağlığı üzerindeki etkileri araştırılmıştır 6,7. TPS, özellikle Alzheimer araştırmalarında nörolojik uygulamalar için uyarlanmıştır ve bilişsel gerileme ve fonksiyonel bozuklukların ele alınmasında umut vaat etmektedir 8,3,4. Bu teknik, Alzheimer hastalığı olan hastaların semptomlarını hafifletmek için şok dalgaları kullanır, bu öğretici5'in çalışma grubundan alınan pilot verilerle gösterildiği gibi. Şok dalgaları, yüksek frekanslı alternatif bir yükiçermedikleri için ultrason dalgalarından farklıdır 9. Şekil 1'de gösterildiği gibi oluşturulan şok dalgası profili, ultrasonun daha yüksek frekanslı genlik özelliği ile birlikte, tekil basınç darbesini ve ardından TPS sırasında genliğin düzleşmesini açıkça göstermektedir. Yüksek frekanslı alternatif stres nedeniyle, ultrason dalgalarının enerjisi doku tarafından emilir ve bu da doku ısınmasına yol açabilir - şok dalgalarında gözlenmeyen bir etki. Diğer uygulamalarda yüksek enerjili şok dalgaları kullanılırken, TPS'de dokuya verilen enerji düşük enerjilidir9. Alzheimer hastalığı üzerindeki potansiyel etkiler ilk olarak Alzheimer Hastalığı için Kayıt Defteri Oluşturma Konsorsiyumu'nda (CERAD)3 gelişmelerin yanı sıra çeşitli alanlarda kortikal kalınlığınartması 10 ve MR ağ bağlantısındaki değişiklikler11 olarak bildirilmiştir.
TPS'nin etki mekanizmaları şu anda araştırılmaktadır ve bu non-invaziv tekniğin hücresel düzeyde beyin aktivitesini nasıl modüle ettiğine odaklanan araştırmalar, potansiyel olarak nöroplastisiteyi artırabilecek ve bilişsel işlevi iyileştirebilecek mekanotransdüksiyon süreçlerini tetiklemektedir 3,4. Şok dalgası tedavisinde, fiziksel enerji lokalize doku alanına etki eder ve mekanotransdüksiyonu12 indükleyerek büyüme faktörleri 13,14 ve nitrik oksit15'in salınımını uyarır. Bu etkiler, sırayla, kan dolaşımını artırabilir ve neoanjiyogeneziteşvik edebilir 16.
TPS'nin amacı, güvenli ve semptomların iyileşmesine yol açabilecek bir ek tedavi sağlamaktır. Uyarılmış alanlar bilateral frontal korteks, bilateral lateral parietal korteks, genişletilmiş precuneus korteksi ve bilateral temporal korteksi içerebilir. Olağan tedavi protokolü, ilk tedavi döngüsü olarak 2 hafta boyunca 6.000 nabız ile altı seanstan oluşur.
Geçici olan ve advers cihazla ilgili olaylarla (ADE'ler) açık bir nedensel ilişki olmayan orta derecede subjektif şiddet ile karakterize edilen oturumların yaklaşık% 4'ünde advers olaylar bildirildiğinden, prosedür güvenli kabul edilir5.
Bu ilk sonuçlar cesaret verici olsa da, araştırmacıların ve klinisyenlerin TPS'nin kendi özel uygulamaları için uygun olup olmadığını değerlendirmeleri çok önemlidir. Göz önünde bulundurulması gereken faktörler arasında Alzheimer hastalığının evresi, hastanın diğer tedavilere yanıtı ve TPS'yi uzman rehberliğinde güvenli bir şekilde uygulayabilecek tesislerin mevcudiyeti yer alır. Alzheimer'ın erken ila orta evrelerindeki bireyler için TPS, minimal yan etkilerle potansiyel bilişsel faydalar sunabilir, ancak henüz bağımsız bir tedavi olarak kabul edilmemektedir. Bunun yerine, farmakolojik müdahaleler veya bilişsel eğitim gibi mevcut tedavileri tamamlayabilir. Randomize kontrollü çalışmaların sonuçları bugüne kadar eksiktir. Bununla birlikte, TPS, kontrollü kullanım ve bilimsel keşif altında Alzheimer hastaları için ek bir tedavi potansiyeline sahip olabilir.
Protokol
TPS ile tedavi edilen tüm hastaların analizi, Bölgesel Tıp Odası Etik Komitesi (Ärztekammer Nordrhein, Nr. 2021026) tarafından onaylanan yerel kayıt defterinin bir parçasıydı. Ayrıca, tüm hastalar tedavi için yazılı onam imzaladı. Toplam 11 hasta TPS ile tedavi edildi (dokuz erkek, iki kadın, yaş aralığı 59-77 yıl, M = 69.82). Tedaviden önce, tüm hastalara NEUROLITH sistemi ile transkraniyal nabız stimülasyonunun (TPS) potansiyel yararları ve riskleri hakkında kapsamlı bir şekilde bilgilendirildikleri ayrıntılı bir bilgilendirilmiş onam süreci uygulandı.
1. Hasta seçimi ve hazırlanması
- Bu stimülasyona başlamadan önce hasta seçimi ve bilgilendirilmiş onam çok önemlidir. Alzheimer Hastalığı için CE işaretini kullanın. Alzheimer klinik sendromu temelinde BOS biyobelirteçlerini kullanarak tanıyı doğrulayın. Bir nörolog veya psikiyatrist tarafından ulusal veya uluslararası yönergelere göre hastalık tedavisi uygulayın.
NOT: TPS, bilimsel araştırma kapsamında bir eklenti olarak sunulabilir. TPS ek bir tedavi olarak uygulandığından, tüm hastalar tedavi boyunca düzenli tıbbi tedavi planlarına devam ettiler. Bazı hastalar TPS seansları sırasında antidemans ilaçları ve / veya antipsikotikler kullanıyordu; Bununla birlikte, bu ilaçlar çalışma protokolünün bir parçası değildi ve müdahalenin bir parçası olarak değiştirilmedi veya standardize edilmedi. - TPS için aşağıdaki dışlama kriterlerini kullanın: Tedavi, vasküler ensefalopati, tedavi alanındaki tromboz, Fazekas derece 3, tümörler, vasküler malformasyonlar, metal implantlar ve serebral amiloid anjiyopati (CAA) dahil olmak üzere Alzheimer hastalığı ile ilgisi olmayan ilgili intraserebral patolojilerle kontrendikedir. Ek kontrendikasyonlar, antikor tedavisi öyküsü veya devam eden antikor, kan pıhtılaşma bozuklukları veya oral antikoagülasyon, ilk uygulamadan altı hafta önce kortikosteroid tedavisi, epilepsi (birden fazla nöbet veya nöbet odaklı tek bir nöbet), TPS tedavisi için onaylanmamış kalp pilleri, tekrarlayan senkop, saldırganlık veya psikoz gibi günlük yaşamı etkileyen ciddi duygusal davranış bozuklukları, hamilelik ve protokole uyulmamasına yol açabilecek tıbbi durumlar. MRI, EEG, BOS analizi, laboratuvar testleri ve çalışmadaki ayrıntılı bilişsel ve duyuşsal değerlendirmeler dahil olmak üzere tanı ve dışlama kriterleri ile ilgili olarak.
2. Nöropsikolojik testler
- İlk stimülasyondan önce (başlangıç) ve son stimülasyondan sonra (stimülasyon sonrası) nöropsikolojik testler yapın. Bu çalışma için Alzheimer Hastalığı Değerlendirme Ölçeği (ADAS) kullanılmıştır.
- ADAS'a başlamadan önce, sessiz, rahat ve dikkat dağıtıcı unsurlardan arınmış olduğundan emin olmak için test ortamını hazırlayın. Değerlendirmeyi, belirli bilişsel alanları değerlendirmek için yapılandırılmış bir formatı takip eden eğitimli bir klinisyen veya nöropsikolog ile gerçekleştirin.
- ADAS iki ana bileşenden oluşur: Bilişsel Alt Ölçek (ADAS-Cog) ve Bilişsel Olmayan Alt Ölçek. Aşağıda açıklandığı gibi bir dizi görev aracılığıyla hafızayı, dili, yönelimi ve praksisi değerlendirmek için en yaygın olarak kullanılan ADAS-Cog'u kullanın.
- Kelime hatırlama: Hastaya bir kelime listesi sunun ve bunları hemen ve bir gecikmeden sonra hatırlamasını isteyin.
- Nesneleri ve parmakları adlandırma: Hastaya bir dizi nesne gösterin ve bunları doğru bir şekilde adlandırmasını isteyin.
- Aşağıdaki komutlar: Hastadan, anlama ve praksisti değerlendirmek için sözlü talimatlara dayalı olarak belirli eylemler gerçekleştirmesini isteyin.
- Görsel yapı: Görsel-uzamsal becerileri değerlendirmek için hastaya geometrik şekilleri kopyalama görevi verin.
- Düşünsel praksis: Hastadan ortak nesnelerin (örneğin, bir kalem veya tarak) kullanımını göstermesini isteyin.
- Oryantasyon: Hastaya geçerli tarih, haftanın günü ve yeri hakkında soru sorun.
- Kelime tanıma: Hastadan daha önce sunulan kelimeleri dikkat dağıtıcı kelimeler listesinden tanımasını isteyin.
- Dil yeteneği: Yapılandırılmış konuşmalar ve cümle inşası yoluyla hastanın akıcılığını ve anlamasını değerlendirin.
- Ruh hali değişiklikleri, ilgisizlik veya ajitasyon gibi davranışsal semptomları değerlendirmek için bilişsel olmayan alt ölçeği kullanın.
- Tutarlılık için, testi uygulayan klinisyenden ADAS kılavuzunda belirtilen talimatlara sıkı sıkıya bağlı kalmasını isteyin. Her görevi performansa göre puanlayın, daha yüksek puanlar daha fazla bozulmayı gösterir.
- Son stimülasyon seansından sonra, sonuçların uygulama etkilerinden ziyade bilişsel işlevdeki gerçek değişiklikleri yansıttığından emin olmak için testin paralel bir versiyonunu kullanarak ADAS'ı tekrarlayın.
3. Cihazın ve ortamın hazırlanması
- Cihazı açın. Cihazın arkasındaki ana güç anahtarını bulun ve açın.
- Ön paneldeki bekleme düğmesine basın. Cihazın başlatılması yaklaşık 5 dakika sürecektir.
- Hastayı konumlandırın. Hastanın olası boyun desteği ile rahat bir şekilde oturduğundan emin olun. Hastanın algılama lensli tanıma gözlükleri takmasını sağlayın. Gözlükleri yerinde tutmak için bant veya kayış kullanarak hastanın kafasına sabitleyin.
- Kamerayı ayarlayın. Hastanın başının çerçeve içinde tamamen görünür olduğundan emin olmak için kamerayı hizalayın. Bu kamera, izleme ve kalibrasyon için kritik öneme sahiptir.
4. Yüksek gerilim testi (Günlük bakım)
- Yüksek voltaj testini (HV-Testi) gerçekleştirin. Bu testi her 24 saatte bir yapın. El tipi aplikatör üzerindeki tetik düğmesine basarak testi tamamlamak için ekrandaki talimatları izleyin.
5. El aleti hazırlığı
- El aletinin zarına bir damla silikon yağı uygulayarak el aletini hazırlayın.
- Önceden doldurulmuş bağlantı membranını (mesafe parçası) el aletine takın ve optimum performans için güvenli olduğundan emin olun.
6. Yeni hastalar için kalibrasyon
- Hastanın MRI verilerini yükleyin. Yeni hastalar için, gerekli MRI taramalarının (T1 ağırlıklı, başın alından arkaya, kulaktan kulağa uzanan yüksek çözünürlüklü görüntüleri) mevcut olduğundan emin olun.
- MRI verilerini içeren harici depolama aygıtını (USB veya CD) sistemin USB bağlantı noktasına takın.
- Bir hasta profili oluşturun. Sistemde Yeni Hasta'yı seçin ve gerekli bilgileri girin. Sistemde yeni bir hasta profili oluştururken, bazı bilgiler MRG-CD'den otomatik olarak içe aktarılırken, diğer detayların manuel olarak girilmesi gerekir.
- CD'yi sisteme yerleştirdikten sonra, hastanın tam adı ve doğum tarihi MRI CD'sindeki meta verilerden otomatik olarak alınır. Tedavi planını manuel olarak sisteme girin. Sistemde zaten depolanmış olan önceden yapılandırılmış Alzheimer Hastalığı (AD) protokolünü seçin. Bu protokol aşağıdaki ayarları içerir: 4 Hz frekans, 0,2 mJ/mm2 enerji seviyesi ve seans başına 6.000 darbe. Protokol olduğu gibi kullanılabilir veya klinisyenin tercihlerine göre ayarlanabilir.
- MRI verilerini yükleyin ve görüntülerin kalitesini doğrulayın. MRI verilerinin kalitesini doğrulamak için, sistem içindeki MRI görüntülerinin tek tek dilimleri arasında manuel olarak gezinin. Tüm anatomik yapıların keskin ve iyi tanımlanmış olduğundan emin olun ve hareket artefaktları veya bozulma olup olmadığını kontrol edin. T1 ağırlıklı görüntülerin genel çözünürlüğünün doğru nöronavigasyon için yeterli olduğunu onaylayın. Görüntü seçimlerini gerektiği gibi ayarlayın ve kalibrasyona devam edin.
- Görüntüleri kalibre etmek için, aşağıdaki yolları kullanarak 3 noktalı kalibrasyon yapmak için kalibrasyon kalemini kullanın.
Yol 1: Alından başın arkasına kadar.
Yol 2: Bir kulaktan diğerine.
Yol 3: Başın üst kısmı boyunca dairesel veya zikzak hareketler gerçekleştirin. - Kalibrasyon sırasında algılama merceklerinin her zaman kameraya baktığından emin olun.
- Temas noktalarını kontrol etmek için döndürerek ekrandaki 3D kafa modelinin hastanın kafasıyla düzgün bir şekilde hizalandığını onaylayın.
7. Tedavi bölgesi kurulumu (Opsiyonel)
- Hastanın özel ihtiyaçlarına göre tedavi bölgelerini tanımlayın. Bu çalışma için, bilateral frontal lob, bilateral parietal lob ve precuneus dahil olmak üzere önceden yapılandırılmış Alzheimer Hastalığı protokolü kullanılmıştır. Ek olarak, ilk protokole bilateral temporal korteks ekleyin. Uyarılacak bölgeleri tanımlamak için MRI görüntülerini ve beynin belirli anatomik işaretlerini kullanın.
- Ekrandaki tedavi bölgelerinin boyutunu, şeklini ve sayısını ayarlayın. ROI'leri ayarlamak için işlem tamamen dokunmatik ekran kontrolleri kullanılarak gerçekleştirilir.
- Sistemin ana arayüzündeki Tedavi Planlama modülüne erişerek başlayın. Bu modülde, tedavi bölgelerinin düzenlenmesini etkinleştirmek için ROI Ayarlama seçeneğini seçin. Ayarlama moduna girdikten sonra, sistem ekranda varsayılan bir yatırım getirisi görüntüler.
- ROI'yi frontal lob, parietal lob, precuneus veya temporal korteks gibi istenen anatomik alan üzerine konumlandırmak için dokunmatik ekrandaki ok düğmelerini kullanın. Düğmeler, hedef beyin bölgesi ile hassas hizalama için ROI'yi her yöne (yukarı, aşağı, sola, sağa) aşamalı olarak hareket ettirmeye izin verir.
- ROI'yi konumlandırdıktan sonra, özel ekran kontrollerini kullanarak boyutlarını (boyut, derinlik ve şekil) ayarlayın:
Derinlik Ayarı (Düğme A): Derinlik düğmesine dokunun ve ROI'nin penetrasyon seviyesini tedavi gereksinimlerine uyacak şekilde ayarlayın.
Genişlik Ayarı (Düğme B): ROI'nin yatay boyutunu genişletmek veya daraltmak için genişlik ayarı düğmesini kullanın.
Yükseklik Ayarı (Düğme C): Yükseklik ayar kontrolüne dokunarak ROI'nin dikey boyutunu değiştirin. Tamamlandığında ayarları kaydedin.
8. Tedavinin yürütülmesi
- Optimum enerji iletimi için hastanın kafa derisine bol miktarda ultrason jeli uygulayın.
- Tedaviye başlayın. Cihazda Tedavi Modunu seçin ve önceden doldurulmuş membranın doğru şekilde takıldığını onaylayın. Önceden doldurulmuş membranın doğru şekilde takıldığı, el aleti üzerindeki yerine düzgün bir şekilde oturduğundan emin olunarak doğrulanır. İsteğe bağlı olarak, hasta seans sırasında işitme koruması kullanabilir.
- El aletini hastanın kafa derisine dik tutun ve yüzey boyunca eşit şekilde hareket ettiğinden emin olun. Şekil 2 , TPS sırasında hasta ile NEUROLITH arasındaki ideal hizalamayı göstermektedir. Şekil 3 , ilgilenilen bölgelerin (ROI) bir örneğini ve bir hastanın MRG'sinde uyarılan dokunun modellemesini göstermektedir. Şekil 4 , stimülasyon sırasında elde taşınan cihazın bir resmini göstermektedir.
- Stimülasyonu izleyin. Ekrandaki hedeflenen alanlar yeşile dönene kadar her bölgeyi tedavi edin, bu da uygun kapsama alanını gösterir. Sürekli izlemeyi sağlamak için algılama lenslerini kameranın görüş alanında tutarken el aletini hareket ettirmeye devam edin.
NOT: Tanıma gözlükleri tedavi sırasında hafifçe kayarsa, seans devam edebilir. Bununla birlikte, gözlükler çıkarılırsa, yeniden kalibrasyon gereklidir. - Oturumu sonlandırın. Tedaviyi sonlandırmak için cihaz üzerindeki Durdur düğmesine basın. Seans bitiş noktasına 6000 darbeye ulaşıldığında ulaşılır.
9. Tedavi sonrası işlemler
- Ekipmanı temizleyin. El aletini ve çıkarılabilir membranı onaylı mendiller kullanarak temizleyin (alkol bazlı temizleyicilerden kaçının).
- Hasta bakımı: Kalan ultrason jelini çıkarmak için kafa derisi bölgesini nazikçe temizleyin. Gerekirse, hastanın saçını bir havlu veya saç kurutma makinesi ile kurulayın. Tedaviden sonra, aktif bir gözlem gerekmese de, baş dönmesi, baş ağrısı veya kafa derisi rahatsızlığı gibi herhangi bir gecikmeli veya hafif yan etki yaşamaları durumunda hastalara önümüzdeki 10-15 dakika boyunca yakınlarda kalmalarını tavsiye edin. Hastaları susuz kalmamaya teşvik edin, çünkü bu genel iyileşmeyi ve refahı destekler. Hastaya, özellikle seanstan sonra yorgun hissediyorsa veya hafif bir rahatsızlık yaşıyorsa, günün geri kalanında yoğun fiziksel aktiviteden kaçınmasını tavsiye edin.
- Tedavi verilerinin saklanması: Tanımlanmış bölgeler de dahil olmak üzere tüm tedavi verilerini kaydedin ve gelecekteki oturumlar için ayarlayın. Tedavi veya geri bildirim sırasındaki herhangi bir gözlem belgelenmelidir.
Sonuçlar
Transkraniyal nabız stimülasyonu,bu eğitimin çalışma grubu 1 tarafından yayınlanan 11 hastadan (dokuz erkek, iki kadın, yaş aralığı 59-77 yıl, M = 69.82) elde edilen kontrolsüz pilot verilerle gösterildiği gibi Alzheimer hastalarının semptomlarını hafifletti. Uyarılan alanlar arasında bilateral frontal korteks, bilateral lateral parietal korteks ve genişletilmiş precuneus korteksi vardı. Protokole bilateral temporal korteks eklendi. Tedavi, ilk tedavi döngüsü olarak 2 hafta boyunca 6.000 bakliyat ile altı başlangıç seansında uygulandı.
Stimülasyon sırasında tedavi protokolü 4 Hz, 0.20 mJ /mm2 ve 6000 darbe içeriyordu. 11 hastadan üçü (% 27) toplam 75 seanstan üçünde (% 4) advers olaylar bildirmiştir. Bunlar arasında çene ağrısı (NRS 4/10), mide bulantısı (NRS 7/10) ve uyuşukluk (NRS 10/10) vardı. Bununla birlikte, bunların hiçbiri 24 saatten fazla sürmedi ve hepsi doğrudan advers cihaz olayları (ADE'ler) olarak stimülasyona atfedilemezdi.
Stimülasyon sonrası ADAS toplam skorunda taban çizgisine kıyasla 30.2'den 25.8'e (p = 0.01) ve 25.8'den 23.3'e (p = 0.04) iyileşen ADAS-Cog skorunda anlamlı bir fark gözlendi. Şekil 5). Bazı hastalar sadece küçük iyileşmeler gösterirken, bir hastadaki en iyi iyileşme %40 idi ve bu da ADAS toplam skorunda %15.76 ve ADAS Cog skorunda %8.65'lik bir genel iyileşmeye yol açtı (Şekil 6). Ayrıca, ADAS testinin kendi kendine bildirilen bir alt ölçeğinde depresif belirtilerde anlamlı bir fark tespit edildi. Tek kuyruklu bir t-testi, ADAS testinin kendi kendine bildirilen bir alt ölçeği ile ölçüldüğü gibi, depresif belirtilerde anlamlı bir azalma gösterdi. Stimülasyondan önce ortalama 0.7 (SS = 1.1) idi ve stimülasyondan sonra 0.2'ye düştü (SS = 0.4; t (8) = 1.859, p < 0.01).
İki haftalık tedavi süresinden önce ve sonra subjektif bir derecelendirme ölçeği tamamlandı. Bu ölçek, hastaların semptom şiddetlerini ve algılanan advers olayları 0 ila 10 arasında bir sayısal derecelendirme ölçeğinde bildirmelerine olanak tanır ve daha yüksek sayılar daha fazla semptom yoğunluğunu gösterir. NRS ile ölçülen semptom şiddetinin ortalama subjektif iyileşmesi 5.7 ila 3.4 arasındaydı (p = 0.023).
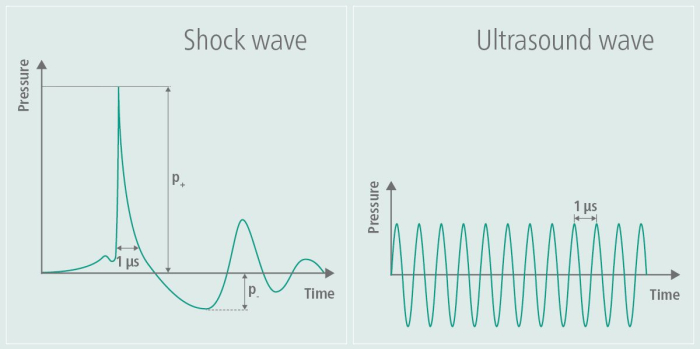
Şekil 1: Stimülasyon sırasında şok dalgası. Grafik, görüntünün sol tarafındaki bir TPS'nin genliğini gösterir ve bunu görüntünün sağ tarafındaki bir ultrasonun genliği ile karşılaştırır. TPS sırasında, tekil bir basınç darbesi üretilir ve ardından genliğin düzleşmesi gelir. Buna karşılık, ultrasonun genliği tekrar düzleşmez, ancak korunur, bu da zaman içinde sürekli yüksek frekanslı salınımlara neden olur. Bu rakam9'dan değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
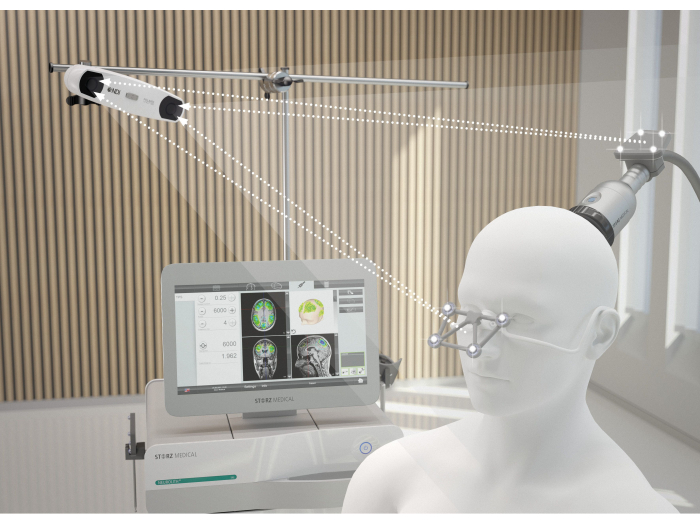
Resim 2: MRG navigasyon sistemi. Görüntü, TPS sırasında hasta ile NEUROLITH arasındaki ideal hizalamayı göstermektedir. 3D kamera, gözlüğün ve el aletinin algılama merceklerine temas eder. Yalnızca bu iletim garanti edilirse, el aleti doğru uzamsal konumda tanınır ve stimülasyonun ekrandaki görselleştirmesi bozulmaz. Bu rakam9'dan değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
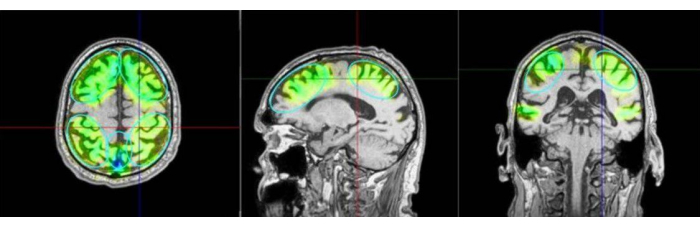
Şekil 3: İlgi alanları ve uyarılan alanlar. Görüntü, ilgilenilen bölgelerin (ROI) bir örneğini ve bir hastanın MRG'sinde uyarılan dokunun modellemesini göstermektedir. Renkler, precuneus'un ilgili bölgelerinin yanı sıra frontal ve parietal bölgelerde uygulanan darbe sayısını daha da farklılaştırır. Yeşil rengi turkuaz, mavi ve menekşe takip eder. Menekşe aşırı yoğunluğu gösterir ve bundan kaçınılmalıdır. Uyarılmış alanlar, navigasyon sisteminden simüle edilmiş veriler olarak esas olarak ulaşılan alanlar olarak görselleştirilir, ancak bu gerçek uygulanan beyin aktivasyonu olarak ölçülmez. ROI olarak önceden tanımlanmamış olmasına rağmen Kempen protokolüne ek zamansal stimülasyon eklenir. Sol: eksenel görünüm, orta: sagital görünüm, sağ: koronal görünüm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
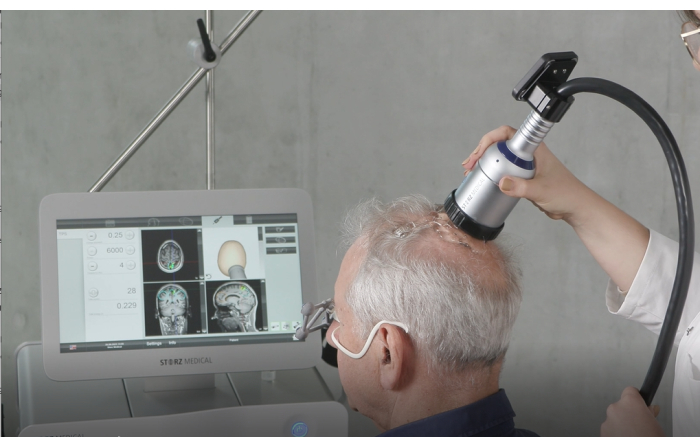
Şekil 4: Elde taşınan cihaz. Bu şekil, stimülasyon sırasında kullanılan el cihazını göstermektedir. Kritik hazırlık adımları, optimum enerji iletimini sağlamak için hastanın kafa derisine yeterli miktarda ultrason jeli uygulanmasını ve önceden doldurulmuş zarın güvenli ve doğru bir şekilde takıldığını doğrulamayı içerir. Tedavi sırasında, el aleti kafa derisine dik tutulur ve tutarlı bir stimülasyonu sürdürmek için yüzey boyunca eşit şekilde hareket ettirilir. Bu rakam9'dan değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
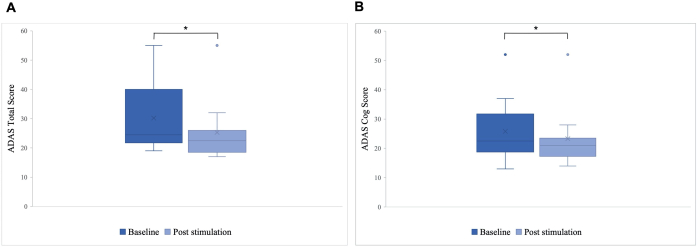
Şekil 5: İlk stimülasyondan önce Alzheimer Hastalığı Değerlendirme Ölçeği (ADAS). Hasta grubunun Alzheimer Hastalığı Değerlendirme Ölçeği'ndeki (ADAS) ilk stimülasyondan önceki (koyu mavi) ve son stimülasyondan sonraki (açık mavi) puanının ortalaması. Daha düşük bir puan, daha iyi performansı gösterir. Kutu grafiği, hastaların verilerinin dağılımını gösterir. (A) ADAS toplam puanı. Çizgi, grubun medyanını temsil eder (taban çizgisi = 24.5, stimülasyon sonrası = 22.5) ve çapraz, ortalama puanları temsil eder (M taban çizgisi = 30.2 (SS 11.55), M stimülasyon sonrası = 25.8 (SS 10.71), *p = 0.01). (B) ADAS dişli puanı. Çizgi, grubun medyanını temsil eder (taban çizgisi = 22.5, stimülasyon sonrası = 21) ve çapraz, ortalama puanları temsil eder (M taban çizgisi = 25.8 (SS 10.77), M stimülasyon sonrası = 23.3 (SS 10.27), *p = 0.04). Bu rakam5'ten değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
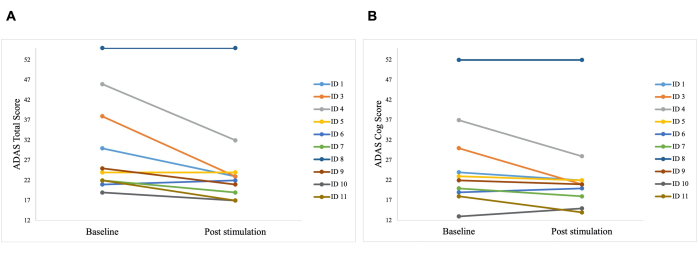
Şekil 6: ADAS'taki hastaların bireysel test sonuçları. Alzheimer Hastalığı Değerlendirme Ölçeği'ndeki (ADAS) hastaların ilk stimülasyondan önce (başlangıç) ve son stimülasyondan sonra (stimülasyon sonrası) bireysel test sonuçları. Daha düşük bir puan, daha iyi performansı gösterir. Her satır bir hastayı temsil eder. (A) ADAS toplam puanındaki her hastanın bireysel puanları. En iyi gelişme 15 puandı (ID 3). (B) ADAS cog skoru alt ölçeğindeki her hastanın bireysel puanları. En iyi gelişme 14 puandı (ID 3 ve ID 4). Bu rakam5'ten değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Genel olarak, TPS Alzheimer hastalığı için olası bir tedavi yöntemidir. Pratik bir bakış açısından, stimülasyon süreci operatör için kullanıcı dostu olacak şekilde tasarlanmıştır. Prosedürün başlangıcında ilgi alanlarını tanımlama yeteneğinin yanı sıra, tedavi sırasında renk kodlu işaretler aracılığıyla uygulanan darbe sayısının görselleştirilmesi, kullanıcı arayüzünün kullanımını önemli ölçüde basitleştirir. İlgilenilen bölgelerin ayarı da serbestçe seçilebilir ve gerektiği gibi ayarlanabilir. Uyarılmış alanlar, simüle edilmiş veriler olarak net bir şekilde görselleştirilir, ancak cihazdan etkilenen daha derin alanları daha düşük enerji seviyelerinde görüntülemek için üretici tarafından daha fazla geliştirme yapılması gerekir.
TPS protokolündeki kritik adımlar, stimülasyon cihazının hedeflenen beyin bölgelerine hassas bir şekilde yerleştirilmesini, nabız dalgalarının doğru yoğunluk ve frekansının sağlanmasını ve hasta yanıtlarının dikkatli bir şekilde izlenmesini içerir. Sorun giderme, enerji kaybını veya optimal olmayan stimülasyonu önlemek için el aleti ile kafa derisi arasında optimum temasın sağlanmasını içerebilir. Rahatsızlık veya yan etkiler gözlenirse, yoğunluk ayarlamaları veya yeniden konumlandırma gerekebilir.
Yayınlanan kontrolsüz veriler, klinik bilişsel iyileşmeler 5,3, ayrıca çeşitli beyin bölgelerindekortikal kalınlık artışı 10 ve MR ağ bağlantısındaki değişiklikler11 göstermiştir. Ruh halindeki iyileşmeler de bildirilmiştir 5,4. Diğer non-invaziv beyin stimülasyon yöntemleriyle karşılaştırıldığında, TPS birkaç farklı avantaj sunar. İlk olarak, mekanik şok dalgalarını hassas nöronavigasyon ile birleştirerek, etkilenen beyin bölgelerine hedefli uygulamaya izin verir. Tipik olarak sadece yüzeysel kortikal katmanları uyaran TMS'nin aksine, TPS'nin penetrasyon derinliği, onu daha derin beyin yapılarının dahil olduğu Alzheimer gibi nörodejeneratif hastalıkların tedavisi için özellikle uygun hale getirir. Ek olarak, TPS'nin olumlu bir güvenlik profiline sahip olduğu görülmektedir, tedavi seanslarının sadece% 4'ünde bildirilen minimal ve geçici yan etkiler vardır, bu da orta ila şiddetli AD5 olan hastalar için daha tolere edilebilir bir seçenek olabileceğini göstermektedir.
Etki mekanizmalarını kapsamlı bir şekilde araştırmak ve TPS tedavisi ile ilişkili potansiyel risk faktörlerinin ayrıntılı bir analizini yapmak için ek temel çalışmalara ihtiyaç vardır.
Bu araştırma grubu tarafından yayınlanan yakın tarihli bir çalışmada, Alzheimer hastalarında beyin ağı aktivitesi, transkraniyal nabız stimülasyonu (TPS) öncesi ve sonrası incelenmiştir17. Sonuçlar, TPS'nin beyin salınımlarını ve bağlantısını modüle edebildiğini ve Alzheimer hastalığında bilişsel işlevi potansiyel olarak iyileştirebileceğini göstermektedir. Önerilen mekanizmalardan biri, TPS sonrası artan gama salınımlarının beyindeki glifatik klerensi kolaylaştırabilmesidir. Glifatik klerens üzerindeki bu olası etki gelecekteki çalışmalarda daha fazla araştırılmalıdır. Ek olarak, TPS'nin beyin ağı fizyolojisini nasıl etkilediğini ve nöroprotektif etkilerinin Alzheimer'ın ilerlemesini yavaşlatıp yavaşlatamayacağını veya durdurup durduramayacağını açıklığa kavuşturmak için daha fazla mekanik çalışmaya ihtiyaç vardır.
TPS'nin hem sağlıklı hem de hastalıklı beyinler üzerindeki etkilerini araştıran klinik öncesi hayvan çalışmaları, altta yatan mekanizmaların daha derin bir şekilde anlaşılması için çok önemlidir. Çeşitli NiBS tekniklerinin farklı mekanizmalar aracılığıyla çalıştığına dikkat etmek önemlidir1. Bu nedenle, ultrason tedavisi18 ve şok dalgası tedavisi6 için tarif edilen etkilerin doku üzerinde bir rol oynayıp oynamadığını ve nasıl oynadığını araştırmak önemlidir. İlki, TPS'nin mekanotransdüksiyon süreçleri üzerindeki olası etkisinin yanı sıra, kapsamlı bir şekilde araştırılması gereken vasküler, hücresel ve moleküler değişiklikleri indükleme potansiyelini tanımladı. Ayrıca, nöroinflamatuar süreçlerin modülasyonu, özellikle kan-beyin bariyeri dinamiklerine vurgu yaparak, gelecekteki araştırmalar için ilgi çekici bir alan sunmaktadır. Bu etkilerin anlaşılması, altta yatan mekanizmalar hakkında değerli bilgiler sağlayabilir ve terapötik uygulamalar için TPS'yi optimize etmeye yardımcı olabilir. Ayrıca, bu, diğer nörodejeneratif hastalıkların yönetiminde TPS tedavisinin potansiyel uygulamasının araştırılmasına katkıda bulunur.
TPS, terapötik bir yaklaşım olarak umut vaat ediyor; Ancak, birkaç sınırlamanın ele alınması gerekir. TPS'nin spesifik etkilerini doğru bir şekilde tanımlamak için plasebo gruplarıyla yapılan kontrollü klinik çalışmalar gereklidir. Önemli bir zorluk, Alzheimer hastalığının (AD) evresi ve komorbiditelerin varlığı gibi faktörlerden etkilenebilen, stimülasyona yanıt olarak yüksek bireyler arası değişkenliktir4. Ek olarak, uzun süreli tedavi için en uygun protokol tanımlanmamıştır. Mevcut yaklaşımlar arasında aylık tek takviye seansları veya bir yıl içinde 12 seanslık bir tedavi döngüsünün tekrarlanması yer almaktadır, ancak bir yaklaşımın diğerine üstünlüğünü destekleyen kanıtlar eksiktir. Gelecekteki klinik araştırmalar, optimal stimülasyon parametrelerinin belirlenmesine, hastaya özgü faktörlerin (örneğin, AD'nin evresi) terapötik sonuçları nasıl etkilediğini değerlendirmeye ve TPS tedavisinin uzun vadeli etkilerini ve sürdürülebilirliğini araştırmaya öncelik vermelidir.
Açıklamalar
Yazar Lars Wojtecki daha önce Alman Araştırma Vakfı, Hilde-Ulrichs-Stiftung für Parkinsonforschung ve ParkinsonFonds Germany, BMBF/ERA-NETNEURON, DFG Forschergruppe (FOR1328), Deutsche Parkinson Vereinigung (DPV), Forschungskommission, Medizinische Fakultät, HHU Düsseldorf, UCB; Medtronic, UCB, Teva, Allergan, Merz, Abbvie, Roche, Bial, Merck, Novartis, Desitin, Spektrum. Yazar Lars Wojtecki, aşağıdaki şirketlere danışmanlık yapmaktadır: TEVA, UCB Schwarz, Desitin, Medtronic, Abbott/Abbvie, MEDA, Boehringer I, Storz Medical, Kyowa Kirin, Guidepoint, Merck, Merz, Synergia, BIAL, Zambon, Sapio Life, STADA, Inomed ve Vertanical. Yazar Celine Cont, Storz Medical'in danışmanıdır. Kalan yazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişkinin yokluğunda yürütüldüğünü beyan eder.
Teşekkürler
Hastalara uyumları ve katılımları için teşekkür ederiz. Teknik yardım ve veri toplama, Veronika Hirsch ve Michaela Wessler'in (tıbbi teknik asistanlar) yardımıyla sağlandı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Disinfectant Wipes: mikrozid universal wipes | schülke | GTIN: 4032651957774 | Used to clean the hand piece after each session to ensure hygiene |
| Dry Towels: Wisch-/Pflegetuch Kolibri | IGEFA Handelsgesellschaft mbH & Co. KG | PZN: 10417600 | Used to dry the patient's skin after the ultrasound gel has been cleaned |
| Handpiece | Storz Medical | HW 030816.01 (114) | Used to hold the device during treatment |
| NEUROLITH | Storz Medical | SN: 19880_0015 | The NEUROLITH system with TPS is a CE-certified device |
| Patient Chair | Adjustable chair for optimal patient positioning during the treatment | ||
| silicone oil | Storz Medical | 13330 | Applied onto the membrane of the handpiece before attaching the prefilled coupling membrane (the distance piece) to the handpiece |
| Sonosid Ultrasound Gel | Asid Bonz GmbH | PZN: 5362311 | Applied to the scalp to ensure optimal transmission of acoustic pulses through the skull |
| Wash Gloves: Esemtan wash mitts | schülke | GTIN: 4032651297016 | For removing the ultrasound gel from the patient post-treatment |
Referanslar
- Koch, G., et al. The emerging field of non-invasive brain stimulation in Alzheimer's disease. Brain. Epub ahead of print. , (2024).
- Menardi, A., et al. Toward noninvasive brain stimulation 2.0 in Alzheimer's disease. Ageing Res Rev. 75, 101555 (2022).
- Beisteiner, R., et al. Transcranial pulse stimulation with ultrasound in Alzheimer's disease-a new navigated focal brain therapy. Adv Sci. 7 (3), 1902583 (2019).
- Matt, E., Dörl, G., Beisteiner, R. Transcranial pulse stimulation (TPS) improves depression in AD patients on state-of-the-art treatment. Alzheimer's Dement. 8 (1), e12245 (2022).
- Cont, C., et al. Retrospective real-world pilot data on transcranial pulse stimulation in mild to severe Alzheimer's patients. Front Neurol. 13, 948204 (2022).
- Guo, J., Hai, H., Ma, Y. Application of extracorporeal shock wave therapy in nervous system diseases: A review. Front Neurol. 13, 963849 (2022).
- Khanna, A., Nelmes, R. T., Gougoulias, N., Maffulli, N., Gray, J. The effects of LIPUS on soft-tissue healing: a review of literature. Br Med Bull. 89, 169-182 (2009).
- Chen, X., You, J., Ma, H., Zhou, M., Huang, C. Transcranial pulse stimulation in Alzheimer's disease. CNS Neurosci Ther. 30 (2), e14372 (2024).
- . Website of Manufacturer Available from: https://www.storzmedical.com/en/physics-and-technology (2025)
- Popescu, T., Pernet, C., Beisteiner, R. Transcranial ultrasound pulse stimulation reduces cortical atrophy in Alzheimer's patients: a follow-up study. Alzheimer's Dement. 7 (1), e12121 (2021).
- Dörl, G., Matt, E., Beisteiner, R. Functional specificity of TPS brain stimulation effects in patients with Alzheimer's disease: A follow-up fMRI analysis. Neurol Ther. 11 (3), 1391-1398 (2022).
- d'Agostino, M. C., Craig, K., Tibalt, E., Respizzi, S. Shock wave as biological therapeutic tool: From mechanical stimulation to recovery and healing, through mechanotransduction. Int J Surg. 24, 147-153 (2015).
- Yahata, K., et al. Low-energy extracorporeal shock wave therapy for promotion of vascular endothelial growth factor expression and angiogenesis and improvement of locomotor and sensory functions after spinal cord injury. J Neurosurg. 25 (6), 745-755 (2016).
- Hatanaka, K., et al. Molecular mechanisms of the angiogenic effects of low-energy shock wave therapy: roles of mechanotransduction. Am J Physiol. 311 (3), C378-C385 (2016).
- Mariotto, S., et al. Extracorporeal shock waves: from lithotripsy to anti-inflammatory action by NO production. Nitric oxide. 12 (2), 89-96 (2005).
- Flournoy, J., Ashkanani, S., Chen, Y. Mechanical regulation of signal transduction in angiogenesis. Front Cell Dev Biol. 10, 933474 (2022).
- Wojtecki, L., Cont, C., Stute, N., Galli, A., Schulte, C., Trenado, C. Electrical brain networks before and after transcranial pulsed shockwave stimulation in Alzheimer's patients. Geroscience. Epub ahead of print. , (2024).
- Sarica, C., et al. Human studies of transcranial ultrasound neuromodulation: A systematic review of effectiveness and safety. Brain Stimul. 15 (3), 737-746 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır