Method Article
Stimolazione transcranica del polso per i pazienti di Alzheimer
In questo articolo
Riepilogo
Questo articolo descrive la procedura di stimolazione transcranica del polso nei pazienti con malattia di Alzheimer. Discute in dettaglio le indicazioni, la metodologia e le prospettive future.
Abstract
La stimolazione transcranica dell'impulso (TPS) è una terapia di neuromodulazione non invasiva con marcatura Conformité Européenne (CE) per il trattamento della malattia di Alzheimer (AD). I primi studi pilota hanno dimostrato effetti promettenti sulla funzione cognitiva. Questo articolo si concentra sulla procedura per il trattamento dei pazienti con AD utilizzando un dispositivo TPS neuronavigato guidato da risonanza magnetica. Il protocollo da seguire a tal fine è descritto in dettaglio, comprese le procedure necessarie e le impostazioni del dispositivo. Viene inoltre fornita una breve panoramica dei risultati clinici rappresentativi pubblicati fino ad oggi. Oltre a miglioramenti clinici significativi nella cognizione e nell'affetto, vengono presentati eventi avversi (AE) e possibili eventi avversi del dispositivo (ADE) per fornire dati sulla sicurezza. Infine, il metodo viene discusso criticamente. In futuro, dovrebbero essere condotti studi randomizzati controllati per escludere eventuali effetti placebo. Attualmente mancano anche studi a lungo termine con un numero maggiore di pazienti. Nonostante queste domande irrisolte, la TPS ha il potenziale come trattamento aggiuntivo per i pazienti di Alzheimer se utilizzata in un contesto controllato e scientificamente guidato.
Introduzione
Le tecniche di stimolazione cerebrale non invasiva (NiBS) sono diventate un punto focale di crescente interesse nella ricerca sulla demenza, offrendo potenziali strategie terapeutiche per mitigare i deficit cognitivi e funzionali associati alle malattie neurodegenerative. Prove crescenti suggeriscono che la NiBS potrebbe migliorare la funzione cognitiva o rallentare il declino cognitivo negli individui con malattia di Alzheimer (AD) in vari stadi della condizione 1,2. Tra queste tecniche, la stimolazione transcranica a impulsi (TPS) è particolarmente nota per la sua capacità di fornire una stimolazione cerebrale altamente focalizzata e mirata con precisione, non solo sulla superficie corticale ma anche nelle regioni cerebrali più profonde 3,4. Gli effetti collaterali associati alla TPS sono rari, di gravità moderata e transitori 3,5.
Inizialmente sviluppate nei campi dell'ortopedia e della cardiologia, la terapia terapeutica a ultrasuoni e la terapia con onde d'urto extracorporee (ESWT) hanno dimostrato di promuovere la guarigione dei tessuti e migliorare il flusso sanguigno. In ortopedia, la ESWT è stata particolarmente applicata per trattare condizioni muscoloscheletriche come tendinopatie e problemi di guarigione ossea, mentre in cardiologia è stata esplorata per i suoi effetti sulla salute vascolare 6,7. La TPS è stata adattata per applicazioni neurologiche, in particolare nella ricerca sull'Alzheimer, mostrando risultati promettenti nell'affrontare il declino cognitivo e le menomazioni funzionali 8,3,4. Questa tecnica utilizza le onde d'urto per alleviare i sintomi dei pazienti con malattia di Alzheimer, come dimostrato dai dati pilota del gruppo di lavoro di questo tutorial5. Le onde d'urto differiscono dalle onde ultrasoniche in quanto non comportano un carico alternato ad alta frequenza9. Il profilo dell'onda d'urto generato, come mostrato nella Figura 1, illustra chiaramente l'impulso di pressione singolare e il successivo appiattimento dell'ampiezza durante la TPS, insieme all'ampiezza di frequenza più elevata caratteristica degli ultrasuoni. A causa dello stress alternato ad alta frequenza, l'energia delle onde ultrasoniche viene assorbita dal tessuto, il che può portare al riscaldamento dei tessuti, un effetto non osservato con le onde d'urto. In altre applicazioni, vengono utilizzate onde d'urto ad alta energia, mentre nel TPS l'energia introdotta nel tessuto è a bassa energia9. I potenziali effetti sulla malattia di Alzheimer sono stati riportati per la prima volta come miglioramenti nel Consortium to Establish a Registry for Alzheimer's Disease (CERAD)3, così come un aumento dello spessore corticale in diverse aree10 e cambiamenti nella connettività della rete RM11.
I meccanismi d'azione della TPS sono attualmente in fase di studio, con la ricerca incentrata su come questa tecnica non invasiva modula l'attività cerebrale a livello cellulare, innescando potenzialmente processi di meccanotrasduzione che potrebbero aumentare la neuroplasticità e migliorare la funzione cognitiva 3,4. Nella terapia con onde d'urto, l'energia fisica agisce sull'area tissutale localizzata e induce la meccanotrasduzione12, stimolando il rilascio dei fattori di crescita13,14 e dell'ossido nitrico15. Questi effetti, a loro volta, possono migliorare la circolazione sanguigna e promuovere la neoangiogenesi16.
L'obiettivo della TPS è fornire una terapia aggiuntiva che sia sicura e che possa portare a un miglioramento dei sintomi. Le aree stimolate possono includere la corteccia frontale bilaterale, la corteccia parietale laterale bilaterale, la corteccia del precuneo estesa e la corteccia temporale bilaterale. Il protocollo di trattamento abituale consiste in sei sessioni con 6.000 impulsi nell'arco di 2 settimane come primo ciclo di trattamento.
La procedura è considerata sicura, in quanto gli eventi avversi sono stati riportati in circa il 4% delle sessioni caratterizzate da una gravità soggettiva moderata, transitoria e senza una chiara relazione causale con gli eventi avversi correlati al dispositivo (ADE)5.
Sebbene questi risultati iniziali siano incoraggianti, è fondamentale che i ricercatori e i medici valutino se la TPS è appropriata per le loro applicazioni specifiche. I fattori da considerare includono lo stadio della malattia di Alzheimer, la risposta del paziente ad altri trattamenti e la disponibilità di strutture in grado di somministrare in sicurezza la TPS sotto la guida di esperti. Per gli individui nelle fasi iniziali e moderate dell'Alzheimer, la TPS può offrire potenziali benefici cognitivi con effetti collaterali minimi, ma non è ancora considerata un trattamento autonomo. Invece, può integrare terapie esistenti come interventi farmacologici o training cognitivo. Ad oggi mancano i risultati degli studi randomizzati controllati. Tuttavia, la TPS potrebbe avere il potenziale come trattamento aggiuntivo per i malati di Alzheimer in uso controllato e con l'esplorazione scientifica.
Protocollo
L'analisi di tutti i pazienti trattati con TPS faceva parte del registro locale approvato dal Comitato Etico della Camera Medica Regionale (Ärztekammer Nordrhein, Nr. 2021026). Inoltre, tutti i pazienti hanno firmato il consenso scritto al trattamento. Un totale di 11 pazienti sono stati trattati con TPS (nove uomini, due donne, fascia d'età 59-77 anni, M = 69,82). Prima del trattamento, tutti i pazienti sono stati sottoposti a un dettagliato processo di consenso informato, durante il quale sono stati accuratamente informati sui potenziali benefici e rischi della stimolazione transcranica del polso (TPS) con il sistema NEUROLITH.
1. Selezione e preparazione del paziente
- Prima di iniziare questa stimolazione, la selezione del paziente e il consenso informato sono fondamentali. Utilizzare il marchio CE per il morbo di Alzheimer. Confermare la diagnosi utilizzando i biomarcatori del liquido cerebrospinale sulla base della sindrome clinica di Alzheimer. Eseguire il trattamento della malattia secondo le linee guida nazionali o internazionali da un neurologo o psichiatra.
NOTA: TPS può essere offerto come componente aggiuntivo nell'ambito dell'esplorazione scientifica. Poiché la TPS è stata somministrata come trattamento aggiuntivo, tutti i pazienti hanno continuato con i loro regolari piani di trattamento medico per tutta la durata del trattamento. Alcuni pazienti assumevano farmaci antidemenza e/o antipsicotici durante le sessioni di TPS; Tuttavia, questi farmaci non facevano parte del protocollo di studio e non sono stati modificati o standardizzati come parte dell'intervento. - Utilizzare i seguenti criteri di esclusione per la TPS: Il trattamento è controindicato con patologie intracerebrali rilevanti non correlate alla malattia di Alzheimer, tra cui encefalopatia vascolare, trombosi nell'area di trattamento, Fazekas grado 3, tumori, malformazioni vascolari, impianti metallici e angiopatia amiloide cerebrale (CAA) come definito dai criteri di Boston. Ulteriori controindicazioni sono una storia o una terapia anticorpale in corso, disturbi della coagulazione del sangue o anticoagulazione orale, trattamento con corticosteroidi entro sei settimane prima della prima applicazione, epilessia (convulsioni multiple o una singola crisi con un focus convulsivo), pacemaker non approvati per la terapia TPS, sincope ricorrente, gravi disturbi comportamentali affettivi che influiscono sulla vita quotidiana come aggressività o psicosi, gravidanza e condizioni mediche che possono portare al mancato rispetto del protocollo. Per quanto riguarda la diagnosi e i criteri di esclusione, tra cui risonanza magnetica, EEG, analisi del liquido cerebrospinale, test di laboratorio e valutazioni cognitive e affettive dettagliate nel workup.
2. Test neuropsicologici
- Eseguire test neuropsicologici prima della prima stimolazione (basale) e dopo l'ultima stimolazione (post-stimolazione). Per questo studio è stata utilizzata la scala di valutazione della malattia di Alzheimer (ADAS).
- Prima di iniziare l'ADAS, prepara l'ambiente di test per assicurarti che sia silenzioso, confortevole e privo di distrazioni. Eseguire la valutazione con un clinico o un neuropsicologo qualificato, che segue un formato strutturato per valutare specifici domini cognitivi.
- L'ADAS è costituito da due componenti principali: la sottoscala cognitiva (ADAS-Cog) e la sottoscala non cognitiva. Usa l'ADAS-Cog, che è il più comunemente usato, per valutare la memoria, il linguaggio, l'orientamento e la prassi attraverso una serie di attività, come descritto di seguito.
- Richiamo delle parole: Presenta al paziente un elenco di parole e chiedi di richiamarle immediatamente e dopo un certo ritardo.
- Dare un nome agli oggetti e alle dita: mostrare al paziente una serie di oggetti e chiedere di nominarli correttamente.
- Comandi seguenti: Chiedi al paziente di eseguire azioni specifiche basate su istruzioni verbali per valutare la comprensione e la prassi.
- Costruzione visuo: Compito del paziente di copiare figure geometriche per valutare le abilità visuospaziali.
- Prassi ideativa: chiedere al paziente di dimostrare l'uso di oggetti comuni (ad esempio, una matita o un pettine).
- Orientamento: interroga il paziente sulla data corrente, il giorno della settimana e il luogo.
- Riconoscimento delle parole: chiedere al paziente di riconoscere le parole presentate in precedenza da un elenco di parole distraenti.
- Abilità linguistiche: Valutare la fluidità e la comprensione del paziente attraverso conversazioni strutturate e la costruzione di frasi.
- Usa la sottoscala non cognitiva per valutare i sintomi comportamentali come cambiamenti di umore, apatia o agitazione.
- Per coerenza, chiedere al medico che somministra il test di attenersi rigorosamente alle istruzioni descritte nel manuale ADAS. Assegna un punteggio a ogni attività in base alle prestazioni, con punteggi più alti che indicano una maggiore compromissione.
- Dopo l'ultima sessione di stimolazione, ripetere l'ADAS utilizzando una versione parallela del test per assicurarsi che i risultati riflettano cambiamenti reali nella funzione cognitiva piuttosto che gli effetti della pratica.
3. Preparazione del dispositivo e dell'ambiente
- Accendi il dispositivo. Individuare l'interruttore di alimentazione principale sul retro del dispositivo e accenderlo.
- Premere il pulsante di standby sul pannello frontale. L'inizializzazione del dispositivo impiegherà circa 5 minuti.
- Posizionare il paziente. Assicurarsi che il paziente sia comodamente seduto, con un possibile supporto per il collo. Far indossare al paziente occhiali di riconoscimento con lenti di rilevamento. Fissare gli occhiali alla testa del paziente utilizzando del nastro adesivo o una cinghia per tenerli in posizione.
- Configura la fotocamera. Allineare la telecamera per assicurarsi che la testa del paziente sia completamente visibile all'interno dell'inquadratura. Questa fotocamera è fondamentale per il tracciamento e la calibrazione.
4. Test ad alta tensione (manutenzione giornaliera)
- Eseguire il test ad alta tensione (HV-Test). Eseguire questo test una volta ogni 24 ore. Seguire le istruzioni sullo schermo per completare il test premendo il pulsante di attivazione sull'applicatore portatile.
5. Preparazione del manipolo
- Preparare il manipolo applicando una goccia di olio siliconico sulla membrana del manipolo.
- Fissare la membrana di accoppiamento preriempita (il distanziatore) al manipolo, assicurandosi che sia sicura per prestazioni ottimali.
6. Calibrazione per nuovi pazienti
- Caricare i dati della risonanza magnetica del paziente. Per i nuovi pazienti, assicurarsi che siano disponibili le scansioni MRI richieste (immagini ad alta risoluzione pesate in T1 della testa dalla fronte alla schiena, che coprono da un orecchio all'altro).
- Inserire il dispositivo di archiviazione esterno (USB o CD) contenente i dati della risonanza magnetica nella porta USB del sistema.
- Crea un profilo del paziente. Selezionare Nuovo paziente nel sistema e inserire le informazioni richieste. Quando si crea un nuovo profilo paziente nel sistema, alcune informazioni vengono importate automaticamente dal CD MRI, mentre altri dettagli devono essere inseriti manualmente.
- Dopo aver inserito il CD nel sistema, il nome completo e la data di nascita del paziente vengono recuperati automaticamente dai metadati sul CD della risonanza magnetica. Inserire manualmente il piano di trattamento nel sistema. Selezionare il protocollo preconfigurato per la malattia di Alzheimer (AD), già memorizzato nel sistema. Questo protocollo include le seguenti impostazioni: una frequenza di 4 Hz, un livello di energia di 0,2 mJ/mm2 e 6.000 impulsi per sessione. Il protocollo può essere utilizzato così com'è o regolato in base alle preferenze del medico.
- Caricare i dati della risonanza magnetica e verificare la qualità delle immagini. Per verificare la qualità dei dati della risonanza magnetica, scorrere manualmente le singole sezioni delle immagini della risonanza magnetica all'interno del sistema. Assicurarsi che tutte le strutture anatomiche siano nitide e ben definite e verificare l'assenza di artefatti di movimento o distorsioni. Verificare che la risoluzione complessiva delle immagini pesate in T1 sia sufficiente per una neuronavigazione accurata. Regolare le selezioni delle immagini secondo necessità e procedere con la calibrazione.
- Per calibrare le immagini, utilizzare la penna di calibrazione per eseguire una calibrazione a 3 punti utilizzando i seguenti percorsi.
Percorso 1: Dalla fronte alla parte posteriore della testa.
Percorso 2: Da un orecchio all'altro.
Percorso 3: Esegui movimenti circolari o a zigzag sulla parte superiore della testa. - Assicurarsi che le lenti di rilevamento siano sempre rivolte verso la fotocamera durante la calibrazione.
- Verificare che il modello 3D della testa sullo schermo si allinei correttamente con la testa del paziente ruotandolo per controllare i punti di contatto.
7. Impostazione della regione di trattamento (opzionale)
- Definisci le regioni di trattamento in base alle esigenze specifiche del paziente. Per questo studio, è stato utilizzato il protocollo preconfigurato per la malattia di Alzheimer, che include il lobo frontale bilaterale, il lobo parietale bilaterale e il precuneo. Inoltre, al protocollo iniziale, aggiungere la corteccia temporale bilaterale. Utilizzare le immagini della risonanza magnetica e specifici punti di riferimento anatomici del cervello per definire le regioni da stimolare.
- Regolare le dimensioni, la forma e il numero di regioni di trattamento sul display. Per regolare il ROI, il processo viene eseguito interamente utilizzando i controlli del display touch.
- Inizia accedendo al modulo Pianificazione del trattamento sull'interfaccia principale del sistema. All'interno di questo modulo, selezionare l'opzione Regolazione ROI per abilitare la modifica delle regioni di trattamento. Una volta in modalità di regolazione, il sistema visualizza un ROI predefinito sullo schermo.
- Per posizionare la ROI sull'area anatomica desiderata, come il lobo frontale, il lobo parietale, il precuneo o la corteccia temporale, utilizzare i pulsanti freccia sul display touch. I pulsanti consentono di spostare il ROI in modo incrementale in tutte le direzioni (su, giù, sinistra, destra) per un allineamento preciso con la regione cerebrale target.
- Dopo aver posizionato il ROI, regolane le dimensioni (dimensione, profondità e forma) utilizzando i controlli dedicati sullo schermo:
Regolazione della profondità (pulsante A): tocca il pulsante della profondità e regola il livello di penetrazione del ROI in base ai requisiti del trattamento.
Regolazione della larghezza (pulsante B): utilizzare il pulsante di regolazione della larghezza per espandere o contrarre la dimensione orizzontale del ROI.
Regolazione dell'altezza (pulsante C): Modifica la dimensione verticale della ROI toccando il controllo di regolazione dell'altezza. Salva le impostazioni una volta completate.
8. Svolgimento del trattamento
- Applicare in sequenza una generosa quantità di gel per ultrasuoni sul cuoio capelluto del paziente per una trasmissione ottimale dell'energia.
- Inizia il trattamento. Selezionare la modalità di trattamento sul dispositivo e verificare che la membrana preriempita sia fissata correttamente. Il corretto fissaggio della membrana preriempita viene verificato assicurandosi che scatti correttamente in posizione sul manipolo. Opzionale: il paziente può utilizzare una protezione dell'udito durante la sessione.
- Tenere il manipolo perpendicolare al cuoio capelluto del paziente, assicurandosi che si muova uniformemente sulla superficie. La Figura 2 illustra l'allineamento ideale tra il paziente e il NEUROLITE durante la TPS. La Figura 3 mostra un esempio delle regioni di interesse (ROI) e la modellazione del tessuto stimolato alla risonanza magnetica di un paziente. La Figura 4 mostra un'illustrazione del dispositivo portatile durante la stimolazione.
- Monitorare la stimolazione. Trattare ogni regione fino a quando le aree mirate sul display diventano verdi, indicando una copertura adeguata. Continuare a muovere il manipolo mantenendo le lenti di rilevamento in vista della telecamera per garantire un tracciamento continuo.
NOTA: Se gli occhiali di riconoscimento si spostano leggermente durante il trattamento, la sessione può procedere. Tuttavia, se gli occhiali vengono rimossi, è necessaria una ricalibrazione. - Concludi la sessione. Per terminare il trattamento, premere il pulsante Stop sul dispositivo. Il punto finale della sessione viene raggiunto al raggiungimento di 6000 impulsi.
9. Procedure post-trattamento
- Pulire l'attrezzatura. Pulire il manipolo e la membrana staccabile utilizzando salviette approvate (evitare detergenti a base di alcol).
- Cura del paziente: Pulire delicatamente l'area del cuoio capelluto per rimuovere eventuali residui di gel per ultrasuoni. Se necessario, asciugare i capelli del paziente con un asciugamano o un asciugacapelli. Dopo il trattamento, consigliare ai pazienti di rimanere nelle vicinanze per i successivi 10-15 minuti nel caso in cui si verifichino effetti collaterali ritardati o lievi, come vertigini, mal di testa o fastidio al cuoio capelluto, sebbene non sia richiesta alcuna osservazione attiva. Incoraggia i pazienti a rimanere idratati, in quanto ciò supporta il recupero e il benessere generale. Consigliare al paziente di evitare un'attività fisica intensa per il resto della giornata, in particolare se si sente affaticato o avverte un lieve disagio dopo la sessione.
- Memorizzazione dei dati di trattamento: salva tutti i dati di trattamento, comprese le regioni definite, e regolali per le sessioni future. Eventuali osservazioni durante il trattamento o feedback devono essere documentati.
Risultati
La stimolazione transcranica del polso ha alleviato i sintomi dei pazienti di Alzheimer, come dimostrato dai dati pilota non controllati di 11 pazienti (nove uomini, due donne, fascia d'età 59-77 anni, M = 69,82) pubblicati dal gruppo di lavoro di questo tutorial1. Le aree stimolate includevano la corteccia frontale bilaterale, la corteccia parietale laterale bilaterale e la corteccia precuneica estesa. La corteccia temporale bilaterale è stata aggiunta al protocollo. Il trattamento è stato somministrato in sei sessioni iniziali con 6.000 impulsi nell'arco di 2 settimane come primo ciclo di trattamento.
Il protocollo di trattamento durante la stimolazione prevedeva 4 Hz, 0,20 mJ/mm2 e 6000 impulsi. Tre pazienti su 11 (27%) hanno riportato eventi avversi in tre delle 75 sessioni totali (4%). Questi includevano dolore alla mascella (NRS 4/10), nausea (NRS 7/10) e sonnolenza (NRS 10/10). Tuttavia, nessuno di questi è durato più di 24 ore e non tutti possono essere direttamente attribuiti alla stimolazione come eventi avversi del dispositivo (ADE).
Una differenza significativa è stata osservata nel punteggio totale ADAS post-stimolazione rispetto al basale, con un miglioramento da 30,2 a 25,8 (p = 0,01), e nel punteggio ADAS-Cog, che è migliorato da 25,8 a 23,3 (p = 0,04; Figura 5). Mentre alcuni pazienti hanno mostrato solo miglioramenti minori, il miglior miglioramento in un paziente è stato del 40%, portando a un miglioramento complessivo del 15,76% nel punteggio totale ADAS e dell'8,65% nel punteggio ADAS Cog (Figura 6). Inoltre, una differenza significativa nei sintomi depressivi è stata rilevata in una sottoscala auto-riferita del test ADAS. Un t-test a una coda ha mostrato una significativa riduzione dei sintomi depressivi, misurata da una sottoscala auto-riferita del test ADAS. Prima della stimolazione, la media era 0,7 (SD = 1,1) e dopo la stimolazione è diminuita a 0,2 (SD = 0,4; t (8) = 1,859, p < 0,01).
Una scala di valutazione soggettiva è stata completata prima e dopo il periodo di trattamento di due settimane. Questa scala consente ai pazienti di segnalare la gravità dei sintomi e qualsiasi evento avverso percepito su una scala di valutazione numerica da 0 a 10, con numeri più alti che indicano una maggiore intensità dei sintomi. Il miglioramento soggettivo medio della gravità dei sintomi, misurato dalla NRS, è stato compreso tra 5,7 e 3,4 (p = 0,023).
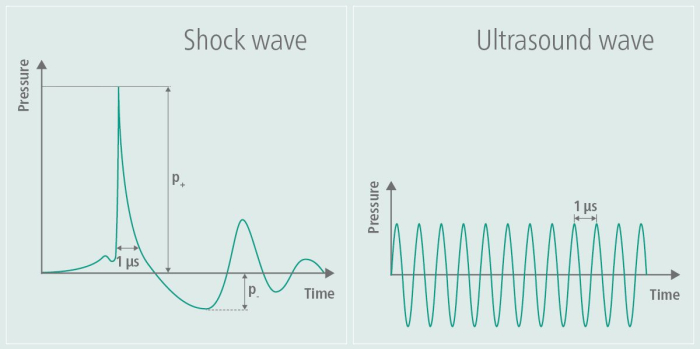
Figura 1: Onda d'urto durante la stimolazione. Il grafico illustra l'ampiezza di un TPS sul lato sinistro dell'immagine e la confronta con l'ampiezza di un'ecografia sul lato destro dell'immagine. Durante la TPS, viene generato un singolo impulso di pressione, seguito da un successivo appiattimento dell'ampiezza. Al contrario, l'ampiezza degli ultrasuoni non si appiattisce di nuovo, ma viene mantenuta, provocando continue oscillazioni ad alta frequenza nel tempo. Questa cifra è stata modificata da9. Clicca qui per visualizzare una versione più grande di questa figura.
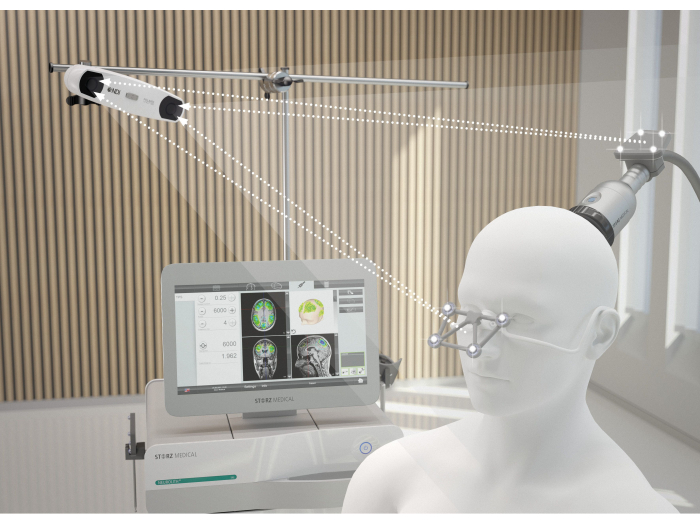
Figura 2: Sistema di navigazione MRI. L'immagine illustra l'allineamento ideale tra il paziente e il NEUROLITE durante la TPS. La telecamera 3D entra in contatto con le lenti di rilevamento della maschera e quelle del manipolo. Solo se questa trasmissione è garantita, il manipolo viene riconosciuto nella corretta posizione spaziale e la visualizzazione della stimolazione sullo schermo è indisturbata. Questa cifra è stata modificata da9. Clicca qui per visualizzare una versione più grande di questa figura.
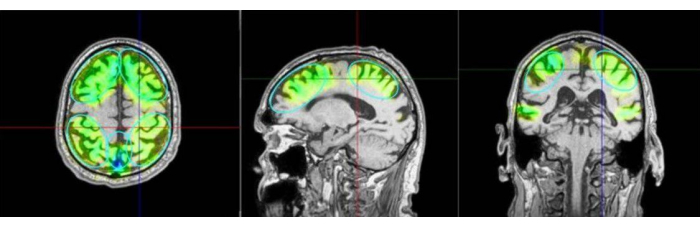
Figura 3: Regioni di interesse e aree stimolate. L'immagine mostra un esempio delle regioni di interesse (ROI) e la modellazione del tessuto stimolato alla risonanza magnetica di un paziente. I colori differenziano ulteriormente il numero di impulsi applicati nelle rispettive aree del precuneo, nonché nelle regioni frontali e parietali. La colorazione verde è seguita da turchese, blu e viola. Il viola indica un'intensità eccessiva e deve essere evitato. Le aree stimolate vengono visualizzate come dati simulati dal sistema di navigazione come aree principalmente raggiunte, ma questo non viene misurato come attivazione cerebrale applicata reale. Un'ulteriore stimolazione temporale viene aggiunta nel protocollo Kempen, sebbene non sia predefinita come ROI. A sinistra: vista assiale, al centro: vista sagittale, a destra: vista coronale. Clicca qui per visualizzare una versione più grande di questa figura.
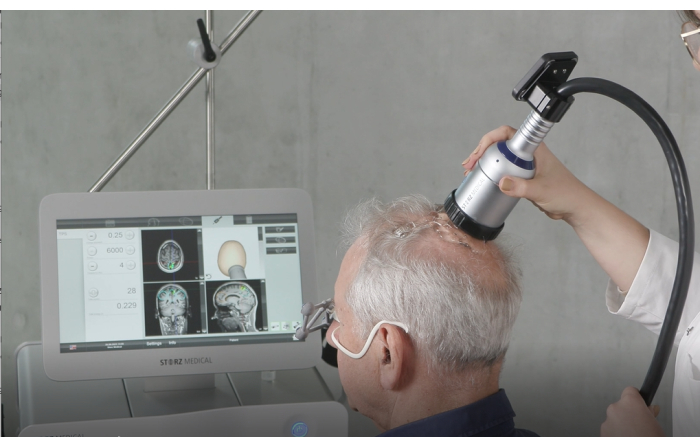
Figura 4: Dispositivo portatile. Questa figura illustra il dispositivo portatile in uso durante la stimolazione. Le fasi preparatorie critiche includono l'applicazione di una quantità sufficiente di gel per ultrasuoni sul cuoio capelluto del paziente per garantire una trasmissione ottimale dell'energia e la verifica che la membrana preriempita sia fissata in modo sicuro e corretto. Durante il trattamento, il manipolo viene tenuto perpendicolare al cuoio capelluto e spostato uniformemente sulla superficie per mantenere una stimolazione costante. Questa cifra è stata modificata da9. Clicca qui per visualizzare una versione più grande di questa figura.
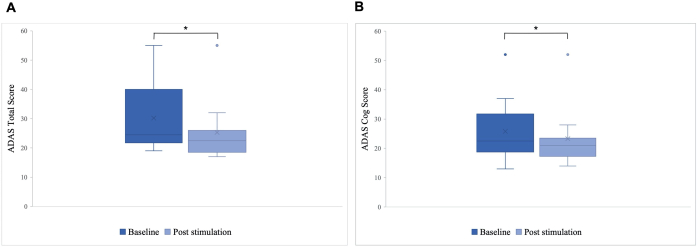
Figura 5: Scala di valutazione della malattia di Alzheimer (ADAS) prima della prima stimolazione. Media del punteggio del gruppo di pazienti sulla scala di valutazione della malattia di Alzheimer (ADAS) prima della prima stimolazione (blu scuro) e dopo l'ultima stimolazione (azzurro). Un punteggio più basso indica prestazioni migliori. Il box plot mostra la distribuzione dei dati dei pazienti. (A) Punteggio totale ADAS. La linea rappresenta la mediana del gruppo (basale = 24,5, post-stimolazione = 22,5) e la croce rappresenta i punteggi medi (M basale = 30,2 (SD 11,55), M post-stimolazione = 25,8 (SD 10,71), *p = 0,01). (B) Punteggio dell'ingranaggio ADAS. La linea rappresenta la mediana del gruppo (basale = 22,5, post-stimolazione = 21) e la croce rappresenta i punteggi medi (M basale = 25,8 (SD 10,77), M post-stimolazione = 23,3 (SD 10,27), *p = 0,04). Questa cifra è stata modificata da5. Clicca qui per visualizzare una versione più grande di questa figura.
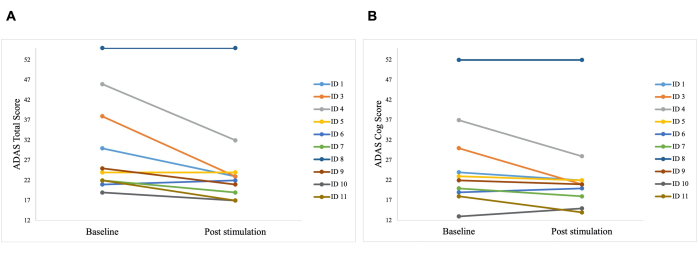
Figura 6: Risultati dei test individuali dei pazienti in ADAS. Risultati dei test individuali dei pazienti nella scala di valutazione della malattia di Alzheimer (ADAS) prima della prima stimolazione (basale) e dopo l'ultima stimolazione (post-stimolazione). Un punteggio più basso indica prestazioni migliori. Ogni riga rappresenta un paziente. (A) Punteggi individuali di ciascun paziente nel punteggio totale ADAS. Il miglior miglioramento è stato di 15 punti (ID 3). (B) Punteggi individuali di ciascun paziente nella sottoscala ADAS cog score. Il miglior miglioramento è stato di 14 punti (ID 3 e ID 4). Questa cifra è stata modificata da5. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Nel complesso, la TPS è un possibile trattamento per il morbo di Alzheimer. Da un punto di vista pratico, il processo di stimolazione è progettato per essere facile da usare per l'operatore. La possibilità di definire le regioni di interesse all'inizio della procedura, insieme alla visualizzazione del numero di impulsi applicati attraverso marcature codificate a colori durante il trattamento, semplifica notevolmente la gestione dell'interfaccia utente. Anche l'impostazione delle regioni di interesse può essere selezionata liberamente e regolata secondo necessità. Le aree stimolate sono chiaramente visualizzate come dati simulati, anche se è necessario un ulteriore sviluppo da parte del produttore per visualizzare le aree più profonde interessate dal dispositivo a livelli di energia inferiori.
I passaggi critici del protocollo TPS includono il posizionamento preciso del dispositivo di stimolazione sulle regioni cerebrali mirate, garantendo la corretta intensità e frequenza delle onde del polso e un attento monitoraggio delle risposte del paziente. La risoluzione dei problemi potrebbe includere la garanzia di un contatto ottimale tra il manipolo e il cuoio capelluto per prevenire la perdita di energia o una stimolazione non ottimale. Se si osservano disagio o effetti collaterali, potrebbe essere necessario regolare l'intensità o riposizionarsi.
Dati pubblicati non controllati hanno dimostrato miglioramenti cognitivi clinici 5,3, nonché un aumento dello spessore corticale in diverse aree cerebrali10 e cambiamenti nella connettività della rete RM11. Sono stati segnalati anche miglioramenti dell'umore 5,4. Rispetto ad altri metodi di stimolazione cerebrale non invasiva, la TPS offre diversi vantaggi distinti. In primo luogo, combina le onde d'urto meccaniche con una neuronavigazione precisa, consentendo un'applicazione mirata alle regioni cerebrali interessate. A differenza della TMS, che in genere stimola solo gli strati corticali superficiali, la profondità di penetrazione del TPS lo rende particolarmente adatto per il trattamento di malattie neurodegenerative come l'Alzheimer, dove sono coinvolte strutture cerebrali più profonde. Inoltre, la TPS sembra avere un profilo di sicurezza favorevole, con effetti collaterali minimi e transitori riportati solo nel 4% delle sessioni di trattamento, indicando che potrebbe essere un'opzione più tollerabile per i pazienti con AD5 da moderata a grave.
Per indagare a fondo i meccanismi d'azione e condurre un'analisi dettagliata dei potenziali fattori di rischio associati alla terapia TPS, sono necessari ulteriori studi di base.
In un recente studio pubblicato da questo gruppo di ricerca, l'attività della rete cerebrale nei pazienti di Alzheimer è stata esaminata prima e dopo la stimolazione transcranica dell'impulso (TPS)17. I risultati indicano che la TPS può modulare le oscillazioni cerebrali e la connettività, migliorando potenzialmente la funzione cognitiva nella malattia di Alzheimer. Uno dei meccanismi proposti è che l'aumento delle oscillazioni gamma post-TPS può facilitare la clearance glinfatica nel cervello. Questo possibile effetto sulla clearance glinfatica dovrebbe essere ulteriormente studiato in studi futuri. Inoltre, sono necessari ulteriori studi meccanicistici per chiarire come la TPS influenzi la fisiologia della rete cerebrale e se i suoi effetti neuroprotettivi possano rallentare o arrestare la progressione dell'Alzheimer.
Gli studi preclinici sugli animali che esplorano gli effetti della TPS su cervelli sani e malati sono fondamentali per ottenere una comprensione più profonda dei meccanismi sottostanti. È importante notare che varie tecniche NiBS operano attraverso meccanismi distinti1. Pertanto, è essenziale indagare se e come gli effetti descritti per l'ultrasuonoterapia18 e la terapia con onde d'urto6 sui tessuti giochino un ruolo nella terapia TPS. Il primo ha descritto la possibile influenza della TPS sui processi di meccanotrasduzione, nonché il suo potenziale di indurre cambiamenti vascolari, cellulari e molecolari, che devono essere studiati a fondo. Inoltre, la modulazione dei processi neuroinfiammatori, con particolare enfasi sulla dinamica della barriera emato-encefalica, presenta un'area intrigante per la ricerca futura. La comprensione di questi effetti potrebbe fornire preziose informazioni sui meccanismi sottostanti e aiutare a ottimizzare la TPS per le applicazioni terapeutiche. Inoltre, ciò contribuisce a esplorare la potenziale applicazione del trattamento TPS nella gestione di altre malattie neurodegenerative.
La TPS si mostra promettente come approccio terapeutico; Tuttavia, è necessario affrontare diverse limitazioni. Gli studi clinici controllati con gruppi placebo sono essenziali per delineare con precisione gli effetti specifici della TPS. Una sfida significativa è l'elevata variabilità interindividuale nella risposta alla stimolazione, che può essere influenzata da fattori come lo stadio della malattia di Alzheimer (AD) e la presenza di comorbidità4. Inoltre, il protocollo ottimale per il trattamento a lungo termine rimane indefinito. Gli approcci attuali includono sessioni mensili di richiamo singolo o la ripetizione di un ciclo di trattamento di 12 sessioni nell'arco di un anno, ma mancano prove a sostegno della superiorità di un approccio rispetto all'altro. La ricerca clinica futura dovrebbe dare priorità all'identificazione dei parametri di stimolazione ottimali, alla valutazione di come i fattori specifici del paziente (ad esempio, lo stadio di AD) influenzano i risultati terapeutici e allo studio degli effetti a lungo termine e della sostenibilità della terapia TPS.
Divulgazioni
L'autore Lars Wojtecki ha precedentemente ricevuto sovvenzioni e supporto istituzionale dalla Fondazione tedesca per la ricerca, Hilde-Ulrichs-Stiftung für Parkinsonforschung e ParkinsonFonds Germany, BMBF/ERA-NETNEURON, DFG Forschergruppe (FOR1328), Deutsche Parkinson Vereinigung (DPV), Forschungskommission, Medizinische Fakultät, HHU Düsseldorf, UCB; Medtronic, UCB, Teva, Allergan, Merz, Abbvie, Roche, Bial, Merck, Novartis, Desitin, Spectrum. L'autore Lars Wojtecki possedeva azioni della società BioNTech SE. L'autore Lars Wojtecki è consulente delle seguenti società: TEVA, UCB Schwarz, Desitin, Medtronic, Abbott/Abbvie, MEDA, Boehringer I, Storz Medical, Kyowa Kirin, Guidepoint, Merck, Merz, Synergia, BIAL, Zambon, Sapio Life, STADA, Inomed e Vertanical. L'autrice Celine Cont è consulente di Storz Medical. Gli altri autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che possa essere interpretata come un potenziale conflitto di interessi.
Riconoscimenti
Ringraziamo i pazienti per la loro conformità e partecipazione. L'assistenza tecnica e la raccolta dei dati sono state garantite con l'aiuto di Veronika Hirsch e Michaela Wessler (assistenti tecnico medico).
Materiali
| Name | Company | Catalog Number | Comments |
| Disinfectant Wipes: mikrozid universal wipes | schülke | GTIN: 4032651957774 | Used to clean the hand piece after each session to ensure hygiene |
| Dry Towels: Wisch-/Pflegetuch Kolibri | IGEFA Handelsgesellschaft mbH & Co. KG | PZN: 10417600 | Used to dry the patient's skin after the ultrasound gel has been cleaned |
| Handpiece | Storz Medical | HW 030816.01 (114) | Used to hold the device during treatment |
| NEUROLITH | Storz Medical | SN: 19880_0015 | The NEUROLITH system with TPS is a CE-certified device |
| Patient Chair | Adjustable chair for optimal patient positioning during the treatment | ||
| silicone oil | Storz Medical | 13330 | Applied onto the membrane of the handpiece before attaching the prefilled coupling membrane (the distance piece) to the handpiece |
| Sonosid Ultrasound Gel | Asid Bonz GmbH | PZN: 5362311 | Applied to the scalp to ensure optimal transmission of acoustic pulses through the skull |
| Wash Gloves: Esemtan wash mitts | schülke | GTIN: 4032651297016 | For removing the ultrasound gel from the patient post-treatment |
Riferimenti
- Koch, G., et al. The emerging field of non-invasive brain stimulation in Alzheimer's disease. Brain. Epub ahead of print. , (2024).
- Menardi, A., et al. Toward noninvasive brain stimulation 2.0 in Alzheimer's disease. Ageing Res Rev. 75, 101555 (2022).
- Beisteiner, R., et al. Transcranial pulse stimulation with ultrasound in Alzheimer's disease-a new navigated focal brain therapy. Adv Sci. 7 (3), 1902583 (2019).
- Matt, E., Dörl, G., Beisteiner, R. Transcranial pulse stimulation (TPS) improves depression in AD patients on state-of-the-art treatment. Alzheimer's Dement. 8 (1), e12245 (2022).
- Cont, C., et al. Retrospective real-world pilot data on transcranial pulse stimulation in mild to severe Alzheimer's patients. Front Neurol. 13, 948204 (2022).
- Guo, J., Hai, H., Ma, Y. Application of extracorporeal shock wave therapy in nervous system diseases: A review. Front Neurol. 13, 963849 (2022).
- Khanna, A., Nelmes, R. T., Gougoulias, N., Maffulli, N., Gray, J. The effects of LIPUS on soft-tissue healing: a review of literature. Br Med Bull. 89, 169-182 (2009).
- Chen, X., You, J., Ma, H., Zhou, M., Huang, C. Transcranial pulse stimulation in Alzheimer's disease. CNS Neurosci Ther. 30 (2), e14372 (2024).
- . Website of Manufacturer Available from: https://www.storzmedical.com/en/physics-and-technology (2025)
- Popescu, T., Pernet, C., Beisteiner, R. Transcranial ultrasound pulse stimulation reduces cortical atrophy in Alzheimer's patients: a follow-up study. Alzheimer's Dement. 7 (1), e12121 (2021).
- Dörl, G., Matt, E., Beisteiner, R. Functional specificity of TPS brain stimulation effects in patients with Alzheimer's disease: A follow-up fMRI analysis. Neurol Ther. 11 (3), 1391-1398 (2022).
- d'Agostino, M. C., Craig, K., Tibalt, E., Respizzi, S. Shock wave as biological therapeutic tool: From mechanical stimulation to recovery and healing, through mechanotransduction. Int J Surg. 24, 147-153 (2015).
- Yahata, K., et al. Low-energy extracorporeal shock wave therapy for promotion of vascular endothelial growth factor expression and angiogenesis and improvement of locomotor and sensory functions after spinal cord injury. J Neurosurg. 25 (6), 745-755 (2016).
- Hatanaka, K., et al. Molecular mechanisms of the angiogenic effects of low-energy shock wave therapy: roles of mechanotransduction. Am J Physiol. 311 (3), C378-C385 (2016).
- Mariotto, S., et al. Extracorporeal shock waves: from lithotripsy to anti-inflammatory action by NO production. Nitric oxide. 12 (2), 89-96 (2005).
- Flournoy, J., Ashkanani, S., Chen, Y. Mechanical regulation of signal transduction in angiogenesis. Front Cell Dev Biol. 10, 933474 (2022).
- Wojtecki, L., Cont, C., Stute, N., Galli, A., Schulte, C., Trenado, C. Electrical brain networks before and after transcranial pulsed shockwave stimulation in Alzheimer's patients. Geroscience. Epub ahead of print. , (2024).
- Sarica, C., et al. Human studies of transcranial ultrasound neuromodulation: A systematic review of effectiveness and safety. Brain Stimul. 15 (3), 737-746 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon