Method Article
גירוי דופק טרנס-גולגולתי לחולי אלצהיימר
In This Article
Summary
מאמר זה מתאר את ההליך של גירוי דופק טרנס-גולגולתי בחולים עם מחלת אלצהיימר. הוא דן בפירוט באינדיקציות, במתודולוגיה ובסיכויים העתידיים.
Abstract
גירוי דופק טרנס-גולגולתי (TPS) הוא טיפול נוירומודולציה לא פולשני עם סימון Conformité Européenne (CE) לטיפול במחלת אלצהיימר (AD). מחקרי פיילוט ראשוניים הראו השפעות מבטיחות על התפקוד הקוגניטיבי. מאמר זה מתמקד בהליך הטיפול בחולים עם אלצהיימר באמצעות מכשיר TPS מונחה MRI ומנווט נוירולוגי. הפרוטוקול שיש לעקוב אחריו מתואר בפירוט, כולל הנהלים הדרושים והגדרות המכשיר. כמו כן ניתנת סקירה קצרה של התוצאות הקליניות המייצגות שפורסמו עד כה. בנוסף לשיפורים קליניים משמעותיים בקוגניציה ובהשפעה, מוצגים תופעות לוואי (AE) ותופעות לוואי אפשריות (ADE) כדי לספק נתוני בטיחות. לבסוף, השיטה נדונה באופן ביקורתי. בעתיד, יש לערוך ניסויים אקראיים ומבוקרים כדי לשלול כל השפעות פלצבו. יש גם מחסור במחקרים ארוכי טווח עם מספר גדול יותר של חולים. למרות השאלות הלא פתורות הללו, ל-TPS יש פוטנציאל כטיפול משלים לחולי אלצהיימר כאשר משתמשים בו בסביבה מבוקרת ומונחית מדעית.
Introduction
טכניקות גירוי מוחי לא פולשני (NiBS) הפכו למוקד עניין גובר בחקר דמנציה, ומציעות אסטרטגיות טיפוליות פוטנציאליות להפחתת ליקויים קוגניטיביים ותפקודיים הקשורים למחלות ניווניות. עדויות מצטברות מצביעות על כך ש-NiBS יכול לשפר את התפקוד הקוגניטיבי או להאט את הירידה הקוגניטיבית אצל אנשים עם מחלת אלצהיימר (AD) בשלבים שונים של המחלה 1,2. בין הטכניקות הללו, גירוי דופק טרנס-גולגולתי (TPS) בולט במיוחד ביכולתו לספק גירוי מוחי ממוקד מאוד וממוקד במדויק, לא רק על פני השטח של קליפת המוח אלא גם באזורים עמוקים יותר במוח 3,4. תופעות הלוואי הקשורות ל-TPS הן נדירות, בינוניות בחומרתן וחולפות 3,5.
פותח בתחילה בתחומי האורתופדיה והקרדיולוגיה, טיפול באולטרסאונד טיפולי וטיפול בגלי הלם חוץ-גופיים (ESWT) הוכח כמקדם ריפוי רקמות ומשפר את זרימת הדם. באורתופדיה, ESWT יושם במיוחד לטיפול במצבי שרירים ושלד כגון גידים ובעיות ריפוי עצם, בעוד בקרדיולוגיה, הוא נחקר על השפעותיו על בריאות כלי הדם 6,7. TPS הותאם ליישומים נוירולוגיים, במיוחד במחקר אלצהיימר, והראה הבטחה בטיפול בירידה קוגניטיבית וליקויים תפקודיים 8,3,4. טכניקה זו משתמשת בגלי הלם כדי להקל על הסימפטומים של חולי אלצהיימר, כפי שהודגם על ידי נתוני פיילוט מקבוצת העבודה של מדריך זה5. גלי הלם נבדלים מגלי אולטרסאונד בכך שהם אינם כרוכים בעומס מתחלף בתדר גבוה9. פרופיל גלי ההלם שנוצר, כפי שמוצג באיור 1, ממחיש בבירור את דופק הלחץ היחיד ואת ההשטחה שלאחר מכן של המשרעת במהלך TPS, יחד עם משרעת התדר הגבוה יותר האופיינית לאולטרסאונד. בשל הלחץ המתחלף בתדר גבוה, האנרגיה של גלי האולטרסאונד נספגת ברקמה, מה שעלול להוביל להתחממות רקמות - השפעה שלא נצפתה בגלי הלם. ביישומים אחרים משתמשים בגלי הלם בעלי אנרגיה גבוהה, ואילו ב-TPS, האנרגיה המוחדרת לרקמה היא אנרגיה נמוכה9. ההשפעות הפוטנציאליות על מחלת האלצהיימר דווחו לראשונה כשיפורים בקונסורציום להקמת רישום למחלת אלצהיימר (CERAD)3, כמו גם עלייה בעובי קליפת המוח במספר אזורים10 ושינויים בקישוריות רשת MR11.
מנגנוני הפעולה של TPS נמצאים כעת במחקר, כאשר המחקר מתמקד באופן שבו טכניקה לא פולשנית זו מווסתת את פעילות המוח ברמה התאית, מה שעלול לעורר תהליכי טרנסדוקציה מכנית שיכולים לשפר את הנוירופלסטיות ולשפר את התפקוד הקוגניטיבי 3,4. בטיפול בגלי הלם, האנרגיה הפיזית פועלת על אזור הרקמה המקומית וגורמת לטרנסדוקציה מכנית12, וממריצה את שחרור גורמי הגדילה 13,14 ותחמוצת החנקן15. השפעות אלה, בתורן, יכולות לשפר את זרימת הדם ולקדם ניאואנגיוגנזה16.
מטרת TPS היא לספק טיפול משלים בטוח ויכול להוביל לשיפור הסימפטומים. אזורים מגורים יכולים לכלול את קליפת המוח הקדמית הדו-צדדית, קליפת המוח הקודקודית הצדדית הדו-צדדית, קליפת המוח הקדם-רקונאוס המורחבת וקליפת המוח הטמפורלית הדו-צדדית. פרוטוקול הטיפול הרגיל מורכב משישה מפגשים עם 6,000 פולסים במשך שבועיים כמחזור הטיפול הראשון.
ההליך נחשב לבטוח, שכן תופעות לוואי דווחו בכ-4% מהמפגשים המאופיינים בחומרה סובייקטיבית בינונית שהיא חולפת וללא קשר סיבתי ברור לאירועים שליליים הקשורים למכשיר (ADEs)5.
בעוד שהתוצאות הראשוניות הללו מעודדות, חיוני לחוקרים ולקלינאים להעריך אם TPS מתאים ליישומים הספציפיים שלהם. הגורמים שיש לקחת בחשבון כוללים את שלב מחלת האלצהיימר, תגובת המטופל לטיפולים אחרים וזמינותם של מתקנים שיכולים לנהל TPS בבטחה בהנחיית מומחים. עבור אנשים בשלבים המוקדמים עד המתונים של אלצהיימר, TPS עשוי להציע יתרונות קוגניטיביים פוטנציאליים עם תופעות לוואי מינימליות, אך הוא עדיין לא נחשב לטיפול עצמאי. במקום זאת, הוא עשוי להשלים טיפולים קיימים כגון התערבויות תרופתיות או אימון קוגניטיבי. תוצאות של ניסויים אקראיים ומבוקרים חסרות עד כה. עם זאת, ל-TPS עשוי להיות פוטנציאל כטיפול משלים לחולי אלצהיימר בשימוש מבוקר ומחקר מדעי.
Protocol
הניתוח של כל החולים שטופלו ב-TPS היה חלק מהרישום המקומי שאושר על ידי ועדת האתיקה של הלשכה הרפואית האזורית (Ärztekammer Nordrhein, Nr. 2021026). יתרה מכך, כל המטופלים חתמו על הסכמה בכתב לטיפול. בסך הכל טופלו 11 חולים ב-TPS (תשעה גברים, שתי נשים, טווח גילאים 59-77 שנים, M = 69.82). לפני הטיפול, כל המטופלים עברו תהליך הסכמה מדעת מפורט, במהלכו הם קיבלו מידע יסודי על היתרונות והסיכונים הפוטנציאליים של גירוי דופק טרנס-גולגולתי (TPS) עם מערכת NEUROLITH.
1. בחירת המטופל והכנתו
- לפני תחילת גירוי זה, בחירת המטופל והסכמה מדעת הם קריטיים. השתמש בסימן CE למחלת אלצהיימר. אשר אבחנה באמצעות סמנים ביולוגיים של CSF על בסיס תסמונת קלינית של אלצהיימר. לבצע טיפול במחלה על פי הנחיות לאומיות או בינלאומיות על ידי נוירולוג או פסיכיאטר.
הערה: ניתן להציע TPS כתוסף במסגרת חקירה מדעית. מכיוון ש-TPS ניתן כטיפול משלים, כל המטופלים המשיכו בתוכניות הטיפול הרפואי הרגילות שלהם לאורך כל הטיפול. חלק מהמטופלים נטלו תרופות נוגדות דמנציה ו/או תרופות אנטי פסיכוטיות במהלך מפגשי ה-TPS; עם זאת, תרופות אלו לא היו חלק מפרוטוקול המחקר ולא שונו או תוקננו כחלק מההתערבות. - השתמש בקריטריוני ההחרגה הבאים עבור TPS: הטיפול אינו מותנה בפתולוגיות תוך מוחיות רלוונטיות שאינן קשורות למחלת אלצהיימר, כולל אנצפלופתיה של כלי הדם, פקקת באזור הטיפול, Fazekas דרגה 3, גידולים, מומים בכלי הדם, שתלי מתכת ואנגיופתיה עמילואידית מוחית (CAA) כמוגדר בקריטריונים של בוסטון. התוויות נגד נוספות הן היסטוריה של טיפול מתמשך בנוגדנים, הפרעות בקרישת הדם או נוגדי קרישה דרך הפה, טיפול בקורטיקוסטרואידים תוך שישה שבועות לפני היישום הראשון, אפילפסיה (או התקפים מרובים או התקף בודד עם מיקוד התקף), קוצבי לב שאינם מאושרים לטיפול ב-TPS, סינקופה חוזרת, הפרעות התנהגות רגשיות חמורות המשפיעות על חיי היומיום כגון תוקפנות או פסיכוזה, הריון ומצבים רפואיים שעלולים להוביל לאי עמידה בפרוטוקול. ביחס לקריטריונים לאבחון ואי הכללה, כולל ניתוח MRI, EEG, CSF, בדיקות מעבדה והערכות קוגניטיביות ורגשיות מפורטות בעבודה.
2. בדיקות נוירופסיכולוגיות
- בצע בדיקות נוירופסיכולוגיות לפני הגירוי הראשון (קו הבסיס) ואחרי הגירוי האחרון (לאחר הגירוי). סולם הערכת מחלת אלצהיימר (ADAS) שימש למחקר זה.
- לפני שתתחיל ב-ADAS, הכן את סביבת הבדיקה כדי להבטיח שהיא שקטה, נוחה וללא הסחות דעת. בצע את ההערכה עם קלינאי או נוירופסיכולוג מיומן, העוקב אחר פורמט מובנה להערכת תחומים קוגנטיביים ספציפיים.
- ה-ADAS מורכב משני מרכיבים עיקריים: תת-הסולם הקוגניטיבי (ADAS-Cog) ותת-הסולם הלא קוגניטיבי. השתמש ב-ADAS-Cog, הנפוץ ביותר, כדי להעריך זיכרון, שפה, התמצאות ופרקטיקה באמצעות סדרה של משימות, כמתואר להלן.
- זכירת מילים: הציגו למטופל רשימת מילים ובקשו להיזכר בהן מיד ולאחר עיכוב.
- מתן שמות לחפצים ואצבעות: הראו למטופל סדרה של חפצים ובקשו לתת להם שם נכון.
- ביצוע פקודות: בקש מהמטופל לבצע פעולות ספציפיות על סמך הוראות מילוליות כדי להעריך את ההבנה והפרקסיס.
- בנייה חזותית: הטיל על המטופל העתקת דמויות גיאומטריות כדי להעריך מיומנויות חזותיות-מרחביות.
- פרקסיס רעיוני: בקש מהמטופל להדגים את השימוש בחפצים נפוצים (למשל, עיפרון או מסרק).
- התמצאות: שאל את המטופל לגבי התאריך, היום בשבוע והמיקום הנוכחיים.
- זיהוי מילים: בקש מהמטופל לזהות מילים שהוצגו בעבר מתוך רשימה של מילים מסיחות דעת.
- יכולת שפה: הערכת שטף והבנה של המטופל באמצעות שיחות מובנות ובניית משפטים.
- השתמש בתת-הסולם הלא קוגניטיבי כדי להעריך תסמינים התנהגותיים כגון שינויים במצב הרוח, אדישות או עצבנות.
- לעקביות, בקש מהקלינאי המנהל את הבדיקה להקפיד על ההוראות המפורטות במדריך ADAS. ציין כל משימה על סמך ביצועים, כאשר ציונים גבוהים יותר מצביעים על ליקוי גדול יותר.
- לאחר מפגש הגירוי האחרון, חזור על ה-ADAS באמצעות גרסה מקבילה של המבחן כדי להבטיח שהתוצאות משקפות שינויים אמיתיים בתפקוד הקוגניטיבי ולא השפעות תרגול.
3. הכנת המכשיר והסביבה
- הפעל את המכשיר. אתר את מתג ההפעלה הראשי בגב המכשיר והפעל אותו.
- לחץ על לחצן ההמתנה בלוח הקדמי. אתחול המכשיר ייקח כ-5 דקות.
- מקם את המטופל. ודא שהמטופל יושב בנוחות, עם תמיכה אפשרית בצוואר. בקש מהמטופל להרכיב משקפי זיהוי עם עדשות זיהוי. הצמידו את המשקפיים לראש המטופל באמצעות סרט או רצועה כדי לשמור אותם במקומם.
- הגדר את המצלמה. יישר את המצלמה כדי להבטיח שראשו של המטופל גלוי במלואו בתוך המסגרת. מצלמה זו קריטית למעקב וכיול.
4. בדיקת מתח גבוה (תחזוקה יומית)
- בצע את בדיקת המתח הגבוה (HV-Test). בצע בדיקה זו אחת ל-24 שעות. עקוב אחר ההוראות שעל המסך כדי להשלים את הבדיקה על ידי לחיצה על לחצן ההדק באפליקטור כף היד.
5. הכנת ידית
- הכן את הידית על ידי מריחת טיפת שמן סיליקון על קרום הידית.
- חבר את קרום הצימוד הממולא מראש (חתיכת המרחק) לחתיכת היד, וודא שהוא מאובטח לביצועים מיטביים.
6. כיול לחולים חדשים
- טען את נתוני ה-MRI של המטופל. עבור מטופלים חדשים, ודא שסריקות ה-MRI הנדרשות (תמונות משוקללות T1, ברזולוציה גבוהה של הראש מהמצח לגב, המכסות מאוזן לאוזן) זמינות.
- הכנס את התקן האחסון החיצוני (USB או CD) המכיל את נתוני ה-MRI ליציאת ה-USB של המערכת.
- צור פרופיל מטופל. בחר מטופל חדש במערכת והזן את המידע הנדרש. בעת יצירת פרופיל מטופל חדש במערכת, חלק מהמידע מיובא אוטומטית מה-MRI-CD, בעוד שפרטים אחרים צריכים להיות מוזנים באופן ידני.
- לאחר הכנסת התקליטור למערכת, שמו המלא ותאריך הלידה של המטופל נשלפים אוטומטית מהמטא-נתונים בתקליטור ה-MRI. הזנה ידנית של תוכנית הטיפול למערכת. בחר את הפרוטוקול המוגדר מראש למחלת אלצהיימר (AD), שכבר מאוחסן במערכת. פרוטוקול זה כולל את ההגדרות הבאות: תדר של 4 הרץ, רמת אנרגיה של 0.2 mJ/mm2 ו-6,000 פולסים לכל הפעלה. ניתן להשתמש בפרוטוקול כפי שהוא או להתאים אותו בהתאם להעדפות הקלינאי.
- טען את נתוני ה-MRI ואמת את איכות התמונות. כדי לאמת את איכות נתוני ה-MRI, גלול ידנית בין הפרוסות הבודדות של תמונות ה-MRI בתוך המערכת. ודא שכל המבנים האנטומיים חדים ומוגדרים היטב ובדוק אם אין חפצי תנועה או עיוותים. ודא שהרזולוציה הכוללת של התמונות המשוקללות T1 מספיקה לניווט עצבי מדויק. התאם את בחירות התמונה לפי הצורך והמשך בכיול.
- כדי לכייל את התמונות, השתמש בעט הכיול כדי לבצע כיול של 3 נקודות באמצעות הנתיבים הבאים.
נתיב 1: מהמצח לחלק האחורי של הראש.
נתיב 2: מאוזן אחת לשנייה.
נתיב 3: בצע תנועות מעגליות או זיגזג על פני החלק העליון של הראש. - ודא שעדשות הזיהוי פונות למצלמה בכל עת במהלך הכיול.
- ודא שדגם הראש התלת-ממדי על המסך מיושר כראוי עם ראש המטופל על ידי סיבובו כדי לבדוק נקודות מגע.
7. הגדרת אזור טיפול (אופציונלי)
- הגדירו אזורי טיפול בהתאם לצרכים הספציפיים של המטופל. במחקר זה, נעשה שימוש בפרוטוקול מחלת האלצהיימר שהוגדר מראש, כולל האונה הקדמית הדו-צדדית, האונה הקודקודית הדו-צדדית ו-precuneus. בנוסף, לפרוטוקול הראשוני, הוסף קליפת המוח הרקתית הדו-צדדית. השתמש בתמונות MRI ובנקודות ציון אנטומיות ספציפיות של המוח כדי להגדיר את האזורים שיש לעורר.
- התאם את הגודל, הצורה ומספר אזורי הטיפול בתצוגה. כדי להתאים את ההחזר על ההשקעה, התהליך מתבצע כולו באמצעות פקדי תצוגת המגע.
- התחל בגישה למודול תכנון הטיפול בממשק הראשי של המערכת. בתוך מודול זה, בחר באפשרות התאמת החזר ROI כדי לאפשר עריכה של אזורי טיפול. ברגע שהמערכת נמצאת במצב התאמה, המערכת מציגה החזר ברירת מחדל על המסך.
- כדי למקם את ההחזר על ההשקעה מעל האזור האנטומי הרצוי, כגון האונה הקדמית, האונה הקודקודית, הפרקונאוס או קליפת המוח הרקתית, השתמש בלחצני החצים בצג המגע. הכפתורים מאפשרים להזיז את ההחזר על ההשקעה באופן הדרגתי לכל הכיוונים (למעלה, למטה, שמאלה, ימינה) ליישור מדויק עם אזור מוח המטרה.
- לאחר מיקום ההחזר על ההשקעה, התאימו את הממדים שלו (גודל, עומק וצורה) באמצעות הפקדים הייעודיים שעל המסך:
התאמת עומק (כפתור A): הקש על כפתור העומק והתאם את רמת החדירה של ה-ROI כך שתתאים לדרישות הטיפול.
התאמת רוחב (כפתור B): השתמש בלחצן כוונון הרוחב כדי להרחיב או לכווץ את הגודל האופקי של החזר ההשקעה.
התאמת גובה (כפתור C): שנה את הממד האנכי של החזר ה-ROI על ידי הקשה על בקרת כוונון הגובה. שמור את ההגדרות לאחר השלמתן.
8. ביצוע הטיפול
- מרחו ברצף כמות נדיבה של ג'ל אולטרסאונד על קרקפת המטופל להעברת אנרגיה אופטימלית.
- התחל את הטיפול. בחר את מצב הטיפול במכשיר ואשר שהממברנה הממולאת מראש מחוברת כהלכה. החיבור הנכון של הממברנה הממולאת מראש מאומת על ידי הבטחה שהוא נלחץ כראוי למקומו על הידית. אופציונלי, המטופל יכול להשתמש בהגנת שמיעה במהלך הפגישה.
- החזק את הידית בניצב לקרקפת המטופל, וודא שהיא מועברת באופן שווה על פני השטח. איור 2 ממחיש את היישור האידיאלי בין המטופל ל-NEUROLITH במהלך TPS. איור 3 מציג דוגמה לאזורי העניין (ROI) ולמידול של רקמות שמגורים ב-MRI של המטופל. איור 4 מציג איור של המכשיר הידני במהלך גירוי.
- עקוב אחר הגירוי. טפל בכל אזור עד שהאזורים הממוקדים בתצוגה יהפכו לירוקים, מה שמעיד על כיסוי מתאים. המשך להזיז את הידית תוך שמירה על עדשות הזיהוי מול המצלמה כדי להבטיח מעקב רציף.
הערה: אם משקפי הזיהוי זזים מעט במהלך הטיפול, הפגישה יכולה להמשיך. עם זאת, אם מסירים את המשקפיים, נדרש כיול מחדש. - סיכום המפגש. לסיום הטיפול, לחץ על כפתור העצירה במכשיר. נקודת הסיום של ההפעלה מושגת כאשר מגיעים ל-6000 פולסים.
9. הליכים לאחר הטיפול
- נקה את הציוד. נקה את הידית ואת הממברנה הניתנת להסרה באמצעות מגבונים מאושרים (הימנע מחומרי ניקוי על בסיס אלכוהול).
- טיפול בחולים: נקו את אזור הקרקפת בעדינות כדי להסיר את כל ג'ל האולטרסאונד שנותר. במידת הצורך יש לייבש את שיער המטופל במגבת או במייבש שיער. לאחר הטיפול, ייעץ למטופלים להישאר בקרבת מקום במשך 10-15 הדקות הבאות למקרה שהם חווים תופעות לוואי מאוחרות או קלות, כגון סחרחורת, כאבי ראש או אי נוחות בקרקפת, אם כי אין צורך בהשגחה פעילה. עודדו את המטופלים לשמור על שתיית מים, מכיוון שהדבר תומך בהתאוששות וברווחה הכללית. ייעץ למטופל להימנע מפעילות גופנית אינטנסיבית למשך שארית היום, במיוחד אם הוא מרגיש עייף או חווה אי נוחות קלה לאחר הפגישה.
- אחסון נתוני טיפול: שמור את כל נתוני הטיפול, כולל אזורים מוגדרים, והתאם למפגשים עתידיים. יש לתעד כל תצפית במהלך הטיפול או המשוב.
תוצאות
גירוי דופק טרנס-גולגולתי הקל על הסימפטומים של חולי אלצהיימר כפי שהוכח על ידי נתוני פיילוט בלתי מבוקרים מ-11 חולים (תשעה גברים, שתי נשים, טווח גילאים 59-77 שנים, M = 69.82) שפורסמו על ידי קבוצת העבודה של מדריך זה1. האזורים המגורים כללו את קליפת המוח הקדמית הדו-צדדית, קליפת המוח הקודקודית הצדדית הדו-צדדית וקליפת המוח הקדם-רקונאוס המורחבת. קליפת המוח הרקתית הדו-צדדית נוספה לפרוטוקול. הטיפול ניתן בשישה מפגשים ראשוניים עם 6,000 פולסים במשך שבועיים כמחזור הטיפול הראשון.
פרוטוקול הטיפול במהלך הגירוי כלל 4 הרץ, 0.20 mJ/mm2 ו-6000 פולסים. שלושה מתוך 11 מטופלים (27%) דיווחו על תופעות לוואי בשלושה מתוך 75 מפגשים בסך הכל (4%). אלה כללו כאבי לסת (NRS 4/10), בחילות (NRS 7/10) ונמנום (NRS 10/10). עם זאת, אף אחד מאלה לא נמשך יותר מ-24 שעות, ולא ניתן לייחס את כולם ישירות לגירוי כאירועים שליליים (ADE).
הבדל מובהק נצפה בציון הכולל של ADAS לאחר הגירוי בהשוואה לקו הבסיס, עם שיפור מ-30.2 ל-25.8 (p = 0.01), ובציון ADAS-Cog, שהשתפר מ-25.8 ל-23.3 (p = 0.04; איור 5). בעוד שחלק מהמטופלים הראו שיפורים קלים בלבד, השיפור הטוב ביותר בחולה היה 40%, מה שהוביל לשיפור כולל של 15.76% בציון הכולל של ADAS ו-8.65% בציון ADAS Cog (איור 6). יתר על כן, הבדל משמעותי בתסמיני דיכאון התגלה בתת-סולם שדווח על עצמו של מבחן ADAS. מבחן t חד-זנבי הראה ירידה משמעותית בתסמיני דיכאון, כפי שנמדד על ידי תת-סולם שדווח על עצמו של מבחן ADAS. לפני הגירוי הממוצע היה 0.7 (SD = 1.1), ואחרי הגירוי הוא ירד ל-0.2 (SD = 0.4; t (8) = 1.859, p < 0.01).
סולם דירוג סובייקטיבי הושלם לפני ואחרי תקופת הטיפול של שבועיים. סולם זה מאפשר למטופלים לדווח על חומרת התסמינים שלהם ועל כל תופעות לוואי נתפסות בסולם דירוג מספרי של 0 עד 10, כאשר מספרים גבוהים יותר מצביעים על עוצמת תסמינים גדולה יותר. השיפור הסובייקטיבי הממוצע בחומרת התסמינים, כפי שנמדד על ידי ה-NRS, היה בין 5.7 ל-3.4 (p = 0.023).
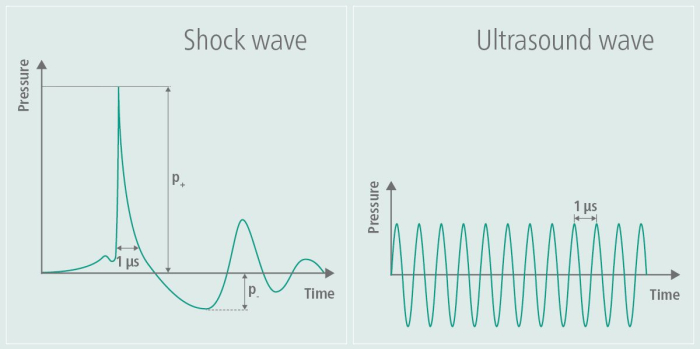
איור 1: גלי הלם במהלך גירוי. הגרף ממחיש את המשרעת של TPS בצד שמאל של התמונה ומשווה אותה למשרעת של אולטרסאונד בצד ימין של התמונה. במהלך TPS נוצר דופק לחץ יחיד, ואחריו השטחה לאחר מכן של המשרעת. לעומת זאת, משרעת האולטרסאונד אינה משתטחת שוב אלא נשמרת, וכתוצאה מכך תנודות מתמשכות בתדר גבוה לאורך זמן. נתון זה שונהמ-9. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
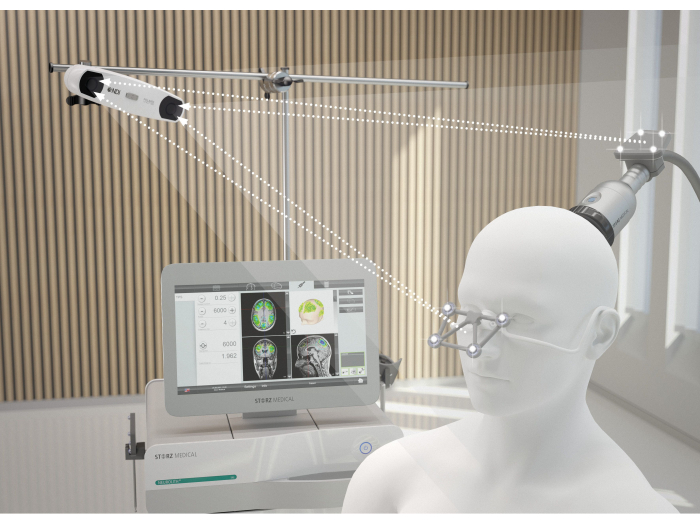
איור 2: מערכת ניווט MRI. התמונה ממחישה את היישור האידיאלי בין המטופל ל-NEUROLITH במהלך TPS. מצלמת התלת מימד יוצרת קשר עם עדשות הזיהוי של המשקפיים ואלה של הידית. רק אם שידור זה מובטח, הידית מזוהה במיקום המרחבי הנכון והדמיית הגירוי על המסך אינה מופרעת. נתון זה שונהמ-9. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
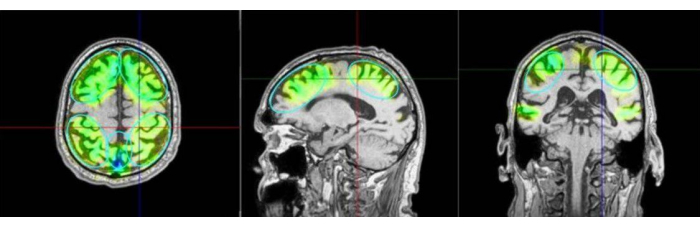
איור 3: אזורי עניין ואזורים מעוררים. התמונה מציגה דוגמה לאזורי העניין (ROI) ולמידול של רקמות המגורה ב-MRI של המטופל. הצבעים מבדילים עוד יותר את מספר הפולסים המופעלים באזורים המתאימים של הפרקונאוס, כמו גם באזורים הקדמיים והקודקודיים. אחרי הצבע הירוק מופיעים טורקיז, כחול וסגול. סגול מעיד על עוצמה מוגזמת ויש להימנע ממנו. אזורים מגורים מוצגים כנתונים מדומים ממערכת הניווט כאזורים שמגיעים אליהם בעיקר, אך זה לא נמדד כהפעלה מוחית אמיתית. גירוי זמני נוסף נוסף בפרוטוקול קמפן אם כי הוא אינו מוגדר מראש כהחזר ROI. משמאל: מבט צירי, באמצע: מבט סגיטלי, ימין: מבט עטרה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
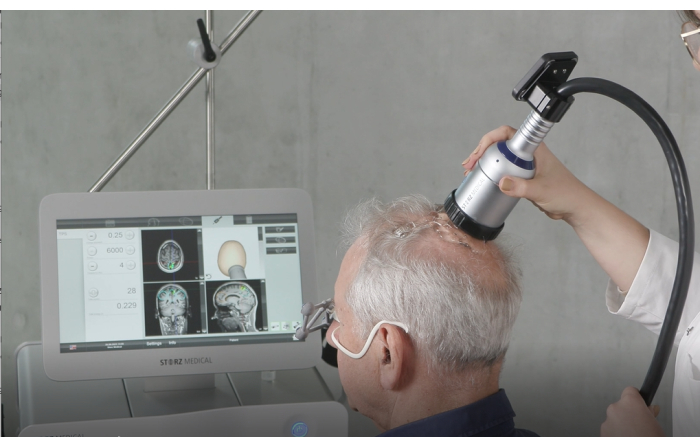
איור 4: מכשיר כף-יד. איור זה ממחיש את המכשיר הידני הנמצא בשימוש במהלך גירוי. שלבי הכנה קריטיים כוללים מריחת כמות מספקת של ג'ל אולטרסאונד על קרקפת המטופל כדי להבטיח העברת אנרגיה אופטימלית ווידוא שהממברנה המלאה מראש מחוברת בצורה מאובטחת ונכונה. במהלך הטיפול, הידית מוחזקת בניצב לקרקפת ומועברת באופן שווה על פני השטח כדי לשמור על גירוי עקבי. נתון זה שונהמ-9. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
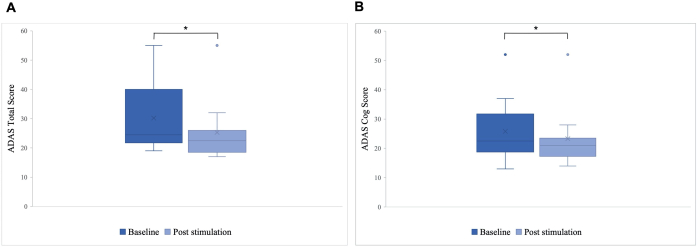
איור 5: סולם הערכת מחלת אלצהיימר (ADAS) לפני הגירוי הראשון. ממוצע הציון של קבוצת המטופלים בסולם הערכת מחלת האלצהיימר (ADAS) לפני הגירוי הראשון (כחול כהה) ואחרי הגירוי האחרון (כחול בהיר). ציון נמוך יותר מעיד על ביצועים טובים יותר. תרשים הקופסה מציג את התפלגות נתוני המטופלים. (א) הציון הכולל של ADAS. הקו מייצג את החציון של הקבוצה (קו בסיס = 24.5, לאחר גירוי = 22.5), והצלב מייצג את הציונים הממוצעים (M בסיס = 30.2 (SD 11.55), M לאחר גירוי = 25.8 (SD 10.71), *p = 0.01). (B) ציון גלגל השיניים של ADAS. הקו מייצג את החציון של הקבוצה (קו בסיס = 22.5, לאחר גירוי = 21), והצלב מייצג את הציונים הממוצעים (M בסיס = 25.8 (SD 10.77), M לאחר גירוי = 23.3 (SD 10.27), *p = 0.04). נתון זה שונהמ-5. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
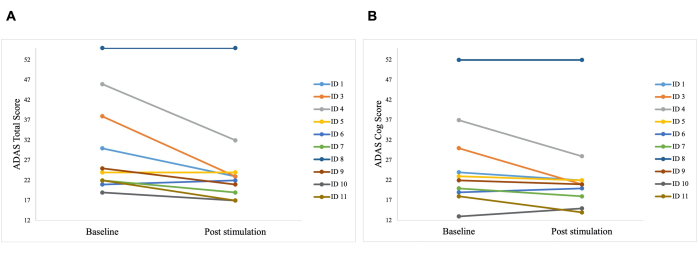
איור 6: תוצאות בדיקה פרטניות של המטופלים ב-ADAS. תוצאות בדיקה פרטניות של החולים בסולם הערכת מחלת אלצהיימר (ADAS) לפני הגירוי הראשון (נקודת ההתחלה) ולאחר הגירוי האחרון (לאחר הגירוי). ציון נמוך יותר מעיד על ביצועים טובים יותר. כל שורה מייצגת מטופל אחד. (A) ציונים אישיים של כל מטופל בציון הכולל של ADAS. השיפור הטוב ביותר היה 15 נקודות (מזהה 3). (B) ציונים אישיים של כל מטופל בתת-סולם ADAS cog score. השיפור הטוב ביותר היה 14 נקודות (מזהה 3 ומזהה 4). נתון זה שונהמ-5. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
בסך הכל, TPS הוא טיפול אפשרי למחלת אלצהיימר. מבחינה מעשית, תהליך הגירוי מתוכנן להיות ידידותי למשתמש עבור המפעיל. היכולת להגדיר אזורי עניין בתחילת ההליך, יחד עם הדמיה של מספר הפולסים המופעלים באמצעות סימונים מקודדים בצבע במהלך הטיפול, מפשטת משמעותית את הטיפול בממשק המשתמש. ניתן גם לבחור ולהתאים באופן חופשי את הגדרת אזורי העניין לפי הצורך. אזורים מגורים מוצגים בבירור כנתונים מדומים, אם כי יש צורך בפיתוח נוסף על ידי היצרן כדי להציג אזורים עמוקים יותר המושפעים מההתקן ברמות אנרגיה נמוכות יותר.
שלבים קריטיים בפרוטוקול TPS כוללים מיקום מדויק של מכשיר הגירוי על אזורי המוח הממוקדים, הבטחת העוצמה והתדירות הנכונים של גלי הדופק, וניטור קפדני של תגובות המטופלים. פתרון בעיות עשוי לכלול הבטחת מגע אופטימלי בין הידית לקרקפת כדי למנוע אובדן אנרגיה או גירוי לא אופטימלי. אם נצפות אי נוחות או תופעות לוואי, ייתכן שיידרשו התאמות עוצמה או מיקום מחדש.
נתונים בלתי מבוקרים שפורסמו הראו שיפורים קוגניטיביים קליניים 5,3, כמו גם עלייה בעובי קליפת המוח במספר אזורים במוח 10 ושינויים בקישוריות רשת MR11. כמו כן דווח על שיפורים במצב הרוח 5,4. בהשוואה לשיטות גירוי מוחי לא פולשניות אחרות, TPS מציעה מספר יתרונות ברורים. ראשית, הוא משלב גלי הלם מכניים עם ניווט עצבי מדויק, המאפשר יישום ממוקד לאזורי מוח מושפעים. בניגוד ל-TMS, שבדרך כלל מגרה רק שכבות קליפת המוח השטחיות, עומק החדירה של TPS הופך אותו למתאים במיוחד לטיפול במחלות ניווניות כמו אלצהיימר, שבהן מעורבים מבנים עמוקים יותר במוח. בנוסף, נראה כי ל-TPS יש פרופיל בטיחות חיובי, עם תופעות לוואי מינימליות וחולפות שדווחו רק ב-4% ממפגשי הטיפול, מה שמצביע על כך שזו עשויה להיות אפשרות נסבלת יותר עבור חולים עם AD5 בינוני עד חמור.
כדי לחקור ביסודיות את מנגנוני הפעולה ולבצע ניתוח מפורט של גורמי סיכון פוטנציאליים הקשורים לטיפול ב-TPS, נדרשים מחקרי יסוד נוספים.
במחקר שפורסם לאחרונה על ידי קבוצת מחקר זו, נבדקה פעילות רשת המוח בחולי אלצהיימר לפני ואחרי גירוי דופק טרנס-גולגולתי (TPS)17. התוצאות מצביעות על כך ש-TPS יכול לווסת תנודות מוח וקישוריות, מה שעשוי לשפר את התפקוד הקוגניטיבי במחלת אלצהיימר. אחד המנגנונים המוצעים הוא שתנודות הגמא המוגברות לאחר TPS עשויות להקל על פינוי גלימפטי במוח. השפעה אפשרית זו על פינוי גלימפטי צריכה להיחקר עוד יותר במחקרים עתידיים. בנוסף, יש צורך במחקרים מכניסטיים נוספים כדי להבהיר כיצד TPS משפיע על הפיזיולוגיה של רשת המוח והאם ההשפעות הנוירו-פרוטקטיביות שלו יכולות להאט או לעצור את התקדמות האלצהיימר.
מחקרים פרה-קליניים בבעלי חיים הבוחנים את ההשפעות של TPS על מוחות בריאים וחולים כאחד הם חיוניים להשגת הבנה מעמיקה יותר של המנגנונים הבסיסיים. חשוב לציין שטכניקות NiBS שונות פועלות באמצעות מנגנונים נפרדים1. לכן, חיוני לחקור האם וכיצד ההשפעות המתוארות לטיפול באולטרסאונד18 וטיפול בגלי הלם6 על רקמות ממלאות תפקיד בטיפול TPS. הראשון תיאר את ההשפעה האפשרית של TPS על תהליכי התמרה מכנית, כמו גם את הפוטנציאל שלו לגרום לשינויים בכלי הדם, התאים והמולקולריים, אותם יש לחקור ביסודיות. יתר על כן, מודולציה של תהליכים נוירו-דלקתיים, עם דגש מיוחד על דינמיקה של מחסום דם-מוח, מהווה תחום מסקרן למחקר עתידי. הבנת ההשפעות הללו יכולה לספק תובנות חשובות לגבי המנגנונים הבסיסיים ולעזור לייעל את TPS ליישומים טיפוליים. יתר על כן, זה תורם לבחינת היישום הפוטנציאלי של טיפול TPS בניהול מחלות ניווניות אחרות.
TPS מראה הבטחה כגישה טיפולית; עם זאת, יש להתייחס למספר מגבלות. ניסויים קליניים מבוקרים עם קבוצות פלצבו חיוניים כדי לתאר במדויק את ההשפעות הספציפיות של TPS. אתגר משמעותי הוא השונות הבין-אישית הגבוהה בתגובה לגירוי, שעשויה להיות מושפעת מגורמים כמו שלב מחלת האלצהיימר (AD) ונוכחות של מחלות נלוות4. בנוסף, הפרוטוקול האופטימלי לטיפול ארוך טווח נותר לא מוגדר. הגישות הנוכחיות כוללות מפגשי דחף חודשיים בודדים או חזרה על מחזור טיפול של 12 מפגשים בתוך שנה, אך חסרות ראיות התומכות בעליונות של גישה אחת על פני השנייה. מחקר קליני עתידי צריך לתת עדיפות לזיהוי פרמטרים אופטימליים של גירוי, להעריך כיצד גורמים ספציפיים למטופל (למשל, שלב של אלצהיימר) משפיעים על התוצאות הטיפוליות, ולחקור את ההשפעות ארוכות הטווח והקיימות של טיפול TPS.
Disclosures
הסופר לארס וויטצקי קיבל בעבר מענקי מימון ותמיכה מוסדית מקרן המחקר הגרמנית, Hilde-Ulrichs-Stiftung für Parkinsonforschung, וקרן פרקינסון גרמניה, BMBF/ERA-NETNEURON, DFG Forschergruppe (FOR1328), Deutsche Parkinson Vereinigung (DPV), Forschungskommission, Medizinische Fakultät, HHU Düsseldorf, UCB; מדטרוניק, UCB, טבע, אלרגן, מרץ, Abbvie, רוש, ביאל, מרק, נוברטיס, דסיטין, ספקטרום. הסופר לארס וויטצקי היה הבעלים של מניות בחברת BioNTech SE. הסופר לארס וויטצקי הוא יועץ לחברות הבאות: TEVA, UCB Schwarz, Desitin, Medtronic, Abbott/Abbvie, MEDA, Boehringer I, Storz Medical, Kyowa Kirin, Guidepoint, Merck, Merz, Synergia, BIAL, Zambon, Sapio Life, STADA, Inomed ו-Vertanical. הסופרת סלין קונט היא יועצת ל-Storz Medical. שאר המחברים מצהירים כי המחקר נערך בהיעדר קשרים מסחריים או פיננסיים כלשהם שיכולים להתפרש כניגוד אינטרסים פוטנציאלי.
Acknowledgements
אנו מודים למטופלים על היענותם והשתתפותם. הסיוע הטכני ואיסוף הנתונים הובטחו בעזרתן של ורוניקה הירש ומיכאלה וסלר (עוזרות טכניות רפואיות).
Materials
| Name | Company | Catalog Number | Comments |
| Disinfectant Wipes: mikrozid universal wipes | schülke | GTIN: 4032651957774 | Used to clean the hand piece after each session to ensure hygiene |
| Dry Towels: Wisch-/Pflegetuch Kolibri | IGEFA Handelsgesellschaft mbH & Co. KG | PZN: 10417600 | Used to dry the patient's skin after the ultrasound gel has been cleaned |
| Handpiece | Storz Medical | HW 030816.01 (114) | Used to hold the device during treatment |
| NEUROLITH | Storz Medical | SN: 19880_0015 | The NEUROLITH system with TPS is a CE-certified device |
| Patient Chair | Adjustable chair for optimal patient positioning during the treatment | ||
| silicone oil | Storz Medical | 13330 | Applied onto the membrane of the handpiece before attaching the prefilled coupling membrane (the distance piece) to the handpiece |
| Sonosid Ultrasound Gel | Asid Bonz GmbH | PZN: 5362311 | Applied to the scalp to ensure optimal transmission of acoustic pulses through the skull |
| Wash Gloves: Esemtan wash mitts | schülke | GTIN: 4032651297016 | For removing the ultrasound gel from the patient post-treatment |
References
- Koch, G., et al. The emerging field of non-invasive brain stimulation in Alzheimer's disease. Brain. Epub ahead of print. , (2024).
- Menardi, A., et al. Toward noninvasive brain stimulation 2.0 in Alzheimer's disease. Ageing Res Rev. 75, 101555 (2022).
- Beisteiner, R., et al. Transcranial pulse stimulation with ultrasound in Alzheimer's disease-a new navigated focal brain therapy. Adv Sci. 7 (3), 1902583 (2019).
- Matt, E., Dörl, G., Beisteiner, R. Transcranial pulse stimulation (TPS) improves depression in AD patients on state-of-the-art treatment. Alzheimer's Dement. 8 (1), e12245 (2022).
- Cont, C., et al. Retrospective real-world pilot data on transcranial pulse stimulation in mild to severe Alzheimer's patients. Front Neurol. 13, 948204 (2022).
- Guo, J., Hai, H., Ma, Y. Application of extracorporeal shock wave therapy in nervous system diseases: A review. Front Neurol. 13, 963849 (2022).
- Khanna, A., Nelmes, R. T., Gougoulias, N., Maffulli, N., Gray, J. The effects of LIPUS on soft-tissue healing: a review of literature. Br Med Bull. 89, 169-182 (2009).
- Chen, X., You, J., Ma, H., Zhou, M., Huang, C. Transcranial pulse stimulation in Alzheimer's disease. CNS Neurosci Ther. 30 (2), e14372 (2024).
- . Website of Manufacturer Available from: https://www.storzmedical.com/en/physics-and-technology (2025)
- Popescu, T., Pernet, C., Beisteiner, R. Transcranial ultrasound pulse stimulation reduces cortical atrophy in Alzheimer's patients: a follow-up study. Alzheimer's Dement. 7 (1), e12121 (2021).
- Dörl, G., Matt, E., Beisteiner, R. Functional specificity of TPS brain stimulation effects in patients with Alzheimer's disease: A follow-up fMRI analysis. Neurol Ther. 11 (3), 1391-1398 (2022).
- d'Agostino, M. C., Craig, K., Tibalt, E., Respizzi, S. Shock wave as biological therapeutic tool: From mechanical stimulation to recovery and healing, through mechanotransduction. Int J Surg. 24, 147-153 (2015).
- Yahata, K., et al. Low-energy extracorporeal shock wave therapy for promotion of vascular endothelial growth factor expression and angiogenesis and improvement of locomotor and sensory functions after spinal cord injury. J Neurosurg. 25 (6), 745-755 (2016).
- Hatanaka, K., et al. Molecular mechanisms of the angiogenic effects of low-energy shock wave therapy: roles of mechanotransduction. Am J Physiol. 311 (3), C378-C385 (2016).
- Mariotto, S., et al. Extracorporeal shock waves: from lithotripsy to anti-inflammatory action by NO production. Nitric oxide. 12 (2), 89-96 (2005).
- Flournoy, J., Ashkanani, S., Chen, Y. Mechanical regulation of signal transduction in angiogenesis. Front Cell Dev Biol. 10, 933474 (2022).
- Wojtecki, L., Cont, C., Stute, N., Galli, A., Schulte, C., Trenado, C. Electrical brain networks before and after transcranial pulsed shockwave stimulation in Alzheimer's patients. Geroscience. Epub ahead of print. , (2024).
- Sarica, C., et al. Human studies of transcranial ultrasound neuromodulation: A systematic review of effectiveness and safety. Brain Stimul. 15 (3), 737-746 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved