A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الموائع الدقيقة في تقييم وظيفة الصفائح الدموية
In This Article
Summary
يمكن تقييم وظيفة الصفائح الدموية تحت التدفق ويمكن نمذجة محاكاة الإنعاش المرقئ باستخدام جهاز ميكروفلويدي ، والذي له تطبيقات في طب الصدمات ونقل الدم.
Abstract
تشتمل الموائع الدقيقة على ركائز وتدفقات ذات صلة من الناحية الفسيولوجية تحاكي الأوعية الدموية ، وبالتالي فهي أداة قيمة لدراسة جوانب تجلط الدم والإرقاء. في البيئات عالية القص التي تحاكي التدفق الشرياني ، يسهل اختبار الموائع الدقيقة دراسة وظيفة الصفائح الدموية ، حيث تتشكل الجلطات الغنية بالصفائح الدموية في منطقة تضيقية موضعية لقناة التدفق. يمكن أن يساعد استخدام الأجهزة التي تسمح بحجم عينة صغير أيضا في تقييم وظيفة الصفائح الدموية تحت التدفق من عينات المرضى محدودة الحجم أو النماذج الحيوانية. قد تساعد دراسة عينات أو عينات مرضى الصدمات بعد نقل منتجات الصفائح الدموية في توجيه الاستراتيجيات العلاجية لمجموعات المرضى التي تكون فيها وظيفة الصفائح الدموية أمرا بالغ الأهمية. يمكن أيضا دراسة آثار تثبيط الصفائح الدموية عن طريق العوامل الدوائية في هذا النموذج. الهدف من هذا البروتوكول هو إنشاء منصة موائع دقيقة تتضمن التدفق الفسيولوجي والأسطح البيولوجية والآليات المرقئة ذات الصلة لتقييم وظيفة الصفائح الدموية مع الآثار المترتبة على دراسة اعتلال التخثر الناجم عن الصدمات وطب نقل الدم.
Introduction
الصدمة هي سبب عالمي رئيسي للوفاة والعجز. غالبا ما تكون الإصابة الشديدة معقدة بسبب اضطراب داخلي فريد من الإرقاء والتخثر ، يسمى اعتلال التخثر الناجم عن الصدمة (TIC) 1. تلعب الصفائح الدموية دورا مهما في TIC ، وقد تم وصفها بأنها لها وظائف تكيفية وغير قابلةللتكيف 2. لا تزال آليات الخلل الوظيفي للصفائح الدموية بعد الإصابة غير واضحة ، وهناك حاجة ماسة لفهم الاستجابة الخلوية بشكل أفضل لتوجيه تطوير الإنعاش والعلاج المحسنين. هناك مشكلة مزعجة إضافية فيما يتعلق بوظيفة الصفائح الدموية بعد الإصابة وهي عدم اليقين من موثوقية القراءات الحالية لوظيفة الصفائح الدموية في مريض الصدمة.
أظهرت دراسات متعددة أنه حتى المرضى المصابين بجروح طفيفة ، مع عدم وجود نمط ظاهري معروف للنزيف السريري ، لديهم وظيفة صفائح الدموية غير الطبيعية باستخدام اختبار وظيفة الصفائح الدموية التقليدي مثل قياس التجميع3،4. ومع ذلك ، فإن القيود المفروضة على قياس التجميع لتقييم وظيفة الصفائح الدموية في بيئة الإصابة تشمل نقص سطح الإصابة ذي الصلة من الناحية الفسيولوجية ، والنهج الاختزالي للتحفيز الناهض ، وتخفيف العينة باستخدام تجميع مقاومة الدم الكامل ، وفصل البلازما مع تجميع انتقال الضوء البصري ، وتقييم العينة الراكدة. بالإضافة إلى ذلك ، لا يزال من غير الواضح ما إذا كانت حساسية وظيفة الصفائح الدموية هذه تمثل خللا خلويا حقيقيا أو قطعة قياس ، مثل زيادة المعاوقة الكهربائية الأساسية ، في وضع الإصابة2. وبالتالي ، فإن دراسة وظائف الصفائح الدموية ذات الصلة في سياق الصدمة أمر بالغ الأهمية لفهم TIC ، وهناك مجال كبير للابتكار والتحسين في هذا المجال.
لا تتضمن المنصات المستخدمة تقليديا لدراسة وظيفة الصفائح الدموية ديناميكيات السوائل وتدفقها ، والتي قد تكون حاسمة في فهم الخلل الوظيفي للصفائح الدموية المتعلق بالصدمة واعتلال التخثر الناجم عن الصدمات5. تشمل آليات الإرقاء التي تعتمد على التدفق استطالة عامل فون ويلبراند (VWF) عند القص العالي ، فوق معدل القص الحرج ، والتقاط الصفائح الدموية عبر البروتين السكري 1 ب6،7،8 ، والتي لا يتم التقاطها باستخدام فحوصات وظيفة الصفائح الدموية الراكدة. بالإضافة إلى ذلك ، ترتبط الصفائح الدموية بشكل تفضيلي ب VWF أو الفيبرينوجين اعتمادا على نظام التدفق وتثير أدوارا تفاضلية في التخثر الشرياني مقابل التخثر الوريدي9،10. تتكون الجلطات الشريانية بشكل أساسي من الصفائح الدموية بينما تتكون الجلطات الوريدية بشكل أساسي من خلايا الدم الحمراء ، وتستند جزئيا إلى أنظمة التدفق11. يمكن أن تساعد المقايسات التي تتضمن أنظمة التدفق في توضيح الاختلالات المتعلقة بطيف الأنماط الظاهرية ل TIC ، من نقص التخثر والأنماط الظاهرية للنزيف إلى فرط التخثر والأنماط الظاهرية للتخثر. أخيرا ، قد تجعل قيود أخذ عينات حجم الدم مع مرضى الصدمات اختبار وظائف الصفائح الدموية التقليدي أمرا صعبا. في حين أن المقايسات مثل قياس التدفق الخلوي يمكن ويجب استخدامها في هذه الظروف ، فإن النتائج غالبا ما تصور التوصيف المادي للعينة وليس تقييما وظيفيا مرققا.
في حين أن آليات ضعف الصفائح الدموية قد لا تكون مفهومة تماما في الصدمة ، فإن نمذجة الخلل الوظيفي للصفائح الدموية في المختبر ، مع مضادات P2Y12 على سبيل المثال ، يمكن أن تساعد أيضا في توجيه دراسة التدخلات العلاجية. يعد الإنعاش المرقئ مهما للغاية في مرضى الصدمات حيث يتم نقل منتجات الدم في نهج متوازن لمعالجة الصدمة واعتلال التخثر وإصابة البطانة إما بالدم الكامل أو مكونات الدم (خلايا الدم الحمراء والبلازما ومركزات الصفائح الدموية) بنسبة وحدة 1: 1: 1 12،13،14. في مرضى الصدمات ، يرتبط الاستخدام المبكر لمنتجات الدم بتحسين البقاء على قيدالحياة 15،16. لإطالة العمر الافتراضي ، تمت دراسة منتجات الصفائح الدموية المخزنة على البارد بشكل متزايد. يظهر فحص الصفائح الدموية المخزنة على البارد زيادة في نشاط مرقئ ، بالإضافة إلى السلامة عند نقلها بعد الإصابة17،18.
يؤكد تطور إنعاش الصفائح الدموية المخزنة على البارد على الحاجة إلى اختبارات إضافية لفهم منتج الصفائح الدموية الأكثر فعالية المتاح للصدمات. ومع ذلك ، غالبا ما تكون فحوصات وظائف الصفائح الدموية التقليدية مفرطة أو ناقصة للكشف عن الخلل الوظيفي ، والتي تحدث في كل من مريض الصدمة الذي يتلقى نقل الصفائح الدموية العلاجي وكذلك في المنتج المنقول نفسه الذي يظهر في آفات تخزين الصفائح الدموية. قد يكون تحديد أصل الخلل الوظيفي أمرا صعبا ، نظرا للقيود المفروضة على فحوصات وظائف الصفائح الدموية الحالية ، بما في ذلك الطبيعة الثابتة لمعظم هذه الاختبارات. لذلك ، عند دراسة الإنعاش المرقئ في المختبر ، فإن المنصة وطرق الكشف لكل من مجموعات الصفائح الدموية المتلقية والمنتج لها أهمية حاسمة في تحديد التدخلات العلاجية المثلى.
يوفر اختبار الموائع الدقيقة ملفات تعريف التدفق والأسطح الحيوية لإنشاء اختبار ذي صلة من الناحية الفسيولوجية لدراسة الصفائح الدموية. يمكن تخصيص أجهزة الموائع الدقيقة لدراسة الفيزيولوجيا المرضية أو أنواع الإصابات ، مثل ثقب الأوعيةالدموية 19 أو تلف البطانية20. تتكون هذه الأجهزة بشكل عام من بولي ثنائي ميثيل سيلوكسان (PDMS) المرتبط بشريحة مجهر زجاجي مع تعديلات على السطح ، مثل الكولاجين ، لتقليد البطانة الفرعية وإصابة الأنسجة. يمكن أن يساعد استخدام هذه الأنواع من الأجهزة القائمة على التدفق في توجيه أبحاث الخلل الوظيفي للصفائح الدموية المرتبطة بالصدمات والمساعدة في فحص الأساليب المثلى لطب نقل الدم لتحسين الخلل الوظيفي للصفائح الدموية. قد تساعد هذه الاستراتيجيات في توضيح الارتباك الموجود حول أهمية مقايسات الصفائح الدموية الثابتة مثل قياس التجميع في المريض المصاب.
Protocol
تم إجراء جميع الأبحاث وفقا للإرشادات المؤسسية. تم الحصول على موافقة من مكتب حماية البحوث البشرية بجامعة بيتسبرغ والحصول على موافقة مستنيرة من المتطوعين البشريين الأصحاء.
1. إعداد جهاز الموائع الدقيقة
- لتصنيع جزء PDMS من الجهاز ، قم بإعداد قالب رئيسي باستخدام النحاس الأصفر عبر التحكم العددي بالكمبيوتر (CNC) بالآلات الدقيقة.
ملاحظة: اعتمادا على أبعاد القناة ، يمكن استخدام تقنيات الطباعة الحجرية الضوئية لإنشاء قالب رئيسي. يشتمل الجهاز المستخدم في هذا البروتوكول على ثماني قنوات متوازية ذات تشكيل دقيق يبلغ عرضها حوالي 480 ميكرومتر ، وطولها 140 ميكرومتر عند مدخل ومخرج الجهاز ، وطول 40 ميكرومتر عند تضيق الجهاز ، بطول منحدر من / إلى منطقة التضيق حوالي 0.3 مم. أطوال القنوات حوالي 6 مم. - مع الحصول على قالب رئيسي ، اسكب قاعدة المطاط الصناعي المصنوعة من السيليكون (التي تم الحصول عليها من مجموعة المطاط الصناعي) في طبق وزن. أضف عامل معالجة السيليكون (الذي تم الحصول عليه من مجموعة المطاط الصناعي) ، مما يسهل الربط المتقاطع لسلاسل بوليمر السيليكون لتحويل PDMS السائل إلى مادة صلبة متينة ومرنة ، بنسبة 10: 1 (عامل أساسي) وتقليب الخليط جيدا.
- ضع القالب في طبق بتري واسكب PDMS غير المعالج على القالب. ضع طبق بتري داخل مجفف مفرغ كهربائي لمدة 30 دقيقة لإزالة الفقاعات.
- قم بإنهاء معالجة PDMS في القالب الرئيسي عن طريق وضعه في فرن مضبوطة على 70 درجة مئوية لمدة 90 دقيقة.
- بعد المعالجة الكاملة ل PDMS ، قم بقطع قالب الموائع الدقيقة باستخدام شفرة حلاقة أو مشرط. قم بعمل ثقوب على حواف القنوات (قطرها 1.5 مم على كلا الجانبين).
- باستخدام شريط المختبر ، قم بتنظيف سطح الشريحة الزجاجية والجانب المحفور من قالب الموائع الدقيقة. استخدم الهواء المضغوط حسب الحاجة لإزالة الحطام المتبقي.
- ضع الشريحة الزجاجية والمصبوب الموائع الدقيقة مع الجانب المحفور لأعلى في منظف البلازما. ابدأ تشغيل مضخة التفريغ ، وأغلق الغرفة ، وقم بتشغيل منظف البلازما إلى الإعداد العالي. اترك الشريحة و PDMS في منظف البلازما لمدة 30 ثانية ، ثم قم بإيقاف تشغيل منظف البلازما وإزالة الفراغ.
- اربط الجبيرة والشريحة الزجاجية التي تم تنظيفها بالبلازما معا عن طريق الضغط برفق على الجوانب التي كانت متجهة لأعلى في منظف البلازما. بعد ذلك ، ضع جهاز الموائع الدقيقة في فرن / لوح تسخين على حرارة 70 درجة مئوية لمدة 10 دقائق.
ملاحظة: لا تضغط كثيرا عند ربط الشريحة المصبيرة والزجاج معا لأن ذلك قد يؤدي إلى فقدان مورفولوجيا القناة. - اشطف كل حجرة ب 10-30 ميكرولتر من 70٪ إيثانول لتعقيمها والسماح لجهاز الموائع الدقيقة بالجفاف على لوح ساخن 70 درجة مئوية.
ملاحظة: يجب تصنيع الأجهزة قبل 24 ساعة على الأقل ولكن يمكن تصنيعها قبل أسابيع إلى شهور. يجب تخزين الأجهزة في حاوية محكمة الإغلاق أو طبق بتري مغطى في درجة حرارة الغرفة. - في اليوم السابق لتجربة جهاز الموائع الدقيقة ، أعد شطف كل غرفة ب 10-30 ميكرولتر من 70٪ إيثانول لتعقيم والسماح لجهاز الموائع الدقيقة بالجفاف على لوح تسخين 70 درجة مئوية.
- قم بتغطية الغرفة بكاشف الكولاجين الليفي للخيول من النوع 1 (1 مجم / مل) ، مخفف بنسبة 0.9٪ كلوريد الصوديوم بنسبة حجمية 1: 5 من خلال مخرج مخصص للمدخل المحدد. تأكد من الحفاظ على الاتجاه داخل التجربة. قم بتخزين الجهاز في وعاء مغلق دافئ ورطب لمنع تبخر الكولاجين المطلي داخل القناة.
- بعد 1 ساعة ، اشطفها بمحلول ملحي مخزن بالفوسفات (PBS) لطرد محلول الكولاجين. اغسل في الاتجاه المعاكس للطلاء. عندما لا يكون قيد الاستخدام ، قم بتخزين الجهاز مرة أخرى في حاوية دافئة ورطب ومغلقة.
2. تحضير عينة الدم
- الحصول على عينة دم كامل مسجلة عن طريق بزل الوريد. احتضان الدم الكامل المسيطر بمحلول حجب مستقبلات FC (1: 600).
ملاحظة: يتم تخزين عينات الدم في درجة حرارة الغرفة قبل وأثناء التجارب. - احتضان الدم الكامل المسيطر مع الجسم المضاد CD41 المترافق الفلوري (باستخدام الفلوروفور المفضل) (1: 600). وصمة عار لمدة 30 دقيقة على الروك الجوزي.
- كعنصر تحكم إيجابي في تثبيط الصفائح الدموية ، أضف Ticagrelor ، وهو مضاد لمستقبلات P2Y12 أعيد تشكيله في محلول 30٪ وزن / حجم 2-هيدروكسي بروبيل-β-سيكلودكسترين (HP-β-CD) في PBS.
ملاحظة: يجب تحضير مخزونات Ticagrelor حتى 6.4 ملي مولار ويمكن إجراء مزيد من التخفيف لمخزونات Ticagrelor في محلول HP-β-CD (30٪ HP-β-CD مذاب في PBS) قبل التجربة (يوصى بتركيزات مخزون 1,000 ضعف). - احتضان العينة المسجلة باستخدام Ticagrelor (التركيز النهائي حتى 6.4 ميكرومتر) لمدة 30 دقيقة لمراقبة تثبيط الصفائح الدموية.
- في حالة خلط منتج الدم مع العينة المقذرة ، قم بتلطيخ منتج الدم بمحلول حجب مستقبلات FC (1: 600) ومترافق فلوري (باستخدام فلوروفور منفصل ومتميز للعينة السيترية) CD41 (1: 600).
- امزج المكافئ الحجمي لوحدات الإنتاج المنقولة مع العينة المصابة. على سبيل المثال ، لمحاكاة وحدتين من منتجات الصفائح الدموية المنقولة إلى شخص ينزف (حوالي 250 مل لكل منتج في حجم دم إجمالي يبلغ 5,000 مل) ، امزج 100 ميكرولتر من منتج الدم في 1,000 ميكرولتر من عينة الدم الستراترية.
- قبل التجربة مباشرة ، قم بتصفية عينة الدم من خلال مرشح 40 ميكرومتر في أنبوب معقم للطرد المركزي الدقيق سعة 1.5 مل.
3. اختبار وظيفة الصفائح الدموية تحت التدفق (الطريقة 1)
- قم بتشغيل المجهر والبرامج المرتبطة به.
- اضبط مستوى مضخة حقنة السحب مع مرحلة المجهر. اضبط الإعدادات على مضخة الحقنة.
- احسب معدل التدفق الحجمي (Q) لمتوسط معدل قص الجدار المطلوب (γ) البالغ 3,500 s-1 عند المنطقة الضيقة للقناة باستخدام المعادلتين (1) و (2)21.
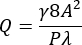 (1)
(1)
 (2)
(2)
حيث A هي مساحة المقطع العرضي للقناة ، P هو المحيط المبلل ، λ هو عامل الشكل ، b هو الجانب القصير للمستطيل (الارتفاع) ، و a هو الجانب الطويل من المستطيل (العرض).
ملاحظة: يتم اختيار قيمة 3,500 s-1 بسبب القص الحرج VWF وهي في النظام الشرياني 7,22,23.
- احسب معدل التدفق الحجمي (Q) لمتوسط معدل قص الجدار المطلوب (γ) البالغ 3,500 s-1 عند المنطقة الضيقة للقناة باستخدام المعادلتين (1) و (2)21.
- ضع جهاز الموائع الدقيقة على مرحلة المجهر. قم بلصق حواف جهاز الموائع الدقيقة على المسرح لتجنب الحركة. تأكد من أن المخرج يواجه الجزء الخلفي من المجهر.
- قم بتوصيل أحد طرفي أنبوب ID 1/16 بوصة (بطول 30 سم تقريبا) بموصل الكوع والطرف الآخر بحقنة سعة 10 مل مع موصل معرف 1/16 بوصة.
- املأ المحقنة ب PBS معقم وقم بتوصيله بمضخة المحقنة.
- ضع موصل الكوع في مخرج الجهاز.
- قم بإعداد خطوط مدخل بطول 10 سم تقريبا مع موصل الكوع على أحد طرفيه والقطع الزاوي على الطرف الآخر.
- قم بتوصيل موصل كوع المدخل بمدخل الجهاز.
- ضع خط المدخل في أنبوب الطرد المركزي الدقيق للنفايات على حامل بزاوية.
- استخدم هدف 10x لأبعاد القناة التي يبلغ عرضها حوالي 500 ميكرومتر وركز على حواف قناة جهاز الموائع الدقيقة.
- قم بتجهيز الخطوط باستخدام PBS وقم بمسح القناة من أي PDMS / حطام عن طريق دفع مضخة الحقنة يدويا. تأكد من التحقق بالقرب من مدخل ومخرج القناة.
- افتح إعدادات التقاط الصور المحفوظة أو أنشئ إجراء التقاط صورة لصور السلاسل الزمنية التي يتم التقاطها كل 1-2 ثانية باستخدام قناة المجال الساطع وقنوات الفلورسنت المقابلة للأجسام المضادة الفلورية CD41 المستخدمة في عينة الدم.
- احصل على عينة الدم السترية المفلترة واخلطها عن طريق سحب العينة لأعلى ولأسفل قبل التجربة مباشرة. ضع العينة على حامل الطرد المركزي الدقيق الزاوية.
- ضع خط المدخل في العينة.
- ابدأ في تسجيل التقاط الصورة.
- ببطء ، اسحب المحقنة لملء الحجم الميت في الأنبوب. بمجرد وصول الدم إلى القناة ، اضغط على الفور على تشغيل على مضخة الحقنة لاستئناف التدفق بمعدل القص المطلوب.
- اضبط التركيز إذا لزم الأمر.
- قم بإجراء التجربة حتى تسد الصفائح الدموية تماما المنطقة المضيقة لجهاز الموائع الدقيقة أو حتى نقطة نهاية تجريبية (أي 10 دقائق).
- تأكد من غمر أنبوب المدخل في عينة الدم طوال مدة التجربة.
- بمجرد اكتمال التجربة ، أوقف التقاط الصورة وأوقف مضخة الحقنة. احفظ التقاط الصورة.
- قم بإزالة موصل كوع المدخل وأفرغ محتويات الأنبوب في شكل مخروطي للنفايات. أفرغ محتويات الحقنة وخطوط المخرج في نفايات مخروطية أيضا.
- استبدل موصلات المدخل والمخرج والأنابيب حسب الضرورة للعينات اللاحقة.
4. اختبار وظيفة الصفائح الدموية تحت التدفق مع عينات منخفضة الحجم (أقل من 1 مل) (الطريقة 2)
- كرر الخطوات من 1.1 إلى 1.4 على النحو الوارد أعلاه.
- قم بثقب مخرج قطره 1.5 مم ومدخل قطره 3 مم عند حواف القنوات.
- كرر الخطوات من 1.6 إلى 3.6 على النحو الوارد أعلاه.
- استخدم هدف 10x لأبعاد القناة التي يبلغ عرضها حوالي 500 ميكرومتر وركز على حواف قناة جهاز الموائع الدقيقة.
- قم بتنظيف القناة من أي نظام PDMS / حطام عن طريق دفع مضخة الحقنة يدويا والتخلص من سائل الوصول بمسحة معملية. قم بإزالة أي حطام بشريط مختبر أعلى جهاز الموائع الدقيقة.
- قم بدفع المضخة يدويا لملء خزان المدخل 3 مم ب PBS.
- افتح إعدادات التقاط الصور المحفوظة أو أنشئ إجراء التقاط صورة لصور السلاسل الزمنية التي يتم التقاطها كل 1-2 ثانية باستخدام قناة المجال الساطع وقنوات الفلورسنت المقابلة للأجسام المضادة الفلورية CD41 المستخدمة في عينة الدم.
- ابدأ السحب على مضخة الحقنة (يدويا أو بسرعة محددة) وبمجرد أن يتقدم PBS إلى القناة وينخفض خط التعبئة في الخزان ، أوقف السحب مؤقتا على المضخة.
- قم بإزالة PBS الزائد من الخزان باستخدام ماصة.
- ابدأ التقاط الصورة.
- قم بسحب عينة الدم في الخزان (حوالي 40 ميكرولتر) وابدأ على الفور في حقنة السحب. تأكد من بدء التدفق.
ملاحظة: إذا لم يتم تحضير محرك مضخة الحقنة للسحب في الخطوة 4.8 ، فلن يبدأ التدفق على الفور ، ويجب تكرار التجربة. - أعد ملء خزان الدم طوال مدة التجربة ، مع ضمان عدم دخول جيوب هوائية إلى القناة.
- قم بإجراء التجربة حتى تسد الصفائح الدموية تماما المنطقة المضيقة لجهاز الموائع الدقيقة أو حتى نقطة نهاية تجريبية (أي 10 دقائق).
- بمجرد اكتمال التجربة ، أوقف التقاط الصورة وأوقف مضخة الحقنة. احفظ التقاط الصورة.
- قم بإزالة الدم الزائد في الخزان عن طريق سحب العينات. أفرغ محتويات أنبوب السحب في أنبوب مخروطي النفايات.
- استبدل الموصلات والأنابيب حسب الضرورة للعينات اللاحقة.
5. إزالة التلوث
- قم بتنظيف خطوط الدم الداخلية والمخرجة عن طريق التنظيف في محلول مبيض بنسبة 10٪.
- إذا تم استخدام جميع القنوات الموجودة على جهاز الموائع الدقيقة ، فتخلص من الجهاز في حاوية النفايات الخطرة بيولوجيا من Sharps.
ملاحظة: يجب التخلص من جميع النفايات البيولوجية في النفايات البيولوجية بشكل مناسب.
6. تحليل الصور
- تصدير الصور من التجارب الحركية باستخدام البرنامج بالنقر فوق ملف | التصدير / الاستيراد | تصدير.
- حدد المعلمات التالية: نوع الملف: تنسيق ملف الصورة الموسومة (TIFF); الضغط: LZW. تحقق من البيانات الأصلية و Shift Pixel ؛ قم بإلغاء تحديد تطبيق منحنى العرض ولون القناة ؛ حدد تحديد مجموعة فرعية (منطقة، منطقة مستطيل، وحدد منطقة القناة مع قياس العرض والارتفاع المحفوظ بين الشروط). قم بالتصدير إلى المجلد المطلوب وتحقق من إنشاء مجلد.
- لاحظ القيم التجريبية أدناه على البرنامج: إطار البدء عندما يدخل الدم إلى القناة ؛ معدل الإطارات (المعلومات ، السلاسل الزمنية).
- قياس متوسط شدة التألق الطبيعي لكل إطار في تجربة باستخدام كود Matlab المقدم كملف تكميلي 1 ، وتغيير المدخلات التالية لكل تجربة: إطار البداية / إطار النهاية بناء على طول التجربة (تأكد من الحفاظ على طول التجربة بين الظروف) ؛ اسم التجربة/اسم المجلد؛ اقتصاص معلمات X و Y و H و W. قم بتشغيل الكود مرة واحدة لقناة فلورسنت الصفائح الدموية المستلمة ومرة واحدة لقناة فلورسنت الصفائح الدموية للمنتج. أبلغ عن قيم MFI (العمود 2) وAUC المعادية (تمت تسويتها لبدء الإطار). اطرح قيمة طول التجربة من قيمة AUC المعيارية.
النتائج
يجب أن تظهر تجارب الموائع الدقيقة بعد استخدام هذه الطريقة تكوين الجلطة الغنية بالصفائح الدموية في منطقة تضيق قناة التدفق (الشكل 1). يوضح الشكل 1 أ النتائج التمثيلية حيث شكلت الصفائح الدموية الوظيفية جلطة في المنطقة الضيقة من القناة لمنع ت?...
Discussion
يحتوي البروتوكول أعلاه على بعض الخطوات الحاسمة لضمان موثوقية التجارب وقابليتها للتكرار. أولا ، يجب النظر بعناية في الأجسام المضادة الفلورية. يجب ألا تمنع الأجسام المضادة المستخدمة للكشف عن الصفائح الدموية في العينة وظيفة مستقبلات الصفائح الدموية للبروتين السكري Ib (GPIb)...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
يقر المؤلفون ويشكرون جميع المتبرعين بالدم الذين شاركوا ، بالإضافة إلى أخصائيي الفصد في مختبر أبحاث طب الصدمات ونقل الدم ومركز UPMC Montefiore للأبحاث السريرية والانتقالية للمساعدة في المجموعات. الرسائل القصيرة مدعومة من قبل K25HL161401. MDN مدعوم بواسطة 1R01HL166944-01A1.
Materials
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
References
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112 (2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509 (2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502 (2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved