É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Microfluídica na avaliação da função plaquetária
Neste Artigo
Resumo
A função plaquetária sob fluxo pode ser avaliada e a ressuscitação hemostática simulada pode ser modelada usando um dispositivo microfluídico, que tem aplicações em trauma e medicina transfusional.
Resumo
A microfluídica incorpora substratos e fluxos fisiologicamente relevantes que mimetizam a vasculatura e são, portanto, uma ferramenta valiosa para estudar aspectos de trombose e hemostasia. Em ambientes de alto cisalhamento simulando fluxo arterial, um ensaio microfluídico facilita o estudo da função plaquetária, pois trombos ricos em plaquetas se formam em uma região estenótica localizada de um canal de fluxo. A utilização de dispositivos que permitem um pequeno volume de amostra também pode ajudar na avaliação da função plaquetária sob fluxo de amostras de pacientes com volume limitado ou modelos animais. O estudo de amostras de pacientes com trauma ou amostras após transfusão de produtos plaquetários pode ajudar a direcionar estratégias terapêuticas para populações de pacientes nas quais a função plaquetária é crítica. Os efeitos da inibição plaquetária via agentes farmacológicos também podem ser estudados neste modelo. O objetivo deste protocolo é estabelecer uma plataforma microfluídica que incorpore fluxo fisiológico, superfícies biológicas e mecanismos hemostáticos relevantes para avaliar a função plaquetária com implicações para o estudo da coagulopatia induzida por trauma e medicina transfusional.
Introdução
O trauma é uma das principais causas globais de morte e incapacidade. A lesão grave é frequentemente complicada por um distúrbio endógeno único de hemostasia e trombose, denominado coagulopatia induzida por trauma (TIC)1. As plaquetas desempenham um papel crítico na TIC e foram descritas como tendo funções adaptativas e desadaptativas2. Os mecanismos da disfunção plaquetária após a lesão permanecem obscuros, e há uma necessidade crítica de entender melhor a resposta celular para orientar o desenvolvimento de ressuscitação e terapia aprimoradas. Um problema adicional incômodo em relação à função plaquetária após a lesão é a incerteza da confiabilidade das leituras atuais da função plaquetária no paciente traumatizado.
Vários estudos mostraram que mesmo pacientes levemente feridos, sem fenótipo de sangramento clínico conhecido, apresentam função plaquetária anormal usando testes convencionais de função plaquetária, como a agregometria 3,4. No entanto, as limitações na agregometria para avaliar a função plaquetária em um cenário de lesão incluem a falta de superfície de lesão fisiologicamente relevante, uma abordagem reducionista para estimulação agonista, diluição de amostra com agregometria de impedância de sangue total, separação de plasma com agregometria de transmissão de luz óptica e avaliação de amostra estagnada. Além disso, ainda não está claro se essa sensibilidade da função plaquetária representa disfunção celular verdadeira ou um artefato de medição, como aumento da impedância elétrica basal, no cenário de lesão2. Assim, estudar as funções plaquetárias relevantes no contexto do trauma é crucial para a compreensão da TIC, e há espaço substancial para inovação e melhoria nessa área.
As plataformas tradicionalmente usadas para estudar a função plaquetária não incluem dinâmica e fluxo de fluidos, o que pode ser crítico na compreensão da disfunção plaquetária relacionada ao trauma e à coagulopatia induzida por trauma5. Os mecanismos de hemostasia que dependem do fluxo incluem o alongamento do fator de von Willebrand (FVW) em alto cisalhamento, acima de uma taxa de cisalhamento crítica, e a captura de plaquetas via glicoproteína 1b 6,7,8, que não são capturadas usando ensaios de função plaquetária estagnada. Além disso, as plaquetas ligam-se preferencialmente ao FVW ou ao fibrinogênio, dependendo do regime de fluxo, e provocam papéis diferenciais na trombose arterial versus venosa 9,10. Os trombos arteriais são compostos principalmente de plaquetas, enquanto os trombos venosos são compostos principalmente de glóbulos vermelhos, baseados, em parte, em regimes de fluxo11. Ensaios que incorporam regimes de fluxo podem ajudar a elucidar disfunções pertencentes ao espectro de fenótipos de TIC, desde fenótipos de hipocoagulabilidade e sangramento até hipercoagulabilidade e fenótipos trombóticos. Finalmente, as restrições de amostragem de volume sanguíneo com populações de pacientes com trauma podem tornar os testes tradicionais da função plaquetária desafiadores. Embora ensaios como a citometria de fluxo possam e devam ser utilizados nessas circunstâncias, os resultados geralmente retratam uma caracterização física de uma amostra e não uma avaliação funcional hemostática.
Embora os mecanismos de disfunção plaquetária possam não ser completamente compreendidos no trauma, a modelagem da disfunção plaquetária in vitro, com antagonistas P2Y12, por exemplo, também pode ajudar a orientar o estudo de intervenções terapêuticas. A ressuscitação hemostática é extremamente importante em pacientes com trauma, onde os hemoderivados são transfundidos em uma abordagem equilibrada para tratar choque, coagulopatia e lesão endotelial com sangue total ou componentes sanguíneos (glóbulos vermelhos, plasma e concentrados de plaquetas) emuma proporção de 1:1:1 12,13,14. Em pacientes traumatizados, o uso precoce de hemoderivados está associado à melhora da sobrevida15,16. Para prolongar a vida útil, os produtos plaquetários armazenados a frio têm sido cada vez mais estudados. O exame de plaquetas armazenadas a frio mostra aumento da atividade hemostática, bem como segurança quando transfundidas após lesão17,18.
A evolução da ressuscitação plaquetária armazenada a frio enfatiza a necessidade de testes adicionais para entender o produto plaquetário mais eficaz disponível para trauma. No entanto, os ensaios tradicionais da função plaquetária são frequentemente superpotencializados ou subpotencializados para detectar disfunção, ocorrendo tanto no paciente traumatizado que recebe transfusão terapêutica de plaquetas quanto no próprio produto transfundido visto em lesões de armazenamento plaquetário. Determinar a origem da disfunção pode ser um desafio, dadas as limitações nos ensaios atuais da função plaquetária, incluindo a natureza estática da maioria desses testes. Portanto, ao estudar a ressuscitação hemostática in vitro, a plataforma e os métodos de detecção para as populações de plaquetas receptoras e do produto são de importância crítica na determinação das intervenções terapêuticas ideais.
O teste microfluídico oferece perfis de fluxo e superfícies biofidélicas para criar um ensaio fisiologicamente relevante para estudar as plaquetas. Os dispositivos microfluídicos podem ser personalizados para estudar fisiopatologia específica ou tipos de lesões, como punção do vaso19 ou dano endotelial20. Esses dispositivos são geralmente compostos de polidimetilsiloxano (PDMS) ligado a uma lâmina de microscópio de vidro com modificações de superfície, como colágeno, para imitar subendotélio e lesão tecidual. A utilização desses tipos de dispositivos baseados em fluxo pode ajudar a orientar a pesquisa de disfunção plaquetária relacionada ao trauma e auxiliar no exame de abordagens ideais de medicina transfusional para melhorar a disfunção plaquetária. Essas estratégias podem ajudar a esclarecer a confusão existente sobre a relevância dos ensaios estáticos de plaquetas, como a agregometria no paciente lesionado.
Protocolo
Todas as pesquisas foram realizadas de acordo com as diretrizes institucionais. A aprovação do Escritório de Proteção à Pesquisa Humana da Universidade de Pittsburgh foi obtida e o consentimento informado de voluntários humanos saudáveis foi obtido.
1. Preparação do dispositivo microfluídico
- Para fabricar a parte PDMS do dispositivo, prepare um molde mestre usando latão por meio de microusinagem de controle numérico computadorizado (CNC).
NOTA: Dependendo das dimensões do canal, técnicas de fotolitografia podem ser usadas para criar um molde mestre. O dispositivo usado neste protocolo inclui oito canais microusinados paralelos com aproximadamente 480 μm de largura, 140 μm de altura na entrada e saída do dispositivo e 40 μm de altura na estenose do dispositivo, com um comprimento de rampa de/para a região estenótica de aproximadamente 0,3 mm. Os comprimentos dos canais são de aproximadamente 6 mm. - Com um molde mestre obtido, despeje a Base de Elastômero de Silicone (obtida do kit de elastômero) em um prato de pesagem. Adicione o Agente de Cura de Silicone (obtido a partir do kit de elastômero), que facilita a reticulação das cadeias de polímero de silicone para transformar o PDMS líquido em um sólido durável e flexível, na proporção de 10:1 (agente base) e agite bem a mistura.
- Coloque o molde em uma placa de Petri e despeje o PDMS não curado no molde. Coloque a placa de Petri dentro de um dessecador a vácuo por 30 min para remover as bolhas.
- Termine de curar o PDMS no molde mestre, colocando-o em um forno regulado para 70 °C por 90 min.
- Após a cura completa do PDMS, corte o molde microfluídico usando uma lâmina de barbear ou bisturi. Faça furos nas bordas dos canais (1,5 mm de diâmetro em ambos os lados).
- Usando fita adesiva de laboratório, limpe a superfície de uma lâmina de vidro e o lado gravado do molde microfluídico. Use ar comprimido conforme necessário para remover os detritos restantes.
- Coloque a lâmina de vidro e o molde microfluídico com o lado gravado para cima em um limpador de plasma. Ligue a bomba de vácuo, sele a câmara e ligue o limpador de plasma para a configuração alta. Deixe a lâmina e o PDMS no limpador de plasma por 30 s, depois desligue o limpador de plasma e remova o vácuo.
- Amarre o molde limpo de plasma e a lâmina de vidro pressionando suavemente os lados que estavam voltados para cima no limpador de plasma. Em seguida, coloque o dispositivo microfluídico em um forno/placa de aquecimento a 70 °C por 10 min.
NOTA: Não aplique muita pressão ao unir o molde e a lâmina de vidro, pois isso pode levar a uma perda na morfologia do canal. - Enxágue cada câmara com 10-30 μL de etanol a 70% para esterilizar e deixe o dispositivo microfluídico secar em uma placa quente a 70 °C.
NOTA: Os dispositivos devem ser feitos com pelo menos 24 horas de antecedência, mas podem ser feitos com semanas a meses de antecedência. Os dispositivos devem ser armazenados em um recipiente hermético ou placa de Petri coberta em temperatura ambiente. - No dia anterior à experimentação com o dispositivo microfluídico, enxágue novamente cada câmara com 10-30 μL de etanol a 70% para esterilizar e deixe o dispositivo microfluídico secar em uma placa de aquecimento a 70 ° C.
- Cubra a câmara com reagente de colágeno fibrilar equino tipo 1 (1 mg / mL), diluído em NaCl a 0,9% em uma proporção volumétrica de 1: 5 através de uma saída designada para a entrada designada. Certifique-se de que a direcionalidade seja conservada em um experimento. Armazene o dispositivo em um recipiente fechado quente e úmido para evitar a evaporação do colágeno revestido dentro do canal.
- Após 1 h, enxágue com solução salina tamponada com fosfato (PBS) para remover a solução de colágeno. Nivele na direção oposta do revestimento. Quando não estiver em uso, guarde o dispositivo novamente em um recipiente quente, úmido e fechado.
2. Preparação da amostra de sangue
- Obter uma amostra de sangue total citrato por punção venosa. Incubar sangue total citrato com solução de bloqueio do receptor FC (1:600).
NOTA: As amostras de sangue são armazenadas em temperatura ambiente antes e durante a experimentação. - Incubar sangue total citrato com anticorpo CD41 conjugado com fluorescência (usando um fluoróforo de escolha) (1:600). Manchar por 30 min em um balancim nutatório.
- Como controle positivo para a inibição plaquetária, adicione Ticagrelor, um antagonista do receptor P2Y12 reconstituído em uma solução de 30% p / v de 2-hidroxipropil-β-ciclodextrina (HP-β-CD) em PBS.
NOTA: Estoques de ticagrelor de até 6,4 mM devem ser preparados e diluição adicional dos estoques de ticagrelor em solução de HP-β-CD (30% de HP-β-CD dissolvido em PBS) pode ser feita antes da experimentação (recomenda-se concentrações de estoque de 1.000x). - Incubar a amostra citrada com Ticagrelor (concentração final até 6,4 μM) durante 30 min para observar a inibição plaquetária.
- Se misturar o hemoderivado com a amostra citrata, corar o hemoderivado com solução de bloqueio do receptor FC (1:600) e anticorpo CD41 conjugado com fluorescência (usando um fluoróforo separado e distinto para a amostra citrato) (1:600).
- Misturar um equivalente volumétrico das unidades de produto transfundido com a amostra citrada. Por exemplo, para simular 2 unidades de produtos plaquetários transfundidos em uma pessoa com hemorragia (aproximadamente 250 mL por produto em um volume total de sangue de 5.000 mL), misture 100 μL de hemoderivado em 1.000 μL de amostra de sangue citrato.
- Imediatamente antes da experimentação, filtre a amostra de sangue através de um filtro de 40 μm em um tubo de microcentrífuga estéril de 1,5 mL.
3. Teste da função plaquetária sob fluxo (Método 1)
- Ligue o microscópio e o software associado.
- Defina o nível da bomba da seringa de retirada com o estágio do microscópio. Ajuste as configurações na bomba de seringa.
- Calcule uma taxa de fluxo volumétrico (Q) para uma taxa média de cisalhamento da parede desejada (γ) de 3.500 s-1 na região estenótica do canal usando as equações (1) e (2)21.
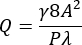 Características (1)
Características (1)
 (2)
(2)
Onde A é a área da seção transversal do canal, P é o perímetro molhado, λ é o fator de forma, b é o lado curto do retângulo (altura) e a é o lado longo do retângulo (largura).
NOTA: O valor de 3.500 s-1 é escolhido devido ao cisalhamento crítico do FVW e está no regime arterial 7,22,23.
- Calcule uma taxa de fluxo volumétrico (Q) para uma taxa média de cisalhamento da parede desejada (γ) de 3.500 s-1 na região estenótica do canal usando as equações (1) e (2)21.
- Coloque o dispositivo microfluídico no microscópio stage. Cole as bordas do dispositivo microfluídico no palco para evitar movimento. Certifique-se de que a saída esteja voltada para a parte traseira do microscópio.
- Conecte uma extremidade do tubo de 1/16" ID (aproximadamente 30 cm de comprimento) a um conector de cotovelo e a outra extremidade a uma seringa de 10 mL com conector de 1/16" ID.
- Encha a seringa com PBS estéril e conecte-a à bomba da seringa.
- Coloque o conector de cotovelo na saída do dispositivo.
- Prepare linhas de entrada com aproximadamente 10 cm de comprimento com o conector de cotovelo em uma extremidade e o corte angular na outra extremidade.
- Conecte o conector do cotovelo de entrada na entrada do dispositivo.
- Posicione a linha de entrada em um tubo de microcentrífuga residual em um suporte angular.
- Use a objetiva de 10x para dimensões de canal de aproximadamente 500 μm de largura e concentre-se nas bordas do canal do dispositivo microfluídico.
- Prepare as linhas com PBS e limpe o canal de qualquer PDMS/detritos avançando a bomba de seringa manualmente. Certifique-se de verificar perto da entrada e saída do canal.
- Abra as configurações de captura de imagem salva ou crie um procedimento de captura de imagem para imagens de séries temporais capturadas a cada 1–2 s com um canal de campo claro e canais fluorescentes correspondentes aos anticorpos CD41 fluorescentes usados na amostra de sangue.
- Obter a amostra de sangue citrato filtrado e misturar pipetando para cima e para baixo imediatamente antes da experiência. Coloque a amostra no suporte da microcentrífuga angular.
- Posicione a linha de entrada na amostra.
- Comece a gravar a captura de imagem.
- Lentamente, retire a seringa para preencher o volume morto no tubo. Assim que o sangue atingir o canal, aperte imediatamente o play na bomba da seringa para retomar o fluxo na taxa de cisalhamento desejada.
- Ajuste o foco, se necessário.
- Execute o experimento até que as plaquetas tenham ocluído completamente a região estenótica do dispositivo microfluídico ou até um ponto final experimental (ou seja, 10 min).
- Certifique-se de que o tubo de entrada esteja submerso na amostra de sangue durante o experimento.
- Quando o experimento estiver concluído, pare a captura de imagem e pare a bomba de seringa. Salve a captura de imagem.
- Remova o conector do cotovelo de entrada e esvazie o conteúdo da tubulação em uma cônica de resíduos. Esvazie também o conteúdo da seringa e das linhas de saída na cônica de resíduos.
- Substitua os conectores de entrada e saída e a tubulação conforme necessário para amostras subsequentes.
4. Teste da função plaquetária sob fluxo com amostras de baixo volume (abaixo de 1 mL) (Método 2)
- Repita as etapas 1.1 a 1.4 como acima.
- Perfure uma saída de 1,5 mm de diâmetro e uma entrada de 3 mm de diâmetro nas bordas dos canais.
- Repita as etapas 1.6 a 3.6 como acima.
- Use a objetiva de 10x para dimensões de canal de aproximadamente 500 μm de largura e concentre-se nas bordas do canal do dispositivo microfluídico.
- Limpe o canal de qualquer PDMS/detritos avançando a bomba da seringa manualmente e absorvendo o fluido de acesso com um lenço de laboratório. Remova quaisquer detritos com fita adesiva na parte superior do dispositivo microfluídico.
- Avance manualmente a bomba para encher o reservatório de entrada de 3 mm com PBS.
- Abra as configurações de captura de imagem salva ou crie um procedimento de captura de imagem para imagens de séries temporais capturadas a cada 1–2 s com um canal de campo claro e canais fluorescentes correspondentes aos anticorpos CD41 fluorescentes usados na amostra de sangue.
- Inicie a retirada na bomba de seringa (manualmente ou com velocidade definida) e assim que o PBS estiver avançando para o canal e a linha de enchimento no reservatório estiver diminuindo, pause a retirada na bomba.
- Remova o excesso de PBS do reservatório com uma pipeta.
- Inicie a captura de imagem.
- Pipetar a amostra de sangue para o reservatório (aproximadamente 40 μL) e iniciar imediatamente a seringa de retirada. Certifique-se de que o fluxo comece.
NOTA: Se o motor da bomba de seringa para retirada não foi preparado na etapa 4.8, o fluxo não começará imediatamente e o experimento deve ser repetido. - Reabasteça o reservatório de sangue durante o experimento, garantindo que nenhuma bolsa de ar entre no canal.
- Execute o experimento até que as plaquetas tenham ocluído completamente a região estenótica do dispositivo microfluídico ou até um ponto final experimental (ou seja, 10 min).
- Quando o experimento estiver concluído, pare a captura de imagem e pare a bomba de seringa. Salve a captura de imagem.
- Remova o excesso de sangue no reservatório pipetando. Esvazie o conteúdo do tubo de extração em um tubo cônico de resíduos.
- Substitua os conectores e a tubulação conforme necessário para amostras subsequentes.
5. Descontaminação
- Limpe as linhas de entrada e saída de sangue lavando em uma solução de alvejante a 10%.
- Se todos os canais do dispositivo microfluídico tiverem sido usados, descarte o dispositivo no recipiente de resíduos biológicos perigosos Sharps.
NOTA: Todos os resíduos biológicos devem ser descartados adequadamente em resíduos de risco biológico.
6. Análise de imagem
- Exporte as imagens de experimentos cinéticos usando software clicando em Arquivo | Exportação/Importação | Exportação.
- Selecione os seguintes parâmetros: tipo de arquivo: Formato de arquivo de imagem marcada (TIFF); compressão: LZW; verifique os dados originais e o deslocamento de pixel; desmarque Aplicar curva de exibição e cor do canal; marque Definir subconjunto (região, região do retângulo e selecione a área do canal com uma medida de conservação de largura e altura entre as condições). Exporte para a pasta desejada e marque Criar pasta.
- Observe os valores experimentais abaixo no software: iniciar o quadro quando o sangue entrar no canal; taxa de quadros (Info, Série Temporal).
- Meça a intensidade média de fluorescência normalizada de cada quadro em um experimento utilizando o código Matlab fornecido como Arquivo Suplementar 1, alterando as seguintes entradas para cada experimento: quadro inicial/quadro final com base na duração do experimento (certifique-se de que o comprimento do experimento seja conservado entre as condições); nome do experimento/nome da pasta; recortando os parâmetros X, Y, H e W. Execute o código uma vez para o canal fluorescente de plaquetas receptoras e uma vez para o canal fluorescente de plaquetas do produto. Relate os valores de MFI normalizados (coluna 2) e AUC normalizados (normalizados para o quadro inicial). Subtraia o valor de duração do experimento do valor de AUC normalizado.
Resultados
Experimentos microfluídicos após o uso deste método devem mostrar a formação de trombos ricos em plaquetas na região de estenose do canal de fluxo (Figura 1). A Figura 1A ilustra resultados representativos em que as plaquetas funcionais formaram um trombo na região estenótica do canal para bloquear o fluxo sanguíneo através do canal. As curvas de intensidade média de fluorescência (MFI) das imagens cinéticas obtidas...
Discussão
O protocolo acima tem algumas etapas críticas para garantir a confiabilidade e reprodutibilidade dos experimentos. Primeiro, os anticorpos fluorescentes devem ser cuidadosamente considerados. Os anticorpos usados para detectar plaquetas na amostra não devem bloquear a função do receptor plaquetário da glicoproteína Ib (GPIb). A correspondência de lotes, sempre que possível entre os experimentos, também é fundamental para garantir a reprodutibilidade do sinal fluorescente. Outra...
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Os autores reconhecem e agradecem a todos os doadores de sangue que participaram, bem como aos flebotomistas do Laboratório de Pesquisa em Medicina Transfusional e Trauma e ao Centro de Pesquisa Clínica e Translacional UPMC Montefiore pela assistência nas coletas. O SMS é suportado pelo K25HL161401. O MDN é suportado por 1R01HL166944-01A1.
Materiais
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
Referências
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112 (2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509 (2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502 (2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados