Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikrofluidik zur Beurteilung der Thrombozytenfunktion
In diesem Artikel
Zusammenfassung
Die Thrombozytenfunktion unter Fluss kann beurteilt und eine simulierte hämostatische Wiederbelebung mit einem mikrofluidischen Gerät modelliert werden, das in der Trauma- und Transfusionsmedizin Anwendung findet.
Zusammenfassung
Die Mikrofluidik enthält physiologisch relevante Substrate und Strömungen, die das Gefäßsystem nachahmen und daher ein wertvolles Werkzeug für die Untersuchung von Aspekten der Thrombose und Blutstillung sind. In Umgebungen mit hoher Scherung, die den arteriellen Fluss simulieren, erleichtert ein mikrofluidischer Assay die Untersuchung der Thrombozytenfunktion, da sich plättchenreiche Thromben in einem lokalisierten stenotischen Bereich eines Flusskanals bilden. Die Verwendung von Geräten, die ein kleines Probenvolumen ermöglichen, kann zusätzlich bei der Bewertung der Thrombozytenfunktion unter Fluss aus volumenbegrenzten Patientenproben oder Tiermodellen helfen. Die Untersuchung von Trauma-Patientenproben oder Proben nach einer Blutplättchenprodukttransfusion kann dazu beitragen, therapeutische Strategien für Patientenpopulationen zu entwickeln, bei denen die Thrombozytenfunktion kritisch ist. Auch die Auswirkungen der Thrombozytenhemmung über pharmakologische Wirkstoffe können in diesem Modell untersucht werden. Das Ziel dieses Protokolls ist es, eine mikrofluidische Plattform zu etablieren, die physiologische Strömungen, biologische Oberflächen und relevante hämostatische Mechanismen zur Beurteilung der Thrombozytenfunktion umfasst, was Auswirkungen auf die Erforschung der traumainduzierten Koagulopathie und der Transfusionsmedizin hat.
Einleitung
Traumata sind eine der weltweit häufigsten Ursachen für Tod und Behinderung. Schwere Verletzungen werden häufig durch eine einzigartige, endogene Störung der Blutstillung und Thrombose erschwert, die als traumainduzierte Koagulopathie (TIC) bezeichnet wird1. Blutplättchen spielen eine entscheidende Rolle bei der TIC und es wurde beschrieben, dass sie sowohl adaptive als auch maladaptive Funktionen haben2. Die Mechanismen der Thrombozytendysfunktion nach einer Verletzung sind nach wie vor unklar, und es besteht ein dringender Bedarf, die zelluläre Reaktion besser zu verstehen, um die Entwicklung einer verbesserten Wiederbelebung und Therapie zu steuern. Ein weiteres ärgerliches Problem in Bezug auf die Thrombozytenfunktion nach einer Verletzung ist die Unsicherheit der Zuverlässigkeit der vorliegenden Messwerte der Thrombozytenfunktion beim Traumapatienten.
Mehrere Studien haben gezeigt, dass selbst leicht verletzte Patienten ohne bekannten klinischen Blutungsphänotyp eine abnormale Thrombozytenfunktion aufweisen, wenn konventionelle Thrombozytenfunktionstests wie die Aggregometrieverwendet werden 3,4. Zu den Einschränkungen in der Aggregometrie zur Beurteilung der Thrombozytenfunktion in einer Verletzungssituation gehören jedoch das Fehlen einer physiologisch relevanten Verletzungsoberfläche, ein reduktionistischer Ansatz zur Agonistenstimulation, die Probenverdünnung mit Vollblutimpedanzaggregometrie, die Plasmatrennung mit optischer Lichttransmissionsaggregometrie und die stagnierende Probenbeurteilung. Darüber hinaus bleibt unklar, ob diese Empfindlichkeit der Thrombozytenfunktion eine echte zelluläre Dysfunktion oder ein Messartefakt, wie z. B. eine erhöhte elektrische Ausgangsimpedanz, im Rahmen einer Verletzung darstellt2. Daher ist die Untersuchung relevanter Thrombozytenfunktionen im Kontext von Traumata entscheidend für das Verständnis von TIC, und es gibt in diesem Bereich erheblichen Raum für Innovationen und Verbesserungen.
Plattformen, die traditionell zur Untersuchung der Thrombozytenfunktion verwendet werden, umfassen nicht die Fluiddynamik und -strömung, was für das Verständnis der Thrombozytendysfunktion im Zusammenhang mit Trauma und traumainduzierter Koagulopathie entscheidend sein kann5. Zu den Mechanismen der Hämostase, die vom Fluss abhängen, gehören die Elongation des von-Willebrand-Faktors (VWF) bei hoher Scherung, oberhalb einer kritischen Scherrate, und die Thrombozytenaufnahme über das Glykoprotein 1b 6,7,8, die nicht mit stagnierenden Thrombozytenfunktionsassays erfasst werden. Darüber hinaus binden Blutplättchen je nach Flussregime bevorzugt VWF oder Fibrinogen und lösen bei arteriellen und venösen Thrombosen unterschiedliche Rollen aus 9,10. Arterielle Thromben bestehen hauptsächlich aus Blutplättchen, während venöse Thromben hauptsächlich aus roten Blutkörperchen bestehen, was zum Teil auf Flussregimen beruht11. Assays, die Flussregime einbeziehen, können bei der Aufklärung von Funktionsstörungen im Zusammenhang mit dem Spektrum der TIC-Phänotypen helfen, von Hypokoagulabilität und Blutungsphänotypen bis hin zu Hyperkoagulabilität und thrombotischen Phänotypen. Schließlich können Einschränkungen bei der Blutvolumenentnahme bei Trauma-Patientenpopulationen traditionelle Thrombozytenfunktionstests zu einer Herausforderung machen. Während Assays wie die Durchflusszytometrie unter diesen Umständen verwendet werden können und sollten, zeigen die Ergebnisse oft eine physikalische Charakterisierung einer Probe und keine hämostatische funktionelle Bewertung.
Während die Mechanismen der Thrombozytendysfunktion bei Traumata möglicherweise nicht vollständig verstanden sind, kann die Modellierung der Thrombozytendysfunktion in vitro, z. B. mit P2Y12-Antagonisten, auch bei der Untersuchung therapeutischer Interventionen helfen. Die hämostatische Wiederbelebung ist bei Traumapatienten von entscheidender Bedeutung, bei denen Blutprodukte in einem ausgewogenen Ansatz transfundiert werden, um Schock, Gerinnungsstörungen und Endothelverletzungen entweder mit Vollblut oder Blutbestandteilen (rote Blutkörperchen, Plasma und Thrombozytenkonzentrate) in einem Einheitsverhältnis von 1:1:1zu behandeln 12,13,14. Bei Traumapatienten ist die frühe Einnahme von Blutprodukten mit einem verbesserten Überleben verbunden 15,16. Um die Haltbarkeit zu verlängern, wurden zunehmend kalt gelagerte Thrombozytenprodukte untersucht. Die Untersuchung von kalt gelagerten Blutplättchen zeigt eine erhöhte hämostatische Aktivität sowie Sicherheit bei der Transfusion nach einer Verletzung17,18.
Die Entwicklung der kaltgelagerten Thrombozytenreanimation unterstreicht die Notwendigkeit zusätzlicher Tests, um das wirksamste Thrombozytenprodukt zu verstehen, das bei Traumata verfügbar ist. Herkömmliche Thrombozytenfunktionsassays sind jedoch häufig über- oder unterpotenziert, um Funktionsstörungen zu erkennen, die sowohl bei dem Traumapatienten, der eine therapeutische Thrombozytentransfusion erhält, als auch bei dem transfundierten Produkt selbst auftritt, das bei Thrombozytenlagerungsläsionen auftritt. Die Bestimmung des Ursprungs einer Dysfunktion kann angesichts der Einschränkungen bei den derzeitigen Thrombozytenfunktionsassays, einschließlich der statischen Natur der meisten dieser Tests, eine Herausforderung darstellen. Daher sind bei der Untersuchung der hämostatischen Wiederbelebung in vitro die Plattform und die Nachweismethoden sowohl für die Empfänger- als auch für die Produktthrombozytenpopulation von entscheidender Bedeutung für die Bestimmung optimaler therapeutischer Interventionen.
Die mikrofluidische Untersuchung bietet Strömungsprofile und biofidele Oberflächen, um einen physiologisch relevanten Assay für die Untersuchung von Blutplättchen zu erstellen. Mikrofluidische Geräte können angepasst werden, um bestimmte Pathophysiologien oder Verletzungsarten zu untersuchen, wie z. B. Gefäßpunktion19 oder Endothelschädigung20. Diese Geräte bestehen im Allgemeinen aus Polydimethylsiloxan (PDMS), das mit Oberflächenmodifikationen wie Kollagen an einen Glasobjektträger gebunden ist, um Subendothel- und Gewebeverletzungen nachzuahmen. Die Verwendung dieser Art von flussbasierten Geräten kann bei der Erforschung traumabedingter Thrombozytendysfunktion hilfreich sein und bei der Untersuchung optimaler transfusionsmedizinischer Ansätze zur Verbesserung der Thrombozytendysfunktion helfen. Diese Strategien können dazu beitragen, die bestehende Verwirrung über die Relevanz statischer Thrombozytenassays wie der Aggregometrie beim verletzten Patienten zu klären.
Protokoll
Alle Untersuchungen wurden in Übereinstimmung mit den institutionellen Richtlinien durchgeführt. Es wurde die Genehmigung des Human Research Protection Office der University of Pittsburgh eingeholt und die Einverständniserklärung gesunder menschlicher Freiwilliger eingeholt.
1. Vorbereitung des mikrofluidischen Geräts
- Um den PDMS-Teil des Geräts herzustellen, bereiten Sie eine Urform aus Messing durch CNC-Mikrobearbeitung (Computer Numerical Control) vor.
HINWEIS: Abhängig von den Kanalabmessungen können Fotolithographietechniken verwendet werden, um eine Urform zu erstellen. Die in diesem Protokoll verwendete Vorrichtung umfasst acht parallele mikromaschinell bearbeitete Kanäle mit einer Breite von etwa 480 μm, einer Höhe von 140 μm am Einlass und Auslass der Vorrichtung und einer Höhe von 40 μm an der Stenose der Vorrichtung, mit einer Rampenlänge zum/vom stenotischen Bereich von etwa 0,3 mm. Die Kanallängen betragen ca. 6 mm. - Gießen Sie mit einer erhaltenen Urform die Silikonelastomerbasis (aus dem Elastomer-Kit) in eine Wiegeschale. Fügen Sie das Silikonhärtungsmittel (aus dem Elastomer-Kit) hinzu, das die Vernetzung der Silikonpolymerketten erleichtert, um das flüssige PDMS in einen haltbaren und flexiblen Feststoff im Verhältnis 10:1 (Basismittel) umzuwandeln, und rühren Sie die Mischung gut um.
- Lege die Form in eine Petrischale und gieße das nicht ausgehärtete PDMS auf die Form. Stellen Sie die Petrischale für 30 Minuten in einen Vakuumexsikkator, um Blasen zu entfernen.
- Beenden Sie die Aushärtung des PDMS in der Urform, indem Sie es für 90 min in einen auf 70 °C eingestellten Ofen stellen.
- Schneiden Sie nach vollständiger PDMS-Aushärtung den mikrofluidischen Abdruck mit einer Rasierklinge oder einem Skalpell aus. Stanzen Sie Löcher an den Rändern der Kanäle (1,5 mm Durchmesser auf beiden Seiten).
- Reinigen Sie mit Laborklebeband die Oberfläche eines Objektträgers und die geätzte Seite des mikrofluidischen Abgusses. Verwenden Sie bei Bedarf Druckluft, um verbleibende Ablagerungen zu entfernen.
- Legen Sie den Objektträger und den mikrofluidischen Abguss mit der geätzten Seite nach oben in einen Plasmareiniger. Starten Sie die Vakuumpumpe, verschließen Sie die Kammer und schalten Sie den Plasmareiniger auf die hohe Stufe ein. Lassen Sie den Objektträger und das PDMS 30 s lang im Plasmareiniger, schalten Sie dann den Plasmareiniger aus und entfernen Sie den Staubsauger.
- Binden Sie den plasmagereinigten Guss und den Glasobjektträger zusammen, indem Sie die Seiten, die im Plasmareiniger nach oben lagen, vorsichtig zusammendrücken. Stellen Sie dann das mikrofluidische Gerät für 10 Minuten bei 70 °C in einen Ofen/eine Kochplatte.
HINWEIS: Üben Sie nicht zu viel Druck aus, wenn Sie den Guss und den Glasobjektträger miteinander verbinden, da dies zu einem Verlust der Kanalmorphologie führen kann. - Spülen Sie jede Kammer mit 10-30 μl 70%igem Ethanol, um es zu sterilisieren und das mikrofluidische Gerät auf einer 70 °C heißen Platte trocknen zu lassen.
HINWEIS: Geräte sollten mindestens 24 Stunden im Voraus hergestellt werden, können aber auch Wochen bis Monate im Voraus hergestellt werden. Die Geräte sollten in einem luftdichten Behälter oder einer abgedeckten Petrischale bei Raumtemperatur gelagert werden. - Spülen Sie am Tag vor dem Experimentieren mit dem mikrofluidischen Gerät jede Kammer erneut mit 10-30 μl 70%igem Ethanol, um es zu sterilisieren und das mikrofluidische Gerät auf einer 70 °C-Heizplatte trocknen zu lassen.
- Die Kammer wird mit einem Typ 1 Fibrillärkollagenreagenz (1 mg/ml) bestrichen, das in 0,9 % NaCl in einem volumetrischen Verhältnis von 1:5 durch einen dafür vorgesehenen Auslass zum vorgesehenen Einlass verdünnt wird. Stellen Sie sicher, dass die Richtungsabhängigkeit innerhalb eines Experiments beibehalten wird. Lagern Sie das Gerät in einem warmen, feuchten, geschlossenen Behälter, um eine Verdunstung des beschichteten Kollagens im Kanal zu verhindern.
- Nach 1 h mit phosphatgepufferter Kochsalzlösung (PBS) spülen, um die Kollagenlösung auszuspülen. Bündig in die entgegengesetzte Richtung der Beschichtung. Bewahren Sie das Gerät bei Nichtgebrauch wieder in einem warmen, feuchten, geschlossenen Behälter auf.
2. Vorbereitung der Blutprobe
- Entnehmen Sie eine Citrat-Vollblutprobe durch Venenpunktion. Inkubieren Sie citriertes Vollblut mit einer FC-Rezeptor-Blockierungslösung (1:600).
HINWEIS: Blutproben werden vor und während des Experiments bei Raumtemperatur gelagert. - Inkubieren Sie citriertes Vollblut mit fluoreszenzkonjugiertem (unter Verwendung eines Fluorophors Ihrer Wahl) CD41-Antikörper (1:600). 30 min lang auf eine Nutenwippe auftragen.
- Als Positivkontrolle für die Thrombozytenhemmung fügen Sie Ticagrelor hinzu, einen P2Y12-Rezeptorantagonisten, der in einer Lösung von 30 % w/v 2-Hydroxypropyl-β-cyclodextrin (HP-β-CD) in PBS rekonstituiert wird.
HINWEIS: Ticagrelor-Bestände bis zu 6,4 mM sollten hergestellt werden und eine weitere Verdünnung der Ticagrelor-Bestände in HP-β-CD-Lösung (30 % HP-β-CD gelöst in PBS) kann vor dem Versuch erfolgen (empfohlen werden 1.000-fache Stammkonzentrationen). - Inkubieren Sie die citrierte Probe 30 Minuten lang mit Ticagrelor (Endkonzentration bis zu 6,4 μM), um die Thrombozytenhemmung zu beobachten.
- Wenn Sie das Blutprodukt mit der Citratprobe mischen, färben Sie das Blutprodukt mit einer FC-Rezeptorblockierungslösung (1:600) und einem fluoreszenzkonjugierten (unter Verwendung eines separaten und von der Citratprobe getrennten Fluorophors) CD41-Antikörpers (1:600).
- Mischen Sie ein volumetrisches Äquivalent der transfundierten Produkteinheiten mit der Citratprobe. Um beispielsweise 2 Einheiten von Thrombozytenprodukten zu simulieren, die in eine blutende Person transfundiert werden (ca. 250 ml pro Produkt in einem Gesamtblutvolumen von 5.000 ml), mischen Sie 100 μl Blutprodukt in 1.000 μl Citratblutprobe.
- Unmittelbar vor dem Experimentieren filtrieren Sie die Blutprobe durch einen 40-μm-Filter in ein steriles 1,5-ml-Mikrozentrifugenröhrchen.
3. Prüfung der Thrombozytenfunktion unter Durchfluss (Methode 1)
- Schalten Sie das Mikroskop und die zugehörige Software ein.
- Stellen Sie die Pumpe einer Entnahmespritze auf eine Höhe mit dem Tisch des Mikroskops ein. Passen Sie die Einstellungen an der Spritzenpumpe an.
- Berechnen Sie einen volumetrischen Durchfluss (Q) für eine gewünschte durchschnittliche Wandscherrate (γ) von 3.500 s-1 im stenotischen Bereich des Kanals unter Verwendung der Gleichungen (1) und (2)21.
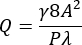 (1)
(1)
 (2)
(2)
Dabei ist A die Querschnittsfläche des Kanals, P der benetzte Umfang, λ der Formfaktor, b die kurze Seite des Rechtecks (Höhe) und a die lange Seite des Rechtecks (Breite).
HINWEIS: Der Wert von 3.500 s-1 wurde aufgrund der kritischen VWF-Scherung gewählt und liegt im arteriellen Regime 7,22,23.
- Berechnen Sie einen volumetrischen Durchfluss (Q) für eine gewünschte durchschnittliche Wandscherrate (γ) von 3.500 s-1 im stenotischen Bereich des Kanals unter Verwendung der Gleichungen (1) und (2)21.
- Platzieren Sie das mikrofluidische Gerät auf dem Mikroskoptisch. Kleben Sie die Kanten des mikrofluidischen Geräts an den Tisch, um Bewegungen zu vermeiden. Stellen Sie sicher, dass der Auslass zur Rückseite des Mikroskops zeigt.
- Verbinden Sie ein Ende des 1/16" ID-Schlauchs (ca. 30 cm lang) mit einem Winkelanschluss und das andere Ende mit einer 10 mL Spritze mit 1/16" ID Anschluss.
- Füllen Sie die Spritze mit sterilem PBS und schließen Sie sie an die Spritzenpumpe an.
- Stecken Sie den Winkelstecker in die Gerätesteckdose.
- Bereiten Sie ca. 10 cm lange Einlaufleitungen vor, mit dem Winkelverbinder an einem Ende und dem abgewinkelten Schnitt am anderen Ende.
- Verbinden Sie den Einlass-Winkelstecker mit dem Geräteeinlass.
- Positionieren Sie die Einlaufleitung in einem Abfall-Mikrozentrifugenröhrchen auf einem abgewinkelten Halter.
- Verwenden Sie das 10-fach-Objektiv für Kanalabmessungen mit einer Breite von ca. 500 μm und fokussieren Sie sich auf die Kanalkanten des mikrofluidischen Geräts.
- Grundieren Sie die Leitungen mit PBS und befreien Sie den Kanal von PDMS/Schmutz, indem Sie die Spritzenpumpe manuell vorschieben. Achten Sie darauf, in der Nähe des Kanaleinlasses und -auslasses zu prüfen.
- Öffnen Sie die gespeicherten Bildaufnahmeeinstellungen oder erstellen Sie ein Bildaufnahmeverfahren für Zeitreihenbilder, die alle 1–2 s mit einem Hellfeldkanal und Fluoreszenzkanälen aufgenommen werden, die den in der Blutprobe verwendeten fluoreszierenden CD41-Antikörpern entsprechen.
- Entnehmen Sie die gefilterte Citratblutprobe und mischen Sie sie, indem Sie sie kurz vor dem Experiment auf und ab pipettieren. Legen Sie die Probe auf den abgewinkelten Mikrozentrifugenhalter.
- Positionieren Sie die Einlassleitung in der Probe.
- Starten Sie die Aufnahme der Bildaufnahme.
- Ziehen Sie die Spritze langsam heraus, um das Totvolumen im Schlauch zu füllen. Sobald das Blut den Kanal erreicht, drücken Sie sofort auf Play an der Spritzenpumpe, um den Fluss mit der gewünschten Schergeschwindigkeit fortzusetzen.
- Passen Sie den Fokus bei Bedarf an.
- Führen Sie das Experiment so lange durch, bis die Blutplättchen den stenotischen Bereich des mikrofluidischen Geräts vollständig verschlossen haben oder bis zu einem experimentellen Endpunkt (d. h. 10 Minuten).
- Stellen Sie sicher, dass der Einlassschlauch für die Dauer des Experiments in die Blutprobe eingetaucht ist.
- Sobald das Experiment abgeschlossen ist, stoppen Sie die Bilderfassung und stoppen Sie die Spritzenpumpe. Speichern Sie die Bildaufnahme.
- Entfernen Sie den Einlasswinkelverbinder und entleeren Sie den Inhalt des Schlauchs in einen konischen Ablauf. Entleeren Sie den Inhalt der Spritze und der Auslassleitungen ebenfalls in den konischen Abfall.
- Ersetzen Sie die Einlass- und Auslassanschlüsse sowie die Schläuche bei Bedarf für nachfolgende Proben.
4. Prüfung der Thrombozytenfunktion im Fluss mit Proben mit geringem Volumen (unter 1 ml) (Methode 2)
- Wiederholen Sie die Schritte 1.1 bis 1.4 wie oben.
- Stanzen Sie an den Rändern der Kanäle einen Auslass mit einem Durchmesser von 1,5 mm und einen Einlass mit einem Durchmesser von 3 mm.
- Wiederholen Sie die Schritte 1.6 bis 3.6 wie oben.
- Verwenden Sie das 10-fach-Objektiv für Kanalabmessungen mit einer Breite von ca. 500 μm und fokussieren Sie sich auf die Kanalkanten des mikrofluidischen Geräts.
- Befreien Sie den Kanal von PDMS/Schmutz, indem Sie die Spritzenpumpe manuell vorschieben und die Zugangsflüssigkeit mit einem Labortuch ableiten. Entfernen Sie alle Rückstände mit Laborklebeband auf der Oberseite des mikrofluidischen Geräts.
- Schieben Sie die Pumpe manuell vor, um den 3-mm-Einlassbehälter mit PBS zu füllen.
- Öffnen Sie die gespeicherten Bildaufnahmeeinstellungen oder erstellen Sie ein Bildaufnahmeverfahren für Zeitreihenbilder, die alle 1–2 s mit einem Hellfeldkanal und Fluoreszenzkanälen aufgenommen werden, die den in der Blutprobe verwendeten fluoreszierenden CD41-Antikörpern entsprechen.
- Starten Sie die Entnahme an der Spritzenpumpe (manuell oder mit eingestellter Drehzahl) und unterbrechen Sie die Entnahme an der Pumpe, sobald PBS in den Kanal vordringt und die Füllleitung im Behälter abnimmt.
- Entfernen Sie überschüssiges PBS mit einer Pipette aus dem Reservoir.
- Starten Sie die Bildaufnahme.
- Pipettieren Sie die Blutprobe in das Reservoir (ca. 40 μl) und starten Sie sofort die Entnahmespritze. Stellen Sie sicher, dass der Ablauf gestartet wird.
HINWEIS: Wenn der Motor der Spritzenpumpe für die Entnahme in Schritt 4.8 nicht vorbereitet wurde, beginnt der Durchfluss nicht sofort und der Versuch sollte wiederholt werden. - Füllen Sie das Blutreservoir für die Dauer des Experiments wieder auf und stellen Sie sicher, dass keine Lufteinschlüsse in den Kanal gelangen.
- Führen Sie das Experiment so lange durch, bis die Blutplättchen den stenotischen Bereich des mikrofluidischen Geräts vollständig verschlossen haben oder bis zu einem experimentellen Endpunkt (d. h. 10 Minuten).
- Sobald das Experiment abgeschlossen ist, stoppen Sie die Bildaufnahme und stoppen Sie die Spritzenpumpe. Speichern Sie die Bildaufnahme.
- Entfernen Sie überschüssiges Blut aus dem Reservoir durch Pipettieren. Entleeren Sie den Inhalt des Entnahmeschlauchs in ein konisches Abfallrohr.
- Ersetzen Sie die Anschlüsse und Schläuche bei Bedarf für nachfolgende Proben.
5. Dekontamination
- Befreien Sie die Ein- und Auslassleitungen von Blut, indem Sie es in eine 10%ige Bleichlösung spülen.
- Wenn alle Kanäle des mikrofluidischen Geräts verwendet wurden, entsorgen Sie das Gerät im Behälter für biogefährliche Abfälle von Sharps.
HINWEIS: Alle biologischen Abfälle sollten ordnungsgemäß in biologisch gefährlichen Abfällen entsorgt werden.
6. Bildanalyse
- Exportieren Sie die Bilder aus kinetischen Experimenten mit Hilfe der Software, indem Sie auf Datei | Exportieren/Importieren | Exportieren.
- Wählen Sie die folgenden Parameter aus: Dateityp: Tagged Image File Format (TIFF); Kompression: LZW; Aktivieren Sie Originaldaten und Pixel verschieben. Deaktivieren Sie die Option Anzeigekurve und Kanalfarbe anwenden. Aktivieren Sie die Option Teilmenge definieren (Bereich, Rechteckbereich) und wählen Sie den Kanalbereich aus, bei dem die Breiten- und Höhenmessung zwischen den Bedingungen beibehalten wird. Exportieren Sie in den gewünschten Ordner und aktivieren Sie Ordner erstellen.
- Beachten Sie die folgenden experimentellen Werte in der Software: Starten Sie den Rahmen , wenn Blut in den Kanal eintritt; Bildrate (Info, Zeitreihe).
- Messen Sie die normierte mittlere Fluoreszenzintensität jedes Frames in einem Experiment unter Verwendung des Matlab-Codes, der als ergänzende Datei 1 bereitgestellt wird, und ändern Sie die folgenden Eingaben für jedes Experiment: Start-Frame/End-Frame basierend auf der Experimentlänge (stellen Sie sicher, dass die Experimentlänge zwischen den Bedingungen erhalten bleibt); Name des Experiments/Ordnername; Zuschneiden der Parameter X, Y, H und W. Führen Sie den Code einmal für den Thrombozyten-Fluoreszenzkanal des Empfängers und einmal für den Thrombozyten-Fluoreszenzkanal des Produkts aus. Melden Sie normalisierte MFI- (Spalte 2) und normalisierte AUC-Werte (normalisiert auf Start-Frame). Subtrahieren Sie den Wert für die Experimentlänge vom normalisierten AUC-Wert.
Ergebnisse
Mikrofluidische Experimente, die auf diese Methode folgen, sollten eine thrombozytenreiche Thrombenbildung im Bereich der Stenose des Strömungskanals zeigen (Abbildung 1). Abbildung 1A zeigt repräsentative Ergebnisse, bei denen funktionelle Blutplättchen einen Thrombus im stenotischen Bereich des Kanals bildeten, um den Blutfluss durch den Kanal zu blockieren. Mittlere Fluoreszenzintensitätskurven (MFI) von kinetischen Bilde...
Diskussion
Das obige Protokoll umfasst einige kritische Schritte, um die Zuverlässigkeit und Reproduzierbarkeit von Experimenten zu gewährleisten. Zunächst sollten fluoreszierende Antikörper sorgfältig in Betracht gezogen werden. Die Antikörper, die zum Nachweis von Blutplättchen in der Probe verwendet werden, sollten die Funktion des Glykoprotein-Ib (GPIb)-Thrombozytenrezeptors nicht blockieren. Der Chargenabgleich, wann immer dies zwischen den Experimenten möglich ist, ist ebenfalls entsc...
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Die Autoren danken allen Blutspendern, die teilgenommen haben, sowie den Phlebotomisten des Trauma and Transfusion Medicine Research Lab und dem UPMC Montefiore Clinical and Translational Research Center für die Unterstützung bei der Sammlung. SMS wird von K25HL161401 unterstützt. MDN wird unterstützt von 1R01HL166944-01A1.
Materialien
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
Referenzen
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112 (2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509 (2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502 (2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten