Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La microfluidique dans l’évaluation de la fonction plaquettaire
Dans cet article
Résumé
La fonction plaquettaire sous flux peut être évaluée et la réanimation hémostatique simulée peut être modélisée à l’aide d’un dispositif microfluidique, qui a des applications en traumatologie et en médecine transfusionnelle.
Résumé
La microfluidique incorpore des substrats et des écoulements physiologiquement pertinents qui imitent le système vasculaire et constituent donc un outil précieux pour étudier les aspects de la thrombose et de l’hémostase. Dans des environnements à fort cisaillement simulant un flux artériel, un test microfluidique facilite l’étude de la fonction plaquettaire, car des thrombus riches en plaquettes se forment dans une région sténosée localisée d’un canal d’écoulement. L’utilisation de dispositifs qui permettent de réduire le volume d’échantillon peut également aider à évaluer la fonction plaquettaire en flux à partir d’échantillons de patients ou de modèles animaux à volume limité. L’étude d’échantillons de patients traumatisés ou d’échantillons après une transfusion de produits plaquettaires peut aider à orienter les stratégies thérapeutiques pour les populations de patients dans lesquelles la fonction plaquettaire est essentielle. Les effets de l’inhibition plaquettaire via des agents pharmacologiques peuvent également être étudiés dans ce modèle. L’objectif de ce protocole est d’établir une plateforme microfluidique qui intègre le flux physiologique, les surfaces biologiques et les mécanismes hémostatiques pertinents pour évaluer la fonction plaquettaire avec des implications pour l’étude de la coagulopathie induite par un traumatisme et de la médecine transfusionnelle.
Introduction
Les traumatismes sont l’une des principales causes mondiales de décès et d’invalidité. Les lésions graves sont souvent compliquées par une perturbation endogène unique de l’hémostase et de la thrombose, appelée coagulopathie induite par un traumatisme (TIC)1. Les plaquettes jouent un rôle essentiel dans les TIC, et elles ont été décrites comme ayant des fonctions adaptatives et inadaptées2. Les mécanismes de la dysfonction plaquettaire après une blessure restent incertains, et il est essentiel de mieux comprendre la réponse cellulaire pour guider le développement d’une réanimation et d’un traitement améliorés. Un autre problème épineux concernant la fonction plaquettaire après une blessure est l’incertitude de la fiabilité des lectures actuelles de la fonction plaquettaire chez le patient traumatisé.
De nombreuses études ont montré que même les patients légèrement blessés, sans phénotype clinique de saignement connu, ont une fonction plaquettaire anormale à l’aide de tests conventionnels de la fonction plaquettaire tels que l’agrégométrie 3,4. Cependant, les limites de l’aggrégométrie pour évaluer la fonction plaquettaire dans un contexte de blessure comprennent l’absence de surface de blessure physiologiquement pertinente, une approche réductionniste de la stimulation par agoniste, la dilution de l’échantillon avec l’agrégation d’impédance du sang total, la séparation du plasma avec l’agrégation de transmission optique de la lumière et l’évaluation de l’échantillon stagnant. De plus, il n’est pas clair si cette sensibilité de la fonction plaquettaire représente un véritable dysfonctionnement cellulaire ou un artefact de mesure, tel qu’une augmentation de l’impédance électrique de base, dans le cadre de la lésion2. Ainsi, l’étude des fonctions plaquettaires pertinentes dans le contexte d’un traumatisme est cruciale pour comprendre les TIC, et il y a une marge d’innovation et d’amélioration substantielle dans ce domaine.
Les plateformes traditionnellement utilisées pour étudier la fonction plaquettaire n’incluent pas la dynamique des fluides et l’écoulement, ce qui peut être essentiel pour comprendre le dysfonctionnement plaquettaire lié aux traumatismes et à la coagulopathie induite par un traumatisme5. Les mécanismes de l’hémostase qui dépendent du flux comprennent l’élongation du facteur de von Willebrand (VWF) à fort cisaillement, au-dessus d’un taux de cisaillement critique, et la capture plaquettaire via la glycoprotéine 1b 6,7,8, qui ne sont pas capturées à l’aide de tests de fonction plaquettaire stagnante. De plus, les plaquettes se lient préférentiellement au VWF ou au fibrinogène en fonction du régime d’écoulement et jouent des rôles différentiels dans la thrombose artérielle par rapport à la thrombose veineuse 9,10. Les thrombus artériels sont principalement constitués de plaquettes, tandis que les thrombus veineux sont principalement composés de globules rouges, en partie sur les régimes de flux11. Les dosages qui intègrent les régimes d’écoulement peuvent aider à élucider les dysfonctionnements relatifs au spectre des phénotypes TIC, de l’hypocoagulabilité et des phénotypes hémorragiques à l’hypercoagulabilité et aux phénotypes thrombotiques. Enfin, les contraintes d’échantillonnage du volume sanguin avec les populations de patients traumatisés peuvent rendre difficiles les tests traditionnels de la fonction plaquettaire. Bien que des tests tels que la cytométrie en flux puissent et doivent être utilisés dans ces circonstances, les résultats décrivent souvent une caractérisation physique d’un échantillon et non une évaluation fonctionnelle hémostatique.
Bien que les mécanismes de la dysfonction plaquettaire ne soient pas complètement compris dans les traumatismes, la modélisation de la dysfonction plaquettaire in vitro, avec des antagonistes de P2Y12 par exemple, peut également aider à guider l’étude des interventions thérapeutiques. La réanimation hémostatique est d’une importance cruciale chez les patients traumatisés où les produits sanguins sont transfusés dans une approche équilibrée pour traiter le choc, la coagulopathie et les lésions endothéliales avec du sang total ou des composants sanguins (globules rouges, plasma et concentrés de plaquettes) dans un rapport unitaire de 1:1:1 12,13,14. Chez les patients traumatisés, l’utilisation précoce de produits sanguins est associée à une amélioration de la survie15,16. Pour prolonger la durée de conservation, les produits plaquettaires conservés au froid sont de plus en plus étudiés. L’examen des plaquettes stockées au froid montre une activité hémostatique accrue, ainsi qu’une sécurité lors de la transfusion après une blessure17,18.
L’évolution de la réanimation plaquettaire conservée au froid souligne la nécessité de tests supplémentaires pour comprendre le produit plaquettaire le plus efficace disponible pour les traumatismes. Cependant, les tests traditionnels de la fonction plaquettaire sont souvent sur- ou sous-potentialisés pour détecter le dysfonctionnement, survenant à la fois chez le patient traumatisé recevant une transfusion de plaquettes thérapeutique et dans le produit transfusé lui-même observé dans les lésions de stockage plaquettaire. Déterminer l’origine du dysfonctionnement peut être difficile, compte tenu des limites des tests actuels de la fonction plaquettaire, y compris la nature statique de la plupart de ces tests. Par conséquent, lors de l’étude de la réanimation hémostatique in vitro, la plateforme et les méthodes de détection pour les populations de plaquettes du receveur et du produit sont d’une importance cruciale pour déterminer les interventions thérapeutiques optimales.
Les tests microfluidiques offrent des profils d’écoulement et des surfaces biofidéliques pour créer un test physiologiquement pertinent sur lequel étudier les plaquettes. Les dispositifs microfluidiques peuvent être personnalisés pour étudier une physiopathologie ou des types de blessures particuliers, tels que la perforation des vaisseaux19 ou les lésions endothéliales20. Ces dispositifs sont généralement composés de polydiméthylsiloxane (PDMS) lié à une lame de microscope en verre avec des modifications de surface, telles que le collagène, pour imiter les lésions sous-endothéliales et tissulaires. L’utilisation de ces types de dispositifs basés sur le flux peut aider à guider la recherche sur la dysfonction plaquettaire liée aux traumatismes et à examiner les approches optimales de la médecine transfusionnelle pour améliorer la dysfonction plaquettaire. Ces stratégies peuvent aider à dissiper la confusion existante quant à la pertinence des dosages plaquettaires statiques, tels que l’agrégométrie chez le patient blessé.
Protocole
Toutes les recherches ont été effectuées dans le respect des directives institutionnelles. L’approbation du Bureau de protection de la recherche humaine de l’Université de Pittsburgh a été obtenue et le consentement éclairé de volontaires humains en bonne santé a été obtenu.
1. Préparation du dispositif microfluidique
- Pour fabriquer la partie PDMS de l’appareil, préparez un moule maître à l’aide de laiton via un micro-usinage à commande numérique par ordinateur (CNC).
REMARQUE : Selon les dimensions du canal, des techniques de photolithographie peuvent être utilisées pour créer un moule maître. Le dispositif utilisé dans ce protocole comprend huit canaux micro-usinés parallèles d’environ 480 μm de large, 140 μm de haut à l’entrée et à la sortie du dispositif, et 40 μm de haut à la sténose du dispositif, avec une longueur de rampe vers/depuis la région sténosée d’environ 0,3 mm. La longueur des canaux est d’environ 6 mm. - Avec un moule maître obtenu, versez la Base en Élastomère de Silicone (obtenue à partir du kit élastomère) dans un plat de pesée. Ajouter l’agent de durcissement du silicone (obtenu à partir du kit élastomère), qui facilite la réticulation des chaînes de polymère de silicone pour transformer le PDMS liquide en un solide durable et flexible, dans un rapport de 10:1 (agent de base) et bien mélanger le mélange.
- Placez le moule dans une boîte de Pétri et versez le PDMS non durci sur le moule. Placez la boîte de Pétri à l’intérieur d’un dessiccateur sous vide pendant 30 min pour éliminer les bulles.
- Terminez le durcissement du PDMS dans le moule maître en le plaçant dans un four réglé à 70 °C pendant 90 min.
- Après un durcissement complet du PDMS, découpez le plâtre microfluidique à l’aide d’une lame de rasoir ou d’un scalpel. Percez des trous sur les bords des canaux (1,5 mm de diamètre des deux côtés).
- À l’aide de ruban adhésif de laboratoire, nettoyez la surface d’une lame de verre et le côté gravé de la fonte microfluidique. Utilisez de l’air comprimé au besoin pour enlever les débris restants.
- Placez la lame de verre et la coulée microfluidique avec le côté gravé vers le haut dans un nettoyant plasma. Démarrez la pompe à vide, scellez la chambre et allumez le nettoyeur plasma à haut niveau. Laissez la glissière et le PDMS dans le nettoyeur plasma pendant 30 s, puis éteignez le nettoyeur plasma et retirez l’aspirateur.
- Liez le coulé nettoyé au plasma et la lame de verre ensemble en appuyant doucement ensemble sur les côtés qui étaient face vers le haut dans le nettoyant plasma. Ensuite, placez le dispositif microfluidique dans un four/plaque chauffante à 70 °C pendant 10 min.
REMARQUE : N’appliquez pas trop de pression lors du collage de la coulée et de la lame de verre ensemble, car cela pourrait entraîner une perte de morphologie du canal. - Rincez chaque chambre avec 10 à 30 μL d’éthanol à 70 % pour stériliser et laissez sécher le dispositif microfluidique sur une plaque chauffante à 70 °C.
REMARQUE : Les appareils doivent être fabriqués au moins 24 h à l’avance, mais peuvent être fabriqués des semaines ou des mois à l’avance. Les appareils doivent être conservés dans un contenant hermétique ou une boîte de Pétri couverte à température ambiante. - La veille de l’expérimentation avec le dispositif microfluidique, rincez à nouveau chaque chambre avec 10 à 30 μL d’éthanol à 70 % pour stériliser et laissez sécher le dispositif microfluidique sur une plaque chauffante à 70 °C.
- Enduire la chambre d’un réactif de collagène fibrillaire équin de type 1 (1 mg/mL), dilué dans 0,9 % de NaCl dans un rapport volumétrique de 1:5 à travers une sortie désignée vers l’entrée désignée. Assurez-vous que la directionnalité est conservée dans une expérience. Stockez l’appareil dans un récipient fermé chaud et humide pour éviter l’évaporation du collagène enrobé dans le canal.
- Après 1 h, rincez avec une solution saline tamponnée au phosphate (PBS) pour rincer la solution de collagène. Affleurer dans le sens opposé du revêtement. Lorsqu’il n’est pas utilisé, rangez à nouveau l’appareil dans un récipient chaud, humide et fermé.
2. Préparation de l’échantillon de sang
- Obtenez un échantillon de sang total citraté par ponction veineuse. Incuber du sang total citraté avec une solution bloquant les récepteurs FC (1:600).
REMARQUE : Les échantillons de sang sont conservés à température ambiante avant et pendant l’expérimentation. - Incuber du sang total citrated avec un anticorps CD41 conjugué à la fluorescence (à l’aide d’un fluorophore de votre choix) (1:600). Colorer pendant 30 min sur une bascule à nutation.
- Comme contrôle positif de l’inhibition plaquettaire, ajoutez du Ticagrelor, un antagoniste des récepteurs P2Y12 reconstitué dans une solution de 2-hydroxypropyl-β-cyclodextrine à 30 % p/v (HP-β-CD) dans du PBS.
REMARQUE : Des souches de Ticagrelor allant jusqu’à 6,4 mM doivent être préparées et une dilution supplémentaire des souches de Ticagrelor dans une solution de HP-β-CD (30 % de HP-β-CD dissous dans du PBS) peut être effectuée avant l’expérimentation (des concentrations de 1 000 fois supérieures sont recommandées). - Incuber l’échantillon de citrated avec du Ticagrelor (concentration finale jusqu’à 6,4 μM) pendant 30 min pour observer l’inhibition plaquettaire.
- Si vous mélangez le produit sanguin avec l’échantillon citraté, colorez le produit sanguin avec une solution bloquant les récepteurs FC (1:600) et un anticorps CD41 conjugué à la fluorescence (à l’aide d’un fluorophore séparé et distinct de l’échantillon citraté) (1:600).
- Mélanger un équivalent volumétrique des unités de produit transfusées avec l’échantillon citraté. Par exemple, pour simuler la transfusion de 2 unités de produits plaquettaires à une personne hémorragique (environ 250 ml par produit pour un volume sanguin total de 5 000 ml), mélangez 100 μL de produit sanguin dans 1 000 μL d’échantillon de sang citraté.
- Immédiatement avant l’expérience, filtrez l’échantillon de sang à travers un filtre de 40 μm dans un tube de microcentrifugation stérile de 1,5 mL.
3. Test de la fonction plaquettaire sous écoulement (méthode 1)
- Allumez le microscope et les logiciels associés.
- Réglez le niveau de la pompe de la seringue de prélèvement avec la platine du microscope. Ajustez les paramètres sur le pousse-seringue.
- Calculez un débit volumétrique (Q) pour un taux de cisaillement moyen de paroi souhaité (γ) de 3 500 s-1 dans la région sténosée du canal à l’aide des équations (1) et (2)21.
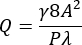 (1)
(1)
 (2)
(2)
Où A est l’aire de la section transversale du canal, P est le périmètre mouillé, λ est le facteur de forme, b est le côté court du rectangle (hauteur) et a est le côté long du rectangle (largeur).
REMARQUE : La valeur de 3 500 s-1 est choisie en raison du cisaillement critique VWF et se situe dans le régime artériel 7,22,23.
- Calculez un débit volumétrique (Q) pour un taux de cisaillement moyen de paroi souhaité (γ) de 3 500 s-1 dans la région sténosée du canal à l’aide des équations (1) et (2)21.
- Placez le dispositif microfluidique sur la platine du microscope. Collez les bords du dispositif microfluidique sur la platine pour éviter tout mouvement. Assurez-vous que la sortie est orientée vers l’arrière du microscope.
- Connectez une extrémité du tube de 1/16 » de diamètre intérieur (environ 30 cm de long) à un connecteur coudé et l’autre extrémité à une seringue de 10 ml avec un connecteur de 1/16 » de diamètre intérieur.
- Remplissez la seringue de PBS stérile et connectez-la au pousse-seringue.
- Placez le connecteur coudé dans la prise de l’appareil.
- Préparez des conduites d’entrée d’environ 10 cm de long avec le connecteur coudé à une extrémité et la coupe coudée à l’autre extrémité.
- Connectez le connecteur coudé d’entrée dans l’entrée de l’appareil.
- Positionnez la conduite d’entrée dans un tube de microcentrifugation à déchets sur un support coudé.
- Utilisez l’objectif 10x pour des dimensions de canal d’environ 500 μm de largeur et concentrez-vous sur les bords du canal du dispositif microfluidique.
- Amorcez les conduites avec du PBS et débarrassez le canal de tout PDMS/débris en avançant manuellement le pousse-seringue. Assurez-vous de vérifier près de l’entrée et de la sortie du canal.
- Ouvrez les paramètres de capture d’image enregistrés ou créez une procédure de capture d’image pour les images de séries chronologiques capturées toutes les 1 à 2 s avec un canal en fond clair et des canaux fluorescents correspondant aux anticorps CD41 fluorescents utilisés dans l’échantillon de sang.
- Obtenez l’échantillon de sang citrated filtré et mélangez en pipetant de haut en bas juste avant l’expérience. Placez l’échantillon sur le support de microcentrifugeuse coudé.
- Positionnez la ligne d’entrée dans l’échantillon.
- Lancez l’enregistrement de la capture d’image.
- Lentement, retirez la seringue pour remplir le volume mort dans la tubulure. Une fois que le sang atteint le canal, appuyez immédiatement sur le bouton de lecture de la pompe à seringue pour reprendre l’écoulement au taux de cisaillement souhaité.
- Ajustez la mise au point si nécessaire.
- Exécutez l’expérience jusqu’à ce que les plaquettes aient complètement occlus la région sténosée du dispositif microfluidique ou jusqu’à un point final expérimental (c’est-à-dire 10 min).
- Assurez-vous que le tube d’entrée est immergé dans l’échantillon de sang pendant toute la durée de l’expérience.
- Une fois l’expérience terminée, arrêtez la capture d’image et arrêtez le pousse-seringue. Enregistrez la capture d’image.
- Retirez le connecteur coudé d’entrée et videz le contenu du tube dans une conique de vidage. Videz également le contenu de la seringue et des conduites de sortie dans les déchets coniques.
- Remplacez les connecteurs d’entrée et de sortie et les tubes au besoin pour les échantillons suivants.
4. Test de la fonction plaquettaire sous écoulement avec des échantillons de faible volume (inférieur à 1 ml) (méthode 2)
- Répétez les étapes 1.1 à 1.4 comme ci-dessus.
- Perforer une sortie de 1,5 mm de diamètre et une entrée de 3 mm de diamètre sur les bords des canaux.
- Répétez les étapes 1.6 à 3.6 comme ci-dessus.
- Utilisez l’objectif 10x pour des dimensions de canal d’environ 500 μm de largeur et concentrez-vous sur les bords du canal du dispositif microfluidique.
- Nettoyez le canal de tout PDMS/débris en faisant avancer manuellement le pousse-seringue et en évacuant le liquide d’accès avec une lingette de laboratoire. Enlevez tous les débris avec du ruban adhésif de laboratoire sur le dessus du dispositif microfluidique.
- Avancez manuellement la pompe pour remplir le réservoir d’entrée de 3 mm avec du PBS.
- Ouvrez les paramètres de capture d’image enregistrés ou créez une procédure de capture d’image pour les images de séries chronologiques capturées toutes les 1 à 2 s avec un canal en fond clair et des canaux fluorescents correspondant aux anticorps CD41 fluorescents utilisés dans l’échantillon de sang.
- Démarrez le prélèvement sur la pompe à seringue (manuellement ou à la vitesse définie) et une fois que le PBS avance dans le canal et que la conduite de remplissage dans le réservoir descend, interrompez le retrait sur la pompe.
- Retirez l’excès de PBS du réservoir à l’aide d’une pipette.
- Lancez la capture d’image.
- Pipeter l’échantillon de sang dans le réservoir (environ 40 μL) et démarrer immédiatement la seringue de prélèvement. Assurez-vous que le flux démarre.
REMARQUE : Si le moteur du pousse-seringue pour le retrait n’a pas été amorcé à l’étape 4.8, le débit ne démarrera pas immédiatement et l’expérience doit être répétée. - Remplissez le réservoir de sang pendant toute la durée de l’expérience, en vous assurant qu’aucune poche d’air ne pénètre dans le canal.
- Exécutez l’expérience jusqu’à ce que les plaquettes aient complètement occlus la région sténosée du dispositif microfluidique ou jusqu’à un point final expérimental (c’est-à-dire 10 min).
- Une fois l’expérience terminée, arrêtez la capture d’image et arrêtez le pousse-seringue. Enregistrez la capture d’image.
- Retirez l’excès de sang dans le réservoir par pipetage. Videz le contenu du tube de prélèvement dans un tube conique de déchets.
- Remplacez les connecteurs et les tubes au besoin pour les échantillons suivants.
5. Décontamination
- Nettoyez les conduites d’entrée et de sortie du sang en rinçant dans une solution d’eau de Javel à 10 %.
- Si tous les canaux du dispositif microfluidique ont été utilisés, jetez le dispositif dans le conteneur de déchets biologiques dangereux Sharps.
REMARQUE : Tous les déchets biologiques doivent être éliminés de manière appropriée avec les déchets biologiques.
6. Analyse d’images
- Exportez les images des expériences cinétiques à l’aide d’un logiciel en cliquant sur Fichier | Exportation/Importation | Exportation.
- Sélectionnez les paramètres suivants : type de fichier : TIFF (Tagged Image File Format) ; compression : LZW ; cochez Données d’origine et Décalage du pixel ; décochez Appliquer la courbe d’affichage et la couleur du canal ; cochez Définir le sous-ensemble (Région, Région Rectangle, puis sélectionnez la zone du canal avec une mesure de largeur et de hauteur conservée entre les conditions). Exportez vers le dossier de votre choix et cochez la case Créer un dossier.
- Notez les valeurs expérimentales ci-dessous sur le logiciel : démarrer l’image lorsque le sang pénètre dans le canal ; fréquence d’images (Info, Séries chronologiques).
- Mesurez l’intensité de fluorescence moyenne normalisée de chaque image dans une expérience à l’aide du code Matlab fourni dans le fichier supplémentaire 1, en modifiant les entrées suivantes pour chaque expérience : image de début/image de fin en fonction de la longueur de l’expérience (assurez-vous que la longueur de l’expérience est conservée entre les conditions) ; le nom de l’expérience/le nom du dossier ; recadrage des paramètres X, Y, H et W. Exécutez le code une fois pour le canal fluorescent plaquettaire du récepteur et une fois pour le canal fluorescent plaquettaire du produit. Indiquez les valeurs normalisées de l’IFM (colonne 2) et de l’AUC normalisée (normalisées à l’image de départ). Soustrayez la valeur de la durée de l’expérience de la valeur AUC normalisée.
Résultats
Les expériences microfluidiques suivant l’utilisation de cette méthode devraient montrer la formation de thrombus riches en plaquettes dans la région de sténose du canal d’écoulement (Figure 1). La figure 1A illustre des résultats représentatifs où les plaquettes fonctionnelles ont formé un thrombus dans la région sténosée du canal pour bloquer le flux sanguin à travers le canal. Les courbes d’intensité moyen...
Discussion
Le protocole ci-dessus comporte quelques étapes essentielles pour assurer la fiabilité et la reproductibilité des expériences. Tout d’abord, les anticorps fluorescents doivent être soigneusement envisagés. Les anticorps utilisés pour détecter les plaquettes dans l’échantillon ne doivent pas bloquer la fonction du récepteur plaquettaire de la glycoprotéine Ib (GPIb). L’appariement des lots, dans la mesure du possible entre les expériences, est également essentiel pour a...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Les auteurs reconnaissent et remercient tous les donneurs de sang qui ont participé, ainsi que les phlébotomistes du laboratoire de recherche en traumatologie et en médecine transfusionnelle et le centre de recherche clinique et translationnelle Montefiore de l’UPMC pour leur aide dans les collections. SMS est pris en charge par K25HL161401. MDN est pris en charge par 1R01HL166944-01A1.
matériels
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Axio Observer | Zeiss | 491917-0001-000 | |
| Bel-Art Space Saver Vacuum Desiccators | Fisher Scientific | 08-594-15A | |
| Fisherbrand Isotemp Digital Hotplate Stirrer | Fisher Scientific | FB30786161 | |
| Nutating Mixer | Fischer Scientific | 88-861-043 | |
| OHAUS Scout Balance Scale | Uline | H-5852 | |
| Oven | Fisher Scientific | 15-103-0520 | |
| Plasma cleaner | Harrick | PDC-32G (115V) | |
| Syringe Pump (PHD ULTRA CP, I/W PROGRAMMABLE) | Harvard Apparatus | 883015 | |
| Zen 3.4 | Zeiss | Blue edition | Software |
| Material | |||
| 1/16 inch ID - Barbed Elbow Connectors | Qosina | 11691 | |
| 10 mL syringe | Fischer Scientific | 14-955-459 | |
| 2-Hydroxypropyl-β-cyclodextrin | Cayman Chemicals | 16169 | 30% Dissolved in Phosphate buffered saline |
| 40-micron filters | Fischer Scientific | NC1469671 | |
| CD41 antibody | Novus Biologicals | NB100-2614 | 1:600 Ratio in Whole Blood |
| Chrono-Par Collagen Reagent | Chrono Log Corporation | 385 | 1:5 Ratio in 0.9% Saline |
| Electron Microscopy Sciences Miltex Biopsy Punch with Plunger, 3.0 mm | Fisher Scientific | NC0856599 | |
| Eppendorf Snap-Cap Microcentrifuge SafeLock Tubes, 1.5 mL | Fisher Scientific | 05-402-25 | |
| Essendant 121oz. Clorox Germicidal Bleach | Fischer Scientific | 50371500 | |
| Ethanol | Fisher Scientific | 07-678-005 | 70% |
| Falcon Safety Dust Off DPSXLRCP Compressed Gas | Supra | 1381978 | |
| Human TruStain | Biolegend | 422302 | 1:600 Ratio in Whole Blood |
| LevGo smartSpatula Disposable Polypropylene Spatula | Fisher Scientific | 18-001-017 | |
| Microscope Slides | Fisher Scientific | 12-550-A3 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| Safety Scalpel | Fisher Scientific | 22-079-718 | |
| Saline | Millipore | 567442 | 0.90% |
| Sartorius Polystyrene Weighing Boats | Fisher Scientific | 13-735-744 | |
| Superslip Cover Slips - Superslip No. 1.5 | Fisher Scientific | 12-541-055 | |
| SYLGARD 184 Silicone Elastomer Kit | Fisher Scientific | NC9285739 | Polydimethylsiloxane (PDMS) |
| Ticagrelor | Cayman Chemicals | 15425 | |
| Tygon PVC Clear Tubing 1/16" ID, 1/8" OD, 50 ft length | McMaster-Carr | 6516T11 | |
| Ultra-Machinable 360 Brass Bar | McMaster-Carr | 8954K721 | For master mold fabrication |
| Vacutainers | BD | 363083 | |
| World Precision Instrument Reusable Biopsy Punch, 1.5mm | Fisher Scientific | NC1215626 |
Références
- Moore, E. E., et al. Trauma-induced coagulopathy. Nat Rev Dis Primers. 7 (1), 1-23 (2021).
- Vulliamy, P., et al. Alterations in platelet behavior after major trauma: adaptive or maladaptive. Platelets. 32 (3), 295-304 (2021).
- Starr, N. E., et al. Identification of injury and shock driven effects on ex vivo platelet aggregometry: A cautionary tale of phenotyping. J Trauma Acute Care Surg. 89 (1), 20-28 (2020).
- Kutcher, M. E., et al. Characterization of platelet dysfunction after trauma. J Trauma Acute Care Surg. 73 (1), 13-19 (2012).
- Yakusheva, A. A., et al. Traumatic vessel injuries initiating hemostasis generate high shear conditions. Blood Adv. 6 (16), 4834-4846 (2022).
- Colace, T. V., Diamond, S. L. Direct observation of von Willebrand factor elongation and fiber formation on collagen during acute whole blood exposure to pathological flow. Arterioscler Thromb Vasc Biol. 33 (1), 105-113 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers. Proc Natl Acad Sci USA. 104 (19), 7899-7903 (2007).
- Savage, B., Almus-Jacobs, F., Ruggeri, Z. M. Specific synergy of multiple substrate-receptor interactions in platelet thrombus formation under flow. Cell. 94 (5), 657-666 (1998).
- Savage, B., Saldívar, E., Ruggeri, Z. M. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor. Cell. 84 (2), 289-297 (1996).
- Ruggeri, Z. M., Mendolicchio, G. L. Adhesion mechanisms in platelet function. Circ Res. 100 (12), 1673-1685 (2007).
- Chernysh, I. N., et al. The distinctive structure and composition of arterial and venous thrombi and pulmonary emboli. Sci Rep. 10 (1), 5112 (2020).
- Holcomb, J. B., et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 313 (5), 471-482 (2015).
- Shea, S. M., et al. Doing more with less: low-titer group O whole blood resulted in less total transfusions and an independent association with survival in adults with severe traumatic hemorrhage. J Thromb Haemost. 22 (1), 140-151 (2024).
- Cardenas, J. C., et al. Platelet transfusions improve hemostasis and survival in a substudy of the prospective, randomized PROPPR trial. Blood Adv. 2 (14), 1696-1704 (2018).
- Sperry, J. L., et al. Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med. 379 (4), 315-326 (2018).
- Meyer, D. E., et al. Every minute counts: Time to delivery of initial massive transfusion cooler and its impact on mortality. J Trauma Acute Care Surg. 83 (1), 19-24 (2017).
- Shea, S. M., et al. Cold-stored platelet hemostatic capacity is maintained for three weeks of storage and associated with taurine metabolism. J Thromb Haemost. 22 (4), 1154-1166 (2024).
- Sperry, J. L., et al. Early cold stored platelet transfusion following severe injury: a randomized clinical trial. Ann Surg. 280 (2), 212-221 (2024).
- Schoeman, R. M., et al. A microfluidic model of hemostasis sensitive to platelet function and coagulation. Cell Mol Bioeng. 10 (1), 3-15 (2017).
- Sakurai, Y., et al. A microengineered vascularized bleeding model that integrates the principal components of hemostasis. Nat Commun. 9 (1), 509 (2018).
- Miller, C. Predicting non-Newtonian flow behavior in ducts of unusual cross section. Ind Eng Chem Fundamentals. 11 (4), 524-528 (1972).
- Kim, D., Bresette, C., Liu, Z., Ku, D. N. Occlusive thrombosis in arteries. APL Bioeng. 3 (4), 041502 (2019).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Sorrells, M. G., Neeves, K. B. Adsorption and absorption of collagen peptides to polydimethlysiloxane and its influence on platelet adhesion flow assays. Micromachines. 11 (1), 62 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon