A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
العوامل السريرية المؤثرة على الجرعة الإشعاعية للخلايا المناعية المنتشرة أثناء العلاج الإشعاعي لسرطان الرئة ذو الخلايا الصغيرة
* These authors contributed equally
In This Article
Summary
نقدم هنا بروتوكولا لتقييم آثار العلاج الإشعاعي على الخلايا الليمفاوية في الجهاز المناعي في سرطان الرئة ذو الخلايا الصغيرة.
Abstract
حظي سرطان الرئة ذو الخلايا الصغيرة (SCLC) باهتمام كبير بسبب الورم الخبيث العالي ، والميل إلى ورم خبيث بعيد ، وسوء التشخيص. يظل العلاج الإشعاعي حجر الزاوية في علاج سرطان الرئة ذو الخلايا الصغيرة محدودة المرحلة (LS-SCLC). ومع ذلك، تظل نتائج العلاج الإشعاعي بمفرده أو بالاشتراك مع العلاج الكيميائي دون المستوى الأمثل. يمكن أن يؤدي العلاج الإشعاعي إلى الإصابة بالتهاب الخلايا الليمفاوية عن طريق تشعيع الأعضاء المكونة للدم مباشرة أو تدمير الخلايا الليمفاوية الناضجة المنتشرة ، مما يؤدي إلى تثبيط المناعة وبالتالي تقليل الفعالية العلاجية. يدمج نموذج الجرعة المقدرة للإشعاع للخلايا المناعية (EDRIC) عوامل مثل ديناميكا الدم والحساسية الإشعاعية للخلايا الليمفاوية والقدرة على الانتشار. تستخدم هذه الدراسة نموذج EDRIC مع تحسينات لحساب جرعة إشعاع الخلايا المناعية المنتشرة. من خلال استخدام منهجية EDRIC ، تستكشف الدراسة العلاقة بين EDRIC والحجم المستهدف للورم ، ومتوسط جرعة الرئة ، ومتوسط جرعة القلب ، والسمات السريرية ، وقلة الصفيحات الليمفاوية في الدم المحيطي أثناء العلاج الإشعاعي ل LS-SCLC ، بهدف إبلاغ استراتيجيات علاج المريض الشخصية.
حللت هذه الدراسة بيانات من 64 مريضا ب LS-SCLC الذين استوفوا معايير التضمين في المستشفى العام بجامعة نينغشيا الطبية من يناير 2023 إلى يناير 2024 ، وجميعهم تلقوا العلاج الإشعاعي المجزأ الصدري التقليدي الجذري. تم تسجيل تعداد الخلايا الليمفاوية في النقاط التالية: قبل العلاج الإشعاعي ، بأقل قيمة ملحوظة أثناء العلاج الإشعاعي ، في نهاية العلاج الإشعاعي ، وشهر واحد بعد العلاج الإشعاعي. تم استخراج بيانات قياس الجرعات ، بما في ذلك متوسط جرعات الرئة والقلب والجسم ، من نظام تخطيط العلاج ، وتم حساب EDRIC المتداول باستخدام هذا النموذج. تم تحليل العلاقة بين قيم EDRIC والنتائج العلاجية. في LS-SCLC ، يتنبأ نموذج EDRIC بشكل فعال بانخفاض عدد الخلايا الليمفاوية ، يرتبط بحجم هدف التخطيط (PTV ؛ سم3) ، ومرحلة TNM ، والنسبة المئوية لانكماش الآفة المستهدفة. بعد العلاج الإشعاعي ، كان هناك انخفاض كبير في عدد الخلايا الليمفاوية في الدم المحيطي ، مع زيادة قيم EDRIC التي تشير إلى انخفاض أكثر وضوحا في الخلايا الليمفاوية.
Introduction
لا يزال سرطان الرئة سببا رئيسيا للمراضة والوفيات في جميع أنحاء العالم ، حيث يشكل سرطان الرئة ذو الخلايا الصغيرة (SCLC) 13٪ -17٪ من الحالات1،2. يتميز SCLC بدرجة عالية من الأورام الخبيثة والميل إلى ورم خبيث مبكر بعيد ، مما يؤدي غالبا إلى التشخيص في المرحلة المتأخرة وسوء التشخيص. سلط التقدم في التكنولوجيا الطبية والفهم الأعمق للخصائص البيولوجية ل SCLC الضوء على القيمة المحتملة للعلاج الإشعاعي في علاجه. ومع ذلك، تظل نتائج العلاج الإشعاعي وحده أو بالاشتراك مع العلاج الكيميائي دون المستوى الأمثل. يعد تحديد العوامل الرئيسية التي تؤثر على فعالية العلاج الإشعاعي في SCLC أمرا ضروريا لتوفير أساس نظري لاستراتيجيات العلاج الفردية والتنبؤ بالتشخيص.
يظهر الجهاز المناعي تفاعلات معقدة مع الإشعاع أو العلاج الكيميائي ، مما يعزز استئصال الخلايا السرطانية أثناء العلاج3،4. يمكن للعلاج الإشعاعي ، على سبيل المثال ، أن يعزز التنشيط المناعي عن طريق إطلاق السيتوكين أو المستضد ، وبالتالي تحفيز انحدار الورم داخل مجال الإشعاع (المعروف باسم التأثير البطني)5. ومع ذلك ، قد يؤدي العلاج الإشعاعي أيضا إلى تثبيط المناعة عند علاج الأورام الصلبة المختلفة ، مما قد يضر بالفعالية العلاجية. قد ينبع هذا التثبيط المناعي من تثبيط النخاع بسبب التشعيع المباشر للأعضاء المكونة للدم أو تدمير الخلايا الليمفاوية المنتشرة الناضجة ، مما يؤدي إلى انخفاض الخلايا الليمفاوية. حددت الدراسات حجم الورم المحدد وجرعات الإشعاع للأعضاء الحرجة مثل القلب والرئتين في سرطان الرئة ذو الخلايا الصغيرة كعوامل حاسمة لتثبيط المناعة ، مع آثار محتملة على بقاء المريضعلى قيد الحياة 6.
تصنف الخلايا الليمفاوية وخلاياها السليفة من بين أكثر أنواع الخلايا حساسية للإشعاع7. كشف تحقيق سوزانا يوفينو8 في جرعة إشعاع الخلايا المنتشرة (DCC) في مرضى الورم الدبقي في الدماغ بعد العلاج الإشعاعي أن التغيرات في حجم حجم التخطيط المستهدف (PTV) تؤثر على متوسط جرعة إشعاع DCC. قد تساهم جرعة الإشعاع لخلايا الدم المنتشرة بشكل كبير في آلية قلة الصفيحات الليمفاوية المستحثة. في حين أن تشعيع نخاع العظام أو الغدد الليمفاوية يمكن أن يؤدي إلى قلة الصفيحات الليمفاوية ، فإن تشعيع الهياكل الخالية من الأنسجة اللمفاوية أو نخاع العظام ، مثل الدماغ ، يمكن أن يؤدي أيضا إلى قلة الصفيحات اللمفاوية. طور Jin et al.9الجرعة المقدرة من الإشعاع للخلايا المناعية (EDRIC) وقياس الجرعات لتحديد تلف الجهاز المناعي الناجم عن العلاج الإشعاعي. تستخدم هذه الدراسة نموذج EDRIC مع تحسينات من Ladbury et al.6 لحساب جرعة إشعاع الخلايا المناعية المنتشرة.
وبالتالي ، تم استخدام طريقة EDRIC لحساب جرعة إشعاع الخلايا الليمفاوية المنتشرة والتحقيق في علاقتها بفعالية العلاج والتشخيص أثناء العلاج الإشعاعي لسرطان الرئة ذو الخلايا الصغيرة10. تم تحليل العلاقة بين قيم EDRIC وعوامل مثل العمر والجنس ودرجة حالة أداء كارنوفسكي (KPS) وتاريخ التدخين وحجم الورم ومرحلة الورم من خلال التقسيم الطبقي. علاوة على ذلك ، تمت مقارنة العلاقة بين قلة الصفيحات الليمفاوية في الدم المحيطي وجرعة إشعاع الخلايا الليمفاوية المنتشرة لوضع الأساس لاستراتيجيات العلاج الشخصية والتنبؤ بالتشخيص.
Protocol
بعد الالتزام الصارم بمعايير التضمين والاستبعاد لهذه الدراسة ، تم الحصول على الموافقة المستنيرة على العلاج الإشعاعي من كل مريض وولي أمره. تم إجراء التدريج السريري وفقا لنظام التدريج TNM للجنة الأمريكية المشتركة لمكافحة السرطان (AJCC)(الطبعة الثامنة). منحت لجنة الأخلاقيات في المستشفى العام بجامعة نينغشيا الطبية (KYLL-2022-0984) الموافقة على هذه الدراسة.
ملاحظة: كانت معايير الإدراج على النحو التالي: (1) سرطان الرئة ذو الخلايا الصغيرة المؤكد مرضيا (TNM المرحلة الثانية والثالثة). (2) العلاج الإشعاعي الأولي باستخدام العلاج الإشعاعي المعدل بالكثافة المطابقة (IMRT) أو العلاج الإشعاعي المعدل بكثافة القوس الحجمي (VMAT) ، بجرعة إشعاعية إجمالية تتراوح بين 50-60 غراي وجرعة واحدة من 2 غراي ؛ (3) معلمات الدم قبل العلاج الإشعاعي ضمن المعدل الطبيعي (كرات الدم البيضاء ≥ 4 × 109 خلايا / لتر ، ≥ الهيموغلوبين 100 جم / لتر ، PLT ≥ 100 × 109 / لتر) ، والوظيفة الطبيعية للأعضاء الحيوية مثل القلب والكبد والكلى ؛ (4) توافر البيانات السريرية الكاملة وسجلات العلاج الإشعاعي؛ (ت) البقاء على قيد الحياة المتوقع لأكثر من 3 أشهر؛ (سادسا) النساء غير الحوامل أو المرضعات. وشملت معايير الاستبعاد: (1) المرضى الذين يعانون من اضطرابات في الدم أو الجهاز المناعي أو تلف كبير في الأعضاء. (ثانيا) تاريخ العلاج بالستيرويد عن طريق الفم لفترات طويلة. (ثالثا) المرضى الذين لم يكملوا العلاج الإشعاعي المخطط له ؛ (4) التاريخ الحديث للإصابة المؤكدة.
1. المعلومات السريرية العامة
- جمع بيانات المريض.
ملاحظة: تم جمع بيانات من 64 مريضا تم تشخيص إصابتهم ب LS-SCLC ، واستوفوا معايير التضمين وخضعوا للعلاج الإشعاعي في قسم العلاج الإشعاعي ، المستشفى العام بجامعة نينغشيا الطبية من يناير 2023 إلى يناير 2024. من بينهم ، 48 من الذكور و 16 من الإناث ، تتراوح أعمارهم بين 41 و 85 عاما. وفقا لنظام التدريج AJCC TNM(الطبعة الثامنة) ، كانت هناك 9 حالات المرحلة الثانية و 55 حالة من المرحلة الثالثة. تلقى جميع المرضى البالغ عددهم 60 مريضا العلاج الكيميائي قبل العلاج الإشعاعي ، مع 46 مريضا يخضعون للعلاج الكيميائي أكثر من مرتين (الجدول 1). يشمل العلاج الإشعاعي تقنيا العلاج الإشعاعي معدل الشدة (IMRT) أو العلاج القوسي معدل الشدة الحجمي (VMAT).
2. تحضير المعالجة المسبقة
- تشخيص سرطان الرئة ذو الخلايا الصغيرة عن طريق تنظير القصبات أو أمراض البزل11 ، كما هو موضح في الشكل 1.
- استبعاد ورم خبيث باستخدام التصوير بالرنين المغناطيسي (MRI) للدماغ والرقبة والبطن وتحديد موقع منطقة الورم عن طريق التصوير المقطعي المحوسب بالإصدار البوزيتروني (PET / CT) 12 ، كما هو موضح في الشكل 2A-C.
- إجراء اختبار إنزيم القلب ، ومخطط كهربية القلب ، والتصوير بالموجات فوق الصوتية للقلب ، ووظيفة الرئة ، ووظيفة الغدة الدرقية لتقييم وظيفة القلب والرئة والحكم على عدم وجود موانع10.
- إبلاغ المرضى وعائلاتهم بشكل كامل بالمخاطر والمضاعفات المتعلقة بالعلاج الإشعاعي والتوقيع على الموافقات المتعلقة بالعلاج الإشعاعي.
ملاحظة: وقت بدء العلاج الإشعاعي: بالنسبة للمرضى الذين يعانون من أورام كبيرة ، ورم خبيث واسع النطاق للغدد الليمفاوية الإقليمية ، وانخماص الرئة المصاحب ، يمكن إعطاء دورتين من العلاج الكيميائي أولا ، في موعد لا يتجاوز الدورة الثالثة من العلاج الكيميائي.
3. العلاج الإشعاعي
- تحديد الموضع: حافظ على المريض مستلقا ، مع وضع سطح الجسم على خطوط الخرائط واليدين والمرفقين على الجبهة. شل حركة المريض باستخدام قالب لدن بالحرارة لضمان الاستقرار. إجراء فحص مقطعي محسوب محسن لتوفير تصور واضح للورم والأوعية الدموية المحيطة به ، كما هو موضح في الشكل 3 أ.
ملاحظة: معلمات الفحص المحظوظ المحسنة هي كما يلي: (1) جرعة عامل التباين: 80 مل Dianbitol. (2) معدل الحقن: 3 مل / ثانية. (3) وقت المسح: المرحلة الأولى: 30-35 ثانية ، المرحلة الثانية: 70-80 ثانية ، إذا لزم الأمر ، يمكن تأخيرها من 3 إلى 10 دقائق. شمل فحص محاكاة التصوير المقطعي المحوسب مستوى قاعدة الجمجمة العلوي ، مع امتداد الحد السفلي 10 سم أسفل الحجاب الحاجز. يتم تحميل شرائح الصورة ، بسماكة 5 مم ، إلى نظام تخطيط العلاج Pinnacle. - تحديد الهدف: حدد بدقة منطقة العلاج الإشعاعي ل SCLC بواسطة نظام القمة في تحديد مواقع صور التصوير المقطعي المحوسب ، كما هو موضح في الشكل 3 ب ، ج.
- حجم الورم الإجمالي - الأولي (GTVp): حدد GTV باستخدام مجموعة من إعدادات النافذة الرئوية والمنصف ، والالتزام بمعايير RTOG والإشارة إلى PET-CT ، والتصوير المقطعي المحوسب ، ونتائج تنظير القصبات.
- استبعاد مناطق انخماص الرئة والإفرازات الخالية من امتصاص فلوروديوكسي جلوكوز (FDG) من التحديد. لا تلف النتوءات الطويلة وأجزاء الجر الجنبي. قم بتضمين نتوءات بطول أقل من 5 مم في المنطقة المستهدفة.
- GTV للعقدة الليمفاوية النقيلية (GTVnd): تحديد الغدد الليمفاوية النقيلية المنصف باستخدام التصوير المقطعي المحوسب للصدر و PET / CT.
- الحجم المستهدف السريري (CTV): يشمل CTV GTVp بهامش 0.5 سم ، مع دمج التشذيب التشريحي ومناطق التصريف اللمفاوي التراكمية.
- حجم التخطيط المستهدف (PTV): مشتق من CTV بهامش إضافي 0.5 سم وتشذيب تشريحي.
ملاحظة: تحديد الأعضاء المعرضة للخطر والقيود: الحبل الشوكي: الجرعة القصوى (Dmax) < 40 Gy. الرئة اليسرى: حجم استقبال 20 غراي (V20) < 20٪. الرئة اليمنى: V20 < 20٪. الرئتان الثنائية: متوسط الجرعة (Dmean) < 13 Gy. الكبد: حجم تلقي 30 غراي (V30) < 30٪. القلب: V30 < 30٪ ، كما هو موضح في الشكل 3D-H.
- حجم الورم الإجمالي - الأولي (GTVp): حدد GTV باستخدام مجموعة من إعدادات النافذة الرئوية والمنصف ، والالتزام بمعايير RTOG والإشارة إلى PET-CT ، والتصوير المقطعي المحوسب ، ونتائج تنظير القصبات.
- تطوير تخطيط العلاج الإشعاعي في إطار نظام تخطيط العلاج المحوسب: استخدام 6MV-X والعلاج الإشعاعي معدل الشدة (IMRT) لتقييم الجرعة المستهدفة.
ملاحظة: كان لدى PTV الذي يغطيه خط الجرعة الموصوفة مطابقة جيدة ، وتوزيع موحد للجرعة في المنطقة المستهدفة ، ولا توجد بقعة باردة في المنطقة المستهدفة ، ولا توجد بقعة ساخنة في العضو المعرض للخطر. كانت حدود الأنسجة الطبيعية في المعدل الطبيعي ، كما هو موضح في الشكل 3I ، J. - تنفيذ خطة العلاج الإشعاعي5: إجراء العلاج الإشعاعي باستخدام مسرع خطي ومقارنة اختبار التصوير المقطعي المحوسب بالحزمة المخروطية (CBCT) مع وضع وضع التصوير المقطعي المحوسب (مرة واحدة في الأسبوع) ، والتنسيب المزدوج ، مرة واحدة في اليوم ، 5 مرات في الأسبوع ، كما هو موضح في الشكل 4 أ ، ب.
- إجراء فحص التصوير المقطعي المحوسب الثانوي مع وصول الجرعة إلى 30-40 GY لتقييم التأثير العلاجي. قلل المنطقة المستهدفة إذا لزم الأمر حتى تصل الجرعة إلى 50-60 غرافي ، كما هو موضح في الشكل 5 أ ، ب.
ملاحظة: لوحظت الاستجابة العلاجية أثناء عملية العلاج ، وتم إعطاء علاج الأعراض وفقا للحالة.
4. طريقة التقييم والفهرس
- احسب متوسط جرعة الرئة ومتوسط جرعة القلب وإجمالي بيانات حجم الجرعة الإجمالية وفقا لطريقة EDRIC بالصيغة التالية:
EDRIC = 0.12 × MLD + 0.08 × MHD +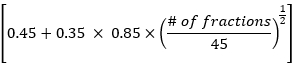 × MBD
× MBD
حيث يمثل B1٪ = 0.12 ، B2٪ = 0.08 ، B3٪ = 0.45 ، و B4٪ = 0.35 النسبة المئوية للأعضاء الأربعة الرئيسية المحتوية على الدم (الرئة والقلب والأوعية الدموية الكبيرة والأوعية الدموية الصغيرة / الشعيرات الدموية) في إجمالي حجم الدم في الجسم ؛ MLD و MHD و MBD هي متوسط جرعة الرئة ومتوسط جرعة القلب ومتوسط جرعة الجسم ، حيث يشير MBD إلى جرعة الإشعاع لكل وحدة حجم من الجسم. في هذه الدراسة ، MBD هو متوسط جرعة الجسم من مستوى غضروف الغدة الدرقية إلى الهامش العلوي للفقرة الصدرية السادسة ، والتي يمكن الحصول عليها إحصائيا من خلال نظام تخطيط العلاج. - مراقبة التغيرات في آفات التصوير المقطعي المحوسب في الصدر والغدد الليمفاوية المنصف في المرضى قبل وبعد شهر واحد من العلاج الإشعاعي. تقييم فعالية العلاج وفقا لمعايير تقييم الاستجابة في الأورام الصلبة (RECIST) ، وتحليل العلاقة بين قيمة EDRIC وفعالية العلاج.
- احسب أقل قيمة للخلايا الليمفاوية في الدم المحيطي قبل وأثناء العلاج الإشعاعي وتحليل ارتباطها بجرعة إشعاع الخلايا الليمفاوية المنتشرة وتأثيرها العلاجي.
5. الأساليب الإحصائية
- إجراء التحليلات الإحصائية باستخدام اختبار T للعينة المستقلة أو اختبار مربع كاي لتقييم الاختلافات بين مجموعات المتغيرات المستمرة والفئوية.
- استخدم معامل ارتباط سبيرمان لتقييم الارتباطات المتغيرة.
ملاحظة: أجريت جميع التحليلات الإحصائية باستخدام SPSS، واعتبرت P < 0.05 ذات دلالة إحصائية.
النتائج
النتائج السريرية
لوحظت تغيرات وقت الجراحة في آفات التصوير المقطعي المحوسب في الصدر والغدد الليمفاوية المنصف في جميع المرضى قبل وبعد شهر واحد من العلاج الإشعاعي ، مع تقييم الفعالية العلاجية باستخدام معايير RECIST. من بين 64 مريضا يعانون من سرطان الرئة ذو الخلايا ?...
Discussion
يلعب الجهاز المناعي دورا محوريا في السيطرة على الورم أثناء العلاج الإشعاعي ، ومع ذلك فإن السمية المناعية الناجمة عن الإشعاع ، مثل قلة الصفيحات الليمفاوية ، مرتبطة بنتائج البقاء على قيد الحياة غير المواتية13،14. يتميز SCLC بأورام خبيثة عالية ...
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل مشروع البحث على مستوى الجامعة لجامعة نينغشيا الطبية (XM2022017).
Materials
| Name | Company | Catalog Number | Comments |
| CT machine | Siemens Healthcare | SOMATOM Force | |
| MRI machine | Siemens Healthcare | MAGNETOM Terra | |
| Varian Clinac_IX Medical electron linear Accelerator | Siemens Healthcare | IX |
References
- Oronsky, B., Reid, T. R., Oronsky, A., Carter, C. A. What's New in SCLC? A Review. Neoplasia. 19 (10), 842-847 (2017).
- Pike, L. R. G., et al. The impact of radiation therapy on lymphocyte count and survival in metastatic cancer patients receiving PD-1 immune checkpoint inhibitors. Int J Radiat Oncol Biol Phys. 103 (1), 142-151 (2019).
- Brahmer, J. R. Harnessing the immune system for the treatment of non-small-cell lung cancer. J Clin Oncol. 31 (8), 1021-1028 (2013).
- Takeshima, T., et al. Key role for neutrophils in radiation-induced antitumor immune responses: Potentiation with G-CSF. Proc Natl Acad Sci U S A. 113 (40), 11300-11305 (2016).
- Yoon, S. W., et al. Per-fraction positional and dosimetric performance of prone breast tangential radiotherapy on Halcyon™ linear accelerator assessed with daily rapid kilo-voltage cone beam computed tomography: a single-institution pilot study. Radiat Oncol. 15 (1), 258 (2020).
- Ladbury, C. J., Rusthoven, C. G., Camidge, D. R., Kavanagh, B. D., Nath, S. K. Impact of radiation dose to the host immune system on tumor control and survival for stage III non-small cell lung cancer treated with definitive radiation therapy. Int J Radiat Oncol Biol Phys. 105 (2), 346-355 (2019).
- Schrek, R. Qualitative and quantitative reactions of lymphocytes to x rays. Ann N Y Acad Sci. 95, 839-848 (1961).
- Yovino, S., Kleinberg, L., Grossman, S. A., Narayanan, M., Ford, E. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Jin, J. Y., et al. A framework for modeling radiation induced lymphopenia in radiotherapy. Radiother Oncol. 144, 105-113 (2020).
- Jin, J. Y., et al. Higher radiation dose to the immune cells correlates with worse tumor control and overall survival in patients with stage III NSCLC: A secondary analysis of RTOG0617. Cancers (Basel). 13 (24), 6193 (2021).
- Lalić, N., et al. Invasive diagnostic procedures from bronchoscopy to surgical biopsy-optimization of non-small cell lung cancer samples for molecular testing. Medicina (Kaunas). 59 (10), 1723 (2023).
- Cerra-Franco, A., et al. Predictors of nodal and metastatic failure in early stage non-small-cell lung cancer after stereotactic body radiation therapy. Clin Lung Cancer. 20 (3), 186-193 (2019).
- Venkatesulu, B. P., Mallick, S., Lin, S. H., Krishnan, S. A systematic review of the influence of radiation-induced lymphopenia on survival outcomes in solid tumors. Crit Rev Oncol Hematol. 123, 42-51 (2018).
- Upadhyay, R., et al. Risk and impact of radiation related lymphopenia in lung cancer: A systematic review and meta-analysis. Radiother Oncol. 157, 225-233 (2021).
- Chow, R., Simone, C. B. Radiation induced lymphopenia in head and neck cancer: The importance of rigorous statistical analysis, radiation field size, and treatment modality. Radiother Oncol. 170, 242 (2022).
- Xu, H., et al. Lymphopenia during definitive chemoradiotherapy in esophageal squamous cell carcinoma: Association with dosimetric parameters and patient outcomes. Oncologist. 26 (3), e425-e434 (2021).
- Liu, Z., et al. Pivotal roles of tumor-draining lymph nodes in the abscopal effects from combined immunotherapy and radiotherapy. Cancer Commun (Lond). 42 (10), 971-986 (2022).
- Yovino, S., et al. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Koukourakis, M. I., Giatromanolaki, A. Lymphopenia and intratumoral lymphocytic balance in the era of cancer immuno-radiotherapy. Crit Rev Oncol Hematol. 159, 103226 (2021).
- Tang, C., et al. Acute phase response before treatment predicts radiation esophagitis in non-small cell lung cancer. Radiother Oncol. 110 (3), 493-498 (2014).
- Dai, D., Tian, Q., Shui, Y., Li, J., Wei, Q. The impact of radiation induced lymphopenia in the prognosis of head and neck cancer: A systematic review and meta-analysis. Radiother Oncol. 168, 28-36 (2022).
- Damen, P. J. J., et al. The influence of severe radiation-induced lymphopenia on overall survival in solid tumors: A systematic review and meta-analysis. Int J Radiat Oncol Biol Phys. 111 (4), 936-948 (2021).
- Lin, Y. J., Kang, Y. M., Wu, Y. H., Chen, Y. W., Hu, Y. W. Lymphocytopenia and survival after whole-brain radiotherapy in patients with small-cell lung cancer. Thorac Cancer. 14 (14), 1268-1275 (2023).
- Suzuki, R., et al. Prognostic significance of total lymphocyte count, neutrophil-to-lymphocyte ratio, and platelet-to-lymphocyte ratio in limited-stage small-cell lung cancer. Clin Lung Cancer. 20 (2), 117-123 (2019).
- Grossman, S. A., et al. Survival in patients with severe lymphopenia following treatment with radiation and chemotherapy for newly diagnosed solid tumors. J Natl Compr Canc Netw. 13 (10), 1225-1231 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved