Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Klinische Faktoren, die die Strahlendosis zirkulierender Immunzellen während der Strahlentherapie bei kleinzelligem Lungenkrebs beeinflussen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll vor, um die Auswirkungen der Strahlentherapie auf die Lymphozyten des Immunsystems bei kleinzelligem Lungenkrebs zu bewerten.
Zusammenfassung
Kleinzelliger Lungenkrebs (SCLC) hat aufgrund seiner hohen Malignität, seiner Neigung zu Fernmetastasen und seiner schlechten Prognose große Aufmerksamkeit erregt. Die Strahlentherapie ist nach wie vor der Eckpfeiler der Behandlung von kleinzelligem Lungenkrebs im begrenzten Stadium (LS-SCLC). Die Ergebnisse mit einer Strahlentherapie allein oder in Kombination mit einer Chemotherapie sind jedoch nach wie vor suboptimal. Die Strahlentherapie kann eine Lymphopenie induzieren, indem sie hämatopoetische Organe direkt bestrahlt oder reife zirkulierende Lymphozyten zerstört, was zu einer Immunsuppression und folglich zu einer Verringerung der therapeutischen Wirksamkeit führt. Das Modell der geschätzten Strahlendosis für Immunzellen (EDRIC) integriert Faktoren wie Hämodynamik, Strahlenempfindlichkeit der Lymphozyten und Proliferationskapazität. In dieser Studie wird das EDRIC-Modell mit Verbesserungen zur Berechnung der Strahlendosis der zirkulierenden Immunzellen verwendet. Unter Verwendung der EDRIC-Methodik untersucht die Studie die Korrelation zwischen EDRIC und der Tumorzielgröße, der durchschnittlichen Lungendosis, der durchschnittlichen Herzdosis, den klinischen Merkmalen und der Lymphozytopenie im peripheren Blut während der Strahlentherapie bei LS-SCLC, mit dem Ziel, personalisierte Behandlungsstrategien für Patienten zu entwickeln.
In dieser Studie wurden Daten von 64 LS-SCLC-Patienten analysiert, die von Januar 2023 bis Januar 2024 die Einschlusskriterien am Allgemeinen Krankenhaus der Ningxia Medical University erfüllten und alle eine radikale thorakale konventionelle fraktionierte Strahlentherapie erhielten. Die Lymphozytenzahl wurde zu folgenden Zeitpunkten aufgezeichnet: vor der Strahlentherapie, beim niedrigsten beobachteten Wert während der Strahlentherapie, am Ende der Strahlentherapie und einen Monat nach der Strahlentherapie. Dosimetrische Daten, einschließlich der durchschnittlichen Lungen-, Herz- und Körperdosen, wurden aus dem Behandlungsplanungssystem extrahiert und der zirkulierende EDRIC wurde unter Verwendung dieses Modells berechnet. Der Zusammenhang zwischen EDRIC-Werten und therapeutischen Outcomes wurde analysiert. Beim LS-SCLC sagt das EDRIC-Modell effektiv die Verringerung der Lymphozytenzahl voraus und korreliert mit der Planung des Zielvolumens (PTV;cm 3), dem TNM-Stadium und dem Prozentsatz der Schrumpfung der Zielläsion. Nach der Strahlentherapie kam es zu einer signifikanten Abnahme der Lymphozytenzahl im peripheren Blut, wobei höhere EDRIC-Werte auf eine ausgeprägtere Lymphozytenreduktion hindeuteten.
Einleitung
Lungenkrebs ist nach wie vor eine der Hauptursachen für Morbidität und Mortalität weltweit, wobei kleinzelliger Lungenkrebs (SCLC) 13 % bis 17 % der Fälle ausmacht 1,2. SCLC zeichnet sich durch einen hohen Grad an Malignität und eine Neigung zu frühen Fernmetastasen aus, was häufig zu einer späten Diagnose und einer schlechten Prognose führt. Fortschritte in der Medizintechnik und ein tieferes Verständnis der biologischen Eigenschaften von SCLC haben den potenziellen Wert der Strahlentherapie bei ihrer Behandlung hervorgehoben. Nichtsdestotrotz bleiben die Ergebnisse einer Strahlentherapie allein oder in Kombination mit einer Chemotherapie suboptimal. Die Identifizierung von Schlüsselfaktoren, die die Wirksamkeit der Strahlentherapie bei SCLC beeinflussen, ist unerlässlich, um eine theoretische Grundlage für individualisierte Behandlungsstrategien und Prognosen zu schaffen.
Das Immunsystem weist komplizierte Wechselwirkungen mit Strahlen- oder Chemotherapie auf, die die Eradikation von Tumorzellen während der Behandlung verstärken 3,4. Die Strahlentherapie kann beispielsweise die Immunaktivierung über die Freisetzung von Zytokinen oder Antigenen fördern und dadurch eine Tumorregression innerhalb des Strahlenfeldes induzieren (bekannt als abskopaler Effekt)5. Die Strahlentherapie kann jedoch auch bei der Behandlung verschiedener solider Tumoren eine Immunsuppression induzieren, was die therapeutische Wirksamkeit beeinträchtigen kann. Diese Immunsuppression kann auf eine Myelosuppression aufgrund einer direkten Bestrahlung hämatopoetischer Organe oder der Zerstörung reifer zirkulierender Lymphozyten zurückzuführen sein, was zu einer Verringerung der Lymphozyten führt. Studien haben die spezifische Tumorgröße und die Strahlendosis für kritische Organe wie Herz und Lunge bei kleinzelligem Lungenkrebs als entscheidende Prädiktoren für die Immunsuppression identifiziert, mit potenziellen Auswirkungen auf das Überleben der Patienten6.
Lymphozyten und ihre Vorläuferzellen gehören zu den strahlenempfindlichsten Zelltypen7. SusannahYovinos 8 Untersuchung der zirkulierenden Zellstrahlendosis (DCC) bei Patienten mit Hirngliomen nach der Strahlentherapie zeigte, dass Veränderungen in der Größe des Planungszielvolumens (PTV) die durchschnittliche DCC-Strahlendosis beeinflussen. Die Strahlendosis für zirkulierende Blutzellen kann signifikant zum Mechanismus der induzierten Lymphozytopenie beitragen. Während die Bestrahlung des Knochenmarks oder der Lymphknoten eine Lymphozytopenie induzieren kann, kann auch die Bestrahlung von Strukturen ohne lymphatisches Gewebe oder Knochenmark, wie z. B. das Gehirn, eine Lymphozytopenie auslösen. Jin et al.9entwickelten das EDRIC-Modell (Estimated Dose of Radiation to immune cells) und die Dosimetrie, um die durch Strahlentherapie induzierte Schädigung des Immunsystems zu quantifizieren. Diese Studie verwendet das EDRIC-Modell mit Verbesserungen von Ladbury et al.6 , um die Strahlendosis der zirkulierenden Immunzellen zu berechnen.
Folglich wurde die EDRIC-Methode verwendet, um die zirkulierende Lymphozyten-Strahlendosis zu berechnen und ihren Zusammenhang mit der Wirksamkeit und Prognose der Behandlung während der Strahlentherapie bei kleinzelligem Lungenkrebs zu untersuchen10. Die Korrelation zwischen EDRIC-Werten und Faktoren wie Alter, Geschlecht, Karnofsky Performance Status (KPS)-Score, Raucheranamnese, Tumorgröße und Tumorstadium wurde durch Stratifizierung analysiert. Darüber hinaus wurde die Korrelation zwischen der Lymphozytopenie des peripheren Blutes und der zirkulierenden Lymphozyten-Strahlendosis verglichen, um die Grundlage für personalisierte Behandlungsstrategien und Prognosen zu schaffen.
Protokoll
Nach strikter Einhaltung der Ein- und Ausschlusskriterien dieser Studie wurde von jedem Patienten und seinem Erziehungsberechtigten eine Einverständniserklärung zur Strahlentherapie eingeholt. Das klinische Staging wurde in Übereinstimmung mit dem TNM-Staging-System des American Joint Committee on Cancer (AJCC) (8. Auflage) durchgeführt. Die Ethikkommission des Ningxia Medical University General Hospital (KYLL-2022-0984) erteilte die Genehmigung für diese Studie.
ANMERKUNG: Die Einschlusskriterien waren wie folgt: (i) pathologisch bestätigter kleinzelliger Lungenkrebs im begrenzten Stadium (TNM Stadium II und III); ii) Erstbehandlung der Strahlentherapie unter Verwendung einer konformalen intensitätsmodulierten Strahlentherapie (IMRT) oder einer intensitätsmodulierten Strahlentherapie des volumetrischen Lichtbogens (VMAT) mit einer Gesamtstrahlendosis von 50 bis 60 Gy und einer Einzeldosis von 2 Gy; (iii) Blutparameter vor der Strahlentherapie im Normbereich (Leukozyten ≥ 4 x 109 Zellen/L, Hb ≥ 100 g/L, PLT ≥ 100 x 109/L) und normale Funktion lebenswichtiger Organe wie Herz, Leber und Nieren; iv) Verfügbarkeit vollständiger klinischer Daten und Aufzeichnungen über die Strahlentherapie; v) erwartetes Überleben von mehr als 3 Monaten; vi) nicht schwangere oder stillende Frauen. Zu den Ausschlusskriterien gehörten: (i) Patienten mit Erkrankungen des Blut- oder Immunsystems oder erheblichen Organschäden; (ii) Vorgeschichte einer verlängerten oralen Steroidtherapie; iii) Patienten, die die geplante Strahlentherapie nicht abgeschlossen haben; (iv) bestätigte Infektionen in der jüngsten Vorgeschichte.
1. Allgemeine klinische Informationen
- Sammeln Sie Patientendaten.
HINWEIS: Es wurden Daten von 64 Patienten gesammelt, bei denen LS-SCLC diagnostiziert wurde, die die Einschlusskriterien erfüllten und sich von Januar 2023 bis Januar 2024 in der Abteilung für Strahlentherapie des Allgemeinen Krankenhauses der Ningxia Medical University einer Strahlentherapie unterzogen. Von ihnen waren 48 männlich und 16 weiblich im Alter von 41 bis 85 Jahren. Nach dem AJCC TNM-Staging-System (8. Auflage) gab es 9 Fälle im Stadium II und 55 Fälle im Stadium III. Alle 60 Patienten erhielten vor der Strahlentherapie eine Chemotherapie, 46 Patienten erhielten mehr als zweimal eine Chemotherapie (Tabelle 1). Zur Strahlentherapie gehören technisch gesehen die intensitätsmodulierte Strahlentherapie (IMRT) oder die volumetrische intensitätsmodulierte Lichtbogentherapie (VMAT).
2. Vorbereitung der Vorbehandlung
- Diagnose von kleinzelligem Lungenkrebs durch Bronchoskopie oder Punktionspathologie11, wie in Abbildung 1 dargestellt.
- Ausschluss von Metastasen mittels Magnetresonanztomographie (MRT) des Gehirns, des Halses und des Abdomens und Lokalisierung des Tumorbereichs durch Positronenemissionstomographie-Computertomographie (PET/CT)12, wie in Abbildung 2A-C gezeigt.
- Führen Sie einen Herzenzymtest, ein Elektrokardiogramm, einen Herzultraschall, eine Lungenfunktion und eine Schilddrüsenfunktion durch, um die Herz-Lungen-Funktion zu beurteilen und zu beurteilen, dass es keine Kontraindikationen gibt10.
- Informieren Sie die Patienten und ihre Angehörigen umfassend über die Risiken und Komplikationen im Zusammenhang mit der Strahlentherapie und unterzeichnen Sie Einverständniserklärungen im Zusammenhang mit der Strahlentherapie.
HINWEIS: Zeitpunkt des Beginns der Strahlentherapie: Bei Patienten mit großen Tumoren, ausgedehnten Metastasen regionaler Lymphknoten und gleichzeitiger Atelektase können zuerst 2 Zyklen Chemotherapie verabreicht werden, spätestens jedoch im dritten Zyklus der Chemotherapie.
3. Strahlentherapie
- Lagerung: Halten Sie den Patienten in Rückenlage, wobei die Körperoberfläche mit Kartierungslinien markiert ist und die Hände und Ellbogen auf der Stirn ruhen. Immobilisieren Sie den Patienten mit einer thermoplastischen Form, um die Stabilität zu gewährleisten. Führen Sie erweiterte CT-Scans durch, um eine klare Visualisierung des Tumors und der umgebenden Blutgefäße zu ermöglichen, wie in Abbildung 3A gezeigt.
HINWEIS: Die erweiterten CT-Scanparameter lauten wie folgt: (1) Dosierung des Kontrastmittels: 80 ml Dianbitol. (2) Injektionsrate: 3 mL/s. (3) Scanzeit: die erste Phase: 30-35 s, die zweite Phase: 70-80 s, falls erforderlich, kann um 3 bis 10 Minuten verzögert werden. Der CT-Simulationsscan umfasste die obere Schädelbasis, wobei sich die untere Grenze 10 cm unterhalb des Zwerchfells erstreckte. Bildscheiben mit einer Dicke von 5 mm werden in das Bestrahlungsplanungssystem von Pinnacle hochgeladen. - Zielabgrenzung: Genaue Abgrenzung des Strahlentherapiebereichs für SCLC durch ein Spitzensystem bei der Positionierung von CT-Bildern, wie in Abbildung 3B, C gezeigt.
- Bruttotumorvolumen – primär (GTVp): Abgrenzung des GTV unter Verwendung einer Kombination aus pulmonalen und mediastinalen Fenstereinstellungen, unter Einhaltung der RTOG-Kriterien und unter Bezugnahme auf PET-CT, erweiterte CT und Bronchoskopie-Befunde.
- Bereiche mit Atelektase und Exsudaten ohne Fluordesoxyglucose (FDG)-Aufnahme sind von der Abgrenzung auszuschließen. Wickeln Sie lange Grate und Pleuratraktionsteile nicht ein. Fügen Sie Grate mit einer Länge von weniger als 5 mm in den Zielbereich ein.
- GTV des metastasierten Lymphknotens (GTVnd): Abgrenzung der mediastinalen metastasierten Lymphknoten mittels Thorax-CT und PET/CT.
- Klinisches Zielvolumen (CTV): Umfasst das CTV GTVp mit einem Rand von 0,5 cm, einschließlich anatomischer Trimmung und kumulativ beteiligter Lymphdrainagebereiche.
- Planung des Zielvolumens (PTV): Ableitung von CTV mit einem zusätzlichen Rand von 0,5 cm und anatomischem Beschnitt.
HINWEIS: Abgrenzung und Einschränkungen der Risikoorgane: Rückenmark: Maximale Dosis (Dmax) < 40 Gy. Linke Lunge: Volumen, das 20 Gy (V20) < 20 % aufnimmt. Rechte Lunge: V20 < 20%. Bilaterale Lunge: Mittlere Dosis (Dmean) < 13 Gy. Leber: Volumen, das 30 Gy (V30) < 30% aufnimmt. Herz: V30 < 30%, wie in Abbildung 3D-H dargestellt.
- Bruttotumorvolumen – primär (GTVp): Abgrenzung des GTV unter Verwendung einer Kombination aus pulmonalen und mediastinalen Fenstereinstellungen, unter Einhaltung der RTOG-Kriterien und unter Bezugnahme auf PET-CT, erweiterte CT und Bronchoskopie-Befunde.
- Entwicklung der Strahlentherapieplanung unter dem computergestützten Therapieplanungssystem: Verwenden Sie 6MV-X und intensitätsmodulierte Strahlentherapie (IMRT), um die Zieldosis zu bewerten.
HINWEIS: PTV, das von der verschreibungspflichtigen Dosislinie abgedeckt wurde, wies eine gute Anpassungsfähigkeit, eine gleichmäßige Dosisverteilung im Zielbereich, keinen kalten Spot im Zielbereich und keinen Hot Spot im gefährdeten Organ auf. Die normalen Gewebegrenzen lagen im Normbereich, wie in Abbildung 3I, J gezeigt. - Führen Sie den Strahlentherapieplan5 aus: Führen Sie die Strahlentherapie mit einem Linearbeschleuniger durch und vergleichen Sie den Kegelstrahl-Computertomographie-Test (DVT) mit der Positionierung der CT-Position (einmal pro Woche), der doppelten Platzierung, einmal täglich, 5 Mal pro Woche, wie in Abbildung 4A, B gezeigt.
- Führen Sie einen sekundären CT-Scan mit einer Dosis von 30-40 GY durch, um die therapeutische Wirkung zu bewerten. Reduzieren Sie den Zielbereich bei Bedarf, bis die Dosis 50-60 GY erreicht, wie in Abbildung 5A, B gezeigt.
HINWEIS: Das therapeutische Ansprechen wurde während des Behandlungsprozesses beobachtet und die symptomatische Behandlung wurde je nach Situation durchgeführt.
4. Bewertungsmethode und Index
- Berechnen Sie die Daten zur mittleren Lungendosis, zur mittleren Herzdosis und zum Gesamtdosisvolumen gemäß der EDRIC-Methode mit der folgenden Formel:
EDRIC = 0,12 × MLD + 0,08 × MHD +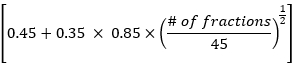 × MBD
× MBD
Dabei steht B1 % = 0,12, B2 % = 0,08, B3 % = 0,45 und B4 % = 0,35 für den prozentualen Anteil der vier wichtigsten bluthaltigen Organe (Lunge, Herz, große Blutgefäße, kleine Blutgefäße/Kapillaren) am Gesamtblutvolumen im Körper; MLD, MHD und MBD sind die mittlere Lungendosis, die mittlere Herzdosis und die mittlere Körperdosis, wobei sich MBD auf die Strahlendosis pro Volumeneinheit des Körpers bezieht. In dieser Studie ist MBD die durchschnittliche Körperdosis vom Schilddrüsenknorpel bis zum oberen Rand des sechsten Brustwirbels, die statistisch über das Behandlungsplanungssystem ermittelt werden kann. - Beobachten Sie die Veränderungen der Thorax-CT-Läsionen und der mediastinalen Lymphknoten bei Patienten vor und 1 Monat nach der Strahlentherapie. Bewerten Sie die Wirksamkeit der Behandlung anhand der Kriterien zur Bewertung des Ansprechens bei soliden Tumoren (RECIST) und analysieren Sie die Beziehung zwischen dem EDRIC-Wert und der Wirksamkeit der Behandlung.
- Zählen Sie den niedrigsten Wert der Lymphozyten im peripheren Blut vor und während der Strahlentherapie und analysieren Sie seine Korrelation mit der Strahlendosis der zirkulierenden Lymphozyten und der therapeutischen Wirkung.
5. Statistische Methoden
- Führen Sie statistische Analysen mit dem unabhängigen Stichproben-T-Test oder dem Chi-Quadrat-Test durch, um Unterschiede zwischen kontinuierlichen und kategorialen Variablengruppen zu bewerten.
- Verwenden Sie den Spearman-Korrelationskoeffizienten, um Variablenkorrelationen auszuwerten.
HINWEIS: Alle statistischen Analysen wurden mit SPSS durchgeführt, und P < 0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Klinisches Ergebnis
Die zeitlichen Veränderungen bei Thorax-CT-Läsionen und mediastinalen Lymphknoten wurden bei allen Patienten vor und 1 Monat nach der Strahlentherapie beobachtet, wobei die therapeutische Wirksamkeit anhand der RECIST-Kriterien bewertet wurde. Von den 64 Patienten mit kleinzelligem Lungenkrebs im begrenzten Stadium zeigten 4 Fälle ein vollständiges Ansprechen, während 57 Fälle ein teilweises Ansprechen zeigten und drei Patienten eine stabile ...
Diskussion
Das Immunsystem spielt eine zentrale Rolle bei der Tumorkontrolle während der Strahlentherapie, doch strahleninduzierte Immuntoxizität, wie z. B. Lymphozytopenie, ist mit ungünstigen Überlebensergebnissen verbunden 13,14. Die SCLC zeichnet sich durch ihre hohe Malignität aus, die oft in fortgeschrittenen Stadien mit einer düsteren Prognose diagnostiziert wird. Die Strahlentherapie ist der Eckpfeiler der Behandlung von LS-SC...
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde durch das universitäre Forschungsprojekt der Ningxia Medical University (XM2022017) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| CT machine | Siemens Healthcare | SOMATOM Force | |
| MRI machine | Siemens Healthcare | MAGNETOM Terra | |
| Varian Clinac_IX Medical electron linear Accelerator | Siemens Healthcare | IX |
Referenzen
- Oronsky, B., Reid, T. R., Oronsky, A., Carter, C. A. What's New in SCLC? A Review. Neoplasia. 19 (10), 842-847 (2017).
- Pike, L. R. G., et al. The impact of radiation therapy on lymphocyte count and survival in metastatic cancer patients receiving PD-1 immune checkpoint inhibitors. Int J Radiat Oncol Biol Phys. 103 (1), 142-151 (2019).
- Brahmer, J. R. Harnessing the immune system for the treatment of non-small-cell lung cancer. J Clin Oncol. 31 (8), 1021-1028 (2013).
- Takeshima, T., et al. Key role for neutrophils in radiation-induced antitumor immune responses: Potentiation with G-CSF. Proc Natl Acad Sci U S A. 113 (40), 11300-11305 (2016).
- Yoon, S. W., et al. Per-fraction positional and dosimetric performance of prone breast tangential radiotherapy on Halcyon™ linear accelerator assessed with daily rapid kilo-voltage cone beam computed tomography: a single-institution pilot study. Radiat Oncol. 15 (1), 258 (2020).
- Ladbury, C. J., Rusthoven, C. G., Camidge, D. R., Kavanagh, B. D., Nath, S. K. Impact of radiation dose to the host immune system on tumor control and survival for stage III non-small cell lung cancer treated with definitive radiation therapy. Int J Radiat Oncol Biol Phys. 105 (2), 346-355 (2019).
- Schrek, R. Qualitative and quantitative reactions of lymphocytes to x rays. Ann N Y Acad Sci. 95, 839-848 (1961).
- Yovino, S., Kleinberg, L., Grossman, S. A., Narayanan, M., Ford, E. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Jin, J. Y., et al. A framework for modeling radiation induced lymphopenia in radiotherapy. Radiother Oncol. 144, 105-113 (2020).
- Jin, J. Y., et al. Higher radiation dose to the immune cells correlates with worse tumor control and overall survival in patients with stage III NSCLC: A secondary analysis of RTOG0617. Cancers (Basel). 13 (24), 6193 (2021).
- Lalić, N., et al. Invasive diagnostic procedures from bronchoscopy to surgical biopsy-optimization of non-small cell lung cancer samples for molecular testing. Medicina (Kaunas). 59 (10), 1723 (2023).
- Cerra-Franco, A., et al. Predictors of nodal and metastatic failure in early stage non-small-cell lung cancer after stereotactic body radiation therapy. Clin Lung Cancer. 20 (3), 186-193 (2019).
- Venkatesulu, B. P., Mallick, S., Lin, S. H., Krishnan, S. A systematic review of the influence of radiation-induced lymphopenia on survival outcomes in solid tumors. Crit Rev Oncol Hematol. 123, 42-51 (2018).
- Upadhyay, R., et al. Risk and impact of radiation related lymphopenia in lung cancer: A systematic review and meta-analysis. Radiother Oncol. 157, 225-233 (2021).
- Chow, R., Simone, C. B. Radiation induced lymphopenia in head and neck cancer: The importance of rigorous statistical analysis, radiation field size, and treatment modality. Radiother Oncol. 170, 242 (2022).
- Xu, H., et al. Lymphopenia during definitive chemoradiotherapy in esophageal squamous cell carcinoma: Association with dosimetric parameters and patient outcomes. Oncologist. 26 (3), e425-e434 (2021).
- Liu, Z., et al. Pivotal roles of tumor-draining lymph nodes in the abscopal effects from combined immunotherapy and radiotherapy. Cancer Commun (Lond). 42 (10), 971-986 (2022).
- Yovino, S., et al. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Koukourakis, M. I., Giatromanolaki, A. Lymphopenia and intratumoral lymphocytic balance in the era of cancer immuno-radiotherapy. Crit Rev Oncol Hematol. 159, 103226 (2021).
- Tang, C., et al. Acute phase response before treatment predicts radiation esophagitis in non-small cell lung cancer. Radiother Oncol. 110 (3), 493-498 (2014).
- Dai, D., Tian, Q., Shui, Y., Li, J., Wei, Q. The impact of radiation induced lymphopenia in the prognosis of head and neck cancer: A systematic review and meta-analysis. Radiother Oncol. 168, 28-36 (2022).
- Damen, P. J. J., et al. The influence of severe radiation-induced lymphopenia on overall survival in solid tumors: A systematic review and meta-analysis. Int J Radiat Oncol Biol Phys. 111 (4), 936-948 (2021).
- Lin, Y. J., Kang, Y. M., Wu, Y. H., Chen, Y. W., Hu, Y. W. Lymphocytopenia and survival after whole-brain radiotherapy in patients with small-cell lung cancer. Thorac Cancer. 14 (14), 1268-1275 (2023).
- Suzuki, R., et al. Prognostic significance of total lymphocyte count, neutrophil-to-lymphocyte ratio, and platelet-to-lymphocyte ratio in limited-stage small-cell lung cancer. Clin Lung Cancer. 20 (2), 117-123 (2019).
- Grossman, S. A., et al. Survival in patients with severe lymphopenia following treatment with radiation and chemotherapy for newly diagnosed solid tumors. J Natl Compr Canc Netw. 13 (10), 1225-1231 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten