Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Küçük Hücreli Akciğer Kanseri için Radyoterapi Sırasında Dolaşımdaki İmmün Hücrelerin Radyasyon Dozunu Etkileyen Klinik Faktörler
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, küçük hücreli akciğer kanserinde radyasyon tedavisinin immün sistem lenfositleri üzerindeki etkilerini değerlendirmek için bir protokol sunuyoruz.
Özet
Küçük hücreli akciğer kanseri (KHAK), yüksek malignitesi, uzak metastaz eğilimi ve kötü prognozu nedeniyle önemli bir ilgi görmektedir. Radyoterapi, sınırlı evreli küçük hücreli akciğer kanseri (LS-SCLC) tedavisinin temel taşı olmaya devam etmektedir. Bununla birlikte, tek başına veya kemoterapi ile kombinasyon halinde radyoterapi ile elde edilen sonuçlar yetersiz kalmaktadır. Radyoterapi, hematopoietik organları doğrudan ışınlayarak veya dolaşımdaki olgun lenfositleri tahrip ederek lenfopeniyi indükleyebilir, bu da immünosupresyona ve sonuç olarak terapötik etkinliği azaltmaya yol açabilir. Bağışıklık hücrelerine tahmini radyasyon dozu (EDRIC) modeli, hemodinamik, lenfosit radyosensitiviti ve proliferasyon kapasitesi gibi faktörleri bütünleştirir. Bu çalışma, dolaşımdaki bağışıklık hücresi radyasyon dozunu hesaplamak için geliştirmelerle birlikte EDRIC modelini kullanmaktadır. Çalışma, EDRIC metodolojisini kullanarak, LS-SCLC için radyoterapi sırasında EDRIC ile tümör hedef boyutu, ortalama akciğer dozu, ortalama kalp dozu, klinik özellikler ve periferik kan lenfositopenisi arasındaki ilişkiyi araştırıyor ve kişiselleştirilmiş hasta tedavi stratejilerini bilgilendirmeyi amaçlıyor.
Bu çalışma, Ocak 2023'ten Ocak 2024'e kadar Ningxia Tıp Üniversitesi Genel Hastanesinde dahil edilme kriterlerini karşılayan ve tümü radikal torasik konvansiyonel fraksiyone radyoterapi alan 64 LS-SCLC hastasının verilerini analiz etti. Lenfosit sayıları radyoterapi öncesi, radyoterapi sırasında gözlenen en düşük değerde, radyoterapi sonunda ve radyoterapiden bir ay sonra kaydedildi. Ortalama akciğer, kalp ve vücut dozları dahil olmak üzere dozimetrik veriler tedavi planlama sisteminden çıkarıldı ve dolaşımdaki EDRIC bu model kullanılarak hesaplandı. EDRIK değerleri ile terapötik sonuçlar arasındaki ilişki analiz edildi. LS-SCLC'de, EDRIC modeli, planlama hedef hacmi (PTV;cm3), TNM aşaması ve hedef lezyon küçülme yüzdesi ile ilişkili olarak lenfosit sayısındaki azalmayı etkili bir şekilde tahmin eder. Radyoterapi sonrası, periferik kan lenfosit sayılarında önemli bir azalma oldu ve daha yüksek EDRIC değerleri daha belirgin lenfosit azalmasına işaret etti.
Giriş
Akciğer kanseri, dünya çapında önde gelen bir morbidite ve mortalite nedeni olmaya devam etmektedir ve küçük hücreli akciğer kanseri (KHAK) vakaların %13-17'sini oluşturmaktadır 1,2. KHAK, yüksek derecede malignite ve erken uzak metastaz eğilimi ile karakterizedir, bu da genellikle geç evre tanı ve kötü prognoza yol açar. Tıbbi teknolojideki ilerlemeler ve SCLC'nin biyolojik özelliklerinin daha derin bir şekilde anlaşılması, tedavisinde radyoterapinin potansiyel değerini vurgulamıştır. Bununla birlikte, tek başına veya kemoterapi ile kombinasyon halinde radyoterapi ile sonuçlar yetersiz kalmaktadır. KHAK'de radyoterapinin etkinliğini etkileyen anahtar faktörlerin belirlenmesi, bireyselleştirilmiş tedavi stratejileri ve prognoz tahmini için teorik bir temel sağlamak için esastır.
Bağışıklık sistemi, radyasyon veya kemoterapi ile karmaşık etkileşimler sergileyerek tedavi sırasında tümör hücresi eradikasyonunu artırır 3,4. Örneğin radyasyon tedavisi, sitokin veya antijen salınımı yoluyla bağışıklık aktivasyonunu teşvik edebilir, böylece radyasyon alanında tümör gerilemesine neden olabilir (abskopal etki olarak bilinir)5. Bununla birlikte, radyoterapi, çeşitli katı tümörleri tedavi ederken immünosupresyona neden olabilir ve potansiyel olarak terapötik etkinliği tehlikeye atabilir. Bu immünosupresyon, hematopoietik organların doğrudan ışınlanmasına veya olgun dolaşımdaki lenfositlerin tahrip olmasına bağlı miyelosupresyondan kaynaklanabilir ve bu da lenfositlerin azalmasına neden olabilir. Çalışmalar, küçük hücreli akciğer kanserinde kalp ve akciğerler gibi kritik organlara spesifik tümör boyutu ve radyasyon dozlarını, immünosupresyonun önemli belirleyicileri olarak belirlemiştir ve hasta sağkalımı için potansiyel etkileri vardır6.
Lenfositler ve öncü hücreleri, radyasyona en duyarlı hücre tipleri arasında yer alır7. Susannah Yovino'nun radyoterapi sonrası beyin glioma hastalarında dolaşımdaki hücre radyasyon dozu (DCC) üzerineyaptığı 8 araştırması, planlama hedef hacminin (PTV) boyutundaki değişikliklerin ortalama DCC radyasyon dozunu etkilediğini ortaya koydu. Dolaşımdaki kan hücrelerine verilen radyasyon dozu, indüklenmiş lenfositopeni mekanizmasına önemli ölçüde katkıda bulunabilir. Kemik iliği veya lenf düğümlerinin ışınlanması lenfositopeniyi indükleyebilirken, beyin gibi lenfoid doku veya kemik iliğinden yoksun yapıların ışınlanması da lenfositopeniyi tetikleyebilir. Jin ve ark.9, radyoterapinin neden olduğu bağışıklık sistemi hasarını ölçmek için bağışıklık hücrelerine tahmini radyasyon dozu (EDRIC) modelini ve dozimetriyi geliştirdi. Bu çalışma, dolaşımdaki bağışıklık hücresi radyasyon dozunu hesaplamak için Ladbury ve ark.6'nın geliştirmeleriyle EDRIC modelini kullanmaktadır.
Sonuç olarak, küçük hücreli akciğer kanseri10 için radyoterapi sırasında dolaşımdaki lenfosit radyasyon dozunu hesaplamak ve tedavi etkinliği ve prognoz ile ilişkisini araştırmak için EDRIC yöntemi kullanıldı. EDRIK değerleri ile yaş, cinsiyet, Karnofsky Performans Durumu (KPS) skoru, sigara içme öyküsü, tümör boyutu ve tümör evresi gibi faktörler arasındaki korelasyon tabakalama yoluyla analiz edildi. Ayrıca, periferik kan lenfositopenisi ile dolaşımdaki lenfosit radyasyon dozu arasındaki korelasyon, kişiselleştirilmiş tedavi stratejileri ve prognoz tahmini için zemin hazırlamak için karşılaştırıldı.
Protokol
Bu çalışmanın dahil etme ve dışlama kriterlerine sıkı sıkıya bağlı kaldıktan sonra, her hastadan ve velilerinden radyoterapi için bilgilendirilmiş onam alındı. Klinik evreleme, Amerikan Kanser Ortak Komitesi (AJCC) TNM evreleme sistemine (8. baskı) uygun olarak yapıldı. Ningxia Tıp Üniversitesi Genel Hastanesi Etik Kurulu (KYLL-2022-0984) bu çalışma için onay verdi.
NOT: Dahil edilme kriterleri aşağıdaki gibidir: (i) patolojik olarak doğrulanmış sınırlı evreli küçük hücreli akciğer kanseri (TNM evre II ve III); (ii) toplam radyasyon dozu 50-60 Gy arasında değişen ve tek doz 2 Gy olan konformal yoğunluk ayarlı radyoterapi (IMRT) veya hacimsel ark yoğunluk ayarlı radyoterapi (VMAT) kullanan ilk radyoterapi tedavisi; (iii) normal aralıkta radyoterapi öncesi kan parametreleri (WBC ≥ 4 x 109 hücre / L, Hb ≥ 100 g / L, PLT ≥ 100 x 109 / L) ve kalp, karaciğer ve böbrekler gibi hayati organların normal fonksiyonu; (iv) eksiksiz klinik verilerin ve radyoterapi kayıtlarının mevcudiyeti; (v) 3 aydan fazla beklenen sağkalım; (vi) hamile olmayan veya emziren kadınlar. Dışlama kriterleri şunları içeriyordu: (i) kan veya bağışıklık sistemi bozuklukları veya önemli organ hasarı olan hastalar; (ii) uzun süreli oral steroid tedavisi öyküsü; (iii) planlanan radyoterapiyi tamamlamayan hastalar; (iv) yakın zamanda doğrulanmış enfeksiyon öyküsü.
1. Genel klinik bilgiler
- Hasta verilerini toplayın.
NOT: Ocak 2023 - Ocak 2024 tarihleri arasında Ningxia Tıp Üniversitesi Genel Hastanesi Radyoterapi Bölümü'nde LS-SCLC tanısı alan, dahil edilme kriterlerini karşılayan ve radyasyon tedavisi gören 64 hastadan veriler toplandı. Bunların 48'i erkek, 16'sı kadındı ve yaşları 41 ile 85 arasında değişiyordu. AJCC TNM evreleme sistemine (8. baskı) göre, 9 evre II ve 55 evre III vakası vardı. 60 hastanın tamamı radyoterapiden önce kemoterapi aldı ve 46 hastaya ikiden fazla kemoterapi uygulandı (Tablo 1). Radyasyon tedavisi teknik olarak yoğunluk ayarlı radyasyon tedavisi (IMRT) veya hacimsel yoğunluk ayarlı ark tedavisini (VMAT) içerir.
2. Ön işlem hazırlığı
- Şekil 1'de gösterildiği gibi küçük hücreli akciğer kanserini bronkoskopi veya ponksiyon patolojisi11 ile teşhis edin.
- Beyin, boyun ve karnın manyetik rezonans görüntülemesini (MRG) kullanarak metastazı dışlayın ve Şekil 2A-C'de gösterildiği gibi pozitron emisyon tomografisi-bilgisayarlı tomografi (PET/BT)12 ile tümör alanını bulun.
- Kardiyopulmoner fonksiyonu değerlendirmek için kardiyak enzim testi, elektrokardiyogram, kardiyak ultrasonografi, solunum fonksiyonu ve tiroid fonksiyonu yapın ve kontrendikasyon olmadığına karar verin10.
- Hastaları ve ailelerini radyoterapiyle ilgili riskler ve komplikasyonlar hakkında tam olarak bilgilendirin ve radyoterapi ile ilgili onayları imzalayın.
NOT: Radyoterapiye başlama süresi: büyük tümörleri, bölgesel lenf nodlarının yaygın metastazı ve eşzamanlı atelektazisi olan hastalar için, en geç üçüncü kemoterapi döngüsünden önce 2 kür kemoterapi verilebilir.
3. Radyoterapi
- Konumlandırma: Hastayı sırtüstü yatırın, vücut yüzeyi haritalama çizgileri ile işaretlenmiş ve eller ve dirsekler alnına dayanacak şekilde tutun. Stabiliteyi sağlamak için hastayı termoplastik bir kalıp kullanarak hareketsiz hale getirin. Şekil 3A'da gösterildiği gibi, tümörün ve çevresindeki kan damarlarının net bir şekilde görselleştirilmesini sağlamak için gelişmiş BT taraması yapın.
NOT: Gelişmiş BT tarama parametreleri aşağıdaki gibidir: (1) Kontrast madde dozu: 80 mL Dianbitol. (2) Enjeksiyon hızı: 3 mL / s. (3) Tarama süresi: ilk faz: 30-35 s, ikinci faz: 70-80 s, gerekirse 3 ila 10 dakika geciktirilebilir. BT simülasyon taraması, üst kafatası tabanı seviyesini kapsıyordu ve alt sınır diyaframın 10 cm altına uzanıyordu. 5 mm kalınlığındaki görüntü dilimleri Pinnacle tedavi planlama sistemine yüklenir. - Hedef tanımlama: Şekil 3B, C'de gösterildiği gibi, BT görüntülerini konumlandırmada zirve sistemi ile SCLC için radyoterapi alanını doğru bir şekilde tanımlayın.
- Brüt tümör hacmi-primer (GTVp): Pulmoner ve mediastinal pencere ayarlarının bir kombinasyonunu kullanarak, RTOG kriterlerine bağlı kalarak ve PET-BT, gelişmiş BT ve bronkoskopi bulgularına atıfta bulunarak GTV'yi tanımlayın.
- Florodeoksiglukoz (FDG) tutulumu olmayan atelektazi ve eksüda alanlarını tanımlamadan hariç tutun. Uzun çapakları ve plevral traksiyon parçalarını sarmayın. Hedef alana 5 mm'den daha az uzunluktaki çapakları dahil edin.
- Metastatik lenf nodunun GTV'si (GTVnd): Göğüs BT ve PET/BT kullanarak mediastinal metastatik lenf nodlarını tanımlayın.
- Klinik hedef hacim (CTV): CTV GTVp'yi 0,5 cm'lik bir kenar boşluğuyla, anatomik düzeltme ve kümülatif olarak tutulan lenfatik drenaj alanlarını içerir.
- Hedef hacmin planlanması (PTV): Ek 0,5 cm'lik bir kenar boşluğu ve anatomik düzeltme ile CTV'den türetin.
NOT: Risk Altındaki Organların Tanımı ve Kısıtlamaları: Omurilik: Maksimum doz (Dmax) < 40 Gy. Sol akciğer: 20 Gy (V20) < %20 alan hacim. Sağ akciğer: V20 < %20. Bilateral akciğerler: Ortalama doz (Dmean) < 13 Gy. Karaciğer: 30 Gy (V30) < %30 alan hacim. Kalp: Şekil 30D-H'de gösterildiği gibi V30 < %3.
- Brüt tümör hacmi-primer (GTVp): Pulmoner ve mediastinal pencere ayarlarının bir kombinasyonunu kullanarak, RTOG kriterlerine bağlı kalarak ve PET-BT, gelişmiş BT ve bronkoskopi bulgularına atıfta bulunarak GTV'yi tanımlayın.
- Bilgisayarlı tedavi planlama sistemi altında radyoterapi planlaması geliştirin: hedef dozu değerlendirmek için 6MV-X ve yoğunluk ayarlı radyoterapi (IMRT) kullanın.
NOT: Reçeteli doz çizgisinin kapsadığı PTV, iyi bir uyumluluğa, hedef alanda tek tip doz dağılımına, hedef bölgede soğuk nokta olmamasına ve risk altındaki organda sıcak nokta olmamasına sahipti. Normal doku sınırları, Şekil 3I, J'de gösterildiği gibi normal aralıktaydı. - Radyoterapi planı5'i uygulayın: Doğrusal bir hızlandırıcı kullanarak radyoterapi uygulayın ve konik ışınlı bilgisayarlı tomografi (CBCT) testini, Şekil 4A, B'de gösterildiği gibi, günde bir kez, haftada 5 kez, çift yerleştirme BT pozisyonu (haftada bir kez), çift yerleştirme ile karşılaştırın.
- Terapötik etkiyi değerlendirmek için doz 30-40 GY'ye ulaşan ikincil bir BT taraması yapın. Şekil 5A, B'de gösterildiği gibi doz 50-60 GY'ye ulaşana kadar gerekirse hedef alanı azaltın.
NOT: Tedavi sürecinde terapötik yanıt gözlendi ve duruma göre semptomatik tedavi verildi.
4. Değerlendirme yöntemi ve indeksi
- Aşağıdaki formülle EDRIC yöntemine göre ortalama akciğer dozu, ortalama kalp dozu ve genel toplam doz hacmi verilerini hesaplayın:
EDRIC = 0.12 × MLD + 0.08 × MHD +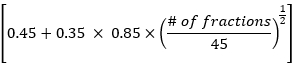 × MBD
× MBD
Burada, B1% = 0.12, B2% = 0.08, B3% =0.45 ve B4% = 0.35, vücuttaki toplam kan hacmindeki dört ana kan içeren organın (akciğer, kalp, büyük kan damarları, küçük kan damarları / kılcal damarlar) yüzdesini temsil eder; MLD, MHD ve MBD ortalama akciğer dozu, ortalama kalp dozu ve ortalama vücut dozudur, burada MBD vücudun birim hacmi başına radyasyon dozunu ifade eder. Bu çalışmada MBD, tiroid kıkırdak seviyesinden altıncı torasik vertebranın üst kenarına kadar olan ortalama vücut dozudur ve tedavi planlama sistemi aracılığıyla istatistiksel olarak elde edilebilir. - Radyoterapiden önce ve 1 ay sonra hastalarda göğüs BT lezyonlarındaki ve mediastinal lenf nodlarındaki değişiklikleri gözlemleyin. Solid tümörlerde yanıt değerlendirme kriterlerine (RECIST) göre tedavi etkinliğini değerlendirin ve EDRIC değeri ile tedavi etkinliği arasındaki ilişkiyi analiz edin.
- Radyoterapi öncesi ve sırasında periferik kan lenfositlerinin en düşük değerini sayın ve dolaşımdaki lenfosit radyasyon dozu ve terapötik etki ile korelasyonunu analiz edin.
5. İstatistiksel yöntemler
- Sürekli ve kategorik değişken grupları arasındaki farkları değerlendirmek için bağımsız örneklem T-testi veya Ki-kare testini kullanarak istatistiksel analizler yapın.
- Değişken korelasyonları değerlendirmek için Spearman korelasyon katsayısını kullanın.
NOT: Tüm istatistiksel analizler SPSS programı kullanılarak yapıldı ve P < 0.05 istatistiksel olarak anlamlı kabul edildi.
Sonuçlar
Klinik sonuç
Akciğer BT lezyonlarında ve mediastinal lenf nodlarında ameliyat zamanı değişiklikleri tüm hastalarda radyoterapiden önce ve radyoterapiden 1 ay sonra gözlendi ve terapötik etkinlik RECIST kriterleri kullanılarak değerlendirildi. Sınırlı evre küçük hücreli akciğer kanserli 64 hastanın 4'ünde tam yanıt, 57'sinde kısmi yanıt, üç hastada stabil hastalık saptandı.
EDRIK ile çeşitli klinik özellikler...
Tartışmalar
Bağışıklık sistemi, radyoterapi sırasında tümör kontrolünde çok önemli bir rol oynar, ancak lenfositopeni gibi radyasyona bağlı immünotoksisite, olumsuz sağkalım sonuçlarıyla bağlantılıdır13,14. SCLC, yüksek malignitesi ile karakterizedir ve sıklıkla ileri evrelerde kasvetli bir prognoz ile teşhis edilir. Radyoterapi, LS-SCLC için temel tedavi olarak durmaktadır. Bununla birlikte, bağışıklık sist...
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Ningxia Tıp Üniversitesi'nin (XM2022017) Üniversite Düzeyinde Araştırma Projesi tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| CT machine | Siemens Healthcare | SOMATOM Force | |
| MRI machine | Siemens Healthcare | MAGNETOM Terra | |
| Varian Clinac_IX Medical electron linear Accelerator | Siemens Healthcare | IX |
Referanslar
- Oronsky, B., Reid, T. R., Oronsky, A., Carter, C. A. What's New in SCLC? A Review. Neoplasia. 19 (10), 842-847 (2017).
- Pike, L. R. G., et al. The impact of radiation therapy on lymphocyte count and survival in metastatic cancer patients receiving PD-1 immune checkpoint inhibitors. Int J Radiat Oncol Biol Phys. 103 (1), 142-151 (2019).
- Brahmer, J. R. Harnessing the immune system for the treatment of non-small-cell lung cancer. J Clin Oncol. 31 (8), 1021-1028 (2013).
- Takeshima, T., et al. Key role for neutrophils in radiation-induced antitumor immune responses: Potentiation with G-CSF. Proc Natl Acad Sci U S A. 113 (40), 11300-11305 (2016).
- Yoon, S. W., et al. Per-fraction positional and dosimetric performance of prone breast tangential radiotherapy on Halcyon™ linear accelerator assessed with daily rapid kilo-voltage cone beam computed tomography: a single-institution pilot study. Radiat Oncol. 15 (1), 258 (2020).
- Ladbury, C. J., Rusthoven, C. G., Camidge, D. R., Kavanagh, B. D., Nath, S. K. Impact of radiation dose to the host immune system on tumor control and survival for stage III non-small cell lung cancer treated with definitive radiation therapy. Int J Radiat Oncol Biol Phys. 105 (2), 346-355 (2019).
- Schrek, R. Qualitative and quantitative reactions of lymphocytes to x rays. Ann N Y Acad Sci. 95, 839-848 (1961).
- Yovino, S., Kleinberg, L., Grossman, S. A., Narayanan, M., Ford, E. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Jin, J. Y., et al. A framework for modeling radiation induced lymphopenia in radiotherapy. Radiother Oncol. 144, 105-113 (2020).
- Jin, J. Y., et al. Higher radiation dose to the immune cells correlates with worse tumor control and overall survival in patients with stage III NSCLC: A secondary analysis of RTOG0617. Cancers (Basel). 13 (24), 6193 (2021).
- Lalić, N., et al. Invasive diagnostic procedures from bronchoscopy to surgical biopsy-optimization of non-small cell lung cancer samples for molecular testing. Medicina (Kaunas). 59 (10), 1723 (2023).
- Cerra-Franco, A., et al. Predictors of nodal and metastatic failure in early stage non-small-cell lung cancer after stereotactic body radiation therapy. Clin Lung Cancer. 20 (3), 186-193 (2019).
- Venkatesulu, B. P., Mallick, S., Lin, S. H., Krishnan, S. A systematic review of the influence of radiation-induced lymphopenia on survival outcomes in solid tumors. Crit Rev Oncol Hematol. 123, 42-51 (2018).
- Upadhyay, R., et al. Risk and impact of radiation related lymphopenia in lung cancer: A systematic review and meta-analysis. Radiother Oncol. 157, 225-233 (2021).
- Chow, R., Simone, C. B. Radiation induced lymphopenia in head and neck cancer: The importance of rigorous statistical analysis, radiation field size, and treatment modality. Radiother Oncol. 170, 242 (2022).
- Xu, H., et al. Lymphopenia during definitive chemoradiotherapy in esophageal squamous cell carcinoma: Association with dosimetric parameters and patient outcomes. Oncologist. 26 (3), e425-e434 (2021).
- Liu, Z., et al. Pivotal roles of tumor-draining lymph nodes in the abscopal effects from combined immunotherapy and radiotherapy. Cancer Commun (Lond). 42 (10), 971-986 (2022).
- Yovino, S., et al. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Koukourakis, M. I., Giatromanolaki, A. Lymphopenia and intratumoral lymphocytic balance in the era of cancer immuno-radiotherapy. Crit Rev Oncol Hematol. 159, 103226 (2021).
- Tang, C., et al. Acute phase response before treatment predicts radiation esophagitis in non-small cell lung cancer. Radiother Oncol. 110 (3), 493-498 (2014).
- Dai, D., Tian, Q., Shui, Y., Li, J., Wei, Q. The impact of radiation induced lymphopenia in the prognosis of head and neck cancer: A systematic review and meta-analysis. Radiother Oncol. 168, 28-36 (2022).
- Damen, P. J. J., et al. The influence of severe radiation-induced lymphopenia on overall survival in solid tumors: A systematic review and meta-analysis. Int J Radiat Oncol Biol Phys. 111 (4), 936-948 (2021).
- Lin, Y. J., Kang, Y. M., Wu, Y. H., Chen, Y. W., Hu, Y. W. Lymphocytopenia and survival after whole-brain radiotherapy in patients with small-cell lung cancer. Thorac Cancer. 14 (14), 1268-1275 (2023).
- Suzuki, R., et al. Prognostic significance of total lymphocyte count, neutrophil-to-lymphocyte ratio, and platelet-to-lymphocyte ratio in limited-stage small-cell lung cancer. Clin Lung Cancer. 20 (2), 117-123 (2019).
- Grossman, S. A., et al. Survival in patients with severe lymphopenia following treatment with radiation and chemotherapy for newly diagnosed solid tumors. J Natl Compr Canc Netw. 13 (10), 1225-1231 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır