Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Клинические факторы, влияющие на дозу облучения циркулирующих иммунных клеток при лучевой терапии мелкоклеточного рака легкого
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этой статье мы представляем протокол для оценки влияния лучевой терапии на лимфоциты иммунной системы при мелкоклеточном раке легкого.
Аннотация
Мелкоклеточный рак легкого (МРЛ) привлек к себе значительное внимание из-за высокой злокачественности, склонности к отдаленному метастазированию и плохого прогноза. Лучевая терапия остается краеугольным камнем лечения мелкоклеточного рака легкого ограниченной стадии (LS-SCLC). Тем не менее, результаты при монолучевой терапии или в сочетании с химиотерапией остаются неоптимальными. Лучевая терапия может вызывать лимфопению путем прямого облучения кроветворных органов или разрушения зрелых циркулирующих лимфоцитов, что приводит к иммуносупрессии и, следовательно, снижению терапевтической эффективности. Модель расчетной дозы облучения иммунных клеток (EDRIC) включает в себя такие факторы, как гемодинамика, радиочувствительность лимфоцитов и пролиферативная способность. В этом исследовании используется модель EDRIC с улучшениями для расчета дозы облучения циркулирующих иммунных клеток. Используя методологию EDRIC, в исследовании изучается корреляция между EDRIC и размером мишени опухоли, средней дозой для легких, средней дозой для сердца, клиническими особенностями и лимфоцитопенией периферической крови во время лучевой терапии LS-SCLC, с целью информирования о персонализированных стратегиях лечения пациентов.
В этом исследовании были проанализированы данные 64 пациентов с LS-SCLC, которые соответствовали критериям включения в Больницу общего профиля Медицинского университета Нинся с января 2023 года по январь 2024 года, все они получали радикальную торакальную традиционную фракционированную лучевую терапию. Количество лимфоцитов регистрировалось в следующие моменты: до лучевой терапии, на самом низком наблюдаемом значении во время лучевой терапии, в конце лучевой терапии и через месяц после лучевой терапии. Дозиметрические данные, включая средние дозы облучения легких, сердца и тела, были извлечены из системы планирования лечения, и с использованием этой модели был рассчитан циркулирующий EDRIC. Была проанализирована взаимосвязь между ценностями EDRIC и терапевтическими исходами. В LS-SCLC модель EDRIC эффективно прогнозирует снижение количества лимфоцитов, коррелируя с планируемым целевым объемом (PTV; cm3), стадией TNM и процентом уменьшения целевого поражения. После лучевой терапии наблюдалось значительное снижение количества лимфоцитов в периферической крови, при этом более высокие значения EDRIC указывали на более выраженное снижение лимфоцитов.
Введение
Рак легких остается ведущей причиной заболеваемости и смертности во всем мире, при этом мелкоклеточный рак легкого (МРЛ) составляет 13–17% случаев 1,2. МРЛ характеризуется высокой степенью злокачественности и склонностью к раннему отдаленному метастазированию, что часто приводит к поздней стадии диагностики и плохому прогнозу. Достижения в области медицинских технологий и более глубокое понимание биологических характеристик МРЛ высветили потенциальную ценность лучевой терапии в ее лечении. Тем не менее, исходы при монолучевой терапии или в сочетании с химиотерапией остаются неоптимальными. Выявление ключевых факторов, влияющих на эффективность лучевой терапии при МРЛ, имеет важное значение для обеспечения теоретической основы для индивидуализированных стратегий лечения и прогнозирования прогноза.
Иммунная система проявляет сложные взаимодействия с лучевой или химиотерапией, усиливая эрадикацию опухолевых клеток во время лечения 3,4. Лучевая терапия, например, может способствовать иммунной активации за счет высвобождения цитокинов или антигенов, тем самым вызывая регрессию опухоли в поле излучения (известный как абскопальный эффект)5. Тем не менее, лучевая терапия также может вызывать иммуносупрессию при лечении различных солидных опухолей, потенциально ставя под угрозу терапевтическую эффективность. Эта иммуносупрессия может быть вызвана миелосупрессией из-за прямого облучения кроветворных органов или разрушения зрелых циркулирующих лимфоцитов, что приводит к снижению количества лимфоцитов. Исследования точно определили размер опухоли и дозы облучения критически важных органов, таких как сердце и легкие, при мелкоклеточном раке легкого как важнейшие предикторы иммуносупрессии, с потенциальными последствиями для выживаемости пациентов6.
Лимфоциты и их предшественники относятся к наиболее чувствительным к радиации типам клеток7. Исследование дозы облучения циркулирующих клеток (DCC) у пациентов с глиомой головного мозга после лучевой терапии показало, что изменения в размере планируемого целевого объема (PTV) влияют на среднюю дозу облучения DCC. Доза облучения циркулирующих клеток крови может в значительной степени способствовать механизму индуцированной лимфоцитопении. В то время как облучение костного мозга или лимфатических узлов может вызвать лимфоцитопению, облучение структур, лишенных лимфоидной ткани или костного мозга, таких как мозг, также может вызвать лимфоцитопению. Jin et al.9разработали модель расчетной дозы облучения иммунных клеток (EDRIC) и дозиметрию для количественной оценки повреждения иммунной системы, вызванного лучевой терапией. В этом исследовании используется модель EDRIC с улучшениями от Ladbury et al.6 для расчета дозы облучения циркулирующих иммунных клеток.
Следовательно, метод EDRIC был использован для расчета дозы облучения циркулирующих лимфоцитов и изучения ее связи с эффективностью и прогнозом лечения при лучевой терапии мелкоклеточного рака легкого10. Корреляция между значениями EDRIC и такими факторами, как возраст, пол, оценка по шкале Карновски (KPS), история курения, размер опухоли и стадия опухоли, была проанализирована с помощью стратификации. Кроме того, корреляция между лимфоцитопенией периферической крови и дозой облучения циркулирующих лимфоцитов была сравнена, чтобы заложить основу для персонализированных стратегий лечения и прогнозирования прогноза.
протокол
После строгого соблюдения критериев включения и исключения из данного исследования было получено информированное согласие на лучевую терапию от каждого пациента и его опекуна. Клиническая стадия проводилась в соответствии с системой стадирования TNM Американского объединенного комитета по раку (AJCC) (8-е издание). Комитет по этике больницы общего профиля Медицинского университета Нинся (KYLL-2022-0984) одобрил это исследование.
ПРИМЕЧАНИЕ: Критерии включения были следующими: (i) патологически подтвержденный мелкоклеточный рак легких ограниченной стадии (TNM стадии II и III); (ii) начальное лучевое лечение с использованием конформной лучевой терапии с модуляцией интенсивности (IMRT) или объемной дуговой лучевой терапии с модулированной интенсивностью (VMAT) с общей дозой облучения в диапазоне от 50-60 Гр и однократной дозой 2 Гр; (iii) параметры крови до лучевой терапии в пределах нормы (лейкоциты ≥ 4 x 109 кл/л, Hb ≥ 100 г/л, PLT ≥ 100 x 109/л) и нормальное функционирование жизненно важных органов, таких как сердце, печень и почки; (iv) наличие полных клинических данных и записей о лучевой терапии; (v) ожидаемая выживаемость более 3 месяцев; vi) небеременные или кормящие женщины. Критерии исключения включали: (i) пациентов с нарушениями крови или иммунной системы или значительным повреждением органов; (ii) длительная пероральная терапия стероидами в анамнезе; (iii) пациенты, которые не завершили плановую лучевую терапию; (iv) недавний анамнез подтвержденной инфекции.
1. Общая клиническая информация
- Собирайте данные о пациентах.
ПРИМЕЧАНИЕ: Были собраны данные о 64 пациентах с диагнозом LS-SCLC, соответствующих критериям включения и проходящих лучевую терапию в отделении лучевой терапии Больницы общего профиля Медицинского университета Нинся с января 2023 года по январь 2024 года. Среди них 48 мужчин и 16 женщин, в возрасте от 41 до 85 лет. Согласно системе стадий AJCC TNM (8-е издание), было 9 случаев II стадии и 55 случаев III стадии. Все 60 пациентов получали химиотерапию до начала лучевой терапии, при этом 46 пациентов проходили химиотерапию более двух раз (табл. 1). Лучевая терапия технически включает в себя лучевую терапию с модуляцией интенсивности (IMRT) или дуговую терапию с модуляцией объемной интенсивности (VMAT).
2. Подготовка к предварительной обработке
- Диагностируйте мелкоклеточный рак легкого с помощью бронхоскопии или пункционной патологии11, как показано на рисунке 1.
- Исключите метастазирование с помощью магнитно-резонансной томографии (МРТ) головного мозга, шеи и брюшной полости и локализуйте область опухоли с помощью позитронно-эмиссионной томографии-компьютерной томографии (ПЭТ/КТ)12, как показано на рисунке 2A-C.
- Проведите исследование сердечных ферментов, электрокардиограмму, ультразвуковое исследование сердца, функцию легких и функцию щитовидной железы, чтобы оценить сердечно-легочную функцию и сделать вывод об отсутствии противопоказаний10.
- Полностью информировать пациентов и их семьи о рисках и осложнениях, связанных с лучевой терапией, и подписывать согласия, связанные с лучевой терапией.
ПРИМЕЧАНИЕ: Время начала лучевой терапии: для пациентов с большими опухолями, обширным метастазированием регионарных лимфатических узлов и сопутствующим ателектазом сначала можно назначить 2 курса химиотерапии, но не позднее третьего цикла химиотерапии.
3. Лучевая терапия
- Положение: Держите пациента в положении лежа на спине, при этом поверхность тела должна быть отмечена картографическими линиями, а кисти и локти лежат на лбу. Иммобилизуйте пациента с помощью термопластичной формы для обеспечения устойчивости. Проведите расширенную компьютерную томографию, чтобы обеспечить четкую визуализацию опухоли и окружающих кровеносных сосудов, как показано на рисунке 3A.
ПРИМЕЧАНИЕ: Расширенные параметры компьютерной томографии следующие: (1) Дозировка контрастного вещества: 80 мл дианбитола. (2) Скорость впрыска: 3 мл/с. (3) Время сканирования: первая фаза: 30-35 с, вторая фаза: 70-80 с, при необходимости может быть отложена от 3 до 10 мин. Компьютерная томография охватывала верхний уровень основания черепа, при этом нижняя граница проходила на 10 см ниже диафрагмы. Срезы изображения толщиной 5 мм загружаются в систему планирования лечения Pinnacle. - Разграничение мишени: Точное определение области лучевой терапии при МРЛ с помощью системы Pinnacle при размещении КТ-изображений, как показано на рисунке 3B, C.
- Общий объем опухоли - первичный (GTVp): Определите GTV с использованием комбинации настроек легочного и медиастинального окна, придерживаясь критериев RTOG и ссылаясь на результаты ПЭТ-КТ, усиленной КТ и бронхоскопии.
- Исключите из оконтуривания участки ателектаза и экссудаты, лишенные поглощения фтордезоксиглюкозы (ФДГ). Не заворачивайте длинные заусенцы и плевральные тракционные части. Включите в целевую область заусенцы длиной менее 5 мм.
- ГТВ метастатического лимфатического узла (ГТВ): Разграничение метастатических лимфатических узлов средостения с помощью КТ грудной клетки и ПЭТ/КТ.
- Клинический целевой объем (CTV): Охватывайте CTV GTVp с запасом 0,5 см, включая анатомическую обрезку и кумулятивно вовлеченные области лимфодренажа.
- Планирование целевого объема (PTV): Получено из CTV с дополнительным отступом 0,5 см и анатомической обрезкой.
ПРИМЕЧАНИЕ: Органы риска Разграничение и ограничения: Спинной мозг: максимальная доза (Dmax) < 40 Гр. Левое легкое: объем получения 20 Гр (V20) < 20%. Правое легкое: V20 < 20%. Двусторонние легкие: средняя доза (Dmean) < 13 Гр. Печень: объем приема 30 Гр (V30) < 30%. Сердце: V30 < 30%, как показано на рисунке 3D-H.
- Общий объем опухоли - первичный (GTVp): Определите GTV с использованием комбинации настроек легочного и медиастинального окна, придерживаясь критериев RTOG и ссылаясь на результаты ПЭТ-КТ, усиленной КТ и бронхоскопии.
- Разработка планов лучевой терапии в рамках компьютеризированной системы планирования терапии: использование 6MV-X и лучевой терапии с модуляцией интенсивности (IMRT) для оценки целевой дозы.
ПРИМЕЧАНИЕ: ПТВ, включенный в линейку рецептурных доз, имел хорошую конформность, равномерное распределение дозы в целевой области, отсутствие холодного пятна в целевой области и отсутствие горячего пятна в органе, подверженном риску. Пределы нормальных тканей находились в пределах нормы, как показано на рисунке 3I, J. - Выполните план лучевой терапии5: Проведите лучевую терапию с использованием линейного ускорителя и сравните исследование конусно-лучевой компьютерной томографии (КЛКТ) с позиционированием КТ (один раз в неделю), двойным размещением, один раз в день, 5 раз в неделю, как показано на рисунке 4А, В.
- Для оценки терапевтического эффекта проводят вторичную компьютерную томографию с дозой до 30-40 ГГ. При необходимости уменьшите целевую площадь до тех пор, пока доза не достигнет 50-60 ГР, как показано на рисунке 5А, В.
ПРИМЕЧАНИЕ: Терапевтический ответ наблюдался в процессе лечения, и симптоматическое лечение назначалось в соответствии с ситуацией.
4. Метод оценки и индекс
- Рассчитайте среднюю дозу облучения легких, среднюю дозу сердечных сокращений и общую общую дозу по методу EDRIC по следующей формуле:
EDRIC = 0,12 × MLD + 0,08 × MHD +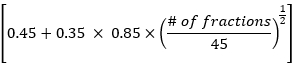 × MBD
× MBD
Где В1% = 0,12, В2% = 0,08, В3% = 0,45 и В4% = 0,35 представляют собой процентное соотношение четырех основных кроветворных органов (легких, сердца, крупных кровеносных сосудов, мелких кровеносных сосудов/капилляров) в общем объеме крови в организме; MLD, MHD и MBD — это средняя доза для легких, средняя доза для сердца и средняя доза для тела, где MBD относится к дозе облучения на единицу объема тела. В данном исследовании MBD представляет собой среднюю дозу в организме от уровня щитовидного хряща до верхнего края шестого грудного позвонка, которая может быть статистически получена с помощью системы планирования лечения. - Наблюдайте за изменениями в поражениях КТ грудной клетки и лимфатических узлах средостения у пациентов до и через 1 месяц после лучевой терапии. Оцените эффективность лечения в соответствии с критериями оценки ответа при солидных опухолях (RECIST) и проанализируйте взаимосвязь между значением EDRIC и эффективностью лечения.
- Подсчитайте наименьшее значение лимфоцитов периферической крови до и во время лучевой терапии и проанализируйте его корреляцию с дозой облучения циркулирующих лимфоцитов и терапевтическим эффектом.
5. Статистические методы
- Выполняйте статистический анализ с использованием независимого выборочного Т-критерия или критерия хи-квадрат для оценки различий между непрерывными и категориальными группами переменных.
- Используйте коэффициент корреляции Спирмена для оценки переменных корреляций.
ПРИМЕЧАНИЕ: Все статистические анализы проводились с использованием SPSS, и P < 0,05 считался статистически значимым.
Результаты
Клинический исход
Изменения во времени операции при поражениях КТ грудной клетки и лимфатических узлах средостения наблюдались у всех пациентов до и через 1 месяц после лучевой терапии, при этом терапевтическую эффективность оценивали по критериям RECIST. Ср...
Обсуждение
Иммунная система играет ключевую роль в контроле опухолей во время лучевой терапии, однако радиационно-индуцированная иммунотоксичность, такая как лимфоцитопения, связана с неблагоприятными исходами выживаемости13,14. МРЛ характеризу?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана исследовательским проектом университетского уровня Медицинского университета Нинся (XM2022017).
Материалы
| Name | Company | Catalog Number | Comments |
| CT machine | Siemens Healthcare | SOMATOM Force | |
| MRI machine | Siemens Healthcare | MAGNETOM Terra | |
| Varian Clinac_IX Medical electron linear Accelerator | Siemens Healthcare | IX |
Ссылки
- Oronsky, B., Reid, T. R., Oronsky, A., Carter, C. A. What's New in SCLC? A Review. Neoplasia. 19 (10), 842-847 (2017).
- Pike, L. R. G., et al. The impact of radiation therapy on lymphocyte count and survival in metastatic cancer patients receiving PD-1 immune checkpoint inhibitors. Int J Radiat Oncol Biol Phys. 103 (1), 142-151 (2019).
- Brahmer, J. R. Harnessing the immune system for the treatment of non-small-cell lung cancer. J Clin Oncol. 31 (8), 1021-1028 (2013).
- Takeshima, T., et al. Key role for neutrophils in radiation-induced antitumor immune responses: Potentiation with G-CSF. Proc Natl Acad Sci U S A. 113 (40), 11300-11305 (2016).
- Yoon, S. W., et al. Per-fraction positional and dosimetric performance of prone breast tangential radiotherapy on Halcyon™ linear accelerator assessed with daily rapid kilo-voltage cone beam computed tomography: a single-institution pilot study. Radiat Oncol. 15 (1), 258 (2020).
- Ladbury, C. J., Rusthoven, C. G., Camidge, D. R., Kavanagh, B. D., Nath, S. K. Impact of radiation dose to the host immune system on tumor control and survival for stage III non-small cell lung cancer treated with definitive radiation therapy. Int J Radiat Oncol Biol Phys. 105 (2), 346-355 (2019).
- Schrek, R. Qualitative and quantitative reactions of lymphocytes to x rays. Ann N Y Acad Sci. 95, 839-848 (1961).
- Yovino, S., Kleinberg, L., Grossman, S. A., Narayanan, M., Ford, E. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Jin, J. Y., et al. A framework for modeling radiation induced lymphopenia in radiotherapy. Radiother Oncol. 144, 105-113 (2020).
- Jin, J. Y., et al. Higher radiation dose to the immune cells correlates with worse tumor control and overall survival in patients with stage III NSCLC: A secondary analysis of RTOG0617. Cancers (Basel). 13 (24), 6193 (2021).
- Lalić, N., et al. Invasive diagnostic procedures from bronchoscopy to surgical biopsy-optimization of non-small cell lung cancer samples for molecular testing. Medicina (Kaunas). 59 (10), 1723 (2023).
- Cerra-Franco, A., et al. Predictors of nodal and metastatic failure in early stage non-small-cell lung cancer after stereotactic body radiation therapy. Clin Lung Cancer. 20 (3), 186-193 (2019).
- Venkatesulu, B. P., Mallick, S., Lin, S. H., Krishnan, S. A systematic review of the influence of radiation-induced lymphopenia on survival outcomes in solid tumors. Crit Rev Oncol Hematol. 123, 42-51 (2018).
- Upadhyay, R., et al. Risk and impact of radiation related lymphopenia in lung cancer: A systematic review and meta-analysis. Radiother Oncol. 157, 225-233 (2021).
- Chow, R., Simone, C. B. Radiation induced lymphopenia in head and neck cancer: The importance of rigorous statistical analysis, radiation field size, and treatment modality. Radiother Oncol. 170, 242 (2022).
- Xu, H., et al. Lymphopenia during definitive chemoradiotherapy in esophageal squamous cell carcinoma: Association with dosimetric parameters and patient outcomes. Oncologist. 26 (3), e425-e434 (2021).
- Liu, Z., et al. Pivotal roles of tumor-draining lymph nodes in the abscopal effects from combined immunotherapy and radiotherapy. Cancer Commun (Lond). 42 (10), 971-986 (2022).
- Yovino, S., et al. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Koukourakis, M. I., Giatromanolaki, A. Lymphopenia and intratumoral lymphocytic balance in the era of cancer immuno-radiotherapy. Crit Rev Oncol Hematol. 159, 103226 (2021).
- Tang, C., et al. Acute phase response before treatment predicts radiation esophagitis in non-small cell lung cancer. Radiother Oncol. 110 (3), 493-498 (2014).
- Dai, D., Tian, Q., Shui, Y., Li, J., Wei, Q. The impact of radiation induced lymphopenia in the prognosis of head and neck cancer: A systematic review and meta-analysis. Radiother Oncol. 168, 28-36 (2022).
- Damen, P. J. J., et al. The influence of severe radiation-induced lymphopenia on overall survival in solid tumors: A systematic review and meta-analysis. Int J Radiat Oncol Biol Phys. 111 (4), 936-948 (2021).
- Lin, Y. J., Kang, Y. M., Wu, Y. H., Chen, Y. W., Hu, Y. W. Lymphocytopenia and survival after whole-brain radiotherapy in patients with small-cell lung cancer. Thorac Cancer. 14 (14), 1268-1275 (2023).
- Suzuki, R., et al. Prognostic significance of total lymphocyte count, neutrophil-to-lymphocyte ratio, and platelet-to-lymphocyte ratio in limited-stage small-cell lung cancer. Clin Lung Cancer. 20 (2), 117-123 (2019).
- Grossman, S. A., et al. Survival in patients with severe lymphopenia following treatment with radiation and chemotherapy for newly diagnosed solid tumors. J Natl Compr Canc Netw. 13 (10), 1225-1231 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены