Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Factores clínicos que influyen en la dosis de radiación de las células inmunitarias circulantes durante la radioterapia para el cáncer de pulmón de células pequeñas
* Estos autores han contribuido por igual
En este artículo
Resumen
En este trabajo presentamos un protocolo para evaluar los efectos de la radioterapia sobre los linfocitos del sistema inmune en el cáncer de pulmón microcítico.
Resumen
El cáncer de pulmón de células pequeñas (CPCP) ha atraído una atención significativa debido a su alta malignidad, propensión a la metástasis a distancia y mal pronóstico. La radioterapia sigue siendo la piedra angular del tratamiento del cáncer de pulmón de células pequeñas en estadio limitado (LS-SCLC). Sin embargo, los resultados con radioterapia sola o en combinación con quimioterapia siguen siendo subóptimos. La radioterapia puede inducir linfopenia mediante la irradiación directa de órganos hematopoyéticos o la destrucción de linfocitos circulantes maduros, lo que conduce a la inmunosupresión y, en consecuencia, disminuye la eficacia terapéutica. El modelo de dosis estimada de radiación a las células inmunitarias (EDRIC) integra factores como la hemodinámica, la radiosensibilidad de los linfocitos y la capacidad de proliferación. Este estudio emplea el modelo EDRIC con mejoras para calcular la dosis de radiación de las células inmunitarias circulantes. Mediante la utilización de la metodología EDRIC, el estudio explora la correlación entre el EDRIC y el tamaño objetivo del tumor, la dosis pulmonar promedio, la dosis cardíaca promedio, las características clínicas y la linfocitopenia en sangre periférica durante la radioterapia para el LS-SCLC, con el objetivo de informar las estrategias de tratamiento personalizadas del paciente.
Este estudio analizó los datos de 64 pacientes con LS-SCLC que cumplieron los criterios de inclusión en el Hospital General de la Universidad Médica de Ningxia entre enero de 2023 y enero de 2024, todos los cuales recibieron radioterapia fraccionada convencional torácica radical. Los recuentos de linfocitos se registraron en los siguientes puntos: antes de la radioterapia, en el valor más bajo observado durante la radioterapia, al final de la radioterapia y un mes después de la radioterapia. Los datos dosimétricos, incluidas las dosis medias de pulmón, corazón y cuerpo, se extrajeron del sistema de planificación del tratamiento, y se calculó el EDRIC circulante utilizando este modelo. Se analizó la relación entre los valores de EDRIC y los resultados terapéuticos. En el LS-SCLC, el modelo EDRIC predice eficazmente la reducción del recuento de linfocitos, correlacionándose con la planificación del volumen objetivo (PTV; cm3), el estadio TNM y el porcentaje de contracción de la lesión objetivo. Después de la radioterapia, hubo una disminución significativa en los recuentos de linfocitos en sangre periférica, con mayores valores de EDRIC que indican una reducción de linfocitos más pronunciada.
Introducción
El cáncer de pulmón sigue siendo una de las principales causas de morbilidad y mortalidad en todo el mundo, y el cáncer de pulmón de células pequeñas (CPCP) representa entre el 13% y el 17% de los casos 1,2. El CPCP se caracteriza por un alto grado de malignidad y una propensión a la metástasis temprana a distancia, lo que a menudo conduce a un diagnóstico tardío y a un pronóstico precario. Los avances en la tecnología médica y una comprensión más profunda de las características biológicas del CPCP han puesto de relieve el valor potencial de la radioterapia en su tratamiento. No obstante, los resultados con radioterapia sola o en combinación con quimioterapia siguen siendo subóptimos. La identificación de los factores clave que influyen en la eficacia de la radioterapia en el CPCP es esencial para proporcionar una base teórica para las estrategias de tratamiento individualizadas y la predicción del pronóstico.
El sistema inmunitario presenta complejas interacciones con la radiación o la quimioterapia, lo que mejora la erradicación de las células tumorales durante el tratamiento 3,4. La radioterapia, por ejemplo, puede fomentar la activación inmunitaria a través de la liberación de citocinas o antígenos, induciendo así la regresión tumoral dentro del campo de radiación (conocido como efecto abscopal)5. Sin embargo, la radioterapia también puede inducir inmunosupresión en el tratamiento de diversos tumores sólidos, lo que puede comprometer la eficacia terapéutica. Esta inmunosupresión puede deberse a la mielosupresión debida a la irradiación directa de los órganos hematopoyéticos o a la destrucción de los linfocitos circulantes maduros, lo que da lugar a una reducción de los linfocitos. Los estudios han identificado el tamaño específico del tumor y las dosis de radiación a órganos críticos como el corazón y los pulmones en el cáncer de pulmón de células pequeñas como predictores cruciales de inmunosupresión, con implicaciones potenciales parala supervivencia del paciente.
Los linfocitos y sus células precursoras se encuentran entre los tipos de células más sensibles a la radiación7. La investigación de Susannah Yovino8 sobre la dosis de radiación celular circulante (DCC) en pacientes con glioma cerebral después de la radioterapia reveló que las alteraciones en el tamaño del volumen objetivo planificado (PTV) influyen en la dosis promedio de radiación DCC. La dosis de radiación a las células sanguíneas circulantes puede contribuir significativamente al mecanismo de linfocitopenia inducida. Si bien la irradiación de la médula ósea o los ganglios linfáticos puede inducir linfocitopenia, la irradiación de estructuras desprovistas de tejido linfoide o médula ósea, como el cerebro, también puede desencadenar linfocitopenia. Jin et al.9desarrollaron el modelo de dosis estimada de radiación a las células inmunitarias (EDRIC) y la dosimetría para cuantificar el daño del sistema inmunitario inducido por la radioterapia. En este estudio se emplea el modelo EDRIC con mejoras de Ladbury et al.6 para calcular la dosis de radiación de las células inmunitarias circulantes.
En consecuencia, se utilizó el método EDRIC para calcular la dosis de radiación de los linfocitos circulantes e investigar su relación con la eficacia y el pronóstico del tratamiento durante la radioterapia para el cáncer de pulmón microcítico10. Se analizó la correlación entre los valores de EDRIC y factores como la edad, el sexo, la puntuación del estado funcional de Karnofsky (KPS), los antecedentes de tabaquismo, el tamaño del tumor y el estadio tumoral. Además, se comparó la correlación entre la linfocitopenia en sangre periférica y la dosis de radiación de los linfocitos circulantes para sentar las bases de las estrategias de tratamiento personalizadas y la predicción del pronóstico.
Protocolo
Siguiendo un estricto cumplimiento de los criterios de inclusión y exclusión de este estudio, se obtuvo el consentimiento informado para la radioterapia de cada paciente y su tutor. La estadificación clínica se llevó a cabo de acuerdo con el sistema de estadificación TNM del American Joint Committee on Cancer (AJCC) (8ª edición). El Comité de Ética del Hospital General de la Universidad Médica de Ningxia (KYLL-2022-0984) otorgó la aprobación para este estudio.
NOTA: Los criterios de inclusión fueron los siguientes: (i) cáncer de pulmón microcítico en estadio limitado confirmado patológicamente (TNM, estadios II y III); ii) tratamiento inicial de radioterapia mediante radioterapia conformada de intensidad modulada (IMRT) o radioterapia de arco volumétrico con modulación de intensidad (VMAT), con una dosis total de radiación que oscila entre 50 y 60 Gy y una dosis única de 2 Gy; (iii) parámetros sanguíneos previos a la radioterapia dentro del rango normal (≥ de leucocitos 4 x 109 células/L, Hb ≥ 100 g/L, PLT ≥ 100 x 109/L) y función normal de órganos vitales como el corazón, el hígado y los riñones; (iv) disponibilidad de datos clínicos completos y registros de radioterapia; (v) supervivencia esperada de más de 3 meses; (vi) mujeres no embarazadas o en período de lactancia. Los criterios de exclusión incluían: (i) pacientes con trastornos de la sangre o del sistema inmunitario o daño orgánico significativo; (ii) antecedentes de tratamiento prolongado con esteroides orales; (iii) pacientes que no completaron la radioterapia programada; (iv) antecedentes recientes de infección confirmada.
1. Información clínica general
- Recopilar datos de los pacientes.
NOTA: Se recogieron datos de 64 pacientes diagnosticados de LS-SCLC, que cumplían los criterios de inclusión y que se sometieron a radioterapia en el Departamento de Radioterapia del Hospital General de la Universidad Médica de Ningxia entre enero de 2023 y enero de 2024. De ellos, 48 eran hombres y 16 mujeres, con edades comprendidas entre los 41 y los 85 años. De acuerdo con el sistema de estadificación TNM del AJCC (8ª edición), hubo 9 casos en estadio II y 55 en estadio III. Los 60 pacientes recibieron quimioterapia antes de la radioterapia, y 46 pacientes se sometieron a quimioterapia más de dos veces (Tabla 1). Técnicamente, la radioterapia incluye la radioterapia de intensidad modulada (IMRT, por sus siglas en inglés) o la terapia de arco con modulación de intensidad volumétrica (VMAT, por sus siglas en inglés).
2. Preparación previa al tratamiento
- Diagnosticar el cáncer de pulmón microcítico por broncoscopia o patología por punción11, como se muestra en la Figura 1.
- Excluir la metástasis mediante resonancia magnética (RMN) del cerebro, cuello y abdomen y localizar el área tumoral mediante tomografía por emisión de positrones-tomografía computarizada (PET/TC)12, como se muestra en la figura 2A-C.
- Realizar prueba de enzimas cardíacas, electrocardiograma, ecografía cardíaca, función pulmonar y función tiroidea para evaluar la función cardiopulmonar y juzgar que no existen contraindicaciones10.
- Informar plenamente a los pacientes y a sus familias de los riesgos y complicaciones relacionados con la radioterapia y firmar los consentimientos relacionados con la radioterapia.
NOTA: Tiempo de inicio de la radioterapia: para pacientes con tumores grandes, metástasis extensas de los ganglios linfáticos regionales y atelectasia concomitante, se pueden administrar 2 ciclos de quimioterapia primero, no más tarde del tercer ciclo de quimioterapia.
3. Radioterapia
- Posicionamiento: Mantener al paciente en decúbito supino, con la superficie corporal marcada con líneas de mapeo y las manos y los codos apoyados en la frente. Inmovilizar al paciente utilizando un molde termoplástico para asegurar la estabilidad. Realizar una tomografía computarizada mejorada para proporcionar una visualización clara del tumor y los vasos sanguíneos circundantes, como se muestra en la figura 3A.
NOTA: Los parámetros mejorados de la tomografía computarizada son los siguientes: (1) Dosis del agente de contraste: 80 ml de Dianbitol. (2) Velocidad de inyección: 3 mL/s. (3) Tiempo de escaneo: la primera fase: 30-35 s, la segunda fase: 70-80 s, si es necesario, se puede retrasar de 3 a 10 min. La tomografía computarizada abarcó el nivel superior de la base del cráneo, con el límite inferior que se extendía 10 cm por debajo del diafragma. Los cortes de imagen, de 5 mm de grosor, se cargan en el sistema de planificación de tratamiento Pinnacle. - Delimitación del objetivo: Delinee con precisión el área de radioterapia para el CPCP mediante un sistema pináculo en el posicionamiento de las imágenes de TC, como se muestra en la Figura 3B, C.
- Volumen tumoral grueso primario (GTVp): delinee el GTV mediante una combinación de ajustes de ventana pulmonar y mediastínica, adhiriéndose a los criterios RTOG y haciendo referencia a los hallazgos de PET-TC, TC mejorada y broncoscopia.
- Excluir de la delimitación las áreas de atelectasia y exudados desprovistos de absorción de fluorodesoxiglucosa (FDG). No envuelva rebabas largas ni piezas de tracción pleural. Incluya rebabas con una longitud de menos de 5 mm en el área objetivo.
- GTV del ganglio linfático metastásico (GTVnd): Delinee los ganglios linfáticos metastásicos mediastínicos mediante TC de tórax y PET/TC.
- Volumen clínico objetivo (CTV): Engloba el CTV GTVp con un margen de 0,5 cm, incorporando áreas de recorte anatómico y drenaje linfático acumulativamente involucradas.
- Planificación del volumen objetivo (PTV): Derivado de la CTV con un margen adicional de 0,5 cm y recorte anatómico.
NOTA: Órganos en riesgo Delimitación y limitaciones: Médula espinal: Dosis máxima (Dmax) < 40 Gy. Pulmón izquierdo: Volumen recibido 20 Gy (V20) < 20%. Pulmón derecho: V20 < 20%. Pulmones bilaterales: Dosis media (Dmean) < 13 Gy. Hígado: Volumen que recibe 30 Gy (V30) < 30%. Corazón: V30 < 30%, como se muestra en la Figura 3D-H.
- Volumen tumoral grueso primario (GTVp): delinee el GTV mediante una combinación de ajustes de ventana pulmonar y mediastínica, adhiriéndose a los criterios RTOG y haciendo referencia a los hallazgos de PET-TC, TC mejorada y broncoscopia.
- Desarrollar la planificación de la radioterapia bajo el sistema de planificación de la terapia computarizada: utilizar 6MV-X y radioterapia de intensidad modulada (IMRT) para evaluar la dosis objetivo.
NOTA: El PTV cubierto por la línea de dosis recetada tenía buena adaptabilidad, distribución uniforme de la dosis en el área objetivo, sin punto frío en el área objetivo y sin punto caliente en el órgano en riesgo. Los límites tisulares normales estaban en el rango normal, como se muestra en la Figura 3I, J. - Ejecutar el plan de radioterapia5: Realizar la radioterapia con un acelerador lineal y comparar la prueba de tomografía computarizada de haz cónico (CBCT) con la posición de TC de posicionamiento (una vez a la semana), doble colocación, una vez al día, 5 veces a la semana, como se muestra en la Figura 4A, B.
- Realizar una tomografía computarizada secundaria con una dosis que alcance los 30-40 GY para evaluar el efecto terapéutico. Reduzca el área objetivo si es necesario hasta que la dosis alcance 50-60 GY, como se muestra en la Figura 5A, B.
NOTA: La respuesta terapéutica se observó durante el proceso de tratamiento, y se dio tratamiento sintomático de acuerdo con la situación.
4. Método de evaluación e índice
- Calcule los datos de dosis pulmonar media, dosis cardíaca media y volumen de dosis total general de acuerdo con el método EDRIC con la siguiente fórmula:
EDRIC = 0,12 × MLD + 0,08 × MHD +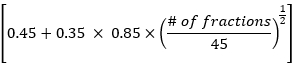 × MBD
× MBD
Donde, B1% = 0,12, B2% = 0,08, B3% = 0,45 y B4% = 0,35 representan el porcentaje de los cuatro principales órganos que contienen sangre (pulmón, corazón, vasos sanguíneos grandes, vasos sanguíneos/capilares pequeños) en el volumen total de sangre del cuerpo; MLD, MHD y MBD son la dosis pulmonar media, la dosis cardíaca media y la dosis corporal media, en la que MBD se refiere a la dosis de radiación por unidad de volumen del cuerpo. En este estudio, la DMO es la dosis corporal promedio desde el nivel del cartílago tiroides hasta el margen superior de la sexta vértebra torácica, que se puede obtener estadísticamente a través del sistema de planificación del tratamiento. - Observar los cambios en las lesiones de la TC de tórax y en los ganglios linfáticos mediastínicos en los pacientes antes y 1 mes después de la radioterapia. Evaluar la eficacia del tratamiento según los criterios de evaluación de la respuesta en tumores sólidos (RECIST), y analizar la relación entre el valor EDRIC y la eficacia del tratamiento.
- Contar el valor más bajo de linfocitos de sangre periférica antes y durante la radioterapia y analizar su correlación con la dosis de radiación de los linfocitos circulantes y el efecto terapéutico.
5. Métodos estadísticos
- Realizar análisis estadísticos utilizando la prueba T de muestra independiente o la prueba de Chi-cuadrado para evaluar las diferencias entre grupos de variables continuas y categóricas.
- Utilice el coeficiente de correlación de Spearman para evaluar las correlaciones de variables.
NOTA: Todos los análisis estadísticos se realizaron con el programa SPSS y se consideró estadísticamente significativo un < P de 0,05.
Resultados
Resultado clínico
Los cambios en el tiempo operatorio de las lesiones de la TC de tórax y de los ganglios linfáticos mediastínicos se observaron en todos los pacientes antes y 1 mes después de la radioterapia, evaluándose la eficacia terapéutica según los criterios RECIST. Entre los 64 pacientes con cáncer de pulmón de células pequeñas en estadio limitado, 4 casos mostraron una respuesta completa, mientras que 57 casos mostraron una respuesta parcial y tre...
Discusión
El sistema inmunitario desempeña un papel fundamental en el control tumoral durante la radioterapia, pero la inmunotoxicidad inducida por la radiación, como la linfocitopenia, está relacionada con resultados de supervivencia desfavorables13,14. El CPCP se caracteriza por su alta malignidad, a menudo diagnosticada en estadios avanzados con un pronóstico sombrío. La radioterapia se erige como el tratamiento fundamental para el...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el Proyecto de Investigación a nivel universitario de la Universidad Médica de Ningxia (XM2022017).
Materiales
| Name | Company | Catalog Number | Comments |
| CT machine | Siemens Healthcare | SOMATOM Force | |
| MRI machine | Siemens Healthcare | MAGNETOM Terra | |
| Varian Clinac_IX Medical electron linear Accelerator | Siemens Healthcare | IX |
Referencias
- Oronsky, B., Reid, T. R., Oronsky, A., Carter, C. A. What's New in SCLC? A Review. Neoplasia. 19 (10), 842-847 (2017).
- Pike, L. R. G., et al. The impact of radiation therapy on lymphocyte count and survival in metastatic cancer patients receiving PD-1 immune checkpoint inhibitors. Int J Radiat Oncol Biol Phys. 103 (1), 142-151 (2019).
- Brahmer, J. R. Harnessing the immune system for the treatment of non-small-cell lung cancer. J Clin Oncol. 31 (8), 1021-1028 (2013).
- Takeshima, T., et al. Key role for neutrophils in radiation-induced antitumor immune responses: Potentiation with G-CSF. Proc Natl Acad Sci U S A. 113 (40), 11300-11305 (2016).
- Yoon, S. W., et al. Per-fraction positional and dosimetric performance of prone breast tangential radiotherapy on Halcyon™ linear accelerator assessed with daily rapid kilo-voltage cone beam computed tomography: a single-institution pilot study. Radiat Oncol. 15 (1), 258 (2020).
- Ladbury, C. J., Rusthoven, C. G., Camidge, D. R., Kavanagh, B. D., Nath, S. K. Impact of radiation dose to the host immune system on tumor control and survival for stage III non-small cell lung cancer treated with definitive radiation therapy. Int J Radiat Oncol Biol Phys. 105 (2), 346-355 (2019).
- Schrek, R. Qualitative and quantitative reactions of lymphocytes to x rays. Ann N Y Acad Sci. 95, 839-848 (1961).
- Yovino, S., Kleinberg, L., Grossman, S. A., Narayanan, M., Ford, E. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Jin, J. Y., et al. A framework for modeling radiation induced lymphopenia in radiotherapy. Radiother Oncol. 144, 105-113 (2020).
- Jin, J. Y., et al. Higher radiation dose to the immune cells correlates with worse tumor control and overall survival in patients with stage III NSCLC: A secondary analysis of RTOG0617. Cancers (Basel). 13 (24), 6193 (2021).
- Lalić, N., et al. Invasive diagnostic procedures from bronchoscopy to surgical biopsy-optimization of non-small cell lung cancer samples for molecular testing. Medicina (Kaunas). 59 (10), 1723 (2023).
- Cerra-Franco, A., et al. Predictors of nodal and metastatic failure in early stage non-small-cell lung cancer after stereotactic body radiation therapy. Clin Lung Cancer. 20 (3), 186-193 (2019).
- Venkatesulu, B. P., Mallick, S., Lin, S. H., Krishnan, S. A systematic review of the influence of radiation-induced lymphopenia on survival outcomes in solid tumors. Crit Rev Oncol Hematol. 123, 42-51 (2018).
- Upadhyay, R., et al. Risk and impact of radiation related lymphopenia in lung cancer: A systematic review and meta-analysis. Radiother Oncol. 157, 225-233 (2021).
- Chow, R., Simone, C. B. Radiation induced lymphopenia in head and neck cancer: The importance of rigorous statistical analysis, radiation field size, and treatment modality. Radiother Oncol. 170, 242 (2022).
- Xu, H., et al. Lymphopenia during definitive chemoradiotherapy in esophageal squamous cell carcinoma: Association with dosimetric parameters and patient outcomes. Oncologist. 26 (3), e425-e434 (2021).
- Liu, Z., et al. Pivotal roles of tumor-draining lymph nodes in the abscopal effects from combined immunotherapy and radiotherapy. Cancer Commun (Lond). 42 (10), 971-986 (2022).
- Yovino, S., et al. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Koukourakis, M. I., Giatromanolaki, A. Lymphopenia and intratumoral lymphocytic balance in the era of cancer immuno-radiotherapy. Crit Rev Oncol Hematol. 159, 103226 (2021).
- Tang, C., et al. Acute phase response before treatment predicts radiation esophagitis in non-small cell lung cancer. Radiother Oncol. 110 (3), 493-498 (2014).
- Dai, D., Tian, Q., Shui, Y., Li, J., Wei, Q. The impact of radiation induced lymphopenia in the prognosis of head and neck cancer: A systematic review and meta-analysis. Radiother Oncol. 168, 28-36 (2022).
- Damen, P. J. J., et al. The influence of severe radiation-induced lymphopenia on overall survival in solid tumors: A systematic review and meta-analysis. Int J Radiat Oncol Biol Phys. 111 (4), 936-948 (2021).
- Lin, Y. J., Kang, Y. M., Wu, Y. H., Chen, Y. W., Hu, Y. W. Lymphocytopenia and survival after whole-brain radiotherapy in patients with small-cell lung cancer. Thorac Cancer. 14 (14), 1268-1275 (2023).
- Suzuki, R., et al. Prognostic significance of total lymphocyte count, neutrophil-to-lymphocyte ratio, and platelet-to-lymphocyte ratio in limited-stage small-cell lung cancer. Clin Lung Cancer. 20 (2), 117-123 (2019).
- Grossman, S. A., et al. Survival in patients with severe lymphopenia following treatment with radiation and chemotherapy for newly diagnosed solid tumors. J Natl Compr Canc Netw. 13 (10), 1225-1231 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados