Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Facteurs cliniques influençant la dose de rayonnement des cellules immunitaires circulantes pendant la radiothérapie pour le cancer du poumon à petites cellules
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous présentons un protocole pour évaluer les effets de la radiothérapie sur les lymphocytes du système immunitaire dans le cancer du poumon à petites cellules.
Résumé
Le cancer du poumon à petites cellules (CPPC) a suscité beaucoup d’attention en raison de sa malignité élevée, de sa propension aux métastases à distance et de son mauvais pronostic. La radiothérapie reste la pierre angulaire du traitement du cancer du poumon à petites cellules de stade limité (LS-SCLC). Cependant, les résultats avec la radiothérapie seule ou en combinaison avec la chimiothérapie restent sous-optimaux. La radiothérapie peut induire une lymphopénie en irradiant directement des organes hématopoïétiques ou en détruisant les lymphocytes circulants matures, conduisant à une immunosuppression et par conséquent diminuant l’efficacité thérapeutique. Le modèle EDRIC (estimation de la dose de rayonnement aux cellules immunitaires) intègre des facteurs tels que l’hémodynamique, la radiosensibilité des lymphocytes et la capacité de prolifération. Cette étude utilise le modèle EDRIC avec des améliorations pour calculer la dose de rayonnement des cellules immunitaires circulantes. En utilisant la méthodologie EDRIC, l’étude explore la corrélation entre l’EDRIC et la taille cible de la tumeur, la dose pulmonaire moyenne, la dose cardiaque moyenne, les caractéristiques cliniques et la lymphocytopénie du sang périphérique pendant la radiothérapie pour le LS-SCLC, dans le but d’éclairer les stratégies de traitement personnalisées des patients.
Cette étude a analysé les données de 64 patients atteints de LS-SCLC qui répondaient aux critères d’inclusion à l’hôpital général de l’Université de médecine du Ningxia de janvier 2023 à janvier 2024, qui ont tous reçu une radiothérapie fractionnée conventionnelle thoracique radicale. Le nombre de lymphocytes a été enregistré aux points suivants : avant la radiothérapie, à la valeur la plus basse observée pendant la radiothérapie, à la fin de la radiothérapie et un mois après la radiothérapie. Les données dosimétriques, y compris les doses moyennes dans les poumons, le cœur et le corps, ont été extraites du système de planification du traitement, et l’EDRIC circulant a été calculée à l’aide de ce modèle. La relation entre les valeurs EDRIC et les résultats thérapeutiques a été analysée. Dans le LS-SCLC, le modèle EDRIC prédit efficacement la réduction du nombre de lymphocytes, en corrélation avec le volume cible de planification (PTV ; cm3), le stade TNM et le pourcentage de rétrécissement de la lésion cible. Après la radiothérapie, il y a eu une diminution significative du nombre de lymphocytes du sang périphérique, avec des valeurs EDRIC plus élevées indiquant une réduction plus prononcée des lymphocytes.
Introduction
Le cancer du poumon reste l’une des principales causes de morbidité et de mortalité dans le monde, le cancer du poumon à petites cellules (CPPC) représentant 13 à 17 % des cas 1,2. Le CPPC se caractérise par un degré élevé de malignité et une propension à métastases précoces à distance, conduisant souvent à un diagnostic tardif et à un mauvais pronostic. Les progrès de la technologie médicale et une meilleure compréhension des caractéristiques biologiques du CPPC ont mis en évidence la valeur potentielle de la radiothérapie dans son traitement. Néanmoins, les résultats de la radiothérapie seule ou en association avec la chimiothérapie restent sous-optimaux. L’identification des facteurs clés influençant l’efficacité de la radiothérapie dans le CPPC est essentielle pour fournir une base théorique pour des stratégies de traitement individualisées et une prédiction du pronostic.
Le système immunitaire présente des interactions complexes avec la radiothérapie ou la chimiothérapie, ce qui améliore l’éradication des cellules tumorales pendant le traitement 3,4. La radiothérapie, par exemple, peut favoriser l’activation immunitaire via la libération de cytokines ou d’antigènes, induisant ainsi une régression tumorale dans le champ de rayonnement (connue sous le nom d’effet abscopal)5. Cependant, la radiothérapie peut également induire une immunosuppression lors du traitement de diverses tumeurs solides, compromettant potentiellement l’efficacité thérapeutique. Cette immunosuppression peut provenir d’une myélosuppression due à l’irradiation directe d’organes hématopoïétiques ou à la destruction des lymphocytes circulants matures, entraînant une réduction des lymphocytes. Des études ont mis en évidence la taille spécifique de la tumeur et les doses de rayonnement dans des organes critiques tels que le cœur et les poumons dans le cancer du poumon à petites cellules comme des prédicteurs cruciaux de l’immunosuppression, avec des implications potentielles pour la survie des patients6.
Les lymphocytes et leurs cellules précurseurs figurent parmi les types de cellules les plus sensibles aux rayonnements7. L’étude de Susannah Yovino sur la dose de rayonnement cellulaire circulant (DCC) chez les patients atteints de gliome cérébral après la radiothérapie a révélé que les modifications de la taille du volume cible de planification (PTV) influencent la dose moyenne de rayonnement DCC. La dose de rayonnement reçue par les cellules sanguines circulantes peut contribuer de manière significative au mécanisme de lymphocytopénie induite. Alors que l’irradiation de la moelle osseuse ou des ganglions lymphatiques peut induire une lymphocytopénie, l’irradiation de structures dépourvues de tissu lymphoïde ou de moelle osseuse, comme le cerveau, peut également déclencher une lymphocytopénie. Jin et al.9ont mis au point le modèle EDRIC (Estimated Dose of Radiation to Immune Cells) et la dosimétrie pour quantifier les dommages au système immunitaire induits par la radiothérapie. Cette étude utilise le modèle EDRIC avec les améliorations de Ladbury et al.6 pour calculer la dose de rayonnement des cellules immunitaires circulantes.
Par conséquent, la méthode EDRIC a été utilisée pour calculer la dose de rayonnement lymphocytaire circulant et étudier sa relation avec l’efficacité du traitement et le pronostic pendant la radiothérapie du cancer du poumon à petites cellules10. La corrélation entre les valeurs EDRIC et des facteurs tels que l’âge, le sexe, le score Karnofsky Performance Status (KPS), les antécédents de tabagisme, la taille de la tumeur et le stade de la tumeur a été analysée par stratification. De plus, la corrélation entre la lymphocytopénie du sang périphérique et la dose de rayonnement lymphocytaire circulant a été comparée afin de jeter les bases de stratégies de traitement personnalisées et de prédiction du pronostic.
Protocole
Suite au strict respect des critères d’inclusion et d’exclusion de cette étude, le consentement éclairé pour la radiothérapie a été obtenu de chaque patient et de son tuteur. La stadification clinique a été réalisée conformément au système de stadification TNM de l’American Joint Committee on Cancer (AJCC) (8e édition). Le comité d’éthique de l’hôpital général de l’Université de médecine du Ningxia (KYLL-2022-0984) a approuvé cette étude.
REMARQUE : Les critères d’inclusion étaient les suivants : (i) cancer du poumon à petites cellules de stade limité pathologiquement confirmé (TNM de stades II et III) ; (ii) traitement initial de radiothérapie utilisant la radiothérapie conformationnelle avec modulation d’intensité (IMRT) ou la radiothérapie avec modulation d’intensité à arc volumétrique (VMAT), avec une dose totale de rayonnement allant de 50 à 60 Gy et une dose unique de 2 Gy ; (iii) paramètres sanguins pré-radiothérapie dans la plage normale (GB ≥ 4 x 109 cellules/L, Hb ≥ 100 g/L, PLT ≥ 100 x 109/L), et le fonctionnement normal des organes vitaux tels que le cœur, le foie et les reins ; iv) la disponibilité de données cliniques complètes et de dossiers de radiothérapie ; (v) survie attendue de plus de 3 mois ; vi) les femmes non enceintes ou allaitantes. Les critères d’exclusion comprenaient : (i) les patients atteints de troubles du sang ou du système immunitaire ou de lésions organiques importantes ; (ii) des antécédents de corticothérapie orale prolongée ; (iii) les patients qui n’ont pas terminé la radiothérapie prévue ; (iv) des antécédents récents d’infection confirmée.
1. Renseignements cliniques généraux
- Collectez les données des patients.
REMARQUE : Les données de 64 patients diagnostiqués avec LS-SCLC, répondant aux critères d’inclusion et subissant une radiothérapie au Département de radiothérapie de l’Hôpital général de l’Université de médecine du Ningxia de janvier 2023 à janvier 2024, ont été collectées. Parmi eux, 48 étaient des hommes et 16 des femmes, âgés de 41 à 85 ans. Selon le système de stadification de l’AJCC TNM (8e édition), il y a eu 9 cas de stade II et 55 cas de stade III. Les 60 patients ont reçu une chimiothérapie avant la radiothérapie, et 46 patients ont subi une chimiothérapie plus de deux fois (tableau 1). La radiothérapie comprend techniquement la radiothérapie avec modulation d’intensité (RCMI) ou la thérapie par arc volumétrique avec modulation d’intensité (VMAT).
2. Préparation du prétraitement
- Diagnostiquer le cancer du poumon à petites cellules par bronchoscopie ou pathologie par ponction11, comme illustré à la figure 1.
- Exclure les métastases à l’aide de l’imagerie par résonance magnétique (IRM) du cerveau, du cou et de l’abdomen et localiser la zone tumorale par tomographie par émission de positons (TEP/TDM)12, comme le montre la figure 2A-C.
- Effectuez un test d’enzymes cardiaques, un électrocardiogramme, une échographie cardiaque, une fonction pulmonaire et une fonction thyroïdienne pour évaluer la fonction cardiopulmonaire et juger qu’il n’y a pas de contre-indications10.
- Informer pleinement les patients et leurs familles des risques et complications liés à la radiothérapie et signer les consentements liés à la radiothérapie.
REMARQUE : Temps d’initiation de la radiothérapie : pour les patients présentant de grosses tumeurs, des métastases étendues des ganglions lymphatiques régionaux et une atélectasie concomitante, 2 cycles de chimiothérapie peuvent être administrés en premier, au plus tard au troisième cycle de chimiothérapie.
3. Radiothérapie
- Positionnement : Maintenez le patient en décubitus dorsal, la surface du corps marquée par des lignes de cartographie et les mains et les coudes reposant sur le front. Immobiliser le patient à l’aide d’un moule thermoplastique pour assurer la stabilité. Effectuez une tomodensitométrie améliorée pour fournir une visualisation claire de la tumeur et des vaisseaux sanguins environnants, comme le montre la figure 3A.
REMARQUE : Les paramètres de tomodensitométrie améliorés sont les suivants : (1) Dosage de l’agent de contraste : 80 mL de dianbitol. (2) Taux d’injection : 3 mL/s. (3) Temps de balayage : la première phase : 30-35 s, la deuxième phase : 70-80 s, si nécessaire, peut être retardée de 3 à 10 min. La simulation de tomodensitométrie englobait le niveau supérieur de la base du crâne, la limite inférieure s’étendant à 10 cm sous le diaphragme. Des tranches d’images, d’une épaisseur de 5 mm, sont téléchargées dans le système de planification du traitement Pinnacle. - Délimitation de la cible : Délimitez avec précision la zone de radiothérapie pour le CPPC par un système de pinacle en positionnant les images CT, comme le montrent les figures 3B et C.
- Volume tumoral brut primaire (GTVp) : Délimitez la GTV à l’aide d’une combinaison de paramètres de fenêtre pulmonaire et médiastinale, en respectant les critères RTOG et en faisant référence aux résultats de la TEP-TDM, de la TDM améliorée et de la bronchoscopie.
- Exclure de la délimitation les zones d’atélectasie et les exsudats dépourvus d’absorption de fluorodésoxyglucose (FDG). N’enveloppez pas de longues bavures et de pièces de traction pleurale. Incluez des meules d’une longueur inférieure à 5 mm dans la zone cible.
- GTV du ganglion métastatique (GTVnd) : Délimiter les ganglions lymphatiques métastatiques médiastinaux à l’aide de la TDM thoracique et de la TEP/TDM.
- Volume cible clinique (CTV) : Englobe la CTV GTVp avec une marge de 0,5 cm, en incorporant une coupe anatomique et des zones de drainage lymphatique impliquées cumulativement.
- Volume cible de planification (PTV) : Dérivez de la CTV avec une marge supplémentaire de 0,5 cm et une coupe anatomique.
REMARQUE : Délimitation et contraintes des organes à risque : Moelle épinière : dose maximale (Dmax) < 40 Gy. Poumon gauche : Volume recevant 20 Gy (V20) < 20 %. Poumon droit : V20 < 20 %. Poumons bilatéraux : Dose moyenne (Dmean) < 13 Gy. Foie : Volume recevant 30 Gy (V30) < 30 %. Cœur : V30 < 30 %, comme le montre la figure 3D-H.
- Volume tumoral brut primaire (GTVp) : Délimitez la GTV à l’aide d’une combinaison de paramètres de fenêtre pulmonaire et médiastinale, en respectant les critères RTOG et en faisant référence aux résultats de la TEP-TDM, de la TDM améliorée et de la bronchoscopie.
- Élaborer la planification de la radiothérapie dans le cadre du système informatisé de planification de la thérapie : utiliser le 6MV-X et la radiothérapie avec modulation d’intensité (IMRT) pour évaluer la dose cible.
REMARQUE : Le PTV couvert par la ligne de dose prescrite présentait une bonne conformabilité, une distribution uniforme de la dose dans la zone cible, aucun point froid dans la zone cible et aucun point chaud dans l’organe à risque. Les limites tissulaires normales se situaient dans la plage normale, comme le montrent les figures 3I et J. - Exécutez le plan de radiothérapie5 : Effectuez la radiothérapie à l’aide d’un accélérateur linéaire et comparez le test de tomodensitométrie à faisceau conique (CBCT) avec la position CT de positionnement (une fois par semaine), le double placement, une fois par jour, 5 fois par semaine, comme le montre la figure 4A, B.
- Effectuez une tomodensitométrie secondaire avec une dose atteignant 30-40 GY pour évaluer l’effet thérapeutique. Réduire la zone cible si nécessaire jusqu’à ce que la dose atteigne 50-60 GY, comme le montrent les figures 5A, B.
REMARQUE : La réponse thérapeutique a été observée au cours du processus de traitement, et un traitement symptomatique a été administré en fonction de la situation.
4. Méthode d’évaluation et indice
- Calculez les données relatives à la dose pulmonaire moyenne, à la dose cardiaque moyenne et au volume total de la dose selon la méthode EDRIC à l’aide de la formule suivante :
EDRIC = 0,12 × MLD + 0,08 × MHD +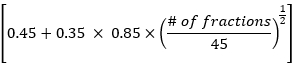 × MBD
× MBD
où B1 % = 0,12, B2 % = 0,08, B3 % = 0,45 et B4 % = 0,35 représentent le pourcentage des quatre principaux organes contenant du sang (poumon, cœur, gros vaisseaux sanguins, petits vaisseaux sanguins/capillaires) dans le volume sanguin total du corps ; MLD, MHD et MBD sont la dose moyenne dans les poumons, la dose cardiaque moyenne et la dose corporelle moyenne, dans laquelle MBD fait référence à la dose de rayonnement par unité de volume du corps. Dans cette étude, la MBD est la dose corporelle moyenne du niveau du cartilage thyroïdien à la marge supérieure de la sixième vertèbre thoracique, qui peut être obtenue statistiquement grâce au système de planification du traitement. - Observez les changements dans les lésions de la tomodensitométrie thoracique et les ganglions lymphatiques médiastinaux chez les patients avant et 1 mois après la radiothérapie. Évaluer l’efficacité du traitement selon les critères d’évaluation de la réponse dans les tumeurs solides (RECIST), et analyser la relation entre la valeur EDRIC et l’efficacité du traitement.
- Comptez la valeur la plus basse des lymphocytes du sang périphérique avant et pendant la radiothérapie et analysez sa corrélation avec la dose de rayonnement des lymphocytes circulants et l’effet thérapeutique.
5. Méthodes statistiques
- Effectuez des analyses statistiques à l’aide du test T de l’échantillon indépendant ou du test du chi carré pour évaluer les différences entre les groupes de variables continues et catégorielles.
- Utilisez le coefficient de corrélation de Spearman pour évaluer les corrélations de variables.
REMARQUE : Toutes les analyses statistiques ont été effectuées à l’aide de SPSS, et le P < 0,05 a été considéré comme statistiquement significatif.
Résultats
Résultat clinique
Les changements de temps opératoire dans les lésions de la tomodensitométrie thoracique et les ganglions lymphatiques médiastinaux ont été observés chez tous les patients avant et 1 mois après la radiothérapie, l’efficacité thérapeutique étant évaluée à l’aide des critères RECIST. Parmi les 64 patients atteints d’un cancer du poumon à petites cellules de stade limité, 4 cas ont présenté une réponse complète, tandis que 57...
Discussion
Le système immunitaire joue un rôle central dans le contrôle des tumeurs pendant la radiothérapie, mais l’immunotoxicité induite par les radiations, telle que la lymphocytopénie, est liée à des résultats de survie défavorables13,14. Le CPPC se caractérise par une forte malignité, souvent diagnostiquée à des stades avancés avec un pronostic sombre. La radiothérapie est la pierre angulaire du traitement du LS-SCLC...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le projet de recherche de niveau universitaire de l’Université de médecine du Ningxia (XM2022017).
matériels
| Name | Company | Catalog Number | Comments |
| CT machine | Siemens Healthcare | SOMATOM Force | |
| MRI machine | Siemens Healthcare | MAGNETOM Terra | |
| Varian Clinac_IX Medical electron linear Accelerator | Siemens Healthcare | IX |
Références
- Oronsky, B., Reid, T. R., Oronsky, A., Carter, C. A. What's New in SCLC? A Review. Neoplasia. 19 (10), 842-847 (2017).
- Pike, L. R. G., et al. The impact of radiation therapy on lymphocyte count and survival in metastatic cancer patients receiving PD-1 immune checkpoint inhibitors. Int J Radiat Oncol Biol Phys. 103 (1), 142-151 (2019).
- Brahmer, J. R. Harnessing the immune system for the treatment of non-small-cell lung cancer. J Clin Oncol. 31 (8), 1021-1028 (2013).
- Takeshima, T., et al. Key role for neutrophils in radiation-induced antitumor immune responses: Potentiation with G-CSF. Proc Natl Acad Sci U S A. 113 (40), 11300-11305 (2016).
- Yoon, S. W., et al. Per-fraction positional and dosimetric performance of prone breast tangential radiotherapy on Halcyon™ linear accelerator assessed with daily rapid kilo-voltage cone beam computed tomography: a single-institution pilot study. Radiat Oncol. 15 (1), 258 (2020).
- Ladbury, C. J., Rusthoven, C. G., Camidge, D. R., Kavanagh, B. D., Nath, S. K. Impact of radiation dose to the host immune system on tumor control and survival for stage III non-small cell lung cancer treated with definitive radiation therapy. Int J Radiat Oncol Biol Phys. 105 (2), 346-355 (2019).
- Schrek, R. Qualitative and quantitative reactions of lymphocytes to x rays. Ann N Y Acad Sci. 95, 839-848 (1961).
- Yovino, S., Kleinberg, L., Grossman, S. A., Narayanan, M., Ford, E. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Jin, J. Y., et al. A framework for modeling radiation induced lymphopenia in radiotherapy. Radiother Oncol. 144, 105-113 (2020).
- Jin, J. Y., et al. Higher radiation dose to the immune cells correlates with worse tumor control and overall survival in patients with stage III NSCLC: A secondary analysis of RTOG0617. Cancers (Basel). 13 (24), 6193 (2021).
- Lalić, N., et al. Invasive diagnostic procedures from bronchoscopy to surgical biopsy-optimization of non-small cell lung cancer samples for molecular testing. Medicina (Kaunas). 59 (10), 1723 (2023).
- Cerra-Franco, A., et al. Predictors of nodal and metastatic failure in early stage non-small-cell lung cancer after stereotactic body radiation therapy. Clin Lung Cancer. 20 (3), 186-193 (2019).
- Venkatesulu, B. P., Mallick, S., Lin, S. H., Krishnan, S. A systematic review of the influence of radiation-induced lymphopenia on survival outcomes in solid tumors. Crit Rev Oncol Hematol. 123, 42-51 (2018).
- Upadhyay, R., et al. Risk and impact of radiation related lymphopenia in lung cancer: A systematic review and meta-analysis. Radiother Oncol. 157, 225-233 (2021).
- Chow, R., Simone, C. B. Radiation induced lymphopenia in head and neck cancer: The importance of rigorous statistical analysis, radiation field size, and treatment modality. Radiother Oncol. 170, 242 (2022).
- Xu, H., et al. Lymphopenia during definitive chemoradiotherapy in esophageal squamous cell carcinoma: Association with dosimetric parameters and patient outcomes. Oncologist. 26 (3), e425-e434 (2021).
- Liu, Z., et al. Pivotal roles of tumor-draining lymph nodes in the abscopal effects from combined immunotherapy and radiotherapy. Cancer Commun (Lond). 42 (10), 971-986 (2022).
- Yovino, S., et al. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Koukourakis, M. I., Giatromanolaki, A. Lymphopenia and intratumoral lymphocytic balance in the era of cancer immuno-radiotherapy. Crit Rev Oncol Hematol. 159, 103226 (2021).
- Tang, C., et al. Acute phase response before treatment predicts radiation esophagitis in non-small cell lung cancer. Radiother Oncol. 110 (3), 493-498 (2014).
- Dai, D., Tian, Q., Shui, Y., Li, J., Wei, Q. The impact of radiation induced lymphopenia in the prognosis of head and neck cancer: A systematic review and meta-analysis. Radiother Oncol. 168, 28-36 (2022).
- Damen, P. J. J., et al. The influence of severe radiation-induced lymphopenia on overall survival in solid tumors: A systematic review and meta-analysis. Int J Radiat Oncol Biol Phys. 111 (4), 936-948 (2021).
- Lin, Y. J., Kang, Y. M., Wu, Y. H., Chen, Y. W., Hu, Y. W. Lymphocytopenia and survival after whole-brain radiotherapy in patients with small-cell lung cancer. Thorac Cancer. 14 (14), 1268-1275 (2023).
- Suzuki, R., et al. Prognostic significance of total lymphocyte count, neutrophil-to-lymphocyte ratio, and platelet-to-lymphocyte ratio in limited-stage small-cell lung cancer. Clin Lung Cancer. 20 (2), 117-123 (2019).
- Grossman, S. A., et al. Survival in patients with severe lymphopenia following treatment with radiation and chemotherapy for newly diagnosed solid tumors. J Natl Compr Canc Netw. 13 (10), 1225-1231 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon