É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fatores clínicos que influenciam a dose de radiação de células imunes circulantes durante a radioterapia para câncer de pulmão de pequenas células
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para avaliar os efeitos da radioterapia nos linfócitos do sistema imunológico no câncer de pulmão de pequenas células.
Resumo
O câncer de pulmão de pequenas células (CPPC) tem recebido atenção significativa devido à sua alta malignidade, propensão a metástases à distância e mau prognóstico. A radioterapia continua sendo a base do tratamento para o câncer de pulmão de pequenas células em estágio limitado (LS-SCLC). No entanto, os desfechos com radioterapia isolada ou em combinação com quimioterapia permanecem abaixo do ideal. A radioterapia pode induzir linfopenia irradiando diretamente órgãos hematopoiéticos ou destruindo linfócitos circulantes maduros, levando à imunossupressão e, consequentemente, diminuindo a eficácia terapêutica. O modelo de dose estimada de radiação para células imunes (EDRIC) integra fatores como hemodinâmica, radiossensibilidade de linfócitos e capacidade de proliferação. Este estudo emprega o modelo EDRIC com aprimoramentos para calcular a dose de radiação de células imunes circulantes. Ao utilizar a metodologia EDRIC, o estudo explora a correlação entre EDRIC e tamanho alvo do tumor, dose pulmonar média, dose cardíaca média, características clínicas e linfocitopenia do sangue periférico durante a radioterapia para LS-SCLC, com o objetivo de informar estratégias personalizadas de tratamento do paciente.
Este estudo analisou dados de 64 pacientes com LS-SCLC que atenderam aos critérios de inclusão no Hospital Geral da Universidade Médica de Ningxia de janeiro de 2023 a janeiro de 2024, todos os quais receberam radioterapia convencional torácica radical fracionada. A contagem de linfócitos foi registrada nos seguintes momentos: antes da radioterapia, no menor valor observado durante a radioterapia, no final da radioterapia e um mês após a radioterapia. Os dados dosimétricos, incluindo doses médias de pulmão, coração e corpo, foram extraídos do sistema de planejamento do tratamento, e o EDRIC circulante foi calculado usando esse modelo. A relação entre os valores de EDRIC e os resultados terapêuticos foi analisada. No LS-SCLC, o modelo EDRIC prevê efetivamente a redução da contagem de linfócitos, correlacionando-se com o volume alvo de planejamento (PTV; cm3), estágio TNM e a porcentagem de encolhimento da lesão-alvo. Após a radioterapia, houve uma diminuição significativa na contagem de linfócitos do sangue periférico, com maiores valores de EDRIC indicando redução mais pronunciada de linfócitos.
Introdução
O câncer de pulmão continua sendo uma das principais causas de morbidade e mortalidade em todo o mundo, com o câncer de pulmão de pequenas células (CPPC) compreendendo 13%-17% dos casos 1,2. O CPPC é caracterizado por um alto grau de malignidade e uma propensão a metástases precoces à distância, muitas vezes levando a diagnósticos em estágio avançado e mau prognóstico. Os avanços na tecnologia médica e uma compreensão mais profunda das características biológicas do CPPC destacaram o valor potencial da radioterapia em seu tratamento. No entanto, os desfechos com radioterapia isolada ou em combinação com quimioterapia permanecem abaixo do ideal. A identificação dos principais fatores que influenciam a eficácia da radioterapia no CPPC é essencial para fornecer uma base teórica para estratégias de tratamento individualizadas e previsão de prognóstico.
O sistema imunológico exibe interações intrincadas com radiação ou quimioterapia, aumentando a erradicação das células tumorais durante o tratamento 3,4. A radioterapia, por exemplo, pode promover a ativação imunológica por meio da liberação de citocinas ou antígenos, induzindo assim a regressão tumoral dentro do campo de radiação (conhecido como efeito abscopal)5. No entanto, a radioterapia também pode induzir imunossupressão no tratamento de vários tumores sólidos, potencialmente comprometendo a eficácia terapêutica. Essa imunossupressão pode resultar da mielossupressão devido à irradiação direta de órgãos hematopoiéticos ou à destruição de linfócitos circulantes maduros, resultando em linfócitos reduzidos. Estudos identificaram o tamanho específico do tumor e as doses de radiação em órgãos críticos, como coração e pulmões, no câncer de pulmão de pequenas células como preditores cruciais de imunossupressão, com implicações potenciais para a sobrevida do paciente6.
Os linfócitos e suas células precursoras estão entre os tipos de células mais sensíveis à radiação7. A investigação de Susannah Yovino8 sobre a dose de radiação de células circulantes (DCC) em pacientes com glioma cerebral pós-radioterapia revelou que alterações no tamanho do volume alvo de planejamento (PTV) influenciam a dose média de radiação DCC. A dose de radiação nas células sanguíneas circulantes pode contribuir significativamente para o mecanismo de linfocitopenia induzida. Embora a irradiação da medula óssea ou dos gânglios linfáticos possa induzir linfocitopenia, a irradiação de estruturas desprovidas de tecido linfóide ou medula óssea, como o cérebro, também pode desencadear linfocitopenia. Jin et al.9desenvolveram o modelo de dose estimada de radiação para células imunes (EDRIC) e dosimetria para quantificar o dano ao sistema imunológico induzido por radioterapia. Este estudo emprega o modelo EDRIC com aprimoramentos de Ladbury et al.6 para calcular a dose de radiação de células imunes circulantes.
Consequentemente, o método EDRIC foi utilizado para calcular a dose de radiação de linfócitos circulantes e investigar sua relação com a eficácia do tratamento e o prognóstico durante a radioterapia para câncer de pulmão de pequenas células10. A correlação entre os valores de EDRIC e fatores como idade, sexo, escore Karnofsky Performance Status (KPS), história de tabagismo, tamanho do tumor e estágio do tumor foi analisada por meio de estratificação. Além disso, a correlação entre a linfocitopenia do sangue periférico e a dose de radiação de linfócitos circulantes foi comparada para estabelecer as bases para estratégias de tratamento personalizadas e previsão de prognóstico.
Protocolo
Após adesão rigorosa aos critérios de inclusão e exclusão deste estudo, o consentimento informado para radioterapia foi obtido de cada paciente e de seu responsável. O estadiamento clínico foi conduzido de acordo com o sistema de estadiamento TNM do American Joint Committee on Cancer (AJCC) (8ª edição). O Comitê de Ética do Hospital Geral da Universidade Médica de Ningxia (KYLL-2022-0984) aprovou este estudo.
NOTA: Os critérios de inclusão foram os seguintes: (i) câncer de pulmão de pequenas células em estágio limitado confirmado patologicamente (TNM estágio II e III); (ii) tratamento radioterápico inicial utilizando radioterapia de intensidade modulada conformada (IMRT) ou radioterapia de intensidade modulada por arco volumétrico (VMAT), com dose total de radiação variando de 50-60 Gy e dose única de 2 Gy; (iii) parâmetros sanguíneos pré-radioterapia dentro da faixa de normalidade (leucócitos ≥ 4 x 109 células/L, Hb ≥ 100 g/L, PLT ≥ 100 x 109/L) e função normal de órgãos vitais como coração, fígado e rins; (iv) disponibilidade de dados clínicos completos e registros de radioterapia; (v) sobrevida esperada de mais de 3 meses; vi) mulheres não grávidas ou lactantes. Os critérios de exclusão incluíram: (i) pacientes com distúrbios sanguíneos ou do sistema imunológico ou danos significativos aos órgãos; (ii) história de corticoterapia oral prolongada; (iii) pacientes que não completaram a radioterapia planejada; (iv) história recente de infecção confirmada.
1. Informações clínicas gerais
- Colete dados do paciente.
NOTA: Foram coletados dados de 64 pacientes diagnosticados com LS-SCLC, atendendo aos critérios de inclusão e submetidos a radioterapia no Departamento de Radioterapia do Hospital Geral da Universidade Médica de Ningxia de janeiro de 2023 a janeiro de 2024. Destes, 48 eram do sexo masculino e 16 do sexo feminino, com idades entre 41 e 85 anos. De acordo com o sistema de estadiamento TNM da AJCC (8ª edição), houve 9 estágios II e 55 casos de estágio III. Todos os 60 pacientes receberam quimioterapia antes da radioterapia, sendo que 46 pacientes foram submetidos à quimioterapia mais de duas vezes (Tabela 1). A radioterapia inclui tecnicamente radioterapia de intensidade modulada (IMRT) ou terapia de arco de intensidade modulada volumétrica (VMAT).
2. Preparação do pré-tratamento
- Diagnosticar o câncer de pulmão de pequenas células por broncoscopia ou patologia de punção11, conforme mostrado na Figura 1.
- Excluir metástases por ressonância magnética (RM) do cérebro, pescoço e abdome e localizar a área tumoral por tomografia computadorizada por emissão de pósitrons (PET/CT)12, conforme mostrado na Figura 2A-C.
- Realizar teste de enzima cardíaca, eletrocardiograma, ultrassonografia cardíaca, função pulmonar e função tireoidiana para avaliar a função cardiopulmonar e julgar que não há contraindicações10.
- Informar totalmente os pacientes e suas famílias sobre os riscos e complicações relacionados à radioterapia e assinar consentimentos relacionados à radioterapia.
NOTA: Tempo de início da radioterapia: para pacientes com tumores grandes, metástase extensa de linfonodos regionais e atelectasia concomitante, 2 ciclos de quimioterapia podem ser administrados primeiro, o mais tardar no terceiro ciclo de quimioterapia.
3. Radioterapia
- Posicionamento: Manter o paciente em decúbito dorsal, com a superfície corporal marcada com linhas de mapeamento e as mãos e cotovelos apoiados na testa. Imobilize o paciente usando um molde termoplástico para garantir a estabilidade. Realize uma tomografia computadorizada aprimorada para fornecer uma visualização clara do tumor e dos vasos sanguíneos circundantes, conforme mostrado na Figura 3A.
NOTA: Os parâmetros de tomografia computadorizada aprimorada são os seguintes: (1) Dosagem do agente de contraste: 80 mL de Dianbitol. (2) Taxa de injeção: 3 mL / s. (3) Tempo de varredura: a primeira fase: 30-35 s, a segunda fase: 70-80 s, se necessário, pode ser atrasada de 3 a 10 min. A simulação de tomografia computadorizada abrangeu o nível superior da base do crânio, com o limite inferior estendendo-se 10 cm abaixo do diafragma. Fatias de imagem, com 5 mm de espessura, são carregadas no sistema de planejamento de tratamento Pinnacle. - Delineamento do alvo: Delinear com precisão a área de radioterapia para CPPC pelo sistema pináculo no posicionamento das imagens de TC, conforme mostrado na Figura 3B, C.
- Volume tumoral bruto primário (GTVp): Delineie o GTV usando uma combinação de configurações de janela pulmonar e mediastinal, aderindo aos critérios RTOG e referenciando PET-CT, TC aprimorada e achados de broncoscopia.
- Exclua áreas de atelectasia e exsudatos desprovidos de captação de fluorodesoxiglicose (FDG) do delineamento. Não enrole rebarbas longas e peças de tração pleural. Inclua rebarbas com comprimento inferior a 5 mm na área alvo.
- GTV do linfonodo metastático (GTVnd): Delinear os linfonodos metastáticos mediastinais usando TC de tórax e PET/CT.
- Volume alvo clínico (CTV): Engloba o CTV GTVp com margem de 0,5 cm, incorporando corte anatômico e áreas de drenagem linfática cumulativamente envolvidas.
- Volume-alvo de planejamento (PTV): Deriva do CTV com uma margem adicional de 0,5 cm e corte anatômico.
NOTA: Delineamento e restrições de órgãos em risco: Medula espinhal: Dose máxima (Dmax) < 40 Gy. Pulmão esquerdo: Volume recebendo 20 Gy (V20) < 20%. Pulmão direito: V20 < 20%. Pulmões bilaterais: Dose média (Dmédia) < 13 Gy. Fígado: Volume recebendo 30 Gy (V30) < 30%. Coração: V30 < 30%, conforme mostrado na Figura 3D-H.
- Volume tumoral bruto primário (GTVp): Delineie o GTV usando uma combinação de configurações de janela pulmonar e mediastinal, aderindo aos critérios RTOG e referenciando PET-CT, TC aprimorada e achados de broncoscopia.
- Desenvolver o planejamento da radioterapia sob o sistema de planejamento de terapia computadorizado: usar 6MV-X e radioterapia de intensidade modulada (IMRT) para avaliar a dose alvo.
NOTA: O PTV coberto pela linha de dose prescrita teve boa conformabilidade, distribuição uniforme da dose na área-alvo, nenhum ponto frio na área-alvo e nenhum ponto quente no órgão em risco. Os limites normais do tecido estavam na faixa normal, conforme mostrado na Figura 3I, J. - Executar o plano de radioterapia5: Realizar a radioterapia com acelerador linear e comparar o exame de tomografia computadorizada de feixe cônico (TCFC) com o posicionamento da posição da TC (uma vez por semana), dupla colocação, uma vez ao dia, 5 vezes por semana, conforme mostrado na Figura 4A, B.
- Realize uma tomografia computadorizada secundária com a dose atingindo 30-40 GY para avaliar o efeito terapêutico. Reduza a área-alvo, se necessário, até que a dose atinja 50-60 GY, conforme mostrado na Figura 5A, B.
NOTA: A resposta terapêutica foi observada durante o processo de tratamento, e o tratamento sintomático foi administrado de acordo com a situação.
4. Método de avaliação e índice
- Calcular a dose pulmonar média, a dose cardíaca média e os dados do volume total da dose global de acordo com o método EDRIC com a seguinte fórmula:
EDRIC = 0,12 × MLD + 0,08 × MHD +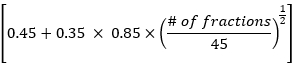 × MBD
× MBD
Onde, B1% = 0,12, B2% = 0,08, B3% = 0,45 e B4% = 0,35 representam a porcentagem dos quatro principais órgãos contendo sangue (pulmão, coração, grandes vasos sanguíneos, pequenos vasos sanguíneos/capilares) no volume total de sangue no corpo; MLD, MHD e MBD são a dose média de pulmão, dose média de coração e dose corporal média, em que MBD se refere à dose de radiação por unidade de volume do corpo. Neste estudo, a DMO é a dose corporal média desde o nível da cartilagem tireoide até a margem superior da sexta vértebra torácica, que pode ser obtida estatisticamente por meio do sistema de planejamento do tratamento. - Observe as alterações nas lesões de TC de tórax e linfonodos mediastinais em pacientes antes e 1 mês após a radioterapia. Avaliar a eficácia do tratamento de acordo com os critérios de avaliação de resposta em tumores sólidos (RECIST) e analisar a relação entre o valor EDRIC e a eficácia do tratamento.
- Conte o menor valor de linfócitos do sangue periférico antes e durante a radioterapia e analise sua correlação com a dose de radiação de linfócitos circulantes e o efeito terapêutico.
5. Métodos estatísticos
- Realize análises estatísticas usando o teste T de amostra independente ou o teste qui-quadrado para avaliar as diferenças entre grupos de variáveis contínuas e categóricas.
- Utilize o coeficiente de correlação de Spearman para avaliar as correlações das variáveis.
NOTA: Todas as análises estatísticas foram realizadas usando o SPSS, e P < 0,05 foi considerado estatisticamente significativo.
Resultados
Evolução clínica
As alterações do tempo operatório nas lesões tomográficas de tórax e linfonodos mediastinais foram observadas em todos os pacientes antes e 1 mês após a radioterapia, com eficácia terapêutica avaliada pelos critérios RECIST. Entre os 64 pacientes com câncer de pulmão de pequenas células em estágio limitado, 4 casos apresentaram resposta completa, enquanto 57 casos apresentaram resposta parcial e três pacientes apresentaram doença e...
Discussão
O sistema imunológico desempenha um papel fundamental no controle do tumor durante a radioterapia, mas a imunotoxicidade induzida por radiação, como a linfocitopenia, está ligada a resultados de sobrevida desfavoráveis13,14. O CPPC é caracterizado por sua alta malignidade, muitas vezes diagnosticada em estágios avançados com prognóstico sombrio. A radioterapia é o tratamento fundamental para o LS-SCLC. No entanto, seu i...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Projeto de Pesquisa de Nível Universitário da Universidade Médica de Ningxia (XM2022017).
Materiais
| Name | Company | Catalog Number | Comments |
| CT machine | Siemens Healthcare | SOMATOM Force | |
| MRI machine | Siemens Healthcare | MAGNETOM Terra | |
| Varian Clinac_IX Medical electron linear Accelerator | Siemens Healthcare | IX |
Referências
- Oronsky, B., Reid, T. R., Oronsky, A., Carter, C. A. What's New in SCLC? A Review. Neoplasia. 19 (10), 842-847 (2017).
- Pike, L. R. G., et al. The impact of radiation therapy on lymphocyte count and survival in metastatic cancer patients receiving PD-1 immune checkpoint inhibitors. Int J Radiat Oncol Biol Phys. 103 (1), 142-151 (2019).
- Brahmer, J. R. Harnessing the immune system for the treatment of non-small-cell lung cancer. J Clin Oncol. 31 (8), 1021-1028 (2013).
- Takeshima, T., et al. Key role for neutrophils in radiation-induced antitumor immune responses: Potentiation with G-CSF. Proc Natl Acad Sci U S A. 113 (40), 11300-11305 (2016).
- Yoon, S. W., et al. Per-fraction positional and dosimetric performance of prone breast tangential radiotherapy on Halcyon™ linear accelerator assessed with daily rapid kilo-voltage cone beam computed tomography: a single-institution pilot study. Radiat Oncol. 15 (1), 258 (2020).
- Ladbury, C. J., Rusthoven, C. G., Camidge, D. R., Kavanagh, B. D., Nath, S. K. Impact of radiation dose to the host immune system on tumor control and survival for stage III non-small cell lung cancer treated with definitive radiation therapy. Int J Radiat Oncol Biol Phys. 105 (2), 346-355 (2019).
- Schrek, R. Qualitative and quantitative reactions of lymphocytes to x rays. Ann N Y Acad Sci. 95, 839-848 (1961).
- Yovino, S., Kleinberg, L., Grossman, S. A., Narayanan, M., Ford, E. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Jin, J. Y., et al. A framework for modeling radiation induced lymphopenia in radiotherapy. Radiother Oncol. 144, 105-113 (2020).
- Jin, J. Y., et al. Higher radiation dose to the immune cells correlates with worse tumor control and overall survival in patients with stage III NSCLC: A secondary analysis of RTOG0617. Cancers (Basel). 13 (24), 6193 (2021).
- Lalić, N., et al. Invasive diagnostic procedures from bronchoscopy to surgical biopsy-optimization of non-small cell lung cancer samples for molecular testing. Medicina (Kaunas). 59 (10), 1723 (2023).
- Cerra-Franco, A., et al. Predictors of nodal and metastatic failure in early stage non-small-cell lung cancer after stereotactic body radiation therapy. Clin Lung Cancer. 20 (3), 186-193 (2019).
- Venkatesulu, B. P., Mallick, S., Lin, S. H., Krishnan, S. A systematic review of the influence of radiation-induced lymphopenia on survival outcomes in solid tumors. Crit Rev Oncol Hematol. 123, 42-51 (2018).
- Upadhyay, R., et al. Risk and impact of radiation related lymphopenia in lung cancer: A systematic review and meta-analysis. Radiother Oncol. 157, 225-233 (2021).
- Chow, R., Simone, C. B. Radiation induced lymphopenia in head and neck cancer: The importance of rigorous statistical analysis, radiation field size, and treatment modality. Radiother Oncol. 170, 242 (2022).
- Xu, H., et al. Lymphopenia during definitive chemoradiotherapy in esophageal squamous cell carcinoma: Association with dosimetric parameters and patient outcomes. Oncologist. 26 (3), e425-e434 (2021).
- Liu, Z., et al. Pivotal roles of tumor-draining lymph nodes in the abscopal effects from combined immunotherapy and radiotherapy. Cancer Commun (Lond). 42 (10), 971-986 (2022).
- Yovino, S., et al. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells. Cancer Invest. 31 (2), 140-144 (2013).
- Koukourakis, M. I., Giatromanolaki, A. Lymphopenia and intratumoral lymphocytic balance in the era of cancer immuno-radiotherapy. Crit Rev Oncol Hematol. 159, 103226 (2021).
- Tang, C., et al. Acute phase response before treatment predicts radiation esophagitis in non-small cell lung cancer. Radiother Oncol. 110 (3), 493-498 (2014).
- Dai, D., Tian, Q., Shui, Y., Li, J., Wei, Q. The impact of radiation induced lymphopenia in the prognosis of head and neck cancer: A systematic review and meta-analysis. Radiother Oncol. 168, 28-36 (2022).
- Damen, P. J. J., et al. The influence of severe radiation-induced lymphopenia on overall survival in solid tumors: A systematic review and meta-analysis. Int J Radiat Oncol Biol Phys. 111 (4), 936-948 (2021).
- Lin, Y. J., Kang, Y. M., Wu, Y. H., Chen, Y. W., Hu, Y. W. Lymphocytopenia and survival after whole-brain radiotherapy in patients with small-cell lung cancer. Thorac Cancer. 14 (14), 1268-1275 (2023).
- Suzuki, R., et al. Prognostic significance of total lymphocyte count, neutrophil-to-lymphocyte ratio, and platelet-to-lymphocyte ratio in limited-stage small-cell lung cancer. Clin Lung Cancer. 20 (2), 117-123 (2019).
- Grossman, S. A., et al. Survival in patients with severe lymphopenia following treatment with radiation and chemotherapy for newly diagnosed solid tumors. J Natl Compr Canc Netw. 13 (10), 1225-1231 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados