A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الجراثيم في حدائق النمل الآتيني: تصور المناظر الطبيعية الميكروبية عن طريق مسح المجهر الإلكتروني
In This Article
Summary
نقترح بروتوكول مجهر إلكتروني ماسح محسن لتصور عينات غير متجانسة وحساسة للغاية تحتوي على كتلة حيوية نباتية وفطرية ، جنبا إلى جنب مع الجراثيم والأغشية الحيوية. يسمح هذا البروتوكول بوصف الأبعاد المكانية لتنظيم الجراثيم.
Abstract
في النظم البيئية الكبيرة ، مثل الغابات المطيرة أو الشعاب المرجانية ، فإن التوطين المكاني للكائنات الحية هو أساس فهمنا لبيئة المجتمع. في عالم الميكروبات ، بالمثل ، فإن النظم البيئية الدقيقة بعيدة كل البعد عن مزيج عشوائي ومتجانس من الكائنات الحية والموائل. يعد الوصول إلى التوزيع المكاني للميكروبات أمرا أساسيا لفهم عمل الكائنات الحية الدقيقة وبيئتها ، حيث من المرجح أن تتفاعل الأنواع المتعايشة وتؤثر على فسيولوجيا بعضها البعض.
يعد النظام البيئي الميكروبي بين الممالك في صميم مستعمرات النمل التي تنمو الفطريات ، والتي تزرع فطريات الفطريات القاعدية كمورد غذائي. يتغذى النمل اللطيف على ركائز متنوعة (معظمها نباتية) ، يتم استقلابها بواسطة الفطريات المزروعة أثناء تشكيل بنية إسفنجية ، "حديقة ميكروبية" تعمل كقناة أمعاء خارجية. الحديقة عبارة عن شبكة متشابكة من الخيوط الفطرية التي تنمو عن طريق استقلاب الركيزة ، وفتح منافذ لميكروبات مميزة ومتكيفة لإنشائها. يعتقد أن الجراثيم تساهم في تدهور الركيزة ونمو الفطريات ، على الرغم من أن تنظيمها المكاني لم يتم تحديده بعد.
هنا ، نصف كيف نستخدم المجهر الإلكتروني الماسح (SEM) للتحقيق ، بتفاصيل غير مسبوقة ، في التنظيم المكاني للميكروبات والأغشية الحيوية عبر أنظمة تربية الفطريات المختلفة للنمل الذي ينمو الفطريات. قدم تصوير SEM وصفا للهيكل المكاني للميكروبات وتنظيمها. كشفت SEM أن الجراثيم تتجمع عادة في الأغشية الحيوية ، وهي بنية واسعة الانتشار للمناظر الطبيعية الميكروبية في زراعة الفطريات. نقدم البروتوكولات المستخدمة لإصلاح وتجفيف وتجفيف الطلاء وتصوير مثل هذا المجتمع المعقد. تم تحسين هذه البروتوكولات للتعامل مع العينات الحساسة وغير المتجانسة ، والتي تشمل الكتلة الحيوية النباتية والفطرية ، بالإضافة إلى الجراثيم والأغشية الحيوية.
Introduction
تتكون النظم الإيكولوجية من كائنات مترابطة بعمليات في موقع جغرافي محدد (أي البيئة). تتفاعل الكائنات الحية مع بيئتها بمرور الوقت ، والتي تظهر منها أنماط مكانية معقدة وغير متجانسة. يحدد الزخرفة المكانية التنوع والاستقرار البيئيين ، وفي النهاية ، عمل النظام البيئي1،2،3،4. في النظم الإيكولوجية الكبيرة ، مثل الأراضي الرطبة والسافانا والشعاب المرجانية والنظم الإيكولوجية القاحلة ، ترتبط الأنماط المكانية بتدفق الموارد وتركيزها. يؤدي السماح بتحسين الموارد وعدم التجانس المكاني والزخرفة إلى أنظمة بيئية أكثر مرونة من النظم البيئية المتجانسة2. يترجم التوطين المكاني للكائنات الحية التي تشكل أساس بيئة المجتمع أيضا إلى العالم الميكروبي.
تظهر النظم البيئية الميكروبية ، بعيدا عن الكائنات الحية المختلطة بشكل عشوائي ومتجانس في جميع أنحاء الموائل الدقيقة ، أنماطا مكانية تحدد الكثير من أدائها5،6،7. من أعمدة فينوغرادسكي إلى الكائنات الحية الدقيقة المرتبطة بالبيئة والمضيف ، يتم تنظيم هذه النظم البيئية بشكل غير متجانس في الفضاء ، مع ترتيبات مكانية تثير استجابات نمطية مختلفة. من المرجح أن تتفاعل الأنواع المتعايشة وتؤثر على فسيولوجيا بعضها البعض. وبالتالي ، فإن التنظيم المكاني للمجتمع ، أكثر من تكوينه في حد ذاته ، يحدد خصائص النظام البيئي والمنافذ البيئية5،7،8. لتوضيح هذه المفاهيم ، يبدو أن التغييرات في الزخرفة المكانية مرتبطة بالتطور المرضي لويحات الأسنان ، والتسوس ، وأمراض اللثة9،10 ، وأمراض التهاب الأمعاء11 ، والتليف الكيسي ، والتهابات الرئة ، والتهابات الجروح المزمنة12،13 ، وسرطان القولون والمستقيم ، والأورامالغدية 14.
في نطاق الجغرافيا الحيوية الميكروبية (دراسة توزيع التنوع البيولوجي والنمذجة عبر المكان والزمان على نطاق صغير) ، تستفيد معرفة النظم الإيكولوجية الميكروبية بشكل كبير من خلال فهم أنماطها المكانية6،13،15،16،17. لقد نظرنا في الأنماط المكانية لنظام بيئي ميكروبي مبني بالحشرات ، موجود في قلب مستعمرات النمل الحيوي الذي ينمو الفطريات (غشائيات الأجنحة: Formicidae: Myrmicinae: Attini: Attina). توجد "حديقة ميكروبية" تتمحور حول فطر قاعدي الفطريات في قبيلة Leucocoprinae (Basidiomycota: Agaricaceae) أو في عائلة Pterulaceae (Basidiomycota: Agaricales) 18،19،20،21،22. الحديقة عبارة عن هيكل إسفنجي ناشئ من شبكة متشابكة من الخيوط تنمو عن طريق استقلاب الركيزة النباتية في الغالب التي يدمجها النمل (الشكل 1). قد تشمل هذه ، وفقا لأجناس atin: أجزاء النبات الجافة ، والجثث الحشرية ، والأوراق المقطوعة حديثا ، والبذور ، وأجزاء الأزهار23،24. على غرار الأمعاء العاشبة الخارجية ، تقوم الحديقة بتحويل البوليمرات المتمردة إنزيميا وكيميائيا إلى موارد غذائية متقلبة ، مما يزود النمل بالأحماض الأمينية الأساسية والدهون والسكريات القابلة للذوبان21،25،26،27،28.
تشير التحليلات فائقة البنية والأنزيمية والنسخية التي أجريت لحدائق أجناس قطع الأوراق Atta و Acromyrmex إلى أن هذه البيئات تبني سلسلة متصلة من تدهور الركيزة والبقع الغذائية26،29،30،31،32. تميل الأجزاء الصغيرة من الحديقة إلى أن تكون أغمق بسبب الركيزة المدمجة حديثا بعد تجزئتها. غالبا ما يتم استعمار هذه الركائز المضافة مؤخرا من الحواف ، والتي تم قطعها بواسطة عمال النمل وتلقيحها بكتل فطرية. تشع من الحواف المقطوعة ، تنتشر خيوط الفطرية على الركيزة29،32،33. تزداد وفرة الخيوط مع تقدم تدهور الركيزة ، مما يؤدي إلى مناطق بيضاء ونشطة فيالتمثيل الغذائي 30،31،32. تميل المناطق القديمة ، ذات الركيزة الأكثر تدهورا والجراثيمالوفيرة 29،32 ، إلى تقديم نغمات بنية ورطوبة أعلى. يقوم العمال بإزالة شظايا هذه المنطقة ، وفصلها في أكوام النفايات ، حيث يأخذون أيضا ركائز تضر بالتكافل الفطري34،35،36. أكوام النفايات ، على الرغم من انفصالها جسديا عن الحديقة ، هي بقعة للتدهور المستمر للركيزة ودورة المغذيات بواسطة الجراثيم الوفيرة للسكان29،32،37،38،39.
تتكون الجراثيم بشكل أساسي من Enterobacter و Klebsiella و Pantoea و Pseudomonas و Serratia ، تعيش أيضا في الحديقة ، ويبدو أنها مشتركة بين أنظمة تربية الفطريات المتنوعة attine. من خلال ترميز المسارات الأيضية التي يمكن أن تكمل عملية التمثيل الغذائي الفطرية ، من المحتمل أن تشارك الجراثيم في الاستجابات الفسيولوجية للحديقة40،41،42،43،44. لم تشير البيانات الميتاجينومية فقط إلى أن الجراثيم كانتموجودة 41،42 ، ولكن أيضا تحليل المجهر الإلكتروني الماسح (SEM) لزراعة الفطريات للنمل القاطع للأوراق أظهر في الغالب بكتيريا على شكل قضيب فوق الركيزةالنباتية 32. على الرغم من عزل البكتيريا (بما في ذلك السلالات المحللة للسليل) من الحديقة بأكملها ، إلا أنها لم يتم تصورها إلا في الأجزاء القديمة من الحديقة وفي أكوام النفايات ، وكذلك في الحبيبات الأولية التي تحملها ملكات المؤسسة29،32. كما أنه من غير المؤكد ما إذا كانت الجراثيم يمكن أن تشكل أغشية حيوية في الجسم الحي (أي في الحديقة والنفايات) ، كما هو موضح من خلال قدرتها الأيضية42 ولوحظ في المختبر44.
هنا ، استخدمنا SEM لفهم التنظيم المكاني للميكروبات عبر مناطق الحدائق ، وتفصيل التفاعلات الفيزيائية للركيزة الدقيقة والميكروبات الخيوط من خلال توفير صور ذات عمق بؤري أكبر ، يسمح SEM بمراقبة الهياكل المجهرية ثلاثية الأبعاد بدقة عالية ، مما يتيح تحليلا شاملا للأنماط المكانية للميكروبات في الحديقة. نقوم بتفصيل خطوات إصلاح وتجفيف وتجفيف ورش الطبقة وتصوير هذه العينات الفطرية غير المتجانسة والحساسة. من خلال إزالة خطوة التثبيت باستخدام رابع أكسيد الأوزميوم (OsO4) وتقليل وقت الجفاف ، قمنا بتبسيط البروتوكولات32،33،45 لإعداد عينات الحدائق والنفايات لتحليل SEM. يحافظ هذا البروتوكول المعدل على الأنماط الهيكلية للخيوط ، بالإضافة إلى التنظيم المكاني للميكروبات والأغشية الحيوية ، ويمكن تطبيقه على النظم البيئية الميكروبية الحساسة الأخرى والأغشية الحيوية.
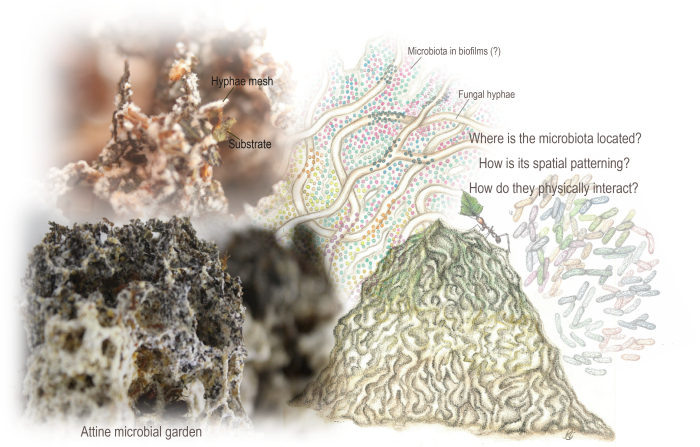
الشكل 1: حدائق Attine الميكروبية. الحديقة عبارة عن هيكل يشبه الإسفنج ناتج عن شبكة متشابكة من الخيوط تنمو عن طريق استقلاب الركيزة النباتية في الغالب التي يدمجها النمل. كما تسكن الحديقة الجراثيم ، التي تشفر مسارات التمثيل الغذائي التي يمكن أن تكمل عملية التمثيل الغذائي الفطرية. أشارت البيانات الميتجينومية وتحليل المجهر الإلكتروني الماسح السابق إلى وجودها ، على الرغم من أننا كانت لدينا معرفة نادرة بتنظيمها المكاني والتفاعلات الفيزيائية مع الركيزة والخيوط الفطرية. استخدمنا SEM للكشف عن التنظيم المكاني للميكروبات والأغشية الحيوية والنمذجة. الرسوم التوضيحية لماريانا باركوتو (حديقة وميكروبات مقتبسة من باركوتو ورودريغيز 94) ، وصور ماريانا باركوتو وإنزو سورينتينو. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. أخذ العينات من المستعمرات الميدانية
ملاحظة: عند جمع مستعمرات النمل ، قم بالإقرار بأن جميع الأذونات التي تتطلبها التشريعات المحلية قد تم الحصول عليها قبل جمعها. في حالتنا ، تم إصدار تصريح التجميع # 74585 من قبل معهد شيكو مينديز للمحافظات الحيوية (ICMBio). عندما تأتي العينات من مستعمرة معملية ، انتقل إلى القسم 2.
- حدد موقع المستعمرة ووضع علامة عليها. احفر خندقا يحيط بمنطقة العش حتى تنكشف غرفة الحديقة (الشكل 2 أ).
ملاحظة: قد تبني بعض أنواع attine مستعمراتها تحت فضلات الأوراق أو داخل جذوع الأشجار الفاسدة. في مثل هذه الحالات ، قم بتدوير القمامة بعناية أو كسر السجلات بعناية لجمع العينات. للحصول على معلومات مفصلة حول تحديد موقع المستعمرات الحية لأنواع النمل المتنوعة وجمعها وصيانتها ، انظر Sosa-Calvo et al.46. - افتح غرفة الحديقة بشكل جانبي لمنع التربة من السقوط على سطح الحديقة. اجمع عينات الحديقة بعناية باستخدام ملقط حشري أو ملعقة أو مقشدة مطبخ ، اعتمادا على حجم الحديقة.
ملاحظة: تأكد من تعقيم الأدوات قبل جمعها. عند جمع حدائق النمل القاطع ، ارتد قفازات قماشية سميكة لمنع (أو على الأقل تخفيف) لدغات العمال. بالنسبة لأنواع الأتين الأخرى ، تكون القفازات القماشية اختيارية. - انقل عينات الحديقة إلى مستلم بلاستيكي نظيف يحتوي على طبقة من الجص لموازنة رطوبة الحديقة. بعد نقل الحديقة وعمال النمل ، أغلق المستلم بإحكام لتجنب تجفيف العينة. قم بتخزين عينات الحديقة في درجة حرارة 23-25 درجة مئوية حتى المعالجة.
- أغلق الخندق بالتربة التي تمت إزالتها مسبقا.
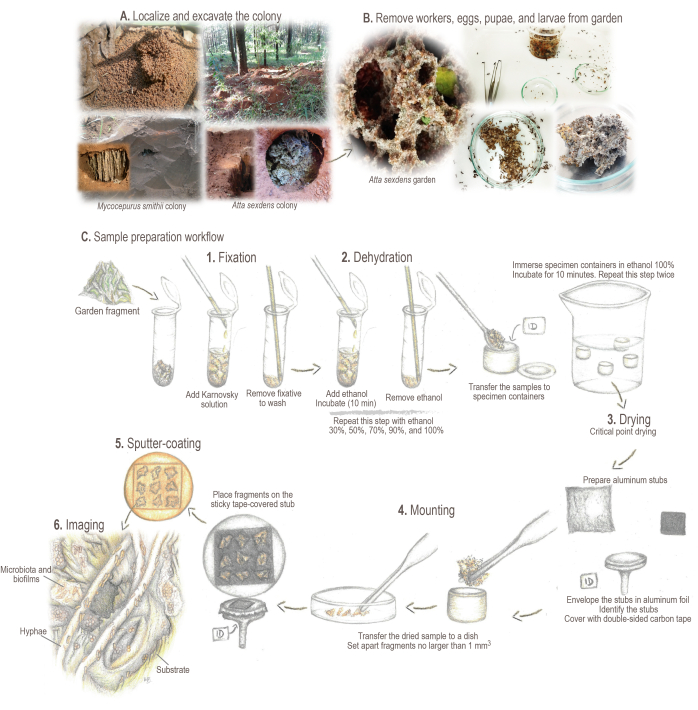
الشكل 2: بروتوكول تحضير العينة. (أ) أخذ عينات من المستعمرات الحقلية. (ب) تجهيز العينات. (ج) أساسيات موجزة وسير العمل لإعداد العينة: 1. التثبيت: لتقوية بنية العينة والحفاظ عليها. 2. الجفاف: يتم استبدال محتوى الماء في العينات بالإيثانول. 3. تجفيف النقطة الحرجة: يحل ثاني أكسيد الكربونالسائل محل الإيثانول ويتبخر. 4. التركيب: عينة معروضة للتحليل. 5. طلاء الرش بالذهب: منع شحن العينة. 6. التصوير. الرسوم التوضيحية والصور بواسطة ماريانا باركوتو. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. الكواشف
ملاحظة: ضع في اعتبارك أنه يجب إعداد الحلول التالية مسبقا.
- تحضير 0.2 م عازلة كاكوديلات الصوديوم. لهذا الغرض ، قم بإذابة 42.8 جم من كاكوديلات الصوديوم في 800 مل من الماء المقطر ، مع التحريك حتى الذوبان واستقرار الأس الهيدروجيني عند 7.2 (إذا لزم الأمر ، اضبط درجة الحموضة باستخدام حمض الهيدروكلوريك). اصنع حجم المحلول إلى 1 لتر عن طريق إضافة الماء المقطر. قم بتخزين المحلول في درجة حرارة 4 درجات مئوية (لمدة ~ 1 شهر).
تنبيه: الجلوتارالديهايد وبارافورمالدهيد سامان ويجب التعامل معهما داخل غطاء الدخان. ارتد قفازات النتريل والنظارات الواقية طوال الوقت أثناء التعامل مع هذه الكواشف. - تحضير مثبت كارنوفسكي (معدل من كارنوفسكي)47. لهذا الغرض ، أضف 10 مل من محلول مائي 25٪ جلوتارالديهايد و 10 مل من محلول مائي بارافورمالديهايد 20٪ إلى 25 مل من محلول كاكوديلات الصوديوم 0.2 M واخلطه. أضف 1 مل من 0.1 M كلوريد الكالسيوم (CaCl2) وقم بتعويض الحجم إلى 100 مل عن طريق إضافة الماء المقطر. قم بتخزين المحلول في درجة حرارة 4 درجات مئوية (لمدة تصل إلى شهر واحد).
تنبيه: مثبت كارنوفسكي ضار عند استنشاقه وقد يسبب تهيج الجلد والعين. وبالتالي ، تجنب استنشاق الأبخرة ، باستخدام الهواء الطلق فقط أو في منطقة جيدة التهوية. ارتد قفازات النتريل والنظارات الواقية طوال الوقت عند التعامل مع المحلول. - باستخدام الإيثانول المطلق (الدرجة التحليلية) ، قم بإعداد محاليل الإيثانول بنسبة 30٪ و 50٪ و 70٪ و 90٪ في الماء المقطر. مطلوب أيضا 100٪ إيثانول.
3. تثبيت العينة
ملاحظة: تعمل المثبتات على تصلب العينات والحفاظ عليها ، مما يحافظ على السمات المورفولوجية. الألدهيدات (مثل بارافورمالدهايد والجلوتارالديهايد) هي مثبتات غير مخثرة من نوع الربط المتقاطع ، مما يؤدي إلى روابط متقاطعة داخل وبين البروتينات والأحماض النووية48.
- قم بإزالة العمال والبيض والشرانق واليرقات من عينات الحديقة باستخدام ملقط الحشرات (الشكل 2 ب). قم بفصل شظايا الحديقة التي لا يزيد حجمها عن 5 مم3. أضف الشظايا إلى أنبوب سعة 2 مل (الشكل 2 ج).
- إلى الأنابيب التي تحتوي على العينات، استخدم ماصة زجاجية من باستور لإضافة ~ 1 مل من محلول التثبيت كارنوفسكي (تأكد من تغطية العينة بالكامل). امزج عن طريق التحريك اللطيف لمساعدة العينة على النقع والتحتضان عند 4 درجات مئوية لمدة 24 ساعة على الأقل قبل الاستمرار في معالجة العينة (الشكل 2 ج.1).
ملاحظة: عندما لا يتم تنفيذ خطوات التجفيف التالية مباشرة بعد التثبيت ، قد يتم إيقاف البروتوكول مؤقتا في هذه الخطوة ، ويمكن تخزين العينات لمدة ~ 1 سنة عند 4 درجات مئوية.
نقترح استخدام ماصة زجاجية من باستور، لأنها تتكون من مادة خاملة ويسهل تنظيفها لإعادة استخدامها بعد ذلك. مادة الحديقة شديدة المقاومة للماء ، وتميل إلى الطفو على سطح المحلول المثبت. عادة ما يستغرق الأمر ما يصل إلى 5 دقائق حتى يتم نقعه بالكامل في المثبت. تأكد من أن المثبت يغطي شظايا الحديقة لأن حجمه يميل إلى التقليل عند دخوله مسام العينة. لقد تحققنا تجريبيا من أنه بعد نقع العينة وأصبحت مبللة ، أصبحت مكوناتها (على وجه الخصوص الفطريات الفطرية الرقيقة) عرضة للتحطم عند خلطها أكثر. وبالتالي ، نوصي بتجنب هز العينات قدر الإمكان.
4. عينة الجفاف
ملاحظة: تقوم سلسلة غسيل الإيثانول بتبادل الماء تدريجيا في عينات من أجل الإيثانول. من المهم أن تبدأ بمحلول إيثانول منخفض التركيز (انظر أدناه) لتجنب الإضرار المفرط أو انهيار هذه العينات الحساسة49.
- قم بإزالة محلول التثبيت الخاص بكارنوفسكي تماما باستخدام ماصة زجاجية ، مع الحرص على عدم تعطيل العينة (الشكل 2C.1).
ملاحظة: تجاهل مثبت كارنوفسكي في مستلم مصنف بشكل صحيح لإدارة المخلفات الكيميائية السامة. - مباشرة بعد إزالة المثبت ، أضف 1 مل من الإيثانول بنسبة 30٪ ، مع الحرص على عدم تعطيل العينة ، واحتضانها لمدة 10 دقائق في درجة حرارة الغرفة (الشكل 2C.2).
ملاحظة: يجب دائما نقع العينات في المحلول. تأكد من استبدال المحاليل بسرعة أثناء سلسلة الغسيل التدريجي للإيثانول. نظرا لأن الحديقة تفقد جانبها المسامي وتتجمع في قاع الأنبوب ، فإن 1 مل من الإيثانول يميل إلى أن يكون كافيا لتغطية العينة (عندما لا يزيد حجم العينة عن 5 مم3). ومع ذلك ، إذا لم يتم تغطية العينات بالكامل ، أضف الإيثانول حتى يتم تغطية العينة بالكامل. - قم بإزالة 30٪ من الإيثانول تماما باستخدام ماصة زجاجية ، مع الحرص على عدم تعطيل العينة. تخلص من 30٪ من الإيثانول بشكل صحيح.
ملاحظة: بالنسبة لسلسلة الغسيل التدريجي للإيثانول بأكملها ، تخلص من الإيثانول في مستلم مصنف بشكل صحيح لإدارة المخلفات الكيميائية السامة. - أضف 1 مل من الإيثانول بنسبة 50٪ واحتضنه لمدة 10 دقائق في درجة حرارة الغرفة. قم بإزالة 50٪ من الإيثانول تماما باستخدام ماصة زجاجية ، مع الحرص على عدم تعطيل العينة. تخلص من 50٪ من الإيثانول بشكل صحيح.
- أضف 1 مل من 70٪ إيثانول واحتضنه لمدة 10 دقائق في درجة حرارة الغرفة. قم بإزالة 70٪ من الإيثانول تماما باستخدام ماصة زجاجية ، مع الحرص على عدم تعطيل العينة. تخلص من 70٪ من الإيثانول بشكل صحيح.
ملاحظة: عند خطوة غسيل الإيثانول بنسبة 70٪ ، يمكن للمستخدم إيقاف البروتوكول مؤقتا إذا لزم الأمر ، حيث يمكن تخزين أنابيب العينة طوال الليل عند 4 درجات مئوية ، عندما لا تتم معالجة المادة على الفور. - أضف 1 مل من الإيثانول بنسبة 90٪ واحتضنه لمدة 10 دقائق في درجة حرارة الغرفة. قم بإزالة 90٪ من الإيثانول تماما باستخدام ماصة زجاجية ، مع الحرص على عدم تعطيل العينة. تخلص من 90٪ من الإيثانول بشكل صحيح.
- أضف 1 مل من الإيثانول بنسبة 100٪ واحتضنه لمدة 10 دقائق في درجة حرارة الغرفة. قم بإزالة الإيثانول بنسبة 100٪ تماما باستخدام ماصة زجاجية ، مع الحرص على عدم تعطيل العينة. تخلص من الإيثانول بنسبة 100٪ بشكل صحيح.
- باستخدام ملقط و / أو ملعقة ، انقل العينات بعناية إلى حاويات عينات لمجفف النقطة الحرجة (CPD) ، والتي تحتوي على ملصقات تعريف العينة (المصنوعة مسبقا بالورق والقلم الرصاص). لتجنب تجفيف العينات ، يتم هذا النقل مع وضع الحاوية في طبق بتري مغطى بالإيثانول بنسبة 100٪.
- ضع الأغطية على الحاويات واغمرها في دورق زجاجي متدرج يحتوي على 100٪ إيثانول يكفي لغمر الحاويات. غطي الدورق الزجاجي واحتضنه لمدة 10 دقائق في درجة حرارة الغرفة ؛ ثم تخلص بشكل صحيح من الإيثانول بنسبة 100٪.
- انقل حاويات العينات إلى دورق زجاجي متدرج آخر يحتوي على ما يكفي من الإيثانول بنسبة 100٪ لغمر الحاويات. غطي الدورق الزجاجي واحتضنه لمدة 10 دقائق في درجة حرارة الغرفة ؛ ثم انقل حاويات العينات إلى مجفف النقطة الحرجة.
ملاحظة: بعد سلسلة الغسيل، يجب شطف الماصات والأكواب الزجاجية بكثرة بالماء المقطر، ويجب التخلص من هذه المياه المتبقية في مستلم مكتوب عليه بشكل صحيح لإدارة المخلفات الكيميائية السامة. بعد الشطف ، يمكن غسل العناصر الزجاجية بمنظف محايد وشطفها بماء الصنبور وتجفيفها بالهواء.
5. تجفيف النقطة الحرجة
ملاحظة: يتبادل مجفف النقطة الحرجة الإيثانول في عينات لثاني أكسيد الكربون السائل (CO 2) ، الذي يتبخر من العينة عند درجة حرارة وضغط أعلى. يرجى اتباع تعليمات الشركة المصنعة لمثل هذه الإجراءات.
- قم بتشغيل الجهاز.
- افتح الغرفة ، ضع حاويات العينة بالداخل ، وأضف الإيثانول بنسبة 100٪ حتى تغطي الحاويات. أغلق الغرفة.
- قم بتنشيط خيار التبريد ، وانتظر حتى تصل درجة الحرارة إلى 10 درجات مئوية.
- افتح صمام أسطوانة CO2 وقم بتنشيط خيار التقليب .
- قم بتنشيط خيار CO2 in ، وتحقق دائما من الغرفة للتحقق من مقدار ثاني أكسيد الكربون2 الذي ملأه بالفعل. عندما تكون الغرفة ممتلئة تقريبا ، قم بإلغاء تنشيط خيار CO2 in وقم بتنشيط خيار Exchange ، مع الاحتفاظ به منشطا حتى يكون هناك ما يكفي من ثاني أكسيد الكربون2 فقط لتغطية الحاويات. تأكد من أن الحاويات مغطاة دائما بCO 2 (أي إلغاء تنشيط خيار التبادل قبل أن يغادر كل ثاني أكسيد الكربون2 الغرفة). كرر الخطوة 5.5 6x.
- قم بتنشيط ثاني أكسيد الكربون2 في مرة أخيرة واملأ الغرفة حتى يتم تغطية الحاويات.
- قم بتنشيط خيار الحرارة وقم بإلغاء تنشيط خيار النمام . أغلق صمام أسطوانة CO2.
- انتظر حتى ترتفع درجة الحرارة إلى 35 درجة مئوية ؛ ثم قم بتنشيط خيار Gas out .
ملاحظة: عند حوالي 30 درجة مئوية ، تصل الغرفة إلى ضغوط 70-80 بار ، مما يحقق النقطة الحرجة ، حيث يختفي السائل. - عندما يصل ضغط الغرفة إلى 1 بار ، تمت إزالة كل محتوى الغاز. افتح الغرفة وأزل الحاويات.
- قم بإيقاف تشغيل الجهاز.
6. تصاعد
- إعداد حاملي عينات SEM (أي بذرة الألومنيوم ؛ الشكل 2 جيم - 4).
- لف البذرة بقطعة من ورق الألمنيوم ، تغطي الجزء العلوي فقط ، لتسهيل تنظيف كعب الروتين بعد التحليل.
- حدد بذرة الروتين عن طريق كتابة نموذج الرمز / الرقم في أسفل الحامل ، مما يضمن تحديد ما يتم وضعه في الأعلى.
- قم بتغطية الجزء العلوي بشريط كربون على الوجهين. ضع بذرة في حامل العينات.
- افتح غطاء حاوية العينة ، وانقل العينة المجففة بعناية إلى طبق بتري زجاجي باستخدام ملقط وملعقة.
ملاحظة: تميل الحدائق المجففة ذات النقاط الحرجة إلى التكتل لتشكيل عينات معبأة للغاية يجب فصلها بعناية كأجزاء لا يزيد حجمها عن 1 مم3. - ضع الأجزاء بعناية على السطح اللاصق للكعب المغطى بالشريط. بمجرد أن يلمس جزء الحديقة الشريط ، يصعب جدا (إعادة) تحريكه ، لذا احرص على عدم وضعه في أماكن أو مواقع غير مرغوب فيها. أضف ما يصل إلى تسعة أجزاء لكل كعب.
- كرر الخطوتين 6.2 و6.3 لكل عينة.
7. طلاء الرش بالذهب
ملاحظة: مطلوب طلاء العينة لمنع شحنها. اتبع تعليمات الشركة المصنعة لضبط الإعدادات مثل ضغط غاز التشغيل (0.5 × 10-1 مم زئبق من ضغط الغاز في هذا البروتوكول) ، ووقت الاخرق (220 ثانية) ، وسمك الطبقة الذهبية (~ 120 Å) ، والتيار (50 مللي أمبير) ، وإمداد الجهد. يميل الاخرق إلى اتباع سير عمل مشترك على الرغم من أن المعدات من مختلف الشركات المصنعة قد تعمل بشكل مختلف قليلا.
- افتح الذراع المستهدف المفصلي وضع بذرة على طاولة العينات.
- أغلق الذراع المستهدف المفصلي وتحقق مما إذا كان الدرع الشظي لغرفة التفريغ الزجاجية مضمنا بشكل صحيح.
- افتح صمام أسطوانة الأرجون وقم بتشغيل مفتاح الطاقة الرئيسي.
- اتبع الفراغ المرتفع في شاشة المعدات حتى يصل إلى علامة 0.5 × 10-1 مم زئبق في الشاشة ؛ ثم قم بتنشيط الشطف. كرر العملية 5x.
- قم بتشغيل نظام تدوير المياه ، وقم بتنشيط الخيار HV On ، وافتح غطاء الفيلم الذهبي. تأكد من أن لون البلازما وردي. لاتباع هذا البروتوكول ، قم بإعداد 220 ثانية من الاخرق بجهد 50 مللي أمبير ، والتي ستودع طبقة ذهبية ~ 120 Å (12 نانومتر).
- يتم إيقاف تشغيل HV تلقائيا. قم بإيقاف تشغيل نظام تدوير المياه وأغلق غطاء الفيلم الذهبي.
- قم بإيقاف تشغيل مفتاح الطاقة الرئيسي ، مما يسمح للهواء بالدخول إلى غرفة التفريغ. بالنسبة لعينات الحدائق والنفايات ، كرر الخطوات 7.1-7.7 3x.
ملاحظة: إذا لم يحدث التصوير مباشرة بعد تحضير العينة ، فقم بتخزين بذرة الورق في وعاء محكم المملوء بطبقة السيليكا لتجنب إعادة ترطيب العينات.
8. التصوير
ملاحظة: اتبع تعليمات الشركة المصنعة لضبط إعدادات SEM ، مثل قطر فتحة العدسة الموضوعية ، وجهد التشغيل ، ومحاذاة نظام شعاع الإلكترون ، والمحاذاة المحورية ، والمنشطات.
- ضع بذرة الذراع في حامل العينة ، مع تدوين الملاحظات حول موضع كل عينة.
ملاحظة: ارتد القفازات عند إدخال حامل العينة أو إزالته ، وحافظ على نظافة الحامل قدر الإمكان. - قم بتشغيل برنامج التشغيل من سطح المكتب.
- حدد إعدادات الجهاز. تصور عينات الحديقة بقطر فتحة موضوعية يبلغ 30 ميكرومتر (أي في المرحلة الثانية) ، وتعمل في فراغ عال ، والكشف عن الإشارات من الإلكترونات الثانوية (SED) ، وتسريع الجهد 20 كيلو فولت ، ومسافة العمل من 15 إلى 20 مم ، وتيار المسبار 40.0 (في وضع التيار العالي) ، وتغيير التكبير وفقا للعينة.
- باتباع تعليمات التنقل ، اضغط على أيقونة Vent وانتظر حتى يتم تنفيس غرفة العينة. يشير شريط التقدم إلى حالة الفراغ.
- عند الوصول إلى الضغط الجوي ، افتح غرفة العينة وأدخل حامل العينة بعناية.
- أغلق باب الغرفة برفق واضغط على أيقونة Evac لإخلاء الجهاز ، بعد حالة التفريغ من خلال شريط التقدم. سيظهر نظام الملاحة موضع المرحلة المتحركة ويوفر رسما بيانيا للحامل عند اكتمال النقل. اضغط على أيقونة الكاميرا لتسجيل صورة لحامل الحامل للحصول على عرض علوي يساعد على التنقل بين العينات أثناء التصوير.
- اضغط على أيقونة الملاحظة لتشغيل مسدس الإلكترون وانتظر حتى تتشكل الصورة. استخدم واجهة المستخدم اليدوية (التحكم اليدوي) لتحريك المحور Z يدويا إلى الارتفاع المناسب (بناء على ارتفاع العينة ومسافة العمل المحددة).
ملاحظة: لإطالة عمر خيوط التنغستن ، قم بإيقاف وظيفة المراقبة مؤقتا عندما لا تكون التصوير النشط. - استخدم إما الخيارات المعروضة على الشاشة أو التحكم اليدوي لتغيير معدل البيانات النقطية وموضع الصورة. حرك المسرح للحصول على رؤية شاملة للعينة ، باستخدام وظيفة RDC للتركيز على مناطق محددة. عند مراقبة هدف (أو هيكل مثير للاهتمام) ، اضبط التكبير والتركيز والسطوع والتباين والوصمة وفقا لذلك. تصحيح وصمة العار باستخدام واجهة المستخدم اليدوية لنقل المرحلة إلى اتجاهين X و Y.
- اضبط التكبير بين 100x و 700x لتصور جوانب الحديقة العامة (مثل كثافة الخيوط والركيزة وأنماط الاستعمار).
- اضبط التكبير بين 700x و 1,500x لتصور الأنماط المكانية للميكروبات.
- اضبط التكبير بين 1,500x و 3,000x لمراقبة التفاعلات الفيزيائية للميكروبات والأغشية الحيوية.
- اضبط التكبير بين 3,000x و 4,000x للتركيز على مجموعات ميكروبية محددة.
- لحفظ صورة ، استخدم وظيفة التجميد ، وانقر فوق صورة رمز ، وقم بإعداد مسار الملف. كمعيار ، قم بتحليل ما لا يقل عن ثلاثة أجزاء من الحديقة ، وقم بتصوير كل واحدة في جميع نطاقات التكبير المذكورة في الخطوة 8.8. ينتج عن هذا ما لا يقل عن 12 صورة لكل عينة، على الرغم من أن المزيد من الصور قد تدعم أوصافا أكثر تفصيلا. نقترح أن 15-25 صورة لكل عينة ، تتراوح بين جميع التكبيرات في الخطوة 8.8 تميل إلى توفير تفاصيل دقيقة لوصف العينة.
ملاحظة: يستغرق التنقيط وحفظ الصورة بضع ثوان يجب خلالها تجنب أي اهتزاز على الطاولة العائمة SEM. - بعد الانتهاء من التصوير ، اضغط على خيار Vent لتنفيس الغرفة ، بعد حالة الفراغ من خلال شريط التقدم. قم بإزالة الحامل بعناية ، وأغلق باب الغرفة برفق ، واضغط على Evac لإخلاء الغرفة.
- بمجرد اكتمال الإخلاء ، اخرج من برنامج التشغيل.
- اضبط السطوع والتباين لتحسين التصور باستخدام محرر الصور.
Access restricted. Please log in or start a trial to view this content.
النتائج
هنا ، قدمنا بروتوكولا مبسطا لتصور مكونات عينات الحدائق والنفايات ، مثل الخيوط الفطرية ، والركيزة ، والميكروبات ، والأغشية الحيوية. عززت SEM فهمنا لكيفية قيام الحديقة والنفايات بسقالة الأنماط الهيكلية للميكروبات (الشكل 3). في حدائق الأتين ، تكون الخيوط الف...
Access restricted. Please log in or start a trial to view this content.
Discussion
يستخدم SEM شعاعا إلكترونيا لمسح العينة ، مما يولد صورة مكبرة لها بحيث يمكن للمرء أن يتصور الهياكل المجهرية ثلاثية الأبعاد بدقة عالية. نظرا لأن SEM يعمل تحت فراغ عال ، يلزم إزالة ما يصل إلى / أكثر من 99٪ من الماء من العينات. داخل غرفة تفريغ SEM ، قد تجف العينات المائية جزئيا وتنها...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
يود المؤلفون أن يشكروا Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) على تقديم الدعم المالي (Grant # 2019 / 03746-0). شكر MOB على منحة الدكتوراه التي تلقيتها من FAPESP (العملية 2021 / 08013-0) و Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - البرازيل (CAPES) - رمز التمويل 001. يشكر AR أيضا Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) على الزمالة البحثية (# 305269/2018). يود المؤلفان أن يشكروا مارسيا ريجينا دي مورا أوادا وأنطونيو تيرويوشي يابوكي على مساعدتهما في الاختبارات التجريبية لإعداد العينات، وريناتو باربوسا سالارولي على المساعدة الفنية، وإنزو سورينتينو لمساعدته في التقاط الصور. أجريت هذه الدراسة بموجب ترخيص التراث الجيني للوصول # SISGen AA39A6D.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 2 mL tube | Axygen | MCT-200-C-BRA | To fix and dehydrate samples |
| Calcium chloride anhydrous | Merck | C4901 | CaCl2 anhydrous to prepare Karnovsky’s fixative |
| Critical point dryer | Leica | EM CPD 300 | For critical point drying |
| Double Sided Carbon Conductive Tape, 12 mm (W) X 5 M (L) | Electron Microscopy Sciences | 77819-12 | For mounting samples |
| Entomological forceps | No specific supplier | To manipulate garden samples | |
| Ethyl alcohol (=ethanol), pure (≥99.5%) | Sigma-Aldrich | 459836 | For dehydration |
| Forceps | No specific supplier | To manipulate garden samples | |
| Glass beaker | No specific supplier | For dehydration | |
| Glass Petri dish | No specific supplier | To manipulate garden samples | |
| Glass pipette | No specific supplier | To fix and dehydrate samples | |
| Glutaraldehyde (Aqueous Glutaraldehyde EM Grade 25%) | Electron Microscopy Sciences | 16220 | To prepare Karnovsky’s fixative |
| Gold target | Ted Pella, Inc. | 8071 | To sputter coat with gold |
| Hydrochloric acid | Sigma-Aldrich | 320331 | For adjusting solutions pH |
| Image editor | Photoshop | any version | To adjust images |
| Paraformaldehyde (Paraformaldehyde 20% Aqueous Solution EM Grade) | Electron Microscopy Sciences | 15713 | To prepare Karnovsky’s fixative |
| Propilene recipient | No specific supplier | For maintaining alive ant colonies | |
| Scanning Electron Microscope | JEOL | IT300 SEM | For sample imaging |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | For preparing sodium cacodylate buffer |
| Spatula | No specific supplier | To manipulate garden samples | |
| Specimen containers with 15 mm dia. x 10 mm high | Ted Pella, Inc. | 4591 | For critical point drying |
| Sputter coater | Baltec | SCD 050 | To coat with gold |
| Stub (Aluminium mount, flat end pin) 12.7 mm x 8 mm | Electron Microscopy Sciences | 75520 | For mounting samples |
References
- Turner, M. G. Landscape ecology: the effect of pattern on process. Annu Rev Ecol Evol Syst. 20 (1), 171-197 (1989).
- Rietkerk, M., Van de Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Schmitz, O. J. Spatial dynamics and ecosystem functioning. PLOS Biol. 8 (5), e1000378(2010).
- Pringle, R. M., Doak, D. F., Brody, A. K., Jocqué, R., Palmer, T. M. Spatial pattern enhances ecosystem functioning in an African savanna. PLOS Biol. 8 (5), e1000377(2010).
- Wimpenny, J. W. Spatial order in microbial ecosystems. Biol Rev. 56 (3), 295-342 (1981).
- Martiny, J. B. H., et al. Microbial biogeography: putting microorganisms on the map. Nat Rev. Microbiol. 4 (2), 102-112 (2006).
- McCallum, G., Tropini, C. The gut microbiota and its biogeography. Nat Rev Microbiol. 22 (2), 105-118 (2024).
- Lamont, R. J., Hajishengallis, G., Koo, H. Social networking at the microbiome-host interface. Infec Immun. 91 (9), e00124-e00223 (2023).
- Welch, J. L. M., Rossetti, B. J., Rieken, C. W., Dewhirst, F. E., Borisy, G. G. Biogeography of a human oral microbiome at the micron scale. Proc Natl Acad Sci USA. 113 (6), E791-E800 (2016).
- Kim, D., et al. Spatial mapping of polymicrobial communities reveals a precise biogeography associated with human dental caries. Proc Natl Acad Sci USA. 117 (22), 12375-12386 (2020).
- Swidsinski, A., Weber, J., Loening-Baucke, V., Hale, L. P., Lochs, H. Spatial organization and composition of the mucosal flora in patients with inflammatory bowel disease. J Clin Microbiol. 43 (7), 3380-3389 (2005).
- Ibberson, C. B., Barraza, J. P., Holmes, A. L., Cao, P., Whiteley, M. Precise spatial structure impacts antimicrobial susceptibility of S. aureus in polymicrobial wound infections. Proc Natl Acad Sci USA. 119 (51), e2212340119(2022).
- Azimi, S., Lewin, G. R., Whiteley, M. The biogeography of infection revisited. Nat Rev Microbiol. 20 (10), 579-592 (2022).
- Dejea, C. M., et al. Microbiota organization is a distinct feature of proximal colorectal cancers. Proc Natl Acad Sci USA. 111 (51), 18321-18326 (2014).
- Hanson, C. A., Fuhrman, J. A., Horner-Devine, M. C., Martiny, J. B. Beyond biogeographic patterns: processes shaping the microbial landscape. Nat Rev Microbiol. 10 (7), 497-506 (2012).
- Adade, E. E., Al Lakhen, K., Lemus, A. A., Valm, A. M. Recent progress in analyzing the spatial structure of the human microbiome: Distinguishing biogeography and architecture in the oral and gut communities. Curr Opin Endocr. 18, 275-283 (2021).
- Mony, C., Bohannan, B. J., Leibold, M. A., Peay, K., Vandenkoornhuyse, P. Microbial landscape ecology: Highlights on the invisible corridors. Front Ecol Evol. 9, 753213(2021).
- Hölldobler, B., Wilson, E. O. The Ants. , Harvard University Press. (1990).
- Chapela, I. H., Rehner, S. A., Schultz, T. R., Mueller, U. G. Evolutionary history of the symbiosis between fungus-growing ants and their fungi. Science. 266 (5191), 1691-1694 (1994).
- Mueller, U. G., Rehner, S. A., Schultz, T. R. The evolution of agriculture in ants. Science. 281 (5385), 2034-2038 (1998).
- Mueller, U. G., Gerardo, N. M., Aanen, D. K., Six, D. L., Schultz, T. R. The evolution of agriculture in insects. Annu Rev Ecol Evol Syst. 36, 563-595 (2005).
- Dentinger, B. T., Lodge, D. J., Munkacsi, A. B., Desjardin, D. E., McLaughlin, D. J. Phylogenetic placement of an unusual coral mushroom challenges the classic hypothesis of strict coevolution in the Apterostigma pilosum group ant-fungus mutualism. Evolution. 63 (8), 2172-2178 (2009).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proc Natl Acad Sci USA. 105, 5435-5440 (2008).
- de Fine Licht, H. H., Boomsma, J. J. Forage collection, substrate preparation, and diet composition in fungus-growing ants. Ecol Entomol. 35 (3), 259-269 (2010).
- Martin, M. M. The biochemical basis of the fungus-attine ant symbiosis: A complex symbiosis is based upon integration of the carbon and nitrogen metabolisms of the two organisms. Science. 169 (3940), 16-20 (1970).
- Grell, M. N., et al. The fungal symbiont of Acromyrmex leaf-cutting ants expresses the full spectrum of genes to degrade cellulose and other plant cell wall polysaccharides. BMC Genomics. 14, 928(2013).
- Lange, L., Grell, M. N. The prominent role of fungi and fungal enzymes in the ant-fungus biomass conversion symbiosis. Appl Microbiol Biotechnol. 98, 4839-4851 (2014).
- Huang, E. L., et al. The fungus gardens of leaf-cutter ants undergo a distinct physiological transition during biomass degradation. Environ Microbiol Rep. 6 (4), 389-395 (2014).
- Craven, S. E., Dix, M. W., Michaels, G. E. Attine fungus gardens contain yeasts. Science. 169 (3941), 184-186 (1970).
- De Fine Licht, H. H., Boomsma, J. J., Tunlid, A. Symbiotic adaptations in the fungal cultivar of leaf-cutting ants. Nat Commun. 5 (1), 5675(2014).
- Aylward, F. O., et al. Enrichment and broad representation of plant biomass-degrading enzymes in the specialized hyphal swellings of Leucoagaricus gongylophorus, the fungal symbiont of leaf-cutter ants. PLoS One. 10 (8), e0134752(2015).
- Moreira-Soto, R. D., Sanchez, E., Currie, C. R., Pinto-Tomás, A. A. Ultrastructural and microbial analyses of cellulose degradation in leaf-cutter ant colonies. Microbiology. 163 (11), 1578-1589 (2017).
- Erthal Jr, M., Silva, C. P., Cooper, R. M., Samuels, R. I. Hydrolytic enzymes of leaf-cutting ant fungi. Comp Biochem. 152 (1), 54-59 (2009).
- North, R. D., Jackson, C. W., Howse, P. E. Communication between the fungus garden and workers of the leaf-cutting ant, Atta sexdens rubropilosa, regarding choice of substrate for the fungus. Physiol Entomol. 24 (2), 127-133 (1999).
- Herz, H., Hölldobler, B., Roces, F. Delayed rejection in a leaf-cutting ant after foraging on plants unsuitable for the symbiotic fungus. Behav Ecol. 19 (3), 575-582 (2008).
- Schiøtt, M., De Fine Licht, H. H., Lange, L., Boomsma, J. J. Towards a molecular understanding of symbiont function: identification of a fungal gene for the degradation of xylan in the fungus gardens of leaf-cutting ants. BMC Microbiol. 8, 40(2008).
- Bot, A. N., Currie, C. R., Hart, A. G., Boomsma, J. J. Waste management in leaf-cutting ants. Ethol Ecol Evol. 13 (3), 225-237 (2001).
- Scott, J. J., et al. Microbial community structure of leaf-cutter ant fungus gardens and refuse dumps. PLOS One. 5 (3), e9922(2010).
- Lewin, G. R., et al. Cellulose-enriched microbial communities from leaf-cutter ant (Atta colombica) refuse dumps vary in taxonomic composition and degradation ability. PLOS One. 11 (3), e0151840(2016).
- Suen, G., et al. An insect herbivore microbiome with high plant biomass-degrading capacity. PLOS Genet. 6 (9), e1001129(2010).
- Aylward, F. O., et al. Convergent bacterial microbiotas in the fungal agricultural systems of insects. MBio. 5 (6), e02077(2014).
- Barcoto, M. O., et al. Fungus-growing insects host a distinctive microbiota apparently adapted to the fungiculture environment. Sci Rep. 10 (1), 12384(2020).
- Francoeur, C. B., et al. Bacteria contribute to plant secondary compound degradation in a generalist herbivore system. mBio. 11, e02146-e02220 (2020).
- Martiarena, M. J. S., Deveau, A., Montoya, Q. V., Flórez, L. V., Rodrigues, A. The hyphosphere of leaf-cutting ant cultivars is enriched with helper bacteria. Microb Ecol. 86 (3), 1773-1788 (2023).
- Leal-Dutra, C. A., et al. Evidence that the domesticated fungus Leucoagaricus gongylophorus recycles its cytoplasmic contents as nutritional rewards to feed its leafcutter ant farmers. IMA Fungus. 14 (1), 19(2023).
- Sosa-Calvo, J., Jesovnik, A., Okonski, E., Schultz, T. R. Locating, collecting, and maintaining colonies of fungus-farming ants (Hymenoptera: Myrmicinae: Attini). Sociobiology. 62 (2), 300-320 (2015).
- Karnovsky, M. J. A formaldehyde glutaraldehyde fixative of high osmolality for use in electron microscopy. J Cell Biol. 27, 137-138 (1965).
- Eltoum, I., Fredenburgh, J., Myers, R. B., Grizzle, W. E. Introduction to the theory and practice of fixation of tissues. J Histotechnol. 24 (3), 173-190 (2001).
- Gusnard, D., Kirschner, R. H. Cell and organelle shrinkage during preparation for scanning electron microscopy: effects of fixation, dehydration and critical point drying. J Microsc. 110 (1), 51-57 (1977).
- Surman, S. B., et al. Comparison of microscope techniques for the examination of biofilms. J Microbiol Methods. 25 (1), 57-70 (1996).
- Augustin, J. O., et al. Yet more "weeds" in the garden: fungal novelties from nests of leaf-cutting ants. PLOS One. 8 (12), e82265(2013).
- Montoya, Q. V., Martiarena, M. J. S., Polezel, D. A., Rodrigues, A. More pieces to a huge puzzle: Two new Escovopsis species from fungus gardens of attine ants. MycoKeys. 46, 97(2019).
- Varanda-Haifig, S. S., et al. Nature of the interactions between hypocrealean fungi and the mutualistic fungus of leaf-cutter ants. Antonie van Leeuwenhoek. 110, 593-605 (2017).
- Custodio, B. C., Rodrigues, A. Escovopsis kreiselii specialization to its native hosts in the fungiculture of the lower attine ant Mycetophylax morschi. Antonie van Leeuwenhoek. 112, 305-317 (2019).
- Schröttner, H., Schmied, M., Scherer, S. Comparison of 3D surface reconstruction data from certified depth standards obtained by SEM and an Infinite Focus Measurement Machine (IFM). Microchim Acta. 155, 279-284 (2006).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of scanning electron microscopy (SEM). Scanning microscopy for nanotechnology: Techniques and applications. Zhou, W., Wang, Z. L. , Springer. New York, NY. 1-40 (2007).
- Kannan, M. Scanning electron microscopy: Principle, components and applications. A Textbook on Fundamentals and Applications of Nanotechnology. Raja, K., Subramanian, K. S., Kannan, M. , Daya Publishing House. 81-92 (2018).
- Ruffolo, J. J. Jr Critical point drying of protozoan cells and other biological specimens for scanning electron microscopy: apparatus and methods of specimen preparation. Trans Am Microsc. 93 (1), 124-131 (1974).
- Echlin, P. Recent advances in specimen coating techniques for electron microscopy. Scanning Electron Microscopy 1981/1. , IITRI. Chicago. 79-90 (1981).
- Ris, H. The cytoplasmic filament system in critical point-dried whole mounts and plastic-embedded sections. J Cell Biol. 100 (5), 1474-1487 (1985).
- Bray, D. F., Bagu, J., Koegler, P. Comparison of hexamethyldisilazane (HMDS), Peldri II, and critical-point drying methods for scanning electron microscopy of biological specimens. Microsc Res Tech. 26 (6), 489-495 (1993).
- Bergmans, L., Moisiadis, P., Van Meerbeek, B., Quirynen, M., Lambrechts, P. Microscopic observation of bacteria: review highlighting the use of environmental SEM. Int Endod J. 38 (11), 775-788 (2005).
- Kirk, S. E., Skepper, J. N., Donald, A. M. Application of environmental scanning electron microscopy to determine biological surface structure. J Microsc. 233 (2), 205-224 (2009).
- Kemmenoe, B. H., Bullock, G. R. Structure analysis of sputter-coated and ion-beam sputter-coated films: a comparative study. J Microsc. 132 (2), 153-163 (1983).
- Kinden, D. A., Brown, M. F. Technique for scanning electron microscopy of fungal structures within plant cells. Phytopathology. 65, 74-76 (1975).
- Masaphy, S., Levanon, D., Tchelet, R., Henis, Y. Scanning electron microscope studies of interactions between Agaricus bisporus (Lang) Sing hyphae and bacteria in casing soil. Appl Environ Microbiol. 53 (5), 1132-1137 (1987).
- Massicotte, H. B., Melville, L. H., Peterson, R. L. Scanning electron microscopy of ectomycorrhizae potential and limitations. Scanning Microsc. 1 (3), 58(1987).
- Visen, A., Singh, P. N., Chakraborty, B., Singh, A., Bisht, T. S. Scanning electron microscopy indicates Pseudomonad strains facilitate AMF mycorrhization in litchi (Litchi chinensis Sonn.) air-layers and improving survivability, growth and leaf nutrient status. Curr Res Microb Sci. 2, 100063(2021).
- Fleeman, R. M., Mikesh, M., Davies, B. W. Investigating Klebsiella pneumoniae biofilm preservation for scanning electron microscopy. Access Microbiol. 5 (2), 000470-000473 (2023).
- Wells, M., Mikesh, M., Gordon, V. Structure-preserving fixation allows scanning electron microscopy to reveal biofilm microstructure and interactions with immune cells. J Microsc. 293 (1), 59-68 (2024).
- Nadell, C. D., Drescher, K., Foster, K. R. Spatial structure, cooperation and competition in biofilms. Nat Rev Microbiol. 14 (9), 589-600 (2016).
- Madsen, J. S., et al. Coexistence facilitates interspecific biofilm formation in complex microbial communities. Environ Microbiol. 18 (8), 2565-2574 (2016).
- Madsen, J. S., Sørensen, S. J., Burmølle, M. Bacterial social interactions and the emergence of community-intrinsic properties. Curr Opin Microbiol. 42, 104-109 (2018).
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nat Rev Microbiol. 17 (4), 247-260 (2019).
- Bringhurst, B., Allert, M., Greenwold, M., Kellner, K., Seal, J. N. Environments and hosts structure the bacterial microbiomes of fungus-gardening ants and their symbiotic fungus gardens. Microb Ecol. 86 (2), 1374-1392 (2023).
- Bringhurst, B., Greenwold, M., Kellner, K., Seal, J. N. Symbiosis, dysbiosis and the impact of horizontal exchange on bacterial microbiomes in higher fungus-gardening ants. Sci Rep. 14 (1), 3231(2024).
- Vargas, S., et al. Body-plan reorganization in a sponge correlates with microbiome change. Mol Biol Evol. 40 (6), msad138(2023).
- Apprill, A., et al. Humpback whale populations share a core skin bacterial community: towards a health index for marine mammals. PLOS One. 9 (3), e90785(2014).
- Fraune, S., et al. Bacteria-bacteria interactions within the microbiota of the ancestral metazoan Hydra contribute to fungal resistance. ISME J. 9 (7), 1543-1556 (2015).
- Gowen, R., Gamal, A., Di Martino, L., McCormick, T. S., Ghannoum, M. A. Modulating the microbiome for Crohn's disease treatment. Gastroenterology. 164 (5), 828-840 (2023).
- Moya, P., et al. Molecular phylogeny and ultrastructure of the lichen microalga Asterochloris mediterranea sp. nov. from Mediterranean and Canary Islands ecosystems. Int J Syst Evol Microbiol. 65 (6), 1838-1854 (2015).
- Zettler, E. R., Mincer, T. J., Amaral-Zettler, L. A. Life in the "plastisphere": microbial communities on plastic marine debris. Environ Sci Technol. 47 (13), 7137-7146 (2013).
- Porter, K. R., Kallman, F. The properties and effects of osmium tetroxide as a tissue fixative with special reference to its use for electron microscopy. Exp Cell Res. 4 (1), 127-141 (1953).
- Ligon, J. J., Abraham, J. L., Boyd, A. S. Traumatic osmium tetroxide inoculation. J Am Acad Dermatol. 45 (6), 949-952 (2001).
- Friedova, N., et al. Osmium absorption after osmium tetroxide skin and eye exposure. Basic Clin Pharmacol Toxicol. 127 (5), 429-433 (2020).
- Fratesi, S. E., Lynch, F. L., Kirkland, B. L., Brown, L. R. Effects of SEM preparation techniques on the appearance of bacteria and biofilms in the Carter Sandstone. J Sediment. 74 (6), 858-867 (2004).
- Dassanayake, R. P., et al. Identification of a reliable fixative solution to preserve the complex architecture of bacterial biofilms for scanning electron microscopy evaluation. PLOS One. 15 (5), e0233973(2020).
- Desiro, A., et al. Detection of a novel intracellular microbiome hosted in arbuscular mycorrhizal fungi. ISME J. 8 (2), 257-270 (2014).
- Morales, D. P., et al. Advances and challenges in fluorescence in situ hybridization for visualizing fungal endobacteria. Front Microbiol. 13, 892227(2022).
- Shi, H., et al. Highly multiplexed spatial mapping of microbial communities. Nature. 588 (7839), 676-681 (2020).
- Valm, A. M., Welch, J. L. M., Borisy, G. G. CLASI-FISH: principles of combinatorial labeling and spectral imaging. Syst Appl Microbiol. 35 (8), 496-502 (2012).
- Fernandez-Brime, S., Muggia, L., Maier, S., Grube, M., Wedin, M. Bacterial communities in an optional lichen symbiosis are determined by substrate, not algal photobionts. FEMS Microbiol Ecol. 95 (3), fiz012(2019).
- Schluter, S., Eickhorst, T., Mueller, C. W. Correlative imaging reveals holistic view of soil microenvironments. Environ Sci Technol. 53 (2), 829-837 (2018).
- Barcoto, M. O., Rodrigues, A. Lessons from insect fungiculture: from microbial ecology to plastics degradation. Front Microbiol. 13, 812143(2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved