A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיקרוביוטה של גני נמלים אטיין: הדמיה של נוף מיקרוביאלי על ידי סריקת מיקרוסקופ אלקטרונים
In This Article
Summary
אנו מציעים פרוטוקול מיקרוסקופ אלקטרונים סורק אופטימלי להדמיית דגימות הטרוגניות ועדינות ביותר המכילות ביומסה צמחית ופטרייתית, יחד עם מיקרוביוטה וביופילם. פרוטוקול זה מאפשר לתאר את הממדים המרחביים של ארגון המיקרוביוטה.
Abstract
במערכות אקולוגיות בקנה מידה מאקרו, כגון יערות גשם או שוניות אלמוגים, הלוקליזציה המרחבית של אורגניזמים היא הבסיס להבנתנו את האקולוגיה הקהילתית. גם בעולם המיקרוביאלי, מערכות אקולוגיות מיקרובסקליות רחוקות מלהיות תערובת אקראית והומוגנית של אורגניזמים ובתי גידול. גישה להתפלגות המרחבית של מיקרובים היא בסיסית להבנת התפקוד והאקולוגיה של המיקרוביוטה, שכן מינים החיים יחד נוטים יותר לתקשר ולהשפיע זה על הפיזיולוגיה של זה.
מערכת אקולוגית מיקרוביאלית בין-ממלכותית נמצאת בליבה של מושבות נמלים המגדלות פטריות, המגדלות פטריות בזידיומיצט כמשאב תזונתי. נמלים אטין מחפשות מצעים מגוונים (בעיקר צמחיים), עוברים מטבוליזם על ידי הפטרייה המתורבת תוך יצירת מבנה ספוגי, "גן מיקרוביאלי" הפועל כמעי חיצוני. הגן הוא רשת שזורה של קורים פטרייתיים הגדלים על ידי חילוף חומרים של המצע, פתיחת גומחות להקמת מיקרוביוטה אופיינית ומותאמת. המיקרוביוטה נחשבת כתורמת לפירוק המצע ולצמיחת פטריות, אם כי הארגון המרחבי שלה טרם נקבע.
במאמר זה אנו מתארים כיצד אנו משתמשים במיקרוסקופ אלקטרונים סורק (SEM) כדי לחקור, בפירוט חסר תקדים, את הארגון המרחבי של המיקרוביוטה והביופילם במערכות שונות של גידול פטריות של נמלים מגדלות פטריות. הדמיית SEM סיפקה תיאור של המבנה המרחבי והארגון של המיקרוביוטה. SEM גילה כי מיקרוביוטה מתאספת בדרך כלל בביופילמים, מבנה נפוץ של נופים מיקרוביאליים בגידול פטריות. אנו מציגים את הפרוטוקולים המשמשים לתיקון, ייבוש, ייבוש, ציפוי מרזב ודימוי קהילה כה מורכבת. פרוטוקולים אלה הותאמו להתמודדות עם דגימות עדינות והטרוגניות, הכוללות ביומסה של צמחים ופטריות, כמו גם המיקרוביוטה והביופילם.
Introduction
מערכות אקולוגיות מורכבות מאורגניזמים המחוברים ביניהם על ידי תהליכים במיקום גיאוגרפי מסוים (כלומר, הסביבה). אורגניזמים מתקשרים עם סביבתם לאורך זמן, ומהם נוצרים דפוסים מרחביים מורכבים והטרוגניים. תבניות מרחביות קובעות את המגוון והיציבות האקולוגיים, ובסופו של דבר, את תפקוד המערכת האקולוגית 1,2,3,4. במערכות אקולוגיות בקנה מידה מאקרו, כגון ביצות, סוואנות, שוניות אלמוגים ומערכות אקולוגיות צחיחות, דפוסים מרחביים מתואמים עם זרימת משאבים וריכוז. התרת אופטימיזציה של משאבים, הטרוגניות מרחבית ודפוסים מביאים למערכות אקולוגיות עמידות יותר מאשר מערכות הומוגניות2. הלוקליזציה המרחבית של אורגניזמים העומדת בבסיס האקולוגיה הקהילתית מתורגמת גם לעולם המיקרוביאלי.
מערכות אקולוגיות מיקרוביות, רחוקות מאורגניזמים המעורבבים באופן אקראי והומוגני ברחבי מיקרו-בתי גידול, מציגות תבניות מרחביות המגדירות חלק ניכר מתפקודן 5,6,7. מעמודות וינוגרדסקי ועד מיקרוביוטה הקשורה לסביבה ולפונדקאי, מערכות אקולוגיות אלה מאורגנות באופן הטרוגני בחלל, עם סידורים מרחביים המעוררים תגובות פנוטיפיות שונות. מינים החיים יחד נוטים יותר לתקשר ולהשפיע זה על הפיזיולוגיה של זה. לפיכך, הארגון המרחבי הקהילתי, יותר מהרכבו כשלעצמו, תוחם תכונות מערכת אקולוגית ונישות אקולוגיות 5,7,8. להמחשת מושגים אלה, שינויים בדפוסים מרחביים נראים מתואמים עם התקדמות פתולוגית של פלאקים דנטליים, עששת, מחלות חניכיים 9,10, מחלות מעי דלקתיות11, דלקות ריאה של סיסטיק פיברוזיס, זיהומים כרוניים בפצעים12,13, סרטן המעי הגס והחלחולת ואדנומות14.
תחת ההיקף של ביוגאוגרפיה מיקרוביאלית (חקר התפלגות המגוון הביולוגי ודפוסים על פני מרחב וזמן בקנה מידה מיקרוביאלי), הידע של מערכות אקולוגיות מיקרוביאליות מועיל במידה רבה על ידי הבנת הדפוסים המרחביים שלהם 6,13,15,16,17. בחנו דפוסים מרחביים של מערכת אקולוגית מיקרוביאלית הבנויה על ידי חרקים, הנמצאת בליבה של נמלת אטין כריזמטית המגדלת פטריות (Hymenoptera: Formicidae: Myrmicinae: Attini: Attina). שם שוכן "גן מיקרוביאלי", שבמרכזו פטריית בזידיומיצט בשבט Leucocoprinae (Basidiomycota: Agaricaceae) או במשפחה Pterulaceae (Basidiomycota: Agaricales)18,19,20,21,22. הגן הוא מבנה ספוגי הבוקע מרשת שזורה של קורים שגדלה על-ידי חילוף חומרים של המצע הצמחי ברובו ששולבו על-ידי הנמלים (איור 1). אלה עשויים לכלול, על פי סוג האטין: חלקי צמחים יבשים, פרשים ופגרים של חרקים, עלים טריים, זרעים וחלקי פרחים23,24. בדומה למעי אוכל-עשב חיצוני, הגינה ממירה באופן אנזימטי וכימי פולימרים סרבנים למשאבים תזונתיים חיוניים, ומספקת לנמלים חומצות אמינו חיוניות, שומנים וסוכרים מסיסים 21,25,26,27,28.
ניתוחים אולטרה-מבניים, אנזימטיים ושעתוק שבוצעו עבור גנים מהסוגים Atta ו-Acromyrmex החותכים עלים מצביעים על כך שסביבות אלה מבנות רצף של התפרקות המצע וטלאים תזונתיים 26,29,30,31,32. חלקים צעירים של הגן נוטים להיות כהים יותר בשל מצע טרי ששולב לאחר שפוצל. מצעים אלה שנוספו לאחרונה מאוכלסים לעתים קרובות מהקצוות, שנחתכו על ידי עובדי נמלים וחוסנו בגושי תפטיר. קורים פטרייתיים, המוקרנים מקצוות חתוכים, מתפשטים על המצע 29,32,33. השפע ההיפאלי עולה ככל שהשפלת המצע מתקדמת, וכתוצאה מכך אזורים לבנבנים ופעילים מטבולית 30,31,32. אזורים ישנים יותר, עם מצע מפורק יותר ומיקרוביוטה שופעת29,32, נוטים להציג גוונים חומים ולחות גבוהה יותר. העובדים מסירים שברים מאזור זה, ומפרידים אותם בערימות פסולת, שם הם גם לוקחים מצעים הפוגעים בסימביונט הפטרייתי 34,35,36. ערימות פסולת, למרות שהן מנותקות פיזית מהגינה, הן נקודה של התפרקות מתמשכת של המצע ומחזור חומרי מזון על ידי המיקרוביוטה השופעת של התושבים 29,32,37,38,39.
מיקרוביוטה המורכבת בעיקר מאנטרובקטר, קלבסיאלה, פנטואה, פסאודומונאס וסרטיה, מאכלסת גם היא את הגן, ככל הנראה משותפת למערכות פטריות אטיניות מגוונות. קידוד מסלולים מטבוליים שיכולים להשלים מטבוליזם פטרייתי, המיקרוביוטה עשויה להשתתף בתגובות הפיזיולוגיות של הגן 40,41,42,43,44. לא רק שנתונים מטאגנומיים הצביעו על כך שהמיקרוביוטה הייתה שם41,42, אלא גם ניתוח מיקרוסקופ אלקטרונים סורק (SEM) של פטריות נמלים חותכות עלים הראה בעיקר חיידקים בצורת מוט מעל מצע צמח32. אף על פי שחיידקים (כולל זנים צלולוליטיים) בודדו מכל הגן, הם הודגמו רק בחלקים ישנים יותר של הגן ובערימות פסולת, כמו גם בגלולה הראשונית שנישאה על ידי מלכות המייסדים29,32. כמו כן, לא היה בטוח אם המיקרוביוטה יכולה ליצור ביופילמים in vivo (כלומר, בגינה ובפסולת), כפי שהוצע על ידי היכולת המטבולית שלהם42 ונצפה במבחנה44.
כאן, השתמשנו ב- SEM כדי להבין עוד יותר את הארגון המרחבי של המיקרוביוטה ברחבי אזורי הגנים, תוך פירוט אינטראקציות פיזיות של מיקרוביוטה-מצע ומיקרוביוטה-קורים. על ידי מתן תמונות עם עומק מוקד גדול יותר, SEM מאפשר תצפיות של מבנים מיקרוסקופיים תלת ממדיים ברזולוציה גבוהה, המאפשר ניתוח מעמיק של דפוסי המיקרוביוטה המרחבית של הגן. אנו מפרטים שלבים לתיקון, ייבוש, ייבוש, התזה של הפרווה ותמונה של דגימות הטרוגניות ועדינות כאלה המבוססות על פטריות. על ידי הסרת שלב הפוסט-קיבוע באמצעות אוסמיום טטרוקסיד (OsO4) והפחתת זמן ההתייבשות, פישטנו את הפרוטוקולים 32,33,45 להכנת דגימות גינה ופסולת לניתוח SEM. פרוטוקול מותאם זה משמר דפוסים מבניים היפאליים, כמו גם את הארגון המרחבי של המיקרוביוטה והביופילם, וניתן ליישם אותו במערכות אקולוגיות מיקרוביאליות עדינות אחרות ובביופילמים.
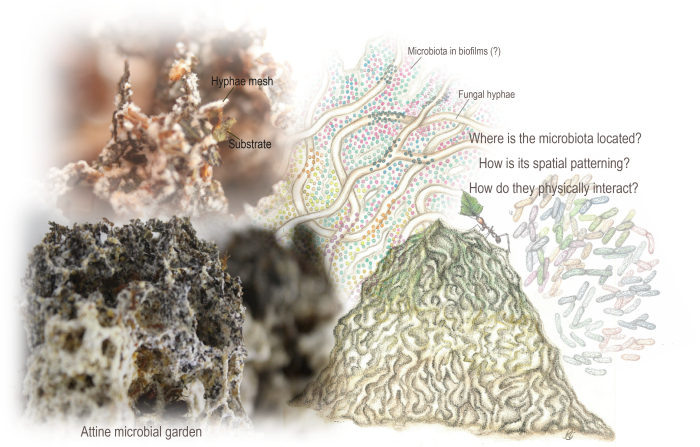
איור 1: גנים מיקרוביאליים של אטין. הגן הוא מבנה דמוי ספוג הנובע מרשת שזורה של קורים הגדלה על ידי חילוף חומרים של המצע הצמחי ברובו המשולב על ידי הנמלים. בגן שוכנת גם המיקרוביוטה, המקודדת מסלולים מטבוליים שיכולים להשלים את חילוף החומרים הפטרייתי. נתונים מטאגנומיים וניתוחים קודמים של מיקרוסקופ אלקטרונים סורק הצביעו על נוכחותו, אם כי היה לנו ידע מועט על הארגון המרחבי שלו ועל האינטראקציות הפיזיות שלו עם המצע וקורי הפטרייה. השתמשנו ב-SEM כדי לחשוף את הארגון המרחבי והתבניות של המיקרוביוטה והביופילם. איורים מאת מריאנה ברקוטו (גינה ומיקרוביוטה שאומצו מברקוטו ורודריגז 94), ותצלומים מאת מריאנה ברקוטו ואנצו סורנטינו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. דיגום מושבות שדה
הערה: בעת איסוף מושבות נמלים, יש לוודא כי כל ההרשאות הנדרשות על פי החקיקה המקומית מתקבלות לפני האיסוף. במקרה שלנו, היתר האיסוף #74585 הונפק על ידי Instituto Chico Mendes de Conservação e Biodiversidade (ICMBio). כאשר הדגימות מגיעות ממושבת מעבדה, עבור לסעיף 2.
- איתור וסימון המושבה. חפרו תעלה המקיפה את אזור הקן עד לחשיפת חדר הגן (איור 2A).
הערה: חלק ממיני האטין עשויים לבנות את מושבותיהם מתחת לפסולת העלים או בתוך בולי עץ רקובים. במקרים כאלה, בזהירות לסובב את המלטה או בזהירות לשבור את יומני לאיסוף הדגימות. למידע מפורט על איתור, איסוף ותחזוקה של מושבות חיות של מיני נמלים אטיניים מגוונים, ראו Sosa-Calvo et al.46. - פתחו את תא הגינה לרוחב כדי למנוע מהאדמה ליפול על משטח הגינה. אספו בזהירות דגימות גינה באמצעות מלקחיים אנטומולוגיים, כף או רחפן מטבח, בהתאם לגודל הגינה.
הערה: הקפד לעקר את הכלים לפני האיסוף. בעת איסוף גינות נמלים חותכות עלים, יש ללבוש כפפות בד עבות כדי למנוע (או לפחות להחליש) עקיצות עובדים. עבור מינים אחרים של אטין כפפות בד הן אופציונליות. - מעבירים את דגימות הגינה לנמען פלסטיק נקי המכיל שכבת טיח לאיזון לחות הגינה. לאחר העברת עובדי הגינה והנמלים, סגרו הרמטית את הנמען כדי למנוע ייבוש דגימה. אחסנו דגימות גינה בטמפרטורה של 23-25 מעלות צלזיוס עד לעיבוד.
- סגור את התעלה עם אדמה שהוסרה בעבר.
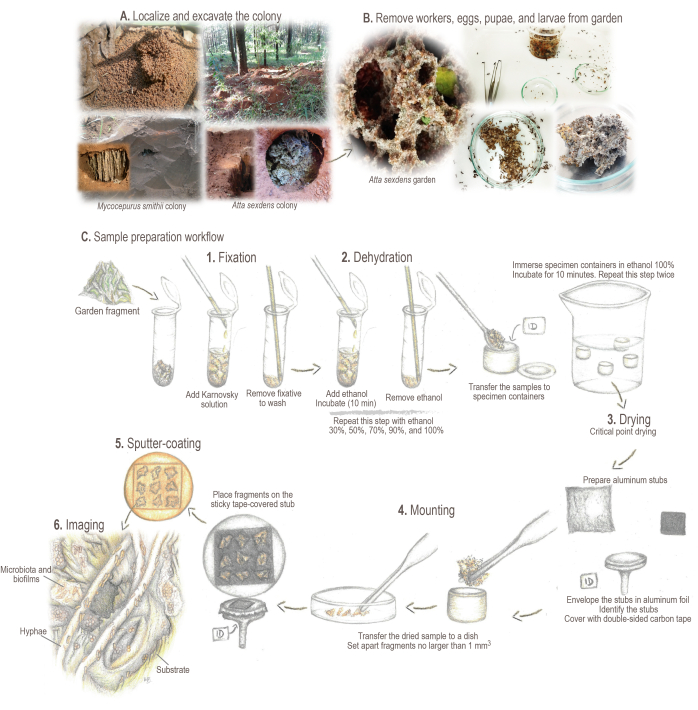
איור 2: פרוטוקול הכנת מדגם. (א) דגימה של מושבות שדה. (B) עיבוד דגימה. (ג) יסודות קצרים וזרימת עבודה להכנת הדגימה: 1. קיבוע: לחיזוק ושימור מבנה המדגם. 2. התייבשות: תכולת המים של הדגימות מוחלפת באתנול. 3. ייבוש נקודה קריטית: CO2 נוזלי מחליף אתנול ומתאדה. 4. הרכבה: המדגם מוצג לניתוח. 5. ציפוי מרזב בזהב: למנוע טעינת דגימה. 6. הדמיה. איורים וצילומים מאת מריאנה ברקוטו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. ריאגנטים
הערה: זכור כי יש להכין מראש את הפתרונות הבאים.
- הכינו מאגר נתרן קקודילט 0.2 מ'. לשם כך, להמיס 42.8 גרם של נתרן cacodylate ב 800 מ"ל של מים מזוקקים, תוך ערבוב עד המסה וייצוב pH ב 7.2 (אם נדרש, להתאים pH באמצעות חומצה הידרוכלורית). לפצות את נפח התמיסה ל 1 L על ידי הוספת מים מזוקקים. אחסן את התמיסה ב 4 ° C (למשך ~ חודש אחד).
אזהרה: גלוטראלדהיד ופרפורמאלדהיד רעילים ויש לטפל בהם בתוך מכסה אדים. ללבוש כפפות ניטריל משקפי מגן כל הזמן בעת טיפול ריאגנטים כאלה. - הכינו את הקיבוע של קרנובסקי (שונה מקרנובסקי)47. לשם כך, להוסיף 10 מ"ל של 25% תמיסה מימית גלוטראלדהיד ו 10 מ"ל של 20% תמיסה מימית paraformaldehyde ל 25 מ"ל של 0.2 M נתרן cacodylate חיץ ולערבב. הוסף 1 מ"ל של 0.1 M סידן כלורי (CaCl2) והשלם את הנפח ל 100 מ"ל על ידי הוספת מים מזוקקים. אחסנו את התמיסה בטמפרטורה של 4°C (עד חודש אחד).
אזהרה: הקיבוע של קרנובסקי מזיק בשאיפה ועלול לגרום לגירוי בעור ובעיניים. לכן, הימנע נשימה אדים, באמצעות רק בחוץ או באזור מאוורר היטב. יש ללבוש כפפות ניטריל ומשקפי מגן כל הזמן בעת הטיפול בתמיסה. - באמצעות אתנול מוחלט (כיתה אנליטית), להכין 30%, 50%, 70%, ו 90% אתנול תמיסות במים מזוקקים; 100% אתנול נדרש גם.
3. קיבוע לדוגמה
הערה: מקבעים מקשיחים ומשמרים דגימות, תוך שמירה על תכונות מורפולוגיות. אלדהידים (כגון פרפורמאלדהיד וגלוטראלדהיד) הם מקבעים לא קרישה מסוג קישור צולב, הגורמים לקשרים צולבים בתוך ובין חלבונים וחומצות גרעין48.
- הוציאו פועלים, ביצים, גלמים וזחלים מדגימות הגינה באמצעות מלקחיים אנטומולוגיים (איור 2B). יש להפריד בין שברי גינה שגודלם אינו עולה על 5 מ"מ3. הוסיפו את השברים לצינור בנפח 2 מ"ל (איור 2C).
- לצינורות המכילים את הדגימות, השתמש פיפטה זכוכית פסטר כדי להוסיף ~ 1 מ"ל של פתרון קיבוע Karnovsky (ודא שהדגימה מכוסה לחלוטין). ערבבו על-ידי תסיסה עדינה כדי לעזור לדגימה להשרות ולדגור בטמפרטורה של 4°C במשך 24 שעות לפחות לפני המשך עיבוד הדגימה (איור 2C.1).
הערה: כאשר שלבי ההתייבשות הבאים לא יבוצעו מיד לאחר הקיבוע, הפרוטוקול עשוי להיות מושהה בשלב זה, ודגימות עשויות להיות מאוחסנות במשך ~1 שנה ב 4 ° C.
אנו ממליצים להשתמש בפיפטה מזכוכית פסטר, מכיוון שהיא מורכבת מחומר אינרטי וקל יותר לנקות אותה לשימוש חוזר לאחר מכן. חומר הגינה הוא הידרופובי מאוד, נוטה לצוף על פני השטח של התמיסה המקבעת. זה בדרך כלל לוקח עד 5 דקות כדי להיות ספוג לחלוטין fixative. יש לוודא שהקיבוע מכסה את שברי הגינה מכיוון שנפחו נוטה להצטמצם ככל שהוא נכנס לנקבוביות הדגימה. וידאנו אמפירית שלאחר שהדגימה הושרה ונרטבה, מרכיביה (בפרט, התפטיר הפטרייתי העדין) הפכו רגישים להתנפצות כאשר ערבבו אותה עוד יותר. לכן, אנו ממליצים להימנע ככל האפשר מטלטול הדגימות.
4. התייבשות מדגם
הערה: סדרת שטיפת האתנול מחליפה בהדרגה את המים בדגימות לאתנול. חשוב להתחיל עם תמיסת אתנול בריכוז נמוך (ראה להלן) כדי למנוע נזק מוגזם או קריסה של דגימות עדינות כאלה49.
- הסירו לחלוטין את הפתרון המקבע של קרנובסקי באמצעות פיפטה מזכוכית, תוך זהירות שלא לשבש את הדגימה (איור 2C.1).
הערה: יש להשליך את הקיבוע של קרנובסקי במושתל המסומן כראוי לטיפול בשאריות כימיות רעילות. - מיד לאחר הסרת הקיבוע, הוסיפו 1 מ"ל של אתנול 30%, נזהרו לא לשבש את הדגימה, ודגרו במשך 10 דקות בטמפרטורת החדר (איור 2C.2).
הערה: דוגמאות צריכות תמיד להיות ספוגות בתמיסה. הקפידו להחליף במהירות תמיסות במהלך סדרת השטיפה ההדרגתית של אתנול. כאשר הגן מאבד את ההיבט הנקבובי שלו ומצטבר בתחתית הצינור, 1 מ"ל אתנול נוטה להספיק כדי לכסות את הדגימה (כאשר הדגימה אינה גדולה מ -5 מ"מ3). עם זאת, אם הדגימות אינן מכוסות לחלוטין, להוסיף אתנול עד הדגימה מכוסה לחלוטין. - לחלוטין להסיר 30% אתנול עם פיפטה זכוכית, נזהר לא לשבש את המדגם. יש להשליך 30% אתנול כראוי.
הערה: עבור כל סדרת השטיפה ההדרגתית של אתנול, יש להשליך אתנול לנמען שסומן כראוי לטיפול בשאריות כימיות רעילות. - מוסיפים 1 מ"ל אתנול 50% ודגרים במשך 10 דקות בטמפרטורת החדר. לחלוטין להסיר 50% אתנול עם פיפטה זכוכית, נזהר לא לשבש את המדגם. יש להשליך 50% אתנול כראוי.
- מוסיפים 1 מ"ל של 70% אתנול ודגרים במשך 10 דקות בטמפרטורת החדר. לחלוטין להסיר 70% אתנול עם פיפטה זכוכית, נזהר לא לשבש את המדגם. יש להשליך 70% אתנול כראוי.
הערה: בשלב שטיפת אתנול 70%, המשתמש רשאי להשהות את הפרוטוקול במידת הצורך, מכיוון שצינורות דגימה עשויים להיות מאוחסנים למשך הלילה ב -4 מעלות צלזיוס, כאשר החומר לא יעובד באופן מיידי. - מוסיפים 1 מ"ל של 90% אתנול ודגרים במשך 10 דקות בטמפרטורת החדר. להסיר לחלוטין 90% אתנול עם פיפטה זכוכית, נזהר לא לשבש את המדגם. יש להשליך 90% אתנול כראוי.
- מוסיפים 1 מ"ל של 100% אתנול ודגרים במשך 10 דקות בטמפרטורת החדר. לחלוטין להסיר 100% אתנול עם פיפטה זכוכית, נזהר לא לשבש את המדגם. יש להשליך 100% אתנול כראוי.
- בעזרת מלקחיים ו/או מרית, העבירו בזהירות את הדגימות למיכלי הדגימה של מייבש הנקודות הקריטיות (CPD), המכילים תוויות זיהוי דגימה (שיוצרו בעבר בנייר ועיפרון). כדי למנוע ייבוש דגימות, העברה זו מתבצעת עם המיכל ממוקם בצלחת פטרי מכוסה 100% אתנול.
- הניחו את המכסים על המיכלים וטבלו אותם בכוס זכוכית מדורגת המכילה 100% אתנול מספיק כדי לטבול את המיכלים. מכסים את הזכוכית ודגרים במשך 10 דקות בטמפרטורת החדר; ואז כראוי להשליך 100% אתנול.
- העבירו את מיכלי הדגימה לכוס זכוכית מדורגת אחרת המכילה מספיק אתנול 100% כדי לטבול את המיכלים. מכסים את הזכוכית ודגרים במשך 10 דקות בטמפרטורת החדר; לאחר מכן, העבירו את מיכלי הדגימה למייבש הכביסה Critical Point.
הערה: לאחר סדרת הכביסה, פיפטות זכוכית וכוסות יש לשטוף בשפע במים מזוקקים, ואת שאריות המים האלה יש להשליך במקבל המסומן כראוי לטיפול בשאריות כימיות רעילות. לאחר השטיפה, ניתן לשטוף פריטי זכוכית בחומר ניקוי ניטרלי, לשטוף במי ברז ולייבש באוויר.
5. ייבוש נקודה קריטית
הערה: מייבש כביסה Critical Point מחליף את האתנול בדגימות בפחמן דו-חמצני נוזלי (CO2), שמתאדה מהדגימה בטמפרטורה ולחץ גבוהים יותר. פעל בהתאם להוראות היצרן עבור הליכים אלה.
- הפעל את הציוד.
- פתחו את התא, הניחו את מיכלי הדגימה בתוכו והוסיפו 100% אתנול עד שהוא מכסה את המיכלים. סגור את החדר.
- הפעל את האפשרות קירור והמתן עד שהטמפרטורה תגיע ל -10 מעלות צלזיוס.
- פתח את שסתום צילינדר CO2 והפעל את האפשרות Stirrer .
- הפעל את CO2 באפשרות , תמיד לבדוק את התא כדי לוודא כמה CO2 כבר מילא אותו. כאשר התא כמעט מלא, בטל את האפשרות CO2 ב והפעל את אפשרות Exchange , תוך שמירה על הפעלתו עד שיהיה מספיק CO2 רק כדי לכסות את המיכלים. ודא שהמכולות מכוסות תמיד ב- CO2 (כלומר, בטל את אפשרות Exchange לפני שכל CO2 עזב את התא). חזור על שלב 5.5 6x.
- הפעל CO2 בפעם האחרונה ומלא את התא עד שהמכלים מכוסים.
- הפעילו את האפשרות 'חימום' ובטלו את האפשרות 'בוחש'. סגור את שסתום צילינדר CO2.
- המתן עד שהטמפרטורה תעלה ל 35 °C (75 °F); לאחר מכן, הפעל את האפשרות יציאת גז .
הערה: בסביבות 30 מעלות צלזיוס, התא מגיע ללחצים של 70-80 בר, ומשיג את הנקודה הקריטית, שבה הנוזל נעלם. - כאשר לחץ התא מגיע לבר אחד, כל תכולת הגז הוסרה. פתח את התא והסר את המיכלים.
- כבה את הציוד.
6. הרכבה
- הכינו מחזיקי דגימות SEM (כלומר, גבעולי אלומיניום; איור 2ג.4).
- עטפו את הגבעולים בחתיכת רדיד אלומיניום, המכסה רק את החלק העליון, כדי להקל על ניקוי הגבעולים לאחר הניתוח.
- זהה את הספסלים על ידי כתיבת קוד / מספר לדוגמה בתחתית המחזיק, הבטחת זיהוי של מה ממוקם על גבי.
- מכסים את החלק העליון בסרט פחמן דו-צדדי. הניחו את הגבעולים במחזיק דגימה.
- פתחו את מכסה מיכל הדגימה, והעבירו בזהירות את הדגימה המיובשת לצלחת פטרי מזכוכית באמצעות מלקחיים ומרית.
הערה: גינות קריטיות מיובשות בנקודה נוטות להצטבר וליצור דגימות צפופות מאוד שיש להפריד בזהירות כשברים בגודל שאינו עולה על 1 מ"מ3. - מניחים בזהירות שברים על המשטח הדביק של הספח המכוסה בסרט. ברגע שקטע הגינה נוגע בקלטת, קשה מאוד להזיז אותו (מחדש), לכן היזהרו לא למקם אותו במקומות או בתנוחות לא רצויות. הוסיפו עד תשעה שברים לכל גיבוב.
- חזור על שלבים 6.2 ו- 6.3 עבור כל דגימה.
7. ציפוי מרזב בזהב
הערה: ציפוי הדגימה נדרש כדי למנוע את טעינתה. עקוב אחר הוראות היצרן להתאמת הגדרות כגון לחץ גז הפעולה (0.5 × 10-1 מ"מ כספית של לחץ גז בפרוטוקול זה), זמן הגמגום (220 שניות), עובי שכבת הזהב (~ 120 Å), הזרם (50 mA) ואספקת המתח. גמגום נוטה לעקוב אחר זרימת עבודה משותפת, אם כי הציוד של יצרנים שונים עשוי לפעול מעט אחרת.
- פתחו את זרוע המטרה בעלת הצירים והניחו את הגבעולים על שולחן הדגימות.
- סגרו את זרוע המטרה בעלת הצירים ובדקו אם מגן הרסיסים של תא ואקום הזכוכית מוטבע כראוי.
- פתח את שסתום צילינדר הארגון והפעל את מתג ההפעלה הראשי.
- עקוב אחר הוואקום העולה בתצוגת הציוד עד שהוא מגיע לסימן 0.5 × 10-1 מ"מ כספית בתצוגה; לאחר מכן, הפעל את שטיפה. חזור על הפעולה 5x.
- הפעל את מערכת זרימת המים, הפעל את האפשרות HV On ופתח את מכסה סרט הזהב. אשר כי צבע הפלזמה הוא ורדרד. כדי לעקוב אחר פרוטוקול זה, הגדר 220 שניות של התזה עם מתח של 50 mA, אשר יפקיד שכבת זהב של ~ 120 Å (12 ננומטר).
- HV מופעל כבוי באופן אוטומטי. כבה את מערכת זרימת המים וסגור את מכסה סרט הזהב.
- כבה את מתג ההפעלה הראשי, ואפשר לאוויר להיכנס לתא הוואקום. עבור דגימות גינה ואשפה, חזור על שלבים 7.1-7.7 3x.
הערה: אם ההדמיה לא תתרחש מיד לאחר הכנת הדגימה, אחסנו את הגבעולים במיכל הרמטי מלא בשכבת סיליקה כדי למנוע התייבשות של הדגימות.
8. הדמיה
הערה: בצע את הוראות היצרן לכוונון הגדרות SEM, כגון קוטר צמצם אובייקטיבי, מתח הפעלה, יישור מערכת קרן האלקטרונים, יישור צירית וסטיגמטורים.
- הניחו את הספסלים במחזיק הדגימה, ורשמו הערות על מיקום כל דגימה.
הערה: יש ללבוש כפפות בעת הכנסה או הסרה של מחזיק הדגימה, ולשמור על המחזיק נקי ככל האפשר. - הפעל את תוכנת הפעולה משולחן העבודה.
- בחר את הגדרות המכשיר. דמיינו דגימות גינה בקוטר צמצם אובייקטיבי של 30 מיקרומטר (כלומר, בשלב השני), הפועלות בוואקום גבוה, איתור אותות מאלקטרונים משניים (SED), מתח תאוצה של 20 קילו וולט, מרחק עבודה של 15 - 20 מ"מ, זרם בדיקה של 40.0 (במצב זרם גבוה), ושינוי ההגדלה בהתאם לדגימה.
- בהתאם להוראות הניווט, לחץ על סמל פתח האוורור והמתן לאוורור תא הדגימה. מד התקדמות מציין את מצב הוואקום.
- כאשר הגיע ללחץ אטמוספרי, פתח את תא הדגימה והכנס בזהירות את מחזיק הדגימה.
- סגור בעדינות את דלת התא ולחץ על סמל Evac כדי לפנות את המכשיר, בהתאם למצב הוואקום דרך סרגל ההתקדמות. מערכת הניווט תציג את מיקום השלב הנע ותספק גרף מחזיק בעת השלמת המעבר. לחץ על סמל המצלמה כדי להקליט תמונה של המחזיק כדי לקבל תצוגה עליונה שתסייע לנווט בין דגימות בזמן ההדמיה.
- לחץ על סמל התצפית כדי להפעיל את אקדח האלקטרונים והמתן עד להיווצרות התמונה. השתמש בממשק המשתמש הידני (בקרה ידנית) כדי להזיז ידנית את ציר Z לגובה המתאים (בהתבסס על גובה הדגימה ומרחק העבודה שנקבע).
הערה: להארכת חיי חוט הטונגסטן, השהה את פונקציית התצפית בכל פעם שאינה מבצעת הדמיה פעילה. - השתמש באפשרויות המוצגות על המסך או בפקד הידני כדי לשנות את קצב הרסטר ואת מיקום התמונה. הזז את הבמה כדי לקבל תצוגה מעמיקה של הדגימה, תוך שימוש בפונקציה RDC כדי להתמקד באזורים ספציפיים. כאשר מתבוננים במבנה מטרה (או מבנה מעניין), התאימו את ההגדלה, המיקוד, הבהירות, הניגודיות והסטיגמה בהתאם. תקן סטיגמה באמצעות ממשק המשתמש הידני כדי להזיז את הבמה לכיווני X ו- Y.
- התאם את ההגדלה בין 100x ל- 700x כדי להמחיש היבטים כלליים של הגן (כגון צפיפות hyphal, מצע ודפוסי התיישבות).
- התאימו את ההגדלה בין 700x ל-1,500x כדי להמחיש את הדפוסים המרחביים של המיקרוביוטה.
- התאימו את ההגדלה בין 1,500x ל-3,000x כדי לצפות באינטראקציות הפיזיות של המיקרוביוטה והביופילם.
- התאימו את ההגדלה בין 3,000x ל-4,000x כדי להתמקד בצבירי חיידקים ספציפיים.
- כדי לשמור תמונה, השתמש בפונקציה Freeze , לחץ על סמל התמונה והגדר את נתיב הקובץ. כסטנדרט, נתח לפחות שלושה שברי גן, הדמיה כל אחד בכל טווחי ההגדלה המוזכרים בשלב 8.8. התוצאה היא לפחות 12 תמונות לדגימה, אם כי תמונות רבות יותר עשויות לתמוך בתיאורים מפורטים יותר. אנו מציעים כי 15-25 תמונות לדגימה, הנעות בין כל ההגדלות בשלב 8.8 נוטות לספק פרטים עדינים לתיאור המדגם.
הערה: הוספת רסטר ושמירה של תמונה אורכת מספר שניות שבמהלכן יש להימנע מכל רטט בשולחן הצף של SEM. - לאחר סיום ההדמיה, לחץ על האפשרות פתח אוורור כדי לאוורר את התא, בהתאם למצב הוואקום דרך מד ההתקדמות. הסר בזהירות את המחזיק, סגור בעדינות את דלת התא ולחץ על Evac כדי לפנות את החדר.
- מיד עם השלמת הפינוי, צא מתוכנת ההפעלה.
- התאם את הבהירות והניגודיות כדי לשפר את התצוגה החזותית באמצעות עורך תמונות.
Access restricted. Please log in or start a trial to view this content.
תוצאות
כאן, הצגנו פרוטוקול פשוט כדי להמחיש את המרכיבים של דגימות גינת אטין ופסולת, כגון קורים פטרייתיים, מצע, מיקרוביוטה וביופילמים. SEM שיפר את ההבנה שלנו לגבי האופן שבו הגינה והפסולת מפיגמים את התבניות המבניות של המיקרוביוטה (איור 3). בגינות אטיניות, קורים פטריי?...
Access restricted. Please log in or start a trial to view this content.
Discussion
SEM משתמש בקרן אלקטרונים כדי לסרוק את הדגימה, ויוצר תמונה מוגדלת שלה כך שניתן לדמיין מיקרו-מבנים תלת מימדיים ברזולוציה גבוהה. מכיוון ש- SEM פועל תחת ואקום גבוה, נדרשת הסרה של עד / יותר מ -99% מהמים מהדגימות. בתוך תא ואקום SEM, דגימות לחות חלקית עלולות להתייבש ולקרוס, מלבד פיזור אל?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
המחברים רוצים להודות Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) על מתן תמיכה כספית (Grant #2019/03746-0). MOB תודה על מלגת דוקטורט שהתקבלה מ FAPESP (תהליך 2021/08013-0) ו Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - ברזיל (CAPES) - קוד האוצר 001. AR מודה גם Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) עבור מלגת מחקר (#305269/2018). המחברים רוצים להודות למרשה רג'ינה דה מורה אאואדה ואנטוניו טרויושי יבוקי על עזרתם בבדיקות פיילוט להכנת דגימות, לרנטו ברבוסה סאלארולי על הסיוע הטכני, ולאנצו סורנטינו על עזרתו בצילומים. מחקר זה בוצע תחת אישור מורשת גנטית גישה # SISGen AA39A6D.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 2 mL tube | Axygen | MCT-200-C-BRA | To fix and dehydrate samples |
| Calcium chloride anhydrous | Merck | C4901 | CaCl2 anhydrous to prepare Karnovsky’s fixative |
| Critical point dryer | Leica | EM CPD 300 | For critical point drying |
| Double Sided Carbon Conductive Tape, 12 mm (W) X 5 M (L) | Electron Microscopy Sciences | 77819-12 | For mounting samples |
| Entomological forceps | No specific supplier | To manipulate garden samples | |
| Ethyl alcohol (=ethanol), pure (≥99.5%) | Sigma-Aldrich | 459836 | For dehydration |
| Forceps | No specific supplier | To manipulate garden samples | |
| Glass beaker | No specific supplier | For dehydration | |
| Glass Petri dish | No specific supplier | To manipulate garden samples | |
| Glass pipette | No specific supplier | To fix and dehydrate samples | |
| Glutaraldehyde (Aqueous Glutaraldehyde EM Grade 25%) | Electron Microscopy Sciences | 16220 | To prepare Karnovsky’s fixative |
| Gold target | Ted Pella, Inc. | 8071 | To sputter coat with gold |
| Hydrochloric acid | Sigma-Aldrich | 320331 | For adjusting solutions pH |
| Image editor | Photoshop | any version | To adjust images |
| Paraformaldehyde (Paraformaldehyde 20% Aqueous Solution EM Grade) | Electron Microscopy Sciences | 15713 | To prepare Karnovsky’s fixative |
| Propilene recipient | No specific supplier | For maintaining alive ant colonies | |
| Scanning Electron Microscope | JEOL | IT300 SEM | For sample imaging |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | For preparing sodium cacodylate buffer |
| Spatula | No specific supplier | To manipulate garden samples | |
| Specimen containers with 15 mm dia. x 10 mm high | Ted Pella, Inc. | 4591 | For critical point drying |
| Sputter coater | Baltec | SCD 050 | To coat with gold |
| Stub (Aluminium mount, flat end pin) 12.7 mm x 8 mm | Electron Microscopy Sciences | 75520 | For mounting samples |
References
- Turner, M. G. Landscape ecology: the effect of pattern on process. Annu Rev Ecol Evol Syst. 20 (1), 171-197 (1989).
- Rietkerk, M., Van de Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Schmitz, O. J. Spatial dynamics and ecosystem functioning. PLOS Biol. 8 (5), e1000378(2010).
- Pringle, R. M., Doak, D. F., Brody, A. K., Jocqué, R., Palmer, T. M. Spatial pattern enhances ecosystem functioning in an African savanna. PLOS Biol. 8 (5), e1000377(2010).
- Wimpenny, J. W. Spatial order in microbial ecosystems. Biol Rev. 56 (3), 295-342 (1981).
- Martiny, J. B. H., et al. Microbial biogeography: putting microorganisms on the map. Nat Rev. Microbiol. 4 (2), 102-112 (2006).
- McCallum, G., Tropini, C. The gut microbiota and its biogeography. Nat Rev Microbiol. 22 (2), 105-118 (2024).
- Lamont, R. J., Hajishengallis, G., Koo, H. Social networking at the microbiome-host interface. Infec Immun. 91 (9), e00124-e00223 (2023).
- Welch, J. L. M., Rossetti, B. J., Rieken, C. W., Dewhirst, F. E., Borisy, G. G. Biogeography of a human oral microbiome at the micron scale. Proc Natl Acad Sci USA. 113 (6), E791-E800 (2016).
- Kim, D., et al. Spatial mapping of polymicrobial communities reveals a precise biogeography associated with human dental caries. Proc Natl Acad Sci USA. 117 (22), 12375-12386 (2020).
- Swidsinski, A., Weber, J., Loening-Baucke, V., Hale, L. P., Lochs, H. Spatial organization and composition of the mucosal flora in patients with inflammatory bowel disease. J Clin Microbiol. 43 (7), 3380-3389 (2005).
- Ibberson, C. B., Barraza, J. P., Holmes, A. L., Cao, P., Whiteley, M. Precise spatial structure impacts antimicrobial susceptibility of S. aureus in polymicrobial wound infections. Proc Natl Acad Sci USA. 119 (51), e2212340119(2022).
- Azimi, S., Lewin, G. R., Whiteley, M. The biogeography of infection revisited. Nat Rev Microbiol. 20 (10), 579-592 (2022).
- Dejea, C. M., et al. Microbiota organization is a distinct feature of proximal colorectal cancers. Proc Natl Acad Sci USA. 111 (51), 18321-18326 (2014).
- Hanson, C. A., Fuhrman, J. A., Horner-Devine, M. C., Martiny, J. B. Beyond biogeographic patterns: processes shaping the microbial landscape. Nat Rev Microbiol. 10 (7), 497-506 (2012).
- Adade, E. E., Al Lakhen, K., Lemus, A. A., Valm, A. M. Recent progress in analyzing the spatial structure of the human microbiome: Distinguishing biogeography and architecture in the oral and gut communities. Curr Opin Endocr. 18, 275-283 (2021).
- Mony, C., Bohannan, B. J., Leibold, M. A., Peay, K., Vandenkoornhuyse, P. Microbial landscape ecology: Highlights on the invisible corridors. Front Ecol Evol. 9, 753213(2021).
- Hölldobler, B., Wilson, E. O. The Ants. , Harvard University Press. (1990).
- Chapela, I. H., Rehner, S. A., Schultz, T. R., Mueller, U. G. Evolutionary history of the symbiosis between fungus-growing ants and their fungi. Science. 266 (5191), 1691-1694 (1994).
- Mueller, U. G., Rehner, S. A., Schultz, T. R. The evolution of agriculture in ants. Science. 281 (5385), 2034-2038 (1998).
- Mueller, U. G., Gerardo, N. M., Aanen, D. K., Six, D. L., Schultz, T. R. The evolution of agriculture in insects. Annu Rev Ecol Evol Syst. 36, 563-595 (2005).
- Dentinger, B. T., Lodge, D. J., Munkacsi, A. B., Desjardin, D. E., McLaughlin, D. J. Phylogenetic placement of an unusual coral mushroom challenges the classic hypothesis of strict coevolution in the Apterostigma pilosum group ant-fungus mutualism. Evolution. 63 (8), 2172-2178 (2009).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proc Natl Acad Sci USA. 105, 5435-5440 (2008).
- de Fine Licht, H. H., Boomsma, J. J. Forage collection, substrate preparation, and diet composition in fungus-growing ants. Ecol Entomol. 35 (3), 259-269 (2010).
- Martin, M. M. The biochemical basis of the fungus-attine ant symbiosis: A complex symbiosis is based upon integration of the carbon and nitrogen metabolisms of the two organisms. Science. 169 (3940), 16-20 (1970).
- Grell, M. N., et al. The fungal symbiont of Acromyrmex leaf-cutting ants expresses the full spectrum of genes to degrade cellulose and other plant cell wall polysaccharides. BMC Genomics. 14, 928(2013).
- Lange, L., Grell, M. N. The prominent role of fungi and fungal enzymes in the ant-fungus biomass conversion symbiosis. Appl Microbiol Biotechnol. 98, 4839-4851 (2014).
- Huang, E. L., et al. The fungus gardens of leaf-cutter ants undergo a distinct physiological transition during biomass degradation. Environ Microbiol Rep. 6 (4), 389-395 (2014).
- Craven, S. E., Dix, M. W., Michaels, G. E. Attine fungus gardens contain yeasts. Science. 169 (3941), 184-186 (1970).
- De Fine Licht, H. H., Boomsma, J. J., Tunlid, A. Symbiotic adaptations in the fungal cultivar of leaf-cutting ants. Nat Commun. 5 (1), 5675(2014).
- Aylward, F. O., et al. Enrichment and broad representation of plant biomass-degrading enzymes in the specialized hyphal swellings of Leucoagaricus gongylophorus, the fungal symbiont of leaf-cutter ants. PLoS One. 10 (8), e0134752(2015).
- Moreira-Soto, R. D., Sanchez, E., Currie, C. R., Pinto-Tomás, A. A. Ultrastructural and microbial analyses of cellulose degradation in leaf-cutter ant colonies. Microbiology. 163 (11), 1578-1589 (2017).
- Erthal Jr, M., Silva, C. P., Cooper, R. M., Samuels, R. I. Hydrolytic enzymes of leaf-cutting ant fungi. Comp Biochem. 152 (1), 54-59 (2009).
- North, R. D., Jackson, C. W., Howse, P. E. Communication between the fungus garden and workers of the leaf-cutting ant, Atta sexdens rubropilosa, regarding choice of substrate for the fungus. Physiol Entomol. 24 (2), 127-133 (1999).
- Herz, H., Hölldobler, B., Roces, F. Delayed rejection in a leaf-cutting ant after foraging on plants unsuitable for the symbiotic fungus. Behav Ecol. 19 (3), 575-582 (2008).
- Schiøtt, M., De Fine Licht, H. H., Lange, L., Boomsma, J. J. Towards a molecular understanding of symbiont function: identification of a fungal gene for the degradation of xylan in the fungus gardens of leaf-cutting ants. BMC Microbiol. 8, 40(2008).
- Bot, A. N., Currie, C. R., Hart, A. G., Boomsma, J. J. Waste management in leaf-cutting ants. Ethol Ecol Evol. 13 (3), 225-237 (2001).
- Scott, J. J., et al. Microbial community structure of leaf-cutter ant fungus gardens and refuse dumps. PLOS One. 5 (3), e9922(2010).
- Lewin, G. R., et al. Cellulose-enriched microbial communities from leaf-cutter ant (Atta colombica) refuse dumps vary in taxonomic composition and degradation ability. PLOS One. 11 (3), e0151840(2016).
- Suen, G., et al. An insect herbivore microbiome with high plant biomass-degrading capacity. PLOS Genet. 6 (9), e1001129(2010).
- Aylward, F. O., et al. Convergent bacterial microbiotas in the fungal agricultural systems of insects. MBio. 5 (6), e02077(2014).
- Barcoto, M. O., et al. Fungus-growing insects host a distinctive microbiota apparently adapted to the fungiculture environment. Sci Rep. 10 (1), 12384(2020).
- Francoeur, C. B., et al. Bacteria contribute to plant secondary compound degradation in a generalist herbivore system. mBio. 11, e02146-e02220 (2020).
- Martiarena, M. J. S., Deveau, A., Montoya, Q. V., Flórez, L. V., Rodrigues, A. The hyphosphere of leaf-cutting ant cultivars is enriched with helper bacteria. Microb Ecol. 86 (3), 1773-1788 (2023).
- Leal-Dutra, C. A., et al. Evidence that the domesticated fungus Leucoagaricus gongylophorus recycles its cytoplasmic contents as nutritional rewards to feed its leafcutter ant farmers. IMA Fungus. 14 (1), 19(2023).
- Sosa-Calvo, J., Jesovnik, A., Okonski, E., Schultz, T. R. Locating, collecting, and maintaining colonies of fungus-farming ants (Hymenoptera: Myrmicinae: Attini). Sociobiology. 62 (2), 300-320 (2015).
- Karnovsky, M. J. A formaldehyde glutaraldehyde fixative of high osmolality for use in electron microscopy. J Cell Biol. 27, 137-138 (1965).
- Eltoum, I., Fredenburgh, J., Myers, R. B., Grizzle, W. E. Introduction to the theory and practice of fixation of tissues. J Histotechnol. 24 (3), 173-190 (2001).
- Gusnard, D., Kirschner, R. H. Cell and organelle shrinkage during preparation for scanning electron microscopy: effects of fixation, dehydration and critical point drying. J Microsc. 110 (1), 51-57 (1977).
- Surman, S. B., et al. Comparison of microscope techniques for the examination of biofilms. J Microbiol Methods. 25 (1), 57-70 (1996).
- Augustin, J. O., et al. Yet more "weeds" in the garden: fungal novelties from nests of leaf-cutting ants. PLOS One. 8 (12), e82265(2013).
- Montoya, Q. V., Martiarena, M. J. S., Polezel, D. A., Rodrigues, A. More pieces to a huge puzzle: Two new Escovopsis species from fungus gardens of attine ants. MycoKeys. 46, 97(2019).
- Varanda-Haifig, S. S., et al. Nature of the interactions between hypocrealean fungi and the mutualistic fungus of leaf-cutter ants. Antonie van Leeuwenhoek. 110, 593-605 (2017).
- Custodio, B. C., Rodrigues, A. Escovopsis kreiselii specialization to its native hosts in the fungiculture of the lower attine ant Mycetophylax morschi. Antonie van Leeuwenhoek. 112, 305-317 (2019).
- Schröttner, H., Schmied, M., Scherer, S. Comparison of 3D surface reconstruction data from certified depth standards obtained by SEM and an Infinite Focus Measurement Machine (IFM). Microchim Acta. 155, 279-284 (2006).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of scanning electron microscopy (SEM). Scanning microscopy for nanotechnology: Techniques and applications. Zhou, W., Wang, Z. L. , Springer. New York, NY. 1-40 (2007).
- Kannan, M. Scanning electron microscopy: Principle, components and applications. A Textbook on Fundamentals and Applications of Nanotechnology. Raja, K., Subramanian, K. S., Kannan, M. , Daya Publishing House. 81-92 (2018).
- Ruffolo, J. J. Jr Critical point drying of protozoan cells and other biological specimens for scanning electron microscopy: apparatus and methods of specimen preparation. Trans Am Microsc. 93 (1), 124-131 (1974).
- Echlin, P. Recent advances in specimen coating techniques for electron microscopy. Scanning Electron Microscopy 1981/1. , IITRI. Chicago. 79-90 (1981).
- Ris, H. The cytoplasmic filament system in critical point-dried whole mounts and plastic-embedded sections. J Cell Biol. 100 (5), 1474-1487 (1985).
- Bray, D. F., Bagu, J., Koegler, P. Comparison of hexamethyldisilazane (HMDS), Peldri II, and critical-point drying methods for scanning electron microscopy of biological specimens. Microsc Res Tech. 26 (6), 489-495 (1993).
- Bergmans, L., Moisiadis, P., Van Meerbeek, B., Quirynen, M., Lambrechts, P. Microscopic observation of bacteria: review highlighting the use of environmental SEM. Int Endod J. 38 (11), 775-788 (2005).
- Kirk, S. E., Skepper, J. N., Donald, A. M. Application of environmental scanning electron microscopy to determine biological surface structure. J Microsc. 233 (2), 205-224 (2009).
- Kemmenoe, B. H., Bullock, G. R. Structure analysis of sputter-coated and ion-beam sputter-coated films: a comparative study. J Microsc. 132 (2), 153-163 (1983).
- Kinden, D. A., Brown, M. F. Technique for scanning electron microscopy of fungal structures within plant cells. Phytopathology. 65, 74-76 (1975).
- Masaphy, S., Levanon, D., Tchelet, R., Henis, Y. Scanning electron microscope studies of interactions between Agaricus bisporus (Lang) Sing hyphae and bacteria in casing soil. Appl Environ Microbiol. 53 (5), 1132-1137 (1987).
- Massicotte, H. B., Melville, L. H., Peterson, R. L. Scanning electron microscopy of ectomycorrhizae potential and limitations. Scanning Microsc. 1 (3), 58(1987).
- Visen, A., Singh, P. N., Chakraborty, B., Singh, A., Bisht, T. S. Scanning electron microscopy indicates Pseudomonad strains facilitate AMF mycorrhization in litchi (Litchi chinensis Sonn.) air-layers and improving survivability, growth and leaf nutrient status. Curr Res Microb Sci. 2, 100063(2021).
- Fleeman, R. M., Mikesh, M., Davies, B. W. Investigating Klebsiella pneumoniae biofilm preservation for scanning electron microscopy. Access Microbiol. 5 (2), 000470-000473 (2023).
- Wells, M., Mikesh, M., Gordon, V. Structure-preserving fixation allows scanning electron microscopy to reveal biofilm microstructure and interactions with immune cells. J Microsc. 293 (1), 59-68 (2024).
- Nadell, C. D., Drescher, K., Foster, K. R. Spatial structure, cooperation and competition in biofilms. Nat Rev Microbiol. 14 (9), 589-600 (2016).
- Madsen, J. S., et al. Coexistence facilitates interspecific biofilm formation in complex microbial communities. Environ Microbiol. 18 (8), 2565-2574 (2016).
- Madsen, J. S., Sørensen, S. J., Burmølle, M. Bacterial social interactions and the emergence of community-intrinsic properties. Curr Opin Microbiol. 42, 104-109 (2018).
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nat Rev Microbiol. 17 (4), 247-260 (2019).
- Bringhurst, B., Allert, M., Greenwold, M., Kellner, K., Seal, J. N. Environments and hosts structure the bacterial microbiomes of fungus-gardening ants and their symbiotic fungus gardens. Microb Ecol. 86 (2), 1374-1392 (2023).
- Bringhurst, B., Greenwold, M., Kellner, K., Seal, J. N. Symbiosis, dysbiosis and the impact of horizontal exchange on bacterial microbiomes in higher fungus-gardening ants. Sci Rep. 14 (1), 3231(2024).
- Vargas, S., et al. Body-plan reorganization in a sponge correlates with microbiome change. Mol Biol Evol. 40 (6), msad138(2023).
- Apprill, A., et al. Humpback whale populations share a core skin bacterial community: towards a health index for marine mammals. PLOS One. 9 (3), e90785(2014).
- Fraune, S., et al. Bacteria-bacteria interactions within the microbiota of the ancestral metazoan Hydra contribute to fungal resistance. ISME J. 9 (7), 1543-1556 (2015).
- Gowen, R., Gamal, A., Di Martino, L., McCormick, T. S., Ghannoum, M. A. Modulating the microbiome for Crohn's disease treatment. Gastroenterology. 164 (5), 828-840 (2023).
- Moya, P., et al. Molecular phylogeny and ultrastructure of the lichen microalga Asterochloris mediterranea sp. nov. from Mediterranean and Canary Islands ecosystems. Int J Syst Evol Microbiol. 65 (6), 1838-1854 (2015).
- Zettler, E. R., Mincer, T. J., Amaral-Zettler, L. A. Life in the "plastisphere": microbial communities on plastic marine debris. Environ Sci Technol. 47 (13), 7137-7146 (2013).
- Porter, K. R., Kallman, F. The properties and effects of osmium tetroxide as a tissue fixative with special reference to its use for electron microscopy. Exp Cell Res. 4 (1), 127-141 (1953).
- Ligon, J. J., Abraham, J. L., Boyd, A. S. Traumatic osmium tetroxide inoculation. J Am Acad Dermatol. 45 (6), 949-952 (2001).
- Friedova, N., et al. Osmium absorption after osmium tetroxide skin and eye exposure. Basic Clin Pharmacol Toxicol. 127 (5), 429-433 (2020).
- Fratesi, S. E., Lynch, F. L., Kirkland, B. L., Brown, L. R. Effects of SEM preparation techniques on the appearance of bacteria and biofilms in the Carter Sandstone. J Sediment. 74 (6), 858-867 (2004).
- Dassanayake, R. P., et al. Identification of a reliable fixative solution to preserve the complex architecture of bacterial biofilms for scanning electron microscopy evaluation. PLOS One. 15 (5), e0233973(2020).
- Desiro, A., et al. Detection of a novel intracellular microbiome hosted in arbuscular mycorrhizal fungi. ISME J. 8 (2), 257-270 (2014).
- Morales, D. P., et al. Advances and challenges in fluorescence in situ hybridization for visualizing fungal endobacteria. Front Microbiol. 13, 892227(2022).
- Shi, H., et al. Highly multiplexed spatial mapping of microbial communities. Nature. 588 (7839), 676-681 (2020).
- Valm, A. M., Welch, J. L. M., Borisy, G. G. CLASI-FISH: principles of combinatorial labeling and spectral imaging. Syst Appl Microbiol. 35 (8), 496-502 (2012).
- Fernandez-Brime, S., Muggia, L., Maier, S., Grube, M., Wedin, M. Bacterial communities in an optional lichen symbiosis are determined by substrate, not algal photobionts. FEMS Microbiol Ecol. 95 (3), fiz012(2019).
- Schluter, S., Eickhorst, T., Mueller, C. W. Correlative imaging reveals holistic view of soil microenvironments. Environ Sci Technol. 53 (2), 829-837 (2018).
- Barcoto, M. O., Rodrigues, A. Lessons from insect fungiculture: from microbial ecology to plastics degradation. Front Microbiol. 13, 812143(2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved