JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Attine Ants' Gardens의 미생물군: 주사 전자 현미경을 통한 미생물 풍경 시각화
요약
우리는 미생물군 및 생물막과 함께 식물 및 곰팡이 바이오매스를 포함하는 매우 이질적이고 섬세한 샘플을 시각화하기 위한 최적화된 주사 전자 현미경 프로토콜을 제안합니다. 이 프로토콜을 사용하면 미생물군 조직의 공간적 차원을 설명할 수 있습니다.
초록
열대우림이나 산호초와 같은 거시적 생태계에서 유기체의 공간적 국소화는 공동체 생태학에 대한 우리의 이해의 기초입니다. 마찬가지로 미생물의 세계에서도 미시적 생태계는 유기체와 서식지의 무작위적이고 균질한 혼합과는 거리가 멉니다. 미생물의 공간적 분포에 접근하는 것은 미생물총(microbiota)의 기능과 생태를 이해하는 데 필수적인데, 이는 동거하는 종이 상호 작용하고 서로의 생리에 영향을 미칠 가능성이 더 높기 때문입니다.
왕국 간 미생물 생태계는 곰팡이 성장 개미 군체의 핵심이며, 이는 담자균류 곰팡이를 영양 자원으로 재배합니다. 아틴 개미는 배양된 곰팡이에 의해 대사되는 다양한 기질(대부분 식물 기반)을 찾아 다니며 외부 장 역할을 하는 "미생물 정원"인 해면 구조를 형성합니다. 정원은 기질을 대사하여 성장하는 곰팡이 균사의 얽힌 그물망으로, 특징적이고 적응된 미생물군이 형성할 수 있는 틈새를 엽니다. 미생물총(microbiota)은 기질 분해와 곰팡이 성장에 기여하는 것으로 생각되지만 공간 조직은 아직 결정되지 않았습니다.
여기에서는 주사 전자 현미경(SEM)을 사용하여 곰팡이 성장 개미의 다양한 곰팡이 배양 시스템에 걸쳐 미생물군 및 생물막 공간 조직을 전례 없는 세부 사항으로 조사하는 방법을 설명합니다. SEM 이미징은 미생물총(microbiota) 공간 구조 및 조직에 대한 설명을 제공했습니다. SEM은 미생물총(microbiota)이 일반적으로 곰팡이 배양에서 미생물 풍경의 광범위한 구조인 생물막에 모인다는 것을 밝혔습니다. 우리는 이러한 복잡한 커뮤니티를 수정, 탈수, 건조, 스퍼터 코팅 및 이미지화하는 데 사용되는 프로토콜을 제시합니다. 이러한 프로토콜은 식물 및 곰팡이 바이오매스, 미생물군 및 생물막으로 구성된 섬세하고 이질적인 샘플을 처리하도록 최적화되었습니다.
서문
생태계는 특정 지리적 위치(즉, 환경)의 과정에 의해 상호 연결된 유기체로 구성됩니다. 유기체는 시간이 지남에 따라 환경과 상호 작용하며, 여기에서 복잡하고 이질적인 공간 패턴이 나타납니다. 공간 패터닝은 생태적 다양성과 안정성, 그리고 궁극적으로 생태계 기능을 결정한다 1,2,3,4. 습지, 사바나, 산호초, 건조 생태계와 같은 거시적 생태계에서 공간적 패턴은 자원의 흐름 및 집중과 상관관계가 있습니다. 자원 최적화, 공간적 이질성 및 패터닝을 허용하면 동질적인 생태계보다 더 탄력적인 생태계를 만들 수 있다2. 군집 생태학의 기초가 되는 유기체의 공간적 지역화는 미생물 세계로도 번역됩니다.
미생물 생태계는 미세서식지 전체에 걸쳐 무작위적이고 균질하게 혼합된 유기체와는 거리가 멀며, 그 기능의 많은 부분을 정의하는 공간적 패턴을 보인다 5,6,7. Winogradsky 기둥에서 환경 및 숙주 관련 미생물군에 이르기까지, 이러한 생태계는 공간에서 이질적으로 조직되어 있으며, 공간 배열은 서로 다른 표현형 반응을 이끌어냅니다. 동거 종은 상호 작용하고 서로의 생리에 영향을 미칠 가능성이 더 큽니다. 따라서 공동체 공간 조직은 그 구성 자체라기보다는 생태계 속성과 생태적 틈새를 구분한다 5,7,8. 이러한 개념을 설명하면, 공간 패턴의 변화는 치태, 충치, 잇몸 질환 9,10, 염증성 장 질환11, 낭포성 섬유증 폐 감염, 만성 상처 감염12,13, 결장직장암 및 선종14의 병리학적 진행과 상관관계가 있는 것으로 보인다.
미생물 생물지리학(microbial biogeography, 미시적 규모에서 시공간을 가로지르는 생물다양성 분포 및 패턴화에 대한 연구)의 범위 하에서, 미생물 생태계에 대한 지식은 미생물의 공간적 패턴을 이해함으로써 큰 이점을 얻을 수 있다 6,13,15,16,17. 우리는 카리스마 있는 곰팡이 성장 아틴 개미(Hymenoptera: Formicidae: Myrmicinae: Attini: Attina) 군체의 핵심에서 발견되는 곤충이 만든 미생물 생태계의 공간적 패턴을 조사했습니다. Leucocoprinae (Basidiomycota : Agaricaceae) 또는 Pterulaceae (Basidiomycota : Agaricales) 18 , 19 , 20 , 21 , 22 계통의 담자균류 곰팡이를 중심으로 한 "미생물 정원"이 있습니다. 정원은 개미가 통합한 대부분 식물 기반 기질을 대사하여 자라는 얽힌 균사 그물망에서 나오는 해면질 구조입니다(그림 1). 여기에는 attine 속에 따라 건조 식물 부분, 곤충 부스러기 및 사체, 갓 자른 잎, 씨앗 및 꽃 부분23,24이 포함될 수 있습니다. 외부 초식성 장과 유사하게, 정원은 효소 및 화학적으로 다루기 힘든 고분자를 불안정한 영양 자원으로 변환하여 개미에게 필수 아미노산, 지질 및 용해성 설탕21 , 25 , 26 , 27 , 28 을 제공합니다.
잎을 자르는 속 Atta와 Acromyrmex의 정원을 위해 수행 된 초 구조, 효소 및 전사체 분석은 이러한 환경이 기질 분해 및 영양 패치의 연속체를 구조화한다는 것을 시사합니다26 , 29 , 30 , 31 , 32 . 정원의 젊은 부분은 파편화 된 후 갓 통합 된 기질로 인해 더 어두운 경향이 있습니다. 이렇게 최근에 추가된 기질은 종종 가장자리에서 군집화되는데, 이 기질은 개미 일개미에 의해 절단되고 균사체 덩어리가 접종됩니다. 절단된 가장자리에서 방사되는 곰팡이 균사는 기판 29,32,33 위로 퍼집니다. 기질 분해가 진행됨에 따라 균사 풍부도가 증가하여 희끄무레하고 대사 활성 영역이 생성됩니다30 , 31 , 32 . 더 많이 분해 된 기질과 풍부한 미생물군29,32을 가진 오래된 영역은 갈색 색조와 더 높은 습도를 나타내는 경향이 있습니다. 작업자는이 영역의 조각을 제거하여 폐기물 더미로 분리하고 곰팡이 공생체 34 , 35 , 36 에 해를 끼치는 기질도 취합니다. 쓰레기 더미는 물리적으로 정원에서 떨어져 있지만 풍부한 서식지 미생물29 , 32 , 37 , 38 , 39 에 의해 지속적인 기질 분해 및 영양 순환의 지점입니다.
주로 Enterobacter, Klebsiella, Pantoea, Pseudomonas 및 Serratia로 구성된 미생물군도 정원에 서식하며 다양한 attine 곰팡이 배양 시스템에서 공유하는 것으로 보입니다. 곰팡이 대사를 보완할 수 있는 대사 경로를 암호화하는 미생물총(microbiota)은 잠재적으로 정원의 생리적 반응에 참여할 수 있습니다 40,41,42,43,44. 메타유전체학(metagenomic) 데이터는 미생물총(microbiota)이 존재한다는 것을 나타냈을 뿐만 아니라41,42, 잎개미의 곰팡이 배양에 대한 주사전자현미경(SEM) 분석에서도 식물 기질 위에 대부분 막대 모양의 박테리아가 있음을 보여주었다32. 박테리아 (셀룰로 분해 균주 포함)는 전체 정원에서 분리되었지만, 정원의 오래된 부분과 폐기물 더미뿐만 아니라 창시자 여왕이 운반 한 초기 펠릿에서만 시각화되었습니다29,32. 또한 미생물총(microbiota)이 이들의 대사 능력(42)에 의해 제안되고 시험관 내에서 관찰된 바와 같이 생체내(즉, 정원 및 폐기물)에 생물막을 형성할 수 있는지 여부는 불확실했습니다 44.
여기에서 우리는 SEM을 사용하여 정원 지역 전반에 걸친 미생물군 공간 조직을 더 자세히 이해하고 미생물총-기질과 미생물군-균사 물리적 상호 작용을 자세히 설명했습니다. SEM은 초점 깊이가 더 큰 이미지를 제공함으로써 고해상도로 3차원 현미경 구조를 관찰할 수 있으므로 정원 미생물총(microbiota) 공간 패턴을 철저히 분석할 수 있습니다. 이러한 이질적이고 섬세한 곰팡이 기반 샘플을 고정, 탈수, 건조, 스퍼터 코팅 및 이미징하는 단계를 자세히 설명합니다. 사오스뮴 테트록사이드(OsO4)를 사용하여 후고정 단계를 제거하고 탈수 시간을 줄임으로써 SEM 분석을 위한 정원 및 폐기물 샘플을 준비하기 위한 프로토콜 32,33,45를 단순화했습니다. 이 적응된 프로토콜은 균사 구조 패턴과 미생물군 및 생물막 공간 조직을 보존하며 다른 섬세한 미생물 생태계 및 생물막에 적용할 수 있습니다.
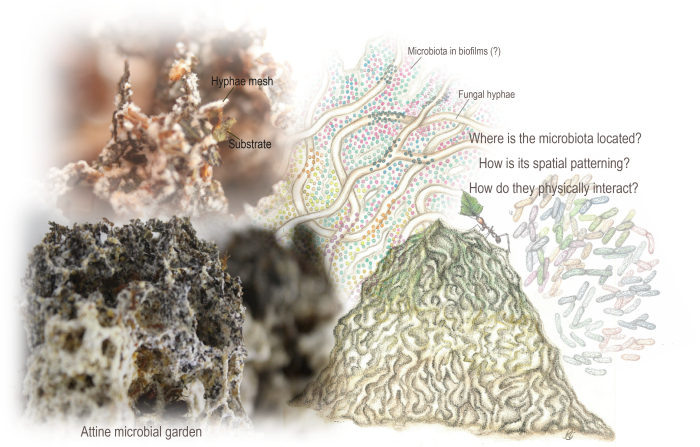
그림 1: Attine 미생물 정원. 정원은 개미가 통합한 대부분 식물 기반 기질을 대사하여 자라는 균사가 얽힌 그물망으로 인한 스펀지 같은 구조입니다. 또한 정원에 서식하는 미생물총(microbiota)은 곰팡이 대사를 보완할 수 있는 대사 경로를 암호화합니다. 균유전체학 데이터와 이전의 주사 전자 현미경 분석은 그 존재를 나타내었지만, 우리는 그것의 공간적 조직과 기질 및 곰팡이 균사와의 물리적 상호 작용에 대한 지식이 거의 없었습니다. 우리는 SEM을 사용하여 미생물총(microbiota)과 생물막의 공간 조직과 패터닝을 밝혔습니다. Mariana Barcoto의 삽화(Barcoto 및 Rodrigues 94에서 각색된 정원 및 미생물군), Mariana Barcoto 및 Enzo Sorrentino의 사진. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 샘플링 필드 식민지
참고: 개미 군집을 수집할 때는 수집하기 전에 현지 법률에서 요구하는 모든 허가를 받았음을 인증하십시오. 우리의 경우, 채취 허가증 #74585는 Instituto Chico Mendes de Conservação e Biodiversidade (ICMBio)에 의해 발급되었습니다. 샘플이 실험실 식민지에서 나오면 섹션 2로 이동합니다.
- 식민지를 찾아 표시합니다. 정원 챔버가 노출될 때까지 둥지 지역을 둘러싼 도랑을 굴착합니다(그림 2A).
참고: 일부 attine 종은 잎 쓰레기 아래 또는 썩은 통나무 내부에 식민지를 구축할 수 있습니다. 이러한 경우 쓰레기를 조심스럽게 회전시키거나 샘플을 수집하기 위해 통나무를 조심스럽게 부수십시오. 다양한 아틴 개미 종의 살아있는 군체를 찾고, 수집하고, 유지하는 것에 대한 자세한 정보는 Sosa-Calvo et al.46을 참조하십시오. - 흙이 정원 표면에 떨어지는 것을 방지하기 위해 정원 챔버를 옆으로 엽니다. 정원 크기에 따라 곤충 집게, 숟가락 또는 주방 스키머를 사용하여 정원 샘플을 조심스럽게 수집합니다.
알림: 수집하기 전에 도구를 소독하십시오. 잎을 자르는 개미의 정원을 채집할 때는 일개미에게 물리는 것을 방지(또는 최소한 약화)하기 위해 두꺼운 천 장갑을 착용하십시오. 다른 attine 종의 경우 패브릭 장갑은 선택 사항입니다. - 정원 샘플을 정원의 습도 균형을 맞추기 위해 석고 층이 들어있는 깨끗한 플라스틱 용기로 옮깁니다. 정원과 개미 일꾼을 옮긴 후 샘플 건조를 피하기 위해 수취인을 완전히 닫습니다. 정원 샘플은 처리할 때까지 23-25°C에서 보관하십시오.
- 이전에 제거한 흙으로 트렌치를 닫습니다.
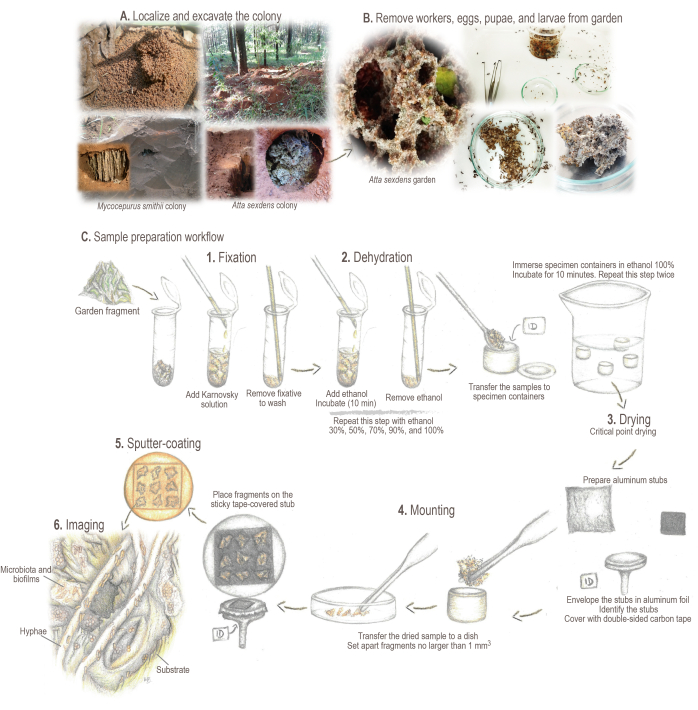
그림 2: 시료 전처리 프로토콜. (A) 들판 군집의 표본 추출. (B) 샘플 처리. (C) 시료 준비를 위한 간략한 기본 사항 및 작업 흐름: 1. 고정: 시료 구조를 강화하고 보존하기 위해. 2. 탈수함: 샘플의 수분 함량을 에탄올로 교환합니다. 3. 임계점 건조 : 액체 CO2 는 에탄올을 대체하고 증발합니다. 4. 장착 : 분석을 위해 표시된 샘플. 5. 금으로 스퍼터 코팅: 샘플 충전을 방지합니다. 6. 이미징. 삽화 및 사진: 마리아나 바르코토(Mariana Barcoto) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 시약
참고: 다음 솔루션을 미리 준비해야 합니다.
- 0.2M 카코딜레이트 나트륨 완충액을 준비합니다. 이를 위해 42.8g의 카코딜레이트 나트륨을 증류수 800mL에 용해시키고 용해 및 pH 안정화가 7.2가 될 때까지 저어줍니다(필요한 경우 염산을 사용하여 pH 조정). 증류수를 첨가하여 용액의 부피를 1L로 구성합니다. 용액을 4 °C에서 보관하십시오 (~ 1 개월 동안).
주의 : 글루타르알데히드와 파라포름알데히드는 독성이 있으므로 흄 후드 내에서 처리해야 합니다. 이러한 시약을 취급하는 동안 항상 니트릴 장갑과 보호 안경을 착용하십시오. - 카르노프스키의 고정제 준비(카르노프스키에서 수정됨)47. 이를 위해 0.2M 나트륨 카코딜레이트 완충액 25mL에 25% 글루타르알데히드 수용액 10mL와 20% 파라포름알데히드 수용액 10mL를 첨가하고 혼합합니다. 0.1M 염화칼슘(CaCl2) 1mL를 넣고 증류수를 넣어 100mL로 부피를 만듭니다. 용액을 4°C에서 보관하십시오(최대 1개월 동안).
주의 : Karnovsky의 고정액은 흡입 시 유해하며 피부와 눈에 자극을 유발할 수 있습니다. 따라서 증기 호흡을 피하고 실외 또는 환기가 잘 되는 곳에서만 사용하십시오. 용액을 취급할 때는 항상 니트릴 장갑과 보호 안경을 착용하십시오. - 절대 에탄올(분석 등급)을 사용하여 증류수에 30%, 50%, 70% 및 90% 에탄올 용액을 준비합니다. 100% 에탄올도 필요합니다.
3. 샘플 정착
참고: 정착제는 샘플을 경화시키고 보존하여 형태학적 특징을 유지합니다. 알데히드(예: 파라포름알데히드 및 글루타르알데히드)는 가교 유형의 비응고성 고정제로, 단백질과 핵산 내부 및 사이의 가교를 유도합니다48.
- 곤충학적 겸자를 사용하여 정원 샘플에서 일개미, 알, 번데기 및 유충을 제거합니다(그림 2B). 5mm 이하의 정원 조각을 분리하십시오3. 2mL 튜브에 절편을 추가합니다(그림 2C).
- 샘플이 들어있는 튜브에 파스퇴르 유리 피펫을 사용하여 ~ 1mL의 Karnovsky 고정 용액을 추가합니다 (샘플이 완전히 덮여 있는지 확인). 시료 처리를 계속하기 전에 최소 24시간 동안 시료를 4°C에서 담그고 배양할 수 있도록 부드러운 교반으로 혼합합니다(그림 2C.1).
참고: 고정 직후 다음 탈수 단계를 수행하지 않는 경우 이 단계에서 프로토콜을 일시 중지할 수 있으며 샘플은 4°C에서 ~1년 동안 보관할 수 있습니다.
파스퇴르 유리 피펫은 불활성 물질로 구성되어 있으며 나중에 재사용하기 위해 청소하기가 더 쉽기 때문에 사용하는 것이 좋습니다. 정원 재료는 소수성이 높으며 고착 용액의 표면 위에 떠 다니는 경향이 있습니다. 정착액에 완전히 담그는 데 일반적으로 최대 5분이 걸립니다. 고정제가 샘플의 모공으로 들어갈 때 부피가 줄어들기 때문에 정원 조각을 덮고 있는지 확인하십시오. 우리는 샘플을 담그고 적신 후 그 구성 요소(특히 섬세한 곰팡이 균사체)가 더 혼합되면 부서지기 쉽다는 것을 경험적으로 확인했습니다. 따라서 가능한 한 샘플을 흔드는 것은 피하는 것이 좋습니다.
4. 샘플 탈수
참고: 에탄올 세척 시리즈는 샘플의 물을 점차적으로 에탄올로 교환합니다. 이러한 섬세한 샘플이 과도하게 손상되거나 붕괴되는 것을 방지하기 위해 저농도 에탄올 용액(아래 참조)으로 시작하는 것이 중요합니다49.
- 유리 피펫을 사용하여 Karnovsky의 고정 용액을 완전히 제거하고 샘플이 방해받지 않도록 주의합니다(그림 2C.1).
참고: Karnovsky의 고정액은 독성 화학 물질 잔류물 관리를 위해 적절하게 표시된 수용액에 폐기하십시오. - 고정제를 제거한 직후 30% 에탄올 1mL를 첨가하고 시료를 방해하지 않도록 주의하고 실온에서 10분 동안 배양합니다(그림 2C.2).
참고: 샘플은 항상 용액에 담가야 합니다. 에탄올 점진적 세척 시리즈 동안 용액을 신속하게 교체하십시오. 정원이 다공성 측면을 잃고 튜브 바닥에서 응집됨에 따라 1mL의 에탄올은 샘플을 덮기에 충분한 경향이 있습니다(샘플이 5mm3보다 크지 않은 경우). 그러나 샘플이 완전히 덮이지 않은 경우 샘플이 완전히 덮일 때까지 에탄올을 첨가하십시오. - 유리 피펫으로 30% 에탄올을 완전히 제거하고 시료를 방해하지 않도록 주의합니다. 30% 에탄올은 적절하게 폐기하십시오.
참고: 전체 에탄올 점진적 세척 시리즈의 경우 독성 화학 물질 잔류물 관리를 위해 적절하게 라벨이 지정된 수용액에 에탄올을 폐기하십시오. - 50% 에탄올 1mL를 넣고 실온에서 10분 동안 배양합니다. 유리 피펫으로 50% 에탄올을 완전히 제거하고 샘플이 중단되지 않도록 주의하십시오. 50% 에탄올은 적절하게 폐기하십시오.
- 70% 에탄올 1mL를 넣고 실온에서 10분 동안 배양합니다. 유리 피펫으로 70% 에탄올을 완전히 제거하고 샘플이 방해받지 않도록 주의하십시오. 70% 에탄올은 적절하게 폐기하십시오.
참고: 70% 에탄올 세척 단계에서 사용자는 시료 튜브를 4°C에서 밤새 보관할 수 있으므로 필요한 경우 프로토콜을 일시 중지할 수 있습니다. 이때 재료가 즉시 처리되지 않습니다. - 90% 에탄올 1mL를 넣고 실온에서 10분 동안 배양합니다. 유리 피펫으로 90% 에탄올을 완전히 제거하고 샘플이 방해되지 않도록 주의하십시오. 90% 에탄올을 적절하게 폐기하십시오.
- 100% 에탄올 1mL를 넣고 실온에서 10분 동안 배양합니다. 유리 피펫으로 100% 에탄올을 완전히 제거하고 샘플이 방해받지 않도록 주의합니다. 100% 에탄올은 올바르게 폐기하십시오.
- 겸자 및/또는 주걱을 사용하여 검체 식별 라벨(이전에 종이와 연필로 제작)이 들어 있는 임계점 건조기(CPD)용 검체 용기에 검체를 조심스럽게 옮깁니다. 샘플 건조를 방지하기 위해 이 이송은 100% 에탄올로 덮인 페트리 접시에 담긴 용기로 수행됩니다.
- 용기에 뚜껑을 덮고 용기를 담글 수 있을 만큼 100% 에탄올이 함유된 눈금이 매겨진 유리 비커에 담그십시오. 유리 비커를 덮고 실온에서 10분 동안 배양합니다. 그런 다음 100% 에탄올을 적절하게 폐기하십시오.
- 표본 용기를 용기를 담글 수 있을 만큼 충분한 100% 에탄올이 들어 있는 다른 눈금이 매겨진 유리 비커로 옮깁니다. 유리 비커를 덮고 실온에서 10분 동안 배양합니다. 그런 다음 표본 용기를 임계점 건조기로 옮깁니다.
참고: 세척 시리즈 후에는 유리 피펫과 비커를 증류수로 충분히 헹궈야 하며, 이 잔류 물은 독성 화학 물질 잔류물 관리를 위해 적절하게 라벨이 부착된 수용액에 폐기해야 합니다. 헹굼 후 유리 제품은 중성 세제로 세척하고 수돗물로 헹구고 공기 건조할 수 있습니다.
5. 임계점 건조
참고: 임계점 건조기는 샘플의 에탄올을 더 높은 온도와 압력에서 샘플에서 증발하는 액체 이산화탄소(CO2)로 교환합니다. 이러한 절차에 대해서는 제조업체의 지침을 따르십시오.
- 장비를 켭니다.
- 챔버를 열고 샘플 용기를 내부에 놓고 용기를 덮을 때까지 100% 에탄올을 추가합니다. 챔버를 닫습니다.
- 냉각 옵션을 활성화하고 온도가 10°C에 도달할 때까지 기다립니다.
- CO2 실린더 밸브를 열고 교반기 옵션을 활성화합니다.
- CO2 in 옵션을 활성화하고 항상 챔버를 확인하여 얼마나 많은 CO2 가 이미 채워져 있는지 확인하십시오. 챔버가 거의 채워지면 CO2 in 옵션을 비활성화하고 교환 옵션을 활성화하여 용기를 덮을 수 있을 만큼 충분한 CO2가 될 때까지 활성 상태를 유지합니다. 용기가 항상 CO2로 덮여 있는지 확인하십시오(즉, 모든 CO2가 챔버를 떠나기 전에 Exchange 옵션을 비활성화). 5.5 단계 6x 반복하십시오.
- 마지막으로 CO2를 활성화하고 용기가 덮일 때까지 챔버를 채웁니다.
- Heat 옵션을 활성화하고 Stirrer 옵션을 비활성화합니다. CO2 실린더 밸브를 닫습니다.
- 온도가 35 ° C까지 올라갈 때까지 기다리십시오. 그런 다음 가스 출력 옵션을 활성화합니다.
참고: 약 30°C에서 챔버는 70-80bar의 압력에 도달하여 액체가 사라지는 임계점에 도달합니다. - 챔버 압력이 1bar에 도달하면 모든 가스 함량이 제거된 것입니다. 챔버를 열고 용기를 제거합니다.
- 장비의 전원을 끕니다.
6. 설치
- SEM 샘플 홀더(즉, 알루미늄 스터브; 그림 2C.4).
- 분석 후 스텁 청소를 용이하게 하기 위해 상단만 덮는 알루미늄 호일 조각으로 스텁을 감쌉니다.
- 홀더 바닥에 샘플 코드/번호를 작성하여 스텁을 식별하여 상단에 배치된 항목의 식별을 보장합니다.
- 양면 카본 테이프로 윗부분을 덮습니다. 스텁을 표본 홀더에 놓습니다.
- 검체 용기의 뚜껑을 열고 건조된 샘플을 집게와 주걱을 사용하여 유리 페트리 접시에 조심스럽게 옮깁니다.
참고: 임계 점으로 건조된 정원은 응집되는 경향이 있어 크기가 1mm,3인치보다 크지 않은 조각으로 조심스럽게 분리해야 하는 고도로 포장된 샘플을 형성합니다. - 테이프로 덮인 스텁의 끈적한 표면에 조각을 조심스럽게 놓습니다. 정원 조각이 테이프에 닿으면 (재)이동하기가 매우 어렵기 때문에 원치 않는 장소나 위치에 두지 않도록 주의하십시오. 스텁당 최대 9개의 프래그먼트를 추가합니다.
- 각 샘플에 대해 6.2단계와 6.3단계를 반복합니다.
7. 금을 가진 침을 튀기 코팅
알림: s를 코팅하십시오.amp충전을 방지하기 위해 필요합니다. 작동 가스 압력 (이 프로토콜에서 가스 압력의 0.5 × 10-1mm Hg), 스퍼터링 시간 (220초), 금층의 두께 (~120Å), 전류 (50mA) 및 전압 공급과 같은 설정을 조정하려면 제조업체의 지침을 따르십시오. 스퍼터링은 일반적인 워크플로를 따르는 경향이 있지만 제조업체마다 장비가 약간 다르게 작동할 수 있습니다.
- 힌지가 달린 타겟 암을 열고 시편 테이블에 스텁을 놓습니다.
- 힌지가 있는 타겟 암을 닫고 유리 진공 챔버의 파편 실드가 제대로 삽입되었는지 확인합니다.
- 아르곤 실린더 밸브를 열고 주 전원 스위치를 켭니다.
- 디스플레이의 0.5 × 10-1mm Hg 표시에 도달할 때까지 장비 디스플레이에서 상승하는 진공을 따릅니다. 그런 다음 헹굼을 활성화하십시오. 작업을 5회 반복합니다.
- 물 순환 시스템을 켜고 HV 켜기 옵션을 활성화한 다음 금 필름 덮개를 엽니다. 플라즈마 색상이 분홍빛이 도는 지 확인합니다. 이 프로토콜을 따르려면 50mA 전압으로 220초의 스퍼터링을 설정하면 ~120Å(12nm)의 금 층이 증착됩니다.
- HV 켜기 는 자동으로 꺼집니다. 물 순환 시스템을 끄고 금박 뚜껑을 닫습니다.
- 주 전원 스위치를 꺼서 공기가 진공 챔버로 들어갈 수 있도록 합니다. 정원 및 폐기물 샘플의 경우 7.1-7.7 3x 단계를 반복합니다.
참고: 샘플 준비 직후 이미징이 발생하지 않는 경우, 샘플이 재수화되지 않도록 실리카 층으로 채워진 밀폐 용기에 스텁을 보관하십시오.
8. 이미징
알림: 대물렌즈 조리개 직경, 작동 볼륨과 같은 SEM 설정 조정에 대한 제조업체의 지침을 따르십시오.tage, 전자빔 시스템의 정렬, 축 정렬 및 스티그메이터.
- 샘플 홀더에 스텁을 놓고 각 샘플의 위치를 메모합니다.
알림: 샘플 홀더를 삽입하거나 제거할 때 장갑을 착용하고 홀더를 가능한 한 깨끗하게 유지하십시오. - 바탕 화면에서 작동 소프트웨어를 실행합니다.
- 측량기 설정을 선택합니다. 30 μm의 대물렌즈 조리개 직경(즉, 두 번째 단계)으로 정원 샘플을 시각화하고, 고진공 상태에서 작동하고, 2차 전자(SED)의 신호를 감지하고, 20kV의 가속 전압, 15 - 20mm의 작동 거리, 40.0의 프로브 전류(고전류 모드에서) 및 샘플에 따라 배율을 변경합니다.
- 탐색 지침에 따라 Vent 아이콘을 누르고 표본 챔버가 환기될 때까지 기다립니다. 진행률 표시줄은 진공 상태를 나타냅니다.
- 대기압에 도달하면 시편 챔버를 열고 샘플 홀더를 조심스럽게 삽입합니다.
- 챔버 도어를 부드럽게 닫고 Evac 아이콘을 눌러 진행 표시줄을 통해 진공 상태를 따라 기기를 비웁니다. 내비게이션 시스템은 이동 스테이지 위치를 표시하고 이동이 완료되면 홀더 그래프를 제공합니다. 카메라 아이콘을 눌러 홀더의 사진을 기록하면 이미징하는 동안 샘플 사이를 탐색하는 데 도움이 되는 상단 보기를 얻을 수 있습니다.
- 관찰 아이콘을 눌러 전자총을 켜고 이미지가 형성될 때까지 기다립니다. Manual User Interface(수동 제어)를 사용하여 Z축을 적절한 높이(샘플 높이 및 결정된 작업 거리에 따라)로 수동으로 이동합니다.
알림: 텅스텐 필라멘트 수명을 연장하려면 이미징이 활발하지 않을 때마다 관찰 기능을 일시 중지하십시오. - 화면에 표시된 옵션 또는 수동 컨트롤을 사용하여 래스터 속도와 이미지 위치를 변경합니다. 스테이지를 이동하여 샘플을 자세히 보고 RDC 기능을 사용하여 특정 영역에 초점을 맞춥니다. 대상(또는 흥미로운) 구조를 관찰할 때 그에 따라 배율, 초점, 밝기, 대비 및 암술을 조정하십시오. Manual User Interface(수동 사용자 인터페이스 )를 사용하여 스테이지를 X 및 Y 방향으로 이동하여 스티gmation을 수정합니다.
- 배율을 100x에서 700x 사이로 조정하여 일반적인 정원 측면(예: 균사 밀도, 기질 및 군집 패턴)을 시각화합니다.
- 배율을 700배에서 1,500배 사이로 조정하여 미생물총(microbiota) 공간 패턴을 시각화합니다.
- 배율을 1,500배에서 3,000배 사이로 조정하여 미생물총(microbiota)과 생물막의 물리적 상호 작용을 관찰합니다.
- 배율을 3,000배에서 4,000배 사이로 조정하여 특정 미생물 클러스터에 초점을 맞춥니다.
- 이미지를 저장하려면 고정 기능을 사용하고 사진 아이콘을 클릭한 다음 파일 경로를 설정합니다. 표준으로, 8.8단계에서 언급한 모든 배율 범위에서 각각을 이미징하여 최소 3개의 정원 조각을 분석합니다. 이로 인해 샘플당 최소 12개의 이미지가 생성되지만 더 많은 이미지가 더 자세한 설명을 지원할 수 있습니다. 8.8단계의 모든 배율을 범위로 하는 샘플당 15-25개의 이미지가 샘플 설명을 위한 세부 정보를 제공하는 경향이 있는 것이 좋습니다.
참고: 이미지를 래스터링하고 저장하는 데 몇 초가 걸리며, 그 동안 SEM 부동 테이블의 진동을 피해야 합니다. - 이미징을 마친 후 Vent 옵션을 눌러 진행률 표시줄을 통해 진공 상태에 따라 챔버를 환기시킵니다. 홀더를 조심스럽게 제거하고 챔버 도어를 부드럽게 닫은 다음 Evac 를 눌러 챔버에서 대피합니다.
- 대피가 완료되는 즉시 작동 소프트웨어를 종료하십시오.
- 밝기와 대비를 조정하여 이미지 편집기를 사용하여 시각화를 개선합니다.
결과
여기에서는 곰팡이 균사, 기질, 미생물군 및 생물막과 같은 attine 정원 및 폐기물 샘플의 구성 요소를 시각화하기 위한 단순화된 프로토콜을 제시했습니다. SEM은 정원과 폐기물이 미생물총(microbiota) 구조 패턴을 어떻게 비계로 삼는지에 대한 이해를 높였습니다(그림 3). attine 정원에서 곰팡이 균사는 기질 표면의 일부를 덮고있는 가지 모양의 구조입?...
토론
SEM은 전자빔을 사용하여 샘플을 스캔하고 고해상도로 3차원 미세 구조를 시각화할 수 있도록 확대된 이미지를 생성합니다. SEM은 고진공 상태에서 작동하기 때문에 시료에서 최대 99% 이상의 수분을 제거해야 합니다. SEM 진공 챔버 내부에서는 부분적으로 수화된 샘플이 탈수되어 붕괴될 수 있으며 전자가 산란될 수 있습니다. SEM에서 고해상도 이미징을 위해 샘플 준비에는...
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
저자는 재정적 지원(보조금 #2019/03746-0)을 제공한 Fundação de Amparo à Pesquisa do Estado de São Paulo(FAPESP)에 감사드립니다. FAPESP(프로세스 2021/08013-0) 및 Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brazil(CAPES) - 재무 코드 001에서 받은 박사 학위 장학금에 대한 MOB에 감사드립니다. AR은 또한 연구 펠로우십(#305269/2018)에 대해 Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq)에 감사드립니다. 저자는 샘플 준비를 위한 파일럿 테스트를 도와준 Marcia Regina de Moura Aouada와 Antonio Teruyoshi Yabuki, 기술 지원을 제공한 Renato Barbosa Salaroli, 사진 촬영을 도와준 Enzo Sorrentino에게 감사를 표합니다. 본 연구는 유전자유산 접근 허가 # SISGen AA39A6D 하에 수행되었다.
자료
| Name | Company | Catalog Number | Comments |
| 2 mL tube | Axygen | MCT-200-C-BRA | To fix and dehydrate samples |
| Calcium chloride anhydrous | Merck | C4901 | CaCl2 anhydrous to prepare Karnovsky’s fixative |
| Critical point dryer | Leica | EM CPD 300 | For critical point drying |
| Double Sided Carbon Conductive Tape, 12 mm (W) X 5 M (L) | Electron Microscopy Sciences | 77819-12 | For mounting samples |
| Entomological forceps | No specific supplier | To manipulate garden samples | |
| Ethyl alcohol (=ethanol), pure (≥99.5%) | Sigma-Aldrich | 459836 | For dehydration |
| Forceps | No specific supplier | To manipulate garden samples | |
| Glass beaker | No specific supplier | For dehydration | |
| Glass Petri dish | No specific supplier | To manipulate garden samples | |
| Glass pipette | No specific supplier | To fix and dehydrate samples | |
| Glutaraldehyde (Aqueous Glutaraldehyde EM Grade 25%) | Electron Microscopy Sciences | 16220 | To prepare Karnovsky’s fixative |
| Gold target | Ted Pella, Inc. | 8071 | To sputter coat with gold |
| Hydrochloric acid | Sigma-Aldrich | 320331 | For adjusting solutions pH |
| Image editor | Photoshop | any version | To adjust images |
| Paraformaldehyde (Paraformaldehyde 20% Aqueous Solution EM Grade) | Electron Microscopy Sciences | 15713 | To prepare Karnovsky’s fixative |
| Propilene recipient | No specific supplier | For maintaining alive ant colonies | |
| Scanning Electron Microscope | JEOL | IT300 SEM | For sample imaging |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | For preparing sodium cacodylate buffer |
| Spatula | No specific supplier | To manipulate garden samples | |
| Specimen containers with 15 mm dia. x 10 mm high | Ted Pella, Inc. | 4591 | For critical point drying |
| Sputter coater | Baltec | SCD 050 | To coat with gold |
| Stub (Aluminium mount, flat end pin) 12.7 mm x 8 mm | Electron Microscopy Sciences | 75520 | For mounting samples |
참고문헌
- Turner, M. G. Landscape ecology: the effect of pattern on process. Annu Rev Ecol Evol Syst. 20 (1), 171-197 (1989).
- Rietkerk, M., Van de Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Schmitz, O. J. Spatial dynamics and ecosystem functioning. PLOS Biol. 8 (5), e1000378 (2010).
- Pringle, R. M., Doak, D. F., Brody, A. K., Jocqué, R., Palmer, T. M. Spatial pattern enhances ecosystem functioning in an African savanna. PLOS Biol. 8 (5), e1000377 (2010).
- Wimpenny, J. W. Spatial order in microbial ecosystems. Biol Rev. 56 (3), 295-342 (1981).
- Martiny, J. B. H., et al. Microbial biogeography: putting microorganisms on the map. Nat Rev. Microbiol. 4 (2), 102-112 (2006).
- McCallum, G., Tropini, C. The gut microbiota and its biogeography. Nat Rev Microbiol. 22 (2), 105-118 (2024).
- Lamont, R. J., Hajishengallis, G., Koo, H. Social networking at the microbiome-host interface. Infec Immun. 91 (9), e00124-e00223 (2023).
- Welch, J. L. M., Rossetti, B. J., Rieken, C. W., Dewhirst, F. E., Borisy, G. G. Biogeography of a human oral microbiome at the micron scale. Proc Natl Acad Sci USA. 113 (6), E791-E800 (2016).
- Kim, D., et al. Spatial mapping of polymicrobial communities reveals a precise biogeography associated with human dental caries. Proc Natl Acad Sci USA. 117 (22), 12375-12386 (2020).
- Swidsinski, A., Weber, J., Loening-Baucke, V., Hale, L. P., Lochs, H. Spatial organization and composition of the mucosal flora in patients with inflammatory bowel disease. J Clin Microbiol. 43 (7), 3380-3389 (2005).
- Ibberson, C. B., Barraza, J. P., Holmes, A. L., Cao, P., Whiteley, M. Precise spatial structure impacts antimicrobial susceptibility of S. aureus in polymicrobial wound infections. Proc Natl Acad Sci USA. 119 (51), e2212340119 (2022).
- Azimi, S., Lewin, G. R., Whiteley, M. The biogeography of infection revisited. Nat Rev Microbiol. 20 (10), 579-592 (2022).
- Dejea, C. M., et al. Microbiota organization is a distinct feature of proximal colorectal cancers. Proc Natl Acad Sci USA. 111 (51), 18321-18326 (2014).
- Hanson, C. A., Fuhrman, J. A., Horner-Devine, M. C., Martiny, J. B. Beyond biogeographic patterns: processes shaping the microbial landscape. Nat Rev Microbiol. 10 (7), 497-506 (2012).
- Adade, E. E., Al Lakhen, K., Lemus, A. A., Valm, A. M. Recent progress in analyzing the spatial structure of the human microbiome: Distinguishing biogeography and architecture in the oral and gut communities. Curr Opin Endocr. 18, 275-283 (2021).
- Mony, C., Bohannan, B. J., Leibold, M. A., Peay, K., Vandenkoornhuyse, P. Microbial landscape ecology: Highlights on the invisible corridors. Front Ecol Evol. 9, 753213 (2021).
- Hölldobler, B., Wilson, E. O. . The Ants. , (1990).
- Chapela, I. H., Rehner, S. A., Schultz, T. R., Mueller, U. G. Evolutionary history of the symbiosis between fungus-growing ants and their fungi. Science. 266 (5191), 1691-1694 (1994).
- Mueller, U. G., Rehner, S. A., Schultz, T. R. The evolution of agriculture in ants. Science. 281 (5385), 2034-2038 (1998).
- Mueller, U. G., Gerardo, N. M., Aanen, D. K., Six, D. L., Schultz, T. R. The evolution of agriculture in insects. Annu Rev Ecol Evol Syst. 36, 563-595 (2005).
- Dentinger, B. T., Lodge, D. J., Munkacsi, A. B., Desjardin, D. E., McLaughlin, D. J. Phylogenetic placement of an unusual coral mushroom challenges the classic hypothesis of strict coevolution in the Apterostigma pilosum group ant-fungus mutualism. Evolution. 63 (8), 2172-2178 (2009).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proc Natl Acad Sci USA. 105, 5435-5440 (2008).
- de Fine Licht, H. H., Boomsma, J. J. Forage collection, substrate preparation, and diet composition in fungus-growing ants. Ecol Entomol. 35 (3), 259-269 (2010).
- Martin, M. M. The biochemical basis of the fungus-attine ant symbiosis: A complex symbiosis is based upon integration of the carbon and nitrogen metabolisms of the two organisms. Science. 169 (3940), 16-20 (1970).
- Grell, M. N., et al. The fungal symbiont of Acromyrmex leaf-cutting ants expresses the full spectrum of genes to degrade cellulose and other plant cell wall polysaccharides. BMC Genomics. 14, 928 (2013).
- Lange, L., Grell, M. N. The prominent role of fungi and fungal enzymes in the ant-fungus biomass conversion symbiosis. Appl Microbiol Biotechnol. 98, 4839-4851 (2014).
- Huang, E. L., et al. The fungus gardens of leaf-cutter ants undergo a distinct physiological transition during biomass degradation. Environ Microbiol Rep. 6 (4), 389-395 (2014).
- Craven, S. E., Dix, M. W., Michaels, G. E. Attine fungus gardens contain yeasts. Science. 169 (3941), 184-186 (1970).
- De Fine Licht, H. H., Boomsma, J. J., Tunlid, A. Symbiotic adaptations in the fungal cultivar of leaf-cutting ants. Nat Commun. 5 (1), 5675 (2014).
- Aylward, F. O., et al. Enrichment and broad representation of plant biomass-degrading enzymes in the specialized hyphal swellings of Leucoagaricus gongylophorus, the fungal symbiont of leaf-cutter ants. PLoS One. 10 (8), e0134752 (2015).
- Moreira-Soto, R. D., Sanchez, E., Currie, C. R., Pinto-Tomás, A. A. Ultrastructural and microbial analyses of cellulose degradation in leaf-cutter ant colonies. Microbiology. 163 (11), 1578-1589 (2017).
- Erthal Jr, M., Silva, C. P., Cooper, R. M., Samuels, R. I. Hydrolytic enzymes of leaf-cutting ant fungi. Comp Biochem. 152 (1), 54-59 (2009).
- North, R. D., Jackson, C. W., Howse, P. E. Communication between the fungus garden and workers of the leaf-cutting ant, Atta sexdens rubropilosa, regarding choice of substrate for the fungus. Physiol Entomol. 24 (2), 127-133 (1999).
- Herz, H., Hölldobler, B., Roces, F. Delayed rejection in a leaf-cutting ant after foraging on plants unsuitable for the symbiotic fungus. Behav Ecol. 19 (3), 575-582 (2008).
- Schiøtt, M., De Fine Licht, H. H., Lange, L., Boomsma, J. J. Towards a molecular understanding of symbiont function: identification of a fungal gene for the degradation of xylan in the fungus gardens of leaf-cutting ants. BMC Microbiol. 8, 40 (2008).
- Bot, A. N., Currie, C. R., Hart, A. G., Boomsma, J. J. Waste management in leaf-cutting ants. Ethol Ecol Evol. 13 (3), 225-237 (2001).
- Scott, J. J., et al. Microbial community structure of leaf-cutter ant fungus gardens and refuse dumps. PLOS One. 5 (3), e9922 (2010).
- Lewin, G. R., et al. Cellulose-enriched microbial communities from leaf-cutter ant (Atta colombica) refuse dumps vary in taxonomic composition and degradation ability. PLOS One. 11 (3), e0151840 (2016).
- Suen, G., et al. An insect herbivore microbiome with high plant biomass-degrading capacity. PLOS Genet. 6 (9), e1001129 (2010).
- Aylward, F. O., et al. Convergent bacterial microbiotas in the fungal agricultural systems of insects. MBio. 5 (6), e02077 (2014).
- Barcoto, M. O., et al. Fungus-growing insects host a distinctive microbiota apparently adapted to the fungiculture environment. Sci Rep. 10 (1), 12384 (2020).
- Francoeur, C. B., et al. Bacteria contribute to plant secondary compound degradation in a generalist herbivore system. mBio. 11, e02146-e02220 (2020).
- Martiarena, M. J. S., Deveau, A., Montoya, Q. V., Flórez, L. V., Rodrigues, A. The hyphosphere of leaf-cutting ant cultivars is enriched with helper bacteria. Microb Ecol. 86 (3), 1773-1788 (2023).
- Leal-Dutra, C. A., et al. Evidence that the domesticated fungus Leucoagaricus gongylophorus recycles its cytoplasmic contents as nutritional rewards to feed its leafcutter ant farmers. IMA Fungus. 14 (1), 19 (2023).
- Sosa-Calvo, J., Jesovnik, A., Okonski, E., Schultz, T. R. Locating, collecting, and maintaining colonies of fungus-farming ants (Hymenoptera: Myrmicinae: Attini). Sociobiology. 62 (2), 300-320 (2015).
- Karnovsky, M. J. A formaldehyde glutaraldehyde fixative of high osmolality for use in electron microscopy. J Cell Biol. 27, 137-138 (1965).
- Eltoum, I., Fredenburgh, J., Myers, R. B., Grizzle, W. E. Introduction to the theory and practice of fixation of tissues. J Histotechnol. 24 (3), 173-190 (2001).
- Gusnard, D., Kirschner, R. H. Cell and organelle shrinkage during preparation for scanning electron microscopy: effects of fixation, dehydration and critical point drying. J Microsc. 110 (1), 51-57 (1977).
- Surman, S. B., et al. Comparison of microscope techniques for the examination of biofilms. J Microbiol Methods. 25 (1), 57-70 (1996).
- Augustin, J. O., et al. Yet more "weeds" in the garden: fungal novelties from nests of leaf-cutting ants. PLOS One. 8 (12), e82265 (2013).
- Montoya, Q. V., Martiarena, M. J. S., Polezel, D. A., Rodrigues, A. More pieces to a huge puzzle: Two new Escovopsis species from fungus gardens of attine ants. MycoKeys. 46, 97 (2019).
- Varanda-Haifig, S. S., et al. Nature of the interactions between hypocrealean fungi and the mutualistic fungus of leaf-cutter ants. Antonie van Leeuwenhoek. 110, 593-605 (2017).
- Custodio, B. C., Rodrigues, A. Escovopsis kreiselii specialization to its native hosts in the fungiculture of the lower attine ant Mycetophylax morschi. Antonie van Leeuwenhoek. 112, 305-317 (2019).
- Schröttner, H., Schmied, M., Scherer, S. Comparison of 3D surface reconstruction data from certified depth standards obtained by SEM and an Infinite Focus Measurement Machine (IFM). Microchim Acta. 155, 279-284 (2006).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D., Zhou, W., Wang, Z. L. Fundamentals of scanning electron microscopy (SEM). Scanning microscopy for nanotechnology: Techniques and applications. , 1-40 (2007).
- Kannan, M., Raja, K., Subramanian, K. S., Kannan, M. Scanning electron microscopy: Principle, components and applications. A Textbook on Fundamentals and Applications of Nanotechnology. , 81-92 (2018).
- Ruffolo, J. J. Critical point drying of protozoan cells and other biological specimens for scanning electron microscopy: apparatus and methods of specimen preparation. Trans Am Microsc. 93 (1), 124-131 (1974).
- Echlin, P. Recent advances in specimen coating techniques for electron microscopy. Scanning Electron Microscopy 1981/1. , 79-90 (1981).
- Ris, H. The cytoplasmic filament system in critical point-dried whole mounts and plastic-embedded sections. J Cell Biol. 100 (5), 1474-1487 (1985).
- Bray, D. F., Bagu, J., Koegler, P. Comparison of hexamethyldisilazane (HMDS), Peldri II, and critical-point drying methods for scanning electron microscopy of biological specimens. Microsc Res Tech. 26 (6), 489-495 (1993).
- Bergmans, L., Moisiadis, P., Van Meerbeek, B., Quirynen, M., Lambrechts, P. Microscopic observation of bacteria: review highlighting the use of environmental SEM. Int Endod J. 38 (11), 775-788 (2005).
- Kirk, S. E., Skepper, J. N., Donald, A. M. Application of environmental scanning electron microscopy to determine biological surface structure. J Microsc. 233 (2), 205-224 (2009).
- Kemmenoe, B. H., Bullock, G. R. Structure analysis of sputter-coated and ion-beam sputter-coated films: a comparative study. J Microsc. 132 (2), 153-163 (1983).
- Kinden, D. A., Brown, M. F. Technique for scanning electron microscopy of fungal structures within plant cells. Phytopathology. 65, 74-76 (1975).
- Masaphy, S., Levanon, D., Tchelet, R., Henis, Y. Scanning electron microscope studies of interactions between Agaricus bisporus (Lang) Sing hyphae and bacteria in casing soil. Appl Environ Microbiol. 53 (5), 1132-1137 (1987).
- Massicotte, H. B., Melville, L. H., Peterson, R. L. Scanning electron microscopy of ectomycorrhizae potential and limitations. Scanning Microsc. 1 (3), 58 (1987).
- Visen, A., Singh, P. N., Chakraborty, B., Singh, A., Bisht, T. S. Scanning electron microscopy indicates Pseudomonad strains facilitate AMF mycorrhization in litchi (Litchi chinensis Sonn.) air-layers and improving survivability, growth and leaf nutrient status. Curr Res Microb Sci. 2, 100063 (2021).
- Fleeman, R. M., Mikesh, M., Davies, B. W. Investigating Klebsiella pneumoniae biofilm preservation for scanning electron microscopy. Access Microbiol. 5 (2), 000470-000473 (2023).
- Wells, M., Mikesh, M., Gordon, V. Structure-preserving fixation allows scanning electron microscopy to reveal biofilm microstructure and interactions with immune cells. J Microsc. 293 (1), 59-68 (2024).
- Nadell, C. D., Drescher, K., Foster, K. R. Spatial structure, cooperation and competition in biofilms. Nat Rev Microbiol. 14 (9), 589-600 (2016).
- Madsen, J. S., et al. Coexistence facilitates interspecific biofilm formation in complex microbial communities. Environ Microbiol. 18 (8), 2565-2574 (2016).
- Madsen, J. S., Sørensen, S. J., Burmølle, M. Bacterial social interactions and the emergence of community-intrinsic properties. Curr Opin Microbiol. 42, 104-109 (2018).
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nat Rev Microbiol. 17 (4), 247-260 (2019).
- Bringhurst, B., Allert, M., Greenwold, M., Kellner, K., Seal, J. N. Environments and hosts structure the bacterial microbiomes of fungus-gardening ants and their symbiotic fungus gardens. Microb Ecol. 86 (2), 1374-1392 (2023).
- Bringhurst, B., Greenwold, M., Kellner, K., Seal, J. N. Symbiosis, dysbiosis and the impact of horizontal exchange on bacterial microbiomes in higher fungus-gardening ants. Sci Rep. 14 (1), 3231 (2024).
- Vargas, S., et al. Body-plan reorganization in a sponge correlates with microbiome change. Mol Biol Evol. 40 (6), msad138 (2023).
- Apprill, A., et al. Humpback whale populations share a core skin bacterial community: towards a health index for marine mammals. PLOS One. 9 (3), e90785 (2014).
- Fraune, S., et al. Bacteria-bacteria interactions within the microbiota of the ancestral metazoan Hydra contribute to fungal resistance. ISME J. 9 (7), 1543-1556 (2015).
- Gowen, R., Gamal, A., Di Martino, L., McCormick, T. S., Ghannoum, M. A. Modulating the microbiome for Crohn's disease treatment. Gastroenterology. 164 (5), 828-840 (2023).
- Moya, P., et al. Molecular phylogeny and ultrastructure of the lichen microalga Asterochloris mediterranea sp. nov. from Mediterranean and Canary Islands ecosystems. Int J Syst Evol Microbiol. 65 (6), 1838-1854 (2015).
- Zettler, E. R., Mincer, T. J., Amaral-Zettler, L. A. Life in the "plastisphere": microbial communities on plastic marine debris. Environ Sci Technol. 47 (13), 7137-7146 (2013).
- Porter, K. R., Kallman, F. The properties and effects of osmium tetroxide as a tissue fixative with special reference to its use for electron microscopy. Exp Cell Res. 4 (1), 127-141 (1953).
- Ligon, J. J., Abraham, J. L., Boyd, A. S. Traumatic osmium tetroxide inoculation. J Am Acad Dermatol. 45 (6), 949-952 (2001).
- Friedova, N., et al. Osmium absorption after osmium tetroxide skin and eye exposure. Basic Clin Pharmacol Toxicol. 127 (5), 429-433 (2020).
- Fratesi, S. E., Lynch, F. L., Kirkland, B. L., Brown, L. R. Effects of SEM preparation techniques on the appearance of bacteria and biofilms in the Carter Sandstone. J Sediment. 74 (6), 858-867 (2004).
- Dassanayake, R. P., et al. Identification of a reliable fixative solution to preserve the complex architecture of bacterial biofilms for scanning electron microscopy evaluation. PLOS One. 15 (5), e0233973 (2020).
- Desiro, A., et al. Detection of a novel intracellular microbiome hosted in arbuscular mycorrhizal fungi. ISME J. 8 (2), 257-270 (2014).
- Morales, D. P., et al. Advances and challenges in fluorescence in situ hybridization for visualizing fungal endobacteria. Front Microbiol. 13, 892227 (2022).
- Shi, H., et al. Highly multiplexed spatial mapping of microbial communities. Nature. 588 (7839), 676-681 (2020).
- Valm, A. M., Welch, J. L. M., Borisy, G. G. CLASI-FISH: principles of combinatorial labeling and spectral imaging. Syst Appl Microbiol. 35 (8), 496-502 (2012).
- Fernandez-Brime, S., Muggia, L., Maier, S., Grube, M., Wedin, M. Bacterial communities in an optional lichen symbiosis are determined by substrate, not algal photobionts. FEMS Microbiol Ecol. 95 (3), fiz012 (2019).
- Schluter, S., Eickhorst, T., Mueller, C. W. Correlative imaging reveals holistic view of soil microenvironments. Environ Sci Technol. 53 (2), 829-837 (2018).
- Barcoto, M. O., Rodrigues, A. Lessons from insect fungiculture: from microbial ecology to plastics degradation. Front Microbiol. 13, 812143 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유