このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
Attine Ants' Gardensの微生物叢:走査型電子顕微鏡による微生物の風景の可視化
要約
私たちは、植物や真菌のバイオマスを含む非常に不均一で繊細なサンプルを、微生物叢やバイオフィルムとともに視覚化するための最適化された走査型電子顕微鏡プロトコルを提案します。このプロトコルにより、微生物叢組織の空間的次元を記述できます。
要約
熱帯雨林やサンゴ礁などのマクロスケールの生態系では、生物の空間的局在化がコミュニティ生態学の理解の基礎となっています。同様に、微生物の世界では、ミクロスケールの生態系は、生物と生息地のランダムで均質な混合物とはほど遠いものです。微生物の空間分布にアクセスすることは、微生物叢の機能と生態を理解するための基本であり、同棲する種は相互作用し、互いの生理機能に影響を与える可能性が高いためです。
王国間の微生物生態系は、菌類を育てるアリのコロニーの中核であり、栄養資源として担子菌類を培養しています。アッティネアリは、多様な基質(主に植物性)を探し、培養された真菌によって代謝され、海綿状の構造、つまり外部の腸として機能する「微生物の庭」を形成します。庭は、基質を代謝することによって成長する真菌菌糸の絡み合ったメッシュであり、特徴的で適応した微生物叢を確立するためのニッチを開きます。この微生物叢は、基質の分解と真菌の増殖に寄与していると考えられていますが、その空間構成はまだ決定されていません。
ここでは、走査型電子顕微鏡(SEM)を使用して、真菌を増殖させるアリのさまざまな菌類培養システムにわたる微生物叢とバイオフィルムの空間構成をこれまでにない詳細さで調査する方法について説明します。SEMイメージングは、微生物叢の空間構造と組織の説明を提供しました。SEMは、微生物叢が一般的にバイオフィルムに集合し、菌類培養における微生物ランドスケープの広範な構造であることを明らかにしました。このような複雑なコミュニティの固定、脱水、乾燥、スパッタコーティング、およびイメージ化に使用されるプロトコルを紹介します。これらのプロトコルは、植物や真菌のバイオマス、微生物叢、バイオフィルムなど、繊細で不均一なサンプルを扱うように最適化されています。
概要
生態系は、特定の地理的位置(つまり、環境)のプロセスによって相互接続された生物で構成されています。生物は時間の経過とともに環境と相互作用し、そこから複雑で不均一な空間パターンが出現します。空間パターニングは、生態学的な多様性と安定性を決定し、最終的には生態系の機能を決定します1,2,3,4。湿地、サバンナ、サンゴ礁、乾燥生態系などのマクロスケールの生態系では、空間パターンは資源の流れと集中と相関しています。資源の最適化、空間的な不均一性、パターニングを可能にすると、均質な生態系よりも回復力のある生態系が実現します2。生物の空間的局在化が群集生態学の基礎にあることは、微生物の世界にも翻訳されます。
微生物生態系は、微小生息地全体にランダムかつ均一に混合された生物から遠く離れており、その機能の多くを定義する空間パターンを示しています5,6,7。ウィノグラードスキーのカラムから環境および宿主に関連する微生物叢まで、これらの生態系は空間的に不均一に組織化されており、空間的な配置によって異なる表現型の応答が引き起こされます。同棲している種は、相互作用し、互いの生理機能に影響を与える可能性が高くなります。したがって、コミュニティの空間構成は、その構成自体以上に、生態系の特性と生態学的ニッチを区切っています5,7,8。これらの概念を説明すると、空間パターンの変化は、歯垢、虫歯、歯周病9,10、炎症性腸疾患11、嚢胞性肺感染症、慢性創傷感染症12,13、結腸直腸癌、および腺腫14の病理学的進行と相関しているように思われる。
微生物生物地理学(ミクロスケールでの空間と時間にわたる生物多様性の分布とパターン化の研究)の範囲の下で、微生物生態系の知識は、その空間パターンを理解することによって大いに恩恵を受ける6,13,15,16,17。私たちは、カリスマ的な菌類を育てるアッティネアリ(膜翅目:Formicidae:Myrmicinae:Attini:Attina)のコロニーの中心に見られる、昆虫が構築した微生物生態系の空間パターンを調べました。Leucocoprinae(Basidiomycota:Agaricaceae)またはPterulaceae科(Basidiomycota:Agaricales)18,19,20,21,22の担子菌を中心とした「微生物の庭」があります。庭は、アリが取り込む主に植物ベースの基質を代謝することによって成長する菌糸の絡み合ったメッシュから出現する海綿状の構造です(図1)。これらには、アティーネ属によれば、乾燥した植物の部分、昆虫の破片と死体、切りたての葉、種子、花の部分が含まれます23,24。外部の草食性の腸に類似して、庭は酵素的および化学的に難治性のポリマーを不安定な栄養資源に変換し、アリに必須アミノ酸、脂質、および可溶性糖を提供します21,25,26,27,28。
葉を刈るAtta属とAcromyrmex属の庭で実施された超微細構造、酵素、およびトランスクリプトーム分析は、これらの環境が基質分解と栄養パッチ26,29,30,31,32の連続体を構造化していることを示唆しています。庭の若い部分は、断片化された後に新しく組み込まれた基質のために暗くなる傾向があります。これらの最近追加された基質は、多くの場合、アリの働きアリの働き者によって切断され、菌糸体の塊が接種された端からコロニーを形成します。切断された端から放射状に広がる真菌菌糸は、基質29,32,33上に広がった。菌糸の存在量は、基質の分解が進行するにつれて増加し、白っぽく代謝活性な領域30,31,32をもたらす。より劣化した基質と豊富な微生物叢29,32を持つ古い地域は、茶色がかった色調とより高い湿度を示す傾向があります。労働者はこの領域の断片を取り除き、それらを廃棄物の山に分離し、そこで真菌共生生物34,35,36に害を及ぼす基質も取ります。廃棄物の山は、庭から物理的に切り離されていますが、豊富な微生物叢29,32,37,38,39による継続的な基質分解と栄養素循環のスポットです。
エンテロバクター、クレブシエラ、パントエア、シュードモナス、セラティアを主成分とする微生物叢も園内に生息しており、多様な菌類養殖システムと共有されているようです。真菌代謝を補完する可能性のある代謝経路をコードする微生物叢は、庭の生理学的応答40,41,42,43,44に関与している可能性があります。メタゲノムデータは、微生物叢がそこに存在したことを示しただけでなく、葉切りアリの菌類養殖の走査型電子顕微鏡(SEM)分析でも、主に植物基質上の棒状の細菌が示された32。バクテリア(セルロース分解株を含む)は庭全体から分離されましたが、それらは庭の古い部分と廃棄物の山、およびファウンドレスクイーン29,32によって運ばれた最初のペレットでのみ視覚化されました。また、微生物叢がin vivo(すなわち、庭や廃棄物)でバイオフィルムを形成できるかどうかも不明であり、その代謝能力42およびin vitroで観察された44から示唆されている。
ここでは、SEMを使用して、園庭地域全体の微生物叢の空間構成をさらに理解し、微生物叢と基質、および微生物叢と菌糸の物理的相互作用を詳細に説明しました。SEMは、より大きな焦点深度の画像を提供することにより、3次元の微視的構造を高解像度で観察することを可能にし、庭の微生物叢の空間パターンを徹底的に分析することを可能にします。このような不均一で繊細な真菌ベースのサンプルを固定、脱水、乾燥、スパッタコート、およびイメージングする手順について詳しく説明します。四酸化オスミウム(OsO4)を使用した固定後ステップを省略し、脱水時間を短縮することにより、SEM分析用の庭および廃棄物サンプルを準備するためのプロトコル32,33,45を簡素化しました。この適応プロトコルは、菌糸の構造パターン、微生物叢およびバイオフィルムの空間構成を保持し、他の繊細な微生物生態系およびバイオフィルムに適用できる可能性があります。
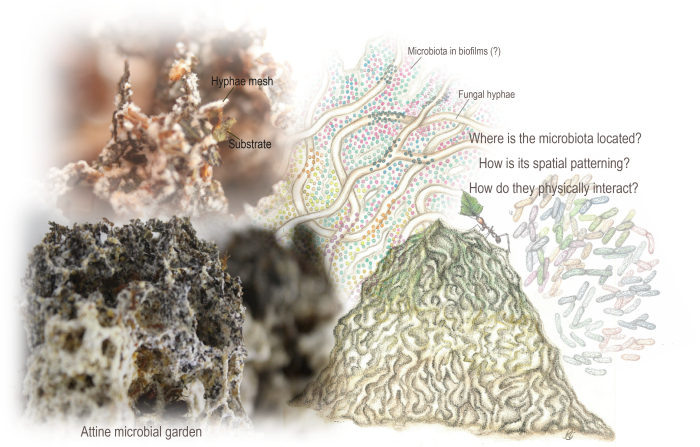
図1:アティーネ微生物園。 庭は、アリが取り込んだ主に植物ベースの基質を代謝することによって成長する菌糸の絡み合ったメッシュから生じるスポンジのような構造です。また、庭には微生物叢があり、真菌の代謝を補完する可能性のある代謝経路をコードしています。メタゲノムデータと以前の走査型電子顕微鏡分析では、その存在が示されていましたが、その空間構成や基質および真菌菌糸との物理的相互作用についてはほとんど知識がありませんでした。私たちはSEMを用いて、微生物叢とバイオフィルムの空間構成とパターニングを明らかにしました。マリアナ・バルコトによるイラスト(バルコトとロドリゲス 94から適応された庭園と微生物叢)、およびマリアナ・バルコトとエンツォ・ソレンティーノによる写真。 この図の拡大版を表示するには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. フィールドコロニーのサンプリング
注:アリのコロニーを収集する場合は、収集する前に、現地の法律で義務付けられているすべての許可を取得していることを証明してください。私たちの場合、収集許可証#74585は、Instituto Chico Mendes de Conservação e Biodiversidade(ICMBio)によって発行されました。サンプルがラボコロニーから来た場合は、セクション2に進みます。
- コロニーを見つけてマークします。庭の部屋が露出するまで、巣穴を囲む溝を掘ります(図2A)。
注:一部のアッティーン種は、落葉の下や腐った丸太の中にコロニーを作る場合があります。このような場合は、リターを慎重に回転させるか、慎重に丸太を壊してサンプルを採取してください。多様なアティーネアリ種の生きたコロニーの発見、収集、維持に関する詳細な情報については、Sosa-Calvo et al.46を参照されたい。 - 土が庭の表面に落ちるのを防ぐために、庭の部屋を横に開きます。庭のサイズに応じて、昆虫学の鉗子、スプーン、またはキッチンスキマーのいずれかを使用して、庭のサンプルを慎重に収集します。
注意: 収集する前に、必ずツールを滅菌してください。葉切りアリの庭を採集するときは、働きバチの咬傷を防ぐ(または少なくとも軽減する)ために、厚手の布製手袋を着用してください。他のアティーネ種の場合、布製手袋はオプションです。 - 庭のサンプルを、庭の湿度のバランスをとるための石膏の層を含むきれいなプラスチックの受取人に移します。庭とアリの労働者を移した後、サンプルの乾燥を避けるために、受取人を密閉して閉じてください。庭のサンプルは、処理まで23〜25°Cで保管してください。
- 以前に取り除いた土でトレンチを閉じます。
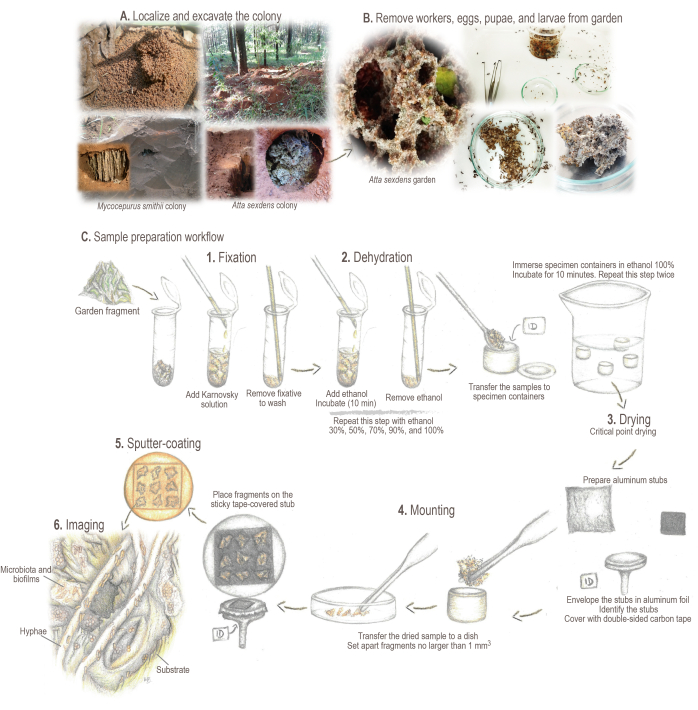
図2:サンプル調製プロトコル。 (A)フィールドコロニーのサンプリング。(B)サンプル処理。(C)サンプル調製のための簡単な基本とワークフロー: 1.固定:サンプル構造を強化し、保存するためのもの。2.脱水:サンプルの水分含有量はエタノールと交換されます。3.臨界点乾燥:液体CO2がエタノールに置き換わり、蒸発します。4.取り付け:分析のためにサンプルが表示されます。5.金によるスパッタコーティング:サンプルの充電を防ぎます。6. イメージング。イラストと写真:マリアナ・バルコト この図の拡大版を表示するには、ここをクリックしてください。
2. 試薬
注:次の解決策を事前に準備する必要があることに注意してください。
- 0.2 Mカコジル酸ナトリウムバッファーを調製します。このためには、42.8gのカコジル酸ナトリウムを800mLの蒸留水に溶解し、溶解してpHが7.2に安定するまで攪拌します(必要に応じて、塩酸を使用してpHを調整します)。蒸留水を加えて溶液の量を1 Lにします。溶液を4°Cで保存します(~1ヶ月間)。
注意:グルタルアルデヒドとパラホルムアルデヒドは有毒であり、ドラフト内で取り扱う必要があります。このような試薬を取り扱うときは、常にニトリル手袋と保護メガネを着用してください。 - カルノフスキーの固定液(カルノフスキーから改変)を調製する47。このためには、10 mLの25%グルタルアルデヒド水溶液と10 mLの20%パラホルムアルデヒド水溶液を25 mLの0.2 Mカコジル酸ナトリウム緩衝液に加えて混合します。0.1M塩化カルシウム(CaCl2)1mLを加え、蒸留水を加えて容量を100mLにします。溶液は4°Cで保存します(最大1ヶ月間)。
注意:カルノフスキーの固定剤は吸入すると有害であり、皮膚や目の炎症を引き起こす可能性があります。.したがって、蒸気を吸い込むことは避け、屋外または換気の良い場所でのみ使用してください。溶液を取り扱うときは、常にニトリル手袋と保護メガネを着用してください。 - 無水エタノール(分析グレード)を使用して、蒸留水に30%、50%、70%、および90%のエタノール溶液を調製します。100%エタノールも必要です。
3. サンプルの固定
注:固定剤は、形態学的特徴を維持しながら、サンプルを硬化させて保存します。アルデヒド(パラホルムアルデヒドやグルタルアルデヒドなど)は、架橋型の非凝固剤固定剤であり、タンパク質と核酸の内部および間に架橋を誘導する48。
- 昆虫学的鉗子を使用して、庭のサンプルから働きバチ、卵、蛹、幼虫を取り除きます(図2B)。庭の破片を5 mm3以下で離して設定します。フラグメントを2mLチューブ(図2C)に加えます。
- サンプルが入ったチューブに、パスツールガラスピペットを使用して、~1 mLのカルノフスキー固定液を加えます(サンプルが完全に覆われていることを確認してください)。穏やかに攪拌して混合し、サンプルを4°Cに浸してインキュベートしてから、サンプル処理を続行します(図2C.1)。
注:以下の脱水ステップが固定直後に行われない場合、このステップでプロトコールを一時停止し、サンプルを4°Cで~1年間保存することができます。
パスツールガラスピペットは、不活性材料で構成されており、後で再利用するための洗浄が容易なため、使用することをお勧めします。園芸材料は疎水性が高く、固定液の表面に浮く傾向があります。通常、固定剤に完全に浸すには最大5分かかります。固定剤がサンプルの細孔に入るとその体積が減少する傾向があるため、固定剤が庭の破片を覆っていることを確認してください。サンプルを浸して濡らした後、その成分(特に繊細な真菌菌糸体)は、さらに混合すると粉々になりやすくなることを経験的に確認しました。したがって、サンプルを振ることはできるだけ避けることをお勧めします。
4.サンプルの脱水
注:エタノール洗浄シリーズは、サンプル中の水を徐々にエタノールと交換します。このようなデリケートなサンプル49を過度に損傷したり崩壊させたりしないように、低濃度のエタノール溶液(下記参照)から始めることが重要である。
- カルノフスキーの固定液をガラスピペットで完全に取り除き、サンプルを乱さないように注意します(図2C.1)。
注:カルノフスキーの固定液は、有毒な化学物質残留物管理のために適切にラベル付けされたレシピエントに廃棄してください。 - 固定液を取り出した直後に、サンプルを乱さないように注意しながら30%エタノール1mLを加え、室温で10分間インキュベートします(図2C.2)。
注:サンプルは常に溶液に浸す必要があります。エタノールの段階的な洗浄シリーズ中に溶液を迅速に交換するようにしてください。庭が多孔質の側面を失い、チューブの底に凝集すると、1 mLのエタノールがサンプルを覆うのに十分になる傾向があります(サンプルが5 mm3以下の場合)。ただし、サンプルが完全に覆われていない場合は、サンプルが完全に覆われるまでエタノールを追加します。 - 30%エタノールをガラスピペットで完全に取り除き、サンプルを乱さないように注意してください。30%エタノールを適切に廃棄します。
注:エタノール段階的な洗浄シリーズ全体では、有毒な化学物質残留物管理のために適切にラベル付けされたレシピエントにエタノールを廃棄します。 - 50%エタノール1mLを加え、室温で10分間インキュベートします。50%エタノールをガラスピペットで完全に除去し、サンプルを乱さないように注意してください。50%エタノールを適切に廃棄します。
- 70%エタノール1mLを加え、室温で10分間インキュベートします。70%エタノールをガラスピペットで完全に除去し、サンプルを乱さないように注意してください。70%エタノールを適切に廃棄します。
注:70%エタノール洗浄ステップでは、サンプルチューブが4°Cで一晩保存される可能性があるため、ユーザーは必要に応じてプロトコルを一時停止することができます。 - 90%エタノール1mLを加え、室温で10分間インキュベートします。90%エタノールをガラスピペットで完全に取り除き、サンプルを乱さないように注意してください。90%エタノールを適切に廃棄します。
- 100%エタノール1mLを加え、室温で10分間インキュベートします。100%エタノールをガラスピペットで完全に取り除き、サンプルを乱さないように注意してください。100%エタノールを適切に廃棄します。
- 鉗子やスパチュラを使用して、サンプル識別ラベル(以前は紙と鉛筆で作成)が入った臨界点乾燥機(CPD)用の試料容器にサンプルを慎重に移します。サンプルの乾燥を避けるために、この移送は、100%エタノールで覆われた容器をペトリ皿に入れた状態で行われます。
- 容器に蓋をして、容器を沈めるのに十分な100%エタノールを含む目盛り付きガラスビーカーに浸します。ガラスビーカーを覆い、室温で10分間インキュベートします。その後、100%エタノールを適切に廃棄します。
- 試料容器を、容器を水没させるのに十分な100%エタノールを含む別の目盛り付きガラスビーカーに移します。ガラスビーカーを覆い、室温で10分間インキュベートします。その後、検体容器を臨界点乾燥機に移します。
注意: 一連の洗浄後、ガラスピペットとビーカーは蒸留水で十分にすすぎ、この残留水は、有毒な化学物質残留物管理のために適切にラベル付けされたレシピエントに廃棄する必要があります。すすぎ後、ガラス製品は中性洗剤で洗い、水道水ですすぎ、風乾することができます。
5.臨界点乾燥
注:クリティカルポイントドライヤーは、サンプル中のエタノールを液体二酸化炭素(CO2)と交換し、より高い温度と圧力でサンプルから蒸発します。このような手順については、製造元の指示に従ってください。
- 機器のスイッチを入れます。
- チャンバーを開き、サンプル容器を中に入れ、容器が覆うまで100%エタノールを加えます。チャンバーを閉じます。
- Coolオプションを有効にし、温度が10°Cに達するまで待ちます。
- CO2シリンダーバルブを開き、 スターラー オプションをアクティブにします。
- オプションでCO2をアクティブにし、常にチャンバーをチェックして、CO2がすでに満たされている量を確認します。チャンバーがほぼ満たされたら、CO2 inオプションを非アクティブ化し、Exchangeオプションをアクティブにして、コンテナを覆うのに十分なCO2があるまでアクティブに保ちます。コンテナが常にCO2で覆われていることを確認してください(つまり、すべてのCO2がチャンバーを出る前に交換オプションを無効にします)。手順5.5 6xを繰り返します。
- 最後にもう一度CO2を活性化し、容器が覆われるまでチャンバーを満たします。
- 「Heat」オプションを有効にし、「Stirrer」オプションを無効にします。CO2シリンダーバルブを閉じます。
- 温度が35°Cに上昇するまで待ちます。次に、 ガスアウト オプションをアクティブにします。
注:約30°Cで、チャンバーは70〜80バールの圧力に達し、液体が 消える臨界点に達します。 - チャンバーの圧力が1バールに達すると、すべてのガス含有量が除去されます。チャンバーを開けて容器を取り出します。
- 機器の電源を切ります。
6. 取り付け
- SEMサンプルホルダー(すなわち、アルミニウムスタブ; 図2C.4)。
- スタブをアルミホイルで包み、上部のみを覆って、分析後のスタブのクリーニングを容易にします。
- ホルダーの底にサンプルコード/番号を記入してスタブを識別し、上部に配置されているものの識別を保証します。
- 上部を両面カーボンテープで覆います。スタブを標本ホルダーに入れます。
- 検体容器の蓋を開け、鉗子とへらを使用して乾燥させたサンプルをガラス製のシャーレに慎重に移します。
注:重要なポイント乾燥した庭は、サイズが1 mm3以下の断片として慎重に離れて設定する必要がある高度に詰められたサンプルを形成する傾向があります。 - テープで覆われたスタブの粘着面に破片を慎重に置きます。庭の破片がテープに触れると、テープを(再)移動することは非常に困難ですので、不要な場所や位置に置かないように注意してください。スタブごとに最大 9 つのフラグメントを追加します。
- 各サンプルについて、手順6.2と6.3を繰り返します。
7.金によるスパッタコーティング
注:サンプルの充電を防ぐために、サンプルをコーティングする必要があります。メーカーの指示に従って、動作ガス圧(このプロトコルでは0.5 × 10-1 mm Hgのガス圧)、スパッタリング時間(220秒)、金層の厚さ(~120 Å)、電流(50 mA)、電圧供給などの設定を調整します。スパッタリングは一般的なワークフローに従う傾向がありますが、メーカーが異なれば装置の動作も若干異なる場合があります。
- ヒンジ付きターゲットアームを開き、スタブを試験片テーブルに置きます。
- ヒンジ付きターゲットアームを閉じ、ガラス真空チャンバーの破片シールドが適切に埋め込まれているかどうかを確認します。
- アルゴンシリンダーバルブを開き、主電源スイッチをオンにします。
- ディスプレイの0.5 × 10-1 mmHgマークに達するまで、機器のディスプレイで真空が上昇するのを追います。次に、 リンスを有効にします。操作を5回繰り返します。
- 水循環システムのスイッチを入れ、オプション HVオンをアクティブにして、金フィルムの蓋を開けます。プラズマの色がピンクがかっていることを確認します。このプロトコルに従うには、50 mA の電圧で 220 秒のスパッタリングを設定し、~120 Å (12 nm) の金層を堆積させます。
- HVオン は自動的にオフになります。水循環システムをオフにし、金フィルムの蓋を閉じます。
- 主電源スイッチをオフにして、空気が真空チャンバーに入るようにします。庭や廃棄物のサンプルについては、手順7.1-7.7を3回繰り返します。
注:サンプル調製直後にイメージングが行われない場合は、サンプルの再水和を避けるために、シリカ層で満たされた密閉容器にスタブを保管してください。
8. イメージング
注意: 対物レンズの開口径、動作電圧、電子ビームシステムのアライメント、軸方向のアライメント、スティグメーターなどのSEM設定を調整するには、製造元の指示に従ってください。
- スタブをサンプルホルダーに置き、各サンプルの位置にメモを取ります。
注:サンプルホルダーを挿入または取り外すときは手袋を着用し、ホルダーをできるだけ清潔に保ちます。 - デスクトップから操作ソフトウェアを起動します。
- 機器の設定を選択します。対物開口径30μm(第2段)で、高真空中での運転、二次電子(SED)からの信号検出、加速電圧 20kV、作動距離15〜20mm、プローブ電流40.0(高電流モード)、試料に応じて倍率を変化させながら、ガーデンサンプルを可視化します。
- ナビゲーションの指示に従って、 ベント アイコンを押し、試料チャンバーがベントされるのを待ちます。プログレスバーはバキュームステータスを示します。
- 大気圧に達したら、試料チャンバーを開け、試料ホルダーを慎重に挿入します。
- チャンバーのドアを静かに閉じ、 Evac アイコンを押して機器を排気し、プログレスバーを通じて真空状態を追跡します。ナビゲーションシステムは、移動が完了したときに移動ステージの位置を表示し、ホルダーグラフを提供します。 カメラ アイコンを押してホルダーの写真を記録し、上面を取得します view イメージング中にサンプル間を移動するのに役立ちます。
- 観測アイコンを押して電子銃をオンにし、画像が形成されるのを待ちます。手動ユーザーインターフェース(手動制御)を使用して、Z軸を適切な高さに手動で移動します(サンプルの高さと決定された作動距離に基づく)。
注意: タングステンフィラメントの寿命を延ばすために、アクティブにイメージングしていないときはいつでも 観察 機能を一時停止してください。 - 画面に表示されるオプションまたは手動コントロールを使用して、 ラスターレート と 画像の位置を変更します。ステージを動かしてサンプルを全体像を把握し、 RDC 機能を使用して特定の領域に焦点を当てます。ターゲット(または興味深い)構造を観察するときは 、それに応じて倍率、焦点、明るさ、コントラスト、 およびスティグメーション を調整します。 手動ユーザーインターフェース を使用してステージをX方向とY方向に動かすことで、スティグマを修正します。
- 倍率を 100 倍から 700 倍の間で調整して、一般的な庭の側面 (菌糸密度、基質、コロニー形成パターンなど) を視覚化します。
- 倍率を700倍から1,500倍の間で調整して、微生物叢の空間パターンを視覚化します。
- 倍率を1,500倍から3,000倍の間で調整して、微生物叢とバイオフィルムの物理的相互作用を観察します。
- 倍率を3,000倍から4,000倍の間で調整して、特定の微生物クラスターに焦点を合わせます。
- 画像を保存するには、 フリーズ 機能を使用し、 写真 アイコンをクリックして、ファイルパスを設定します。標準として、少なくとも3つの庭の断片を分析し、ステップ8.8で説明したすべての倍率範囲で各断片をイメージングします。これにより、サンプルごとに少なくとも 12 枚の画像が生成されますが、画像が多いほど詳細な説明がサポートされる場合があります。サンプルあたり15〜25枚の画像、ステップ8.8のすべての倍率の範囲では、サンプルの説明に細かい詳細を提供する傾向があることを示唆しています。
注:画像のラスタライズと保存には数秒かかりますが、その間、SEMフローティングテーブル上の振動を避ける必要があります。 - イメージングが終了したら、 ベント オプションを押してチャンバーをベントし、プログレスバーを通じて真空状態を追跡します。ホルダーを慎重に取り外し、チャンバードアを静かに閉じ、 Evac を押してチャンバーを排気します。
- 退避が完了したらすぐに操作ソフトウェアを終了します。
- 明るさとコントラストを調整して、画像エディタを使用して視覚化を改善します。
Access restricted. Please log in or start a trial to view this content.
結果
ここでは、真菌菌糸、基質、微生物叢、バイオフィルムなど、アティーネガーデンおよび廃棄物サンプルの成分を視覚化するための簡略化されたプロトコルを提示しました。SEMは、庭と廃棄物が微生物叢の構造パターンをどのように足場にするかについての理解を深めました(図3)。アティーネガーデンでは、真菌菌糸は基質表面の一部を覆う枝...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
SEMは、電子ビームを使用してサンプルをスキャンし、サンプルの拡大画像を生成することで、3次元の微細構造を高解像度で視覚化できます。SEMは高真空下で動作するため、サンプルから最大99%以上の水を除去する必要があります。SEM真空チャンバー内では、部分的に水和したサンプルが脱水して崩壊し、電子が散乱する可能性があります。SEMでの高解像度イメージ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者には、開示すべき利益相反はありません。
謝辞
著者は、財政的支援を提供してくださったFundação de Amparo à Pesquisa do Estado de São Paulo(FAPESP)に感謝します(Grant #2019/03746-0)。MOBは、FAPESP(プロセス2021/08013-0)およびCoordenação de Aperfeiçoamento de Pessoal de Nível Superi-ブラジル(CAPES)-財務コード001から受け取った博士号奨学金に感謝します。また、Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) の研究員(#305269/2018)にも感謝します。著者は、サンプル調製のパイロットテストに協力してくれたMarcia Regina de Moura Aouada氏とAntonio Teruyoshi Yabuki氏、技術支援を提供してくれたRenato Barbosa Salaroli氏、写真撮影に協力してくれたEnzo Sorrentino氏に感謝します。この研究は、アクセス遺伝遺産承認#SISGen AA39A6Dの下で実施されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 2 mL tube | Axygen | MCT-200-C-BRA | To fix and dehydrate samples |
| Calcium chloride anhydrous | Merck | C4901 | CaCl2 anhydrous to prepare Karnovsky’s fixative |
| Critical point dryer | Leica | EM CPD 300 | For critical point drying |
| Double Sided Carbon Conductive Tape, 12 mm (W) X 5 M (L) | Electron Microscopy Sciences | 77819-12 | For mounting samples |
| Entomological forceps | No specific supplier | To manipulate garden samples | |
| Ethyl alcohol (=ethanol), pure (≥99.5%) | Sigma-Aldrich | 459836 | For dehydration |
| Forceps | No specific supplier | To manipulate garden samples | |
| Glass beaker | No specific supplier | For dehydration | |
| Glass Petri dish | No specific supplier | To manipulate garden samples | |
| Glass pipette | No specific supplier | To fix and dehydrate samples | |
| Glutaraldehyde (Aqueous Glutaraldehyde EM Grade 25%) | Electron Microscopy Sciences | 16220 | To prepare Karnovsky’s fixative |
| Gold target | Ted Pella, Inc. | 8071 | To sputter coat with gold |
| Hydrochloric acid | Sigma-Aldrich | 320331 | For adjusting solutions pH |
| Image editor | Photoshop | any version | To adjust images |
| Paraformaldehyde (Paraformaldehyde 20% Aqueous Solution EM Grade) | Electron Microscopy Sciences | 15713 | To prepare Karnovsky’s fixative |
| Propilene recipient | No specific supplier | For maintaining alive ant colonies | |
| Scanning Electron Microscope | JEOL | IT300 SEM | For sample imaging |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | For preparing sodium cacodylate buffer |
| Spatula | No specific supplier | To manipulate garden samples | |
| Specimen containers with 15 mm dia. x 10 mm high | Ted Pella, Inc. | 4591 | For critical point drying |
| Sputter coater | Baltec | SCD 050 | To coat with gold |
| Stub (Aluminium mount, flat end pin) 12.7 mm x 8 mm | Electron Microscopy Sciences | 75520 | For mounting samples |
参考文献
- Turner, M. G. Landscape ecology: the effect of pattern on process. Annu Rev Ecol Evol Syst. 20 (1), 171-197 (1989).
- Rietkerk, M., Van de Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Schmitz, O. J. Spatial dynamics and ecosystem functioning. PLOS Biol. 8 (5), e1000378(2010).
- Pringle, R. M., Doak, D. F., Brody, A. K., Jocqué, R., Palmer, T. M. Spatial pattern enhances ecosystem functioning in an African savanna. PLOS Biol. 8 (5), e1000377(2010).
- Wimpenny, J. W. Spatial order in microbial ecosystems. Biol Rev. 56 (3), 295-342 (1981).
- Martiny, J. B. H., et al. Microbial biogeography: putting microorganisms on the map. Nat Rev. Microbiol. 4 (2), 102-112 (2006).
- McCallum, G., Tropini, C. The gut microbiota and its biogeography. Nat Rev Microbiol. 22 (2), 105-118 (2024).
- Lamont, R. J., Hajishengallis, G., Koo, H. Social networking at the microbiome-host interface. Infec Immun. 91 (9), e00124-e00223 (2023).
- Welch, J. L. M., Rossetti, B. J., Rieken, C. W., Dewhirst, F. E., Borisy, G. G. Biogeography of a human oral microbiome at the micron scale. Proc Natl Acad Sci USA. 113 (6), E791-E800 (2016).
- Kim, D., et al. Spatial mapping of polymicrobial communities reveals a precise biogeography associated with human dental caries. Proc Natl Acad Sci USA. 117 (22), 12375-12386 (2020).
- Swidsinski, A., Weber, J., Loening-Baucke, V., Hale, L. P., Lochs, H. Spatial organization and composition of the mucosal flora in patients with inflammatory bowel disease. J Clin Microbiol. 43 (7), 3380-3389 (2005).
- Ibberson, C. B., Barraza, J. P., Holmes, A. L., Cao, P., Whiteley, M. Precise spatial structure impacts antimicrobial susceptibility of S. aureus in polymicrobial wound infections. Proc Natl Acad Sci USA. 119 (51), e2212340119(2022).
- Azimi, S., Lewin, G. R., Whiteley, M. The biogeography of infection revisited. Nat Rev Microbiol. 20 (10), 579-592 (2022).
- Dejea, C. M., et al. Microbiota organization is a distinct feature of proximal colorectal cancers. Proc Natl Acad Sci USA. 111 (51), 18321-18326 (2014).
- Hanson, C. A., Fuhrman, J. A., Horner-Devine, M. C., Martiny, J. B. Beyond biogeographic patterns: processes shaping the microbial landscape. Nat Rev Microbiol. 10 (7), 497-506 (2012).
- Adade, E. E., Al Lakhen, K., Lemus, A. A., Valm, A. M. Recent progress in analyzing the spatial structure of the human microbiome: Distinguishing biogeography and architecture in the oral and gut communities. Curr Opin Endocr. 18, 275-283 (2021).
- Mony, C., Bohannan, B. J., Leibold, M. A., Peay, K., Vandenkoornhuyse, P. Microbial landscape ecology: Highlights on the invisible corridors. Front Ecol Evol. 9, 753213(2021).
- Hölldobler, B., Wilson, E. O. The Ants. , Harvard University Press. (1990).
- Chapela, I. H., Rehner, S. A., Schultz, T. R., Mueller, U. G. Evolutionary history of the symbiosis between fungus-growing ants and their fungi. Science. 266 (5191), 1691-1694 (1994).
- Mueller, U. G., Rehner, S. A., Schultz, T. R. The evolution of agriculture in ants. Science. 281 (5385), 2034-2038 (1998).
- Mueller, U. G., Gerardo, N. M., Aanen, D. K., Six, D. L., Schultz, T. R. The evolution of agriculture in insects. Annu Rev Ecol Evol Syst. 36, 563-595 (2005).
- Dentinger, B. T., Lodge, D. J., Munkacsi, A. B., Desjardin, D. E., McLaughlin, D. J. Phylogenetic placement of an unusual coral mushroom challenges the classic hypothesis of strict coevolution in the Apterostigma pilosum group ant-fungus mutualism. Evolution. 63 (8), 2172-2178 (2009).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proc Natl Acad Sci USA. 105, 5435-5440 (2008).
- de Fine Licht, H. H., Boomsma, J. J. Forage collection, substrate preparation, and diet composition in fungus-growing ants. Ecol Entomol. 35 (3), 259-269 (2010).
- Martin, M. M. The biochemical basis of the fungus-attine ant symbiosis: A complex symbiosis is based upon integration of the carbon and nitrogen metabolisms of the two organisms. Science. 169 (3940), 16-20 (1970).
- Grell, M. N., et al. The fungal symbiont of Acromyrmex leaf-cutting ants expresses the full spectrum of genes to degrade cellulose and other plant cell wall polysaccharides. BMC Genomics. 14, 928(2013).
- Lange, L., Grell, M. N. The prominent role of fungi and fungal enzymes in the ant-fungus biomass conversion symbiosis. Appl Microbiol Biotechnol. 98, 4839-4851 (2014).
- Huang, E. L., et al. The fungus gardens of leaf-cutter ants undergo a distinct physiological transition during biomass degradation. Environ Microbiol Rep. 6 (4), 389-395 (2014).
- Craven, S. E., Dix, M. W., Michaels, G. E. Attine fungus gardens contain yeasts. Science. 169 (3941), 184-186 (1970).
- De Fine Licht, H. H., Boomsma, J. J., Tunlid, A. Symbiotic adaptations in the fungal cultivar of leaf-cutting ants. Nat Commun. 5 (1), 5675(2014).
- Aylward, F. O., et al. Enrichment and broad representation of plant biomass-degrading enzymes in the specialized hyphal swellings of Leucoagaricus gongylophorus, the fungal symbiont of leaf-cutter ants. PLoS One. 10 (8), e0134752(2015).
- Moreira-Soto, R. D., Sanchez, E., Currie, C. R., Pinto-Tomás, A. A. Ultrastructural and microbial analyses of cellulose degradation in leaf-cutter ant colonies. Microbiology. 163 (11), 1578-1589 (2017).
- Erthal Jr, M., Silva, C. P., Cooper, R. M., Samuels, R. I. Hydrolytic enzymes of leaf-cutting ant fungi. Comp Biochem. 152 (1), 54-59 (2009).
- North, R. D., Jackson, C. W., Howse, P. E. Communication between the fungus garden and workers of the leaf-cutting ant, Atta sexdens rubropilosa, regarding choice of substrate for the fungus. Physiol Entomol. 24 (2), 127-133 (1999).
- Herz, H., Hölldobler, B., Roces, F. Delayed rejection in a leaf-cutting ant after foraging on plants unsuitable for the symbiotic fungus. Behav Ecol. 19 (3), 575-582 (2008).
- Schiøtt, M., De Fine Licht, H. H., Lange, L., Boomsma, J. J. Towards a molecular understanding of symbiont function: identification of a fungal gene for the degradation of xylan in the fungus gardens of leaf-cutting ants. BMC Microbiol. 8, 40(2008).
- Bot, A. N., Currie, C. R., Hart, A. G., Boomsma, J. J. Waste management in leaf-cutting ants. Ethol Ecol Evol. 13 (3), 225-237 (2001).
- Scott, J. J., et al. Microbial community structure of leaf-cutter ant fungus gardens and refuse dumps. PLOS One. 5 (3), e9922(2010).
- Lewin, G. R., et al. Cellulose-enriched microbial communities from leaf-cutter ant (Atta colombica) refuse dumps vary in taxonomic composition and degradation ability. PLOS One. 11 (3), e0151840(2016).
- Suen, G., et al. An insect herbivore microbiome with high plant biomass-degrading capacity. PLOS Genet. 6 (9), e1001129(2010).
- Aylward, F. O., et al. Convergent bacterial microbiotas in the fungal agricultural systems of insects. MBio. 5 (6), e02077(2014).
- Barcoto, M. O., et al. Fungus-growing insects host a distinctive microbiota apparently adapted to the fungiculture environment. Sci Rep. 10 (1), 12384(2020).
- Francoeur, C. B., et al. Bacteria contribute to plant secondary compound degradation in a generalist herbivore system. mBio. 11, e02146-e02220 (2020).
- Martiarena, M. J. S., Deveau, A., Montoya, Q. V., Flórez, L. V., Rodrigues, A. The hyphosphere of leaf-cutting ant cultivars is enriched with helper bacteria. Microb Ecol. 86 (3), 1773-1788 (2023).
- Leal-Dutra, C. A., et al. Evidence that the domesticated fungus Leucoagaricus gongylophorus recycles its cytoplasmic contents as nutritional rewards to feed its leafcutter ant farmers. IMA Fungus. 14 (1), 19(2023).
- Sosa-Calvo, J., Jesovnik, A., Okonski, E., Schultz, T. R. Locating, collecting, and maintaining colonies of fungus-farming ants (Hymenoptera: Myrmicinae: Attini). Sociobiology. 62 (2), 300-320 (2015).
- Karnovsky, M. J. A formaldehyde glutaraldehyde fixative of high osmolality for use in electron microscopy. J Cell Biol. 27, 137-138 (1965).
- Eltoum, I., Fredenburgh, J., Myers, R. B., Grizzle, W. E. Introduction to the theory and practice of fixation of tissues. J Histotechnol. 24 (3), 173-190 (2001).
- Gusnard, D., Kirschner, R. H. Cell and organelle shrinkage during preparation for scanning electron microscopy: effects of fixation, dehydration and critical point drying. J Microsc. 110 (1), 51-57 (1977).
- Surman, S. B., et al. Comparison of microscope techniques for the examination of biofilms. J Microbiol Methods. 25 (1), 57-70 (1996).
- Augustin, J. O., et al. Yet more "weeds" in the garden: fungal novelties from nests of leaf-cutting ants. PLOS One. 8 (12), e82265(2013).
- Montoya, Q. V., Martiarena, M. J. S., Polezel, D. A., Rodrigues, A. More pieces to a huge puzzle: Two new Escovopsis species from fungus gardens of attine ants. MycoKeys. 46, 97(2019).
- Varanda-Haifig, S. S., et al. Nature of the interactions between hypocrealean fungi and the mutualistic fungus of leaf-cutter ants. Antonie van Leeuwenhoek. 110, 593-605 (2017).
- Custodio, B. C., Rodrigues, A. Escovopsis kreiselii specialization to its native hosts in the fungiculture of the lower attine ant Mycetophylax morschi. Antonie van Leeuwenhoek. 112, 305-317 (2019).
- Schröttner, H., Schmied, M., Scherer, S. Comparison of 3D surface reconstruction data from certified depth standards obtained by SEM and an Infinite Focus Measurement Machine (IFM). Microchim Acta. 155, 279-284 (2006).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of scanning electron microscopy (SEM). Scanning microscopy for nanotechnology: Techniques and applications. Zhou, W., Wang, Z. L. , Springer. New York, NY. 1-40 (2007).
- Kannan, M. Scanning electron microscopy: Principle, components and applications. A Textbook on Fundamentals and Applications of Nanotechnology. Raja, K., Subramanian, K. S., Kannan, M. , Daya Publishing House. 81-92 (2018).
- Ruffolo, J. J. Jr Critical point drying of protozoan cells and other biological specimens for scanning electron microscopy: apparatus and methods of specimen preparation. Trans Am Microsc. 93 (1), 124-131 (1974).
- Echlin, P. Recent advances in specimen coating techniques for electron microscopy. Scanning Electron Microscopy 1981/1. , IITRI. Chicago. 79-90 (1981).
- Ris, H. The cytoplasmic filament system in critical point-dried whole mounts and plastic-embedded sections. J Cell Biol. 100 (5), 1474-1487 (1985).
- Bray, D. F., Bagu, J., Koegler, P. Comparison of hexamethyldisilazane (HMDS), Peldri II, and critical-point drying methods for scanning electron microscopy of biological specimens. Microsc Res Tech. 26 (6), 489-495 (1993).
- Bergmans, L., Moisiadis, P., Van Meerbeek, B., Quirynen, M., Lambrechts, P. Microscopic observation of bacteria: review highlighting the use of environmental SEM. Int Endod J. 38 (11), 775-788 (2005).
- Kirk, S. E., Skepper, J. N., Donald, A. M. Application of environmental scanning electron microscopy to determine biological surface structure. J Microsc. 233 (2), 205-224 (2009).
- Kemmenoe, B. H., Bullock, G. R. Structure analysis of sputter-coated and ion-beam sputter-coated films: a comparative study. J Microsc. 132 (2), 153-163 (1983).
- Kinden, D. A., Brown, M. F. Technique for scanning electron microscopy of fungal structures within plant cells. Phytopathology. 65, 74-76 (1975).
- Masaphy, S., Levanon, D., Tchelet, R., Henis, Y. Scanning electron microscope studies of interactions between Agaricus bisporus (Lang) Sing hyphae and bacteria in casing soil. Appl Environ Microbiol. 53 (5), 1132-1137 (1987).
- Massicotte, H. B., Melville, L. H., Peterson, R. L. Scanning electron microscopy of ectomycorrhizae potential and limitations. Scanning Microsc. 1 (3), 58(1987).
- Visen, A., Singh, P. N., Chakraborty, B., Singh, A., Bisht, T. S. Scanning electron microscopy indicates Pseudomonad strains facilitate AMF mycorrhization in litchi (Litchi chinensis Sonn.) air-layers and improving survivability, growth and leaf nutrient status. Curr Res Microb Sci. 2, 100063(2021).
- Fleeman, R. M., Mikesh, M., Davies, B. W. Investigating Klebsiella pneumoniae biofilm preservation for scanning electron microscopy. Access Microbiol. 5 (2), 000470-000473 (2023).
- Wells, M., Mikesh, M., Gordon, V. Structure-preserving fixation allows scanning electron microscopy to reveal biofilm microstructure and interactions with immune cells. J Microsc. 293 (1), 59-68 (2024).
- Nadell, C. D., Drescher, K., Foster, K. R. Spatial structure, cooperation and competition in biofilms. Nat Rev Microbiol. 14 (9), 589-600 (2016).
- Madsen, J. S., et al. Coexistence facilitates interspecific biofilm formation in complex microbial communities. Environ Microbiol. 18 (8), 2565-2574 (2016).
- Madsen, J. S., Sørensen, S. J., Burmølle, M. Bacterial social interactions and the emergence of community-intrinsic properties. Curr Opin Microbiol. 42, 104-109 (2018).
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nat Rev Microbiol. 17 (4), 247-260 (2019).
- Bringhurst, B., Allert, M., Greenwold, M., Kellner, K., Seal, J. N. Environments and hosts structure the bacterial microbiomes of fungus-gardening ants and their symbiotic fungus gardens. Microb Ecol. 86 (2), 1374-1392 (2023).
- Bringhurst, B., Greenwold, M., Kellner, K., Seal, J. N. Symbiosis, dysbiosis and the impact of horizontal exchange on bacterial microbiomes in higher fungus-gardening ants. Sci Rep. 14 (1), 3231(2024).
- Vargas, S., et al. Body-plan reorganization in a sponge correlates with microbiome change. Mol Biol Evol. 40 (6), msad138(2023).
- Apprill, A., et al. Humpback whale populations share a core skin bacterial community: towards a health index for marine mammals. PLOS One. 9 (3), e90785(2014).
- Fraune, S., et al. Bacteria-bacteria interactions within the microbiota of the ancestral metazoan Hydra contribute to fungal resistance. ISME J. 9 (7), 1543-1556 (2015).
- Gowen, R., Gamal, A., Di Martino, L., McCormick, T. S., Ghannoum, M. A. Modulating the microbiome for Crohn's disease treatment. Gastroenterology. 164 (5), 828-840 (2023).
- Moya, P., et al. Molecular phylogeny and ultrastructure of the lichen microalga Asterochloris mediterranea sp. nov. from Mediterranean and Canary Islands ecosystems. Int J Syst Evol Microbiol. 65 (6), 1838-1854 (2015).
- Zettler, E. R., Mincer, T. J., Amaral-Zettler, L. A. Life in the "plastisphere": microbial communities on plastic marine debris. Environ Sci Technol. 47 (13), 7137-7146 (2013).
- Porter, K. R., Kallman, F. The properties and effects of osmium tetroxide as a tissue fixative with special reference to its use for electron microscopy. Exp Cell Res. 4 (1), 127-141 (1953).
- Ligon, J. J., Abraham, J. L., Boyd, A. S. Traumatic osmium tetroxide inoculation. J Am Acad Dermatol. 45 (6), 949-952 (2001).
- Friedova, N., et al. Osmium absorption after osmium tetroxide skin and eye exposure. Basic Clin Pharmacol Toxicol. 127 (5), 429-433 (2020).
- Fratesi, S. E., Lynch, F. L., Kirkland, B. L., Brown, L. R. Effects of SEM preparation techniques on the appearance of bacteria and biofilms in the Carter Sandstone. J Sediment. 74 (6), 858-867 (2004).
- Dassanayake, R. P., et al. Identification of a reliable fixative solution to preserve the complex architecture of bacterial biofilms for scanning electron microscopy evaluation. PLOS One. 15 (5), e0233973(2020).
- Desiro, A., et al. Detection of a novel intracellular microbiome hosted in arbuscular mycorrhizal fungi. ISME J. 8 (2), 257-270 (2014).
- Morales, D. P., et al. Advances and challenges in fluorescence in situ hybridization for visualizing fungal endobacteria. Front Microbiol. 13, 892227(2022).
- Shi, H., et al. Highly multiplexed spatial mapping of microbial communities. Nature. 588 (7839), 676-681 (2020).
- Valm, A. M., Welch, J. L. M., Borisy, G. G. CLASI-FISH: principles of combinatorial labeling and spectral imaging. Syst Appl Microbiol. 35 (8), 496-502 (2012).
- Fernandez-Brime, S., Muggia, L., Maier, S., Grube, M., Wedin, M. Bacterial communities in an optional lichen symbiosis are determined by substrate, not algal photobionts. FEMS Microbiol Ecol. 95 (3), fiz012(2019).
- Schluter, S., Eickhorst, T., Mueller, C. W. Correlative imaging reveals holistic view of soil microenvironments. Environ Sci Technol. 53 (2), 829-837 (2018).
- Barcoto, M. O., Rodrigues, A. Lessons from insect fungiculture: from microbial ecology to plastics degradation. Front Microbiol. 13, 812143(2022).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved