Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Attine Karıncalarının Bahçelerinin Mikrobiyotası: Elektron Mikroskobunu Tarayarak Mikrobiyal Bir Manzarayı Görselleştirmek
Bu Makalede
Özet
Mikrobiyota ve biyofilm ile birlikte bitki ve mantar biyokütlesi içeren oldukça heterojen ve hassas numuneleri görselleştirmek için optimize edilmiş bir Taramalı Elektron Mikroskobu protokolü öneriyoruz. Bu protokol, mikrobiyota organizasyonunun mekansal boyutlarının tanımlanmasına izin verir.
Özet
Yağmur ormanları veya mercan resifleri gibi makro ölçekli ekosistemlerde, organizmaların mekansal lokalizasyonu, topluluk ekolojisi anlayışımızın temelidir. Mikrobiyal dünyada, aynı şekilde, mikro ölçekli ekosistemler, organizmaların ve habitatların rastgele ve homojen bir karışımından uzaktır. Mikropların mekansal dağılımına erişmek, mikrobiyotanın işleyişini ve ekolojisini anlamak için esastır, çünkü birlikte yaşayan türlerin etkileşime girme ve birbirlerinin fizyolojisini etkileme olasılığı daha yüksektir.
Krallıklar arası bir mikrobiyal ekosistem, basidiomycete mantarlarını bir besin kaynağı olarak yetiştiren mantar yetiştiren karınca kolonilerinin merkezinde yer alır. Attin karıncaları, süngerimsi bir yapı oluştururken, ekili mantar tarafından metabolize edilen çeşitli substratlar (çoğunlukla bitki bazlı) için yem ararlar, bu da harici bir bağırsak görevi gören bir "mikrobiyal bahçe"dir. Bahçe, substratı metabolize ederek, karakteristik ve uyarlanmış bir mikrobiyotanın kurulması için nişler açarak büyüyen iç içe geçmiş bir mantar hifleri ağıdır. Mikrobiyotanın substrat bozulmasına ve mantar büyümesine katkıda bulunduğu düşünülmektedir, ancak mekansal organizasyonu henüz belirlenmemiştir.
Burada, mantar yetiştiren karıncaların farklı mantar kültürü sistemlerindeki mikrobiyota ve biyofilm mekansal organizasyonunu benzeri görülmemiş ayrıntılarla araştırmak için Taramalı Elektron Mikroskobunu (SEM) nasıl kullandığımızı açıklıyoruz. SEM görüntüleme, mikrobiyotanın mekansal yapısı ve organizasyonunun bir tanımını sağlamıştır. SEM, mikrobiyotanın yaygın olarak mantar yetiştiriciliğindeki mikrobiyal manzaraların yaygın bir yapısı olan biyofilmlerde bir araya geldiğini ortaya koydu. Böylesine karmaşık bir topluluğu düzeltmek, kurutmak, kurutmak, püskürtmek ve görüntülemek için kullanılan protokolleri sunuyoruz. Bu protokoller, bitki ve mantar biyokütlesinin yanı sıra mikrobiyota ve biyofilmi içeren hassas ve heterojen numunelerle başa çıkmak için optimize edilmiştir.
Giriş
Ekosistemler, belirli bir coğrafi konumdaki (yani çevre) süreçlerle birbirine bağlanan organizmalardan oluşur. Organizmalar zamanla çevreleriyle etkileşime girer ve bu da karmaşık ve heterojen mekansal kalıpların ortaya çıktığı anlamına gelir. Mekansal modelleme, ekolojik çeşitliliği ve istikrarı ve nihayetinde ekosistem işleyişini belirler 1,2,3,4. Sulak alanlar, savanlar, mercan resifleri ve kurak ekosistemler gibi makro ölçekli ekosistemlerde, mekansal modeller kaynak akışı ve konsantrasyonu ile ilişkilidir. Kaynak optimizasyonuna, mekansal heterojenliğe ve modellemeye izin vermek, homojen olanlardan daha esnek ekosistemlerle sonuçlanır2. Topluluk ekolojisinin temelinde yer alan organizmaların mekansal lokalizasyonu, mikrobiyal dünyaya da tercüme edilir.
Mikrobiyal ekosistemler, mikroorganizmalar boyunca rastgele ve homojen bir şekilde karışmış organizmalardan uzakta, işlevlerinin çoğunu tanımlayan mekansal modeller sergiler 5,6,7. Winogradsky sütunlarından çevre ve konakçı ile ilişkili mikrobiyotaya kadar, bu ekosistemler uzayda heterojen bir şekilde düzenlenmiştir ve mekansal düzenlemeler farklı fenotipik tepkileri ortaya çıkarır. Birlikte yaşayan türlerin etkileşime girme ve birbirlerinin fizyolojisini etkileme olasılığı daha yüksektir. Bu nedenle, topluluk mekansal organizasyonu, kendi başına bileşiminden daha fazla, ekosistem özelliklerini ve ekolojik nişleri sınırlar 5,7,8. Bu kavramları açıklamak için, uzamsal desenlemedeki değişiklikler diş plaklarının, çürüklerin, diş eti hastalıklarının 9,10, inflamatuar bağırsak hastalığının11, kistik fibrozun akciğer enfeksiyonlarının, kronik yara enfeksiyonlarının12,13, kolorektal kanserin ve adenomların14 patolojik ilerlemesi ile ilişkili görünmektedir.
Mikrobiyal biyocoğrafya (mikro ölçekte uzay ve zaman boyunca biyolojik çeşitlilik dağılımı ve modelleme çalışması) kapsamında, mikrobiyal ekosistemlerin bilgisi, mekansal kalıplarını kavrayarak büyük ölçüde yararlanılır 6,13,15,16,17. Karizmatik mantar yetiştiren attine karınca (Hymenoptera: Formicidae: Myrmicinae: Attini: Attina) kolonilerinin merkezinde bulunan, böcek yapılı bir mikrobiyal ekosistemin mekansal modellerini inceledik. Leucocoprinae (Basidiomycota: Agaricaceae) kabilesinde veya Pterulaceae (Basidiomycota: Agaricales) familyasında bir basidiomycete mantarı etrafında merkezlenmiş bir "mikrobiyal bahçe" bulunur.18,19,20,21,22. Bahçe, karıncalar tarafından dahil edilen çoğunlukla bitki bazlı substratı metabolize ederek büyüyen iç içe geçmiş bir hif ağından çıkan süngerimsi bir yapıdır (Şekil 1). Bunlar, attine cinslerine göre şunları içerebilir: kuru bitki kısımları, böcek parçaları ve leşleri, taze kesilmiş yapraklar, tohumlar ve çiçek kısımları23,24. Dış otçul bir bağırsağa benzer şekilde, bahçe enzimatik ve kimyasal olarak inatçı polimerleri kararsız besin kaynaklarına dönüştürür ve karıncalara esansiyel amino asitler, lipitler ve çözünür şekerler sağlar 21,25,26,27,28.
Yaprak kesme cinsleri Atta ve Acromyrmex'in bahçeleri için gerçekleştirilen ultrayapısal, enzimatik ve transkriptomik analizler, bu ortamların substrat bozulması ve beslenme yamalarının sürekliliğini yapılandırdığını göstermektedir 26,29,30,31,32. Bahçenin genç kısımları, parçalandıktan sonra yeni eklenen alt tabaka nedeniyle daha koyu olma eğilimindedir. Yakın zamanda eklenen bu substratlar genellikle karınca işçileri tarafından kesilen ve misel kümeleri ile aşılanan kenarlardan kolonize edilir. Kesilmiş kenarlardan yayılan mantar hifleri substrat üzerine yayılır 29,32,33. Substrat bozunması ilerledikçe hif bolluğu artar, bu da beyazımsı ve metabolik olarak aktif bölgelerle sonuçlanır 30,31,32. Daha fazla bozulmuş substrat ve bol miktarda mikrobiyota29,32 içeren daha eski bölgeler, kahverengimsi tonlar ve daha yüksek nem sunma eğilimindedir. İşçiler bu bölgenin parçalarını çıkarır, onları atık yığınlarına ayırırlar ve burada mantar simbiyotuna zarar veren substratları da alırlar 34,35,36. Atık yığınları, bahçeden fiziksel olarak ayrılmış olmasına rağmen, bol miktarda yaşayan mikrobiyota 29,32,37,38,39 tarafından sürekli substrat bozulması ve besin döngüsünün bir noktasıdır.
Esas olarak Enterobacter, Klebsiella, Pantoea, Pseudomonas ve Serratia'dan oluşan bir mikrobiyota da bahçede yaşar ve görünüşe göre çeşitli attine mantar kültür sistemleri tarafından paylaşılır. Mantar metabolizmasını tamamlayabilecek metabolik yolları kodlayan mikrobiyota, bahçenin fizyolojik tepkilerine potansiyel olarak katılır 40,41,42,43,44. Metagenomik veriler sadece mikrobiyotanın orada olduğunu göstermeklekalmadı 41,42, aynı zamanda yaprak kesen karıncaların mantar kültürünün Taramalı Elektron Mikroskobu (SEM) analizi, bitki substratı üzerinde çoğunlukla çubuk şeklindeki bakterileri gösterdi32. Bakteriler (selülolitik suşlar dahil) tüm bahçeden izole edilmiş olsa da, yalnızca bahçenin eski kısımlarında ve atık yığınlarında ve ayrıca kurucu kraliçeler tarafından taşınan ilk peletlerdegörüntülendi 29,32. Mikrobiyotanın metabolik kapasitelerinin42 önerdiği ve in vitro44'te gözlemlendiği gibi in vivo (yani bahçede ve atıkta) biyofilm oluşturup oluşturamayacağı da belirsizdi.
Burada, mikrobiyota-substrat ve mikrobiyota-hiflerin fiziksel etkileşimlerini detaylandırarak, bahçe bölgelerindeki mikrobiyota mekansal organizasyonunu daha iyi anlamak için SEM'i kullandık. SEM, daha büyük odak derinliğine sahip görüntüler sağlayarak, üç boyutlu mikroskobik yapıların yüksek çözünürlükte gözlemlenmesine izin vererek, bahçe mikrobiyotası mekansal modellerinin kapsamlı bir analizini sağlar. Bu tür heterojen ve hassas mantar bazlı örnekleri düzeltmek, kurutmak, kurutmak, püskürtmek ve görüntülemek için adımları detaylandırıyoruz. Osmiyum tetroksit (OsO4) kullanarak postfiksasyon adımını kaldırarak ve dehidrasyon süresini azaltarak, SEM analizi için bahçe ve atık numunelerinin hazırlanması için 32,33,45 protokollerini basitleştirdik. Bu uyarlanmış protokol, hifal yapısal modellerin yanı sıra mikrobiyota ve biyofilm mekansal organizasyonunu korur ve diğer hassas mikrobiyal ekosistemlere ve biyofilmlere uygulanabilir.
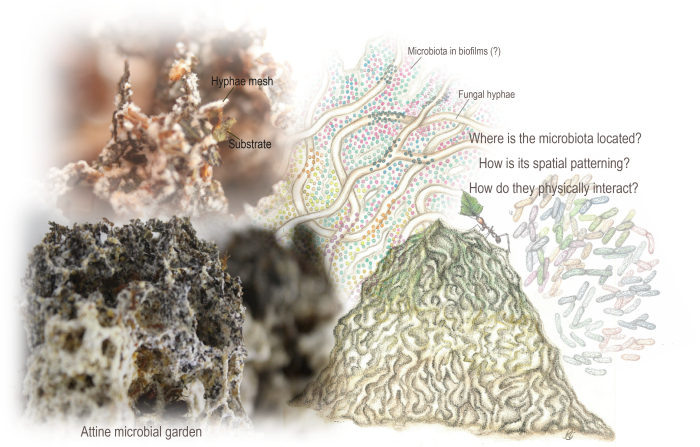
Şekil 1: Attine mikrobiyal bahçeleri. Bahçe, karıncalar tarafından dahil edilen çoğunlukla bitki bazlı substratı metabolize ederek büyüyen iç içe geçmiş bir hif ağından kaynaklanan sünger benzeri bir yapıdır. Ayrıca bahçede yaşayan, mantar metabolizmasını tamamlayabilecek metabolik yolları kodlayan mikrobiyota da bulunur. Metagenomik veriler ve önceki Taramalı Elektron Mikroskobu analizi, mekansal organizasyonu ve substrat ve mantar hifleri ile fiziksel etkileşimleri hakkında çok az bilgimiz olmasına rağmen, varlığını gösterdi. Mikrobiyota ve biyofilm mekansal organizasyonunu ve modellemesini ortaya çıkarmak için SEM'i kullandık. Mariana Barcoto'nun çizimleri (Barcoto ve Rodrigues 94'ten uyarlanmış bahçe ve mikrobiyota) ve Mariana Barcoto ve Enzo Sorrentino'nun fotoğrafları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. Örnekleme alanı kolonileri
NOT: Karınca kolonilerini toplarken, toplamadan önce yerel mevzuatın gerektirdiği tüm izinlerin alındığını onaylayın. Bizim durumumuzda, #74585 toplama izni Instituto Chico Mendes de Conservação e Biodiversidade (ICMBio) tarafından verilmiştir. Numuneler bir laboratuvar kolonisinden geldiğinde, bölüm 2'ye gidin.
- Koloniyi bulun ve işaretleyin. Bahçe odası açığa çıkana kadar yuva alanını çevreleyen bir hendek kazın (Şekil 2A).
NOT: Bazı attine türleri kolonilerini yaprak çöpünün altına veya çürümüş kütüklerin içine inşa edebilir. Bu gibi durumlarda, çöpü dikkatlice döndürün veya numuneleri toplamak için kütükleri dikkatlice kırın. Çeşitli attine karınca türlerinin canlı kolonilerinin bulunması, toplanması ve bakımı hakkında ayrıntılı bilgi için Sosa-Calvo ve ark.46'ya bakınız. - Toprağın bahçe yüzeyine düşmesini önlemek için bahçe odasını yanlamasına açın. Bahçe büyüklüğüne bağlı olarak entomolojik forseps, kaşık veya mutfak kepçesi kullanarak bahçe örneklerini dikkatlice toplayın.
NOT: Toplamadan önce aletleri sterilize ettiğinizden emin olun. Yaprak kesen karıncaların bahçelerini toplarken, işçi ısırıklarını önlemek (veya en azından azaltmak) için kalın kumaş eldivenler giyin. Diğer attin türleri için kumaş eldivenler isteğe bağlıdır. - Bahçe numunelerini, bahçenin nemini dengelemek için bir sıva tabakası içeren temiz bir plastik alıcıya aktarın. Bahçe ve karınca işçilerini aktardıktan sonra, numunenin kurumasını önlemek için alıcıyı hava geçirmez şekilde kapatın. Bahçe numunelerini işlenene kadar 23-25 °C'de saklayın.
- Açmayı daha önce çıkarılmış toprakla kapatın.
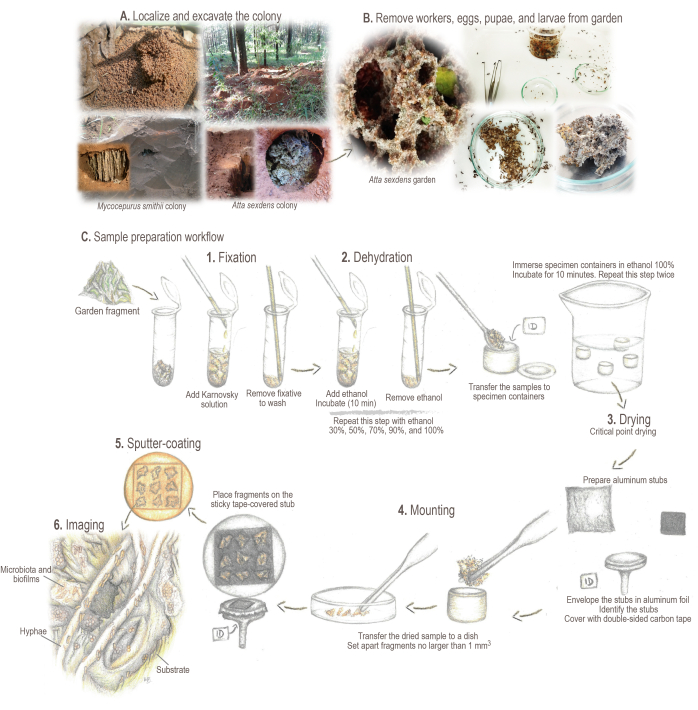
Şekil 2: Numune hazırlama protokolü. (A) Tarla kolonilerinden numune alınması. (B) Numune işleme. (C) Numune hazırlama için kısa temeller ve iş akışı: 1. Sabitleme: numune yapısını güçlendirmek ve korumak için. 2. Dehidrasyon: numunelerin su içeriği etanol ile değiştirilir. 3. Kritik nokta kurutma: sıvı CO2 etanolün yerini alır ve buharlaştırılır. 4. Montaj: analiz için görüntülenen örnek. 5. Altın ile püskürtme kaplama: numune şarjını önleyin. 6. Görüntüleme. İllüstrasyonlar ve fotoğraflar Mariana Barcoto'ya aittir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Reaktifler
NOT: Aşağıdaki çözümlerin önceden hazırlanması gerektiğini unutmayın.
- 0.2 M sodyum kakodilat tamponu hazırlayın. Bunun için 42.8 g sodyum kakodilatı 800 mL damıtılmış su içinde çözün, çözünene ve 7.2'de pH stabilizasyonuna kadar karıştırın (gerekirse pH'ı hidroklorik asit kullanarak ayarlayın). Damıtılmış su ekleyerek çözeltinin hacmini 1 L'ye yükseltin. Solüsyonu 4 °C'de saklayın (~ 1 ay).
DİKKAT: Gluteraldehit ve paraformaldehit toksiktir ve çeker ocak içinde ele alınmalıdır. Bu tür reaktifleri kullanırken her zaman nitril eldiven ve koruyucu gözlük kullanın. - Karnovsky'nin fiksatifini hazırlayın (Karnovsky'den değiştirilmiş)47. Bunun için 25 mL 0.2 M sodyum kakodilat tamponuna 10 mL %25 glutaraldehit sulu çözeltisi ve 10 mL %20 paraformaldehit sulu çözeltisi ekleyin ve karıştırın. 1 mL 0.1 M kalsiyum klorür (CaCl2) ekleyin ve damıtılmış su ekleyerek hacmi 100 mL'ye yükseltin. Solüsyonu 4 °C'de saklayın (1 aya kadar).
DİKKAT: Karnovsky fiksatifi solunduğunda zararlıdır ve cilt ve göz tahrişine neden olabilir. Bu nedenle, yalnızca açık havada veya iyi havalandırılan bir alanda kullanarak buharları solumaktan kaçının. Solüsyonu tutarken her zaman nitril eldiven ve koruyucu gözlük kullanın. - Mutlak etanol (analitik derece) kullanarak, damıtılmış suda %30, %50, %70 ve %90 etanol çözeltileri hazırlayın; % 100 etanol de gereklidir.
3. Örnek fiksasyon
NOT: Fiksatifler, morfolojik özellikleri koruyarak numuneleri sertleştirir ve korur. Aldehitler (paraformaldehit ve glutaraldehit gibi), proteinler ve nükleik asitler48 içinde ve arasında çapraz bağları indükleyen, çapraz bağlama tipinde pıhtılaştırıcı olmayan fiksatiflerdir.
- Entomolojik forseps kullanarak bahçe örneklerinden işçileri, yumurtaları, pupaları ve larvaları çıkarın (Şekil 2B). 5 mm'den büyük olmayan bahçe parçalarını ayırın3. Parçaları 2 mL'lik bir tüpe ekleyin (Şekil 2C).
- Numuneleri içeren tüplere ~ 1 mL Karnovsky fiksatif solüsyonu eklemek için bir Pasteur cam pipet kullanın (numunenin tamamen kaplandığından emin olun). Numune işlemeye devam etmeden önce numunenin en az 24 saat boyunca 4 °C'de ıslanmasına ve inkübe edilmesine yardımcı olmak için hafifçe çalkalayarak karıştırın (Şekil 2C.1).
NOT: Fiksasyondan hemen sonra aşağıdaki dehidrasyon adımları gerçekleştirilmeyecekse, protokol bu adımda duraklatılabilir ve numuneler 4 ° C'de ~ 1 yıl boyunca saklanabilir.
İnert bir malzemeden oluştuğu ve daha sonra yeniden kullanım için temizlenmesi daha kolay olduğu için bir Pasteur cam pipet kullanmanızı öneririz. Bahçe malzemesi oldukça hidrofobiktir ve fiksatif çözeltinin yüzeyi üzerinde yüzmeye meyillidir. Sabitleyiciye tamamen batırılması genellikle 5 dakika kadar sürer. Sabitleyicinin bahçe parçalarını kapladığından emin olun, çünkü numunenin gözeneklerine girerken hacmi azalma eğilimindedir. Numune ıslatıldıktan ve ıslandıktan sonra, bileşenlerinin (özellikle hassas mantar miselyumu) daha fazla karıştırıldığında parçalanmaya duyarlı hale geldiğini ampirik olarak doğruladık. Bu nedenle, numuneleri mümkün olduğunca sallamaktan kaçınmanızı öneririz.
4. Örnek dehidrasyon
NOT: Etanol yıkama serisi, numunelerdeki suyu kademeli olarak etanol ile değiştirir. Bu tür hassas numunelere aşırı zarar vermekten veya çökmekten kaçınmak için düşük konsantrasyonlu bir etanol çözeltisiyle (aşağıya bakınız) başlamak önemlidir49.
- Numuneyi bozmamaya dikkat ederek Karnovsky'nin fiksatif solüsyonunu bir cam pipet kullanarak tamamen çıkarın (Şekil 2C.1).
NOT: Karnovsky'nin fiksatifini toksik kimyasal kalıntı yönetimi için uygun şekilde etiketlenmiş bir alıcıya atın. - Fiksatifi çıkardıktan hemen sonra, numuneyi bozmamaya dikkat ederek 1 mL %30 etanol ekleyin ve oda sıcaklığında 10 dakika inkübe edin (Şekil 2C.2).
NOT: Numunelerin her zaman çözeltiye batırılması gerekir. Etanol kademeli yıkama serisi sırasında çözeltileri hızlı bir şekilde değiştirdiğinizden emin olun. Bahçe gözenekli yönünü kaybettiğinden ve tüp dibinde toplandıkça, numuneyi kaplamak için 1 mL etanol yeterli olma eğilimindedir (numune 5 mm'den büyük olmadığında3). Bununla birlikte, numuneler tamamen kaplanmamışsa, numune tamamen kaplanana kadar etanol ekleyin. - Numuneyi bozmamaya dikkat ederek %30 etanolü bir cam pipetle tamamen çıkarın. % 30 etanolü uygun şekilde atın.
NOT: Etanol kademeli yıkama serisinin tamamı için, toksik kimyasal kalıntı yönetimi için uygun şekilde etiketlenmiş bir alıcıdaki etanolü atın. - 1 mL %50 etanol ekleyin ve oda sıcaklığında 10 dakika inkübe edin. Numuneyi bozmamaya dikkat ederek %50 etanolü bir cam pipetle tamamen çıkarın. % 50 etanolü uygun şekilde atın.
- 1 mL %70 etanol ekleyin ve oda sıcaklığında 10 dakika inkübe edin. Numuneyi bozmamaya dikkat ederek %70 etanolü bir cam pipetle tamamen çıkarın. % 70 etanolü uygun şekilde atın.
NOT: %70 etanol yıkama adımında, numune tüpleri, malzemenin hemen işlenmeyeceği 4 ° C'de gece boyunca saklanabileceğinden, kullanıcı gerekirse protokolü duraklatabilir. - 1 mL %90 etanol ekleyin ve oda sıcaklığında 10 dakika inkübe edin. Numuneyi bozmamaya dikkat ederek %90 etanolü bir cam pipetle tamamen çıkarın. % 90 etanolü uygun şekilde atın.
- 1 mL %100 etanol ekleyin ve oda sıcaklığında 10 dakika inkübe edin. Numuneyi bozmamaya dikkat ederek %100 etanolü bir cam pipetle tamamen çıkarın. % 100 etanolü uygun şekilde atın.
- Bir forseps ve/veya bir spatula kullanarak, numuneleri, numune tanımlama etiketlerini (daha önce kağıt ve kurşun kalemle yapılmış) içeren kritik nokta kurutucu (CPD) için numune kaplarına dikkatlice aktarın. Numunelerin kurumasını önlemek için bu transfer, %100 etanol ile kaplı bir Petri kabına yerleştirilen kap ile gerçekleştirilir.
- Kapakları kapların üzerine koyun ve kapları suya batırmaya yetecek kadar %100 etanol içeren dereceli bir cam kabın içine daldırın. Cam kabı kapatın ve oda sıcaklığında 10 dakika inkübe edin; Ardından% 100 etanolü uygun şekilde atın.
- Numune kaplarını, kapları daldırmak için yeterli miktarda %100 etanol içeren başka bir dereceli cam kabın üzerine aktarın. Cam kabı kapatın ve oda sıcaklığında 10 dakika inkübe edin; Ardından, numune kaplarını kritik nokta kurutucusuna aktarın.
NOT: Yıkama serisinden sonra, cam pipetler ve beherler bol miktarda damıtılmış su ile durulanmalı ve bu artık su, toksik kimyasal kalıntı yönetimi için uygun şekilde etiketlenmiş bir alıcıya atılmalıdır. Durulamadan sonra, cam çamaşırlar nötr deterjanla yıkanabilir, musluk suyuyla durulanabilir ve havayla kurutulabilir.
5. Kritik nokta kurutma
NOT: Bir Kritik Nokta Kurutucu, numunelerdeki etanolü, numuneden daha yüksek sıcaklık ve basınçta buharlaşan sıvı karbondioksit (CO2) ile değiştirir. Lütfen bu tür prosedürler için üreticinin talimatlarına uyun.
- Ekipmanı açın.
- Hazneyi açın, numune kaplarını içine yerleştirin ve kapları kaplayana kadar %100 etanol ekleyin. Odayı kapatın.
- Soğut seçeneğini etkinleştirin ve sıcaklık 10 °C'ye ulaşana kadar bekleyin.
- CO2 silindir valfini açın ve Karıştırıcı seçeneğini etkinleştirin.
- CO2 seçeneğini etkinleştirin, ne kadar CO2 doldurduğunu doğrulamak için her zaman hazneyi kontrol edin. Hazne neredeyse dolduğunda, CO2 seçeneğini devre dışı bırakın ve Değiştir seçeneğini etkinleştirin, sadece kapları kaplayacak kadar yeterli CO2 olana kadar aktif tutun. Kapların her zaman CO2 ile kaplı olduğundan emin olun (yani, tüm CO2 hazneden ayrılmadan önce Değiştirme seçeneğini devre dışı bırakın). Adım 5.5 6x'i tekrarlayın.
- CO2'yi son bir kez etkinleştirin ve kaplar kapanana kadar hazneyi doldurun.
- Isı seçeneğini etkinleştirin ve Karıştırıcı seçeneğini devre dışı bırakın. CO2 silindir valfini kapatın.
- Sıcaklık 35 °C'ye yükselene kadar bekleyin; ardından Gaz çıkışı seçeneğini etkinleştirin.
NOT: Yaklaşık 30 °C'de, hazne 70-80 bar basınca ulaşır ve sıvının kaybolduğu kritik noktaya ulaşır. - Hazne basıncı 1 bar'a ulaştığında, tüm gaz içeriği giderilmiştir. Hazneyi açın ve kapları çıkarın.
- Ekipmanı kapatın.
6. Montaj
- SEM numune tutucuları hazırlayın (yani alüminyum saplamalar; Şekil 2C.4).
- Analizden sonra saplama temizliğini kolaylaştırmak için saplamaları yalnızca üst kısmı kaplayan bir parça alüminyum folyo ile sarın.
- Numune kodunu/numarasını tutucunun altına yazarak koçanları tanımlayın ve üstüne yerleştirilenin tanımlanmasını garanti edin.
- Üst kısmı çift taraflı karbon bantla kaplayın. Saplamaları bir numune tutucuya yerleştirin.
- Numune kabının kapağını açın ve kurutulmuş numuneyi forseps ve spatula kullanarak dikkatlice bir cam Petri kabına aktarın.
NOT: Kritik noktada kurumuş bahçeler, boyutu1 mm'den3 büyük olmayan parçalar halinde dikkatlice ayrılması gereken yüksek oranda paketlenmiş numuneler oluşturan topaklanma eğilimindedir. - Parçaları, bantla kaplı saplamanın yapışkan yüzeyine dikkatlice yerleştirin. Bahçe parçası banda dokunduğunda, onu (yeniden) hareket ettirmek çok zordur, bu nedenle istenmeyen yerlere veya konumlara yerleştirmemeye dikkat edin. Saplama başına en fazla dokuz parça ekleyin.
- Her örnek için 6.2 ve 6.3 adımlarını tekrarlayın.
7. Altın ile püskürtme kaplama
NOT: Numunenin kaplanması, şarj olmasını önlemek için gereklidir. Çalışma gazı basıncı (bu protokolde 0,5 × 10-1 mm Hg gaz basıncı), püskürtme süresi (220 s), altın tabakanın kalınlığı (~120 Å), akım (50 mA) ve voltaj kaynağı. Püskürtme, ortak bir iş akışını takip etme eğilimindedir, ancak farklı üreticilerin ekipmanı biraz farklı çalışabilir.
- Menteşeli hedef kolunu açın ve saplamaları numune tablasına yerleştirin.
- Menteşeli hedef kolu kapatın ve cam vakum odasının kıymık kalkanının düzgün şekilde gömülüp gömülmediğini kontrol edin.
- Argon silindir valfini açın ve ana güç anahtarını açın.
- Ekipman ekranında yükselen vakumu, ekrandaki 0.5 × 10-1 mm Hg işaretine ulaşana kadar takip edin; ardından Durulamayı etkinleştirin. İşlemi 5 kez tekrarlayın.
- Su sirkülasyon sistemini açın, HV Açık seçeneğini etkinleştirin ve altın film kapağını açın. Plazma renginin pembemsi olduğunu onaylayın. Bu protokolü takip etmek için, ~120 ş(12 nm) altın bir katman bırakacak olan 50 mA voltajla 220 s püskürtme ayarlayın.
- HV Açık otomatik olarak kapatılır. Su sirkülasyon sistemini kapatın ve altın film kapağını kapatın.
- Ana güç anahtarını kapatın ve havanın vakum odasına girmesine izin verin. Bahçe ve atık numuneleri için 7.1-7.7 adımlarını 3 kez tekrarlayın.
NOT: Numune hazırlandıktan hemen sonra görüntüleme gerçekleşmeyecekse, numunelerin yeniden sulanmasını önlemek için saplamaları silika tabakasıyla doldurulmuş hermetik bir kapta saklayın.
8. Görüntüleme
NOT: Objektif açıklık çapı, çalışma voltajı, elektron ışını sisteminin hizalanması, eksenel hizalama ve damgalayıcılar gibi SEM ayarlarını yapmak için üreticinin talimatlarını izleyin.
- Saplamaları numune tutucuya yerleştirin ve her bir numunenin konumu hakkında not alın.
NOT: Numune tutucuyu takarken veya çıkarırken eldiven giyin ve tutucuyu mümkün olduğunca temiz tutun. - İşlem yazılımını masaüstünden başlatın.
- Enstrüman ayarlarını seçin. Objektif açıklık çapı 30 μm (yani ikinci aşamada), yüksek vakumda çalışan, ikincil elektronlardan (SED) gelen sinyalleri algılayan, 20 kV hızlanma voltajı, 15 - 20 mm çalışma mesafesi, 40.0 prob akımı (yüksek akım modunda) ve büyütmeyi numuneye göre değiştiren bahçe örneklerini görselleştirin.
- Navigasyon talimatlarını izleyerek, Havalandırma simgesine basın ve numune odasının havalandırılmasını bekleyin. Bir ilerleme çubuğu, vakum durumunu gösterir.
- Atmosferik basınca ulaşıldığında, numune haznesini açın ve numune tutucuyu dikkatlice yerleştirin.
- Hazne kapısını yavaşça kapatın ve ilerleme çubuğundan vakum durumunu takip ederek cihazı boşaltmak için Evac simgesine basın. Navigasyon sistemi, hareketli tabla konumunu gösterecek ve hareket tamamlandığında bir tutucu grafiği sağlayacaktır. Görüntüleme sırasında örnekler arasında gezinmeye yardımcı olacak bir üst görünüm elde etmek için tutucunun bir fotoğrafını kaydetmek için Kamera simgesine basın.
- Elektron tabancasını açmak için Gözlem simgesine basın ve görüntünün oluşmasını bekleyin. Z eksenini manuel olarak uygun yüksekliğe hareket ettirmek için Manuel Kullanıcı Arayüzünü (manuel kontrol) kullanın (numune yüksekliğine ve belirlenen çalışma mesafesine bağlı olarak).
NOT: Tungsten filament ömrünü uzatmak için, aktif olarak görüntüleme yapılmadığında Gözlem işlevini duraklatın. - Raster hızını ve görüntü konumunu değiştirmek için ekranda gösterilen seçenekleri veya manuel kontrolü kullanın. Numunenin kapsamlı bir görünümünü elde etmek için sahneyi hareket ettirin ve belirli alanlara odaklanmak için RDC işlevini kullanın. Bir hedef (veya ilginç) yapıyı gözlemlerken, büyütmeyi, odaklamayı, parlaklığı, kontrastı ve damgalamayı buna göre ayarlayın. Sahneyi X ve Y yönlerine taşımak için Manuel Kullanıcı Arayüzünü kullanarak damgalamayı düzeltin.
- Genel bahçe özelliklerini (hif yoğunluğu, alt tabaka ve kolonizasyon modelleri gibi) görselleştirmek için büyütmeyi 100x ile 700x arasında ayarlayın.
- Mikrobiyota uzamsal modellerini görselleştirmek için büyütmeyi 700x ile 1.500x arasında ayarlayın.
- Mikrobiyota ve biyofilm fiziksel etkileşimlerini gözlemlemek için büyütmeyi 1.500x ile 3.000x arasında ayarlayın.
- Belirli mikrobiyal kümelere odaklanmak için büyütmeyi 3.000x ile 4.000x arasında ayarlayın.
- Bir görüntüyü kaydetmek için Dondur işlevini kullanın, Fotoğraf simgesine tıklayın ve dosya yolunu ayarlayın. Standart olarak, en az üç bahçe parçasını analiz edin ve her birini adım 8.8'de belirtilen tüm büyütme aralıklarında görüntüleyin. Bu, örnek başına en az 12 görüntüyle sonuçlanır, ancak daha fazla görüntü daha ayrıntılı açıklamaları destekleyebilir. Numune başına 15-25 görüntünün, adım 8.8'deki tüm büyütmeleri değiştirerek, numune açıklaması için ince ayrıntılar sağlama eğiliminde olduğunu öneriyoruz.
NOT: Bir görüntünün rasterleştirilmesi ve kaydedilmesi birkaç saniye sürer ve bu süre zarfında SEM kayan tablasındaki herhangi bir titreşimden kaçınılmalıdır. - Görüntülemeyi bitirdikten sonra, ilerleme çubuğundan vakum durumunu takip ederek odayı boşaltmak için Havalandırma seçeneğine basın. Tutucuyu dikkatlice çıkarın, hazne kapısını yavaşça kapatın ve hazneyi boşaltmak için Evac'a basın.
- Tahliye tamamlanır tamamlanmaz operasyon yazılımından çıkın.
- Bir görüntü düzenleyici kullanarak görselleştirmeyi iyileştirmek için parlaklığı ve kontrastı ayarlayın.
Sonuçlar
Burada, mantar hifleri, substrat, mikrobiyota ve biyofilmler gibi attine bahçesi ve atık örneklerinin bileşenlerini görselleştirmek için basitleştirilmiş bir protokol sunduk. SEM, bahçenin ve atığın mikrobiyotanın yapısal modellerini nasıl iskele kurduğuna dair anlayışımızı geliştirmiştir (Şekil 3). Attine bahçelerinde, mantar hifleri, substrat yüzeyinin bazı kısımlarını kaplayan dal benzeri yapılardır. Mantar hifleri dehidr...
Tartışmalar
SEM, numuneyi taramak için bir elektron ışını kullanır ve üç boyutlu mikro yapıları yüksek çözünürlükte görselleştirebilecek şekilde büyütülmüş bir görüntüsünü oluşturur. SEM yüksek vakum altında çalıştığından, numunelerden %99'a kadar/daha fazla suyun uzaklaştırılması gerekir. SEM vakum odasının içinde, kısmen hidratlanmış numuneler, saçılan elektronların yanı sıra dehidre olabilir ve çökebilir. SEM'de yüksek çözünürlüklü gö...
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, mali destek sağladığı için Fundação de Amparo à Pesquisa do Estado de São Paulo'ya (FAPESP) teşekkür eder (Hibe #2019/03746-0). MOB, FAPESP (süreç 2021/08013-0) ve Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brezilya (CAPES) - Finans Kodu 001'den alınan doktora bursu için teşekkür eder. AR ayrıca Conselho Nacional de Desenvolvimento Científico e Tecnológico'ya (CNPq) bir araştırma bursu için teşekkür eder (#305269/2018). Yazarlar, numune hazırlama için pilot testlere yardımcı oldukları için Marcia Regina de Moura Aouada ve Antonio Teruyoshi Yabuki'ye, teknik yardım için Renato Barbosa Salaroli'ye ve fotoğraf çekiminde yardımcı olduğu için Enzo Sorrentino'ya teşekkür eder. Bu çalışma, erişim genetik miras yetkilendirmesi # SISGen AA39A6D kapsamında gerçekleştirilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2 mL tube | Axygen | MCT-200-C-BRA | To fix and dehydrate samples |
| Calcium chloride anhydrous | Merck | C4901 | CaCl2 anhydrous to prepare Karnovsky’s fixative |
| Critical point dryer | Leica | EM CPD 300 | For critical point drying |
| Double Sided Carbon Conductive Tape, 12 mm (W) X 5 M (L) | Electron Microscopy Sciences | 77819-12 | For mounting samples |
| Entomological forceps | No specific supplier | To manipulate garden samples | |
| Ethyl alcohol (=ethanol), pure (≥99.5%) | Sigma-Aldrich | 459836 | For dehydration |
| Forceps | No specific supplier | To manipulate garden samples | |
| Glass beaker | No specific supplier | For dehydration | |
| Glass Petri dish | No specific supplier | To manipulate garden samples | |
| Glass pipette | No specific supplier | To fix and dehydrate samples | |
| Glutaraldehyde (Aqueous Glutaraldehyde EM Grade 25%) | Electron Microscopy Sciences | 16220 | To prepare Karnovsky’s fixative |
| Gold target | Ted Pella, Inc. | 8071 | To sputter coat with gold |
| Hydrochloric acid | Sigma-Aldrich | 320331 | For adjusting solutions pH |
| Image editor | Photoshop | any version | To adjust images |
| Paraformaldehyde (Paraformaldehyde 20% Aqueous Solution EM Grade) | Electron Microscopy Sciences | 15713 | To prepare Karnovsky’s fixative |
| Propilene recipient | No specific supplier | For maintaining alive ant colonies | |
| Scanning Electron Microscope | JEOL | IT300 SEM | For sample imaging |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | For preparing sodium cacodylate buffer |
| Spatula | No specific supplier | To manipulate garden samples | |
| Specimen containers with 15 mm dia. x 10 mm high | Ted Pella, Inc. | 4591 | For critical point drying |
| Sputter coater | Baltec | SCD 050 | To coat with gold |
| Stub (Aluminium mount, flat end pin) 12.7 mm x 8 mm | Electron Microscopy Sciences | 75520 | For mounting samples |
Referanslar
- Turner, M. G. Landscape ecology: the effect of pattern on process. Annu Rev Ecol Evol Syst. 20 (1), 171-197 (1989).
- Rietkerk, M., Van de Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Schmitz, O. J. Spatial dynamics and ecosystem functioning. PLOS Biol. 8 (5), e1000378 (2010).
- Pringle, R. M., Doak, D. F., Brody, A. K., Jocqué, R., Palmer, T. M. Spatial pattern enhances ecosystem functioning in an African savanna. PLOS Biol. 8 (5), e1000377 (2010).
- Wimpenny, J. W. Spatial order in microbial ecosystems. Biol Rev. 56 (3), 295-342 (1981).
- Martiny, J. B. H., et al. Microbial biogeography: putting microorganisms on the map. Nat Rev. Microbiol. 4 (2), 102-112 (2006).
- McCallum, G., Tropini, C. The gut microbiota and its biogeography. Nat Rev Microbiol. 22 (2), 105-118 (2024).
- Lamont, R. J., Hajishengallis, G., Koo, H. Social networking at the microbiome-host interface. Infec Immun. 91 (9), e00124-e00223 (2023).
- Welch, J. L. M., Rossetti, B. J., Rieken, C. W., Dewhirst, F. E., Borisy, G. G. Biogeography of a human oral microbiome at the micron scale. Proc Natl Acad Sci USA. 113 (6), E791-E800 (2016).
- Kim, D., et al. Spatial mapping of polymicrobial communities reveals a precise biogeography associated with human dental caries. Proc Natl Acad Sci USA. 117 (22), 12375-12386 (2020).
- Swidsinski, A., Weber, J., Loening-Baucke, V., Hale, L. P., Lochs, H. Spatial organization and composition of the mucosal flora in patients with inflammatory bowel disease. J Clin Microbiol. 43 (7), 3380-3389 (2005).
- Ibberson, C. B., Barraza, J. P., Holmes, A. L., Cao, P., Whiteley, M. Precise spatial structure impacts antimicrobial susceptibility of S. aureus in polymicrobial wound infections. Proc Natl Acad Sci USA. 119 (51), e2212340119 (2022).
- Azimi, S., Lewin, G. R., Whiteley, M. The biogeography of infection revisited. Nat Rev Microbiol. 20 (10), 579-592 (2022).
- Dejea, C. M., et al. Microbiota organization is a distinct feature of proximal colorectal cancers. Proc Natl Acad Sci USA. 111 (51), 18321-18326 (2014).
- Hanson, C. A., Fuhrman, J. A., Horner-Devine, M. C., Martiny, J. B. Beyond biogeographic patterns: processes shaping the microbial landscape. Nat Rev Microbiol. 10 (7), 497-506 (2012).
- Adade, E. E., Al Lakhen, K., Lemus, A. A., Valm, A. M. Recent progress in analyzing the spatial structure of the human microbiome: Distinguishing biogeography and architecture in the oral and gut communities. Curr Opin Endocr. 18, 275-283 (2021).
- Mony, C., Bohannan, B. J., Leibold, M. A., Peay, K., Vandenkoornhuyse, P. Microbial landscape ecology: Highlights on the invisible corridors. Front Ecol Evol. 9, 753213 (2021).
- Hölldobler, B., Wilson, E. O. . The Ants. , (1990).
- Chapela, I. H., Rehner, S. A., Schultz, T. R., Mueller, U. G. Evolutionary history of the symbiosis between fungus-growing ants and their fungi. Science. 266 (5191), 1691-1694 (1994).
- Mueller, U. G., Rehner, S. A., Schultz, T. R. The evolution of agriculture in ants. Science. 281 (5385), 2034-2038 (1998).
- Mueller, U. G., Gerardo, N. M., Aanen, D. K., Six, D. L., Schultz, T. R. The evolution of agriculture in insects. Annu Rev Ecol Evol Syst. 36, 563-595 (2005).
- Dentinger, B. T., Lodge, D. J., Munkacsi, A. B., Desjardin, D. E., McLaughlin, D. J. Phylogenetic placement of an unusual coral mushroom challenges the classic hypothesis of strict coevolution in the Apterostigma pilosum group ant-fungus mutualism. Evolution. 63 (8), 2172-2178 (2009).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proc Natl Acad Sci USA. 105, 5435-5440 (2008).
- de Fine Licht, H. H., Boomsma, J. J. Forage collection, substrate preparation, and diet composition in fungus-growing ants. Ecol Entomol. 35 (3), 259-269 (2010).
- Martin, M. M. The biochemical basis of the fungus-attine ant symbiosis: A complex symbiosis is based upon integration of the carbon and nitrogen metabolisms of the two organisms. Science. 169 (3940), 16-20 (1970).
- Grell, M. N., et al. The fungal symbiont of Acromyrmex leaf-cutting ants expresses the full spectrum of genes to degrade cellulose and other plant cell wall polysaccharides. BMC Genomics. 14, 928 (2013).
- Lange, L., Grell, M. N. The prominent role of fungi and fungal enzymes in the ant-fungus biomass conversion symbiosis. Appl Microbiol Biotechnol. 98, 4839-4851 (2014).
- Huang, E. L., et al. The fungus gardens of leaf-cutter ants undergo a distinct physiological transition during biomass degradation. Environ Microbiol Rep. 6 (4), 389-395 (2014).
- Craven, S. E., Dix, M. W., Michaels, G. E. Attine fungus gardens contain yeasts. Science. 169 (3941), 184-186 (1970).
- De Fine Licht, H. H., Boomsma, J. J., Tunlid, A. Symbiotic adaptations in the fungal cultivar of leaf-cutting ants. Nat Commun. 5 (1), 5675 (2014).
- Aylward, F. O., et al. Enrichment and broad representation of plant biomass-degrading enzymes in the specialized hyphal swellings of Leucoagaricus gongylophorus, the fungal symbiont of leaf-cutter ants. PLoS One. 10 (8), e0134752 (2015).
- Moreira-Soto, R. D., Sanchez, E., Currie, C. R., Pinto-Tomás, A. A. Ultrastructural and microbial analyses of cellulose degradation in leaf-cutter ant colonies. Microbiology. 163 (11), 1578-1589 (2017).
- Erthal Jr, M., Silva, C. P., Cooper, R. M., Samuels, R. I. Hydrolytic enzymes of leaf-cutting ant fungi. Comp Biochem. 152 (1), 54-59 (2009).
- North, R. D., Jackson, C. W., Howse, P. E. Communication between the fungus garden and workers of the leaf-cutting ant, Atta sexdens rubropilosa, regarding choice of substrate for the fungus. Physiol Entomol. 24 (2), 127-133 (1999).
- Herz, H., Hölldobler, B., Roces, F. Delayed rejection in a leaf-cutting ant after foraging on plants unsuitable for the symbiotic fungus. Behav Ecol. 19 (3), 575-582 (2008).
- Schiøtt, M., De Fine Licht, H. H., Lange, L., Boomsma, J. J. Towards a molecular understanding of symbiont function: identification of a fungal gene for the degradation of xylan in the fungus gardens of leaf-cutting ants. BMC Microbiol. 8, 40 (2008).
- Bot, A. N., Currie, C. R., Hart, A. G., Boomsma, J. J. Waste management in leaf-cutting ants. Ethol Ecol Evol. 13 (3), 225-237 (2001).
- Scott, J. J., et al. Microbial community structure of leaf-cutter ant fungus gardens and refuse dumps. PLOS One. 5 (3), e9922 (2010).
- Lewin, G. R., et al. Cellulose-enriched microbial communities from leaf-cutter ant (Atta colombica) refuse dumps vary in taxonomic composition and degradation ability. PLOS One. 11 (3), e0151840 (2016).
- Suen, G., et al. An insect herbivore microbiome with high plant biomass-degrading capacity. PLOS Genet. 6 (9), e1001129 (2010).
- Aylward, F. O., et al. Convergent bacterial microbiotas in the fungal agricultural systems of insects. MBio. 5 (6), e02077 (2014).
- Barcoto, M. O., et al. Fungus-growing insects host a distinctive microbiota apparently adapted to the fungiculture environment. Sci Rep. 10 (1), 12384 (2020).
- Francoeur, C. B., et al. Bacteria contribute to plant secondary compound degradation in a generalist herbivore system. mBio. 11, e02146-e02220 (2020).
- Martiarena, M. J. S., Deveau, A., Montoya, Q. V., Flórez, L. V., Rodrigues, A. The hyphosphere of leaf-cutting ant cultivars is enriched with helper bacteria. Microb Ecol. 86 (3), 1773-1788 (2023).
- Leal-Dutra, C. A., et al. Evidence that the domesticated fungus Leucoagaricus gongylophorus recycles its cytoplasmic contents as nutritional rewards to feed its leafcutter ant farmers. IMA Fungus. 14 (1), 19 (2023).
- Sosa-Calvo, J., Jesovnik, A., Okonski, E., Schultz, T. R. Locating, collecting, and maintaining colonies of fungus-farming ants (Hymenoptera: Myrmicinae: Attini). Sociobiology. 62 (2), 300-320 (2015).
- Karnovsky, M. J. A formaldehyde glutaraldehyde fixative of high osmolality for use in electron microscopy. J Cell Biol. 27, 137-138 (1965).
- Eltoum, I., Fredenburgh, J., Myers, R. B., Grizzle, W. E. Introduction to the theory and practice of fixation of tissues. J Histotechnol. 24 (3), 173-190 (2001).
- Gusnard, D., Kirschner, R. H. Cell and organelle shrinkage during preparation for scanning electron microscopy: effects of fixation, dehydration and critical point drying. J Microsc. 110 (1), 51-57 (1977).
- Surman, S. B., et al. Comparison of microscope techniques for the examination of biofilms. J Microbiol Methods. 25 (1), 57-70 (1996).
- Augustin, J. O., et al. Yet more "weeds" in the garden: fungal novelties from nests of leaf-cutting ants. PLOS One. 8 (12), e82265 (2013).
- Montoya, Q. V., Martiarena, M. J. S., Polezel, D. A., Rodrigues, A. More pieces to a huge puzzle: Two new Escovopsis species from fungus gardens of attine ants. MycoKeys. 46, 97 (2019).
- Varanda-Haifig, S. S., et al. Nature of the interactions between hypocrealean fungi and the mutualistic fungus of leaf-cutter ants. Antonie van Leeuwenhoek. 110, 593-605 (2017).
- Custodio, B. C., Rodrigues, A. Escovopsis kreiselii specialization to its native hosts in the fungiculture of the lower attine ant Mycetophylax morschi. Antonie van Leeuwenhoek. 112, 305-317 (2019).
- Schröttner, H., Schmied, M., Scherer, S. Comparison of 3D surface reconstruction data from certified depth standards obtained by SEM and an Infinite Focus Measurement Machine (IFM). Microchim Acta. 155, 279-284 (2006).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D., Zhou, W., Wang, Z. L. Fundamentals of scanning electron microscopy (SEM). Scanning microscopy for nanotechnology: Techniques and applications. , 1-40 (2007).
- Kannan, M., Raja, K., Subramanian, K. S., Kannan, M. Scanning electron microscopy: Principle, components and applications. A Textbook on Fundamentals and Applications of Nanotechnology. , 81-92 (2018).
- Ruffolo, J. J. Critical point drying of protozoan cells and other biological specimens for scanning electron microscopy: apparatus and methods of specimen preparation. Trans Am Microsc. 93 (1), 124-131 (1974).
- Echlin, P. Recent advances in specimen coating techniques for electron microscopy. Scanning Electron Microscopy 1981/1. , 79-90 (1981).
- Ris, H. The cytoplasmic filament system in critical point-dried whole mounts and plastic-embedded sections. J Cell Biol. 100 (5), 1474-1487 (1985).
- Bray, D. F., Bagu, J., Koegler, P. Comparison of hexamethyldisilazane (HMDS), Peldri II, and critical-point drying methods for scanning electron microscopy of biological specimens. Microsc Res Tech. 26 (6), 489-495 (1993).
- Bergmans, L., Moisiadis, P., Van Meerbeek, B., Quirynen, M., Lambrechts, P. Microscopic observation of bacteria: review highlighting the use of environmental SEM. Int Endod J. 38 (11), 775-788 (2005).
- Kirk, S. E., Skepper, J. N., Donald, A. M. Application of environmental scanning electron microscopy to determine biological surface structure. J Microsc. 233 (2), 205-224 (2009).
- Kemmenoe, B. H., Bullock, G. R. Structure analysis of sputter-coated and ion-beam sputter-coated films: a comparative study. J Microsc. 132 (2), 153-163 (1983).
- Kinden, D. A., Brown, M. F. Technique for scanning electron microscopy of fungal structures within plant cells. Phytopathology. 65, 74-76 (1975).
- Masaphy, S., Levanon, D., Tchelet, R., Henis, Y. Scanning electron microscope studies of interactions between Agaricus bisporus (Lang) Sing hyphae and bacteria in casing soil. Appl Environ Microbiol. 53 (5), 1132-1137 (1987).
- Massicotte, H. B., Melville, L. H., Peterson, R. L. Scanning electron microscopy of ectomycorrhizae potential and limitations. Scanning Microsc. 1 (3), 58 (1987).
- Visen, A., Singh, P. N., Chakraborty, B., Singh, A., Bisht, T. S. Scanning electron microscopy indicates Pseudomonad strains facilitate AMF mycorrhization in litchi (Litchi chinensis Sonn.) air-layers and improving survivability, growth and leaf nutrient status. Curr Res Microb Sci. 2, 100063 (2021).
- Fleeman, R. M., Mikesh, M., Davies, B. W. Investigating Klebsiella pneumoniae biofilm preservation for scanning electron microscopy. Access Microbiol. 5 (2), 000470-000473 (2023).
- Wells, M., Mikesh, M., Gordon, V. Structure-preserving fixation allows scanning electron microscopy to reveal biofilm microstructure and interactions with immune cells. J Microsc. 293 (1), 59-68 (2024).
- Nadell, C. D., Drescher, K., Foster, K. R. Spatial structure, cooperation and competition in biofilms. Nat Rev Microbiol. 14 (9), 589-600 (2016).
- Madsen, J. S., et al. Coexistence facilitates interspecific biofilm formation in complex microbial communities. Environ Microbiol. 18 (8), 2565-2574 (2016).
- Madsen, J. S., Sørensen, S. J., Burmølle, M. Bacterial social interactions and the emergence of community-intrinsic properties. Curr Opin Microbiol. 42, 104-109 (2018).
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nat Rev Microbiol. 17 (4), 247-260 (2019).
- Bringhurst, B., Allert, M., Greenwold, M., Kellner, K., Seal, J. N. Environments and hosts structure the bacterial microbiomes of fungus-gardening ants and their symbiotic fungus gardens. Microb Ecol. 86 (2), 1374-1392 (2023).
- Bringhurst, B., Greenwold, M., Kellner, K., Seal, J. N. Symbiosis, dysbiosis and the impact of horizontal exchange on bacterial microbiomes in higher fungus-gardening ants. Sci Rep. 14 (1), 3231 (2024).
- Vargas, S., et al. Body-plan reorganization in a sponge correlates with microbiome change. Mol Biol Evol. 40 (6), msad138 (2023).
- Apprill, A., et al. Humpback whale populations share a core skin bacterial community: towards a health index for marine mammals. PLOS One. 9 (3), e90785 (2014).
- Fraune, S., et al. Bacteria-bacteria interactions within the microbiota of the ancestral metazoan Hydra contribute to fungal resistance. ISME J. 9 (7), 1543-1556 (2015).
- Gowen, R., Gamal, A., Di Martino, L., McCormick, T. S., Ghannoum, M. A. Modulating the microbiome for Crohn's disease treatment. Gastroenterology. 164 (5), 828-840 (2023).
- Moya, P., et al. Molecular phylogeny and ultrastructure of the lichen microalga Asterochloris mediterranea sp. nov. from Mediterranean and Canary Islands ecosystems. Int J Syst Evol Microbiol. 65 (6), 1838-1854 (2015).
- Zettler, E. R., Mincer, T. J., Amaral-Zettler, L. A. Life in the "plastisphere": microbial communities on plastic marine debris. Environ Sci Technol. 47 (13), 7137-7146 (2013).
- Porter, K. R., Kallman, F. The properties and effects of osmium tetroxide as a tissue fixative with special reference to its use for electron microscopy. Exp Cell Res. 4 (1), 127-141 (1953).
- Ligon, J. J., Abraham, J. L., Boyd, A. S. Traumatic osmium tetroxide inoculation. J Am Acad Dermatol. 45 (6), 949-952 (2001).
- Friedova, N., et al. Osmium absorption after osmium tetroxide skin and eye exposure. Basic Clin Pharmacol Toxicol. 127 (5), 429-433 (2020).
- Fratesi, S. E., Lynch, F. L., Kirkland, B. L., Brown, L. R. Effects of SEM preparation techniques on the appearance of bacteria and biofilms in the Carter Sandstone. J Sediment. 74 (6), 858-867 (2004).
- Dassanayake, R. P., et al. Identification of a reliable fixative solution to preserve the complex architecture of bacterial biofilms for scanning electron microscopy evaluation. PLOS One. 15 (5), e0233973 (2020).
- Desiro, A., et al. Detection of a novel intracellular microbiome hosted in arbuscular mycorrhizal fungi. ISME J. 8 (2), 257-270 (2014).
- Morales, D. P., et al. Advances and challenges in fluorescence in situ hybridization for visualizing fungal endobacteria. Front Microbiol. 13, 892227 (2022).
- Shi, H., et al. Highly multiplexed spatial mapping of microbial communities. Nature. 588 (7839), 676-681 (2020).
- Valm, A. M., Welch, J. L. M., Borisy, G. G. CLASI-FISH: principles of combinatorial labeling and spectral imaging. Syst Appl Microbiol. 35 (8), 496-502 (2012).
- Fernandez-Brime, S., Muggia, L., Maier, S., Grube, M., Wedin, M. Bacterial communities in an optional lichen symbiosis are determined by substrate, not algal photobionts. FEMS Microbiol Ecol. 95 (3), fiz012 (2019).
- Schluter, S., Eickhorst, T., Mueller, C. W. Correlative imaging reveals holistic view of soil microenvironments. Environ Sci Technol. 53 (2), 829-837 (2018).
- Barcoto, M. O., Rodrigues, A. Lessons from insect fungiculture: from microbial ecology to plastics degradation. Front Microbiol. 13, 812143 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır