Method Article
تحليل نشاط الخلايا التائية البشرية في بيئة الزراعة المشتركة الخيفية للخلايا السرطانية المعالجة مسبقا
In This Article
Summary
يصف البروتوكول الحالي سير عمل تجريبي يسمح بتحليل خارج الجسم الحي لتحفيز الخلايا التائية البشرية في نظام زراعة خيفية مع الخلايا السرطانية المعالجة مسبقا.
Abstract
تلعب الخلايا التائية السامة للخلايا دورا رئيسيا في القضاء على الخلايا السرطانية ، وبالتالي تتم دراستها بشكل مكثف في علم مناعة السرطان. أصبح تواتر ونشاط الخلايا التائية السامة للخلايا داخل الأورام والبيئة المكروية للورم (TME) الآن مؤشرات حيوية تنبؤية وتنبؤية راسخة للعديد من أنواع الأورام. ومع ذلك ، فمن المعروف أن طرق علاج الورم المختلفة ، بما في ذلك العلاج الإشعاعي والعلاج الكيميائي والعلاج المناعي والعلاج الموجه ، لا تعدل مناعة الورم فحسب ، بل تعدل أيضا الجهاز المناعي نفسه. وبالتالي ، فإن التفاعل بين الخلايا السرطانية والخلايا التائية يتطلب دراسة أكثر كثافة في سياقات علاجية مختلفة لفهم الدور المعقد للخلايا التائية أثناء علاج الورم بشكل كامل. لتلبية هذه الحاجة ، تم تطوير بروتوكول لتحليل نشاط الخلايا التائية السامة للخلايا البشرية (CD8 +) وقدرتها على التكاثر في الزراعة المشتركة مع الخلايا السرطانية المعالجة مسبقا. على وجه التحديد ، يتم تلطيخ الخلايا التائية CD8 + من المتبرعين الأصحاء بعلامة التكاثر غير السامة كربوكسي فلورسين ثنائي الأسيتات إستر السكسينيميديل (CFSE) ويتم تحفيزها باستخدام ألواح مغلفة ب CD3 / CD28. بعد ذلك ، يتم زراعة الخلايا التائية بشكل مشترك مع الخلايا السرطانية المعالجة مسبقا. كقراءة ، يتم قياس تكاثر الخلايا التائية عن طريق قياس توزيع إشارة CFSE وتقييم التعبير عن علامات تنشيط السطح عبر قياس التدفق الخلوي. يمكن استكمال ذلك بشكل أكبر عن طريق تحديد إفراز السيتوكين باستخدام مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA). تسهل هذه الطريقة تقييم التغيرات الناجمة عن العلاج في التفاعل بين الخلايا السرطانية والخلايا التائية ، مما يوفر أساسا لتحليلات أكثر تفصيلا لطرق علاج الورم ومناعتها في بيئة الإنسان خارج الجسم الحي . بالإضافة إلى ذلك ، فإنه يساهم في تقليل التحليلات قبل السريرية في الجسم الحي .
Introduction
في الوقت الحاضر ، أصبح من الواضح أكثر من أي وقت مضى أن نمو الأورام وتقدمها يعتمدان بشدة على التلاعب الفعال وقمع الجهاز المناعي للمضيف. تظهر الخلايا المحولة كل يوم ، حتى في الكائن الحي السليم. ومع ذلك ، فإن تكوين الأورام العيانية هو حدث نادر إلى حد ما ، حيث تتم إزالة الخلايا المحولة الناشئة من الكائن الحي بكفاءة عالية. لإزالة الخلايا الخبيثة ، تدخل أنواع مختلفة من الخلايا المناعية مثل الخلايا التائية السامة للخلايا أو الخلايا التائية القاتلة الطبيعية (NK) أو الخلايا القاتلة الطبيعية أو الضامة 1،2،3. ومع ذلك ، قد تظهر أحيانا استنساخ الخلايا المحولة التي تعيش في حالة توازن مع الجهاز المناعي للمضيف ، والذي يتميز باستراتيجيات مثبطة للمناعة مختلفة لاستنساخ الخليةالسرطانية 4. في النهاية ، تكتسب بعض الخلايا المحولة وظائف إضافية تمكن الخلايا السرطانية من قمع الاستجابة المناعية بنشاط ، مما يؤدي بالتالي إلى نمو الورم. يتم التوسط في هذا التثبيط المناعي من خلال العديد من الآليات ، والتي تشمل التعبير عن الروابط المثبطة للمناعة على الخلايا السرطانية أو التجنيد النشط أو التحضير لمجموعات الخلايا المناعية المنظمة للمناعة أو المثبطة للمناعة. يوضح ما يسمى بمفهوم التحرير المناعي الدور الرئيسي للتعديل المناعي أثناء تكوين الورم ونموه5.
وبالتالي ، فليس من المستغرب أن يكون الجهاز المناعي في الوقت الحاضر محورا رئيسيا ليس فقط في علاج السرطان ولكن أيضا كعامل تنبؤي وتنبؤي في العديد من كيانات الورم والبيئات العلاجية. خلال السنوات الماضية ، ظهرت مثبطات نقاط التفتيش المناعية (ICIs) كخيارات علاجية واعدة في كيانات سرطانية صلبة مختلفة ، مثل سرطان الخلايا الحرشفية في الرأس والرقبة (HNSCC) أو سرطان الرئة ذو الخلايا غير الصغيرة (NSCLC) بهدف تعديل البيئة المكروية للورم (TME) نحو استجابة مناعية أكثر كفاءة مضادة للورم وتناقص تثبيط المناعة للخلاياالسرطانية 6. تهدف مثبطات نقاط التفتيش المناعية إلى تعزيز قتل الخلايا السرطانية بوساطة الخلايا التائية من خلال استهداف جزيئات نقاط التفتيش المناعية مثل تلك الموجودة في بروتين الموت المبرمج 1 (PD-1) ومحور الترابط 1 (PD1 / PD-L1). تؤكد هذه الحقيقة على الدور الرئيسي للخلايا التائية في المناعة المضادة للورم. في HNSCC ، على سبيل المثال ، تمت الموافقة بنجاح على ICIs كعلاج من الخط الأول في HNSCC7 المتكرر والمنتشر. تماشيا مع ذلك ، فإن وجود الخلايا التائية السامة للخلايا في TME ، بالإضافة إلى التعبير عن PD1 و PD-L1 على الخلايا السرطانية والخلايا التائية وفقا لذلك ، يمكن أن يكون بمثابة مؤشرات حيوية تنبؤية في HNSCC8،9،10.
على الرغم من أن الخلايا التائية لها دور حاسم في مناعة الورم وعلاج الورم ، إلا أن العديد من الأسئلة المفتوحة حول تفاعلاتها مع الورم لا تزال بحاجة إلى معالجة. في الوقت الحاضر ، من المعروف أن الاستجابة المناعية للورم هي عملية ديناميكية وأن مناعة الأورام يمكن أن تتغير طوال مسار المرض والعلاجات. من المعروف على نطاق واسع أن طرق العلاج المختلفة ، مثل العلاج الكيميائي (CT) أو العلاج الإشعاعي (RT) أو العلاج الموجه (TT) ، تعدل النمط الظاهري المناعي للخلايا السرطانية. يمكن أن يؤدي RT إلى زيادة تنظيم جزيئات نقاط التفتيش المناعية في أنسجة الورم وتغيير تواتر الخلايا المتسللة للورم11،12. من ناحية أخرى ، يمكن ل TT أيضا تأييد التغييرات الإيجابية داخل الورم و TME عن طريق التعديل المباشر للاستجابة المناعية التكيفية13،14،15،16. ومع ذلك ، فإن دراسة هذه التعديلات في المرضى صعبة ، لأن هذا يتطلب فحصا متكررا لأنسجة الورم أثناء العلاج. وبالتالي ، هناك حاجة إلى أنظمة نموذجية تجريبية قاطعة لدراسة النمط الظاهري المناعي الديناميكي للخلايا السرطانية والخلايا التائية ، والأهم من ذلك ، تفاعلاتها.
ومن ثم ، لغرض تحليل نشاط الخلايا التائية وتفاعلات الخلايا السرطانية والخلايا التائية ، هناك حاجة إلى اختبار شامل للزراعة المشتركة خارج الجسم الحي يسهل تنفيذه في أي مختبر بناء على عمل زراعة الخلايا المباشر وتحليلات قياس التدفق الخلوي شائعة الاستخدام. بناء على الأدبيات الحالية والمتاحة ، لم يتم نشر بروتوكول سهل الاستخدام وشائع الاستخدام فيما يتعلق بالزراعة المشتركة للخلايا التائية والخلايا السرطانية حتى الآن. على الرغم من نشر العديد من فحوصات الزراعة المشتركة للخلايا التائية وعضيات الورم مؤخرا ، إلا أن تقنية زراعة الخلايا ثلاثية الأبعاد لا تزال غير منفذة في الوقت الحاضر كتقنية قياسية في كل مختبر. وبالتالي ، فإننا نقدم بروتوكولا للاستخدام في زراعة الخلايا ثنائية الأبعاد ، والذي قد يتم إنشاؤه أيضا لزراعة الخلايا ثلاثية الأبعاد في المستقبل. غالبا ما تكون بروتوكولات الزراعة المشتركة ثنائية الأبعاد الأخرى أكثر تعقيدا ، لأنها تتطلب ، على سبيل المثال ، نقل الخلايا السرطانية مع لوسيفيراز17 أو مناسبة فقط للأورام الخبيثة الدموية (الزراعة المشتركة للخلايا التائية التي لا مثيل لها مع خلايا سرطان الدم)18. في الفحص الموصوف هنا ، يتم عزل الخلايا التائية من المتبرعين الأصحاء العاديين عن الدم المحيطي ويتم تحفيزها بالأجسام المضادة ل CD3 ومضادات CD28. بعد ذلك ، يتم زراعة الخلايا التائية بشكل مشترك مع الخلايا السرطانية المعالجة مسبقا من أجل تحليل القدرة التكاثرية للخلايا التائية بالإضافة إلى نشاطها عن طريق قياس التدفق الخلوي. وبالتالي ، يمكن بسهولة فحص تأثيرات طرق العلاج المختلفة على النمط الظاهري المناعي للخلايا السرطانية ، مثل RT أو CT أو TT ، والتي بدورها تؤثر على نشاط الخلايا التائية وتكاثرها ، واستخدامها كأساس لتحليلات ميكانيكية أعمق وتحليلات ما قبل السريرية المتتالية المختارة في الجسم الحي . يوفر الاختبار الموصوف هنا إعدادا سهل الاستخدام ، حيث لا توجد أجهزة أو تقنيات أو مواد غير تقليدية ضرورية. بالإضافة إلى ذلك ، يمكن تكييف الاختبار بسهولة مع خطوط الخلايا السرطانية المختلفة أو مجموعات فرعية محددة من الخلايا التائية (على سبيل المثال ، خلايا CD4 + T). باستخدام هذه التقنية ، يتم تحقيق توحيد قياسي عال وقابلية للتكرار.
Protocol
يتضمن هذا الاختبار سحب الدم وزراعة الخلايا الأولية البشرية. لذلك ، فإن التصويت الأخلاقي إلزامي لهذه التحليلات. جميع النتائج المقدمة في هذه المخطوطة مشمولة بالموافقة الأخلاقية لتجربة IMMO-NHD ، وتم الحصول على موافقة خطية مستنيرة من جميع المتبرعين. تم منح الموافقة من قبل مجلس المراجعة المؤسسية لجامعة فريدريش ألكسندر إرلانغن نورنبرغ في 9 نوفمبر 2022 (رقم الطلب 21-415-B). الخلايا السرطانية HSC4 المستخدمة في هذه الدراسة هي من خط الخلايا المتاح تجاريا.
يجسد هذا الاختبار جميع خطوات مقايسة الزراعة المشتركة للخلايا التائية والخلايا السرطانية ، باستخدام خط خلية سرطان الخلايا الحرشفية للرأس والرقبة (HNSCC) HSC4 في بيئة علاج تتضمن العلاج الإشعاعي (RT) واثنين من مثبطات كيناز محددة. وبالتالي ، فإن المعلمات مثل أعداد الخلايا وأوقات التربسين ومخططات العلاج خاصة بإعداد الزراعة المشتركة هذا ويجب تكييفها مع خطوط الخلايا السرطانية الأخرى (انظر أيضا قسم المناقشة). تم تنفيذ جميع خطوات الطرد المركزي في درجة حرارة الغرفة. في هذه الدراسة ، تم استخدام مثبطات كيناز AZD0156 و VE-822 لاستهداف نظام إصلاح تلف الحمض النووي (DDR) لخلايا HSC4. AZD0156 (Selleckchem) يثبط الرنح توسع الشعيرات المتحور (ATM) البروتين, بينما VE-822 (Selleckchem) يستهدف ترنح توسع الشعيرات وRad3 المرتبط بالبروتين (ATR). تمت مناقشة كلا المثبطين كعوامل محتملة لزيادة الحساسية الإشعاعية في الخلايا السرطانية. يتم إذابتها في ثنائي ميثيل سلفوكسيد (DMSO) وتخزينها عند -20 درجة مئوية. يوفر الشكل 1 مخططا انسيابيا لمقايسة خارج الجسم الحي ، يوضح بالتفصيل الزراعة المشتركة للخلايا السرطانية المعالجة مسبقا مع خلايا CD8 + T البشرية المحفزة CD3 / CD28. الكواشف والمعدات المستخدمة مدرجة في جدول المواد.
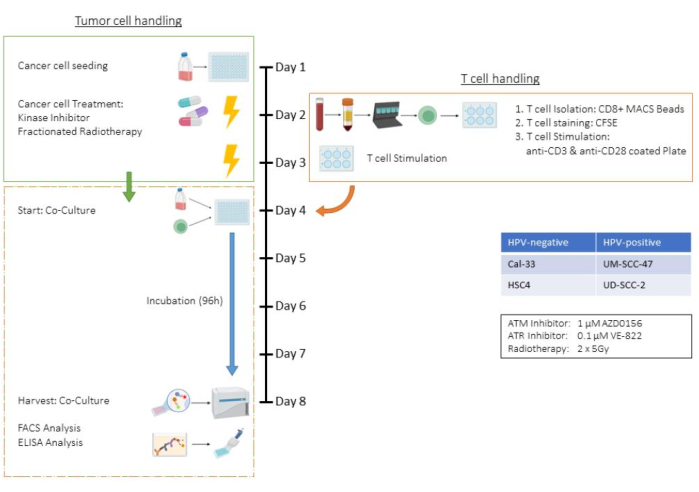
الشكل 1: مخطط انسيابي لمقايسة خارج الجسم الحي للخلايا السرطانية المعالجة مسبقا في الزراعة المشتركة مع (CD3 / CD28) حفز خلايا CD8 + T البشرية. اليوم 1: بذر الخلايا السرطانية HSC4. اليوم 2: علاج الخلايا السرطانية والعزل ، وتلوين CFSE ، والبذر في صفائح مغلفة ب CD3 / CD28 من خلايا CD8 + T البشرية. اليوم 3: علاج الخلايا السرطانية. اليوم 4: عد الآبار التمثيلية للخلايا السرطانية. حصاد وعد جميع الخلايا التائية. الزراعة المشتركة للخلايا التائية والخلايا السرطانية HSC4 بنسبة 1: 1. اليوم 5 - الأيام 8: حضانة الثقافة المشتركة. اليوم 8: حصاد الزراعة المشتركة ، وتجميد المواد الطافية ، والتلوين القائم على الأجسام المضادة ، وتحليل الخلايا عن طريق قياس التدفق الخلوي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. بذر الخلايا السرطانية (اليوم 1)
ملاحظة: التوقيت: 1 ساعة. يتم زرع الخلايا السرطانية البشرية HSC4 من زجاجات زراعة الخلايا T75 في 96 لوحة بئر.
- تخلص من المادة الطافية (D10 Medium) لزجاجة زراعة الخلايا.
- اغسل الخلايا السرطانية ب 5 مل من 37 درجة مئوية PBS دافئة. تجاهل PBS.
- نظرا لأن الخلايا السرطانية HSC4 تميل إلى الالتصاق بإحكام بقوارير زراعة الخلايا ، يوصى باستخدام التربسين على خطوتين لضمان فصل جميع الخلايا. لهذا الغرض ، أضف 3 مل من التربسين وضع الزجاجة على لوح تسخين عند 37 درجة مئوية لمدة 3 دقائق ، ثم تخلص من التربسين باستخدام ماصة.
- أضف 3 مل أخرى من التربسين ، ضع الزجاجة على لوح التسخين ، وانتظر حتى يتم الوصول إلى التعليق أحادي الخلية. تحقق مجهريا بحثا عن تعليق أحادي الخلية.
- أوقف التربسين عن طريق إضافة الحجم المزدوج من D10 Medium (DMEM مكمل بمصل بقري للجنين بنسبة 10٪ و 1٪ بنسلين ستربتومايسين) ، وقم بتعليقه جيدا ، وانقل الخلايا إلى أنبوب طرد مركزي سعة 50 مل.
- حدد عدد خلايا معلق الخلية الواحدة ، ثم احسب الكمية الإجمالية للخلايا السرطانية وفقا للحجم الإجمالي. يوصى باستخدام غرفة خلية نيوباور لتحديد عدد الخلايا.
- جهاز طرد مركزي أنبوب الطرد المركزي سعة 50 مل يحتوي على الخلايا السرطانية عند 300 × جم لمدة 5 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية.
- أعد تعليق الخلايا السرطانية HSC4 بحجم مناسب من D10 Medium للوصول إلى تركيز 15,000 خلية في وسط 200 ميكرولتر.
- وفقا للعلاجات المخطط لها للخلايا السرطانية ، قم بزرع 3 آبار على الأقل لكل حالة تحتوي على 15,000 خلية سرطانية HSC4 في وسط 200 ميكرولتر في لوحين من 96 بئرا (عينة واحدة ، 1x خلية سرطانية فقط ، 1x خلية عد جيدة ليوم الزراعة المشتركة).
ملاحظة: يعتمد رقم الخلية على خط الخلية ووقت المضاعفة. يجب فحص عدد الخلايا للعلاجات المختلفة في التجارب المسبقة لتجنب التقاء 100٪ أثناء الحضانة. - احتضان الخلايا لمدة 24 ساعة عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 والرطوبة المشبعة.
2. علاج الخلايا السرطانية (اليوم 2)
ملاحظة: التوقيت: 3-5 ساعات. بعد وقت حضانة مدته 24 ساعة ، يمكن معالجة خلايا HSC4 المصنفة مسبقا وفقا لمخطط العلاج المطلوب. في هذه الحالة النموذجية ، يتم علاج الخلايا السرطانية بمثبط ATM أو ATR. هنا ، بالإضافة إلى ذلك ، يتم أيضا تشعيع واحدة من لوحين من 96 بئرا ب 2 × 5 Gy بعد ذلك.
- تحضير مثبطات كيناز للحصول على تركيز 1 ميكرومتر AZD0156 (مثبط ATM) و 0.1 ميكرومتر VE-822 (مثبط ATR) لعلاج الخلايا السرطانية.
- عالج الخلايا السرطانية وفقا لذلك ، على سبيل المثال ، معالجة صف واحد من العينات ب 3.1 ميكرولتر من مثبط ATM وآخر ب 3.1 ميكرولتر من مثبط ATR في كل لوحة.
- بعد 3-5 ساعات من الحضانة عند 37 درجة مئوية ، قم بإشعاع لوحة واحدة ب 5 Gy.
- بعد الحضانة لمدة 24 ساعة أخرى ، قم بإشعاع نفس اللوحة مرة أخرى باستخدام 5 Gy.
3. عزل الخلايا التائية (اليوم 2)
ملاحظة: التوقيت: 4 ساعات. يتم عزل خلايا CD8 + T مغناطيسيا باستخدام MicroBeads المضادة ل CD8 من PBMCs بعد الطرد المركزي المتدرج للكثافة للدم المحيطي (PB) المشتق من متبرعين بالغين أصحاء. ثم يتم تلطيخ الخلايا التائية المعزولة ب CFSE وتحضنها في صفيحة بئر مطلية ب CD3 / CD28 للتحفيز. لتكون قادرا على العمل صديقا للموارد والمواد في الخطوات اللاحقة ، من المهم تقدير كمية الخلايا التائية اللازمة لتجارب الزراعة المشتركة. اعتمادا على المتبرع ، يمكن عزل ما بين 50،000،000 إلى 100،000،000 PBMCs من حوالي 45 مل من دم EDTA. حوالي 10٪ من إجمالي PBMCs عبارة عن خلايا CD8 + T.
- الطرد المركزي المتدرج الكثافة
- نقل 3-5 أنابيب دم EDTA سعة 9 مل مشتقة من متبرع سليم إلى أنبوبين للطرد المركزي سعة 50 مل.
- املأ كلا أنبوبي الطرد المركزي حتى 50 مل باستخدام PBS + 2٪ FBS.
- قم بإعداد ستة أنابيب طرد مركزي (مع ترصيع بلاستيكي لفصل PBMCs) وملء كل منها ب 15 مل من + 4 درجة مئوية وسط تدرج الكثافة الباردة.
- قم بتراكب وسط تدرج الكثافة بعناية ب 12-15 مل من الدم المخفف من الخطوة 3.1.2.
- جهاز طرد مركزي عند 1200 × جم لمدة 10 دقائق (لا حاجة للتباطؤ).
- تحضير صفيحة 6 آبار لتحفيز الخلايا التائية
- تحضير الأجسام المضادة: قم بإعداد محلول مضاد ل CD3 (استنساخ OKT3) بمقدار 1 مجم / مل مع PBS. قم بإعداد محلول مضاد ل CD28 (استنساخ 28.2) بمقدار 0.1 مجم / مل مع PBS.
- التوصية: استخدم الوقت أثناء الطرد المركزي (الخطوة 3.1.5) لإعداد محاليل الطلاء وطلاء الآبار نفسها لتحفيز الخلايا التائية.
- امزج 5 ميكرولتر من محلول الأجسام المضادة CD3 مع 4.995 ميكرولتر من PBS و 50 ميكرولتر من محلول الأجسام المضادة CD28 مع 4.950 ميكرولتر من PBS (التركيز النهائي: 1 ميكروغرام / ميكرولتر).
- أضف 1.000 ميكرولتر من كلا محاليل الأجسام المضادة إلى كل بئر من الصفيحة المكونة من 6 آبار.
- قم بتغطية 2 أو 3 آبار ، اعتمادا على الكمية المتوقعة من الخلايا التائية ، من الصفيحة المكونة من 6 آبار واحتضانها لمدة ساعتين على الأقل عند 37 درجة مئوية.
- تحضير وسط الخلية التائية
ملاحظة: تحضير 100x L-Lysine: قم بإذابة 200 مجم من L-Lysine hydrochloride في 50 مل من الماء المقطر في أنبوب طرد مركزي سعة 50 مل. عقيم المحلول باستخدام فلتر حقنة 0.2 ميكرومتر ونقله إلى أنبوب جديد سعة 50 مل باستخدام حقنة نضح سعة 50 مل. قم بتخزين المحلول في درجة حرارة 4-8 درجات مئوية واستخدمه في غضون 3 أشهر. تحضير 15 ملي مولار ل-أرجينين: قم بإذابة 26 ملغ من L-Arginine في 10 مل من DPBS. عقم المحلول باستخدام مرشح حقنة 0.2 ميكرومتر وانقله إلى أنبوب جديد باستخدام حقنة سعة 10 مل. قم بتخزين المحلول في درجة حرارة 4-8 درجات مئوية واستخدمه في غضون 3 أشهر.- استخدم وقت الطرد المركزي كما هو مذكور في الخطوة 1.5 لتحضير وسط الخلية التائية.
- قم بإعداد حوالي 10-30 مل من وسط الخلايا التائية ، اعتمادا على الكمية المتوقعة من الخلايا التائية.
- امزج وسط RPMI الخالي من L-Arginine و L-Lysine مع 10٪ FBS معطل حراريا ، و 1٪ بنسلين - ستربتومايسين ، 1٪ L-Arginin ، 1٪ L-Lysin و 1٪ L-Glutamin. مثال: 25.8 مل من متوسط RPMI + 3 مل من FBS + 0.3 مل من القلم / البكتيريا العقدية + 0.3 مل من L-Arginin + 0.3 مل من L-Lysin + 0.3 مل من L-Glutamin.
- قم بتخزين الوسط المتبقي عند 4 درجات مئوية خلال اليومين التاليين لاستخدامه في اليوم 4 - بداية الاستزراع المشترك. لكل جولة جديدة من التجربة بأكملها ، يوصى بإعداد وسيط ثقافة جديد.
- عزل PBMC
- بعد الطرد المركزي (الخطوة 3.1.5) ، قم بنقل المادة الطافية إلى أربعة أنابيب طرد مركزي جديدة سعة 50 مل وتخلص من الأنابيب المستخدمة.
- املأ أنابيب الطرد المركزي حتى 50 مل باستخدام PBS + 2٪ FBS.
- جهاز طرد مركزي عند 300 × جم لمدة 8 دقائق في درجة حرارة الغرفة.
- تخلص من المادة الطافية ، وأعد تعليق حبيبات الخلية في 1 مل من PBS + 2٪ FBS لكل منهما ، ودمجها في أنبوبين للطرد المركزي.
- أعد ملء الأنابيب إلى 50 مل باستخدام PBS + 2٪ FCS.
- جهاز طرد مركزي عند 120 × جم لمدة 10 دقائق في درجة حرارة الغرفة.
- تخلص من المادة الطافية ، وأعد تعليق حبيبات الخلية بعناية في 1 مل من PBS + 2٪ FBS ، واجمع بين الكريتين في صقر واحد.
- املأ أنبوب الطرد المركزي حتى 50 مل باستخدام PBS + 2٪ FBS.
- احسب العدد الإجمالي ل PBMCs باستخدام غرفة عد Neubauer. التوصية: قم بتخفيف تعليق الخلية 1:10 باللون الأزرق للعد.
- فصل الخلايا التائية CD8 +
ملاحظة: استخدم CD8 MicroBeads البشري مع أعمدة الفصل المغناطيسي (MS) والمخزن المؤقت لفرز الخلايا المنشطة المغناطيسية بالإضافة إلى (MACS +) لفصل خلايا CD8 + T مغناطيسيا وفقا لبروتوكول الشركة المصنعة (انظر جدول المواد).- جهاز الطرد المركزي PBMCs (بعد عد الخلايا) عند 300 × جم لمدة 10 دقائق.
- تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في 80 ميكرولتر من المخزن المؤقت MACS + (500 مل من PBS مكمل ب 10 ملي مولار EDTA و 0.5٪ BSA) لكل 107 خلايا (على سبيل المثال ، يتم إعادة تعليق 60،000،000 PBMCs في 6 × 80 ميكرولتر = 480 ميكرولتر عازلة).
ملاحظة: مثال: 465 مل PBS + 10 مل (0.5 متر) محلول EDTA و25 مل BSA-Stock. - أضف 20 ميكرولتر من حبيبات CD8 الدقيقة لكل 107 خلايا واخلطها بعناية عن طريق سحب العينة لأعلى ولأسفل. احتضن لمدة 15 دقيقة عند 4 درجات مئوية.
- بعد الحضانة ، اغسل الخلايا بإضافة 2 مل من المخزن المؤقت MACS + لكل 107 خلايا.
- جهاز طرد مركزي عند 300 × جم لمدة 10 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية وأعد تعليق الخلايا في 1,000 ميكرولتر من المخزن المؤقت MACs +.
- ضع عمودين MS في المغناطيس وضع أنبوبين للطرد المركزي سعة 15 مل تحتها.
- جهز الأعمدة بمخزن مؤقت 500 ميكرولتر MACS +. يمر المخزن المؤقت عبر الأعمدة ويمكن جمعه في أنابيب الطرد المركزي تحتها. يمكن أيضا إجراء هذه الخطوة بالتوازي مع الخطوة 3.5.6.
- بعد ذلك ، قم بسحب تعليق الخلية بالتساوي في أعمدة MS المعدة. يمكن جمع التدفق في نفس أنابيب الطرد المركزي. يحتوي الآن على جميع الخلايا غير المسماة والسلبية CD8.
- امسح الأعمدة عن طريق إضافة 3 × 500 ميكرولتر من المخزن المؤقت MACs +. أضف فقط حاجزا جديدا أعلى الأعمدة بمجرد أن تجف أو توقفت عن التنقيط.
- قم بتسمية الخلايا النهائية التي تم جمعها على أنها "Flow-through" أو "CD8 سلبية" وادمجها في أنبوب طرد مركزي واحد. يمكن استخدام هذا لاحقا لقياس نقاء العزل عن طريق قياس التدفق الخلوي.
- خذ أنبوب طرد مركزي جديد سعة 15 مل يسمى "خلايا CD8 + T". تتم إزالة الأعمدة من المغناطيس ووضعها على أنبوب الطرد المركزي.
- اغسل كلا العمودين اللذين يحتويان على خلايا CD8 الموجبة المغناطيسية ب 1,000 ميكرولتر من المخزن المؤقت MACS + لكل منهما. لذلك ، قم بإدخال المخزن المؤقت في الأعمدة وابدأ على الفور في دفع المحلول بعناية خارج الأعمدة باستخدام المكبس الذي توفره الشركة المصنعة.
ملاحظة: افعل ذلك لكلا العمودين ، حيث جمع 2 مل من التعليق الكلي للخلايا التائية في الطرد المركزي. - احسب العدد الإجمالي للخلايا التائية باستخدام غرفة عد نيوباور. توصية: استخدم مخففا بنسبة 1: 4 مع التريبان الأزرق.
- تلطيخ الخلايا التائية ب CFSE
- الطرد المركزي للخلايا التائية المعزولة عند 300 × جم لمدة 5 دقائق.
- أثناء الطرد المركزي ، قم بإعداد محلول تلطيخ CFSE عن طريق خلط 1.1 ميكرولتر من محلول CFSE في 10 مل من PBS. يجب أن يكون التركيز النهائي 1 ميكرومتر.
- تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في 1,000 ميكرولتر من PBS. جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق.
- تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في محلول تلطيخ CFSE 2000 ميكرولتر (1 ميكرومتر). احتضن لمدة 20 دقيقة عند 37 درجة مئوية.
- الطرد المركزي للخلايا الملطخة عند 300 × جم لمدة 5 دقائق. تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في 1,000 ميكرولتر من PBS.
- جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق. تخلص من المادة الطافية وأعد تعليق حبيبات الخلية بالكمية المناسبة من وسط الخلية التائية للوصول إلى تركيز 1.5-2 × 106 خلايا T في حوالي 3-4 مل من وسط الخلية التائية.
- بذر الخلايا التائية في صفيحة من 6 آبار
- تخلص من محلول الطلاء من اللوحة المكونة من 6 آبار.
- بذور 1.5-2 مليون خلية تائية معزولة وملطخة في 3-4 مل خلية تائية وسط لكل بئر.
- احتضان الخلايا التائية عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لمدة 48 ساعة القادمة
ملاحظة: اضبط كثافة البذر دائما على 1.5 مليون خلية / 3 مل. تجنب زرع الخلايا التائية بكثافة أقل. من الممكن وجود كثافة أعلى ، ولكن يجب اختبارها.
4. بداية الثقافة المشتركة (اليوم 4)
ملاحظة: التوقيت: 2 ساعة. بعد تحديد عدد خلايا الخلايا السرطانية HSC4 ، تتم إضافة الخلايا التائية إلى الألواح المكونة من 96 بئرا بنسبة 1: 1.
- حصاد بئر واحد لكل حالة لتحديد عدد الخلايا التمثيلية
- تخلص من المادة الطافية للبئر التي تم زرعها بشكل مثالي لتحديد عدد الخلايا.
- أولا ، اغسل الخلايا ب 100 ميكرولتر PBS ، ثم تخلص من PBS.
- أضف 100 ميكرولتر من التربسين واحتضنه لمدة 5 دقائق على لوح تسخين. ثم قم بإعادة تعليق وفحص معلق الخلية الواحدة تحت المجهر ؛ إذا لم تنفصل الخلايا ، أضف 50 ميكرولتر أخرى من التربسين.
- بمجرد انفصال جميع الخلايا ، أوقف تفاعل التربسين عن طريق إضافة 100 ميكرولتر (أو 150 ميكرولتر إذا تمت إضافة 50 ميكرولتر إضافي من التربسين من قبل) من وسط D10 وإعادة تعليقه.
- انقل الحجم الكامل البالغ 200 ميكرولتر من البئر إلى أنبوب عينة سعة 1.5 مل واستخدم 100 ميكرولتر لقياس عدد الخلايا. تذكر ضبط رقم الخلية المقاسة على حجم العينة.
- تلطيخ الخلايا السرطانية HSC4 بصبغة تتبع الخلايا الفلورية غير السامة
- قم بإعداد متتبع الخلية (انظر جدول المواد) عن طريق إذابة 2 ميكرولتر في 20 مل PBS (التركيز النهائي 0.1 ميكرومتر وفقا للشركة المصنعة).
- Pipet وسيط D10 من جميع الآبار التي تحتوي على خلايا سرطانية والتخلص منه.
- أضف 200 ميكرولتر من محلول تعقب الخلايا إلى آبار الخلايا السرطانية. احتضن لمدة 20 دقيقة عند 37 درجة مئوية.
- بعد الحضانة ، تخلص من محلول التلوين واغسله بإضافة 100 ميكرولتر من PBS. بعد ذلك ، تجاهل أيضا PBS.
- أضف 200 ميكرولتر من وسط D10 الطازج.
- حصاد الخلايا التائية (صفيحة 6 آبار)
- إعادة تعليق الخلايا التائية بعناية في وسطها ؛ معظم الخلايا التائية معلقة ويمكن حصادها ببساطة عن طريق إخراجها من بئرها.
- تحقق مجهريا مما إذا كانت الآبار فارغة ؛ إذا لم يكن الأمر كذلك ، فقم بالحصاد باستخدام 1,000 ميكرولتر من التربسين ، ضع اللوحة على لوح تسخين عند 37 درجة مئوية حتى تنفصل الخلايا التائية ، ثم أوقف التفاعل بإضافة 1,000 ميكرولتر من PBS أو وسط الخلية التائية (اختياري).
- عد الخلايا التائية باستخدام غرفة عد نيوباور. ثم الطرد المركزي للخلايا التائية عند 300 × جم لمدة 5 دقائق.
- أعد تعليق الخلايا التائية في وسط الخلية التائية (استخدم نفس الوسط المحضر في اليوم 2 عزل الخلايا التائية) إلى تركيز نهائي يبلغ 10,000 خلية تائية لكل 20 ميكرولتر.
- إضافة الخلايا التائية إلى الخلايا السرطانية HSC4 (لوحة 96 بئر)
- أضف الكمية المطلوبة من الخلايا التائية إلى آبار الخلايا السرطانية وفقا لعدد الخلايا السرطانية المحددة مسبقا بنسبة 1: 1.
- حافظ على خلية ورمية واحدة جيدا لكل حالة خالية من الخلايا التائية كعنصر تحكم "للخلايا السرطانية فقط". يتيح التحكم في "الخلية السرطانية الوحيدة" البوابة الدقيقة لبيانات التدفق.
- أضف 200 ميكرولتر من تعليق الخلية التائية إلى بئر فارغ كعنصر تحكم "خلية تائية فقط" (200,000 خلية T). يتيح عنصر التحكم "الخلية التائية فقط" البوابة الدقيقة لبيانات التدفق.
- احتضان الاستزراع المشترك لمدة 96 ساعة (37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2)
5. القياس الكمي لتكاثر الخلايا التائية عن طريق قياس التدفق الخلوي (اليوم 7)
ملاحظة: التوقيت: 3 ساعات. بعد احتضان الزراعة المشتركة لمدة 96 ساعة أخرى ، يتم حصاد الآبار وتلطيخها بمزيج من الأجسام المضادة تحتوي على أجسام مضادة مختلفة اعتمادا على فرضية البحث (على سبيل المثال ، الأجسام المضادة ل CD3 و CD8 و HLA-DR و CD25). بعد ذلك ، يتم تحليل الخلايا عن طريق قياس التدفق الخلوي متعدد الألوان.
- إعداد ونقش مجموعة من أنابيب FACS وأنابيب الطرد المركزي الدقيقة لكل بئر يتم حصادها.
- حصاد الخلايا
- أعد تعليق الخلايا في وسطها وانقلها إلى أنابيب FACS.
- اغسل الخلايا باستخدام 100 ميكرولتر من PBS ، ثم انقلها إلى أنابيب FACS.
- أضف 100 ميكرولتر من التربسين إلى الآبار واحتضن على لوح التسخين (37 درجة مئوية) لمدة 5 دقائق.
- أعد تعليق الخلايا ، ثم تحكم مجهريا إذا تم فصل جميع الخلايا. إذا كان الأمر كذلك ، فقم بنقل معلق الخلية المثقببة إلى أنابيب FACS.
- تحقق مجهريا إذا كانت جميع الآبار فارغة ؛ إذا لم يكن الأمر كذلك، فكرر الخطوات 5.2.3-5.2.4.
- جمع الطاف للثقافة المشتركة لمزيد من التجارب
- جهاز طرد مركزي الأنابيب المملوءة بالخلايا عند 300 × جم لمدة 5 دقائق.
- قم بسحب حوالي 300 ميكرولتر من المادة الطافية بعناية من الأنابيب إلى مجموعة مختلفة من أنابيب الطرد المركزي الدقيقة ليتم تجميدها عند -20 درجة مئوية. يمكن استخدام المادة الطافية لاحقا لإجراء ، على سبيل المثال ، فحوصات ELISA من أجل تحديد كمية السيتوكينات المفرزة.
- تلطيخ الخلايا بالأجسام المضادة لإجراء قياس التدفق الخلوي
- تحضير مزيج الأجسام المضادة: أضف 5 ميكرولتر من البرتقال المضاد ل CD3-Krome ، و 0.5 ميكرولتر من مضاد CD8-PerCE-Cyp5.5 ، و 1 ميكرولتر من مضاد HLA-DR-APCVio770 ، و 2.5 ميكرولتر من مضاد CD25-PE-Dazzle إلى 91 ميكرولتر من المخزن المؤقت PBS / FACS.
- أضف 200 ميكرولتر من المخزن المؤقت FACS (PBS مكمل بنسبة 2٪ FBS و 2٪ EDTA) إلى كل أنبوب وأعد تعليقه.
- جهاز الطرد المركزي مرة أخرى عند 300 × جم لمدة 5 دقائق. تخلص من المادة الطافية وأعد تعليق الخلايا في 100 ميكرولتر من مزيج الأجسام المضادة المعد مسبقا (الخطوة 5.4.1). احتضن لمدة 30-45 دقيقة عند 4 درجات مئوية في الثلاجة المحمية من الضوء.
- بعد الحضانة ، جهاز الطرد المركزي عند 300 × جم لمدة 5 دقائق. تخلص من المادة الطافية وأعد تعليق الخلايا في 100 ميكرولتر من المخزن المؤقت FACS.
- قم بإجراء قياس التدفق الخلوي على مقياس خلوي قادر على تمييز جميع الأجسام المضادة الفلورية المذكورة أعلاه وإشارة CSFE.
6. استراتيجية البوابات وتحليل البيانات
- استبعاد الزوجيات وتحديد مجموعة الخلايا التائية الصحيحة (الشكل 2 أ).
- استبعاد عدد المضاعفات بناء على الآجل مقابل منطقة الانتثار الجانبية (FSC-A مقابل SSC-A) (Singlets).
- مؤامرة "Singlets" لتحديد الخلايا التائية بناء على الأمام مقابل منطقة الانتثار الجانبية (FSC-A مقابل SSC-A) (الخلايا التائية).
ملاحظة: للحصول على أفضل استبعاد للحجم ، قم بقياس عينات "الخلايا التائية فقط" و "الخلايا السرطانية فقط" بالتوازي (الشكل 2 ب). - ارسم تعبير CD3 ضد SSC-A للتمييز بين الخلايا التائية. علاوة على ذلك ، يمكن تحديد الخلايا التائية الإيجابية CD8 عن طريق رسم إشارة CD8 مقابل SSC-A. جميع الخلايا التائية هي CD3 + / CD8 + (خلايا CD8 + T) (الشكل 2 أ).
- ارسم إشارة CFSE لجميع "خلايا CD8 + T" كرسم بياني.
ملاحظة: بوابات السكان الفرعيين غير التكاثريين (أعلى إشارة CFSE) ، والسكان الفرعيين التكاثريين (جميع الخلايا التائية ذات إشارة CFSE المنخفضة) ، والسكان الفرعيين التكاثريين للغاية (جميع الخلايا التائية من ذروة CFSE4 أو أقل كثافة).
- تحليل علامات السطح المرتبطة بالنشاط على مجموعة الخلايا التائية
- اتبع خطوات البوابة (الخطوة 6.1) (الشكل 3 أ).
- الخيار أ: اختر "خلايا CD8 + T" كمدخلات وقم بتحليلها لتعبير CD25 أو HLA-DR عن طريق رسم مضان علامة السطح المعنية مقابل خصائص SSC-A.
ملاحظة: إذا كان من الممكن اكتشاف مجموعة سكانية فرعية عالية CD25 مميزة ، يوصى ببوابة السكان المرتفعين CD25. الأمر نفسه ينطبق على بوابات / تحليل HLA-DR على الخلايا التائية (الشكل 3 ب). - الخيار ب: اختر "خلايا CD8 + T" كمدخلات وقم بتحليلها لتعبير CD25 أو HLA-DR عن طريق رسم مضان علامة السطح المعنية مقابل خصائص SSC-A.
ملاحظة: إذا لم يكن هناك مجموعة سكانية فرعية مميزة يمكن اكتشافها (تعتمد على علامة السطح التي تم تحليلها) ، فمن المستحسن تحليل تحول متوسط شدة التألق (MFI) لمجموعة الخلايا التائية بأكملها (الشكل 3 ج).
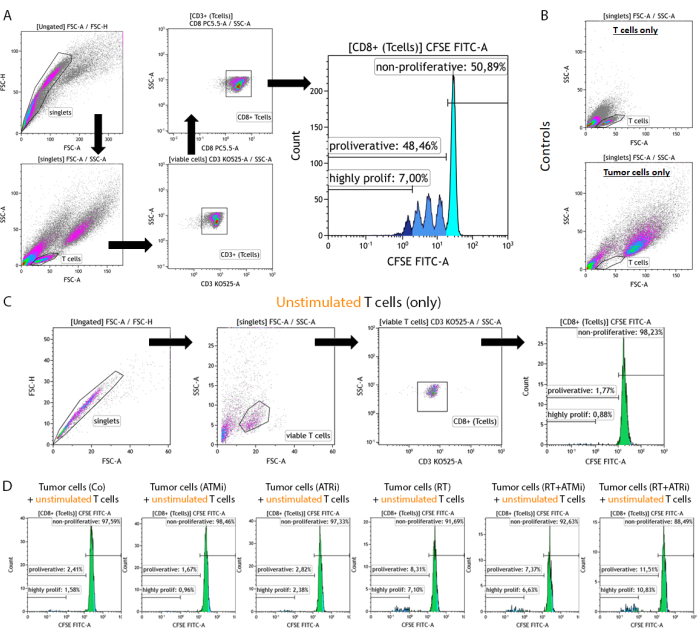
الشكل 2: استراتيجية البوابات للخلايا التائية الملطخة ب CFSE والمحفزة مسبقا لتحليل التكاثر بعد 96 ساعة من الزراعة المشتركة مع الخلايا السرطانية HNSCC المعالجة مسبقا. يتم حصاد الخلايا التائية والخلايا السرطانية بعد 96 ساعة من الزراعة المشتركة من صفيحة مكونة من 96 بئرا ، وتلطيخها باستخدام علامة سطح خاصة بالخلايا التائية ، ويتم قياسها باستخدام جهاز قياس التدفق الخلوي. (أ) تم استبعاد الزوجات بناء على FSC-A / FSC-H ، وتم بوابات الخلايا التائية أولا حسب الحجم (FSC-A / SSC-A). تم تحليل الخلايا التائية بشكل أكبر من أجل تعبيرها CD3 (مضاد CD3 Krome Orange) و CD8 (anti-CD8 PerCP-Cy5.5). تم رسم الخلايا التائية CD3 + / CD8 + في رسم بياني ، وتم تحليل شدة إشارة CFSE. تمثل إشارة CFSE مجموعات فرعية للخلايا التائية ذات سلوك انتشار متنوع. تم تعريف الخلايا التائية ذات أعلى إشارة CFSE على أنها "غير تكاثرية". تم تلخيص جميع المجموعات الفرعية التي تظهر فقدان إشارة CFSE ، الناجمة عن انقسام الخلايا الذي يؤدي إلى نصف الإشارة ، في قمم مميزة على أنها "تكاثرية". تم تعريف الخلايا التائية التي انقسمت أكثر من ثلاث مرات (أكثر من ثلاث قمم إشارة CSFE) على أنها "شديدة التكاثر". (ب) كعنصر تحكم ، يتم قياس العينات التي تتكون فقط من الخلايا التائية المحفزة مسبقا والخلايا السرطانية المعالجة مسبقا فقط. يمكن تمييز الخلايا التائية والخلايا السرطانية HSC4 حسب الحجم باستخدام FSC-A مقابل. إشارة SCC-A. علاوة على ذلك ، تم تحليل خلايا CD8 + T غير المحفزة للتحقق من تنشيط الخلايا التائية بناء على الزراعة المشتركة مع الخلايا السرطانية الخيفية وحدها. (ج) كعنصر تحكم ، تم تضمين حضانة الخلايا التائية غير المحفزة الملطخة ب CFSE لمدة 96 ساعة بالتوازي مع الزراعة المشتركة. (د) تمت زراعة الخلايا التائية غير المحفزة والملطخة ب CFSE مع الخلايا السرطانية المعالجة مسبقا. بعد 96 ساعة ، تم حصاد الخلايا ، وتم قياس إشارة CFSE باستخدام الإجراء القياسي. لم تظهر الخلايا التائية غير المحفزة أي تكاثر سواء بمفردها أو بعد الزراعة المشتركة مع الخلايا السرطانية المعالجة مسبقا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
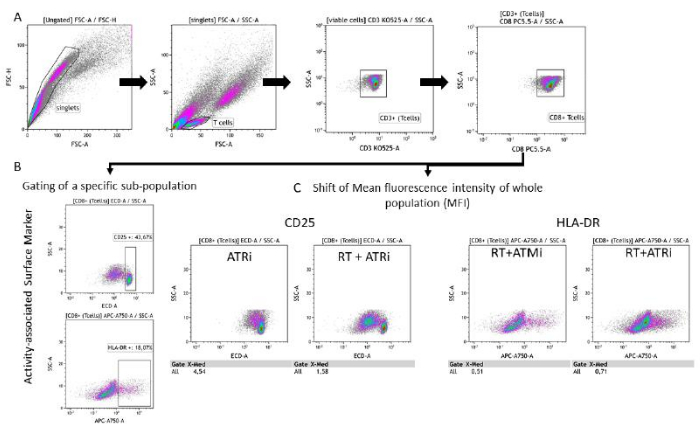
الشكل 3: استراتيجية البوابات لتعبير علامة السطح (CD25 و HLA-DR) المرتبطة بنشاط الخلايا التائية بعد 96 ساعة من الزراعة المشتركة مع خلايا HNSCC المعالجة مسبقا. (أ) تم استبعاد الزوجات بناء على خصائص FSC-A / FSC-H ، وتم بوابات الخلايا التائية أولا حسب الحجم (FSC-A / SSC-A). تم تحليل الخلايا التائية بشكل أكبر من أجل تعبيرها CD3 (مضاد CD3 Krome Orange) و CD8 (anti-CD8 PerCP-Cy5.5). يمكن إجراء بوابات علامات النشاط CD25 (anti-CD25 PEDazzle594) و HLA-DR (anti-HLA-DR APC-Vio770) على سطح الخلية التائية في إعدادين مختلفين. (ب) بوابات جميع خلايا CD8 + T للنسبة المئوية لمجموعةسكانية فرعيةعالية CD25 أو HLA-DR عالية بناء على مخططات الكثافة. (ج) بدلا من ذلك ، يتم إجراء قياس إزاحة MFI لمجموعة الخلايا التائية CD8 + بأكملها لكلا علامات النشاط. يتم عرض صور تمثيلية من تحليل تعبير علامة سطح الخلية التائية بعد الزراعة المشتركة مع الخلايا السرطانية HSC4. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
تم زرع الخلايا السرطانية HSC4 المشتقة من HNSCC واحتضانها طوال الليل. بعد 24 ساعة ، عولجت الخلايا بمثبط كيناز. بعد 3 ساعات ، تم تطبيق أول جرعتين من 5 غراي لكل كسر. بعد 24 ساعة ، تم تطبيق الجرعة الثانية ، وتم احتضان الخلايا مرة أخرى بين عشية وضحاها. في موازاة ذلك ، قبل 48 ساعة من بدء الزراعة المشتركة ، تم عزل الخلايا التائية من دم متبرع سليم. أولا ، تم عزل PBMCs باستخدام أنابيب الطرد المركزي المتدرجة الكثافة ووسط فصل معقم. تم حساب PBMCs باستخدام غرفة عد الخلايا ، وتم عزل خلايا CD8 + T باستخدام مجموعة عزل الخلايا التائية CD8 +. ثم تم تلطيخ خلايا CD8 + T المعزولة ب CFSE (1 ميكرومتر) وتم عدها لاحقا. تم زرع الخلايا التائية في صفائح بئر مغلفة مسبقا CD3 / CD28 بكثافة 1.5 × 106 خلايا / 3 مل. بعد 48 ساعة من التحفيز ، تم حصاد الخلايا التائية وعدها وإعادة تعليقها بكثافة 10,000 خلية / 10 ميكرولتر. بالإضافة إلى ذلك ، تم حصاد الآبار التمثيلية للخلايا السرطانية المصنفة وحسابها ، وتم استبدال الوسط بجميع الآبار المتبقية. تمت إضافة الخلايا التائية إلى الخلايا السرطانية بنسبة 1: 1. تم حصاد الزراعة المشتركة بعد 96 ساعة ، وتم تخزين المادة الطافية عند -20 درجة مئوية ، وتم تلطيخ الخلايا وقياسها بواسطة قياس التدفق الخلوي (الشكل 1).
تم تحديد الخلايا التائية من خلال استبعاد الحجم وإيجابية CD3 / CD8. أظهرت إشارة CFSE للخلايا الإيجابية CD3 + / CD8 + توزيع الخلايا التائية غير التكاثرية (إشارة CFSE عالية) ومجموعات سكانية فرعية متميزة من الخلايا التائية المتكاثرة (فقدان شدة إشارة CFSE). تم قياس نسبة الخلايا التائية المتكاثرة بشكل مثالي لخط خلايا HSC4 HNSCC (الشكل 4 أ). تم تعريف جميع الخلايا التائية التي أظهرت انقساما واحدا على الأقل على أنها "تكاثرية". تم تعريف الخلايا التائية التي أظهرت أكثر من 3 أقسام على أنها "شديدة التكاثر" (الشكل 4 ب). بالنسبة لخط الخلايا السلبي لفيروس الورم الحليمي البشري HSC4 ، تم الكشف عن زيادة طفيفة في معدل التكاثر عندما تمت زراعة الخلايا التائية بشكل مشترك مع الخلايا السرطانية المشععة. أدى RT و RT بالإضافة إلى تثبيط ATR إلى زيادة كبيرة في تكاثر الخلايا التائية المتتالية عند مقارنتها بالثقافات المشتركة ل RT بالإضافة إلى خلايا HSC4 المعالجة بتثبيط ATM مع الخلايا التائية. فيما يتعلق بالجزء "التكاثري للغاية" للخلايا التائية ، كانت المعالجة المسبقة لخلايا HSC4 مع RT بالإضافة إلى تثبيط ATR هي الأكثر فاعلية في تحفيز تكاثر الخلايا التائية (الشكل 4 ب).
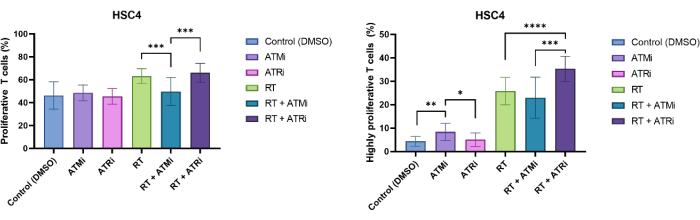
الشكل 4: تكاثر الخلايا التائية الملطخة ب CFSE لتحليل التغيرات المعتمدة على العلاج HSC4 في تكاثر الخلايا التائية. (أ) نسبة الخلايا التائية المتكاثرة بعد 96 ساعة من الزراعة المشتركة مع الخلايا السرطانية HSC4 السلبية المعالجة مسبقا. كان تكاثر الخلايا التائية أقل بشكل ملحوظ بعد الزراعة المشتركة مع الخلايا السرطانية المعالجة ب RT + ATMi عند مقارنتها بعلاج RT أو RT بالإضافة إلى ATRi. (ب) RT للخلايا السرطانية HSC4 تسبب في جزء أعلى من الخلايا التائية عالية التكاثر (أكثر من ثلاثة انقسامات خلاوية). بعد الزراعة المشتركة للخلايا السرطانية HSC4 المعالجة مسبقا RT + ATRi مع الخلايا التائية ، كانت النسبة المئوية للخلايا التائية عالية التكاثر هي الأعلى. تظهر الأشرطة بيانات من أربع تجارب مستقلة مع الخلايا التائية من أربعة متبرعين مستقلين وأصحاء (ن = 4 ؛ يعني ± SD). (* ص≤ 0.05 ، ** ص ≤ 0.01 ، *** ص ≤ 0.001 ، **** ص ≤ 0.0001 ؛ تم اختبار الدلالة الإحصائية من خلال مقارنة جميع الظروف التجريبية مقابل كل منها باستخدام Mann-Whitney-U ثنائي الذيل للبيانات غير الموزعة بشكل طبيعي). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
يمكن استخدام فقدان CFSE القائم على الانتشار لتحديد معدل تكاثر الخلايا التائية. علاوة على ذلك ، توصف العديد من علامات سطح الخلية بأنها مرتبطة بنشاط الخلايا التائية ، مثل CD25 و HLADR. لذلك ، تم إجراء تحليل CD25 و HLA-DR على سطح جميع خلايا CD3 + و CD8 + T عن طريق قياس التدفق الخلوي (الشكل 5). يمكن تحديد التعبير كميا إذا كانت المجموعاتالفرعية العالية المميزة CD25 أو HLA-DR عالية يمكن اكتشافها ويمكن تمييزها عن طريق بوابات هذه الخلايا الإيجابية للغاية (الشكل 3 ب). إذا لم يكن من الممكن اكتشاف مجموعات سكانية فرعية مميزة ، فيمكن قياس متوسط شدة التألق (MFI) لجميع السكان ، ويمكن قياس التحولات القائمة على الحالة في MFI (الشكل 3 ج).
على سبيل المثال ، تم تحليل التعبير الذي حدده MFI ل CD25 و HLA-DR بعد 96 ساعة من الزراعة المشتركة مع الخلايا السرطانية HSC4 المعالجة مسبقا (الشكل 5). بعد الزراعة المشتركة للخلايا التائية مع الخلايا السرطانية HSC4 المعالجة بتقنية RT ، تم تنظيم التعبير عن CD25 على الخلايا التائية بقوة. والجدير بالذكر أن المعالجة المسبقة للخلايا السرطانية باستخدام ATMi فقط أدت إلى انخفاض كبير في التعبير عن CD25 مقارنة بالمعالجة المسبقة ل ATRi. في الإعداد المشترك مع RT ، على الرغم من أن RT أدى إلى انخفاض التعبير عن CD25 على الخلايا التائية ، أدى الجمع بين RT و ATMi إلى زيادة التعبير عن CD25 عند مقارنته ب RT plus ATRi (الشكل 5 أ). فيما يتعلق بالتعبير عن HLA-DR على الخلايا التائية ، أدى RT بشكل عام إلى تنظيم HLA-DR ، ولكن مرة أخرى ، بالاشتراك مع ATMi أو ATRi ، لوحظ سلوك مختلف (الشكل 5 ب). زادت الخلايا التائية المزروعة مع خلايا HSC4 التي تمت معالجتها مسبقا بمزيج من RT + ATRi من التعبير عن HLA-DR مقارنة ب RT وحده أو RT + ATMi.
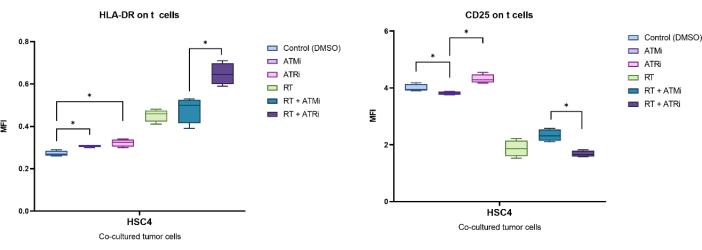
الشكل 5: التعبير عن علامات التنشيط CD25 و HLA-DR على سطح الخلايا التائية بعد 96 ساعة من الزراعة المشتركة مع الخلايا السرطانية HSC4 المعالجة مسبقا. تم تحليل التعبير عن CD25 و HLA-DR بناء على تحول MFI لمجموعة الخلايا التائية بأكملها. أدى RT من HSC4 إلى انخفاض التعبير عن CD25 على الخلايا التائية وزيادة التعبير عن HLA-DR. أدى الجمع بين RT و ATMi إلى أنماط تعبير مختلفة بشكل كبير عند مقارنتها ب RT plus ATRi. تظهر المخططات الصندوقية بيانات من أربع تجارب مستقلة مع الخلايا التائية من أربعة متبرعين مستقلين وأصحاء (ن = 4 ؛ يعني ± SD). تم تحليل البيانات من خلال مقارنة جميع الظروف التجريبية مع بعضها البعض باستخدام اختبار Mann-Whitney-U ثنائي الذيل للبيانات غير الموزعة بشكل طبيعي (* ص ≤ 0.050). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تشير هذه البيانات بشكل مثالي إلى أن علاج الخلايا السرطانية ، في هذه الحالة لخلايا HSC4 HNSCC ، يؤثر على مناعة الخلايا السرطانية. يمكن مراقبة ذلك عن طريق الزراعة المشتركة للخلايا السرطانية مع الخلايا التائية المحفزة مسبقا ، مما يؤدي إلى سلوك تكاثر متنوع وتعبير عن علامات التنشيط على الخلايا التائية البشرية بناء على نظام علاج الخلايا السرطانية المطبق.
Discussion
يقدم البروتوكول المقدم هنا طريقة سريعة وسهلة لتحليل القدرة التكاثرية للخلايا التائية جنبا إلى جنب مع حالة تنشيطها في بيئة زراعة مشتركة مع الخلايا السرطانية المعالجة مسبقا. وبالتالي ، يمكن بسهولة فحص تأثيرات طرائق العلاج المختلفة ، مثل RT أو CT أو TT ، على نشاط الخلايا التائية وتكاثرها ، مما يبني الأساس للتحليلات المناعية الأعمق اللاحقة للأساليب الواعدة. تثبت النتائج التمثيلية الموضحة في هذه المخطوطة أن مقايسة الزراعة المشتركة للخلايا التائية الخيفية تعمل بشكل جيد. لوحظت اختلافات كبيرة في تكاثر الخلايا التائية ، وكذلك في نشاط الخلايا التائية ، للزراعة المشتركة مع خلايا HSC4 البشرية المعالجة مسبقا (HNSCC) (الشكل 4 والشكل 5). وجد أن علاج HSC4 إما ب RT وحده أو بالاشتراك مع TT أدى إلى زيادة تكاثر الخلايا التائية ، لا سيما فيما يتعلق بالجزء التكاثري للغاية للخلايا التائية (الشكل 4). تماشيا مع التقدير الكمي لمعدل الانتشار ، تأثرت حالة تنشيط الخلايا التائية أيضا بشكل تفاضلي بأنظمة العلاج المختلفة. باختصار ، أدى تطبيق RT إلى تقليل تنظيم التعبير عن CD25 على الخلايا التائية ، في حين تم تنظيم التعبير عن HLA-DR. يؤدي RT إلى تلف الحمض النووي في الخلايا السرطانية المشععة ، مما يؤدي بدوره إلى استجابات الإجهاد الخلوي التي تشمل إطلاق الجزيئات والسيتوكينات المرتبطة بالإجهاد والضرر ، بالإضافة إلى التعبير عن روابط سطح الخلية المعدلةللمناعة 19.
يعمل الجمع بين RT و TT في شكل مثبطات لإصلاح الحمض النووي على تعزيز هذه التأثيرات والحفاظ عليها ، حيث لا تستطيع الخلايا السرطانية إصلاح تلف الحمض النووي الناجم عن RT بكفاءة. قد يؤدي ذلك إلى تعزيز وإفراز العوامل المناعية والتعبير عن روابط سطح الخلية المناعيةوالحفاظ عليها 20. وفقا لذلك ، أثبتنا سابقا أن علاج الخلايا السرطانية (HNSCC) بمثبطات تلف RT و DNA يغير النمط الظاهري المناعي على سطح الخلية السرطانية. تضمن تعديل النمط الظاهري المناعي تنظيم جزيء تحفيز المناعة ICOS-L بالإضافة إلى الجزيء المثبط للمناعة PD-L111. استجابة لهذا التعديل للنمط الظاهري المناعي للخلية السرطانية ، قد تنظم الخلايا التائية التعبير عن علامات التنشيط على سطح الخلية أيضا. علاوة على ذلك ، من المعروف أن RT يحفز إطلاق السيتوكينات المؤيدة للالتهابات ، مثل IFNγ أو IL-6 ، والتي بدورها تؤثر على تكاثر الخلايا التائيةونشاطها 21. يعد التعبير عن علامات التنشيط على الخلايا التائية عملية ديناميكية للغاية. أظهرت البيانات من Zimmerman et al.22 أن CD25 يتم التعبير عنه بشكل كبير بعد 24 ساعة من التحفيز ولكن يتم تنظيمه مرة أخرى بعد 96 ساعة بعد التحفيز. هذا يتماشى مع النتائج التي توصلنا إليها. في المقابل ، HLA-DR هي علامة تنشيط في المرحلة المتأخرة وتسبقها عموما زيادة CD25 و CD6923. ومن الجدير بالملاحظة أن الجمع بين RT + ATRi يؤدي إلى تنظيم HLA-DR بشكل كبير على الخلايا التائية مقارنة ب RT + ATMi. تتماشى هذه النتيجة مع عمل Dillion et al. الذين أظهروا التأثيرات التآزرية ل ATRi + RT في إحداث TME24 الالتهابي. تم تحقيق تعديل أقل وضوحا لنشاط الخلايا التائية وتكاثرها عن طريق معالجة الخلايا السرطانية بمثبطات كيناز وحدها (الشكل 5). قد يكون هذا بسبب حقيقة أن مثبطات إصلاح الحمض النووي ATMi و ATRi تعمل كمحسن لتلف الحمض النووي الناجم عن RT ، وبالتالي فهي ليست منعية للغاية عند تطبيقها كعلاج أحادي. لقد أظهرنا بالفعل الحد الأدنى من سمية ATMi أو ATRi وحده11. باختصار ، تؤكد النتائج الإمكانات المناعية ل RT (و TT مع مثبطات تلف الحمض النووي) وتشير أيضا إلى أن هذا النظام التجريبي مناسب لفحص القدرات المنحفة المناعية لطرق العلاج المتميزة في خلايا سرطان الرأس والرقبة البشرية.
على الرغم من أن الطريقة المعروضة هنا سهلة وقوية ، إلا أن هناك بعض الخطوات الحاسمة في البروتوكول التي يجب مراعاتها مسبقا. من الضروري وجود تركيزات عالية من EDTA أثناء عملية العزل ، وكذلك أثناء تحليل التدفق الخلوي للخلايا التائية. وبالتالي ، يوصى بجمع دم المتبرع في أنابيب تجميع مغلفة ب EDTA واستخدام عازلة MACS مكملة ب 10 ملي مولار EDTA لضمان عزل الخلايا التائية بكفاءة وتوليد معلق أحادي الخلية متجانس لتقييم قياس التدفق الخلوي. بالإضافة إلى ذلك ، فإن تكوين وسط الخلية التائية له أهمية كبيرة للقدرة التكاثرية للخلايا التائية. بعد اختبار تركيبات وسائط الثقافة المختلفة ، ينتج عن الوسط الذي يحتوي على تركيزات منخفضة من L-Arginine و L-Lysine أفضل إشارة تكاثر الخلايا التائية ، حيث أن L-Arginine أمر بالغ الأهمية لعملية التمثيل الغذائي للخلايا التائية والبقاء على قيد الحياة ويجب توفيره بتركيز مناسب25،26. ومع ذلك, ينبغي للمرء أن يضع في اعتبارنا أن حلول ارجينين وليسين ليست مستقرة على المدى الطويل، وبالتالي تحتاج إلى استخدامها في غضون 3 أشهر. للتحفيز الأمثل ، يجب تحضير وسط الخلية التائية المكمل بالأحماض الأمينية طازجا لكل تجربة زراعة الخلايا التائية. علاوة على ذلك ، فإن أعداد خلايا الخلايا التائية ، وكذلك تلك الخاصة بالخلايا السرطانية ، هي عوامل حاسمة يجب مراعاتها لأنها تؤثر على قراءة التجربة.
بالنسبة للخلايا السرطانية ، من ناحية ، يكون التقاء الخلايا من 70٪ إلى 80٪ مطلوبا في نهاية تجربة الزراعة المشتركة. قد يؤدي فرط نمو الخلايا السرطانية إلى إفراز العوامل التي تمنع نمو الخلايا وستؤثر لاحقا أيضا على معدل تكاثر الخلايا التائية. نظرا لأن نمو الخلايا السرطانية يعتمد بشكل كبير على خط الخلايا الفردية ، فإننا نوصي بإجراء اختبار شامل لسلوك نمو خط الخلايا السرطانية المعنية في ألواح الآبار المختلفة ولأنظمة العلاج المختلفة. علاوة على ذلك ، يجب زراعة الخلايا السرطانية والخلايا التائية بشكل مشترك بنسبة 1: 1. لذلك ، من الضروري زرع بئر إضافي من الخلايا السرطانية لكل حالة علاجية ، والتي يمكن استخدامها لتحديد عدد الخلايا في يوم بداية الزراعة المشتركة. وبالتالي ، يمكن للمرء أن يضمن أن عددا مناسبا من الخلايا التائية سيتم زرعها لظروف العلاج المختلفة. فيما يتعلق بعدد خلايا الخلايا التائية ، من الضروري مراعاة أن كمية الخلايا التائية التي يمكن عزلها عن متبرع سليم فردية للغاية. تمثل الخلايا التائية حوالي 45٪ إلى 70٪ من PBMCs للمتبرع السليم27. وبالتالي ، يجب بالفعل تقدير الكمية المطلوبة من الخلايا التائية على نطاق واسع في وقت سحب الدم. علاوة على ذلك ، فإن كثافة الخلايا التائية مهمة لكفاءة تنشيط الخلايا التائية وبقائها على قيد الحياة. وبالتالي ، يجب زرع الخلايا التائية بتركيز لا يقل عن 1.5 مليون خلية لكل بئر من صفيحة 6 آبار في 3 مل من وسط الخلايا التائية للتحفيز الأولي قبل بداية الزراعة المشتركة. من الممكن زيادة كثافة الخلايا التائية ، ولكن يجب تجنب الكثافة المنخفضة. يمكن أيضا تقييم تنشيط الخلايا التائية شكليا تحت المجهر ، حيث تميل الخلايا التائية المنشطة إلى تكوين مجموعات خلايا.
نظرا لأن هذه الطريقة عبارة عن نظام تجريبي مبسط لدراسة القدرات المنحفة المناعية لخطوط الخلايا السرطانية المختلفة وطرق العلاج ، فإن لها بعض القيود التي يجب أخذها في الاعتبار. أولا ، يعتمد هذا الاختبار على نظام خيفي ، مما يعني أن الخلايا التائية المانحة ليست متطابقة مع HLA مع خط الخلايا السرطانية المعنية. وبالتالي ، فإن عدم تطابق HLA هذا قد يؤدي بالفعل إلى تحفيز الخلايا التائية ، وبالتالي تكاثر الخلايا التائية دون مزيد من التحفيز من علاج الخلاياالسرطانية 28. لتحديد هذا التأثير غير المرغوب فيه ، تم زراعة الخلايا التائية المعزولة مع خط خلايا HSC4 دون تحفيز مسبق مع الأجسام المضادة CD28 و CD3. وجد أنه لم يتم إحداث أي تكاثر تقريبا في هذا الإعداد ، مما يشير إلى أن عدم تطابق HLA له تأثيرات طفيفة فقط على تنشيط الخلايا التائية في هذا الإعداد التجريبي المحدد. إلى جانب ذلك ، تم العثور على اختلافات كبيرة في تكاثر الخلايا التائية وتنشيطها بناء على علاج الخلايا السرطانية على الرغم من الإعداد الخيفي. ومع ذلك ، من أجل إنشاء هذا الاختبار ، يجب اختبار التكاثر المحتمل الناجم عن الخيف للخلايا التائية وقياسه مرة واحدة في بداية التجارب. هناك حاجة إلى عناصر التحكم الموصى بها "الخلايا التائية فقط" و "الخلايا السرطانية فقط" للحصول على بوابات كافية وهي إلزامية في كل تكرار للتجارب. ومع ذلك ، يحتاج المرء إلى أن يضع في اعتباره أن نظام الزراعة المشتركة الخيفي يفتقر إلى التعرف على المستضد الخاص بالورم. وبالتالي ، قد لا يعكس هذا النظام بدقة الاستجابة المحددة المضادة للورم كما سيحدث في الجسم الحي في المرضى29،30. لمزيد من التحسين ، سيكون الإعداد الأكثر تعقيدا هو نهج الثقافة المشتركة الذاتية. في هذا الإعداد ، يجب زراعة خزعات الورم المشتقة من المريض وإدخالها في الثقافة باستخدام الخلايا التائية المعزولة من الدم المحيطي لنفس المريض28. ومع ذلك ، قد يكون هذا النهج التجريبي صعبا ليس فقط من حيث زراعة الخلايا السرطانية الأولية ولكن أيضا من حيث توافر المواد الحيوية المشتقة من المريض. هناك قيود أخرى يجب مراعاتها وهي نسبة الخلايا السرطانية والخلايا التائية في الزراعة المشتركة. نظرا لأن النسبة الموصى بها للخلايا هي 1: 1 ، فإن النسبة لا تعكس الوضع الفسيولوجي ل TME في المرضى31. ومع ذلك ، يجب قبول هذا القيد ، كما هو الحال مع انخفاض عدد الخلايا التائية ، فإن التغييرات في معدل الانتشار وحالة التنشيط غير قابلة للقياس الكمي.
في مجال مناعة الورم ، يوفر هذا الاختبار الفرصة للكشف عن المناعة لطرق العلاج المختلفة في بيئة تجريبية سهلة وسريعة في المختبر . لذلك ، لا يمكن توفير الوقت فقط عن طريق الفحص المسبق للأساليب الواعدة من حيث المناعة ، ولكن أيضا في التجارب في الجسم الحي . يمكن تقليل النماذج الحيوانية ، حيث يمكن متابعة مخططات العلاج الواعدة فقط في النماذج الحيوانية لتعكس الجهاز المناعي ككل في الكائن الحي. علاوة على ذلك ، نظرا لأن هذا الاختبار يعتمد على الخلايا الأولية البشرية وخطوط الخلايا السرطانية البشرية ، فقد تكون النتائج أكثر قابلية للترجمة إلى العيادة من المقايسات التي تستند إلى أنظمة وأنواع نموذجية أخرى.
في المستقبل ، يمكن تعديل هذا الاختبار وتكييفه للإجابة على أسئلة بحثية أكثر تحديدا. على سبيل المثال ، يمكن للمرء تضمين علاج للخلايا التائية ليعكس سيناريو علاجي أقرب إلى الوضع لدى المرضى. نظرا لأن الخلايا التائية التفاعلية للورم توجد في الغالب في TME ، فإنها تتأثر بنفس القدر بالعلاجات المحلية مثل RT ومن المحتمل أن تتأثر أيضا بالعلاجات الجهازية مثل CT أو TT32. التعزيز الإضافي للاختبار هو الزراعة المشتركة للخلايا التائية مع كرويات الورم من خطوط الخلايا السرطانية أو حتى الزراعة المشتركة مع عضيات الورم المشتقة من المريض. هذه الثقافات ثلاثية الأبعاد أكثر قابلية للمقارنة مع بنية الورم في المريض28. أخيرا ، يمكن أيضا تكييف قراءة التجربة عبر قياس التدفق الخلوي بسهولة من أجل التحقيق في المزيد من الجزيئات على سطح الخلايا التائية أو عن طريق تحليل التعبير عن جزيئات نقاط التفتيش المناعية على الخلايا السرطانية. بالإضافة إلى تحديد النمط الظاهري المناعي للخلايا التائية ، يمكن للمرء استخدام المواد الطافية لزراعة الخلايا من تجارب الزراعة المشتركة لتقدير السيتوكينات المفرزة أو الكيموكينات لاكتساب المزيد من الأفكار حول نشاط الخلايا التائية. باختصار ، يقدم هذا البروتوكول فحصا شاملا وقويا وسهلا للزراعة المشتركة للخلايا التائية والخلايا السرطانية يسمح بفحص المناعة لطرق علاج السرطان المختلفة. نظرا لأن هذا الاختبار قابل للتكيف مع أسئلة بحثية محددة ، فهو مناسب تماما للتطبيق في المجال الواسع لمناعة الورم.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم تمويل هذا البحث جزئيا من قبل المركز متعدد التخصصات للبحوث السريرية في إرلانغن (IZKF Erlangen) و Bayerisches Zentrum für Krebsforschung (BZKF).
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL Cellstar tubes | Greiner Bio-One GmbH | 188271 | |
| 50 mL Cellstar tubes | Greiner Bio-One GmbH | 227261 | |
| 6 well cell culture plate sterile, with lid | Greiner Bio-One GmbH | 657160 | |
| 96 well cell culture plate sterile, F-bottom, with lid | Greiner Bio-One GmbH | 655180 | |
| AZD0156 | Selleck Chemicals GmbH | S8375 | |
| Berzosertib (VE-822) | Selleck Chemicals GmbH | S7102 | |
| CASYcups | OMNI Life Science GmbH & Co KG | 5651794 | |
| CASYton | OMNI Life Science GmbH & Co KG | 5651808 | |
| CD25a, PE-Dazzle594, Mouse IgG1 | Biolegend | 356126 | |
| CD28-UNLB | Beckmann Coulter, Inc. | IM1376 | |
| CD3a,Krome Orange, Mouse IgG1 | Beckmann Coulter, Inc. | B00068 | |
| CD3e Monoclonal Antibody | Thermo-Fisher Scientific, Inc. | MA1-10176 | |
| CD4, APC, Mouse Anti-Human Mouse IgG1 | BD Pharmingen | 555349 | |
| CD8 MicroBeads, human | Miltenyi Biotec, Inc. | 130-045-201 | |
| CD8a, PerCP-Cy5.5, Mouse IgG1 | Biolegend | 300924 | |
| CellTracker Deep Red Dye | Thermo Fisher Scientific, Inc. | C34565 | |
| CFSE | Merck KGaA (Sigma-Aldrich) | 21888 | |
| DMEM (Dulbecco´s Modified Eagle´s Medium) | PAN-Biotech GmbH | P04-02500 | |
| DxFlex Flow Cytometer (with Auto Loader) | Beckmann Coulter, Inc. | C44326, C02846 | |
| EDTA disodium salt dihydrate | Carl Roth GmbH + Co. KG | 8043.2 | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-500ML | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-100ML | For production of heat-inactivated FBS. Heat up for 30 min at 56 °C with mixing to inactivate complement proteins. |
| Graph Pad Prism (version number 9) | GraphPad Software | - | |
| HLA-DR, DP, DQ Antibody, anti-human, APC-Vio770 | Miltenyi Biotec, Inc. | 130-123-550 | |
| Kaluza (version number 2.1) | Beckmann Coulter, Inc. | - | |
| L-Arginin | Merck KGaA (Sigma-Aldrich) | A8094-25G | |
| L-Lysin-monohydrochloride | Merck KGaA (Sigma-Aldrich) | L5626-100G | |
| MACS BSA Stock Solution | Miltenyi Biotec, Inc. | 130-091-376 | |
| MS Columns | Miltenyi Biotec, Inc. | 130-042-201 | |
| Neubauer-improved counting chamber | Paul Marienfeld GmbH & Co. KG | 640010 | |
| PBS | Merck KGaA (Sigma-Aldrich) | D8537-500mL | |
| Penicillin-Streptomycin | Thermo-Fisher Scientific, Inc. | 1514-122 | |
| ROTISep 1077 | Carl Roth GmbH + Co. KG | 0642.2 | |
| RPMI-1640 Medium | Merck KGaA (Sigma-Aldrich) | R1790 | |
| SepMate 50mL tubes | Stemcell Technologies | 85450 | |
| Trypan blue | Merck KGaA (Sigma-Aldrich) | T6146-25G | |
| Trypsin | Thermo-Fisher Scientific, Inc. | 15400054 |
References
- Hiam-Galvez, K. J., Allen, B. M., Spitzer, M. H. Systemic immunity in cancer. Nat Rev Cancer. 21 (6), 345-359 (2021).
- Mantovani, A., Allavena, P., Marchesi, F., Garlanda, C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 21 (11), 799-820 (2022).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From t cell basic science to clinical practice. Nat Rev Immunol. 20 (11), 651-668 (2020).
- Dunn, G. P., Old, L. J., Schreiber, R. D. The immunobiology of cancer immunosurveillance and immunoediting. Immunity. 21 (2), 137-148 (2004).
- Mittal, D., Gubin, M. M., Schreiber, R. D., Smyth, M. J. New insights into cancer immunoediting and its three component phases--elimination, equilibrium and escape. Curr Opin Immunol. 27, 6-25 (2014).
- Irianto, T., Gaipl, U. S., Ruckert, M. Immune modulation during anti-cancer radio(immuno)therapy. Int Rev Cell Mol Biol. 382, 239-277 (2024).
- Burtness, B., et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (keynote-048): A randomized, open-label, phase 3 study. Lancet. 394 (10212), 1915-1928 (2019).
- Hecht, M., et al. Safety and efficacy of single cycle induction treatment with cisplatin/docetaxel/ durvalumab/tremelimumab in locally advanced HNSCC: First results of checkered-CD8. J Immunother Cancer. 8 (2), e001378(2020).
- Chen, J. A., Ma, W., Yuan, J., Li, T. Translational biomarkers and rationale strategies to overcome resistance to immune checkpoint inhibitors in solid tumors. Cancer Treat Res. 180, 251-279 (2020).
- Solomon, B., Young, R. J., Rischin, D. Head and neck squamous cell carcinoma: Genomics and emerging biomarkers for immunomodulatory cancer treatments. Semin Cancer Biol. 52 (Pt 2), 228-240 (2018).
- Meidenbauer, J., et al. Inhibition of atm or atr in combination with hypo-fractionated radiotherapy leads to a different immunophenotype on transcript and protein level in HNSCC. Front Oncol. 14, 1460150(2024).
- Kumari, S., et al. Immunomodulatory effects of radiotherapy. Int J Mol Sci. 21 (21), 8151(2020).
- Wimmer, S., et al. Hypofractionated radiotherapy upregulates several immune checkpoint molecules in head and neck squamous cell carcinoma cells independently of the HPV status while icos-l is upregulated only on HPV-positive cells. Int J Mol Sci. 22 (17), 9114(2021).
- Derer, A., et al. Chemoradiation increases pd-l1 expression in certain melanoma and glioblastoma cells. Front Immunol. 7, 610(2016).
- Schatz, J., et al. Normofractionated irradiation and not temozolomide modulates the immunogenic and oncogenic phenotype of human glioblastoma cell lines. Strahlenther Onkol. 199 (12), 1140-1151 (2023).
- Xu, M. M., Pu, Y., Zhang, Y., Fu, Y. X. The role of adaptive immunity in the efficacy of targeted cancer therapies. Trends Immunol. 37 (2), 141-153 (2016).
- Olivo Pimentel, V., Yaromina, A., Marcus, D., Dubois, L. J., Lambin, P. A novel co-culture assay to assess anti-tumor cd8(+) t cell cytotoxicity via luminescence and multicolor flow cytometry. J Immunol Methods. 487, 112899(2020).
- Kulp, M., Diehl, L., Bonig, H., Marschalek, R. Co-culture of primary human t cells with leukemia cells to measure regulatory t cell expansion. STAR Protoc. 3 (3), 101661(2022).
- Ruckert, M., et al. Immune modulatory effects of radiotherapy as basis for well-reasoned radioimmunotherapies. Strahlenther Onkol. 194 (6), 509-519 (2018).
- Samstein, R. M., Riaz, N. The DNA damage response in immunotherapy and radiation. Adv Radiat Oncol. 3 (4), 527-533 (2018).
- Meeren, A. V., Bertho, J. M., Vandamme, M., Gaugler, M. H. Ionizing radiation enhances il-6 and il-8 production by human endothelial cells. Mediators Inflamm. 6 (3), 185-193 (1997).
- Zimmerman, M., et al. Ifn-gamma upregulates survivin and ifi202 expression to induce survival and proliferation of tumor-specific T cells. PLoS One. 5 (11), e14076(2010).
- Saraiva, D. P., et al. Expression of HLA-dr in cytotoxic t lymphocytes: A validated predictive biomarker and a potential therapeutic strategy in breast cancer. Cancers (Basel). 13 (15), (2021).
- Dillon, M. T., et al. Atr inhibition potentiates the radiation-induced inflammatory tumor microenvironment. Clin Cancer Res. 25 (11), 3392-3403 (2019).
- Geiger, R., et al. L-Arginine modulates T cell metabolism and enhances survival and anti-tumor activity. Cell. 167 (3), 829-842.e13 (2016).
- Rodriguez, P. C., Quiceno, D. G., Ochoa, A. C. L-Arginine availability regulates t-lymphocyte cell-cycle progression. Blood. 109 (4), 1568-1573 (2007).
- Lozano-Ojalvo, D., López-Fandiño, R., López-Expósito, I., et al. The impact of food bioactives on health: In vitro and ex vivo models. Verhoeckx, K., et al. , Springer International Publishing. Cham. 169-180 (2015).
- Gronholm, M., et al. Patient-derived organoids for precision cancer immunotherapy. Cancer Res. 81 (12), 3149-3155 (2021).
- Perez, C., Gruber, I., Arber, C. Off-the-shelf allogeneic t cell therapies for cancer: Opportunities and challenges using naturally occurring "universal" donor t cells. Front Immunol. 11, 583716(2020).
- Martinez Bedoya, D., Dutoit, D., Migliorini, D. Allogeneic car t cells: An alternative to overcome challenges of car t cell therapy in glioblastoma. Front Immunol. 12, 640082(2021).
- Schnellhardt, S., et al. The prognostic value of FOXP3+ tumor-infiltrating lymphocytes in rectal cancer depends on immune phenotypes defined by CD8+ cytotoxic T cell density. Front Immunol. 13, 781222(2022).
- Zitvogel, L., Kroemer, G. Oncoimmunology: A practical guide for cancer immunotherapy. , Springer International Publishing. Cham. 23-39 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved