Method Article
Analyse de l’activité des lymphocytes T humains dans un cadre de co-culture allogénique de cellules tumorales prétraitées
Dans cet article
Résumé
Le présent protocole décrit un flux de travail expérimental qui permet l’analyse ex vivo de la stimulation des lymphocytes T humains dans un système de co-culture allogénique avec des cellules tumorales prétraitées.
Résumé
Les lymphocytes T cytotoxiques jouent un rôle clé dans l’élimination des cellules tumorales et sont donc étudiés de manière intensive en immunologie du cancer. La fréquence et l’activité des lymphocytes T cytotoxiques dans les tumeurs et leur microenvironnement tumoral (TME) sont maintenant des biomarqueurs pronostiques et prédictifs bien établis pour de nombreux types de tumeurs. Cependant, il est bien connu que diverses modalités de traitement des tumeurs, notamment la radiothérapie, la chimiothérapie, l’immunothérapie et la thérapie ciblée, modulent non seulement l’immunogénicité de la tumeur, mais également le système immunitaire lui-même. Par conséquent, l’interaction entre les cellules tumorales et les lymphocytes T nécessite une étude plus intensive dans différents contextes thérapeutiques afin de bien comprendre le rôle complexe des lymphocytes T pendant le traitement tutumoral. Pour répondre à ce besoin, un protocole a été développé pour analyser l’activité et la capacité de prolifération des lymphocytes T cytotoxiques humains (CD8+) en co-culture avec des cellules tumorales prétraitées. Plus précisément, les lymphocytes T CD8+ de donneurs sains sont colorés avec le marqueur de prolifération non toxique carboxyfluorescéine diacétate succinimidylique (CFSE) et stimulés à l’aide de plaques recouvertes de CD3/CD28. Par la suite, les lymphocytes T sont co-cultivés avec des cellules tumorales prétraitées. À titre d’indication, la prolifération des lymphocytes T est quantifiée en mesurant la distribution du signal CFSE et en évaluant l’expression des marqueurs d’activation de surface par cytométrie en flux. Cela peut être complété par la quantification de la libération de cytokines à l’aide d’un test immuno-enzymatique (ELISA). Cette méthode facilite l’évaluation des changements induits par le traitement dans l’interaction entre les cellules tumorales et les lymphocytes T, fournissant une base pour des analyses plus détaillées des modalités de traitement des tumeurs et de leur immunogénicité dans un cadre humain ex vivo . De plus, il contribue à la réduction des analyses précliniques in vivo .
Introduction
De nos jours, il devient de plus en plus évident que l’excroissance et la progression des tumeurs dépendent fortement de la manipulation efficace et de la suppression du système immunitaire de l’hôte. Des cellules transformées émergent tous les jours, même dans un organisme sain. Cependant, la formation de tumeurs macroscopiques est un événement plutôt rare, car les cellules transformées émergentes sont retirées de l’organisme avec une grande efficacité. Pour l’élimination des cellules malignes, différents types de cellules immunitaires telles que les cellules T cytotoxiques, les cellules T tueuses naturelles (NK), les cellules NK ou les macrophages entrent en action 1,2,3. Néanmoins, des clones cellulaires transformés peuvent parfois émerger et survivre dans un état d’équilibre avec le système immunitaire de l’hôte, qui se caractérise par différentes stratégies immunosuppressives du clone de cellules tumorales4. Finalement, certaines cellules transformées acquièrent d’autres fonctions qui permettent aux cellules tumorales de supprimer activement la réponse immunitaire, ce qui conduit par conséquent à la croissance de la tumeur. Cette immunosuppression est médiée par de nombreux mécanismes, notamment l’expression de ligands immunosuppresseurs sur les cellules tumorales ou le recrutement actif ou l’amorçage de populations de cellules immunitaires immunorégulatrices ou immunosuppressives. Ce concept d’édition immunitaire démontre le rôle clé de la modulation immunitaire lors de la formation et de la croissance tumorale5.
Il n’est donc pas surprenant que le système immunitaire soit aujourd’hui un élément majeur non seulement dans le traitement du cancer, mais aussi en tant que facteur prédictif et pronostique dans de nombreuses entités tumorales et contextes thérapeutiques. Au cours des dernières années, les inhibiteurs de point de contrôle immunitaire (ICI) sont apparus comme des options thérapeutiques prometteuses dans différentes entités cancéreuses solides, telles que le carcinome épidermoïde de la tête et du cou (HNSCC) ou le cancer du poumon non à petites cellules (NSCLC) dans le but de moduler le microenvironnement tumoral (TME) vers une réponse immunitaire antitumorale plus efficace et une immunosuppression diminuée des cellules tumorales6. Les inhibiteurs de point de contrôle immunitaire visent à stimuler la destruction des cellules tumorales médiée par les lymphocytes T en ciblant les molécules de point de contrôle immunitaire telles que celles de la protéine de mort programmée 1 (-1) et de son axe ligand 1 (PD1/-L1). Ce fait souligne le rôle clé des lymphocytes T dans l’immunité anti-tumorale. Dans le HNSCC, par exemple, les ICI ont été approuvés avec succès comme traitement de première intention dans le HNSCC7 récurrent et métastasé. Dans le même ordre d’idées, la présence de lymphocytes T cytotoxiques dans le TME, ainsi que l’expression de PD1 et-L1 sur les cellules tumorales et les lymphocytes T en conséquence, peuvent servir de biomarqueurs prédictifs dans HNSCC 8,9,10.
Même si les lymphocytes T jouent un rôle crucial dans l’immunologie tumorale et la thérapie tumorale, de nombreuses questions ouvertes sur leurs interactions avec la tumeur doivent encore être abordées. De nos jours, il est bien connu que la réponse immunitaire tumorale est un processus dynamique et que l’immunogénicité des tumeurs peut changer tout au long de la maladie et des traitements. Différentes modalités de traitement, telles que la chimiothérapie (CT), la radiothérapie (RT) ou la thérapie ciblée (TT), sont particulièrement connues pour moduler le phénotype immunologique des cellules tumorales. La RT peut entraîner la régulation à la hausse des molécules de point de contrôle immunitaire dans le tissu tumoral et modifier la fréquence des cellules infiltrant la tumeur11,12. TT, d’autre part, peut également approuver des changements favorables au sein de la tumeur et de l’EUT par modulation directe de la réponse immunitaire adaptative 13,14,15,16. Cependant, ces modulations sont difficiles à étudier chez les patients, car cela nécessiterait un examen répétitif du tissu tumoral au cours du traitement. Ainsi, des systèmes modèles expérimentaux concluants sont nécessaires pour étudier le phénotype immunologique dynamique des cellules tumorales et des cellules T et, plus important encore, leurs interactions.
Par conséquent, dans le but d’analyser l’activité des lymphocytes T et les interactions entre les cellules tumorales et les lymphocytes T, un test de co-culture ex vivo complet est nécessaire, facile à mettre en œuvre dans n’importe quel laboratoire, basé sur des travaux de culture cellulaire simples et des analyses de cytométrie en flux couramment utilisées. Sur la base de la littérature existante et disponible, aucun protocole facile à utiliser et couramment utilisé concernant la co-culture de cellules T et de cellules tumorales n’a été publié à ce jour. Bien que plusieurs tests de co-culture pour les lymphocytes T et les organoïdes tumoraux aient été publiés récemment, la technique de culture cellulaire 3D n’est toujours pas mise en œuvre en tant que technique standard dans tous les laboratoires. Ainsi, nous fournissons un protocole pour l’utilisation dans la culture cellulaire 2D, qui pourrait tout aussi bien être établi pour la culture cellulaire 3D à l’avenir. D’autres protocoles de co-culture 2D sont souvent plus complexes, car ils nécessitent, par exemple, la transduction de cellules tumorales avec la luciférase17 ou ne conviennent qu’aux hémopathies malignes (co-culture de lymphocytes T non appariés avec des cellules leucémiques)18. Dans le test décrit ici, les lymphocytes T de donneurs sains normaux sont isolés du sang périphérique et stimulés par des anticorps anti-CD3 et anti-CD28. Par la suite, les lymphocytes T sont co-cultivés avec des cellules tumorales (pré-)traitées afin d’analyser la capacité proliférative des lymphocytes T ainsi que leur activité via la cytométrie en flux. Ainsi, les effets de différentes modalités de traitement sur le phénotype immunitaire des cellules tumorales, telles que RT, CT ou TT, qui à leur tour influencent l’activité et la prolifération des lymphocytes T, peuvent facilement être examinés et utilisés comme base pour des analyses mécanistes plus approfondies et des analyses précliniques in vivo consécutives sélectionnées. Le test décrit ici offre une configuration facile à utiliser, car aucun dispositif, technique ou matériel non conventionnel n’est nécessaire. De plus, le test peut être facilement adapté à différentes lignées de cellules tumorales ou à des sous-ensembles spécifiques de lymphocytes T (par exemple, les lymphocytes T CD4+). Cette technique permet d’obtenir une standardisation et une reproductibilité élevées.
Protocole
Ce test implique des prélèvements sanguins et la culture de cellules primaires humaines. Par conséquent, un vote éthique est obligatoire pour ces analyses. Tous les résultats présentés dans ce manuscrit sont couverts par l’approbation éthique de l’essai IMMO-NHD, et le consentement éclairé écrit a été obtenu de tous les donneurs. L’approbation a été accordée par le comité d’examen institutionnel de la Friedrich-Alexander-Universität Erlangen-Nürnberg le 9 novembre 2022 (numéro de demande 21-415-B). Les cellules tumorales HSC4 utilisées dans cette étude proviennent d’une lignée cellulaire disponible dans le commerce.
Ce test illustre toutes les étapes du test de co-culture de cellules T et de cellules tumorales, en utilisant la lignée cellulaire HSC4 du carcinome épidermoïde de la tête et du cou (HNSCC) humaine dans un cadre de traitement impliquant une radiothérapie (RT) et deux inhibiteurs de kinases spécifiques. Par conséquent, des paramètres tels que le nombre de cellules, les temps de trypsinisation et les schémas de traitement sont spécifiques à ce contexte de co-culture et doivent être adaptés à d’autres lignées cellulaires tumorales (voir aussi la section Discussion). Toutes les étapes de centrifugation ont été effectuées à température ambiante. Dans cette étude, les inhibiteurs de kinases AZD0156 et VE-822 ont été utilisés pour cibler le système de réparation des dommages à l’ADN (DDR) des cellules HSC4. AZD0156 (Selleckchem) inhibe la protéine ATM (ataxia telangiectasia mutated), tandis que VE-822 (Selleckchem) cible la protéine ATR (Ataxia télangiectasie) et la protéine Rad3. Les deux inhibiteurs ont été discutés comme agents potentiels pour augmenter la radiosensibilité dans les cellules tumorales. Ils sont dissous dans du sulfoxyde de diméthyle (DMSO) et stockés à -20 °C. La figure 1 présente un organigramme du test ex vivo , détaillant la co-culture de cellules tumorales prétraitées avec des lymphocytes T CD8+ humains stimulés par CD3/CD28. Les réactifs et l’équipement utilisés sont répertoriés dans la table des matériaux.
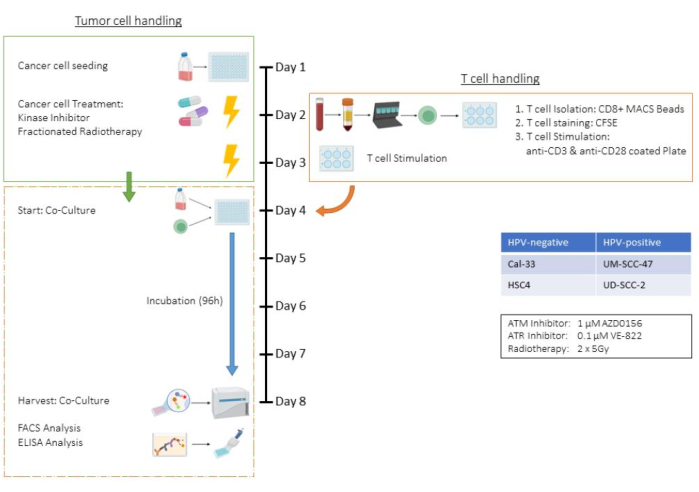
Figure 1 : Organigramme du dosage ex vivo de cellules tumorales prétraitées en co-culture avec des lymphocytes T CD8+ humains stimulés par CD3/CD28. Jour 1 : Ensemencement des cellules tumorales HSC4. Jour 2 : Traitement des cellules tumorales et isolement, coloration CFSE et ensemencement dans des plaques de cellules T CD8+ humaines recouvertes de CD3/CD28. Jour 3 : Traitement des cellules tumorales. Jour 4 : Comptage des puits représentatifs des cellules tumorales. Récolte et comptage de tous les lymphocytes T. Co-culture de cellules T et de cellules tumorales HSC4 dans un rapport de 1:1. Jour 5-Jour 8 : Incubation en co-culture. Jour 8 : Récolte de la co-culture, congélation des surnageants, coloration à base d’anticorps et analyse des cellules par cytométrie en flux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Ensemencement des cellules tumorales (Jour 1)
REMARQUE : Durée : 1 h. Les cellules tumorales humaines HSC4 sont ensemencées à partir de bouteilles de culture cellulaire T75 dans des plaques à 96 puits.
- Jeter le surnageant (milieu D10) du flacon de culture cellulaire.
- Lavez les cellules tumorales avec 5 ml de PBS chaud à 37 °C. Jetez PBS.
- Étant donné que les cellules tumorales HSC4 ont tendance à adhérer étroitement aux flacons de culture cellulaire, la trypsinisation en deux étapes est recommandée pour s’assurer que toutes les cellules sont détachées. Pour cela, ajoutez 3 mL de trypsine et placez le flacon sur une plaque chauffante à 37 °C pendant 3 min, puis jetez la trypsine à l’aide d’une pipette.
- Ajoutez encore 3 ml de trypsine, placez le flacon sur la plaque chauffante et attendez que la suspension unicellulaire soit obtenue. Vérifiez au microscope s’il n’y a pas de suspension unicellulaire.
- Arrêtez la trypsine en ajoutant le double volume de milieu D10 (DMEM complété par 10 % de sérum fœtal bovin et 1 % de pénicilline-streptomycine), remettez complètement en suspension et transférez les cellules dans un tube de centrifugation de 50 ml.
- Déterminez le nombre de cellules de la suspension unicellulaire, puis calculez la quantité totale de cellules tumorales en fonction du volume total. Une chambre cellulaire Neubauer est recommandée pour la détermination du nombre de cellules.
- Centrifugez le tube de centrifugation de 50 mL contenant les cellules tumorales à 300 x g pendant 5 min à température ambiante. Jetez le surnageant.
- Remettre en suspension les cellules tumorales HSC4 dans un volume approprié de milieu D10 pour atteindre une concentration de 15 000 cellules dans un milieu de 200 μL.
- Selon les traitements prévus des cellules tumorales, ensemencez pour chaque condition au moins 3 puits contenant 15 000 cellules tumorales HSC4 dans un milieu de 200 μL dans deux plaques de 96 puits (1x échantillon, 1x contrôle de cellule tumorale uniquement, 1x puits de comptage de cellules pour la journée de co-culture).
REMARQUE : Le nombre de cellules dépend de la lignée cellulaire et du temps de doublage. Le nombre de cellules pour différents traitements doit être examiné lors d’expériences préalables afin d’éviter une confluence de 100 % pendant l’incubation. - Incuber les cellules pendant 24 h à 37 °C et 5 % de CO2 et d’humidité saturée.
2. Traitement des cellules tumorales (Jour 2)
REMARQUE : Durée : 3-5 h. Après un temps d’incubation de 24 h, les cellules HSC4 précédemment ensemencées peuvent être traitées selon le schéma de traitement souhaité. Dans ce cas exemplaire, les cellules tumorales sont traitées avec un inhibiteur de l’ATM ou de l’ATR. De plus, l’une des deux plaques à 96 puits est également irradiée avec 2x 5 Gy par la suite.
- Préparez les inhibiteurs de kinase pour obtenir une concentration de 1 μM AZD0156 (inhibiteur de l’ATM) et de 0,1 μM VE-822 (inhibiteur de l’ATR) pour traiter les cellules tumorales.
- Traitez les cellules tumorales en conséquence, par exemple, en traitant une rangée d’échantillons avec 3,1 μL d’inhibiteur d’ATM et une seconde avec 3,1 μL d’inhibiteur d’ATR dans chaque plaque.
- Après 3 à 5 h d’incubation à 37 °C, irradier une plaque de 5 Gy.
- Après une autre incubation de 24 h, irradiez à nouveau la même plaque avec 5 Gy.
3. Isolement des lymphocytes T (jour 2)
REMARQUE : Durée : 4 h. Les lymphocytes T CD8+ sont isolés magnétiquement avec des microbilles anti-CD8 provenant de PBMC après centrifugation par gradient de densité de sang périphérique (PB) provenant de donneurs adultes sains. Les lymphocytes T isolés sont ensuite colorés avec CFSE et incubés dans une plaque à puits recouverte de CD3/CD28 pour la stimulation. Pour pouvoir travailler en utilisant les ressources et le matériel dans les étapes ultérieures, il est important d’estimer la quantité de cellules T nécessaires aux expériences de co-culture. En fonction du donneur, entre 50 000 000 et 100 000 000 PBMC peuvent être isolés à partir d’environ 45 ml de sang EDTA. Environ 10 % des PBMC totaux sont des lymphocytes T CD8+.
- Centrifugation par gradient de densité
- Transférez 3 à 5 tubes sanguins EDTA de 9 mL provenant d’un donneur sain dans deux tubes de centrifugation de 50 mL.
- Remplissez les deux tubes de centrifugation à 50 mL avec PBS + 2 % FBS.
- Préparez six tubes de centrifugation (avec incrustation en plastique pour la séparation des PBMC) et remplissez chacun d’eux avec 15 mL de milieu à gradient de densité froide de + 4 °C.
- Recouvrir soigneusement le milieu à gradient de densité avec 12 à 15 ml de sang dilué de l’étape 3.1.2.
- Centrifugeuse à 1200 x g pendant 10 min (pas de décélération nécessaire).
- Préparation d’une plaque à 6 puits pour la stimulation des lymphocytes T
- Préparez des anticorps : Préparez une solution d’anti-CD3 (clone OKT3) de 1 mg/mL avec du PBS. Préparez une solution d’anti-CD28 (clone 28.2) de 0,1 mg/mL avec du PBS.
- Recommandation : utiliser le temps pendant la centrifugation (étape 3.1.5) pour la préparation des solutions d’enrobage et l’enrobage des puits eux-mêmes pour la stimulation des lymphocytes T.
- Mélanger 5 μL de solution d’anticorps CD3 avec 4,995 μL de PBS et 50 μL de solution d’anticorps CD28 avec 4,950 μL de PBS (concentration finale : 1 μg/μL).
- Ajouter 1.000 μL des deux solutions d’anticorps dans chaque puits de la plaque à 6 puits.
- Enduire 2 ou 3 puits, en fonction de la quantité attendue de lymphocytes T, de la plaque à 6 puits et incuber pendant au moins 2 h à 37 °C.
- Préparation du milieu des lymphocytes T
REMARQUE : Préparation de 100x L-Lysine : Dissoudre 200 mg de chlorhydrate de L-Lysine dans 50 mL d’eau distillée dans un tube de centrifugation de 50 mL. Stérilisez la solution à l’aide d’un filtre à seringue de 0,2 μm et transférez-la dans un nouveau tube de 50 ml à l’aide d’une seringue de perfusion de 50 mL. Conservez la solution à une température de 4 à 8 °C et utilisez-la dans les 3 mois. Préparation de 15 mM de L-Arginine : Dissoudre 26 mg de L-Arginine dans 10 mL de DPBS. Stérilisez la solution à l’aide d’un filtre à seringue de 0,2 μm et transférez-la dans un nouveau tube à l’aide d’une seringue de 10 mL. Conservez la solution à une température de 4 à 8 °C et utilisez-la dans les 3 mois.- Utilisez le temps de centrifugation mentionné à l’étape 1.5 pour préparer le milieu des lymphocytes T.
- Préparez environ 10 à 30 ml de milieu de cellules T, en fonction de la quantité prévue de cellules T.
- Mélangez le milieu RPMI sans L-Arginine et L-Lysine avec 10 % de FBS inactivé par la chaleur, 1 % de pénicilline-streptomycine, 1 % de L-Arginine, 1 % de L-Lysine et 1 % de L-Glutamine. Exemple : 25,8 mL de milieu RPMI + 3 mL de FBS + 0,3 mL de Pen/Strep + 0,3 mL de L-Arginine + 0,3 mL de L-Lysine + 0,3 mL de L-Glutamin.
- Conservez le milieu restant à 4 °C pendant les deux jours suivants pour l’utiliser le jour 4 - Début de la co-culture. Pour chaque nouvelle série de l’ensemble de l’expérience, il est recommandé de préparer un milieu de culture frais.
- Isolation PBMC
- Après la centrifugation (étape 3.1.5), transvaser le surnageant dans quatre nouveaux tubes de centrifugation de 50 mL et jeter les tubes usagés.
- Remplissez les tubes de centrifugation jusqu’à 50 mL avec du PBS + 2 % FBS.
- Centrifugeuse à 300 x g pendant 8 min à température ambiante.
- Jetez le surnageant, remettez en suspension la pastille cellulaire dans 1 mL de PBS + 2 % FBS chacun, et combinez-les dans deux tubes de centrifugation.
- Remplissez les tubes à 50 mL avec PBS + 2 % de FCS.
- Centrifugeuse à 120 x g pendant 10 min à température ambiante.
- Jetez le surnageant, remettez soigneusement la pastille en suspension dans 1 mL de PBS +2 % FBS et combinez les deux pastilles dans un seul faucon.
- Remplissez le tube de centrifugation à 50 mL avec du PBS + 2 % de FBS.
- Comptez le nombre total de PBMC à l’aide d’une chambre de comptage Neubauer. Recommandation : diluer la suspension cellulaire 1:10 avec du bleu trypan pour le comptage.
- Séparation des lymphocytes T CD8+
REMARQUE : Utilisez des microbilles CD8 humaines avec des colonnes de séparation magnétique (MS) et un tampon de tri cellulaire activé magnétique plus (MACS+) pour séparer magnétiquement les cellules T CD8+ conformément au protocole du fabricant (voir le tableau des matériaux).- Centrifuger les PBMC (après comptage cellulaire) à 300 x g pendant 10 min.
- Jeter le surnageant et remettre en suspension la pastille cellulaire dans 80 μL de tampon MACS+ (500 mL de PBS complété par 10 mM d’EDTA et 0,5 % de BSA) par 10à 7 cellules (par exemple, 60 000 000 de PBMC sont remis en suspension dans 6 x 80 μL = 480 μL de tampon).
REMARQUE : Exemple : 465 mL de PBS + 10 mL (0,5 m) d’EDTA et 25 mL de solution BSA-Stock. - Ajouter 20 μL de microbilles CD8 par 107 cellules et mélanger soigneusement en pipetant de haut en bas. Incuber pendant 15 min à 4 °C.
- Après l’incubation, laver les cellules en ajoutant 2 mL de tampon MACS+ pour 107 cellules.
- Centrifugeuse à 300 x g pendant 10 min à température ambiante. Jetez le surnageant et remettez les cellules en suspension dans 1 000 μL de tampon MACS+.
- Placez deux colonnes MS dans l’aimant et placez deux tubes de centrifugation de 15 ml en dessous.
- Préparez les colonnes avec un tampon MACS+ de 500 μL. Le tampon traverse les colonnes et peut être collecté dans les tubes de centrifugation situés en dessous. Cette étape peut également être effectuée parallèlement à l’étape 3.5.6.
- Ensuite, pipetez la suspension cellulaire de manière égale dans les colonnes MS préparées. Le flux peut être collecté dans les mêmes tubes de centrifugation. Il contient maintenant toutes les cellules CD8 négatives non étiquetées.
- Videz les colonnes en ajoutant 3 x 500 μL de tampon MACS+. N’ajoutez un nouveau tampon sur les colonnes que dès qu’elles sont à sec ou qu’elles ont cessé de couler.
- Étiquetez les cellules finales collectées comme « Flow-through » ou « CD8 négatif » et combinez-les dans un seul tube de centrifugation. Celle-ci peut ensuite être utilisée pour mesurer la pureté de l’isolement par cytométrie en flux.
- Prenez un nouveau tube de centrifugation de 15 ml étiqueté « lymphocytes T CD8+ ». Les colonnes sont retirées de l’aimant et placées sur le tube de centrifugation.
- Rincez les deux colonnes contenant les lymphocytes T CD8 positifs marqués magnétiquement avec 1 000 μL de tampon MACS+ chacune. Par conséquent, placez le tampon dans les colonnes et commencez immédiatement à pousser soigneusement la solution hors des colonnes à l’aide du piston fourni par le fabricant.
REMARQUE : Effectuer cette opération pour les deux colonnes, en recueillant 2 mL de suspension totale de cellules T lors de la centrifugation. - Comptez le nombre total de lymphocytes T à l’aide d’une chambre de comptage Neubauer. Recommandation : Utilisez une dilution 1:4 avec du bleu trypan.
- Coloration des lymphocytes T avec CFSE
- Centrifuger les lymphocytes T isolés à 300 x g pendant 5 min.
- Pendant la centrifugation, préparer la solution de coloration CFSE en mélangeant 1,1 μL de solution CFSE dans 10 mL de PBS. La concentration finale doit être de 1 μM.
- Jetez le surnageant et remettez en suspension la pastille cellulaire dans 1 000 μL de PBS. Centrifugeuse à 300 x g pendant 5 min.
- Jeter le surnageant et remettre en suspension la pastille cellulaire dans une solution de coloration CFSE de 2000 μL (1 μM). Incuber pendant 20 min à 37 °C.
- Centrifuger les cellules colorées à 300 x g pendant 5 min. Jetez le surnageant et remettez en suspension la pastille cellulaire dans 1 000 μL de PBS.
- Centrifugeuse à 300 x g pendant 5 min. Jetez le surnageant et remettez en suspension la pastille cellulaire dans la quantité appropriée de milieu de cellules T pour atteindre une concentration de 1,5-2 x 106 cellules T dans environ 3-4 mL de milieu de cellules T.
- Amorçage de lymphocytes T dans une plaque à 6 puits
- Jetez la solution d’enrobage de la plaque à 6 puits.
- Ensemencez 1,5 à 2 millions de lymphocytes T isolés et colorés dans un milieu de cellules T de 3 à 4 mL par puits.
- Incuber les lymphocytes T à 37 °C et 5 % de CO2 pendant les 48 h suivantes
REMARQUE : Ajustez toujours la densité de semis à 1,5 Mio cellules / 3 ml. Évitez d’ensemencer les lymphocytes T dans une densité plus faible. Une densité plus élevée est possible, mais doit être testée.
4. Début de la co-culture (jour 4)
REMARQUE : Durée : 2 h. Après avoir déterminé le nombre de cellules tumorales HSC4, les lymphocytes T sont ajoutés aux plaques de 96 puits dans un rapport de 1:1.
- Prélèvement d’un puits par condition pour déterminer un nombre de cellules représentatif
- Écartez le surnageant du puits qui a été ensemencement de manière exemplaire pour la détermination du nombre de cellules.
- Tout d’abord, lavez les cellules avec 100 μL de PBS, puis jetez le PBS.
- Ajouter 100 μL de trypsine et incuber 5 min sur une plaque chauffante. Ensuite, remettez en suspension et vérifiez la suspension unicellulaire au microscope ; si les cellules ne se détachent pas, ajoutez encore 50 μL de trypsine.
- Dès que toutes les cellules se sont détachées, arrêtez la réaction de trypsine en ajoutant 100 μL (ou 150 μL si 50 μL supplémentaires de trypsine ont été ajoutés auparavant) du milieu D10 et remettez en suspension.
- Transférez tout le volume de 200 μL du puits dans un tube d’échantillon de 1,5 mL et utilisez 100 μL pour mesurer le nombre de cellules. N’oubliez pas d’ajuster le nombre de cellules mesurées au volume de l’échantillon.
- Coloration des cellules tumorales HSC4 avec un colorant fluorescent non toxique
- Préparez le traqueur cellulaire (voir le tableau des matériaux) en dissolvant 2 μL dans 20 mL de PBS (concentration finale 0,1 μM selon le fabricant).
- Pipetez le milieu D10 hors de tous les puits contenant des cellules tumorales et jetez-le.
- Ajoutez 200 μL de la solution de suivi cellulaire dans les puits de cellules tumorales. Incuber pendant 20 min à 37 °C.
- Après l’incubation, jeter la solution de coloration et laver en ajoutant 100 μL de PBS. Par la suite, jetez également le PBS.
- Ajouter 200 μL de milieu D10 frais.
- Récolte des lymphocytes T (plaque à 6 puits)
- Remettez soigneusement les lymphocytes T en suspension dans leur milieu ; la plupart des lymphocytes T sont en suspension et peuvent être récoltés en étant simplement pipetés hors de leur puits.
- Vérifiez au microscope si les puits sont vides ; sinon, récoltez en utilisant 1 000 μL de trypsine, placez la plaque sur une plaque chauffante à 37 °C jusqu’à ce que les lymphocytes T se soient détachés, puis arrêtez la réaction en ajoutant 1 000 μL de PBS ou de milieu de cellules T (facultatif).
- Comptez les lymphocytes T à l’aide d’une chambre de comptage Neubauer. Ensuite, centrifugez les lymphocytes T à 300 x g pendant 5 min.
- Remettre les lymphocytes T en suspension dans un milieu de lymphocytes T (utiliser le même milieu préparé lors de l’isolement des lymphocytes T du jour 2) jusqu’à une concentration finale de 10 000 lymphocytes T par 20 μL.
- Ajout de lymphocytes T aux cellules tumorales HSC4 (plaque à 96 puits)
- Ajoutez la quantité souhaitée de lymphocytes T dans les puits de cellules tumorales en fonction du nombre de cellules tumorales précédemment déterminé dans un rapport de 1:1.
- Gardez une cellule tumorale bien par condition exempte de cellules T comme contrôle « uniquement des cellules tumorales ». Ce contrôle « uniquement des cellules tumorales » permet de contrôler précisément les données de flux.
- Ajoutez 200 μL de suspension de lymphocytes T dans un puits vide en tant que témoin « uniquement des lymphocytes T » (200 000 lymphocytes T). Ce contrôle « uniquement des cellules T » permet de contrôler avec précision les données de flux.
- Incuber de la co-culture pendant 96 h (37 °C, 5 % CO2)
5. Quantification de la prolifération des lymphocytes T par cytométrie en flux (jour 7)
REMARQUE : Durée : 3h. Après avoir incubé la co-culture pendant 96 heures supplémentaires, les puits sont récoltés et colorés par un mélange d’anticorps contenant différents anticorps selon l’hypothèse de recherche (par exemple, anticorps anti-CD3, CD8, HLA-DR et CD25). Ensuite, les cellules sont analysées par cytométrie en flux multicolore.
- Préparez et inscrivez un lot de tubes FACS et de tubes de microcentrifugation pour chaque puits à récolter.
- Prélèvement de cellules
- Remettez les cellules en suspension dans leur milieu et transférez-les dans les tubes FACS.
- Lavez les cellules avec 100 μL de PBS, puis transférez-le dans les tubes FACS.
- Ajouter 100 μL de trypsine dans les puits et incuber sur la plaque chauffante (37 °C) pendant 5 min.
- Remettez les cellules en suspension, puis contrôlez au microscope si toutes les cellules sont détachées. Si c’est le cas, transférez la suspension cellulaire trypsinée dans les tubes FACS.
- Vérifiez au microscope si tous les puits sont vides ; Si ce n’est pas le cas, répétez les étapes 5.2.3 à 5.2.4.
- Collecte du surnageant de la co-culture pour d’autres expériences
- Centrifuger les tubes remplis de cellules à 300 x g pendant 5 min.
- Pipetez soigneusement environ 300 μL de surnageant hors des tubes et dans un autre lot de tubes de microcentrifugation à congeler à -20° C. Le surnageant peut ensuite être utilisé pour effectuer, par exemple, des tests ELISA afin de quantifier les cytokines sécrétées.
- Coloration des cellules avec des anticorps pour effectuer une cytométrie en flux
- Préparez un mélange d’anticorps : Ajouter 5 μL d’anti-CD3-Krome Orange, 0,5 μL d’anti-CD8-PerCE-Cyp5.5, 1 μL d’anti-HLA-DR-APCVio770, 2,5 μL d’anti-CD25-PE-Dazzle à 91 μL de tampon PBS/FACS.
- Ajouter 200 μL de tampon FACS (PBS complété par 2 % de FBS et 2 % d’EDTA) dans chaque tube et remettre en suspension.
- Centrifuger à nouveau à 300 x g pendant 5 min. Jeter le surnageant et remettre les cellules en suspension dans 100 μL du mélange d’anticorps préalablement préparé (étape 5.4.1). Incuber 30-45 min à 4 °C au réfrigérateur à l’abri de la lumière.
- Après l’incubation, centrifuger à 300 x g pendant 5 min. Jetez le surnageant et remettez les cellules en suspension dans 100 μL de tampon FACS.
- Effectuer une cytométrie en flux sur un cytomètre capable de discriminer tous les anticorps fluorescents susmentionnés et le signal CSFE.
6. Stratégie de contrôle et analyse des données
- Exclure les doublets et identifier la bonne population de lymphocytes T (figure 2A).
- Exclure la population des doublets basée sur l’avant vs. zone de diffusion latérale (FSC-A vs. SSC-A) (maillots).
- Tracer les « singlets » pour l’identification des lymphocytes T en fonction de l’avant par rapport à l’avant. zone de diffusion latérale (FSC-A vs. SSC-A) (lymphocytes T).
REMARQUE : Pour une exclusion de la meilleure taille, mesurez les échantillons « Lymphocytes T uniquement » et « Cellules tumorales uniquement » en parallèle (Figure 2B). - Tracez l’expression de CD3 par rapport à la SSC-A pour discriminer les lymphocytes T. De plus, les lymphocytes T CD8 positifs peuvent être identifiés en comparant le signal CD8 au SSC-A. Tous les lymphocytes T sont des lymphocytes CD3+/CD8+ (lymphocytes T CD8+) (figure 2A).
- Tracez le signal CFSE de tous les lymphocytes T CD8+ sous forme d’histogramme.
REMARQUE : Déclenchement de la sous-population non proliférative (signal CFSE le plus élevé), de la sous-population proliférative (tous les lymphocytes T avec un signal CFSE réduit) et de la sous-population hautement proliférative (tous les lymphocytes T du 4e pic CFSE ou moins intensif).
- Analyse des marqueurs de surface associés à l’activité sur la population de lymphocytes T
- Suivez les étapes de contrôle (étape 6.1) (Figure 3A).
- Option A : Choisissez les « lymphocytes T CD8+ » en entrée et analysez-les pour leur expression CD25 ou HLA-DR en traçant la fluorescence du marqueur de surface respectif par rapport aux caractéristiques SSC-A.
REMARQUE : Si une sous-population distincte à CD25 élevé est détectable, il est recommandé d’établir un contrôle pour la population à CD25. Il en va de même pour le gating/l’analyse de HLA-DR sur les lymphocytes T (Figure 3B). - Option B : Choisissez les « lymphocytes T CD8+ » en entrée et analysez-les pour leur expression CD25 ou HLA-DR en traçant la fluorescence du marqueur de surface respectif par rapport aux caractéristiques SSC-A.
REMARQUE : Si aucune sous-population distincte n’est détectable (en fonction du marqueur de surface analysé), il est recommandé d’analyser le décalage de l’intensité moyenne de fluorescence (IMF) de l’ensemble de la population de lymphocytes T (figure 3C).
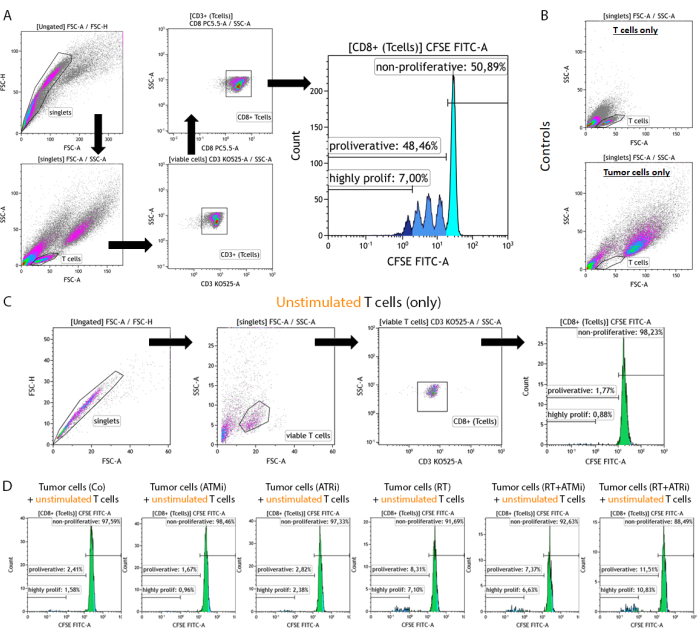
Figure 2 : Stratégie de déclenchement de cellules T pré-stimulées et colorées au CFSE pour l’analyse de la prolifération après 96 h de co-culture avec des cellules tumorales HNSCC prétraitées. Les lymphocytes T et les cellules tumorales sont prélevés 96 h après la co-culture à partir d’une plaque de 96 puits, colorés à l’aide d’un marqueur de surface spécifique aux lymphocytes T et mesurés à l’aide d’un appareil de cytométrie en flux. (A) Les doublets ont été exclus sur la base de FSC-A/FSC-H, et les lymphocytes T ont été classés en premier par taille (FSC-A/SSC-A). L’expression de CD3 (anti-CD3 Krome Orange) et de CD8 (anti-CD8 PerCP-Cy5.5) a été analysée plus en détail. Les lymphocytes T CD3+/CD8+ ont été tracés dans un histogramme, et l’intensité du signal CFSE a été analysée. Le signal CFSE représente des sous-groupes de lymphocytes T avec un comportement de prolifération divers. Les lymphocytes T ayant le signal CFSE le plus élevé ont été définis comme « non prolifératifs ». Toutes les sous-populations présentant une perte du signal CFSE, causée par la division cellulaire conduisant à la réduction de moitié du signal, dans des pics distincts, ont été résumées comme « prolifératives ». Les lymphocytes T qui se sont divisés plus de trois fois (plus de trois pics de signal CSFE) ont été définis comme « hautement prolifératifs ». (B) En tant que contrôle, des échantillons composés uniquement de cellules T pré-stimulées et de cellules tumorales prétraitées sont mesurés en plus. Les lymphocytes T et les cellules tumorales HSC4 peuvent être discriminés en fonction de leur taille à l’aide de FSC-A vs. Signal SCC-A. De plus, des lymphocytes T CD8+ non stimulés ont été analysés pour vérifier l’activation des lymphocytes T basée sur la co-culture avec des cellules tumorales allogéniques seules. (C) En tant que contrôle, l’incubation de lymphocytes T non stimulés colorés au CFSE pendant 96 h parallèlement à la co-culture a été incluse. (D) Des cellules T non stimulées, colorées au CFSE, ont été co-cultivées avec des cellules tumorales prétraitées. Après 96 h, les cellules ont été récoltées et le signal CFSE a été mesuré à l’aide de la procédure standard. Les lymphocytes T non stimulés n’ont montré aucune prolifération, que ce soit seuls ou après co-culture avec des cellules tumorales prétraitées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
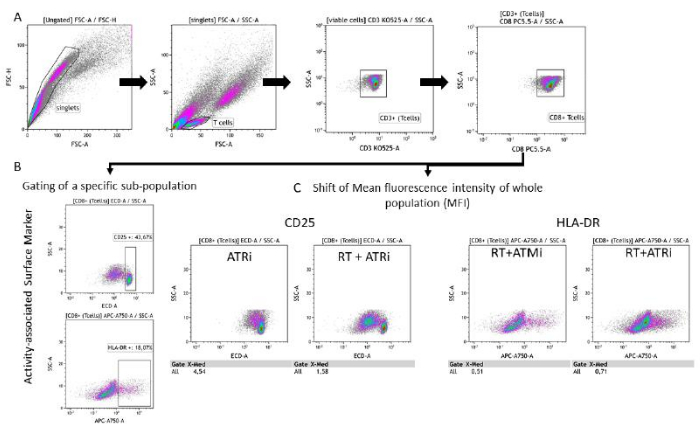
Figure 3 : Stratégie de déclenchement de l’expression du marqueur de surface (CD25 et HLA-DR) associée à l’activité des lymphocytes T après 96 h de co-culture avec des cellules HNSCC prétraitées. (A) Les doublets ont été exclus en fonction de leurs caractéristiques FSC-A/FSC-H, et les lymphocytes T ont été classés en premier par taille (FSC-A/SSC-A). L’expression de CD3 (anti-CD3 Krome Orange) et de CD8 (anti-CD8 PerCP-Cy5.5) a été analysée plus en détail. Le déclenchement des marqueurs d’activité CD25 (anti-CD25 PEDazzle594) et HLA-DR (anti-HLA-DR APC-Vio770) à la surface des lymphocytes T peut être effectué dans deux contextes différents. (B) Déclenchement de tous les lymphocytes T CD8+ pour le pourcentage d’une sous-population spécifique à CD25élevé ou à HLA-DR élevé, sur la base de diagrammes de densité. (C) Alternativement, la mesure d’un décalage MFI de l’ensemble de la population de lymphocytes T CD8+ est effectuée pour les deux marqueurs d’activité. Des images représentatives de l’analyse de l’expression des marqueurs de surface des lymphocytes T après co-culture avec des cellules tumorales HSC4 sont présentées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Les cellules tumorales HSC4 dérivées d’un HNSCC ont été ensemencées et incubées pendant la nuit. Après 24 heures, les cellules ont été traitées avec un inhibiteur de kinase. Après 3 h, les deux premières doses de 5 Gy par fraction ont été appliquées. Après 24 heures, la deuxième dose a été appliquée et les cellules ont de nouveau été incubées pendant la nuit. En parallèle, 48 h avant le début de la co-culture, des lymphocytes T ont été isolés dans le sang d’un donneur sain. Tout d’abord, les PBMC ont été isolés à l’aide de tubes de centrifugation à gradient de densité et d’un milieu de séparation stérile. Les PBMC ont été comptés à l’aide d’une chambre de comptage cellulaire, et les lymphocytes T CD8+ ont été isolés à l’aide de la trousse d’isolement des lymphocytes T CD8+. Des lymphocytes T CD8+ isolés ont ensuite été colorés avec CFSE (1 μM) et comptés par la suite. Les lymphocytes T ont été ensemencés dans des plaques à puits pré-enrobées CD3/CD28 d’une densité de 1,5 x 106 cellules/3 mL. Après 48 h de stimulation, les lymphocytes T ont été récoltés, comptés et remis en suspension dans une densité de 10 000 cellules/10 μL. De plus, des puits représentatifs des cellules tumorales ensemencées ont été récoltés et comptés, et le milieu a été échangé contre tous les puits restants. Des lymphocytes T ont été ajoutés aux cellules tumorales dans un rapport de 1:1. La co-culture a été récoltée après 96 h, le surnageant a été stocké à -20 °C, et les cellules ont été colorées et mesurées par cytométrie en flux (Figure 1).
Les lymphocytes T ont été identifiés par l’exclusion de taille et la positivité des CD3/CD8. Le signal CFSE des cellules CD3+/CD8+ positives a montré la distribution des lymphocytes T non prolifératifs (signal CFSE élevé) et des sous-populations distinctes de lymphocytes T proliférants (perte d’intensité du signal CFSE). La proportion de lymphocytes T proliférants a été mesurée de manière exemplaire pour la lignée cellulaire HSC4 HNSCC (Figure 4A). Tous les lymphocytes T qui présentaient au moins une division ont été définis comme « prolifératifs ». Les lymphocytes T qui présentaient plus de 3 divisions ont été définis comme « hautement prolifératifs » (Figure 4B). Pour la lignée cellulaire HSC4 négative au VPH, une légère augmentation du taux de prolifération a été détectée lorsque les lymphocytes T ont été co-cultivés avec des cellules tumorales irradiées. La RT et l’inhibition de la RT plus l’ATR ont entraîné une augmentation significative de la prolifération consécutive des lymphocytes T par rapport aux co-cultures de cellules HSC4 traitées par RT plus inhibition de l’ATM avec des cellules T. En ce qui concerne la fraction « hautement proliférative » des lymphocytes T, le prétraitement des cellules HSC4 avec RT plus inhibition de l’ATR a été le plus efficace pour stimuler la prolifération des lymphocytes T (Figure 4B).
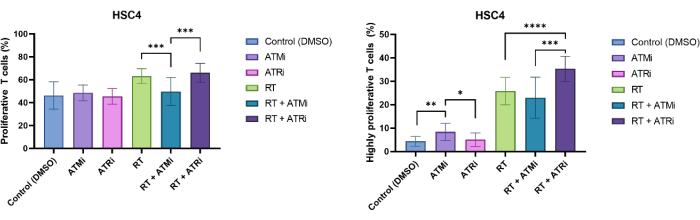
Figure 4 : Prolifération des lymphocytes T colorés au CFSE pour l’analyse des changements de la prolifération des lymphocytes T dépendants du traitement de HSC4. (A) Proportion de lymphocytes T en prolifération après 96h de co-culture avec des cellules tumorales HSC4 négatives au VPH prétraitées. La prolifération des lymphocytes T était significativement plus faible après co-culture avec des cellules tumorales HSC4 traitées par RT+ATMi par rapport au traitement RT ou RT plus ATRi. (B) La RT des cellules tumorales HSC4 a induit une fraction plus élevée de cellules T hautement proliférantes (plus de trois divisions cellulaires. Après co-culture de cellules tumorales HSC4 prétraitées par RT+ATRi avec des lymphocytes T, le pourcentage de lymphocytes T hautement prolifératifs était le plus élevé. Les barres montrent les données de quatre expériences indépendantes avec les lymphocytes T de quatre donneurs sains indépendants (n = 4 ; Moyenne ± écart-type). (*p≤ 0,05, **p≤ 0,01, ***p≤ 0,001, ****p≤ 0,0001 ; la signification statistique a été testée en comparant toutes les conditions expérimentales à chacune d’elles à l’aide d’un Mann-Whitney-U bilatéral pour des données non distribuées normalement). Veuillez cliquer ici pour voir une version agrandie de cette figure.
La perte de CFSE basée sur la prolifération peut être utilisée pour quantifier le taux de prolifération des lymphocytes T. De plus, plusieurs marqueurs de surface cellulaire sont décrits comme étant associés à l’activité des lymphocytes T, tels que CD25 et HLADR. Par conséquent, une analyse des CD25 et HLA-DR à la surface de tous les lymphocytes T CD3+ et CD8+ par cytométrie en flux a été effectuée (Figure 5). L’expression peut être quantifiée si des sous-populations distinctes à CD25élevé ou à HLA-DRélevé sont détectables et peuvent être discriminées en manipulant ces cellules hautement positives (Figure 3B). Si aucune sous-population distincte n’est détectable, l’intensité moyenne de fluorescence (IMF) de l’ensemble de la population peut être mesurée et les décalages de l’IMF en fonction de l’état peuvent être quantifiés (figure 3C).
De manière exemplaire, l’expression identifiée par l’IMF de CD25 et HLA-DR a été analysée après 96 h de co-culture avec des cellules tumorales HSC4 prétraitées (Figure 5). Après co-culture de lymphocytes T avec des cellules tumorales HSC4 traitées par RT, l’expression de CD25 sur les lymphocytes T a été fortement régulée à la baisse. Notamment, le prétraitement des cellules tumorales avec uniquement des ATMi a entraîné une diminution significative de l’expression de CD25 par rapport au prétraitement des ATRi. Dans le cadre combiné avec la RT, même si la RT a entraîné une diminution de l’expression de CD25 sur les lymphocytes T, la combinaison de la RT avec l’ATMi a entraîné une augmentation de l’expression de CD25 par rapport à la RT plus ATRi (Figure 5A). En ce qui concerne l’expression de HLA-DR sur les lymphocytes T, la RT a généralement conduit à une régulation positive de HLA-DR, mais encore une fois, en combinaison avec ATMi ou ATRi, un comportement différent a été observé (Figure 5B). Les lymphocytes T co-cultivés avec des cellules HSC4 qui ont été prétraités avec une combinaison de RT+ATRi ont augmenté l’expression de HLA-DR par rapport à RT seul ou RT+ATMi.
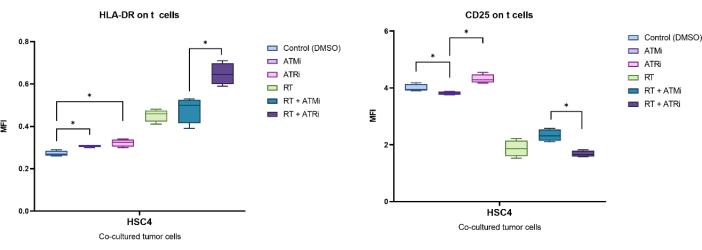
Figure 5 : Expression des marqueurs d’activation CD25 et HLA-DR à la surface des lymphocytes T après 96 h de co-culture avec des cellules tumorales HSC4 prétraitées. L’expression de CD25 et de HLA-DR a été analysée sur la base du décalage de l’IMF de l’ensemble de la population de lymphocytes T. La RT de HSC4 a entraîné une diminution de l’expression de CD25 sur les lymphocytes T et une augmentation de l’expression de HLA-DR. L’association de la RT et de l’ATMi a entraîné des profils d’expression significativement différents par rapport à la RT associée à l’ATRi. Les boîtes à moustaches montrent les données de quatre expériences indépendantes avec les lymphocytes T de quatre donneurs sains indépendants (n = 4 ; Moyenne ± écart-type). Les données ont été analysées en comparant toutes les conditions expérimentales les unes par rapport aux autres à l’aide d’un test de Mann-Whitney-U bilatéral pour des données non distribuées normalement (*p≤ 0,050). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ces données indiquent de manière exemplaire que le traitement des cellules tumorales, dans ce cas des cellules HSC4 HNSCC, impacte l’immunogénicité des cellules tumorales. Cela peut être surveillé par la co-culture des cellules tumorales avec des cellules T pré-stimulées, ce qui conduit à un comportement de prolifération diversifié et à l’expression de marqueurs d’activation sur les cellules T humaines en fonction du régime de traitement des cellules tumorales appliqué.
Discussion
Le protocole présenté ici offre une méthode rapide et facile pour analyser la capacité proliférative des lymphocytes T ainsi que leur état d’activation dans un cadre de co-culture avec des cellules tumorales prétraitées. Ainsi, les effets de différentes modalités de traitement, telles que la RT, la TDM ou la TT, sur l’activité et la prolifération des lymphocytes T peuvent facilement être criblés, jetant ainsi les bases d’analyses immunologiques ultérieures plus approfondies d’approches prometteuses. Les résultats représentatifs présentés dans ce manuscrit prouvent que ce test de co-culture de lymphocytes T allogéniques fonctionne bien. Des différences significatives dans la prolifération des lymphocytes T, ainsi que dans l’activité des lymphocytes T, ont été observées pour la co-culture avec des cellules humaines HSC4 prétraitées différentiellement (HNSCC) (Figure 4 et Figure 5). Il a été constaté que le traitement de la HSC4 avec la RT seule ou en association avec la TT entraînait une prolifération accrue des lymphocytes T, en particulier en ce qui concerne la fraction hautement proliférative des lymphocytes T (Figure 4). Conformément à la quantification du taux de prolifération, l’état d’activation des lymphocytes T a également été affecté de manière différentielle par les différents régimes de traitement. En résumé, l’application de la RT a entraîné une forte régulation négative de l’expression de CD25 sur les lymphocytes T, tandis que l’expression de HLA-DR a été régulée à la hausse. La RT induit des dommages à l’ADN dans les cellules tumorales irradiées, ce qui entraîne à son tour des réponses au stress cellulaire qui incluent la libération de molécules et de cytokines associées au stress et aux dommages, ainsi que l’expression de ligands de surface cellulaire immunomodulateurs19.
La combinaison de la RT et de la TT sous la forme d’inhibiteurs de la réparation de l’ADN renforce et maintient encore ces effets, car les cellules tumorales ne peuvent pas réparer efficacement les dommages à l’ADN induits par la RT. Cela pourrait favoriser et maintenir la sécrétion de facteurs immunogènes et l’expression de ligands immunogènes à la surface des cellules20. Conformément à cela, nous avons démontré précédemment que le traitement des cellules tumorales (HNSCC) avec des inhibiteurs de la RT et des dommages à l’ADN modifie le phénotype immunitaire à la surface des cellules tumorales. La modulation du phénotype immunitaire comprenait la régulation de la molécule immunostimulante ICOS-L ainsi que de la molécule immunosuppressive-L111. En réponse à cette modulation du phénotype immunitaire des cellules tumorales, les lymphocytes T pourraient également réguler l’expression des marqueurs d’activation à leur surface. De plus, la RT est bien connue pour stimuler la libération de cytokines pro-inflammatoires, telles que l’IFNγ ou l’IL-6, qui à leur tour ont un impact sur la prolifération et l’activité des lymphocytesT 21. L’expression de marqueurs d’activation sur les lymphocytes T est un processus hautement dynamique. Les données de Zimmerman et coll.22 ont montré que le CD25 est fortement exprimé 24 h après la stimulation, mais qu’il est à nouveau régulé à la baisse après 96 h après la stimulation. Cela est conforme à nos conclusions. En revanche, HLA-DR est un marqueur d’activation de phase tardive et est généralement précédé d’une augmentation de CD25 et CD6923. De manière notable, la combinaison de RT + ATRi conduit à une régulation positive significative de HLA-DR sur les cellules T par rapport à RT + ATMi. Cette découverte est conforme aux travaux de Dillion et al. qui ont démontré des effets synergiques d’ATRi + RT dans l’induction d’un TME24 inflammatoire. Une modulation moins prononcée de l’activité et de la prolifération des lymphocytes T a été obtenue par le traitement des cellules tumorales avec les inhibiteurs de kinases seuls (Figure 5). Cela pourrait être dû au fait que les inhibiteurs de réparation de l’ADN ATMi et ATRi fonctionnent comme un amplificateur des dommages à l’ADN induits par la RT et ne sont donc pas très immunogènes lorsqu’ils sont appliqués en monothérapie. Nous avons déjà démontré la toxicité minime de l’ATMi ou de l’ATRi seul11. En résumé, les résultats confirment le potentiel immunogène de la RT (et de la TT avec des inhibiteurs de dommages à l’ADN) et indiquent en outre que ce système expérimental est adapté au dépistage des capacités immunostimulantes de différentes modalités de traitement dans les cellules cancéreuses de la tête et du cou humaines.
Même si la méthode présentée ici est simple et robuste, il y a quelques étapes critiques dans le protocole qui doivent être prises en compte au préalable. La présence de concentrations élevées d’EDTA pendant le processus d’isolement, ainsi que lors de l’analyse cytométrique en flux des lymphocytes T, est nécessaire. Ainsi, il est recommandé de prélever le sang du donneur dans des tubes de prélèvement recouverts d’EDTA et d’utiliser un tampon MACS complété par 10 mM d’EDTA pour assurer une isolation efficace des lymphocytes T et la génération d’une suspension unicellulaire homogène pour l’évaluation cytométrique en flux. De plus, la composition du milieu des lymphocytes T est d’une importance majeure pour la capacité de prolifération des lymphocytes T. Après avoir testé différentes compositions de milieux de culture, un milieu avec de faibles concentrations de L-arginine et de L-lysine donne le meilleur signal de prolifération des lymphocytes T, car la L-arginine est essentielle au métabolisme et à la survie des lymphocytes T et doit être fournie à une concentration appropriée25,26. Néanmoins, il faut garder à l’esprit que les solutions de L-arginine et de L-lysine ne sont pas stables à long terme et doivent donc être utilisées dans les 3 mois. Pour une stimulation optimale, le milieu de cellules T complété par les acides aminés doit être préparé fraîchement pour chaque expérience de culture de cellules T. De plus, le nombre de cellules des lymphocytes T, ainsi que ceux des cellules tumorales, sont des facteurs critiques qui doivent être pris en compte car ils ont un impact sur la lecture de l’expérience.
Pour les cellules tumorales, d’une part, une confluence cellulaire de 70 % à 80 % est souhaitée à la fin de l’expérience de co-culture. Une prolifération des cellules tumorales pourrait entraîner la sécrétion de facteurs qui inhibent la croissance cellulaire et auraient par conséquent un impact sur le taux de prolifération des lymphocytes T. Comme la croissance des cellules tumorales dépend fortement de la lignée cellulaire individuelle, nous recommandons de tester minutieusement le comportement de croissance de la lignée cellulaire tumorale respective dans différentes plaques de puits et pour les différents régimes de traitement. De plus, les cellules tumorales et les lymphocytes T doivent être co-cultivés dans un rapport de 1:1. Par conséquent, il est obligatoire d’ensemencer un puits supplémentaire de cellules tumorales pour chaque condition de traitement, qui peut être utilisé pour la détermination du nombre de cellules le jour du début de la co-culture. Ainsi, on peut s’assurer qu’un nombre approprié de lymphocytes T sera ensemencé pour les différentes conditions de traitement. En ce qui concerne le nombre de cellules des lymphocytes T, il est nécessaire de considérer que la quantité de lymphocytes T qui peuvent être isolés d’un donneur sain est très individuelle. Les lymphocytes T représentent environ 45 % à 70 % des PBMC d’un donneur sain27. Ainsi, la quantité requise de lymphocytes T devrait déjà être largement estimée au moment du prélèvement sanguin. De plus, la densité des lymphocytes T est importante pour l’efficacité de l’activation des lymphocytes T et leur survie. Par conséquent, les lymphocytes T doivent être ensemencés à une concentration d’au moins 1,5 million de cellules par puits d’une plaque à 6 puits dans 3 mL de milieu de lymphocytes T pour la stimulation initiale avant le début de la co-culture. Une densité de lymphocytes T plus élevée est possible, mais une densité plus faible doit être évitée. L’activation des lymphocytes T peut également être évaluée morphologiquement au microscope, car les lymphocytes T activés ont tendance à former des amas de cellules.
Comme cette méthode est un système expérimental simplifié pour étudier les capacités immunostimulantes de différentes lignées cellulaires tumorales et modalités de traitement, elle présente certaines limites qui doivent être prises en considération. Tout d’abord, ce test est basé sur un système allogénique, ce qui signifie que les cellules T du donneur ne sont pas appariées HLA avec la lignée cellulaire tumorale respective. Ainsi, ce décalage HLA pourrait déjà induire une stimulation des lymphocytes T et, par la suite, une prolifération des lymphocytes T sans stimulation supplémentaire du traitement des cellules tumorales28. Pour quantifier cet effet indésirable, des lymphocytes T isolés ont été co-cultivés avec la lignée cellulaire HSC4 sans stimulation préalable avec des anticorps CD28 et CD3. Il a été constaté que presque aucune prolifération n’a été induite dans ce contexte, ce qui indique que le décalage HLA n’a que des effets mineurs sur l’activation des lymphocytes T dans ce cadre expérimental spécifique. En outre, des différences significatives dans la prolifération et l’activation des lymphocytes T en fonction du traitement des cellules tumorales malgré le cadre allogénique ont été trouvées. Néanmoins, pour l’établissement de ce test, la prolifération potentielle des lymphocytes T induite par l’allogenèse devrait être testée et quantifiée une fois au début des expériences. Les contrôles recommandés « uniquement les cellules T » et « uniquement les cellules tumorales » sont nécessaires pour un contrôle suffisant et sont obligatoires dans chaque réplication des expériences. Néanmoins, il faut garder à l’esprit qu’un système de co-culture allogénique manque de reconnaissance de l’antigène spécifique à la tumeur. Ainsi, ce système peut ne pas refléter avec précision la réponse antitumorale spécifique telle qu’elle se produirait in vivo chez les patients29,30. Pour une amélioration supplémentaire, un cadre plus sophistiqué serait une approche de co-culture autologue. Dans ce contexte, les biopsies tumorales dérivées du patient doivent être cultivées et mises en culture avec des lymphocytes T isolés du sang périphérique du même patient28. Cette approche expérimentale, cependant, pourrait être difficile non seulement en termes de culture de cellules tumorales primaires, mais aussi en termes de disponibilité de biomatériaux dérivés de patients. Une autre limitation à prendre en compte est le rapport entre les cellules tumorales et les lymphocytes T dans la co-culture. Comme le rapport recommandé des cellules est de 1:1, le rapport ne reflète pas la situation physiologique de l’EUT chez les patients31. Cependant, cette limitation doit être acceptée, car avec un nombre de lymphocytes T plus faible, les changements dans le taux de prolifération et le statut d’activation ne sont pas quantifiables.
Dans le domaine de l’immunologie tumorale, ce test offre la possibilité de dépister l’immunogénicité de différentes modalités de traitement dans un cadre expérimental in vitro facile et rapide. Par conséquent, non seulement il est possible de gagner du temps en présélectionnant les approches les plus prometteuses en termes d’immunogénicité, mais aussi des expériences in vivo . Les modèles animaux peuvent être réduits, car seuls des schémas de traitement prometteurs pourraient être poursuivis dans des modèles animaux pour refléter le système immunitaire dans son ensemble dans un organisme. De plus, comme ce test est basé sur des cellules primaires humaines et des lignées cellulaires cancéreuses humaines, les résultats pourraient être plus transposables en clinique que les tests basés sur d’autres systèmes et espèces modèles.
À l’avenir, ce test pourrait être modulé et adapté pour répondre à des questions de recherche plus spécifiques. Par exemple, on pourrait inclure un traitement des lymphocytes T pour refléter un scénario de traitement plus proche de la situation chez les patients. Étant donné que les lymphocytes T réactifs aux tumeurs se trouvent principalement dans le TME, ils sont également affectés par les thérapies locales telles que la RT et sont probablement également affectés par les thérapies systémiques telles que la TDM ou le TT32. Une autre amélioration du test est la co-culture de lymphocytes T avec des sphéroïdes tumoraux de lignées cellulaires tumorales ou même la co-culture avec des organoïdes tumoraux dérivés de patients. Ces cultures tridimensionnelles sont plus comparables à la structure d’une tumeur chez un patient28. Enfin, la lecture de l’expérience par cytométrie en flux peut également être adaptée facilement afin d’étudier d’autres molécules à la surface des lymphocytes T ou en analysant l’expression des molécules de point de contrôle immunitaire sur les cellules tumorales. En plus de la détermination du phénotype immunitaire des lymphocytes T, on pourrait utiliser les surnageants de culture cellulaire des expériences de co-culture pour la quantification des cytokines ou des chimiokines sécrétées afin d’obtenir plus d’informations sur l’activité des lymphocytes T. En résumé, ce protocole fournit un test de co-culture complet, robuste et facile à réaliser sur les lymphocytes T et les cellules tumorales qui permet de dépister l’immunogénicité de différentes modalités de traitement du cancer. Comme ce test est adaptable à des questions de recherche spécifiques, il est bien adapté pour une application dans le vaste domaine de l’immunologie tumorale.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Cette recherche a été financée en partie par le Centre interdisciplinaire de recherche clinique d’Erlangen (IZKF Erlangen) et le Bayerisches Zentrum für Krebsforschung (BZKF).
matériels
| Name | Company | Catalog Number | Comments |
| 15 mL Cellstar tubes | Greiner Bio-One GmbH | 188271 | |
| 50 mL Cellstar tubes | Greiner Bio-One GmbH | 227261 | |
| 6 well cell culture plate sterile, with lid | Greiner Bio-One GmbH | 657160 | |
| 96 well cell culture plate sterile, F-bottom, with lid | Greiner Bio-One GmbH | 655180 | |
| AZD0156 | Selleck Chemicals GmbH | S8375 | |
| Berzosertib (VE-822) | Selleck Chemicals GmbH | S7102 | |
| CASYcups | OMNI Life Science GmbH & Co KG | 5651794 | |
| CASYton | OMNI Life Science GmbH & Co KG | 5651808 | |
| CD25a, PE-Dazzle594, Mouse IgG1 | Biolegend | 356126 | |
| CD28-UNLB | Beckmann Coulter, Inc. | IM1376 | |
| CD3a,Krome Orange, Mouse IgG1 | Beckmann Coulter, Inc. | B00068 | |
| CD3e Monoclonal Antibody | Thermo-Fisher Scientific, Inc. | MA1-10176 | |
| CD4, APC, Mouse Anti-Human Mouse IgG1 | BD Pharmingen | 555349 | |
| CD8 MicroBeads, human | Miltenyi Biotec, Inc. | 130-045-201 | |
| CD8a, PerCP-Cy5.5, Mouse IgG1 | Biolegend | 300924 | |
| CellTracker Deep Red Dye | Thermo Fisher Scientific, Inc. | C34565 | |
| CFSE | Merck KGaA (Sigma-Aldrich) | 21888 | |
| DMEM (Dulbecco´s Modified Eagle´s Medium) | PAN-Biotech GmbH | P04-02500 | |
| DxFlex Flow Cytometer (with Auto Loader) | Beckmann Coulter, Inc. | C44326, C02846 | |
| EDTA disodium salt dihydrate | Carl Roth GmbH + Co. KG | 8043.2 | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-500ML | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-100ML | For production of heat-inactivated FBS. Heat up for 30 min at 56 °C with mixing to inactivate complement proteins. |
| Graph Pad Prism (version number 9) | GraphPad Software | - | |
| HLA-DR, DP, DQ Antibody, anti-human, APC-Vio770 | Miltenyi Biotec, Inc. | 130-123-550 | |
| Kaluza (version number 2.1) | Beckmann Coulter, Inc. | - | |
| L-Arginin | Merck KGaA (Sigma-Aldrich) | A8094-25G | |
| L-Lysin-monohydrochloride | Merck KGaA (Sigma-Aldrich) | L5626-100G | |
| MACS BSA Stock Solution | Miltenyi Biotec, Inc. | 130-091-376 | |
| MS Columns | Miltenyi Biotec, Inc. | 130-042-201 | |
| Neubauer-improved counting chamber | Paul Marienfeld GmbH & Co. KG | 640010 | |
| PBS | Merck KGaA (Sigma-Aldrich) | D8537-500mL | |
| Penicillin-Streptomycin | Thermo-Fisher Scientific, Inc. | 1514-122 | |
| ROTISep 1077 | Carl Roth GmbH + Co. KG | 0642.2 | |
| RPMI-1640 Medium | Merck KGaA (Sigma-Aldrich) | R1790 | |
| SepMate 50mL tubes | Stemcell Technologies | 85450 | |
| Trypan blue | Merck KGaA (Sigma-Aldrich) | T6146-25G | |
| Trypsin | Thermo-Fisher Scientific, Inc. | 15400054 |
Références
- Hiam-Galvez, K. J., Allen, B. M., Spitzer, M. H. Systemic immunity in cancer. Nat Rev Cancer. 21 (6), 345-359 (2021).
- Mantovani, A., Allavena, P., Marchesi, F., Garlanda, C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 21 (11), 799-820 (2022).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From t cell basic science to clinical practice. Nat Rev Immunol. 20 (11), 651-668 (2020).
- Dunn, G. P., Old, L. J., Schreiber, R. D. The immunobiology of cancer immunosurveillance and immunoediting. Immunity. 21 (2), 137-148 (2004).
- Mittal, D., Gubin, M. M., Schreiber, R. D., Smyth, M. J. New insights into cancer immunoediting and its three component phases--elimination, equilibrium and escape. Curr Opin Immunol. 27, 6-25 (2014).
- Irianto, T., Gaipl, U. S., Ruckert, M. Immune modulation during anti-cancer radio(immuno)therapy. Int Rev Cell Mol Biol. 382, 239-277 (2024).
- Burtness, B., et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (keynote-048): A randomized, open-label, phase 3 study. Lancet. 394 (10212), 1915-1928 (2019).
- Hecht, M., et al. Safety and efficacy of single cycle induction treatment with cisplatin/docetaxel/ durvalumab/tremelimumab in locally advanced HNSCC: First results of checkered-CD8. J Immunother Cancer. 8 (2), e001378(2020).
- Chen, J. A., Ma, W., Yuan, J., Li, T. Translational biomarkers and rationale strategies to overcome resistance to immune checkpoint inhibitors in solid tumors. Cancer Treat Res. 180, 251-279 (2020).
- Solomon, B., Young, R. J., Rischin, D. Head and neck squamous cell carcinoma: Genomics and emerging biomarkers for immunomodulatory cancer treatments. Semin Cancer Biol. 52 (Pt 2), 228-240 (2018).
- Meidenbauer, J., et al. Inhibition of atm or atr in combination with hypo-fractionated radiotherapy leads to a different immunophenotype on transcript and protein level in HNSCC. Front Oncol. 14, 1460150(2024).
- Kumari, S., et al. Immunomodulatory effects of radiotherapy. Int J Mol Sci. 21 (21), 8151(2020).
- Wimmer, S., et al. Hypofractionated radiotherapy upregulates several immune checkpoint molecules in head and neck squamous cell carcinoma cells independently of the HPV status while icos-l is upregulated only on HPV-positive cells. Int J Mol Sci. 22 (17), 9114(2021).
- Derer, A., et al. Chemoradiation increases pd-l1 expression in certain melanoma and glioblastoma cells. Front Immunol. 7, 610(2016).
- Schatz, J., et al. Normofractionated irradiation and not temozolomide modulates the immunogenic and oncogenic phenotype of human glioblastoma cell lines. Strahlenther Onkol. 199 (12), 1140-1151 (2023).
- Xu, M. M., Pu, Y., Zhang, Y., Fu, Y. X. The role of adaptive immunity in the efficacy of targeted cancer therapies. Trends Immunol. 37 (2), 141-153 (2016).
- Olivo Pimentel, V., Yaromina, A., Marcus, D., Dubois, L. J., Lambin, P. A novel co-culture assay to assess anti-tumor cd8(+) t cell cytotoxicity via luminescence and multicolor flow cytometry. J Immunol Methods. 487, 112899(2020).
- Kulp, M., Diehl, L., Bonig, H., Marschalek, R. Co-culture of primary human t cells with leukemia cells to measure regulatory t cell expansion. STAR Protoc. 3 (3), 101661(2022).
- Ruckert, M., et al. Immune modulatory effects of radiotherapy as basis for well-reasoned radioimmunotherapies. Strahlenther Onkol. 194 (6), 509-519 (2018).
- Samstein, R. M., Riaz, N. The DNA damage response in immunotherapy and radiation. Adv Radiat Oncol. 3 (4), 527-533 (2018).
- Meeren, A. V., Bertho, J. M., Vandamme, M., Gaugler, M. H. Ionizing radiation enhances il-6 and il-8 production by human endothelial cells. Mediators Inflamm. 6 (3), 185-193 (1997).
- Zimmerman, M., et al. Ifn-gamma upregulates survivin and ifi202 expression to induce survival and proliferation of tumor-specific T cells. PLoS One. 5 (11), e14076(2010).
- Saraiva, D. P., et al. Expression of HLA-dr in cytotoxic t lymphocytes: A validated predictive biomarker and a potential therapeutic strategy in breast cancer. Cancers (Basel). 13 (15), (2021).
- Dillon, M. T., et al. Atr inhibition potentiates the radiation-induced inflammatory tumor microenvironment. Clin Cancer Res. 25 (11), 3392-3403 (2019).
- Geiger, R., et al. L-Arginine modulates T cell metabolism and enhances survival and anti-tumor activity. Cell. 167 (3), 829-842.e13 (2016).
- Rodriguez, P. C., Quiceno, D. G., Ochoa, A. C. L-Arginine availability regulates t-lymphocyte cell-cycle progression. Blood. 109 (4), 1568-1573 (2007).
- Lozano-Ojalvo, D., López-Fandiño, R., López-Expósito, I., et al. The impact of food bioactives on health: In vitro and ex vivo models. Verhoeckx, K., et al. , Springer International Publishing. Cham. 169-180 (2015).
- Gronholm, M., et al. Patient-derived organoids for precision cancer immunotherapy. Cancer Res. 81 (12), 3149-3155 (2021).
- Perez, C., Gruber, I., Arber, C. Off-the-shelf allogeneic t cell therapies for cancer: Opportunities and challenges using naturally occurring "universal" donor t cells. Front Immunol. 11, 583716(2020).
- Martinez Bedoya, D., Dutoit, D., Migliorini, D. Allogeneic car t cells: An alternative to overcome challenges of car t cell therapy in glioblastoma. Front Immunol. 12, 640082(2021).
- Schnellhardt, S., et al. The prognostic value of FOXP3+ tumor-infiltrating lymphocytes in rectal cancer depends on immune phenotypes defined by CD8+ cytotoxic T cell density. Front Immunol. 13, 781222(2022).
- Zitvogel, L., Kroemer, G. Oncoimmunology: A practical guide for cancer immunotherapy. , Springer International Publishing. Cham. 23-39 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon